-
Medical journals
- Career
Účinnost bevacizumabu v léčbě relabujícího karcinomu vaječníku: kazuistika
Authors: Zuzana Donátová; Jitka Abrahámová
Authors‘ workplace: Onkologická klinika, 1. LF UK a Thomayerova nemocnice, Praha, primářka prof. MUDr. Jitka Abrahámová, DrSc.
Published in: Prakt Gyn 2013; 17(3): 209-215
Category: Oncogynecology: Case report
Overview
Karcinom vaječníku (epiteliální zhoubný nádor) je gynekologická malignita s nejhorší prognózou. Je považována za chemosenzitivní onemocnění. Chemoterapie paklitaxel/karboplatina byla do roku 2011 více než 15 let standardním léčebným režimem. Novou nadějí pro pacientky s karcinomem vaječníku je chemoterapie kombinovaná s cílenou antiangiogenní léčbou bevacizumabem. Bevacizumab je humanizovaná monoklonální protilátka proti klíčovému faktoru angiogeneze, vaskulárnímu endoteliálnímu růstovému faktoru (VEGF). Jeho účinnost je prokázána u řady nádorových onemocnění. Popisovaný případ pacientky ukazuje, jakým přínosem bylo přidání bevacizumabu k chemické léčbě u opakovaně relabujícího karcinomu vaječníku v souladu s výsledky klinických výzkumů.
Klíčová slova:
antiangiogenní léčba – bevacizumab – epiteliální zhoubný nádor vaječníku – chemoterapieÚvod
Karcinom vaječníku je gynekologická malignita s nejhorší prognózou. Je na předním místě v mortalitě mezi gynekologickými nádory. Jeho incidence je za posledních 20 let stabilní. V roce 2009 byla incidence 22,5/100 000 žen, tj. 1 200 případů a mortalita 13,9/100 000 žen, tj. 741 případů (graf 1) [1].
Graph 1. Časový vývoj hrubé incidence a mortality u karcinomu vaječníku v letech 1977–2010 
V době diagnózy mají přibližně dvě třetiny pacientek onemocnění v pokročilém stadiu s velkým rizikem relapsu nemoci po primární léčbě (graf. 2) [1].
Graph 2. Časový vývoj zastoupení klinických stadií karcinomu ovaria v době diagnostikování onemocnění 
Mezi zásadní prognostické faktory karcinomu ovaria patří klinické stadium, pooperační reziduum nádoru, přítomnost ascitu a pozitivita peritoneálního výplachu u časných stadií, celkový klinický stav pacientky – performance status (PS), věk a histologická varianta nádoru.
Medián celkového přežití pacientek s ovariálním karcinomem se za posledních 25 let prodloužil ze 17 na více než 65 měsíců.
Angiogeneze má zásadní význam pro fyziologické procesy v ovariu i pro patogenezi epiteliálních ovariálních karcinomů, jejich progresi, metastatický rozsev i tvorbu ascitu.
Buňky epiteliálního ovariálního karcinomu produkují vaskulární endotelový růstový faktor (VEGF), který je klíčovým mediátorem angiogeneze, která je komplexním procesem vedoucím k novotvorbě cévní sítě nádoru, je vinutější, má narušené perivaskulární obaly a zvýšenou permeabilitu [2].
Bevacizumab
Bevacizumab (BEV) je rekombinantní humanizovaná monoklonální protilátka, která se váže na VEGF-receptor. Neutralizuje ligand blokem VEGF-A, VEGF-B, VEGF-C, brání interakci s receptory, a tak nejsou signální cesty receptoru VEGF aktivovány. Tím dochází ke zvýšení apoptózy a nižšímu přežití endotelových buněk a klesá tak proliferace endotelových buněk a nádorová angiogeneze [2].
Metodika léčby u případové pacientky
V případě naši pacientky jsme pro léčbu 2. relapsu karcinomu vaječníku využili schéma GC – gemcitabin (1 000 mg/m2 den 1 a 8) a karboplatina (AUC 4 den 1) každých 21 dní s bevacizumabem (15 mg/kg den 1) podle protokolu klinického hodnocení fáze III – OCEANS (schéma) [5].
Schéma. Východisko případu: studie OCEANS, upraveno podle Aghajanian ASCO 2011 [5] ![Schéma. Východisko případu: studie OCEANS, upraveno podle Aghajanian ASCO 2011 [5]](https://pl-master.mdcdn.cz/media/image/22e4d4aa77cd7c59d9ff7a0ba3502271.png?version=1537790407)
Popis případ
Pacientka (ročník 1952) pracovala v rámci své lékařské profese v oboru hematologie.
Na základě údajů z rodinné anamnézy víme, že její otec zemřel v 62 letech na karcinom pankreatu a že má starší sestru a dvě dcery. V minulosti kouřila. Do doby zjištění první malignity měla pouze klinicky němou, sonograficky verifikovanou cholecystolitiázu.
V roce 2006 jí byl při mamografickém vyšetření prokázán karcinom pravého prsu, stadium IIA. Histologicky se jednalo o hormonálně pozitivní, nízce diferencovaný invazivní duktální karcinom, s nízkou expresí genu c-erbB2. Komplexní léčba karcinomu prsu na jiném pracovišti zahrnovala operaci (parciální resekci pravého prsu a exenteraci axily), adjuvantní chemoterapii – 6 cyklů kombinace FEC (fluorouracil, epirubicin, cyklofosfamid, s kumulativní dávkou epirubicinu 1 068 mg), radioterapii na oblast pravého prsu a spádových lymfatických uzlin a následnou hormonální léčbu tamoxifenem až do roku 2010, kdy byla tato léčba změněna na dosud trvající léčbu inhibitorem aromatázy letrosolem.
V rámci následné dispenzarizace se začátkem roku 2010 u pacientky objevily bolesti břicha, pro které byla učiněna další vyšetření, a při nich jí byl diagnostikován druhý zhoubný nádor, a to karcinom vaječníků pokročilého stadia IIIC. Histologicky se jednalo o špatně diferencovaný serózní adenokarcinom.
Pozitivita rodinné anamnézy a výskyt duplicity malignity u pacientky byly důvodem provedení genetického vyšetření. To prokázalo mutaci genu BRCA 2 (nonsense substituci c.8363G >A/p.Trp2788X.). Další genetické testování potvrdilo přítomnost mutace i u mladší dcery nemocné.
Na základě nálezů byla pacientka indikována k operaci. Dne 20. 4. 2010 provedena hysterektomie a bilaterální adnexektomie, peritonektomie (parciální zadní i přední), apendektomie, omentektomie a exstirpace metastázy z přední stěny břišní. Ponecháno reziduum na zadní stěně žaludku velikosti 0,5 cm ve stěně. Pooperačně pacientka podstoupila 6 cyklů standardní chemoterapie v režimu paklitaxel/karboplatina. Kontrolní PET/CT-vyšetření v září 2010 prokázalo kompletní remisi choroby s normalizací hodnot onkomarkerů v laboratorním obraze. Pacientka v té době na vlastní žádost přestoupila do péče našeho pracoviště.
Již v březnu 2011, po 7 měsících od dosažení kompletní remise, byl na základě elevace onkomarkerů, USG-vyšetření a PET/CT-vyšetření pacientce prokázán 1. relaps karcinomu vaječníků v oblasti malé pánve. Následná operace 29. 3. 2011 byla pouhou explorací s průkazem difuzní karcinomatózy parietálního a viscerálního peritonea, včetně oblasti rektosigmatu. Během operace byl vypuštěn ascites o objemu 1,5 l. Histologie odebraných vzorků znovu potvrdila serózní adenokarcinom. V době hojení došlo k významné klinické progresi intraabdominálního nálezu.
Zvolená kombinace chemoterapie gemcitabin/cisplatina ani po 2 cyklech nebyla klinicky a laboratorně efektivní, byla proto nahrazena chemoterapií topotekanem. Podáním celkem 8 cyklů topotekanu bylo dosaženo u pacientky výrazné parciální regrese tumorózního postižení dle PET/CT-vyšetření.
Bohužel v lednu 2012 kontrolní PET/CT-vyšetření u pacientky prokázalo 2. relaps choroby. Nově ascites, postižení peritonea, podezření na lokální recidivu v oblasti malé pánve, lymfatických uzlin mediastina a retroperitonea.
V této době byly k dispozici příznivé výsledky primární analýzy klinického hodnocení fáze III studie OCEANS (o studii níže) se zlepšením přežití bez progrese, zvýšením četnosti léčebných odezvy a prodloužením trvání odezvy po přidání bevacizumabu k chemické léčbě (tab. 1 a graf 3) [5].
Table 1. OCEAN: primární analýza přežití bez progrese (PFS), upraveno podle [5] ![OCEAN: primární analýza přežití bez progrese (PFS), upraveno podle [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d8ae36c999398850b8ddc6830df6e5eb.png)
Graph 3. Pravděpodobnost přežití bez progrese (PFS), upraveno podle [5] ![Pravděpodobnost přežití bez progrese (PFS), upraveno podle [5]](https://pl-master.mdcdn.cz/media/image/6deadac13619ecaafe74860e0d2c92e4.png?version=1537790407)
Snaha pacientky i její rodiny o uplatnění bevacizumabu v další léčbě vyústily v složité jednání vedení našeho pracoviště s plátcem zdravotního pojištění, který umožnil individuální úhradou zahájení této léčby v únoru 2012, za podmínky přísného a pravidelného monitorování efektu nasazené léčby.
Již po 4 cyklech léčby GC/BEV byla na PET/CT-vyšetření v dubnu 2012 pozorována významná parciální regrese nálezů v dutině břišní, vymizel tumorózní nález v mediastinu (obr. 1 a obr. 2).
Image 1. PET/CT vyšetření před zahájením léčby (1.1) a po 3 měsících (1.2) – oblast jater 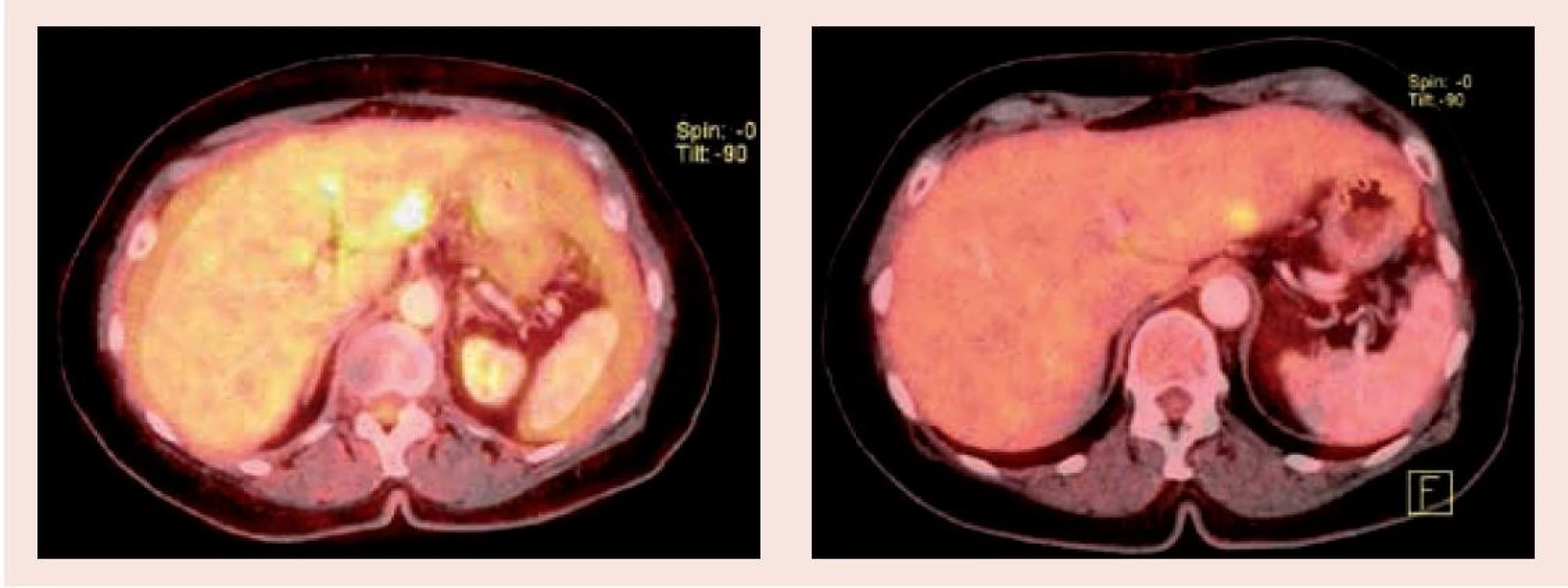
Image 2. PET/CT vyšetření před zahájením léčby (2.1) a po 3 měsících (2.2) – oblast malé pánve 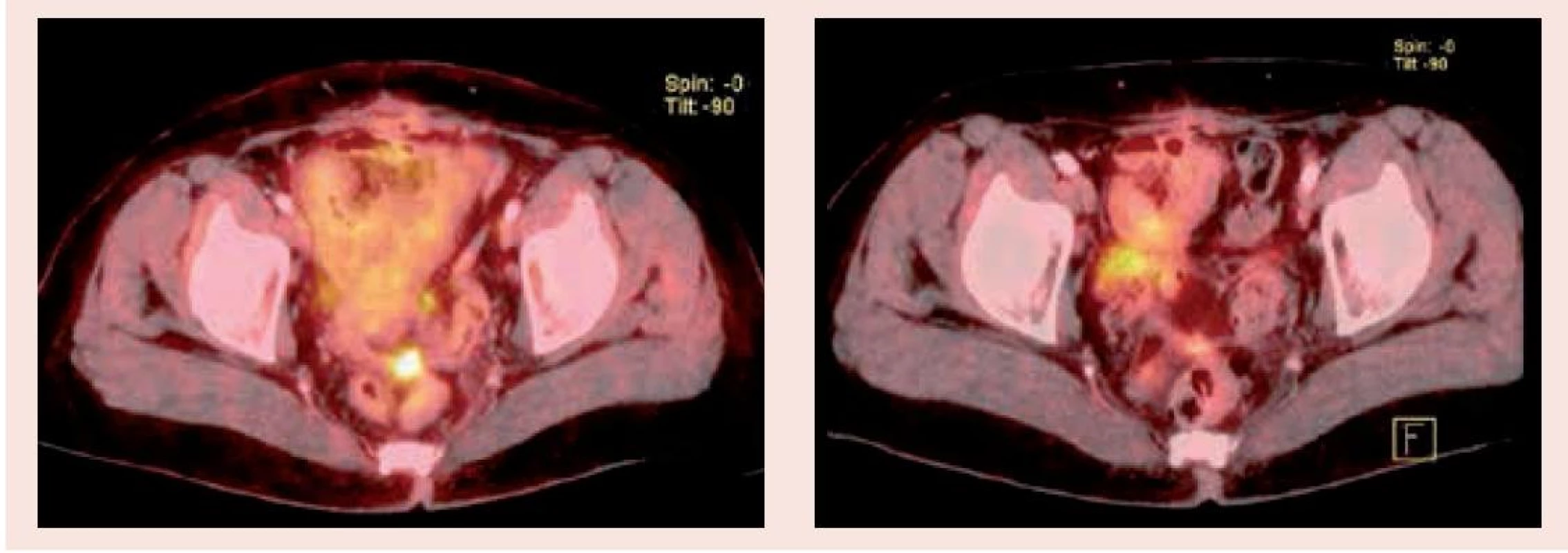
Léčebný efekt kopírovaly klesající hodnoty onkomarkerů (graf 4).
Graph 4. Grafické znázornění dynamiky hodnot monitorovaných onkomarkerů během léčby relapsů 
Nálezy byly v lednu 2013 po 12 měsíční léčbě stabilizované, kontrolní PET/CT-vyšetření bez jasné patologické akumulace podaného radiofarmaka.
V březnu 2013 po roční léčbě potencované bevacizumabem odhalilo PET/CT-vyšetření 3. relaps choroby (tab. 2).
Table 2. Závěry výsledků kontrol léčby schématem gemcitabin + karboplatina + bevacizumab 
Léčba touto kombinací byla z hlediska toxicity dobře tolerovaná, pacientka byla ve vynikající kondici odpovídající performance statusu 0, přetrvávaly projevy neurotoxicity (G1) a hematologické toxicity (G1). Aplikace karboplatiny byla ukončena při výskytu alergické reakce po 4. cyklu a byla dále nahrazena do 9. cyklu cisplatinou. V srpnu 2012 po 9. cyklu chemoterapie zjištěna hypertenze.
Předchozí adjuvantní léčba karcinomu prsu v roce 2006 částečně vyčerpala kumulativní dávku antracyklinů. Kontrolní echokardiografické vyšetření a EKG-vyšetření potvrdilo normální nález, a proto pacientka v současnosti dále pokračuje v léčbě pegylovaným lipozomálním doxorubicinem.
Diskuse
Efektivitu a uplatnění bevacizumabu v primární léčbě ovariálního karcinomu potvrdily klinické studie fáze III. V studii GOG-218 (Gynecologic Oncology Group) bylo randomizováno do 3 ramen 1 873 pacientek stadia III–IV. V této studii bylo srovnáváno rameno (1.) standardní léčby karboplatinou s paklitaxelem s ramenem (2.), v němž byla aplikace této chemoterapie potencována přidáním bevacizumabu v dávce 15 mg/m2 každé 3 týdny a dále s ramenem (3.), ve kterém byla k chemoterapii přidaná léčba bevacizumabem v dávce 15 mg/m2 prolongována na celkovou dobu 15 měsíců. Přidáním bevacizumabu k chemoterapii paklitaxelem s karboplatinou se zvýšil interval přežití bez progrese (PFS – progression-free survival) o 3,8 měsíce (z 10,3 na 14,1 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 38 % a snížení rizika progrese nemoci a smrti o 28 %. Při dalším pokračování samotné aplikace po dobu 12 měsíců dojde ke zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 56 % a ke snížení rizika progrese nemoci a smrti o 36 % [3,4].
Do studie ICON 7 bylo zařazeno 1 528 chemonaivních pacientek stadia I-IV, které byly rozděleny do 2 ramen. Rameno (1.) se standardní léčbou paklitaxelem s karboplatinou a rameno (2.), ve kterém byl k standardní chemoterapii od 2. cyklu přidán bevacizumab v dávce 7,5 mg/m2 v délce trvání 12 měsíců. PFS byl v rameni s BEV zvýšen o 2,3 měsíce (z 16 na 18,3 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 27 % a snížení rizika progrese nemoci a smrti o 21 % [3,4].
Studie OCEANS (Ovarian Cancer Study Comparing the Efficacy and Safety of Chemotherapy and Anti-Angiogenic Therapy in Platinum-Sensitive Recurrent Disease) je multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie fáze III, do níž bylo zařazeno 484 žen s platina-senzitivním prvním relapsem karcinomu ovaria. Tato studie srovnávala rameno s chemoterapií karboplatinou s gemcitabinem a s aplikací bevacizumabu 15 mg/kg s pokračováním aplikace samotné biologické léčby až do progrese nemoci s ramenem, v němž byl bevacizumab nahrazen placebem. Primárním cílem studie bylo stanovení PFS, sekundárním cílem bylo stanovení celkového přežití (OS – overall survival), míry léčebné odezvy (ORR – overall response rate) a bezpečnosti látky. U skupiny pacientek s cílenou léčbou došlo k prodloužení PFS o 4 měsíce (8,4 vs 12,4 měsíce; HR 0,484) a medián OS se prodloužil o 5,6 měsíce (29,9 vs 35,5 měsíce; HR 0,751) [5,6,7].
Další studie AURELIA byla určena pro pacientky s nádorem rezistentním k platině a byl posuzován efekt přidání bevacizumabu v dávce 15 mg/m2 každé 3 týdny nebo 10 mg/m2 každé 2 týdny (dle režimu) ke standardní chemoterapii (paklitaxel, topotekan nebo pegylovaný lipozomální doxorubicin dle volby řešitele) ve srovnání se samotnou chemoterapií. Primárním cílem této studie bylo prokázat prodloužení přežití bez progrese. Zařazeno bylo 361 pacientek do ramen paklitaxel 80 mg/m2 dny 1, 8, 15 a 22 každé 4 týdny nebo topotekan 4 mg/m2 dny 1, 8 a 15 každé 4 týdny nebo 1,25 mg/m2 dny 1–5 každé 3 týdny nebo pegylovaný lipozomální doxorubicin 40 mg/m2 den 1 každé 4 týdny). Léčba pokračovala vždy až do progrese nebo nepřijatelné toxicity. Cíl této studie byl splněn, střední přežití bez progrese bylo prodlouženo o 3,3 měsíce (3,4 vs 6,7 měsíce). Významného prodloužení přežití bez progrese bylo dosaženo ve všech hodnocených podskupinách nemocných (např. dle zvolené chemoterapie, přítomnosti ascitu), významně byla rovněž zvýšena četnost odezvy. Léčba byla bezpečná s nízkou incidencí obávané perforace gastrointestinálního traktu [8,9].
Bevacizumab se jeví jako nová možnost léčby pro nemocné s pokročilým nádorem jak v primární léčbě, tak u pacientek s rekurentním nádorem citlivým i rezistentním k platině.
Závěr
Ve srovnání s protokolem OCEANS jsme pacientce pro vysoké riziko progrese onemocnění, předléčenost a vynikající léčebnou odezvu a toleranci režimu, potvrzující slibnost výsledků klinického hodnocení studií OCEANS a AURELIA, ponechali udržovací léčbu bevacizumabem i gemcitabinem po základní řadě 9 cyklů chemoterapie do progrese.
Nasazení této úspěšné kombinace bevacizumabu s chemoterapií vedlo k významnému prodloužení přežití naší pacientky ve výborné kondici.
To je důkazem faktu, známého z řady klinických hodnocení léčby s přidáním bevacizumabu, že inhibice angiogeneze je účinná ve všech liniích léčby ovariálního karcinomu, a to i v případě karcinomu pokročilého a relabujícího [5–9].
V našich podmínkách podle současných doporučení České onkologické společnosti je bevacizumab indikován v kombinaci s paklitaxelem a karboplatinou k 1. linii léčby pacientek s pokročilým epitelovým karcinomem vaječníků (stadia IIIB, IIIC, IV), vejcovodů nebo primárním nádorem pobřišnice. Podává se po dobu 6 léčebných cyklů, a následně se pokračuje v samostatné léčbě bevacizumabem do progrese nemoci nebo maximálně po dobu 15 měsíců nebo do nepřijatelné toxicity, dle toho, co nastane nejdříve. Doporučená dávka bevacizumabu je 15 mg/kg tělesné hmotnosti podaná 1krát za 3 týdny ve formě intravenózní infuze [10].
Poděkování
Autorky děkuji za umožnění publikovat dokumentaci nemocné poskytnuté Klinikou zobrazovacích metod Fakultní nemocnice Plzeň, přednosta doc. MUDr. B. Kreuzberg, CSc.
Doručeno do redakce dne 1. srpna 2013
Přijato po recenzi dne 2. září 2013
MUDr. Zuzana Donátová
zuzana.donatova@ftn.cz
Onkologická klinika, 1. LF UK a Thomayerova nemocnice, Praha
www.ftn.cz
prof. MUDr. Jitka Abrahámová, DrSc.
Sources
1. ÚZIS ČR. NOR ČR. Novotvary 2009. ÚZIS ČR, NOR ČR 2012. ISBN 978–80–7280–975–2 Dostupné i z WWW: <http:// www.uzis.cz/publikace/novotvary-2009>.
2. Ramakrishnan S, Subramanian IV, Yokoyama Y et al. Angiogenesis in normal and neoplastic ovaries. Angiogenesis 2005; 8(2): 169–182.
3. Burger RA, Brady MF, Bookman MA et al. Gynecologic Oncology Group. Incorporation of Bevacizumab in the Primary Treatment of Ovarian Cancer. N Engl J Med 2011; 365(26): 2473–2483.
4. Perren TJ, Swart AM, Pfisterer J et al (ICON 7 Investigators). A phase 3 trial of bevacizumab in ovarian Cancer. N Engl J Med 2011;365(26): 2484–2496.
5. Aghajanian C, Finkler NJ, Rutherford T et al. OCEANS: A randomized, double-blinded, placebo-controlled phase III trial of chemotherapy with or without bevacizumab (BEV) in patients with platinum-sensitive recurrent epithelial ovarian (EOC), primary peritoneal (PPC), or fallopian tube cancer (FTC). ASCO Annual Meeting Proceedings (Post-Meeting Edition; Annual Meeting Chicago June 4–8). J Clin Oncol 2011; 29(18, Suppl): Abstract LBA5007.
6. Aghajanian C, Blank SV, Goff BA et al. An updated safety analysis of OCEANS, a randomized, double-blind, phase III trial of gemcitabine (G) and carboplatin (C) with bevacizumab (BV) or placebo (PL) followed by BV or PL to disease progression (PD) in patients with platinum-sensitive (Plat-S) recurrent ovarian cancer. J Clin Oncol 2012; 30(15, Suppl), ASCO Annual Meeting Proceedings (Post-Meeting Edition; Annual Meeting Chicago): Abstract 5054.
7. Aghajanian C, et al. OCEANS: Updated overall survival analysis in OCEANS, a randomised phase 3 trial of gemcitabine (G) + carboplatin ( C ) and bevacisumab (BV) or placebo (PL) follow by BV or PL in platium sensitive recurrent epithelial ovaria (ROC) , primary peritoneal (PPC), or Fallopian tube cancer (FTC). 2012 Program and abstracts of the 2012 Annual Congress of the European Society for Medical Oncology, Abstract 9670.
8. Pujade - Lauraine E, Hilpert F et al (AURELIA Investigators). A randomised phase III trial evaluating bevacizumab (BEV) plus chemotherapy (CT) for platinum (PT) - resistant recurrent ovarian cancer (OC) J. Clin Oncol 2012; 30(18, Suppl 2012 ASCO Annual Meeting Abstracts LBA 5002.
9. Poveda AM, Selle F, Hilpert F et al. Weekly paclitaxel ( PAC) pegylated liposomal doxorubicin ( PLD) or topotecan ( TOP) +/ - bevacizumab ( BEV) in platinum ( PT) - resistant recurrent ovarian cancer (OC) : analysis by chemotherap y ( CT( cohort in the GCIG AURELIA randomised phase III trial. Program and abstracts of the 2012 Annual Congress of the European Socienty for Medical Oncology, Abstract LBA 26
10. Modrá kniha České onkologické společnosti JEP, 16. vyd. Masarykův onkologický ústav 2013: kap. 9.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2013 Issue 3-
All articles in this issue
- Účinnost bevacizumabu v léčbě relabujícího karcinomu vaječníku: kazuistika
- Resveratrol v onkogynekologii
- Ambulantní hysteroskopická sterilizace systémem Essure – nová technologie permanentní antikoncepce
- Kdy odeslat pacientku k venerologovi?
- Novinky ve studiu syndromu polycystických ovarií
- Antiadhezivní prostředky v laparoskopické operativě
- Czech urogynecology in 21th century
- Determinanty zdravotní gramotnosti těhotných žen
- XIth World Congress of Perinatal Medicine
- 10th Congress of European Society of Gynecology
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ambulantní hysteroskopická sterilizace systémem Essure – nová technologie permanentní antikoncepce
- Antiadhezivní prostředky v laparoskopické operativě
- Kdy odeslat pacientku k venerologovi?
- Novinky ve studiu syndromu polycystických ovarií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

