-
Medical journals
- Career
Fournierova gangréna jako komplikace Amyandovy hernie
Authors: F. Sládek 1; V. Krass 1,2; O. Salaš 1; M. Sutorý 1,2; L. Paša 2
Authors‘ workplace: Chirurgické oddělení, Úrazová nemocnice v Brně 1; Klinika traumatologie Lékařské fakulty Masarykovy Univerzity Brno 2
Published in: Rozhl. Chir., 2019, roč. 98, č. 7, s. 291-296.
Category: Case Report
Overview
Úvod: Fournierova gangréna je zřídka se vyskytující, nicméně rychle progredující závažný stav s vysokou mortalitou. Ve většině případů je charakterizována jako nekrotizující fasciitida oblasti perinea a zevního genitálu. Amyandova hernie je vzácným stavem, kdy je apendix céka obsahem vaku tříselné kýly. Zánětlivé změny apendixu tvoří pouze 0,1 % případů při verifikaci Amyandovy kýly. Fournierova gangréna vzniklá jako komplikace při pozdě diagnostikované apendicitidě uložené v tříselném kanálu je v literatuře popsána v ojedinělých kazuistických sděleních.
Kazuistika: Kazuistika 70letého pacienta s probíhající Fournierovou gangrénou vzniklou na podkladě gangrenózní apendicitidy Amyandovy hernie.
Závěr: Fournierova gangréna jako komplikace Amyandovy hernie je raritním stavem, v literatuře referovaným pouze jako ojedinělá kazuistická sdělení. Vzhledem k vzácnosti patologie a nedostatku randomizovaných kontrolovaných studií je obtížné určení optimálního léčebného postupu dle principů evidence-based medicine. Vhodným přístupem k této patologii se jeví spojení vypracovaných guidelines v terapii Amyandovy hernie dle Losanoffa a Bassona, spolu s doporučovaným zlatým standardem terapie u Fournierovy gangrény, tj. včasným a radikálním chirurgickým débridement, adekvátní antibiotickou terapií a intenzivní péčí o pacienta.
Klíčová slova:
Fournierova gangréna – Amyandova hernie – nekrotizující fasciitida – gangrenózní apendicitida – tříselná kýla
Úvod
Fournierova gangréna je vzácná, fulminantně probíhající forma nekrotizující fasciitidy, postihující oblast zevního genitálu, perinea a anorekta. V roce 1764 byla referována nejprve Bauriennem, svůj název dostala podle pařížského dermatovenerologa Jeana Alfreda Fourniera, který v roce 1883 na souboru pěti mladých mužů popsal idiopatickou nekrotizující gangrénu skrota a penisu [2]. V dnešní době je prokázáno, že se téměř nikdy nejedná o idiopatický stav, vyvolávající příčina může být natolik triviální, že je přehlédnuta [3]. Zároveň se onemocnění neomezuje pouze na mladé muže, ale bylo popsáno i u žen a u dětí [4]. Nekrotizující fasciitida často vzniká jako následek infekce oblasti anorekta (30–50 %), urogenitální (20–40 %) či kůže zevního genitálu (20 %) [5].
Zlatým standardem terapie Fournierovy gangrény je včasné a radikální chirurgické débridement [3] spolu s efektivní antibiotickou terapií a intenzivní péčí o pacienta.
Amyandova hernie je definována jako přítomnost apendixu céka ve vaku inguinální hernie. Byla pojmenována podle britského chirurga Claudia Amyanda, který v roce 1735 v St. George’s Hospital v Londýně provedl první doloženou úspěšnou apendektomii. Pacientem byl 11letý chlapec s inkarcerovanou pravostrannou tříselnou kýlou, jejímž obsahem byl perforovaný apendix [6]. První provedená apendektomie v USA o více než století později byla taktéž případem Amyandovy hernie [7].
Tříselná kýla je jednou z nejčastějších operací ve všeobecné chirurgii. Celosvětově je ročně uváděno více než 20 milionů operací pro inguinální hernii. Incidence nálezu, kdy je apendix obsahem tříselné kýly, je asi 1 %. Komplikace ve smyslu apendicitidy, příp. perforace či abscesu v kýle je mnohem vzácnější, incidence tvoří asi 0,1 % [8].
Levostranná Amyandova hernie je popisována v souvislosti se situs viscerum inversus, u intestinální malrotace a syndromu cékum mobile [9].
Léčba tohoto vzácného stavu zahrnuje apendektomii a hernioplastiku. Apendektomie je indikována především u zánětu na apendixu. Užití mesh plastiky není v případě apendicitidy doporučováno z důvodu rizika pooperačních infekčních komplikací [10].
Kazuistika
Muž, 70 let, hypertonik, BMI 40, v anamnéze abusus alkoholu, byl přivezen RZP 6. 6. 2018 na spádové interní pracoviště pro 14 dní trvající febrilie nejasné etiologie. Pacient spíše simplexní povahy. Vstupní CRP 347 mg/l, Leu 17,1x109/ l, PCT 3,2 ng/ml. Vstupní klinické vyšetření bylo bez zásadní patologie, břicho pro obezitu obtížně vyšetřitelné, palpačně nebolestivé, bez hmatné resistence, peristaltika fyziologická. Vstupní RTG S+P, RTG břicha a UZ břicha bez patologie. Empiricky byl nasazen Amoksiklav 1,2g i.v. O dva dny později pro otok v oblasti pravého hemiskrota byl proveden UZ s nálezem rozšíření obalů varlete, chirurgické konzilium zkonstatovalo stav svědčící pro pravostrannou orchiepididymitidu. Do medikace byl přidán Gentamicin 480 mg i.v. Dále doporučená kontrola urologem byla provedena 11. 6. 2018, stav hodnocen jako progredující dermatitida zevního genitálu a podbřišku, orchitida spíše v regresi. Po týdnu od příjmu pacienta byl domluven překlad do Úrazové nemocnice v Brně pro progresi stavu a suspekci na Fournierovu gangrénu.
Pacient byl přivezen v těžkém septickém stavu, TK 70/50, TF 115, byla zjištěna fibrilace síní s rychlou odpovědí komor a počínající respirační selhání. V klinickém nálezu byla dominantní pokročilá gangréna skrota s flegmonou podbřišku (Obr. 1, 2), s krepitací podkoží a putridním foetorem. Pacient byl urgentně přijat na ARO. Po nezbytné hemodynamické stabilizaci, zajištění dýchacích cest a nasazení ATB terapie Meronem + Targocid + Metronidazol byl pacient převezen na operační sál k revizi. Byla provedena radikální nekrektomie celého pravého hemiskrota, které jevilo známky pokročilé anaerobní infekce, a pravostranná orchiektomie pro pokročilou nekrózu pravého varlete (Obr. 3). Dále byl zjištěn nekrotický infiltrát v oblasti pravého tříselného kanálu, který peroperačně imponoval jako tříselná hernie, jejíž obsah byl vzhledem k pokročilé gangréně neidentifikovatelný. Ten byl taktéž odstraněn. Na konci operace byly provedeny bilaterálně incize v oblasti podbřišku, kde nebyly patrny známky fasciitidy, a zároveň byla doplněna punkční epicystostomie k derivaci moči. Výkon byl poté pro oběhovou nestabilitu pacienta ukončen (Obr. 4).
Image 1. Gangréna skrota s flegmonou v podbřišku
Fig. 1. Scrotal gangrene with hypogastric phlegmon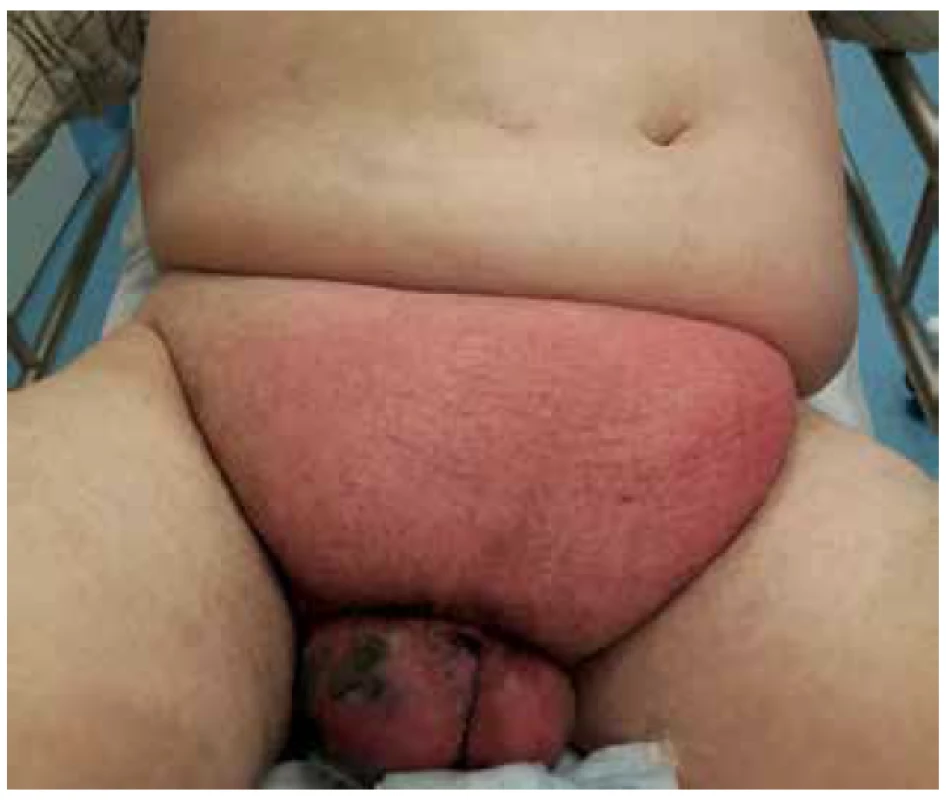
Image 2. Gangréna skrota s flegmonou v podbřišku
Fig. 2. Scrotal gangrene with hypogastric phlegmon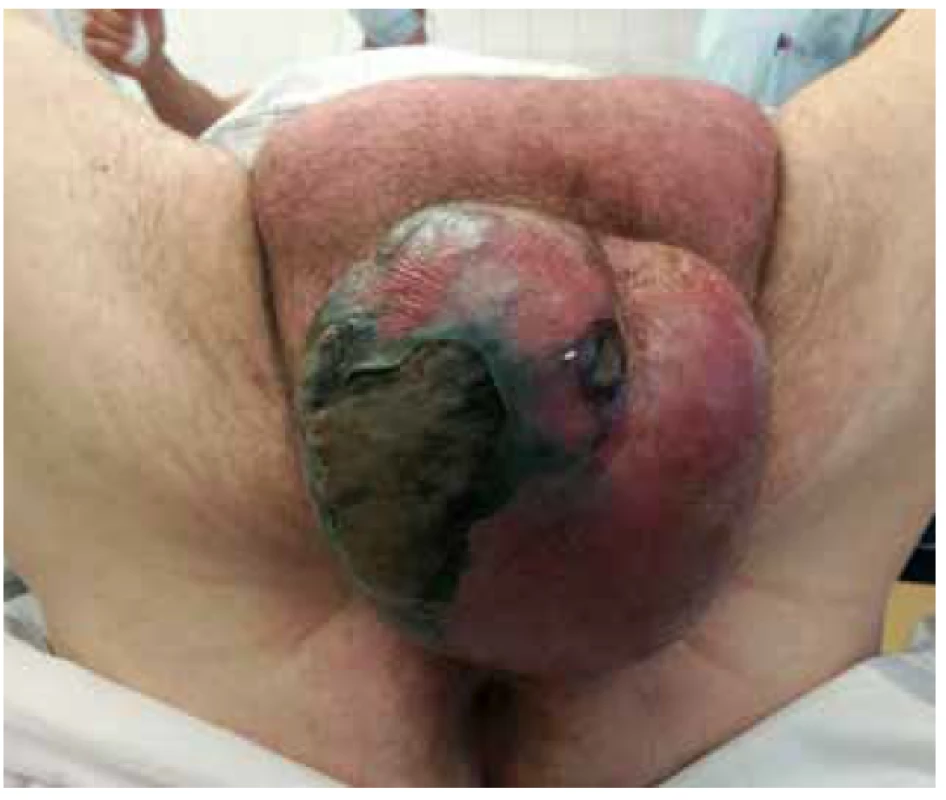
Image 3. Peritestikulární nekróza s nekrózou pravého varlete
Fig. 3. Peritesticular and right testicular necrosis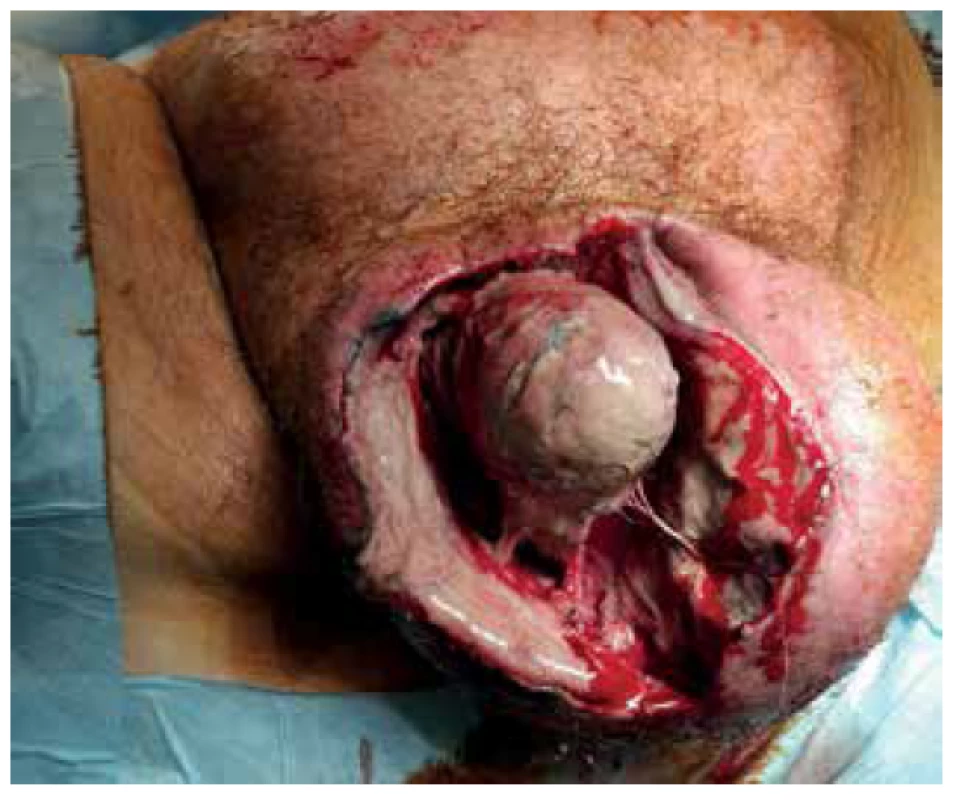
Image 4. Stav po nekrektomii
Fig. 4. Condition after necrectomy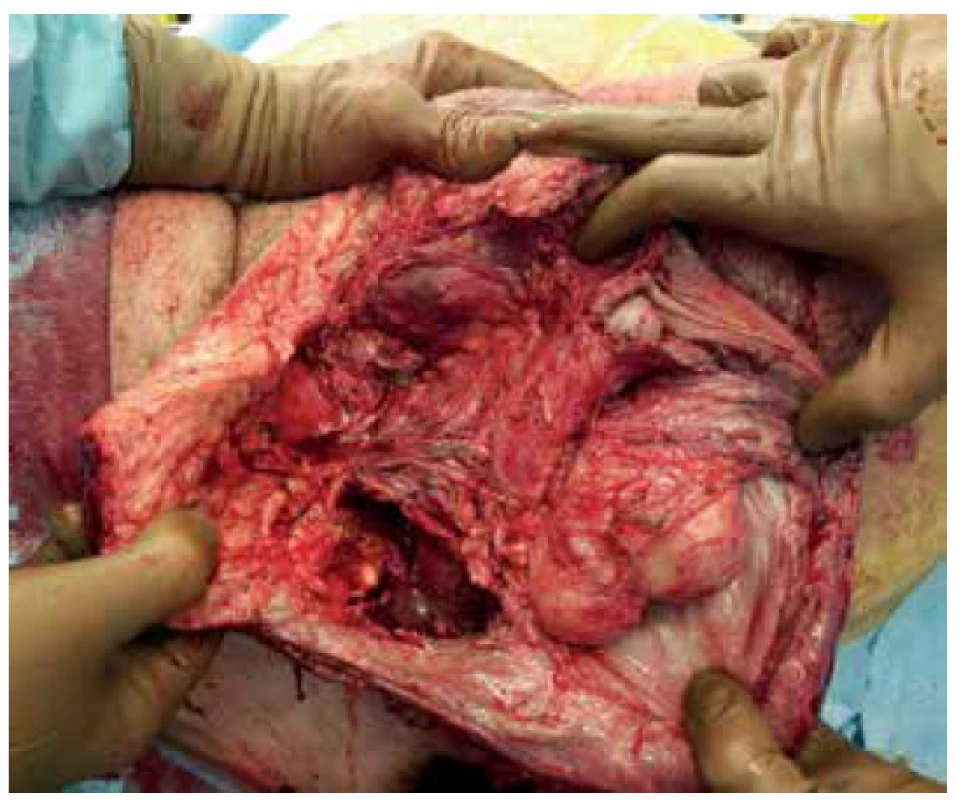
V následujících dnech byl pacient trvale na oběhové podpoře vysokými dávkami noradrenalinu a byla nutná podpora diurézy a suplementace kalia, dále pokračovala antibiotická terapie, Meronem 2g i.v. po 8 hod., Targocid 400 mg 1x denně a Metronidazol 500 mg i.v. po 8 hod. Rána byla převazována 2x denně s antiseptickými obklady. O dva dny později, 15. 6. 2018, kdy byly vyloučeny známky pokračující gangrény, byla naložena podtlaková terapie Vacuum assisted closure (VAC) (Obr. 5). Zároveň došlo k poklesu zánětlivých parametrů. Výsledkem bakteriologické kultivace bylo E.coli a Enterococcus faecalis, anaerobní bakterie byly negativní.
Image 5. Naložení VAC do defektu
Fig. 5. Vacuum Assisted Closure of the defect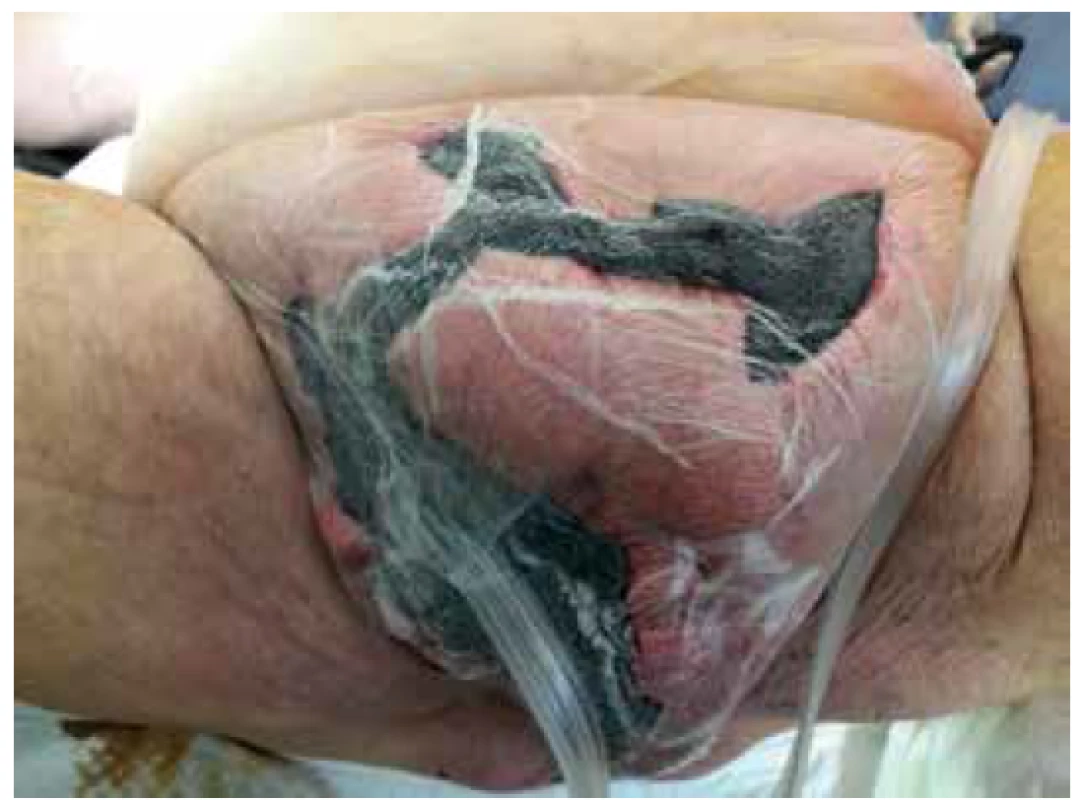
Šestý den od primární operace, při plánované výměně podtlakové terapie, byla zjištěna sterkorální sekrece z p. třísla, nicméně stav pacienta byl po stránce hemodynamické i zánětlivých parametrů zlepšen. Revizí z dolní střední laparotomie byl nalezen absces a sterkorální retence uložená retrocékálně, resp. retroperitoneálně s komunikací do pravého třísla. Zdrojem byla perforace v oblasti céka, resp. v místě reziduálního pahýlu původního apendixu, který byl s největší pravděpodobností součástí infiltrátu pravého třísla a byl odstraněn při původní revizi. Vzhledem k zachovalé vitalitě céka byl defekt uzavřen dvouvrstevnou suturou s plombáží přilehlým omentem, bez nutnosti resekce a byla provedena protektivní dvouhlavňová ileostomie. V následujících dnech došlo k postupné úpravě stavu pacienta, byl extubován a do defektu byl zpět naložen VAC systém.
28. 6. 2018, tj. 16. den od příjmu, byla provedena kompletní sutura rány skrota a třísla s drenáží (Obr. 6). Pacient byl postupně vertikalizován a plně zatížen stravou. 9. 7. 2018, tj. 27. den hospitalizace v našem zařízení, byl přeložen do LDN na původní pracoviště. Následně po 3 měsících po provedeném kolonoskopickém vyšetření, kde nebyla zjištěna intraluminální patologie, bylo provedeno zanoření stomie. V pooperačním období pro absces v ráně po destomizaci byla opět přechodně naložena podtlaková terapie a pacient byl 11. den od operace propuštěn do domácího ošetřování. Při následujících ambulantních kontrolách se rány již hojily bez komplikací, pacient byl v příznivém klinickém stavu a další ambulantní sledování bylo domluveno pouze v případě obtíží (Obr. 7).
Image 6. Stav po kompletní sutuře s drenáží
Fig. 6. Condition after complete suture with drainage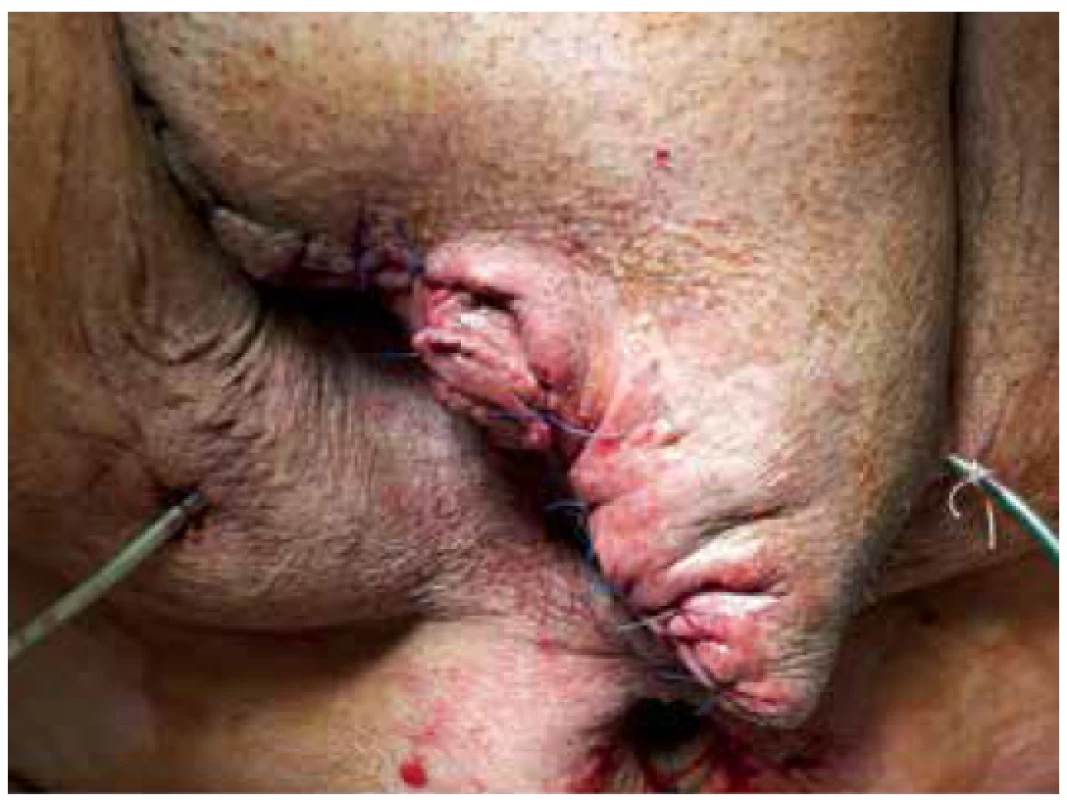
Image 7. Stav po třech měsících od primární operace
Fig. 7. Condition at 3 months from the primary surgery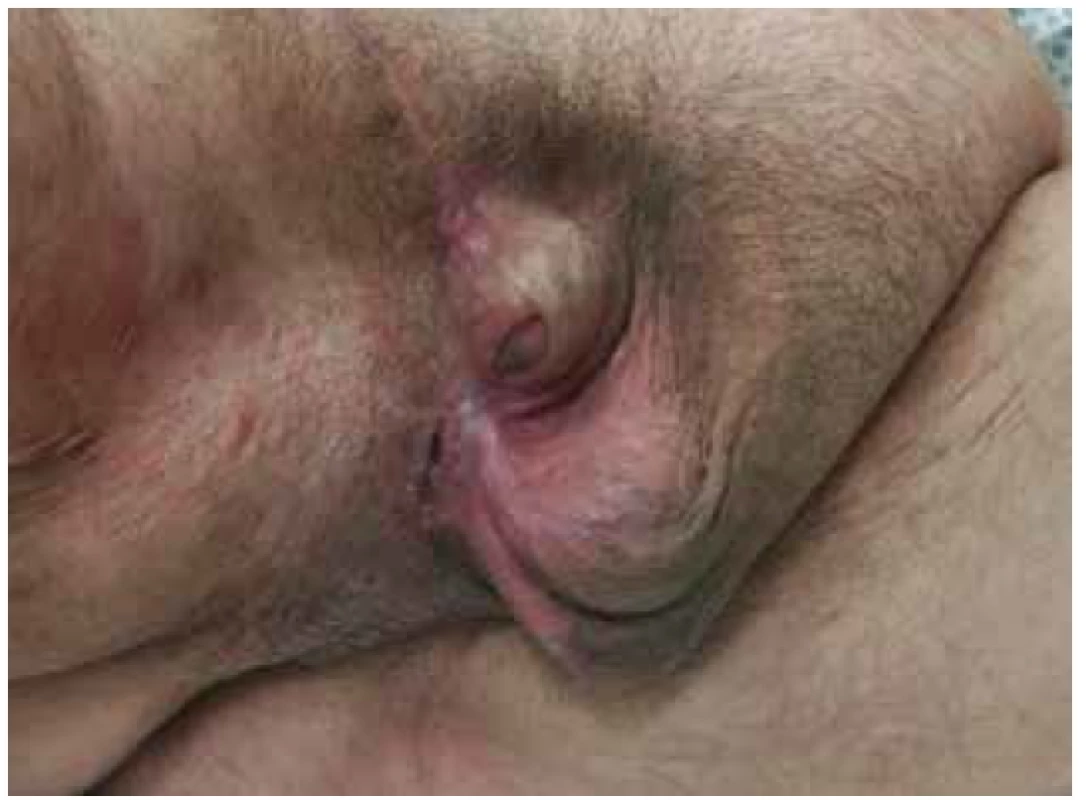
Diskuze
Dle dostupných literárních údajů samotná přítomnost Amyandovy hernie nebývá příčinou mortality, zdrojem komplikací a úmrtí bývají přidružené komorbidity pacienta [11]. Fournierova gangréna je raritní a závažná komplikace Amyandovy hernie, která mortalitu významně zvyšuje. V literatuře je referována zřídka, pouze v jednotlivých kazuistických sděleních [12–16]. Při zavedených terapeutických postupech je uváděná mortalita Fournierovy gangrény 20−30 % [4]. Problematice Amyandovy hernie se v domácí literatuře věnovali autoři Hrivnák a spol. [17].
Předoperační diagnostika Amyandovy hernie není jednoduchá vzhledem k tomu, že již přítomnost inkarcerované tříselné hernie je indikací k akutní operaci a není cílem přesně pátrat, zda je obsahem zanícený apendix [18]. Před operací je tedy možná diagnostika pomocí UZ a CT vyšetření, ačkoliv nejčastější jsou až perioperační nálezy. Akutní apendicitida Amyandovy hernie je ve většině případů způsobena extraluminální obstrukcí, resp. tlakem uvnitř vaku kýly, v případě příliš těsného inguinálního anulu, změnami intraabdominálního tlaku a stahem svalů břišní stěny, které způsobí strangulaci apendixu. V menším zastoupení může být způsobena obstrukcí intraluminální, nejčastěji přítomným fekolitem. Translokace virulentních bakterií přes vak hernie do podkoží vede k rychlému šíření infekce, obliterativní endarteriitidě a trombóze cév v podkoží s tkáňovou ischemií, které vedou k Fournierově gangréně [12,19].
Fournierova gangréna je relativně vzácný stav reprezentující pouze 0,02 % hospitalizací. Vzrůstající incidence souvisí především se stárnutím populace a vyšší prevalencí diabetu [20]. Z hlavních predisponujících faktorů jsou tedy uváděny především diabetes mellitus, chronický alkoholismus, human immunodeficiency virus (HIV), lymfoproliferativní onemocnění a kortikoterapie, resp. stavy kompromitující imunitu pacienta. Malnutrice a nízký socioekonomický status jsou uváděny v souvislosti s nízkou úrovni perineální hygieny [4].
Patofyziologie onemocnění vychází ze synergického působení mezi potenciálně málo lokálně agresivními bakteriemi zahrnujícími především Staphylococcus aureus, Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus mirabilis, Enterococci, Bacteroides fragilis a anaerobní streptokoky. Každý mikroorganismus produkuje enzymy nezbytné pro koagulaci nutričních cév, čímž dochází k redukci jak krevního zásobení, tak také tlaku kyslíku ve tkáních. Tkáňová hypoxie poté napomáhá růstu fakultativně anaerobních a mikroaerofilních bakterií, které produkcí enzymů (lecitinázy a kolagenázy) působí na fasciální bariéru, podél níž dochází k rychlému rozšíření infekce. Vzhledem k nepřítomnosti podkožní tkáně v oblasti skrota dochází k nekróze tunica dartos s expozicí testes, která bývají vitální, pokud je zachováno krevní zásobení z břišní aorty. Ve většině případů nekróza varlat indikuje retroperitoneální či intraabdominální zdroj infekce [3].
V našem případě vzhledem k významné obezitě pacienta, BMI 40, a již rozvinuté gangréně v době příjmu pacienta, nebyla předoperační diagnostika, která by verifikovala Amyandovu hernii, provedena. Zároveň se domníváme, že právě obezita pacienta a chudý klinický nález na břiše byly příčinou původní diagnózy pravostranné orchiepididymitidy stanovené na interním pracovišti. Obezitu u pacienta s přítomnou Amyandovou hernií, pokud nejsou projevy střevní obstrukce, tedy hodnotíme jako významný rizikový faktor, který vede ke zpoždění diagnózy přítomné apendicitidy a možnému rozvoji nekrotizující fasciitidy.
Diabetes mellitus, který je často v přímé korelaci s obezitou pacienta, je určen jako zásadní rizikový faktor pro vznik Fournierovy gangrény.
Losanoff a Basson vytvořili klasifikační systém, který definuje 4 typy Amyandovy hernie, v závislosti na klinických podmínkách, a doporučený postup chirurgického řešení [10] (Tab.1).
Table 1. Losanoff a Basson klasifikace Amyandovy hernie [11]
Tab. 1. Losanoff and Basson‘s classification of Amyand‘s hernia [11]![Losanoff a Basson klasifikace Amyandovy hernie [11]<br>
Tab. 1. Losanoff and Basson‘s classification of Amyand‘s hernia [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a1934257eef781e2328bf548cfb843e7.png)
Čtvrtý typ hernie dle Losanoffa a Bassona, resp. Amyandova hernie se sekundárně vzniklou Fournierovou gangrénou, který byl referován v naší kazuistice, vyžaduje akutní odstranění nekrotických a devitalizovaných tkání. Thwaini a spol. uvedli, že již několikahodinové zpoždění významně zvyšuje mortalitu [21]. Dále je nezbytné nasazení širokospektrých antibiotik a reparace defektu třísla bez použití síťky jako prevence pooperačních infekčních komplikací.
U námi referovaného pacienta, vzhledem k již vstupně závažnému septickému stavu a nutnosti následné časné abdominální revize, která ještě prohloubila probíhající SIRS, plastika tříselné hernie provedena nebyla. Dá se tedy do budoucna předpokládat recidiva tříselné hernie s nutností operačního řešení.
Perioperační suspekce na nekrózu samotných testes v terénu nekrotizující fasciitidy je často důvodem k provedení orchiektomie, ačkoliv samotná testes bývají, dle následných patologických nálezů, postižena pouze výjimečně [1]. Rajaguru a spol. uvedli, že nekróza varlat bývá přítomna, pokud je zdroj infekce uložen intraabdominálně [12]. Tak tomu bylo i v námi referovaném případu.
V dalším pooperačním průběhu došlo k výraznému urychlení hojení tkání za použití podtlakové terapie. Assenza a spol. uvedli, že aplikace VAC významně redukuje dobu hospitalizace a morbiditu pacienta a zároveň umožňuje časnější rekonstrukční a plastické řešení vzniklého defektu [22]. V našem případě, vzhledem k obezitě pacienta a nadbytku okolní tkáně, bylo možné uzavření defektu postupnými suturami. Nebyla tedy nutná plastická rekonstrukce ve smyslu v literatuře uváděných možností za použití dermoepidermálních štěpů, fasciokutánních perforátorových laloků či myokutánních laloků [4].
Vzhledem k nejčastější lokalizaci a celkové alteraci stavu u probíhající Fournierovy gangrény je nezbytná taktéž derivace moči, ať už pouhým zavedením močového katétru, či v závažnějších případech provedením epicystostomie.
Otázkou je derivace stolice jako prevence kontaminace ranné plochy. Akcan a spol. vyhodnotili provedení kolostomie k derivaci stolice jako kontroverzní. V nezbytných případech doporučují provedení derivační kolostomie již při primární operaci [23]. Korkut a spol. uvedli signifikantně vyšší mortalitu, 38 %, u pacientů, u kterých je nezbytné provedení kolostomie, ve srovnání s mortalitou, 7 %, u pacientů bez kolostomie [24].
Použití hyperbarické oxygenoterapie bývá v literatuře uváděno jako doplňková terapie k provedenému chirurgickému débridement. Singh a spol. uvedli jako jednoznačnou indikaci použití u pacientů nereagujících na konvenční terapeutické postupy a dále u klostridiových a jiných závažných anaerobních infekcí [4].
Závěr
Fournierova gangréna jako komplikace Amyandovy hernie je raritním stavem, v literatuře referovaným pouze jako ojedinělá kazuistická sdělení. Vzhledem k vzácnosti patologie a nedostatku randomizovaných kontrolovaných studií je obtížné určení optimálního léčebného postupu dle principů evidence-based medicine. Vhodným přístupem k této patologii se jeví spojení vypracovaných guidelines v terapii Amyandovy hernie dle Losanoffa a Bassona spolu s doporučovaným zlatým standardem terapie u Fournierovy gangrény, tj. včasným a radikálním chirurgickým débridement, adekvátní antibiotickou terapií a intenzivní péčí o pacienta.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Filip Sládek
Úrazová nemocnice v Brně
Ponávka 139/6
662 50 Brno
e-mail: filip.sladek@mou.cz
Sources
- Yanar H, Taviloglu K, Ertekin C, et al. Fournier’s gangrene: risk factors and strategies for management. World J Surg. 2006;30 : 1750–4. doi:10.1007/s00268-005-0777-3.
- Fournier JA. Jean-Alfred Fournier 1832-1914. Gangrène foudroyante de la verge (overwhelming gangrene). Sem Med 1883. Dis Colon Rectum. 1988;31 : 984–8.
- Pernetti R, Palmieri F, Sagrini E, et al. Fournier’s gangrene: Clinical case and review of the literature. Arch Ital Urol Androl Organo Uff Soc Ital Ecogr Urol E Nefrol. 2016;88 : 237–8. doi:10.4081/aiua.2016.3.237.
- Singh A, Ahmed K, Aydin A, et al. Fournier’s gangrene. A clinical review. Arch Ital Urol Androl Organo Uff Soc Ital Ecogr Urol E Nefrol. 2016;88 : 157–64.
- Eke N. Fournier’s gangrene: a review of 1726 cases. Br J Surg. 2000;87 : 718–28. doi: 10.1046/j.1365-2168.2000.01497.x.
- Amyand C. Of an inguinal rupture, with a pin in the appendix coeci, incrusted with stone; and some observations on wounds in the guts. Phil Trans R Soc. 1736;39 : 329–42.
- Creese PG. The first appendectomy. Surg Gynecol Obstet. 1953;97 : 643–52.
- Michalinos A, Moris D, Vernadakis S. Amyand’s hernia: a review. Am J Surg. 2014;207 : 989–95. doi: 10.1016/j.amjsurg.2013.07.043.
- Gupta S, Sharma R, Kaushik R. Left-sided Amyand’s hernia. Singapore Med J. 2005;46 : 424–5.
- Losanoff JE, Basson MD. Amyand hernia: a classification to improve management. Hernia 2008;12 : 325–6. doi: 10.1007/s10029-008-0331-y.
- Sharma H, Gupta A, Shekhawat NS, et al. Amyand’s hernia: a report of 18 consecutive patients over a 15-year period. Hernia 2007;11 : 31–5. doi: 10.1007/s10029-006-0153-8.
- Rajaguru K, Tan Ee Lee D. Amyand’s hernia with appendicitis masquerading as Fournier’s gangrene: a case report and review of the literature. J Med Case Reports 2016;10 : 263. doi: 10.1186/s13256-016-1046-9.
- Osorio JK, Guzmán-Valdivia G. Ipsilateral Aymand’s and Richter’s hernia, complicated by necrosing fascitis. Hernia 2006;10 : 443–6. doi: 10.1007/s10029-006-0120-4.
- Mai C. Perforated Amyand’s hernia with necrotizing fasciitis. J Trauma Inj Infect Crit Care 2011;71:E42. doi: 10.1097/TA.0b013e3181cc889d.
- Gaeta M, Volta S, Minutoli A, et al. Fournier gangrene caused by a perforated retroperitoneal appendix: CT demonstration. Am J Roentgenol. 1991;156 : 341–2.doi: 10.2214/ajr.156.2.1898809.
- Ebaugh EP, Hessel K, Udobi K. Appendiceal perforation, necrotizing groin infection and spermatic cord necrosis in a case of Amyand’s hernia. Int J Surg Case Rep. 2016;24 : 172–4. doi: 10.1016/j.ijscr.2016.05.026.
- Hrivnák R, Hanke I, Penka I, et al. Amyandova hernie – vzácná náhlá příhoda břišní. Rozhl chir. 2011;90 : 523−6.
- Barut I, Tarhan ÖR. A rare variation of Amyand’s hernia: Gangreneous appendicitis in an incarcerated inguinal hernia sac. Eur J Gen Med. 2008;5 : 112–4. doi:10.29333/ejgm/82588.
- Singal R, Mittal A, Gupta A, et al. An incarcerated appendix: report of three cases and a review of the literature. Hernia 2012;16 : 91–7. doi: 10.1007/s10029-010-0715-7.
- Sorensen MD, Krieger JN, Rivara FP, et al. Fournier’s gangrene: population based epidemiology and outcomes. J Urol. 2009;181 : 2120–6. doi: 10.1016/j.juro.2009.01.034.
- Thwaini A, Khan A, Malik A, et al. Fournier’s gangrene and its emergency management. Postgrad Med J. 2006;82 : 516–9. doi: 10.1136/pgmj.2005.042069.
- Assenza M, Cozza V, Sacco E, et al. VAC (Vacuum Assisted Closure) treatment in Fournier’s gangrene: personal experience and literature review. Clin Ter. 2011;162:e1−5.
- Akcan A, Sözüer E, Akyildiz H, et al. Necessity of preventive colostomy for Fournier’s gangrene of the anorectal region. TJTES. 2009;15 : 342–6.
- Korkut M, Içöz G, Dayangaç M, et al. Outcome analysis in patients with Fournier’s gangrene: report of 45 cases.
- Dis Colon Rectum. 2003;46 : 649–52.
- doi: 10.1097/01.DCR.0000059329.29085.E9.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 7-
All articles in this issue
- Klinická výživa v chirurgii a jak dál?
- Operační řešení tříselné kýly z pohledu nejnovějších doporučení
- Srovnání účinnosti nízkoobjemových roztoků v přípravě střeva před kolonoskopií: randomizovaná, prospektivní, odslepená studie
- Fixace sítěk při laparoskopické plastice tříselných kýl
- Fistuloklýza jako metoda zajištění výživy u pacienta s vysokoobjemovou enteroatmosférickou píštělí – kazuistika
- Fournierova gangréna jako komplikace Amyandovy hernie
- Absces sleziny jako vzácný projev mimoplicní tuberkulózy − kazuistika
- Konference SAGES 2019
- Ohlédnutí za mezinárodním kongresem karcinomu žaludku
- Infraglenoidální zlomenina krčku lopatky − skutečnost nebo mýtus?
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Operační řešení tříselné kýly z pohledu nejnovějších doporučení
- Fixace sítěk při laparoskopické plastice tříselných kýl
- Fournierova gangréna jako komplikace Amyandovy hernie
- Fistuloklýza jako metoda zajištění výživy u pacienta s vysokoobjemovou enteroatmosférickou píštělí – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

