-
Medical journals
- Career
Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
Authors: V. Adámková
Authors‘ workplace: Ústav lékařské mikrobiologie Lékařské fakulty Univerzity Palackého, Olomouc ; Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice v Praze
Published in: Rozhl. Chir., 2019, roč. 98, č. 4, s. 145-151.
Category: Review
Overview
Komplikované nitrobřišní infekce (cIAI) jsou častou příčinou nemocnosti na jednotkách intenzivní péče. Stále častěji jsou vyvolány multirezistentními kmeny enterobakterií či Pseudomonas aeruginosa. V souboru 592 pacientů z 1. chirurgické kliniky VFN v Praze v letech 2014–2017 byl zaznamenán alarmující nárůst rezistence u kmenů Escherichia coli k potencovaným aminopenicilinům, piperacilinu/tazobaktamu a cefalosporinům třetí generace (z 28,7 % v roce 2014 na 37,5 % v roce 2017, z 25 % na 32 % a z 2,3 % na 5,6 % resp.). Ceftolozan/tazobaktam a ceftazidim/avibaktam patří mezi nová cefalosporinová antibiotika s indikací na léčbu komplikovaných nitrobřišních infekcí. Ceftolozan/tazobaktam vykazuje vysokou účinnost vůči multirezistentním kmenům P. aeruginosa včetně karbapenem rezistentních izolátů. Nový nebeta-laktamové inhibitor beta-laktamáz avibaktam v kombinaci s ceftazidimem je účinný na kmeny enterobakterií produkujících karbapenemázy. Obě antibiotika jsou součástí nových WSES doporučených postupů pro terapii komplikovaných nitrobřišních infekcí.
Klíčová slova:
komplikované nitrobřišní infekce – bakteriální rezistence – ceftolozan/tazobaktam – ceftazidim/avibaktam
Úvod
Komplikované nitrobřišní infekce (cIAI) jsou, i přes adekvátní chirurgickou terapii, druhou nejčastější příčinou mortality na jednotkách intenzivní péče [1]. Management cIAI je komplexní a zahrnuje jak chirurgické ošetření zdroje, tak vhodnou antibiotickou terapii. Současné doporučené postupy léčby cIAI navrhují pro empirické antibiotické krytí taková antibiotika, která mají ve svém spektru gramnegativní tyčinky i grampozitivní koky, především enterokoky, a zároveň reflektují lokální epidemiologickou situaci. Přidání antibiotika se spektrem účinku proti obligátním anaerobům je doporučováno do kombinace pouze u infekcí, kde zdrojem infekce je appendix nebo tlusté střevo a konečník. Předchozí doporučené postupy navrhovaly monoterapii (cefalosporiny 3. generace, ertapenem, tigecyklin) pro středně závažné komunitní IAI nebo meropenem, piperacilin/tazobaktam či cefepim s metronidazolem pro závažné nebo nozokomiální IAI [2,3].
Avšak optimální volba antibiotika pro cIAI může být výrazně komplikovanější, a to především díky stále se zvyšujícímu podílu multirezistentních bakterií jako původců cIAI. Nevhodná nebo opožděná antibiotická léčba zvyšuje jak riziko terapeutického selhání, tak náklady spojené s následnou péčí včetně prodloužení délky hospitalizace [4].
Etiologie komplikovaných nitrobřišních infekcí je polymikrobní a zahrnuje mikroorganismy pocházející primárně ze zažívacího traktu pacienta, především enterobakterie. Narůstající rezistence těchto bakterií nejen ve zdravotnických zařízeních, ale i v komunitě se stává obrovskou výzvou v léčbě cIAI [5]. Existující doporučené postupy se v kontextu těchto epidemiologických dat stávají zcela nedostatečnými a nová antibiotika, která by byla účinná na multirezistentní původce, jsou čím dále častěji vyžadována.
Rezistence u původců komplikovaných nitrobřišních infekcí
Enterobakterie jsou nejčastějšími původci cIAI, a proto je třeba jim věnovat zvýšenou pozornost. Současným největším problémem vyskytující se rezistence u těchto bakterií je produkce tzv. širokospektrých beta-laktamáz (ESBL – extended-spectrum beta-lactamase).
Surveillance studie pravidelně monitorující trendy rezistence u patogenů cIAI, jako např. SMART (the Study for Monitoring Antimicrobial ResistanceTrends), dokládají narůstající podíl ESBL produkujících kmenů Escherichia coli z 9 % v roce 2003 na 11 % v roce 2010 a Klebsiella pneumoniae ze 14 % na 23 %, zároveň byl zaznamenán trend poklesu citlivosti těchto původců k fluorovaným chinolonům z 81 % v roce 2003 na 71 % v roce 2007 a cefalosporinům třetí generace z 90 % na 77 % [6]. Ačkoliv zůstávají karbapenemy (ertapenem, meropenem, imipenem) lékem první volby na infekce vyvolané ESBL produkujícími kmeny enterobakterií, je pozorován snižující se trend citlivosti kmenů K. pneumoniae produkujících ESBL k ertapenemu [7,8].
Rozsáhlé a nepřiměřené používání karbapenemů podporuje objevení se karbapenem rezistentních kmenů, jejichž zvyšující se podíl je patrný především u infekcí spojených s poskytovanou zdravotní péčí.
Kromě enterobakterií může být dalším původcem cIAI Pseudomonas aeruginosa, především u zánětlivých pooperačních komplikací, u které je zachycen nepříznivý nárůst rezistence (>30 %) k amikacinu, ceftazidimu či karbapenemům u izolátů z nozokomiálních IAI [9].
V případě nitrobřišních infekcí spojených s poskytovanou zdravotní péčí je třeba vzít v potaz i roli enterokoků a kvasinek, přičemž zde je problém narůstající rezistence kmenů Enterococcus faecium k vankomycinu a kvasinek k flukonazolu [10,11].
Zvyšující se trend výskytu rezistentních kmenů je alarmující, avšak globální data nejsou dostatečným podkladem pro adekvátní antibiotickou léčbu konkrétního pacienta. Vždy je třeba vzít v úvahu, kromě rizikových faktorů výskytu rezistentních bakterií, i lokální epidemiologickou situaci. Bohužel nejsou k dispozici celonárodní data, která by se dala porovnat s těmi evropskými, ale každé chirurgické pracoviště by mělo mít k dispozici kumulativní antibiogramy nejčastěji se vyskytujících původců nitrobřišních infekcí.
V případě původců nitrobřišních infekcí analyzovaných v letech 2014–2017 na 1. chirurgické klinice VFN v Praze je též patrný nárůst rezistence k nejčastěji používaným antibiotikům, ať již používaných v profylaxi, nebo terapeuticky.
V uvedeném souboru bylo vyšetřeno 592 pacientů s nitrobřišní infekcí, přičemž nejčastěji zastoupeným původcem byla Escherichia coli s narůstají rezistencí k potencovaným aminopenicilinům, piperacilinu/tazobaktamu i fluorovaným chinolonům, Klebsiella sp. se stejnými trendy rezistence a navíc ojedinělým záchytem karbapenem rezistentních kmenů (v roce 2015 a 2017), Enterococcus faecium, kdy rezistence k vankomycinu byla zachycena pouze v roce 2014 a 2015, a dále Pseudomonas aeruginosa s výraznou rezistencí ke karbapenemům (Tab. 1, Graf 1, 2, 3). Data u izolátů E. faecium a P. aeruginosa jsou srovnatelná s evropskými trendy, ale podíl ESBL produkujících kmenů K. pneumoniae je téměř dvojnásobný, což dokumentují i surveillance data z jiné databáze – EARS-Net (European Antimicrobial Resistance Surveillance Network), která monitoruje rezistenci u invazivních izolátů z hemokultur a kde je Česká republika na čelních místech ve výskytu ESBL produkujících enterobakterií [12].
Table 1. Zastoupení nejčastějších bakteriálních kmenů z klinických materiálů z dutiny břišní a podíl významného typu rezistence
Tab. 1: Incidence of the most frequent bacteria from intra-abdominal specimen and proportion of important type of antibacterial resistance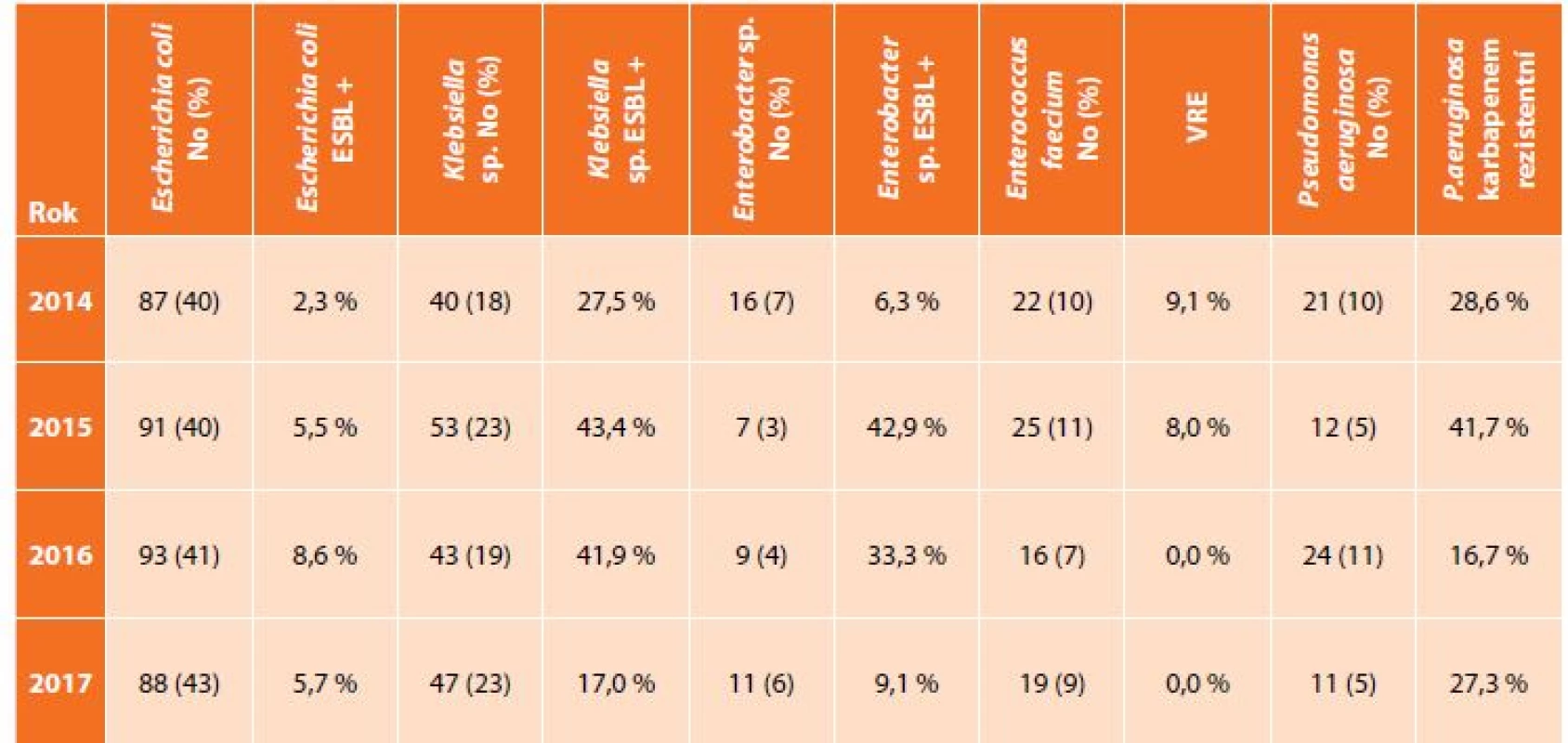
Zkratky: ESBL – extended-spectrum beta-lactamase Graph 1. Přehled rezistence u kmenů Escherichia coli izolovaných z cIAI
Graph 1: Resistance trends of Escherichia coli isolated from cIAI
Zkratky: AMC – amoxicilin/k. klavulanová, AMI – amikacin, CEF III – cefalosporiny 3. generace, KAR – karbapenemy, GEN – gentamicin, FQ – fluorované chinolony, PIP/TAZ – piperacilin/tazobaktam, TGC - tigecyklin Abbreviations: AMC – amoxicillin/clavulanic acid, AMI – amikacin, CEF III – 3rd generation of cephalosporines, KAR – carbapenems, GEN – gentamicin, FQ – fluoroquinolones, PIP/TAZ – piperacillin/tazobactam, TGC - tigecycline Graph 2. Přehled rezistence u kmenů Klebsiella sp. izolovaných z cIAI
Graph 2: Resistance trends of Klebsiella sp. isolated from cIAI
Zkratky: AMC – amoxicilin/k. klavulanová, AMI – amikacin, CEF III – cefalosporiny 3. generace, KAR – karbapenemy, GEN – gentamicin, FQ – fluorované chinolony, PIP/TAZ – piperacilin/tazobaktam, TGC - tigecyklin Abbreviations: AMC – amoxicillin/clavulanic acid, AMI – amikacin, CEF III – 3rd generation of cephalosporines, KAR – carbapenems, GEN – gentamicin, FQ – fluoroquinolones, PIP/TAZ – piperacillin/tazobactam, TGC - tigecycline Graph 3. Přehled rezistence u kmenů Pseudomonas aeruginosa izolovaných z cIAI
Graph 3: Resistance trends of Pseudomonas aeruginosa isolated from cIAI
Zkratky: AMI – amikacin, CIP – ciprofloxacin, CTZ – ceftazidim, GEN – gentamicin. KAR – karbapenemy, PIP/TAZ – piperacilin/tazobaktam Abbreviations: AMI – amikacin, CIP – ciprofloxacin, CTZ – ceftazidime, GEN – gentamicin, KAR – carbapenems, PIP/TAZ – piperacilin/tazobactam Nová antibiotika pro terapii nitrobřišních infekcí
Znepokojivá epidemiologická data ukazují potřebu nových přístupů k terapii infekcí vyvolaných těmito multirezistentními bakteriemi, v případě komplikovaných nitrobřišních infekcí je to především otázka vhodného antibiotického krytí producentů širokospektrých beta-laktamáz. V rutinní praxi jsou stále častěji používány karbapenemy, popřípadě tigecyklin, avšak narůstající spotřeba karbapenemových antibiotik vede k další selekci rezistentních bakterií. Rezistence ke karbapenemovým antibiotikům je způsobena buď produkcí karbapenemáz (enzymy degradující karbapenemová antibiotika – KPC, OXA, VIM, IMP a NDM) (Tab. 2), nebo změnou porinové permeability, jež má za následek sníženou schopnost antibiotika dostat se k cílové struktuře bakteriální buňky [13]. Velkou výzvou současné medicíny je nejenom vývoj nových molekul s účinkem na karbapenemrezistentní bakterie, ale též snížení jejich spotřeby, aby se rezistence dále nezvyšovala.
Table 2. Klasifikace beta-laktamáz dle Amblera a vztah C/T a C/A
Tab. 2: Ambler classification of beta-lactamases and relation to C/T and C/A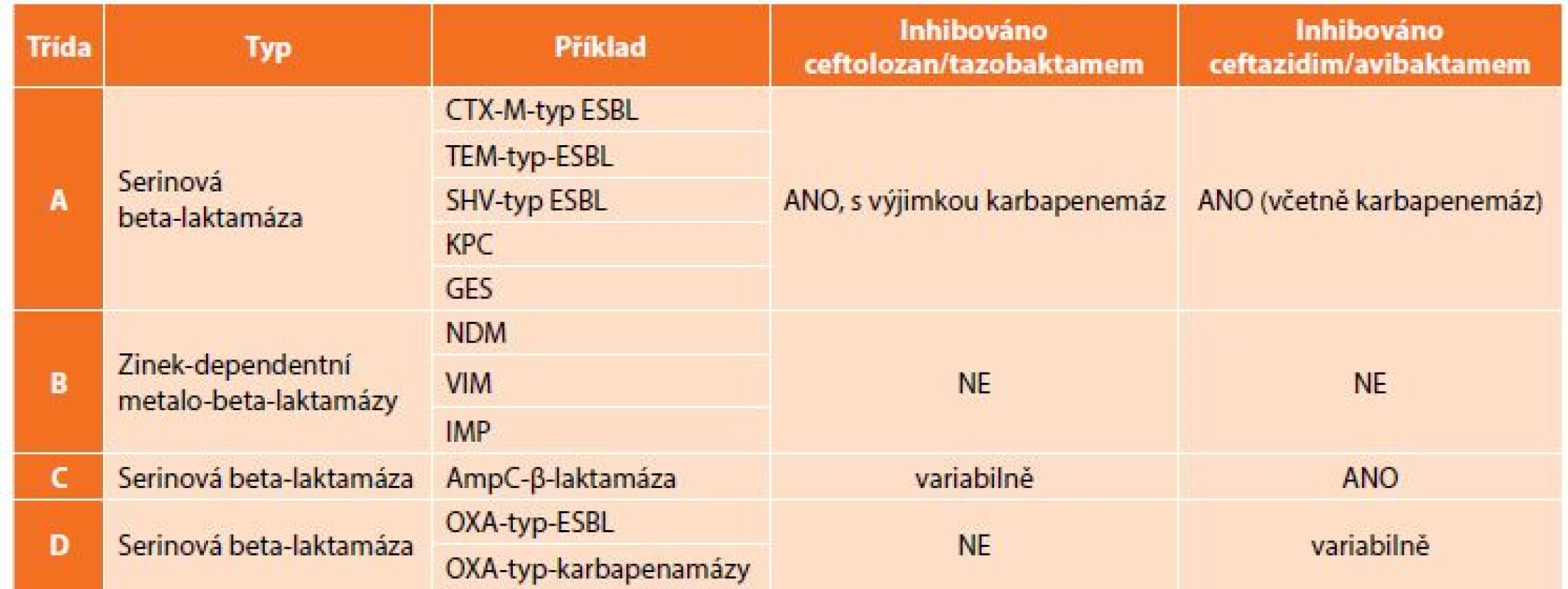
Vysvětlivky: ESBL – extended-spectrum beta-lactamase Jako tzv. karbapenem šetřící strategie se jeví použití dvou nových antibiotik, která byla schválena a uvolněna FDA mimo jiné pro terapii komplikovaných nitrobřišních infekcí vyvolaných rezistentními kmeny Pseudomonas aeruginosa a enterobakterií. Obě jsou ze skupiny cefalosporinů a jsou kombinována s inhibitorem beta-laktamáz. Jedná se o ceftolozan s tazobaktamem a ceftazidim s avibaktamem.
Ceftolozan/tazobaktam (C/T)
Ceftolozan/tazobaktam (ZerbaxaⓇ, MSD, USA) byl v prosinci 2014 schválen FDA pro terapii komplikovaných nitrobřišních infekcí v kombinaci s metronidazolem a pro terapii komplikovaných infekcí močových cest. Ceftolozan je nové cefalosporinové antibiotikum strukturálně podobné třetí generaci cefalosporinů, avšak s posílenou účinností vůči kmenům P. aeruginosa díky zvýšené odolnosti vůči hydrolýze a efluxu. Kombinace s tazobaktamem, jako inhibitorem beta-laktamáz, zvyšuje odolnost ceftolozanu před účinkem beta-laktamáz třídy A a C [14].
Na základě výsledků klinických zkoušek ASPECT-cIAI (Assessment of the Safety Profile and Efficacy of Ceftolozane/Tazobactam in Complicated Intra-abdominal Infections) byl uvolněn pro léčbu cIAI v kombinaci metronidazolem. Komparátorem ve studii byl meropenem a ceftolozan/tazobaktam splnil kritéria noninferiority. Klinická účinnost byla 94,2 % pro C/T a 94,7 % pro meropenem. Mezi nejčastěji izolované původce patřily kmeny E. coli, (65,1 %), K. pneumoniae (9,4 %) a P. aeruginosa (8,9 %). Více než polovina pacientů měla polymikrobní nález. U pacientů s infekcí vyvolanou producenty ESBL byla klinická účinnost zaznamenána v 95,8 % ve skupině ceftolozan/tazobaktam s metronidazolem a v 88,5 % pro meropenem [15]. Analýza subpopulace pacientů s infekcí P. aeruginosa ukázala 100% účinnost C/T oproti 93,1% u meropenemu. In vitro aktivita C/T vůči klinickým izolátům P. aeruginosa hodnocená MIC90 byla dvojnásobná než u meropenemu, 32násobná vůči piperacilinu/tazobaktamu a 8násobná než u gentamicinu [16]. Nežádoucí účinky byly srovnatelné v obou skupinách, nejčastěji se jednalo o nauzeu nebo průjem. Dávkování C/T je 1,5 g každých 8 hodin (+ metronidazol 500 mg po 8 hod). Ceftolozan/tazobaktam je eliminován převážně ledvinami, a proto je nutná úprava dávky (Tab. 3) [17].
Table 3. Dávkování ceftolozan/tazobaktamu a ceftazidim/avibaktamu při renální insuficienci
Tab. 3: Dosage of ceftolozane/tazobactam and ceftazidime/avibactam in renal insufficiency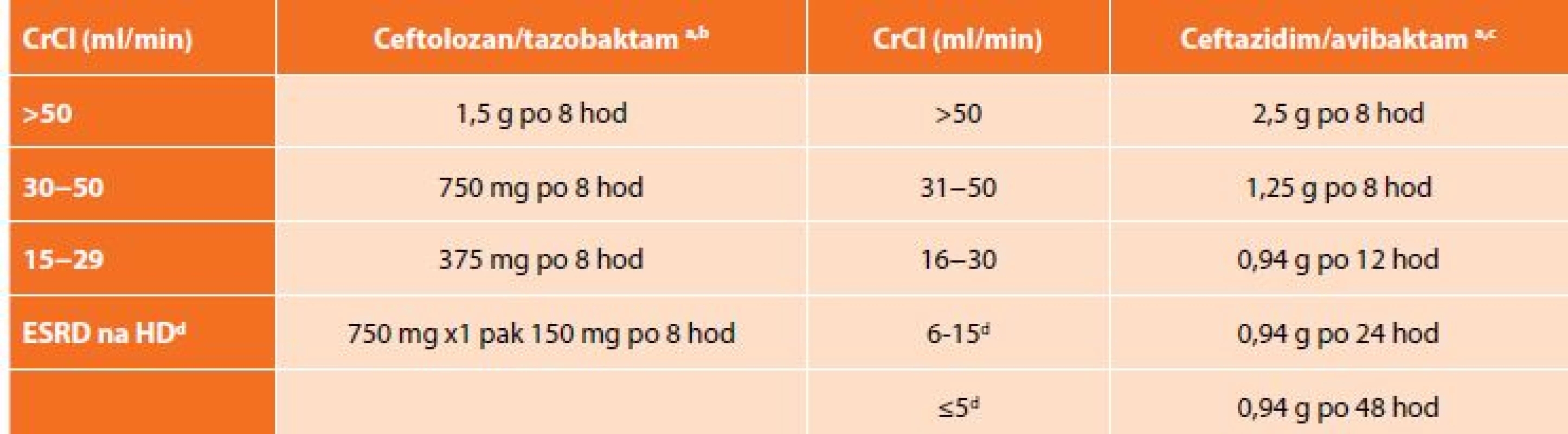
Vysvětlivky: a celková dávka cefalosporinu a inhibitoru betalaktamáz; b hodinová infuze; c délka infuze 2 hodiny; d dávka se podává po dialýze; CrCl – clearance kreatininu dle Cockroft-Gault; ESRD – end-stage renal disease; HD – hemodialýza. Vzhledem k nákladům na terapii ceftolozan/tazobaktamem v porovnání s ostatními kombinacemi běžně užívaných antibiotik, zůstane C/T lékem především pro pacienty s pseudomonádovou infekcí, kde je jeho účinnost nesrovnatelně vyšší než u ostatních antibiotik včetně karbapenemů.
Ceftazidim/avibaktam (C/A)
Ceftazidim/avibaktam (ZaviceftaⓇ, Pfizer, USA) byl FDA schválen pro léčbu cIAI v únoru 2015 v kombinaci s metronidazolem u komplikovaných močových infekcí, dále je schválen k terapii dospělých hospitalizovaných pacientů s komplikovanými močovými infekcemi včetně pyelonefritidy, s nozokomiální pneumonií včetně ventilátorové a infekcí vyvolaných gramnegativními aerobními bakteriemi s omezenými léčebnými možnostmi. Jedná se o zavedený cefalosporin třetí generace kombinovaný s novým nebeta-laktamovým inhibitorem beta-laktamáz – avibaktamem. Samotný avibaktam nemá dostatečnou klinickou účinnost, ale inhibuje široké spektrum beta-laktamáz třídy A, C a některé z třídy D [18].
V in vitro studiích vykazoval C/A velmi vysokou aktivitu vůči enterobakteriím včetně multirezistentních (99,3 %), extenzivně rezistentních (96,5 %) a meropenem rezistentních kmenů (98 %) [19,20]. Účinnost na karbapenem rezistentní kmeny byla testována v mnoha studiích a ceftazidim/avibaktam byl nejúčinnější ze všech testovaných beta-laktamů. Ze 177 kmenů produkujících různé typy karbapenemáz byla in vitro účinnost C/A 93 % v porovnání s kolistinem (88 %), tigecyklinem (79 %) a fosfomycinem (78 %) [21]. Ceftazidim/avibaktam není in vitro účinný na kmeny produkující metalo-beta-laktamázy (třída B).
Klinická účinnost byla hodnocena ve dvou randomizovaných, dvojitě zaslepených mezinárodních studiích, komparátorem byl opět meropenem. Nejčastější diagnózou byla perforace apendixu nebo periapendikulární absces (42 %), dále perforace žaludečního či duodenálního vředu a cholecystitida. Ve všech sledovaných parametrech, ať již klinické účinnosti, nebo mikrobiologické eradikaci, byl ceftazidim/avibaktam v kombinaci s metronidazolem srovnatelný s meropenem. Nežádoucí účinky byly též srovnatelné a většinou se jednalo o zažívací obtíže.
Doporučené dávkování je 2,5 g každých 8 hod. (+ metronidazol 500 mg po 8 hod). Stejně jako ceftolozan/tazobaktam i ceftazidim/avibaktam se vylučuje ledvinami, a proto je nutná úprava dávky při renální insuficienci (Tab. 3). C/A se odstraňuje dialýzou, a tak je doporučeno podávání až po dialýze [22].
Další nová antibiotika
Kromě výše uvedených kombinací antibiotik, která jsou již dostupná v klinické praxi, jsou ve fázi klinických zkoušek testovány další molekuly či kombinace „starých“ antibiotik s novými druhy inhibitorů beta-laktamáz. K dispozici jsou zatím pouze výsledky laboratorní účinnosti, které se jeví jako slibné, avšak je třeba počkat na závěry klinického hodnocení (Tab. 4) [23].
Table 4. Přehled nových antibiotik a jejich in vitro aktivita vůči multirezistentním gramnegativním bakteriím
Tab. 4: New antibiotics and their in vitro activity against multi-drug resistant bacteria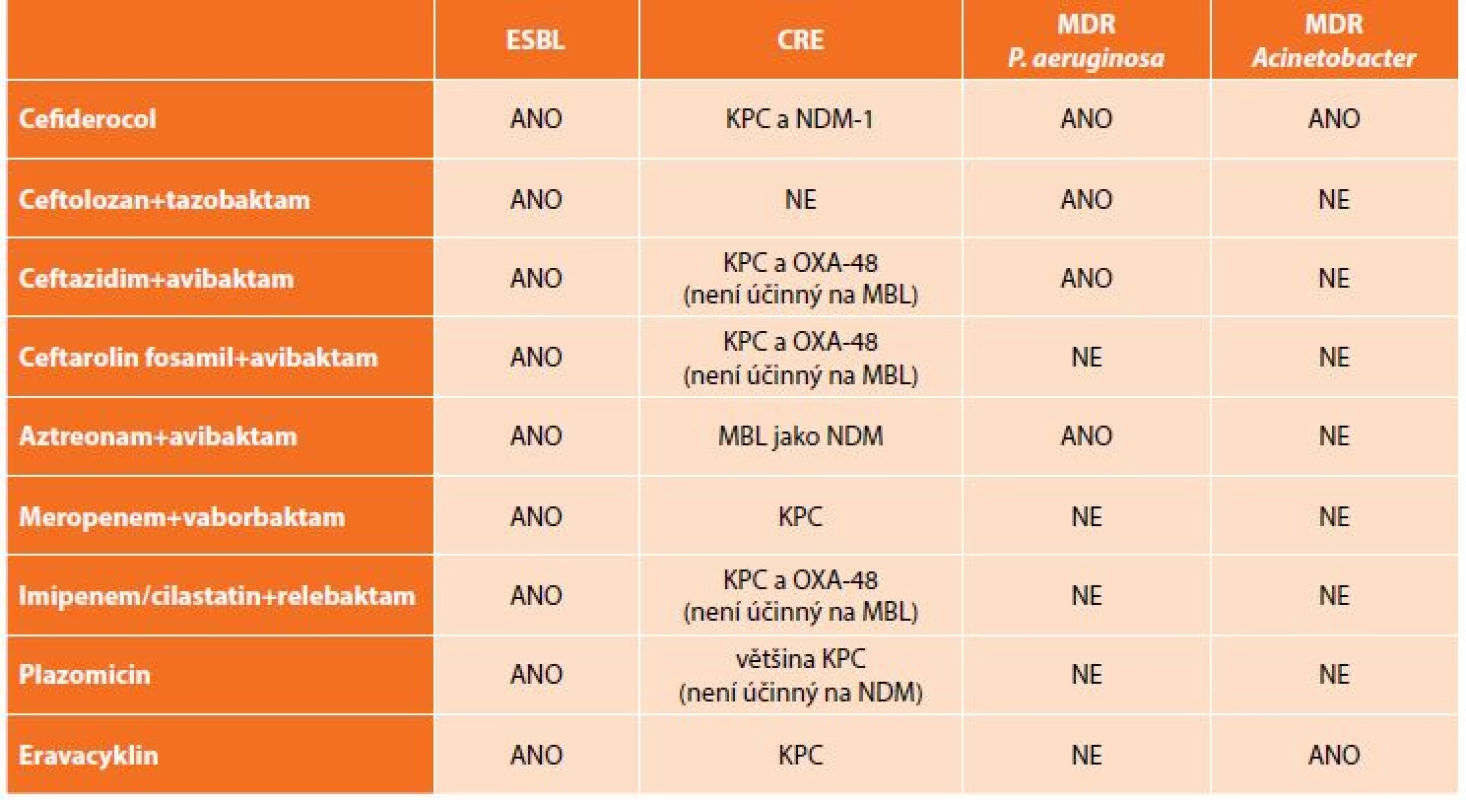
Diskuze
Antibiotická terapie hraje klíčovou roli v managementu komplikovaných nitrobřišních infekcí, zvláště u pacientů v kritickém stavu, kteří vyžadují bezprostřední zahájení adekvátní léčby. Nevhodná úvodní antibiotická léčba jednoznačně zvyšuje riziko klinického selhání, na druhé straně nadužívání širokospektrých antibiotik má za následek selekci rezistentních bakterií a jejich šíření, což se v konečném důsledku promítne i do nákladové efektivity léčby.
Optimální strategie antibiotické terapie nitrobřišních infekcí by měla zahrnovat účinnou iniciální terapii, která bude na jedné straně klinicky efektivní, ale zároveň nepovede k nadměrné spotřebě antibiotik, a tím nebude zvyšovat selekční tlak. Změna přístupu k antiinfekční terapii nitrobřišních infekcí odráží narůstající rezistenci nejčastějších bakteriálních původců k antibiotikům – kmeny E. coli, K. pneumoniae produkující širokospektré beta-laktamázy, karbapenem rezistentní kmeny P. aeruginosa, vankomycin rezistentní enterokoky, methicilin rezistentní S. aureus, multirezistentní kmeny Acinetobacter spp. – a současný vzestup výskytu mykotických agens, která se uplatňují především u kriticky nemocných pacientů s nozokomiálními infekcemi.
Nárůst rezistence původců IAI vede k tomu, že v empirické terapii jsou stále více používány karbapenemy v kombinaci s metronidazolem nebo piperacilin/tazobaktam s aminoglykosidem i pro pacienty, kteří jsou stabilní a nejsou v riziku výskytu multirezistentních bakterií. Doporučený postup pro diagnostiku terapii nitrobřišních infekcí stále velmi dobře reflektuje epidemiologickou situaci, a proto není třeba ho upravovat [24]. Pro terapii sekundární peritonitidy u pacienta stabilizovaného, bez rizika výskytu ESBL pozitivních kmenů, přicházejícího z komunity je dostatečným antibiotickým krytím potencovaný aminopenicilin, v případě alergie na beta-laktamová antibiotika ciprofloxacin v kombinaci s metronidazolem nebo kombinace klindamycinu s gentamicinem a metronidazolem, s nutností monitorování hladin gentamicinu. Pacient stabilizovaný s rizikovými faktory pro přítomnost ESBL pozitivních kmenů enterobakterií musí být zajištěn antibiotiky se spektrem účinku zahrnujícím tuto skupinu původců, tj. ertapenem nebo tigecyklin. Antimykotické krytí u stabilizovaného pacienta z komunity není doporučeno. U pacienta v kritickém stavu s rizikovými faktory pro vznik infekce vyvolané ESBL pozitivními kmeny bakterií jsou doporučeny karbapenemy druhé skupiny v kombinaci s antimykotikem vzhledem k současnému vyššímu riziku přítomnosti kvasinek.
Nozokomiální infekce jsou většinou vyvolané rezistentními bakteriemi, častěji se vyskytují i enterokoky, nefermentující bakterie a kvasinky, proto musí být volba antiinfektiv komplexní. U stabilizovaného pacienta je dostačující kombinace piperacilin/tazobaktamu s gentamicinem, u pacienta v kritickém stavu je to kombinace karbapenemu druhé skupiny s vankomycinem.
Závěr
Všechna nová uvedená antibiotika cílí na rezistentní bakterie, které jsou v současné době největším problémem v terapii cIAI. Pouze u ceftolozanu/tazobaktamu a ceftazidimu/avibaktamu jsou k dispozici i data z klinických zkoušek, která vypadají nadějně, a proto byla obě antibiotika zahrnuta i do nejnovějších mezinárodních doporučených postupů léčby cIAI, ale pouze jako přípravky rezervní a karbapenem šetřící [25].
Ačkoliv se vývoj nových molekul či kombinací antibiotik jeví optimisticky, je třeba si zachovat jistou zdrženlivost, protože ruku v ruce s novými antibiotiky se objeví rezistentní bakterie. Rozvoj rezistence je sice přirozený fenomén, avšak vidíme jeho značnou akceleraci podmíněnou nadužíváním a nesprávným používáním antibiotik. Současný trend v antibiotické politice je zkracování délky podávání, a to i v případě cIAI. Zkrácená doba podávání antibiotik u cIAI na čtyři dny je účinná a bezpečná při adekvátní chirurgické kontrole zdroje [26].
Vyvarování se protrahovanému podávání antibiotik spolu s případnou deeskalací patří mezi důležitá opatření v boji s nárůstem bakteriální rezistence.
Konflikt zájmů
Autorka článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Václava Adámková
Klinická mikrobiologie a ATB centrum 1. LF UK a VFN
Ke Karlovu 2
120 00 Praha
e-mail: vaclava.adamkova@vfn.cz
Sources
- Armstrong C. Updated guideline on diagnosis and treatment of intra-abdominal infections. Am Fam Phys. 2010;82 : 694–709.
- Solomkin JS, Mazuski JE, Bradley JS, et al. Diagnosis and management of complicated intra-abdominal infection in adultsand children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010;50 : 133–64. doi: 10.1086/649554.
- Sartelli M, Viale P, Catena F, et al. WSES guidelines for management of intra-abdominal infections. World J Emerg Surg. 2013;8 : 3. doi: 10.1186/1749-7922-8-3.
- Chong YP, Bae IG, Lee SR, et al. Clinical andeconomic consequences of failure of initial antibiotic therapy for patientswith community-onset complicated intra-abdominal infections. PLoS One 2015;10:e0119956. doi: 10.1371/journal.pone.0119956
- Sartelli M, Catena F, Ansaloni L, et al. Complicated intra-abdominal infections worldwide: the definitive data of the CIAOWStudy. World J Emerg Surg. 2014;9 : 37. doi: 10.1186/1749-7922-9-37
- Hawser SP, Bouchillon SK, Hoban DJ, et al. In vitro susceptibilities of aerobicand facultative anaerobic Gram-negative bacilli from patients with intra-abdominal infections worldwide from 2005–2007: results from the SMARTstudy. Int J Antimicrob Agents. 2009;34 : 585–8. doi: 10.1016/j.ijantimicag.2009.07.013.
- Huang CC, Chen YS, Toh HS, et al. Impact of revisedCLSI breakpoints for susceptibility to third-generation cephalosporins and carbapenems among Enterobacteriaceae isolates in the Asia-Pacific region: resultsfrom the Study for Monitoring Antimicrobial Resistance Trends (SMART), 2002–2010. Int J Antimicrob Agents. 2012;40(Suppl.)S4–S10. doi: 10.1016/S0924-8579(12)70003-1.
- Kazmierczak KM, Lob SH, Hoban DJ, et al. Characterization of extended-spectrum-lactamases and antimicrobial resistanceof Klebsiella pneumoniae in intra-abdominal infection isolates in Latin America, 2008–2012. Results of the study for monitoring ntimicrobial resistancetrends. Diagn Microbiol Infect Dis. 2015;82 : 209–14. doi: 10.1016/j.diagmicrobio.2015.03.025.
- Badal R, Lob S, Bouchillon S, et al. Susceptibility of intra-abdominal pathogens in Europe, Africa and Middle East—SMART2010/2011. In: 22nd European Congress of Clinical Microbiology and Infectious Diseases (ECCMID) Annual Meeting. Basel, Switzerland ESCMID 2012.
- Swenson BR, Metzger R, Hedrick TL, et al.Choosing antibiotics for intra-abdominal infections: what do we mean by ‘highrisk’? Surg Infect. (Larchmt) 2009;10 : 29–39. doi: 10.1089/sur.2007.041.
- Adámková V, Vaňková A, Ulrych J, et al. Analýza záchytu kvasinek u pacientů po břišním chirurgickém výkonu. Rozhl Chir. 2017;96 : 426−32.
- Wang X, Zhang F, Zhao C, et al. In vitro activities of ceftazidime-avibactam and aztreonam-avibactam against 372 gram-negative bacilli collected in 2011 and 2012 from 11 teaching hospitals in China. Antimicrob Agents Chemother. 2014;58 : 1774–8. doi: 10.1128/AAC.02123-13.
- Livermore DM, Mushtag S, Ge Y. Chequerboard titration of cephalosporin CXA-101 (FR264205) and tazobactam versus beta-lactamase-producing Enterobacteriaceae. J Antimicrob Chemother. 2010;65 : 1972–4. doi: 10.1093/jac/dkq248
- Solomkin J, Hershberger E, Miller B, et al. Ceftolozane/tazobactam plus metronidazole for complicated intra-abdominal infections in an era of multidrug resistance: results from a randomized, double-blind, phase 3 trial (ASPECT-cIAI). Clin Infect Dis. 2015;60 : 1462–71. doi:10.1093/cid/civ097.
- Miller B, Popejoy MW, Hershberger E, et al. Characteristics and outcomes of complicated intra-abdominal infections involving Pseudomonas aeruginosa from a randomized, double-blind, phase 3 ceftolozane/tazobactam study. Antimicrob Agents Chemother. 2016;60 : 4387–90. doi: 10.1128/AAC.03074-15.
- Zerbaxa™ (ceftolozane sulfate; tazobactam sodium) [package insert]. Lexington, MA: Cubist Pharmaceuticals LLC 2015.
- Li H, Estabrook M, Jacoby GA, et al. In vitro susceptibility of characterized β-lactamase-producing strains tested with avibactam combinations. Antimicrob Agents Chemother. 2015;59 : 1789–93. doi: 10.1128/AAC.04191-14.
- Levasseur P, Girard AM, Miossec C, et al. In vitro antibacterial activity of the ceftazidime-avibactam combination against enterobacteriaceae, including strains with well-characterized β-lactamases. Antimicrob Agents Chemother. 2015;59 : 1931–4. doi: 10.1128/AAC.04218-14.
- Mutters NT, Zimmermann S, Kaase M, et al. Activity of temocillin, mecillinam, ceftazidime, and ceftazidime/avibactam against carbapenem-non-susceptible Enterobacteriaceae without carbapenemase production. Eur J Clin Microbiol Infect Dis. 2015;34 : 2429–37.
- Vasoo S, Cunningham SA, Cole NC, et al. In vitro activities of ceftazidime-avibactam, aztreonam-avibactam, and a panel of older and contemporary antimicrobial agents against carbapenemase-producing gram-negative bacilli. Antimicrob Agents Chemother. 2015;59 : 7842–6. doi: 10.1128/AAC.02019-15.
- Avycaz™ (avibactam sodium; ceftazidime) [package insert]. Verona, Italy: GlaxoSmithKling 2015
- Bassetti M, Carnelutti A, Peghin M. Patient specific risk stratification for antimicrobial resistance and possible treatment strategies in gram-negative bacterial infections. Expert Review of Anti-infective Therapy 2017;15 : 55−65. doi: 10.1080/14787210.2017.1251840.
- Gürlich R, Adámková V, Ulrych J, et al. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozhl Chir. 2014;93 : 334−52.
- Sartelli M, Chichom-Mefire A, Labricciosa FM, et al. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intraabdominal Infections. World Journal of Emergency Surgery 2017;12 : 29. doi: 10.1186/s13017-017-0141-6.
- Sawyer RG, Claridge JA, Nathens AB, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N EnglJ Med. 2015;372 : 1996–2005. doi: 10.1056/NEJMoa1411162.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 4-
All articles in this issue
- Zásady antibiotické léčby
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Instilačná podtlaková terapia ULTRAVAC v terapii infikovaných laparotómií s fascitídou − priebežné výsledky prospektívnej randomizovanej štúdie
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Hemangiomatóza velkého omenta − kazuistika
- Intraportální aplikace kmenových buněk po embolizaci portální žíly neurychluje růst jaterních metastáz
- Chirurgická léčba alveolární echinokokózy: naše zkušenost a systematický přehled literatury
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zásady antibiotické léčby
- Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
- Role nových antibiotik u nitrobřišních infekcí v éře multirezistentních bakterií
- Hemangiomatóza velkého omenta − kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

