-
Medical journals
- Career
Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
Authors: P. Bachleda 1; P. Utíkal 1; L. Kalinová 1; J. Zadražil 2; E. Buriánková 3; M. Kolář 4
Authors‘ workplace: II. chirurgická klinika FNOL a LF UP v Olomouci, přednosta: doc. MUDr. Petr Bachleda, CSc. 1; III. interní klinika FNOL a LF UP v Olomouci, přednosta: prof. MUDr. Vlastimil Ščudla, CSc. 2; Klinika nukleární medicíny FNOL a LF UP v Olomouci, přednosta: doc. MUDr. Miroslav Mysliveček, CSc. 3; Ústav mikrobiologie FNOL a LF UP v Olomouci, přednosta: prof. MUDr. Milan Kolář, Ph. D. 4
Published in: Rozhl. Chir., 2010, roč. 89, č. 1, s. 80-84.
Category: Monothematic special - Original
Overview
Infikovaný ePTFE interponát, který slouží k hemodialýze, ohrožuje nemocného lokálními komplikacemi jako jsou uzávěr spojky, tunelová infekce a masivní krvácení. Tyto komplikace jsou spojeny se zánikem funkce spojky. Infikovaná spojka může být zdrojem metastatických infekcí (endokarditida, artritida, pneumonie) a sepse. V evropských podmínkách je většinou interponát poslední možností kromě zavedení centrálního žilního katétru přístupu k dialýze, proto je snaha jej i při projevu infekce zachránit. Autoři na základě vlastních zkušeností a literárních poznatků hodnotí totální graftektomii (TGE) a parciální graftectomii (PGE) u infikované cévní protézy a zaujímají stanovisko k otázce, zda zkušenost v této problematice, která doporučuje odstranit infikovaný interponát, je lepším rádcem, než výsledky moderních vyšetřovacích metod (UZ, mikrobiologie, PET CT), které dovolují obhájit konzervativní přístup. Na dokumentované kazuistice se přiklání k řešení na podkladu zkušenosti. Při gramnegativním původu infekce protézy doporučuji autoři odstranění celé protézy (TGE).
Klíčová slova:
arteriovenózní spojka k hemodialýze – ePTFE interponát – infekce interponátuÚVOD
Léčba v chronickém dialyzačním programu vyžaduje cévní přístup k dialýze. Ten je zajišťován kanylací centrálního žilního řečiště, založením autologní arteriovenózní spojky nebo založením arteriovenózní spojky pomocí umělé cévní protézy, která je interponátem mezi arteriálním a žilním řečištěm a je používaná k dialýze. Založení arteriovenózní spojky pomocí autologního řečiště se považuje z hlediska délky funkce spojky a možných komplikací za nejvhodnější cévní přístup [1, 2]. Vždy však existují nemocní, kteří nemají k založení av spojky vhodné autologní podkožní žilní řečiště. Jejich vlastní řečiště je hypoplastické, nebo bylo předchozími výkony spotřebováno. U těchto nemocných se v přístupu k dialýze zavádí centrální žilní katétr nebo se implantuje interponát – graft [2]. V současné době je pro svou dostupnost preferován interponát z ePTFE, protože dobře splňuje požadavky, které jsou na av spojku založenou pomocí cévní náhrady kladeny: snadnou dosažitelnost a manipulaci, inertnost materiálu, rychlé vhojení, nízký výskyt postkanylačního krvácení, relativní odolnost ke vzniku infekčních a trombotických komplikací a tedy dlouhodobou kumulativní funkci. Zkušenosti s ePTFE interponáty lze považovat za dlouhodobé. V chirurgii arteriovenózních spojek k hemodialýze byla protéza z ePTFE poprvé použita již v roce 1973 Volderem [3]. Po zhodnocení výsledků jejich funkce se ePTFE interponáty staly zlatým standardem v chirurgii av spojek [4, 5, 6, 7, 8].
Při hodnocení ePTFE interponátu v hemodialyzačním programu je sledována délka jeho funkce ve vztahu k rozvoji stenotických a trombotických komplikací [9, 10, 11, 12]. Ty jsou v zásadě reparabilní. Za závažnější komplikaci se považuje jeho infekce [13]. Ta může být příčinou celkové infekce dialyzovaného nemocného. Infekce nemocných v programu náhrady funkce ledvin je spojena s vysokou morbiditou a je druhou nejčastější příčinou jejich úmrtí [14, 15, 16, 17]. Grafty jsou infekcí ohroženy v 11–35 % [9, 18, 19, 20, 21], přičemž infekční komplikace, které mají původ v graftu, jsou asi o 1/3 častější než u nemocných s nativní av spojkou [22].
KAZUISTIKA
Muž, 67 roků, s chronickou ledvinnou nedostatečností na podkladě chronické glomerulonefritidy. Hemodialýza od 9/92 cestou radiocefalické (rc) spojky. Transplantace ledviny v roce 1995. V roce 2008 selhání štěpu. V 05/2008 rerekonstrukce av spojky pro stenózu rc anastomózy: při nekvalitní arterii, ale dobré cefalické žíle byl použit ePTFE interponát (graft) na předloktí mezi brachiální arterií v loketní jamce a cefalickou žílou zápěstí s distálním tokem v graftu. Dialyzován kanylacemi graftu.
Image 1. Zkalená sekrece z místa arteriální anastomózy Fig. 1. Opaque secretion from the arterial anastomosis site 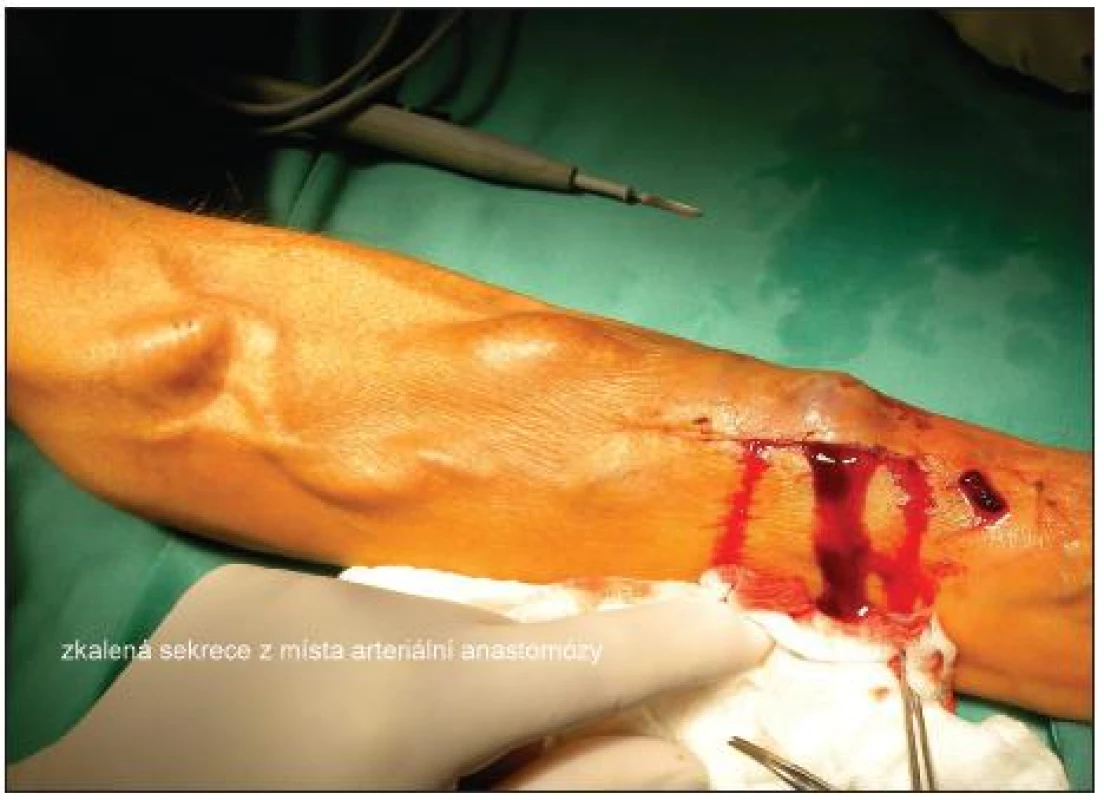
Ve 12/2008 opakovaně léčen pro septické stavy ve spádu. Klinicky byl lokální nález na graftu zcela negativní. V hemokultuře byla prokázána bakterie Pseudomonas aeruginosa. Na základě jícnového echa byla za zdroj infekce považována vegetace na mitrální chlopni. Pacient byl léčen antibiotiky (ceftazidim, gentamicin, ciprofloxacin) do konce 01/2009. Kontrolní jícnové echo bylo negativní. V 04/2009 byl zaznamenán opět septický stav nejasné etiologie s pozitivním nálezem Pseudomonas aeruginosa v hemokultuře. Srdeční echo neprokazuje vegetace. V místě protézo-venózní anastomózy je kožní defekt o průměru asi 3 mm. Podle nemocného se jedná o následek úrazu. Klinicky zcela klidné. Kultivace z defektu byla opakovaně negativní. Jako možný zdroj infekce byla považována dutina ústní, kde byla prováděna rozsáhlá extrakce zubů. Léčen antimikrobními přípravky – ciprofloxacinem a cefprozilem. Další septický stav v 05/09, kožní defekt v místě anastomózy přetrvával a nemocný popsal opakované drobné krvácení. Nebyly žádné klinické příznaky infekce protézy. UZ vyšetření neprokázalo volnou tekutinu v okolí protézy. Pro podezření na krvácení při infekci graftu byla indikována revize (7. 5. 2009), peroperační nález byl bez známky infekce, protéza byla fixována v podkoží. Anastomóza byla resekována a založena proximálněji. Výkon byl v rozsahu parciální graftektomie (PGE) s lokálním ošetřením místa původní anastomózy. Rána se hojila bez komplikací. Mikrobiologické vyšetření resekovaného interponátu prokázalo pseudomonádovou infekci a nemocný byl léčen piperacilin/tazobaktamem a ciprofloxacinem.
Image 2. Infikovaná ePTFE protéza av spojky Fig. 2. Infected ePTFE A-V shunt prosthesis 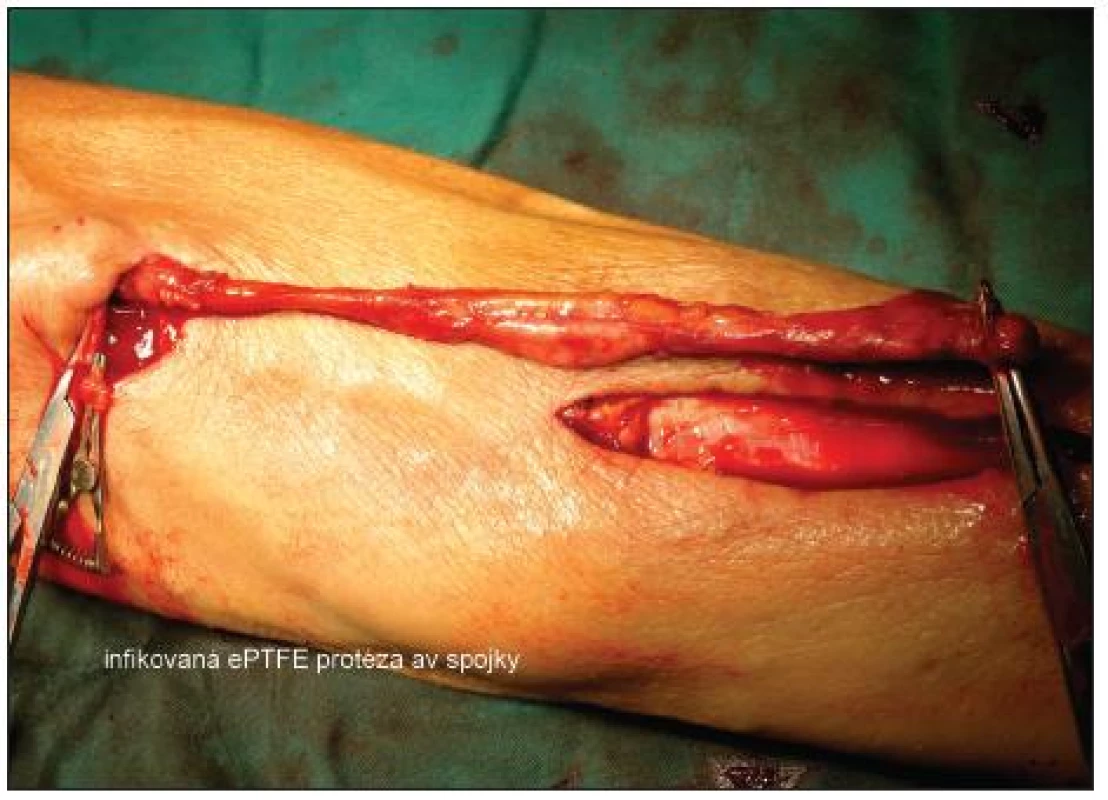
Při příznivém lokálním nálezu bylo zvažováno vyjmutí celé protézy. Nemocný byl oběhově stabilní, afebrilní, spojka byla funkční a operační rána se hojila bez zánětlivých příznaků. Bylo provedeno kontrolní UZ vyšetření av spojky, ta byla funkční s průtokem 450 ml/min, graft byl fixován v podkoží bez průkazu volné tekutiny v okolí. PET CT prokázalo zvýšenou akumulaci 18F-FDG v oblasti předloktí a protézy, ale nebylo možno odlišit zánět od časných reparativních pooperačních změn (6. pooperační den). Došlo k poklesu zánětlivých markerů (CRP, leukocytů). Graft byl ponechán a nemocný jím byl dialyzován. Nemocný byl s antibiotickou terapií a funkční spojkou přeložen 8. pooperační den do spádového zařízení. Důraz byl kladen na sledování lokálního nálezu.
Image 3. Vyjmutá ePTFE protéza s trombem Fig. 3. Removed ePTFE prosthesis with thrombus 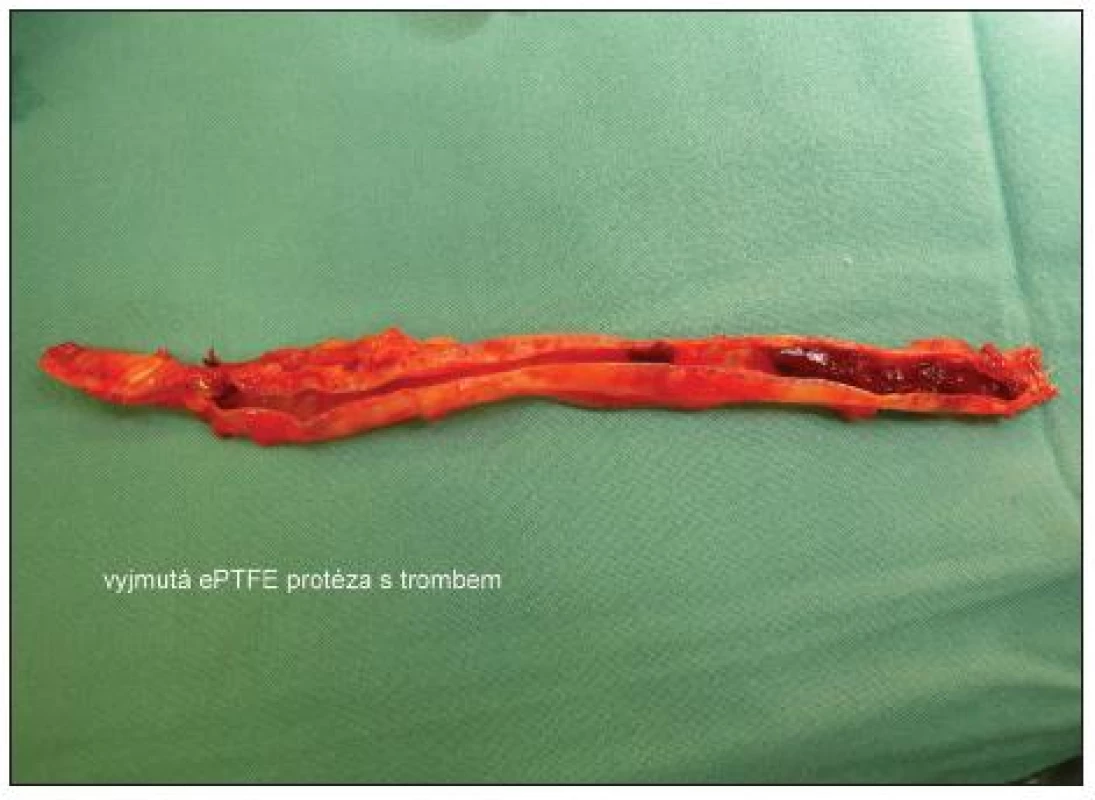
Po 3 týdnech vznikl opět septický stav a byla indikována revize a vyjmutí graftu. Lokální kožní nález byl klidný, při otevření původní rány nad anastomózou byl nalezen zkalený hematom a při opatrné revizi anastomózy došlo k masivnímu krvácení. Protéza byla vyjmuta a rána byla lokálně ošetřována. Nová autologní brachiocefalická spojka byla založena v loketní jamce (viz fotodokumentace). Nemocný je v současné době, 3 měsíce po vyjmutí protézy bez potíží a bez známky infekčního onemocnění.
DISKUSE
Je většinou obtížné odlišit, zda je primární infekce graftu a následující infekční komplikace je z tohoto zdroje, nebo je průběh opačný a z jiné infekce je hematogenně postižena cévní protéza. Na vznik infekce u dialyzovaného nemocného má vliv řada faktorů: snížená imunita dialyzovaného, kterou způsobuje dysfunkce neutrofilů při urémii [23, 24, 25], obezita nemocného, diabetes mellitus [26], hypalbuminemie [27,28] a nedostatečná osobní hygiena [29]. Dalším rizikovým faktorem je HIV infekce [30, 31]. Zásadní vliv má technika kanylace interponátu a délka jeho používání [18, 27, 32, 33]. Interponát, stejně jako všechny cévní protézy, je ohrožen také jinými infekcemi nemocného, které hematogenní cestou proniknou do interponátu [34]. Arteriovenózní graft potvrzuje také známou zkušenost z cévní chirurgie, že antibiotickou léčbou lze projevy infekce potlačit, ale nelze jí infekci z cévní protézy trvale odstranit. Ta je trvalým rizikem zdroje infekčních projevů lokálních nebo celkových. Významným rizikovým faktorem infekce je předchozí výskyt bakteriemie [22].
Cévní přístup k hemodialýze je nejčastěji infikován běžnou kožní mikroflórou, kterou většinou zastupují grampozitivní bakterie. Většinou je infekce způsobena kmeny Staphylococcus aureus nebo jinými grampozitivními bakteriemi, především koaguláza-negativními stafylokoky. Staphylococcus aureus je prokazován až v 68 % infekcí, výskyt ostatních grampozitivních bakterií se pohybuje v rozmezí od 20–60 % [27, 35]. Gramnegativní baktérie jsou méně častou příčinou a jejich výskyt je prokazatelný ve 28 % [27, 36]. Jejich výskyt je dáván do souvislosti s přenosem infekce z dialyzačních přístrojů [37]. Polymikrobiální etiologie se vyskytuje u 6 % nemocných [36]. Vstupní branou infekce je nejčastěji vlastní cévní přístup, následuje močový trakt, gastrointestinální trakt a dýchací cesty.
Stanovení diagnózy infekce interponátu je dáno většinou klinickým nálezem: zarudnutím kůže, proteplením, lokální bolestivostí, otokem, abscesem, sekrecí z rány (po kanylačním vpichu), která může být od serózní po purulentní. K tomu se mohou připojit celkové příznaky jako jsou teploty a třesavky. Velmi závažné jsou tunelové infekce, kdy lůžko graftu je vyplněno hnisem a graft „plave“. V místě kanylace vzniká chronická píštěl s hnisavou sekrecí. Prvním projevem infekce může být krvácení z anastomóz. Především infikovaná arteriální anastomóza graftu na brachiální arterii může být příčinou masivního krvácení [38]. Při nejasném rozsahu infekčního postižení je indikováno UZ vyšetření, které může zobrazit volnou tekutinu kolem graftu [35]. Při sekreci z vpichu nebo z rány je třeba odebrat materiál na mikrobiologické vyšetření a při projevech sepse opakovaně hemokulturu. U septických stavů nejasné etiologie je třeba myslet na klinicky nenápadnou cévní protézu a nemocného došetřit pomocí značkovaných leukocytů [39] nebo pomocí pozitronové emisní tomografie (FDG-PET) [40]. PET CT metoda je považována za jednodušší a přesnější než metoda používající indiem značkované leukocyty [40, 41].
Léčba infikovaného graftu může být konzervativní, chirurgická nebo nejčastěji je kombinací obou metod. Z chirurgického hlediska je základním principem odstranění celé protézy nebo infikovaného úseku protézy. Jedná se o totální graftektomii (TGE), o subtotální graftektomii (SGE) nebo o parciální graftektomii (PGE) [35].
Totální graftektomie je určena pro stavy, kdy je přítomna sepse, krvácení z anastomózy nebo tunelová infekce [42, 43]. Vyjmutí graftu vyžaduje ošetření původních anastomóz, žilní se přešívá, arteriální se ošetřuje žilním patchem, výjimečně se při krvácení z anastomózy arterie podvazuje. Velmi vzácně může podvaz arterie vést k ischemii ruky a je nutný žilní bypass ve zdravém podkoží k revaskularizaci periferie ruky. U výrazně sklerotického arteriálního řečiště předloktí není většinou bypass technicky možný. V tomto případě je třeba upřednostnit ischémii ruky před ohrožením života arteriálním krvácením. Z praxe je známé, že pokud při funkčním interponátu nebyla ruka ohrožena ischemií, lze arterii podvázat [44, 45]. Podvaz brachiální arterie lze také provést pod odstupem hluboké brachiální arterie. Podvaz je proveden ve zdravé tkáni, je bezpečný a má dobrý výsledek bez ischemických komplikací nebo krvácení [46]. V některých případech, kdy arteriální anastomóza není zřejmě infekcí postižena, je akceptabilní ponechání malého zbytku protézy v délce 2–3 mm na arteriální anastomóze, který se přešije [47,48]. Tento výkon se označuje také jako subtotální graftektomie a je určen pro nemocné s infikovaným graftem bez septických příznaků. Zjednodušuje výkon tím, že zmenší riziko poranění arterie nebo nervů v jizevnaté tkáni a zmenší riziko arteriálního krvácení. Po vyjmutí cévní protézy jsou odstraněny nekrotické tkáně a je prováděna laváž lůžka protézy [35].
Ošetření arterie přímou suturou nebo ponechání malého zbytku protézy může být nedostatečným výkonem, protože z obavy poranění okolních struktur nebo z obavy zúžení arterie není výkon radikální a je ponechána okolní infikovaná tkáň. Důsledkem je postup infekce a arteriální krvácení. U nemocných s pozitivní hemokulturou je riziko nového krvácení přes 20 % a je doporučena resekce arterie v místě anastomózy a její náhrada žilním interponátem. To umožní následný dokonalý debridment tkání. Tento postup je z hlediska odstranění infekce radikální a také zabrání vzniku stenózy arterie po jejím primárním ošetření [49]. Následuje mikrobiologické vyšetření graftu a cílená antibiotická terapie [15]. Před získáním výsledků mikrobiologické kultivace jsou nemocní antibioticky léčeni empiricky nejčastěji kombinací gentamicinu nebo vankomycinu s cefalosporiny III. generace [30, 35, 36]. Další antibiotická léčba je dána odběrem materiálu a kultivací. Dávkování antibiotik je korigováno ledvinnými funkcemi a celková doba léčby bývá 3–6 týdnů [30, 35].
Parciální graftektomie je určena pro stavy, kdy je jen část protézy infikována. Kritériem pro tento výkon je peroperační nález, kdy mimo postižený úsek protézy jsou její ostatní oddíly dobře fixovány v podkoží bez známek infekce. Infikovaný úsek je resekován, nepostižené úseky protézy podvázány a podkoží tunelu přešito v místě anastomóz. Infikované podkoží je převázáno a do zdravého podkoží se uloží nová protéza, která se našije na zdravé úseky původní protézy. Metoda umožní dialýzy na původním ponechaném řečišti a není potřeba nemocného zajistit centrálním katétrem. Tento výkon je doporučován, ale z praktického hlediska je jeho aplikace kontroverzní, protože původní protéza je často opět zdrojem infekce. Peroperačně není jednoznačně prokazatelné, kam až infekce zasahuje a PGE má riziko dalších infekčních projevů a krvácení. Dobrý výsledek u PGE je udáván v 74–80 % [18, 35, 42, 43, 50]. Je nutno připomenout, že tento názor není jednoznačně akceptován a některá centra doporučují jen TGE, protože PGE je spojena s dalšími infekčními komplikacemi [51].
V některých případech se jedná o „lokální infekci“, kdy v místě vstupu infekce je kožní nekróza, absces nebo píštěl a nemocný nemá celkové příznaky. Postižení protézy nelze vyloučit, ale lokální nález je malý a je možno řešit stav lokální chirurgickou terapií – drenáží, proplachem a podáním antibiotik podle citlivosti [42, 52]. Tímto přístupem lze většinou infekční proces utlumit, ale nikoliv definitivně vyléčit.
Při zhodnocení naší kazuistiky získáváme následující poznatky. Není prokazatelné, zda zdrojem infekce a sepse byla primárně cévní protéza, nebo zda naopak zdrojem infekce byla endokarditida a hematogenně byla postižena protéza. Pro druhou verzi svědčí lokální klidný nález na graftu. I při informacích o zvládnutých septických stavech existovaly argumenty pro ponechání protézy: příznivý lokální předoperační a peroperační nález, vždy negativní kultivace z kanylačních vpichů, funkční spojka, pokles zánětlivých markerů, negativní UZ nález a v zásadě negativní PET CT nález. Pro vyjmutí graftu svědčil průkaz infekce protézy bakterií Pseudomonas aeruginosa po první operaci, dále nebyla nutnost zachránit tento přístup k dialýze a bylo známo obecné riziko krvácení z reanastomózy. Nález při vyjmutí graftu, zřejmá infekce anastomózy při klidném kožním krytu a její následné peroperační krvácení nás vede k názoru, že i podle uznávaných kritérií správně indikovaná PGE je při pozdějším průkazu gramnegativní infekce v graftu spojena s vysokým rizikem komplikací a protéza se má vyjmout [38, 54].
Obecně lze konstatovat, že u nemocných, kteří jsou dialyzovaní cestou ePTFE interponátu, je třeba graft trvale brát jako potenciální zdroj infekce. Při septických stavech je třeba graft vyšetřit, i když je klinicky klidný. Zásadním pro osud graftu je okamžitá léčba kožních nebo vzdálených infekcí. Jen včasná a razantní antibiotická léčba může pozitivně ovlivnit počínající lokální infekci postihující kůži a podkoží. Z infikovaného graftu není možné infekci antibiotickou terapií odstranit a je nutné graft v postiženém úseku resekovat nebo je podle našich zkušeností správnější graft vyjmout. Gramnegativní infekce graftu je indikací k TGE. Dalším krokem je zajištění náhradního přístupu k dialýze nejčastěji cestou centrálního žilního katétru a intravenózní podávání antibiotik. Po zvládnutí infekční komplikace je nutná další operace, která zajistí přístup k dialýze implantací dalšího graftu nejlépe v jiné lokalizaci než byl původní. Léčba infikovaného graftu je spojena s hospitalizací a tím také s vysokými náklady na péči [42, 59].
Doc. MUDr. Petr Bachleda, CSc.
I. P. Pavlova 6
775 20 Olomouc
e-mail: petr.bachleda@fnol.cz
Sources
1. National Kidney Foundation: Kidney Disease Outcome Quality Initiative (NKFK/DOQI) clinical practice guidelines for vascular access. Am. J. Kidney Dis., 2001; 37(Suppl 1): 137–181.
2. Ether, J., Mendelssohn, D. C., Elder, S. R., et al. Vascular access use and outcomes: an international perspective from the Dialysis Outcomes nad Practice Patterns Study. Nephrol. Dial. Transplant., 2008; 23 : 3219–3226.
3. Volder, J. G. R., Kirkham, R. L., Kolff, W. J. AV shunts created in new ways. Trans. Amer. Soc. Artif. Intern. Organs, 1973; 19 : 38–42.
4. Baker, L. D., Johnson, J. M., Goldfarb, D. Expanded polytetrafluoroethylene (PTFE) subcutaneous arteriovenous conduit: an improved vascular access for chronic hemodialysis. Trans. Amer. Soc. Artif. Intern. Organs, 1976; 22 : 382–387.
5. Berardinelli, L. Grafts and graft materials as vascular substitutes for haemodialysis access construction. Eur. J. Vasc. Endovasc. Surg., 2006; 32 : 203–211.
6. Kaufmann, J. L., Garb, J. L., Berman, J. A., et al. A prospective comparison of two expanded polytetrafluoroethylene grafts for linear forearm hemodialysis access: does the manufacturer matter? J. Am. Coll. Surg., 1997; 185 : 74–79.
7. Hurlbert, S. N., Maltos, M. A., Henretta, J. F., et al. Long-term patency rates, complications and cost-effectiveness of polytetrafluoroethylene (PTFE) grafts for hemodialysis access: a prospective study that compares Impra versus Gore-tex grafts. Cardiovasc. Surg., 1998; 6 : 652–656.
8. Sorom, A. J, Hughes, C. B., McCarthy, J. T., et al. Prospective, randomized evaluation of a cuffed expanded polytetrafluoroethylene graft for hemodialysis vascular access. Surgery, 2002; 132 : 135–140.
9. Schild, A. F., Perez, E., Gillaspie, E., et al. Arteriovenous fistulae vs arteriovenous grafts: a retrospective review of 1 700 consecutive vascular access cases. J. Vasc. Access, 2008; 9 : 231–235.
10. Zouny, E. W., Dykstra, D. M., Goodkin, D. A., et al. Hemodialysis vascular access preferences at outcomes in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Kidney International, 2002; 61 : 2266–2271.
11. Anel, R. L., Yevzlin, A. S., Ivanovich, P. Vascular access and patient outcomes in hemodialysis: questions answered in recent literature. Arteficial Organs, 2003; 27 : 237–241.
12. Schwab, S. J., Harrington, J. T., Singh, A., et al. Vascular access for hemodialysis. Kidney Int., 1999; 55 : 2078–2090.
13. Vilhelmi, M., Haverich, A. Material used for hemodialysis vascular access: current strategies and a call to action. Graft, 2003; 6 : 6–15.
14. Sarnak, M. J., Jaber, B. L. Mortality caused by sepsis in patients with end-stage renal disease compared with the general population. Kidney Int., 2000; 58 : 1758–1764.
15. Butterfly, D. W., Schwab, S. J. Dialysis access infection. Curr. Opin. Nephrol. Hypertens, 2000; 9 : 631–635.
16. The United States Renal Data System 1999 annual data report. Am. J. Kid. Dis., 1999; 34 : 1–176.
17. Lafrance, J. P., Rahme, E., Nedjar, H., et al. Vascular access related infections: definitions, incidence rates, and risk factors. Am. J. Kidney Dis., 2008; 52 : 982–983.
18. Raju, S. PTFE grafts for hemodialysis access. Techniques for insertion and management of complications. Ann. Surg., 1987; 206 : 666–673.
19. Zibari, G. B., Gadallah, M. R., Landreneau, M., et al. Preoperative vancomycin prophylaxis decreases incidence of postoperative hemodialysis vascular access infections. Am. J. Kidney Dis., 1997; 30 : 343–348.
20. Zibari, G. B., Rohr, M. S., Landreneau, M. D., et al. Complications from permanent hemodialysis vascular access. Surgery, 1988; 104 : 681–686.
21. Padberg, F. T, Lee, B. C., Curl, L. R., et al. Hemoaccess site infection. Surg. Gynecol. Obstet, 1992; 174 : 103–108.
22. Hoen, B., Paul-Dauphin, A., Hestin, D., et al. EPIBACDIAL: A multicenter prospective study of risk factors for bacteremia in chronic dialysis patients. J. Am. Soc. Nephrol., 1998; 9 : 869–876.
23. Jaber, B. L. Bacterial infections in hemodialysis patients: Pathogenesis and prevention. Kidney Int., 2005; 67 : 2508–2519.
24. Vanholder, R., De Smet, R., Glorieux, G., et al. Review on uremic toxins: Classification, concetration, and interindividual variability. Kidney Int., 2003; 63 : 1934–1943.
25. Girndt, M., Sester, U., Sester, M., et al. Impaired cellular immune function in patients with end-stage renal failure. Nephrol. Dial. Transplant., 1999; 14 : 2807–2810.
26. Dhingra, R. K., Zouny, E. W., Hulbert-Shearon, T. H., et al. Type of vascular access and mortality in US hemodialysis patients. Kidney Int., 2001; 60 : 1443–1451.
27. Minga, T. E, Flanagan, K. H, Allon, M. Clinical consequences of infected arteriovenous grafts in hemodilaysis patients. Am. J. Kidney Dis., 2001; 38 : 975–978.
28. Miller, P. E, Carlton, D., Deirhoi, M. H., et al. Natural history of arteriovenous grafts in hemodialysis patients. Am. J. Kidney Dis., 2000; 36 : 68–74.
29. Kaplowitz, L. G., Comstock, J. A., Landwehr, D. M., et al. A prospective study of infections in hemodialysis patients: Patients hygiene and other risk factors for infection. Infect. Control Hosp. Epidemiol., 1988; 9 : 534–541.
30. Nassar, G. M., Ayus, J. C. Infectious complications of the hemodialysis access. Kidney Int., 2001; 60 : 1–13.
31. Curi, M. A., Pallas, P. J., Silva, M. B. Jr., et al. Hemodialysis access: Influence of the human immunodeficiency virus on patency and infection rates. J. Vasc. Surg., 1999; 29 : 608–616.
32. Kessler, M., Hoen, B., Mayeux, D., et al. Bacteremia in patients on chronic hemodialysis: a multicenter prospective survey. Neohrom, 1993; 64 : 95–100.
33. Allon, M., Depner, T. A., Radova, M., et al. Impact of dialysis dose and membrane on infection-related hospitalisation and death: Results of the HEMO study. J. Am. Soc. Nephrol., 2003; 14 : 1863–1870.
34. Bonomo, R. A, Rice, D., Whalen, C., et al. Risk factors associated with permanent access-site infections in chronic hemodialysis patients. Infect. Control Hosp. Epidemiol., 1997; 18 : 757–761.
35. Ryan, S. V., Calligaro, K. D., Dougherty, M. J. et al. Management of infected prosthetic dialysis arteriovenous grafts. J. Vasc. Surg., 2004; 39 : 73–78.
36. Lentino, J. R, Baddour, L. M., Wray, M., et al. Staphylococcus aureus and other bacteremias in hemodialysis patients: antibiotic therapy and surgical removal of access site. Infection, 2000; 28 : 355–360.
37. Wang, S. A, Levine, R. B., Carson, L. A., et al. An outbreak of gram-negative bacteremia in hemodialysis patientsntraced to hemodialysis machine waste drain ports. Infect. Control Hosp. Epidemiol., 1999; 20 : 746–751.
38. Bachleda, P., et al. Cévní náhrady v chirurgii arteriovenózních spojek k hemodialýze. Prodos, 2001; 78–81.
39. Palestro, C. J., Vega, A., Kim, C. K., et al. Indium 111 labeled leukocyte scintigraphy in hemodialysis access-site infection. J. Nucl. Med., 1990; 31 : 319–324.
40. Musso, G. C., Reynaldi, J., Navarro, M., et al. Hidden clotted vascular access infection diagnosed by fluorodeoxyglucose positron emission tomography. Nephrology, (Carlton), 2008; 13 : 264–2655.
41. Lawrence, P. F., Dres, D. J., Alazraki, N., et al. Indium-111-labeled leukocyte scanning for detection of prosthetic vascular graft infection. J. Vasc. Surg., 1985; 2 : 165–173.
42. Bhat, T. J., Tellis, V. A., Kohlberg, W. I., et al. Management of sepsis involving ePTFE grafts for hemodialysis access. Surgery, 1980; 87 : 445–450.
43. Tailor, B., Sigley, R. D., May, K. J. Fate of infected and eroded hemodialysis grafts and autogenous fistulas. Am. J. Surg., 1993; 165 : 632–636.
44. Haug, M. Der komplizierter av shunt infolge aerterieller Probleme. Angioarchiv, 1991; Bd 22 : 15–17.
45. Humphries, A. L. Jr., Nesbit, R. R. Jr., Caruana, R. J., et al. Thirty-six recommendations for vascular access operation: lessons learned from our first thousands operations. Am. Surg., 1981; 47 : 145–151.
46. Schanzer, A., Ciaranello, A. L., Schanzer, H. Brachial artery ligation with total graft excision is a safe and effective approach to prosthetic arteriovenous graft infection. J. Vasc. Surg., 2008; 48 : 655–658.
47. Gifford, R. R. Management of tunnel infections of dialysis PTFE grafts. J. Vasc. Surg., 1985; 2 : 854–858.
48. Calligaro, K. D, Veith, F. J., Valladares, J. A., et al. Prosthetic patch remnants to treat infected arterial grafts. J. Vasc. Surg., 2000; 31 : 245–252.
49. Wu, M. Y., Ko, P. J., Hsieh, H. C., et al. Repair of arteriotomy after removal of infected hemodialysis access by venous graft. Chang Gung Med. J., 2003; 26 : 911–918.
50. Schulte, W. P., Helmer, S. D., Salazar, R., et al. Surgical treatment of infected prosthesis dialysis arteriovenous grafts: total versus partial graft excision. Am. J. Surg., 2007; 193 : 385–388
51. Schild, A. F., Simon, S., Prieto, J., et al. Single-center review of infections associated with 1574 consecutive access procedures. Vasc. Endovasc. Surg., 2003; 37 : 27–31.
52. Albert, F. J. Clinical considerations in hemodialysis access infection. Adv. Ren. Replace Ther., 2006; 3 : 208–217.
53. Ballard, J. L, Bunt, T. J, Malone, J. M. Major complications of angioacces surgery. Am. J. Surg., 1992; 3 : 229–232.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 1-
All articles in this issue
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

