-
Medical journals
- Career
Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
Authors: R. Staffa 1; Z. Kříž 1; R. Vlachovský 1; M. Dvořák 1; T. Novotný 1; J. Buček 1; S. Šárník 2; B. Vojtíšek 3
Authors‘ workplace: II. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. R. Staffa, Ph. D. 1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. J. Vítovec, CSc., FESC. 2; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně, přednosta: doc. MUDr. P. Krupa, CSc. 3
Published in: Rozhl. Chir., 2010, roč. 89, č. 1, s. 39-44.
Category: Monothematic special - Original
Overview
Autor prezentuje soubor 12 pacientů (10 mužů, 2 ženy, průměrný věk 52,7 roků, rozmezí 50–79 let) s infekcí cévní protézy (n = 9) nebo zvýšeným rizikem infekce protézy (n = 3), u nichž byla použita autogenní hluboká žíla z dolní končetiny (vena femoralis superficialis) jako tepenná náhrada v aorto-iliako-femorální pozici. V průběhu sledování souboru (průměrná délka 14,1 ± 7,3 měsíců, rozmezí 3–27 měsíců) nezemřel žádný pacient a žádný pacient nemusel být reoperován. V souboru nebyla pozorována plicní embolizace. Nebyly zaznamenány žádné časné ani pozdní komplikace charakteru rekurentní infekce, okluze štěpu, amputace končetiny nebo aneuryzmatické dilatace žilního štěpu. V jednom případě přechodně přetrvával benigní edém končetiny po odběru hluboké žíly dobře kontrolovaný kompresivní punčochou.
Závěry zahraničních studií a dosavadní zkušenosti autora potvrzují, že použití autogenní femorální žíly vykazuje velmi dobré výsledky při řešení infekce cévní protézy, jedné z nejobávanějších a nejzávažnějších komplikací v cévní chirurgii.Klíčová slova:
infekce cévní protézy – vena femoralis superficialis – hluboká žíla dolní končetiny – autogenní rekonstrukceÚVOD
Standardním řešením infekce cévní protézy v aorto-iliako-femorální pozici je v současné době na většině pracovišť v ČR její explantace a revaskularizace extraanatomickým bypassem, nejčastěji axillo-(bi)femorálním. Výsledky však nejsou zcela uspokojivé vzhledem k vysokému riziku okluze a následné amputace končetiny a riziku reinfekce. Rovněž další modality (rifampicinem impregnovaná in situ protéza, silver graft, allogenní tepenný nebo žilní štěp, autogenní vena saphena magna) jsou zatíženy zvýšeným amputačním rizikem, rizikem rekurentní infekce až 20 %, mortalitou 20–75 %. Z literárních údajů vyplývá, že nejlepších výsledků při řešení infekce aorto-iliako-femorální cévní protézy bylo dosaženo pomocí autogenní femorální žíly a cílem práce autorů bylo tuto premisu ověřit na vlastním souboru.
PACIENTI A METODA
V období 6/2007–6/2009 byla autogenní femorální žíla jako tepenná náhrada implantována 12 pacientům. Jednalo se o 10 mužů a 2 ženy průměrného věku 52,7 roků (rozmezí 50–76 let). Soubor tvořili z menší části pacienti naší kliniky v kombinaci s extramurálními pacienty. Femorální žíla byla použita 9x jako náhrada infikované cévní protézy (2x náhrada aorto-bifemorální protézy, 4x náhrada jednostranné aorto-femorální protézy, 2x náhrada jednoho raménka aorto-bifemorální protézy, 1x náhrada iliako-femorální protézy). U 3 pacientů se zvýšeným rizikem infekce (gangrena s pozitivním mikrobiálním nálezem, elevace CRP, febrilie) byla provedena tepenná rekonstrukce pomocí autogenní femorální žíly jako primární výkon, z toho 2x aorto-femorální a 1x iliako-femorální (Tab. 1). Ve 2 případech šlo o akutní výkon. U 8 pacientů s infekcí cévní protézy byl mikrobiální nález pozitivní (Tab. 2), u 3 z nich polymikrobiální. U jednoho pacienta i přes přítomnost abscesu kolem protézy byl mikrobiální nález negativní.
Table 1. Typ tepenné rekonstrukce pomocí autogenní vena femoralis superficialis Tab. 1. Type of arterial reconstruction using autogenous superficial femoral vein 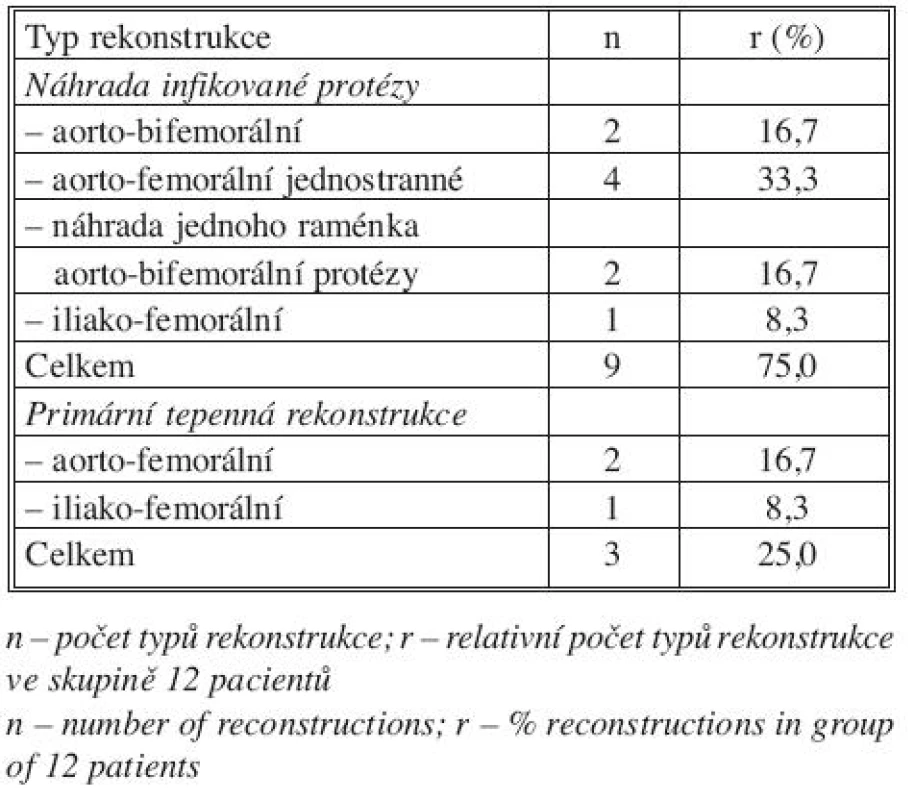
Table 2. Mikrobiální nález u pacientů s infekcí cévní protézy Tab. 2. Bacterial findings in patients with infected prosthetic graft 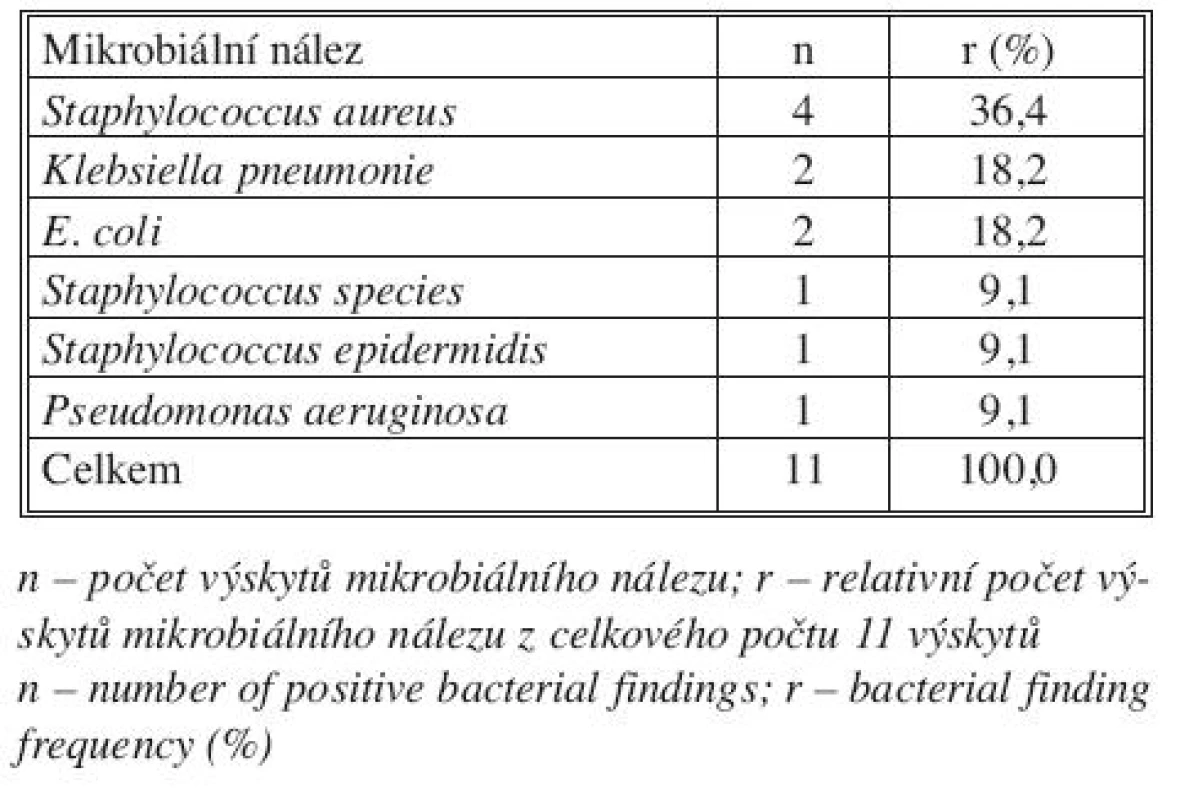
Infekce cévní protézy byla diagnostikována na základě klinického nálezu (absces nebo píštěl v třísle, febrilie, elevace CRP) a potvrzena CT vyšetřením – nález abscesu (Obr. 1) nebo tzv. „plovoucí protézy“ (Obr. 2) nebo v kombinaci s metodou FDG-PET/CT (Obr. 3).
Image 1. Infekce aorto-femorální cévní protézy vlevo. CT obraz abscesu kolem cévní protézy v oblasti nad tříselným vazem Fig. 1. Infected left aorto-femoral prosthetic graft. CT image of an abscess around the vascular prosthesis in the suprainguinal area 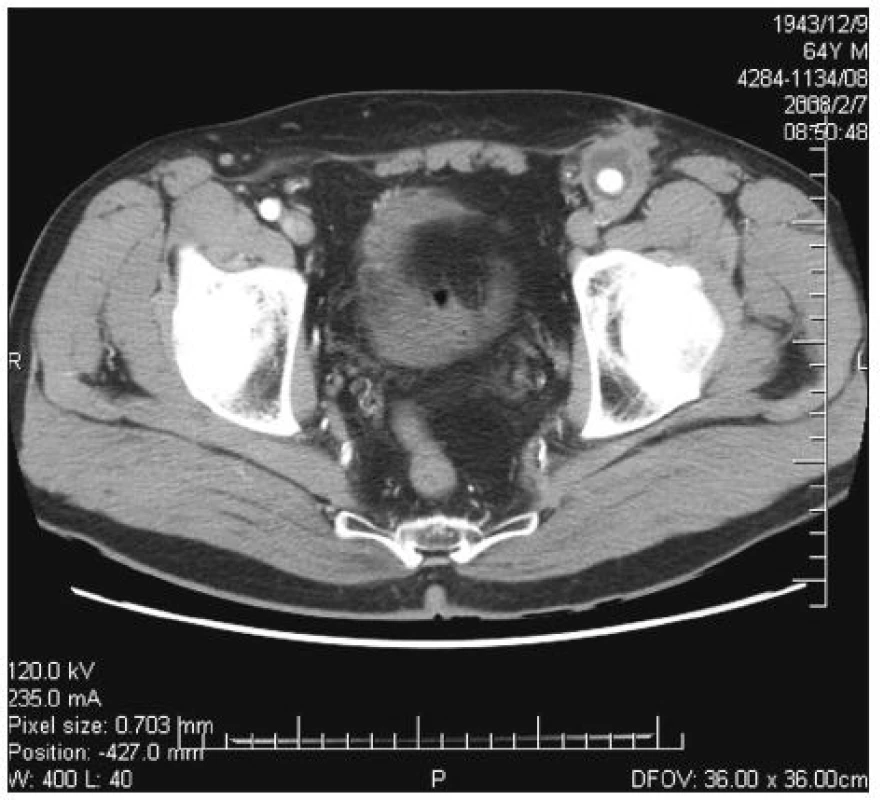
Image 2. Infekce aorto-femorální cévní protézy vlevo. CT obraz tzv. plovoucí protézy. Lem tekutiny kolem cévní protézy svědčí pro infekci v celém jejím průběhu Fig. 2. Infected left aorto-femoral prosthetic graft. A so-called floating prosthesis, as detected by computed tomography. The presence of perigraft fluid indicates infection of the complete graft 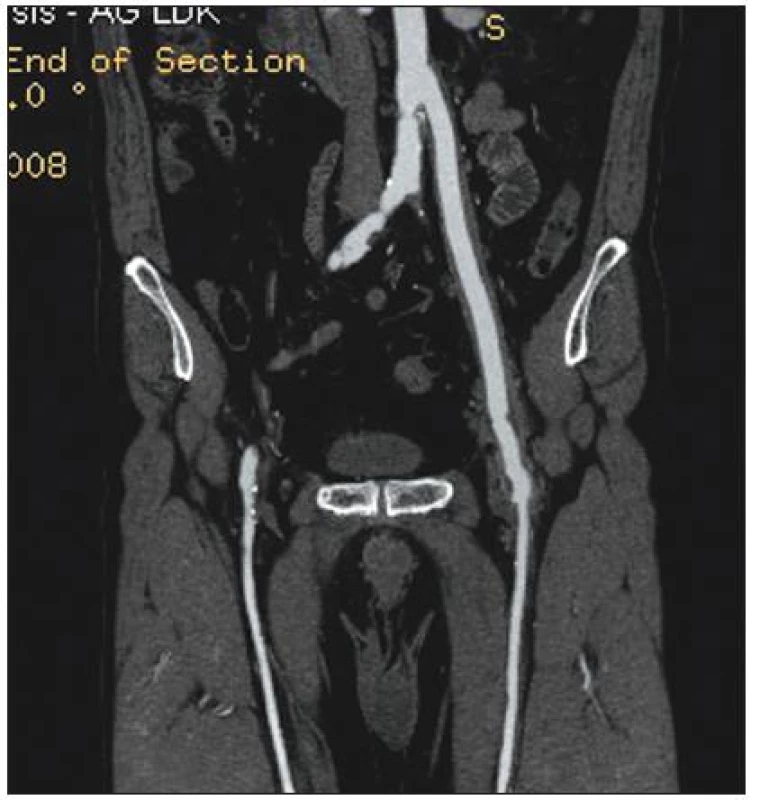
Image 3. FDG-PET/CT obraz infekce aorto-bifemorální cévní protézy v celém jejím průběhu Fig. 3. A totally infected aorto-bifemoral graft, as detected by FDG-PET/CT 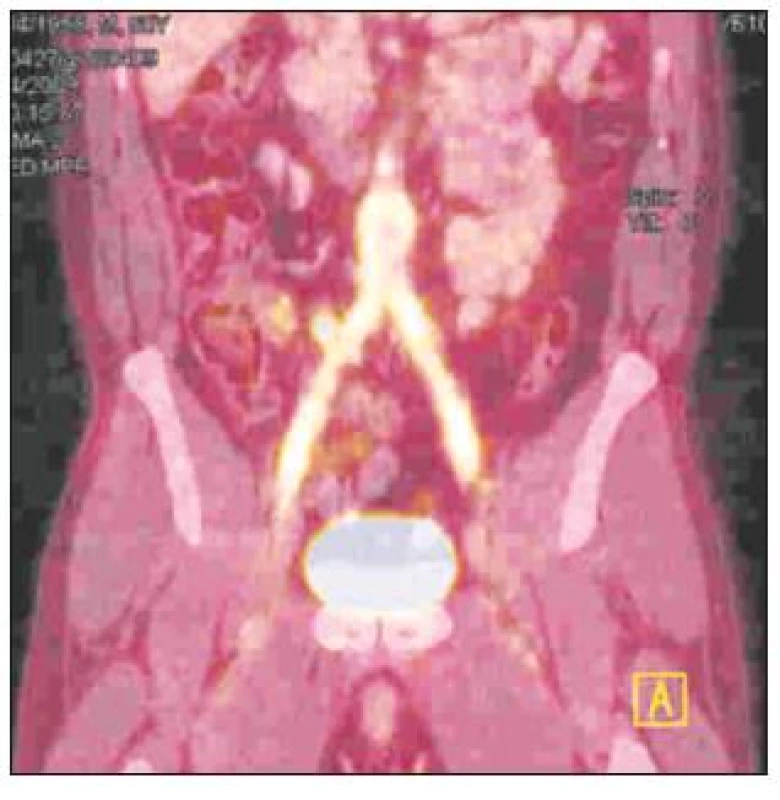
Vena femoralis superficialis byla podle potřeby odebrána i s částí vena poplitea (Obr. 4, 5) a to z jedné nebo obou dolních končetin. Žíla byla poté evertována a chlopně cíleně odstraněny. Implantována byla v nonreverzní pozici. Před odběrem vena femoralis superficialis vždy předcházelo dopplerometrické potvrzení dobré kvality vena profunda femoris, aby byla zajištěna žilní drenáž odběrové končetiny. U dvou pacientů operovaných urgentně byla kvalita vena profunda femoris posouzena peroperačně.
Image 4. Preparace vena femoralis superficialis v pravém třísle a dále v subsartoriálním a Hunterově tunelu. Vlevo je vidět odstup vena profunda femoris, jejíž kvalita byla předem ověřena dopplerometricky Fig. 4. Harvesting of the superficial femoral vein in the right groin, in the subsatorial canal and Hunter’s canal. On the left the profunda femoris vein branches off; its quality was verified beforehand by Doppler sonography 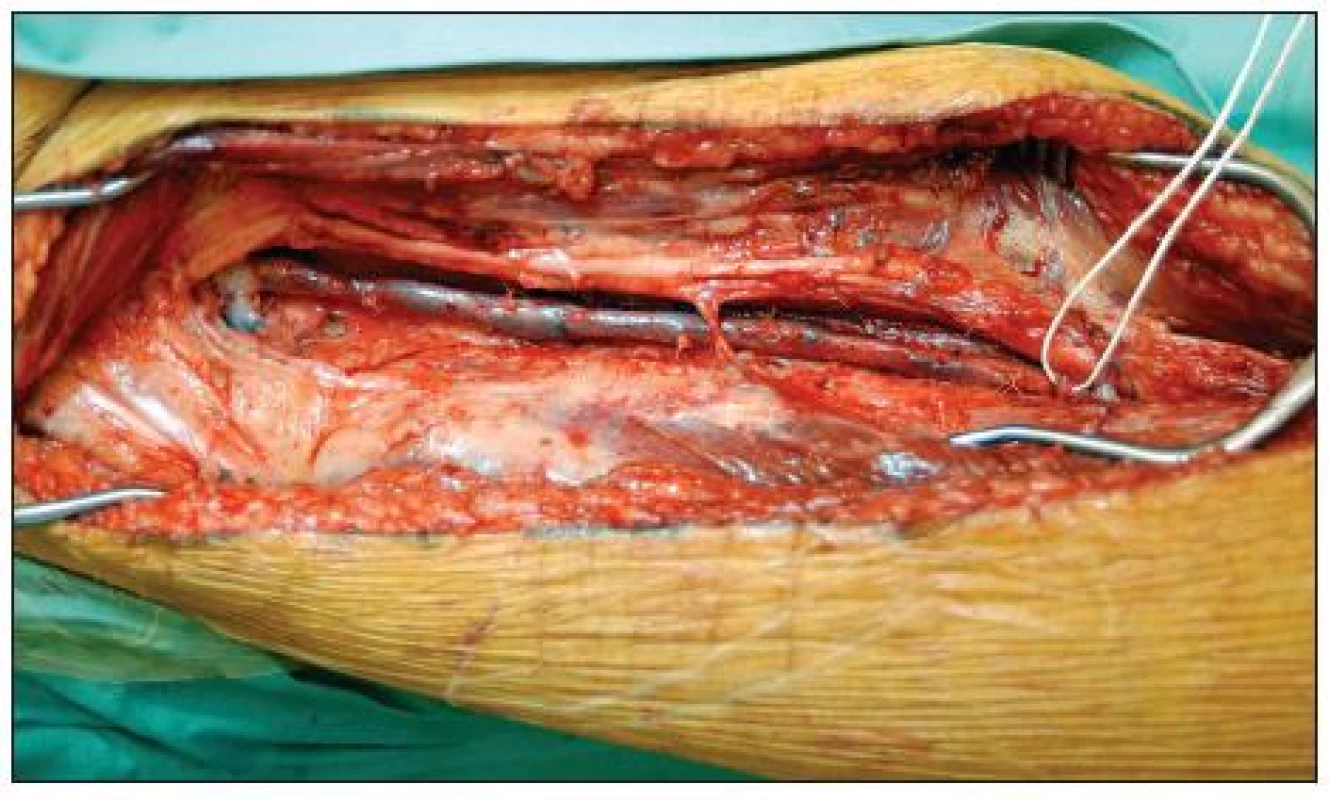
Image 5. Odebraná femorální žíla v délce 33 cm připravená k použití jako štěp. Dostatečný průměr žíly na proximálním i distálním konci vyhovuje plánované aorto-femorální rekonstrukci Fig. 5. Harvested femoral vein, 33 cm in length, prepared for use as a graft. The vein diameter on both the proximal and the distal end is sufficient for the planned aorto-femoral reconstruction 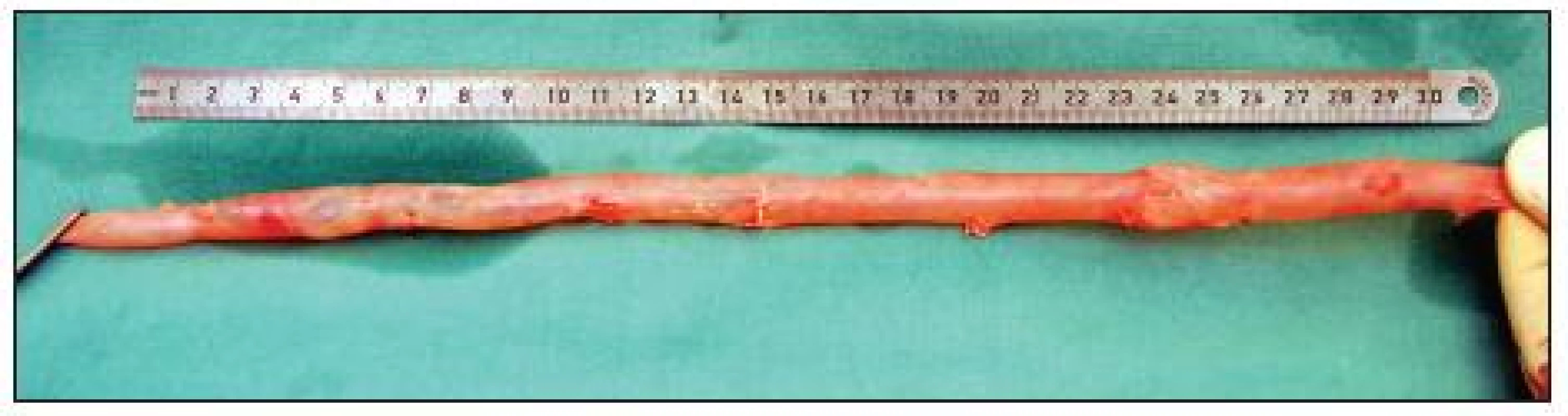
Antibiotika byla vysazena při poklesu febrilií, většinou 4.–6. pooperační den. Ve dvou případech, kdy bylo autogenní femorální žílou nahrazeno jedno raménko aorto-bifemorální protézy byla antibiotická terapie ponechána 6 týdnů. V pooperačním údobí byli pacienti převedeni na antiagregační terapii. Před propuštěním bylo provedeno CTA za účelem vyloučení rekurentní infekce a potvrzení průchodnosti a správného utváření bypassu.
SLEDOVÁNÍ PACIENTŮ
Pacienti byli ambulantně sledováni v intervalech 1, 3 a každých 6 měsíců (duplexní vyšetření, CTA – 6 měsíců po operaci, CRP, měření obvodů dolních končetin). Cílem bylo sledovat průchodnost rekonstrukce, vyloučit rekurentní infekci, vyloučit aneuryzmatickou dilataci štěpu a posoudit přítomnost otoku odběrové končetiny (Obr. 6, 7, 8).
Image 6. Stav po náhradě infikované aorto-femorální cévní protézy vlevo in situ štěpem z autologní vena femoralis superficialis. Kontrolní CTA prokazuje dobrou průchodnost a morfologii stěpu Fig. 6. Replacement of an infected left aorto-femoral prosthetic graft using an in situ graft of superficial femoral vein. CT angiography confirmed good morphology as well as patency of the graft 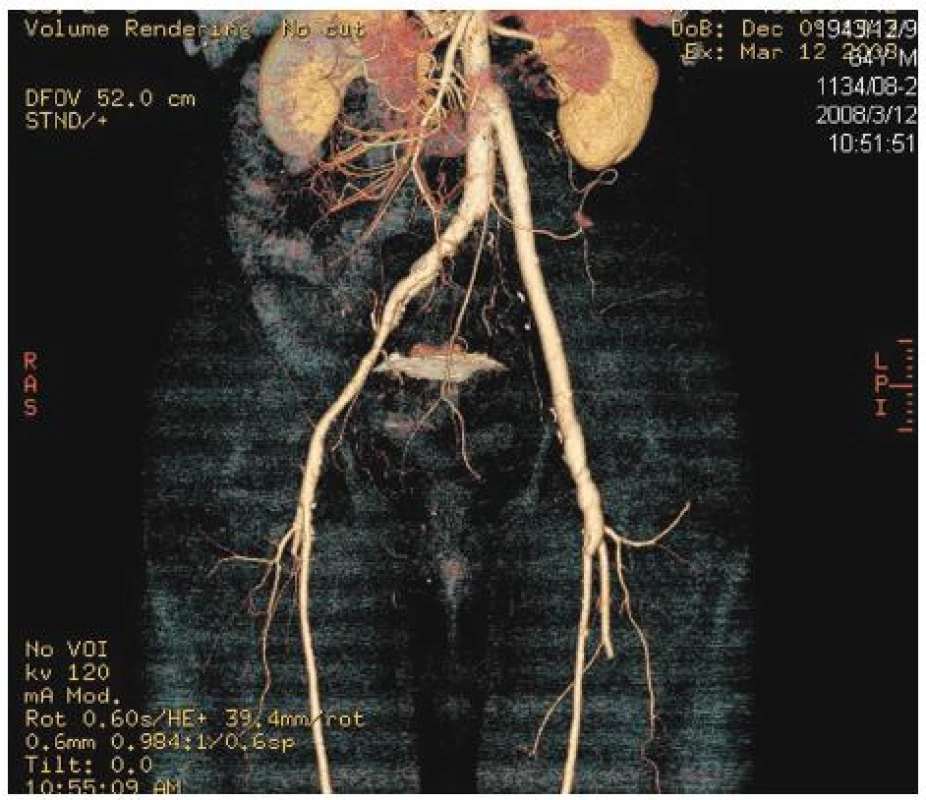
Image 7. Stav po explantaci infikované aorto-bifemorální cévní protézy a in situ rekonstrukci pomocí štěpů z autologních femorálních vén odebraných z obou dolních končetin. Kontrolní CTAprokazuje dobrou průchodnost a morfologii aorto-bifemorální rekonstrukce Fig. 7. Replacement of an infected aorto-bifemoral prosthetic graft and in situ reconstruction using autogenous superficial femoral vein grafts harvested from both lower extremities. CT angiography confirmed good morphology as well as patency of the graft 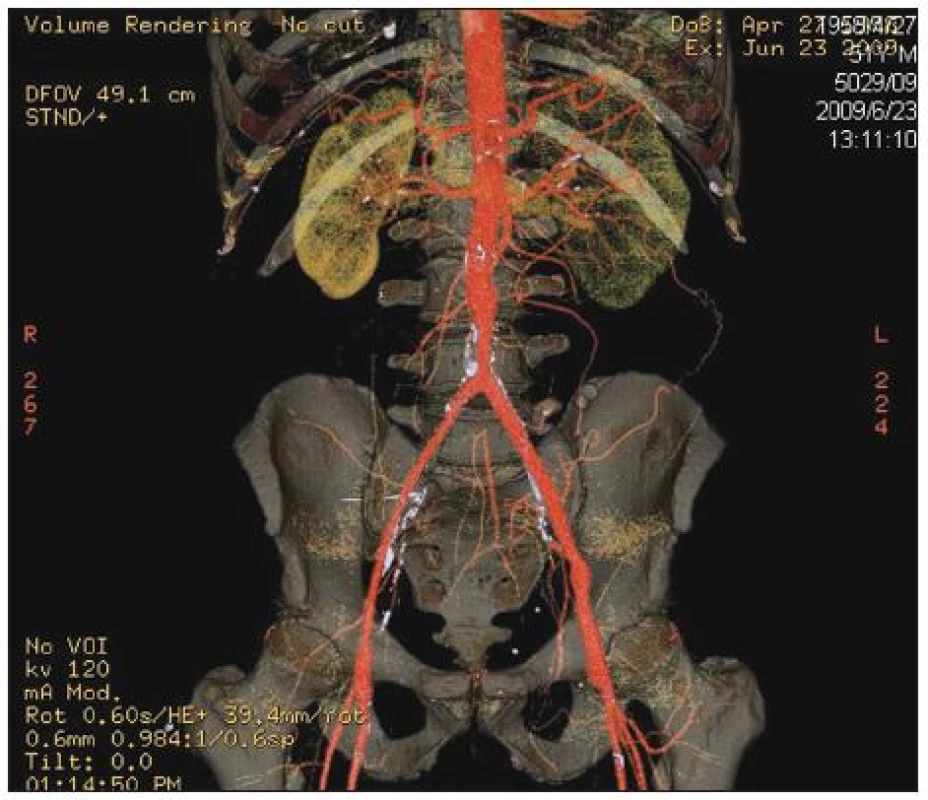
Image 8. Pacient 3 týdny po explantaci infikované aorto-bifemorální cévní protézy a in situ rekonstrukci pomocí štěpů z autologních femorálních vén. Všechny operační rány se zhojily per primam, nejsou známky otoku dolních končetin po oboustranném odběru vena femoralis superficialis Fig. 8. Patient at 3 weeks after explantation of an infected aorto-bifemoral prosthetic graft and in situ reconstruction with autogenous femoral vein grafts. All surgical wounds have healed by first intention; neither lower extremity shows any sign of oedema following harvest of the superficial femoral vein 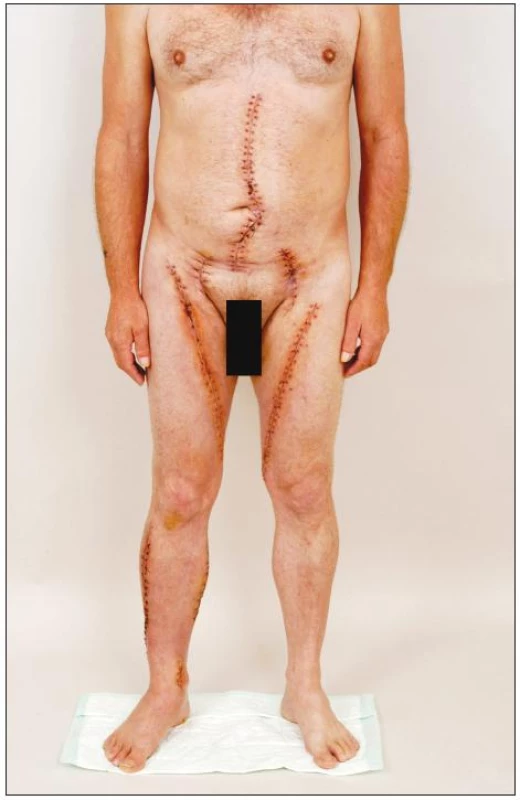
VÝSLEDKY
V průběhu sledování souboru (průměrná délka 14,1 ± 7,3 měsíců, rozmezí 3–27 měsíců) nezemřel žádný pacient a žádný pacient nemusel být reoperován. V souboru nebyla pozorována plicní embolizace.
Z časných komplikací byla v jednom případě pozorována přechodná lymfatická sekrece z třísla, dále v jednom případě sekundární hojení rány po odběru femorální žíly a rovněž v jednom případě časný pooperační revaskularizační syndrom bérce rešený fasciotomií a pozdější resuturou. U dvou pacientů byl pozorován benigní edém končetiny po odběru femorální žíly, který u jednoho z nich spontánně odezněl ještě v časném pooperačním období.
Nebyly zaznamenány žádné pozdní komplikace charakteru rekurentní infekce, okluze štěpu, amputace končetiny, aneuryzmatické dilatace žilního štěpu. V jednom případě pokračovalo sekundární hojení rány po odběru femorální žíly. Rovněž v jednom případě přetrvával benigní edém odběrové končetiny (dobře kontrolovaný kompresivní punčochou) se spontánní regresí po 3 měsících (Tab. 3).
Table 3. Komplikace časné a pozdní Tab. 3. Early and late complications 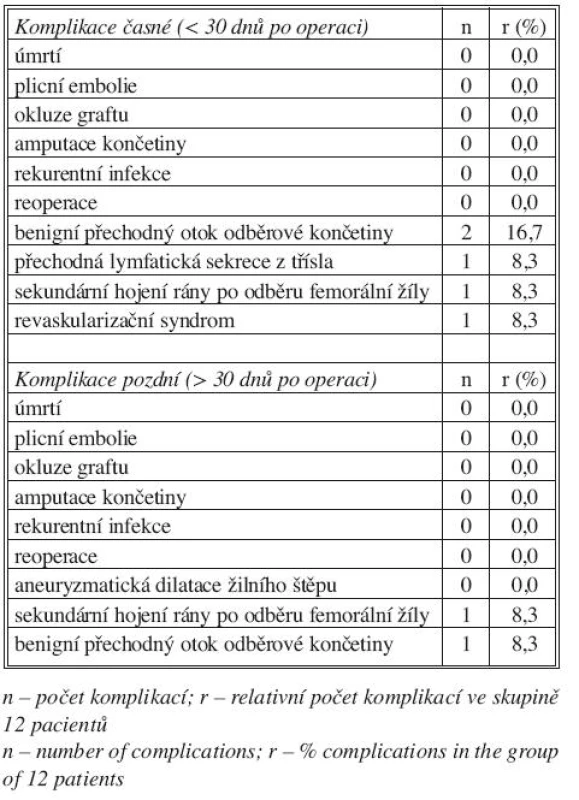
DISKUSE
Infekce cévní protézy v aorto-iliako-femorální oblasti je jednou z nejzávažnějších a nejobávanějších komplikací v cévní chirurgii. Přesto, že se jedná o komplikaci relativně vzácnou (incidence 1–6 %) [1], stále představuje výzvu jak pro cévně-chirurgické týmy, tak také pro diagnostický management. V diagnostice kromě CT a MR se dnes již standardně využívá metoda FDG-PET/CT založená na detekci akumulace radioizotopem značených leukocytů v místě zánětu, kde je patrná zvýšená utilizace glukózy [2, 3, 4]. Co se týče chirurgické léčby, v uplynulém období se etablovala řada postupů, ačkoliv společnými všem metodám jsou eradikace infekce, tedy nejlépe kompletní odstranění cévní protézy a následná tepenná extraanatomická nebo in situ rekonstrukce.
Nejčastěji používanou extraanatomickou cévní rekonstrukcí při infekci aorto-iliako-femorální protézy je axillo-(bi)femorální bypass pomocí cévní protézy vedené mimo oblast infektu. Ačkoliv je tato metoda považována za standardní, její výsledky, zvláště dlouhodobé, nejsou ideální. Důvodem je jednak poměrně vysoké riziko rekurentní infekce (až 20 %) [5], ale především riziko trombózy relativně „dlouhé“ cévní protézy daného průměru a s tím spojené riziko amputace končetiny (až 43 %) [6]. Hlavní výhodou metody je možnost použití v urgentních stavech, jako je např. akutní krvácení z aorto-duodenální píštěle u pacienta s infekcí cévní protézy v aortální oblasti [7].
Mezi in situ náhrady infikované aorto-iliako-femorální protézy patří např. bypass pomocí cévní protézy smáčené v roztoku rifampicinu nebo cévní protézy impregnované solemi stříbra, vždy v kombinaci s omentoplastikou. Tento postup je vhodný pouze u tzv. nízkovirulentních infekcí (tato skutečnost však často není předem známa) a jeho hlavní nevýhodou je vysoké riziko rekurentní infekce [8, 9, 10]. Další variantou in situ rekonstrukcí je použití „čerstvých“ nebo kryoprezervovaných tepenných allograftů. Riziko rekurentní infekce je ve srovnání s arteficielní náhradou výrazně nižší, nevýhodou metody je však riziko degradace allogenního štěpu a závislost na přítomnosti vhodného dárce nebo nabídce tkáňových bank [11, 12]. Při hledání vhodnějšího materiálu pro in situ náhradu infikované aorto-iliako-femorální protézy se pozornost logicky obrátila na autogenní žílu, jejíž odolnost vůči infekci obecně je vysoká. Pokusy nahradit aorto-femorální úsek pomocí autogenní vena saphena magna nepřinesly dobré výsledky. Ačkoliv jsou známy ojedinělé úspěšné kazuistiky, ve větších a déle sledovaných souborech se poukazuje na vysoké riziko okluze takových rekonstrukcí (64–75 %) [13, 14, 15].
Přínosem při řešení infekce cévní protézy bylo použití autogenní femorální žíly. Průměr vena femoralis superficialis, která se za tím účelem odebírá v celé délce a často s částí vena poplitea je v proximálním úseku 14–16 mm a distálně 8–12 mm. Je tak ideálním štěpem, který má všechny výhody autogenního materiálu včetně jeho odolnosti vůči infekci a zároveň splňuje požadavek na dostatečný průměr pro aorto-iliako-femorální pozici. Clagett v roce 1997 zveřejňuje práci, ve které hodnotí soubor 41 pacientů, u nichž byla infikovaná aorto-(bi)femorální cévní protéza nahrazena štěpem z pacientovy femorální žíly. Autor studie udává 100% pětiletou kumulativní sekundární průchodnost rekonstrukcí a nulový výskyt rekurentní infekce. Pouze u 4 pacientů po odběru femorální žíly pozoroval benigní edém končetiny, ve všech případech dobře kontrolovaný kompresivní punčochou, bez venózních ulcerací [16]. Podobně pozitivní výsledky zaznamenávají další autoři v USA a v Evropě [17, 18, 19, 20]. Na našem pracovišti se náhradě infikované cévní protézy v aorto-iliako-femorální pozici pomocí autogenní vena femoralis superficialis programově věnujeme od roku 2007 [21, 22] a naše dosavadní zkušenosti potvrzují velmi dobrý efekt metody.
ZÁVĚR
Výsledky studie hovoří ve prospěch metody řešení infekce aorto-iliako-femorální cévní protézy pomocí autogenní femorální žíly a potvrzují velmi dobré výsledky uváděné jinými autory. Riziko rekurentní infekce autogenního žilního štěpu je minimální, dlouhodobá průchodnost vynikající. Obava z otoku dolní končetiny po odběru femorální žíly není opodstatněná.
Prof. MUDr. Robert Staffa, Ph.D.
II. chirurgická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: robert.staffa@fnusa.cz
Sources
1. Herman, J., Utíkal, P., Sekanina, Z., Bachleda, P. Infekce náhrad abdominální aorty. Rozhl. Chir., 2009; 88(7): 349–352.
2. Špaček, M., Bělohlávek, O., Votrubová J., Šebesta, P., Štádler P. Diagnostics of „non-acute” vascular prosthesis infection using 18F-FDG PET/CT: our experience with 96 prostheses. Eur. J. Nucl. Med. Mol. Imaging., 2009; 36(5): 850–858.
3. Štádler, P., Bělohlávek, O., Špaček, M., Michálek, P. Diagnosis of vascular prosthesis infection with FDG-PET/CT. J. Vasc. Surg., 2004; 40 : 1246–1247.
4. Fukuchi, K., Ishida, Y., Higashi, M., Tsunekawa, T., Ogino, H., Minatoya, K., Kiso, K., Naito, H. Detection of aortic graft infection by fluorodeoxyglucose positron emission tomography: Comparison with computed tomographic findings. J. Vasc. Surg., 2005; 42(5): 919–925.
5. Bacourt, F., Koskas, F., and the French University Association for research in surgery. Axillobifemoral bypass and aortic exclusion for vascular septic lesions: a multicenter retrospective study of 98 cases. Ann. Vasc. Surg., 1992; 6 : 119–126.
6. Quinones-Baldrich, W. J., Hernandes, J. J., Moore, W. S. Long-term results following surgical management of aortic graft infection. Arch. Surg., 1991; 126 : 507–511.
7. Wasiková, S., Staffa, R., Kříž, Z., Piskač, P. Léčba infekce cévní protézy a aortoenterické píštěle jako pozdní komplikace rekonstrukčního výkonu na abdominální aortě – kazuistika. Rozhl. Chir., 2007; 86 : 522–524.
8. Chiche, L., Pitre, J., Sarfati, P. O. In situ repair of a secondary aorto-appendiceal fistula with a rifampin-bonded Dacron graft. Ann. Vasc. Surg., 1999; 13 : 225–228.
9. Batt, M., Magne, J. L., Alric, P., Muzj, A., Ruotolo, C., Ljungstrom, K. G., Garcia-Casas, R., Simms, M. In situ revascularization with silver-coated polyester grafts to treat aortic infection: early and midterm results. J. Vasc. Surg., 2003; 38(5): 983–989.
10. Oderich, G., Bower, T., Cherry, K., Panneton, J. Jr., Sullivan, T., Noel, A., Carmo, M., Cha, S., Karla, M., Gloviczki, P. Evolution from Axillofemoral to In Situ Prosthetic Reconstruction for the Treatment of Aortic Graft Infections at a Single Center. J. Vasc. Surg., 2006; 43(6): 1166–1174.
11. Noel, A. A., Gloviczki, P., Cherry, K. J. Jr., Safi, H., Goldstone, J., Morasch, M. D., Johansen, K. H. Abdominal aortic reconstruction in infected fields: early results of the United States cryopreserved aortic allograft registry. J. Vasc. Surg., 2002; 35(5): 847–852.
12. Kieffer, E., Gomes, D., Chiche, L., Fleron, M. H., Koskas, F., Bahnini, A. Allograft replacement for infrarenal aortic graft infection: early and late results in 179 patients. J. Vasc. Surg., 2004; 39 : 1009–1017.
13. Clagett, G. P., Bowers, B. L., Polez-Viego, M. A., et al. Creation of neo-aortoiliac system from lower extremity deep and superficial veins. Ann. Surg., 1993; 218 : 239–249.
14. Seeger, J. M., Wheeler, J. R., Gregory, R. T. Autogenous graft replacement of infected prosthetic grafts in the femoral position. Surgery, 1983; 93 : 39–45.
15. Jicha, D. L., Reilly, L.M., Kuestner, L. M., Stoney, R. J. Durability of cross-femoral grafts after aortic graft infection: the fate of autogenous conduits. J. Vasc. Surg. 1995; 22(4): 393–405; discussion 406–407.
16. Clagett, G. P., Valentine, R. J., Hagino, R. T. Autogenous aortoiliac/femoral reconstruction from superficial femoral-popliteal veins: feasibility and durability. J. Vasc. Surg., 1997, 25(2): 255–266, discussion 267–270.
17. Nevelsteen, A., Lacroix, H., Suy, R. Autogenous reconstruction with lower extremity deep veins: an alternative treatment of prosthetic infection after reconstructive surgery for aortoiliac disease. J. Vac. Surg., 1995; 22 : 129–134.
18. Franke, S., Voit, R. The superficial femoral vein as arterial substitute in infections of the aortoiliac region. Ann. Vasc. Surg., 1997; 11(4): 406–412.
19. Gordon, L. L., Hagino, R. T., Jackson, M. R., Modrall, J. G., Valentine, R. J., Clagett, G. P. Complex aortofemoral prosthetic infections: the role of autogenous superficial femoropopliteal vein reconstruction. Arch. Surg., 1999; 134(6): 615-20; discussion 620–621.
20. Gibbons, C. P., Ferguson, C. J., Edwards, K., Roberts, D. E., Osman, H. Use of superficial femoropopliteal vein for suprainguinal arterial reconstruction in the presence of infection. B. J. Surg., 2000; 87 : 771–776.
21. Staffa, R. Tepenná náhrada odebraná z hlubokého žilního systému – prioritní operace v ČR. Medical Tribune 2007; 3(21): A1.
22. Staffa, R., Kříž, Z., Vlachovský, R. Hluboká žíla dolní končetiny jako tepenná náhrada při řešení infekce cévní protézy. Rozhl. Chir., 2008; 87(4): 186–189.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 1-
All articles in this issue
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

