-
Medical journals
- Career
Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
Authors: Radek Pohnán; M. Ryska; R. Doležel; I. Veverová 1; Z. Linke 2
Authors‘ workplace: Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta prof. MUDr. Miroslav Ryska, CSc. ; Oddělení patologie ÚVN Praha, primář MUDr. Petr Hrabal 1; Radioterapeuticko-onkologické oddělení FN Motol Praha, primářka MUDr. Jana Prausová 2
Published in: Rozhl. Chir., 2009, roč. 88, č. 11, s. 629-633.
Category: Monothematic special - Original
Overview
Úvod:
Gastrointestinální stromální tumory (GIST) patří mezi nejčastější mezenchymální nádory trávicího ústrojí, jejich incidence je ale malá. Původ GISTů je v progenitorové buňce diferencující se směrem ke Cajalovým gastrointestinálním pacemakerovým buňkám a většina jich exprimuje tyrozinkinázový receptor KIT. Cílem naší práce bylo zhodnotit stav léčby GISTů na vlastní sestavě a porovnat dosažené výsledky s literaturou.Metoda:
Retrospektivně jsme analyzovali všechny pacienty s histologicky potvrzenou diagnózou GIST, kteří byli operováni na Chirurgické klinice 2. LF UK a ÚVN Praha v letech 2003 až 2008.Výsledky:
13 pacientů podstoupilo chirurgickou léčbu v Ústřední vojenské nemocnici Praha v pětiletém období. Nejčastější lokalizací tumoru byl žaludek (46 %), a tenké střevo (duodenum 23 %, jejunum 23 %, ileum 8 %). U 12 nemocných byl proveden radikální výkon v rozsahu R0 resekce (92 %). 10 pacientů (77 %) je v remisi, 1 nemocný je ve fázi stabilizace onemocnění (8 %), v 1 případě je progrese onemocnění s generalizací (8 %).Závěr:
Chirurgická léčba je standardem léčby lokalizovaných tumorů. Nemocní po radikální resekci profitují z adjuvantní léčby inhibitory tyrozinkinázy. V léčbě metastatické nemoci a recidivujícího onemocnění byla prokázána účinnost specifických inhibitorů tyrosin kinázy. Primární chirurgická léčba u metastatického onemocnění je paliací pro nemocné s krvácením a obstrukcí.Klíčová slova:
gastrointestinální stromální tumor – diagnostika – chirurgická léčbaÚVOD
Gastrointestinální stromální tumory (GIST) jsou skupinou řídce se vyskytujících mezenchymálních tumorů s incidencí 1–2/100 000 obyvatel [1, 2]. Přesto se jedná o nejčastější neepiteliální tumory trávicího ústrojí. Tvoří méně než 1 % primárních novotvarů gastrointestinální oblasti. Postihují stejně ženy i muže, u dětí je výskyt velmi vzácný. Nejčastěji jsou diagnostikovány ve věku šedesáti let [1, 2].
Termín gastrointestinální stromální tumory vytvořili Mazur s Clarkem [3] v roce 1983, kdy takto označovali mezenchymální tumory GIT, které nevykazovaly známky hladkosvalové ani neurogenní diferenciace [3].
Tato široká skupina novotvarů má pravděpodobně původ v progenitorových buňkách, které se diferencují směrem ke Cajalovým intersticiálním buňkám majících funkci intestinálního pacemakeru [4]. V 95 % exprimují KIT protein (CD117).
Cílem předkládané retrospektivní analýzy bylo zhodnotit stav léčby GIST na vlastní sestavě a porovnat naše výsledky s literaturou.
Image 1. GIST s převahou vřetenitých, fascikulárně uspořádaných buněk, HE, zvětšení 100x Fig. 1: GIST with prevailing spindle shaped, fascicular cells, H-E staining, enlargement 100x 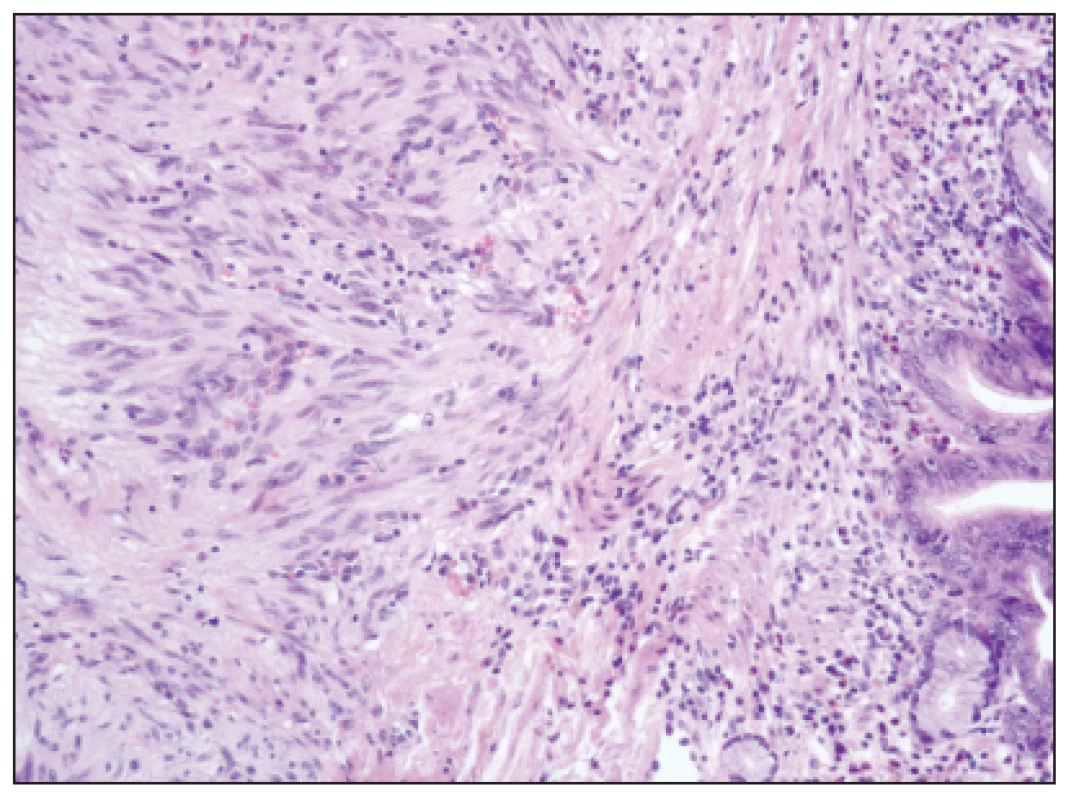
Image 2. GIST převážně epiteloidního vzhledu s ložiskovou vakuolizací cytoplazmy, HE, zvětšení 100x Fig. 2. GIST, prevailing epitheloid cells with focal cytoplasmic vacuolization, H-E staining, enlargement 100x 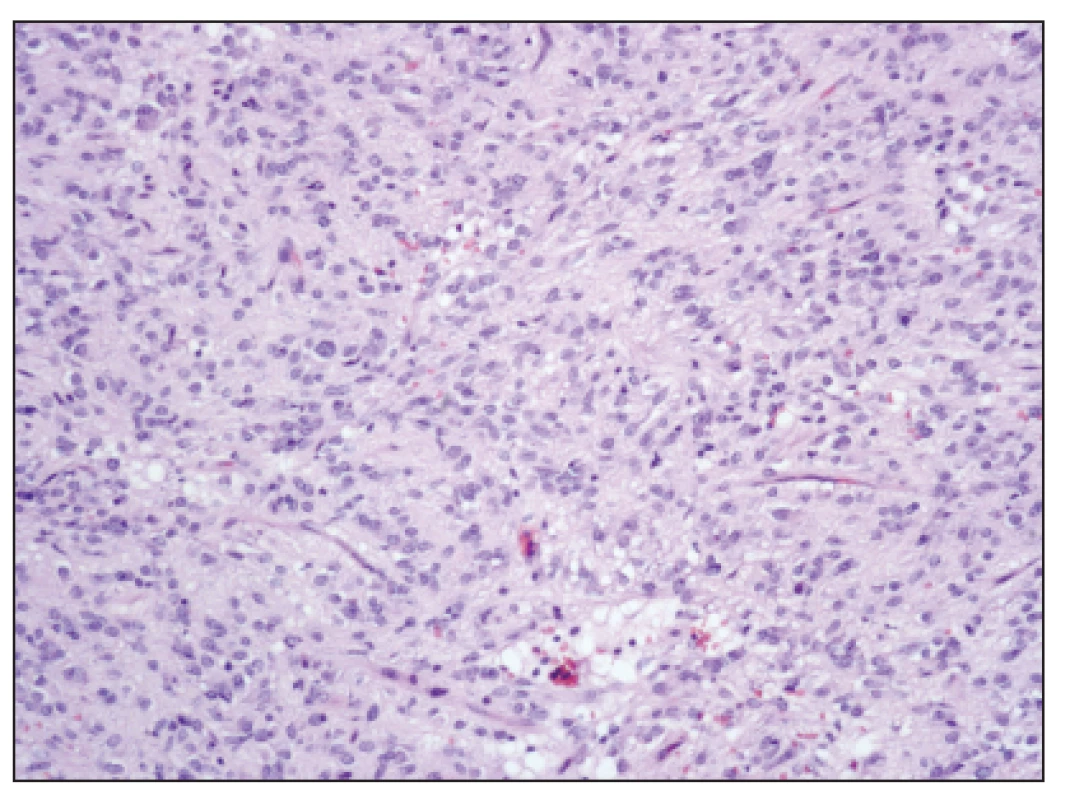
Image 3. Nádorové buňky exprimují c-kit (CD117), zvětšeno 200x Fig. 3. The tumor cells expressing c-kit (CD117), enlargement 200x 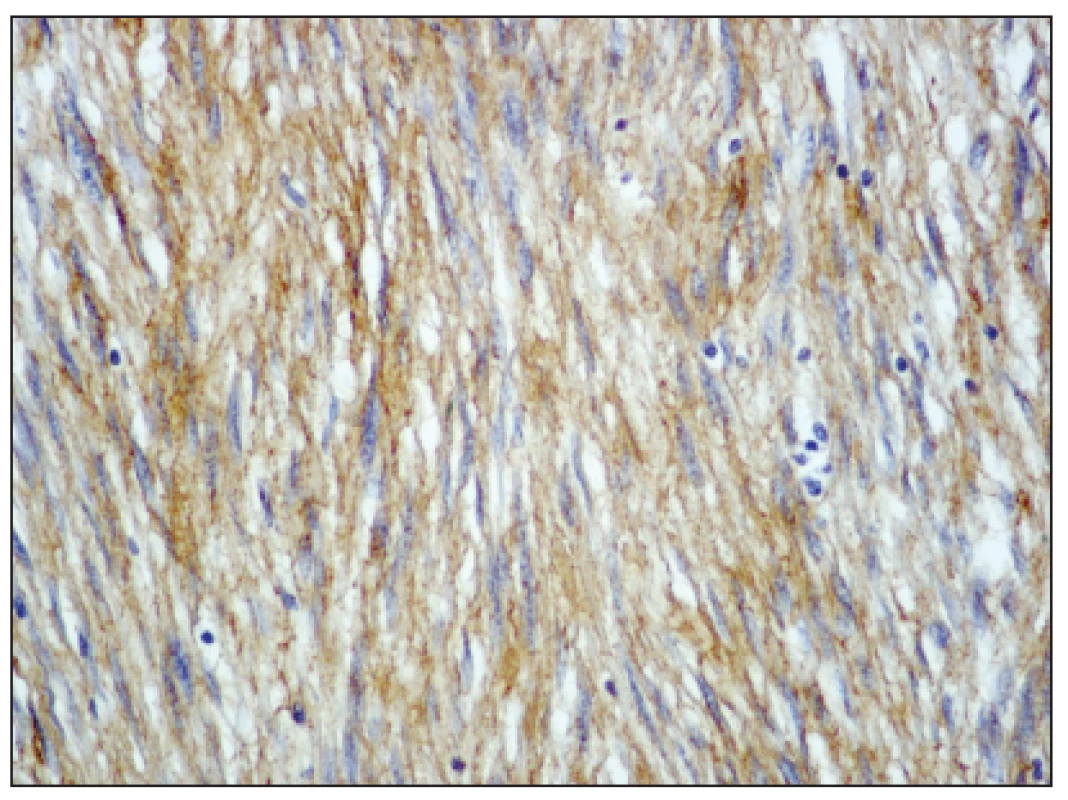
Table 1. Charakteristika souboru pacientů operovaných pro GIST 2003–2008 Tab. 1. Characteristics of the group of patients, operated for GIST during 2003–2008 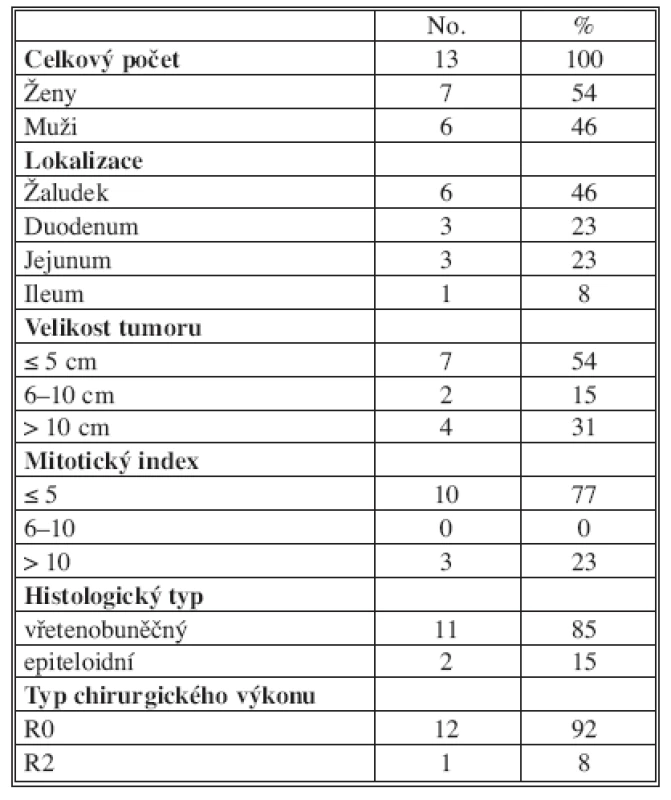
MATERIÁL A METODA
Retrospektivně jsme hodnotili dokumentaci všech pacientů operovaných pro GIST na Chirurgické klinice 2. LF UK a ÚVN Praha v období od ledna 2003 do prosince 2008. Sledovány byly základní demografické parametry nemocných – věk, pohlaví. Dále jsme sledovali lokalizaci, velikost tumoru, histologickou formu, mitotický index, symptomy onemocnění, radikalitu chirurgického výkonu a pooperační komplikace.
Po operaci byli pacienti dispenzarizováni po 3 měsících v prvním roce od výkonu a dále po 6 měsících v dalších letech. Sledovali jsme průběh choroby a adjuvantní léčbu.
Získaná data jsme sumarizovali metodami deskriptivní statistiky pomocí tabulkového kalkulátoru Excel.
VÝSLEDKY
V období mezi lednem 2003 a prosincem 2008 bylo přijato na Chirurgickou kliniku 2. LF UK a ÚVN Praha 13 nemocných, kteří podstoupili operaci a u nichž byla histologicky potvrzena diagnóza GIST. V souboru je 7 žen (54 %) a 6 mužů (46 %), průměrný věk 62 let, medián 60 let (interval 47–80). Nejčastějšími symptomy v době diagnózy byly krvácení do trávicího ústrojí (31 %), hmatná rezistence (15 %), dyspepsie (8 %), dorzalgie (8 %), pneumoperitoneum (8 %), anemie (8 %), u 3 pacientů se jednalo o náhodný nález (23 %).
Nejčastější lokalizací tumoru byl žaludek (46 %), dalšími místy bylo duodenum (23 %), jejunum (23 %) a ileum (8 %).
Medián velikosti tumoru je 5 cm (interval 3–19 cm), u 85 % se jednalo u vřetenobuněčnou formu, v 15 % byla forma epiteloidní. Imunohistochemickými metodami byl KIT protein detekován u 85 % pacientů, u 77 % nemocných byl detekován CD 34+. Sedm pacientů (54 %) mělo GIST s nízkým rizikem agresivního chování, 1 nemocný (8 %) měl GIST se středním rizikem agresivního chování a u 5 pacientů (38 %) byl nalezen GIST s vysokým rizikem agresivního chování.
U 12 nemocných (92 %) byl proveden radikální výkon v rozsahu R0 resekce. U jednoho nemocného nebylo možné tumor odstranit. Perioperační mortalita byla 8 %, kdy příčinou úmrtí bylo kardiální selhání. Pooperační komplikace se vyskytly u 1 nemocného, kdy došlo k dehiscenci anastomózy s nutností reoperace. Dva pacienti podstoupili lečbu imatinibem mesilátu. Pooperačně je sledováno 12 nemocných, 10 pacientů (77 %) je v remisi, 1 nemocný léčený imatinibem je ve fázi stabilizace onemocnění, u jedné pacientky je progrese onemocnění s generalizací.
DISKUSE
Nejčastějším výskytem primárních GISTů je žaludek (60 %), dále tenké střevo (30 %), kolorektum (5 %) a jícen (5 %) [5]. Stromální tumory se mohou vyskytovat i v omentu, mesenteriu, retroperitoneu [6], žlučníku, [7] pankreatu [8], vagině a močovém měchýři [9, 10]. Nádory lokalizované mimo trávicí trubici se některými autory označují jako EGIST (extragastrointestinální stromální tumory). V našem souboru se GIST vyskytoval nejčastěji v oblasti tenkého střeva (54 %) a žaludku (46 %).
Příznaky onemocnění jsou nespecifické a zahrnují řadu gastrointestinálních symptomů jako je dyspepsie, nauzea, zvracení, střevní dyskineze, abdominální dyskomfort a bolest. Někdy je prvním projevem onemocnění obstrukce trávicího ústrojí či krvácení. Malé tumory mohou být asymptomatické, u 30 % GISTů se jedná o náhodný nález při pitvě či při operaci z jiné příčiny [11]. I v našem souboru byly symptomy nespecifické, u nejvíce nemocných bylo projevem onemocnění krvácení do trávicího traktu (31 %), u 3 pacientů se jednalo o náhodný nález.
V době diagnózy jsou u 10 % nemocných nalezeny metastázy. Metastatická choroba postihuje nejčastěji játra a dále peritoneum, omentum a retroperitoneum. Metastazování do lymfatických uzlin je zřídkavé a je známkou pokročilého onemocnění. U našich nemocných nebyly metastázy v době diagnózy přítomny, u jedné pacientky došlo po 18 měsících od operace k progresi onemocnění s tvorbou metastáz v játrech.
V současné době není známé žádné specifické zobrazovací vyšetření k diagnostice GISTů [12]. Standardní součástí předoperační diagnostiky jsou endoskopická vyšetření trávicího ústrojí a CT/MRI vyšetření. Pozitronová emisní tomografie je užitečná při detekci metastatického postižení, ale její hlavní význam je v následném follow-up [11, 12]. Předoperační bioptická vyšetření jsou zdrojem kontroverzí. Odběr biopsie by měl být proveden při endoskopickém vyšetření. Perkutánní jehlová biopsie je spojena s rizikem peritoneálního rozsevu a je indikovaná pouze u jasně neresekovatelného onemocnění [12].
Makroskopicky bývají GISTy dobře ohraničené, často jsou pokryté tenkou pseudokapsulou. Mají elastickou konzistenci a mohou být septované. Dosahují velikosti mezi 1 až 30 cm v průměru. Malé tumory mají na řezu vláknitou homogenní strukturu bílé barvy. S růstem velikosti přibývá regresivních změn – nekróza, kalcifikace, prokrvácení či pseudocystická přeměna [12, 13].
V histologickém obraze se stromální tumory rozdělují na typ vřetenobuněčný, epiteloidní a smíšený. Nejčastěji se vyskytuje vřetenobuněčná forma (70 %), která byla v éře před GIST označována jako leiomyosarkom. Epiteloidní forma se vyskytuje ve 20 % a byla dříve označována jako leiomyoblastom [13, 14]. Tumory v analyzovaném souboru byla velké mezi 3 až 19 cm (medián 5 cm), histologicky se jednalo v 85 % o vřetenobuněčnou formu, u 15 % nalezl patolog formu epiteloidní.
Na rozdíl od nádorů vykazujících známky hladkosvalové či neurogenní diferenciace, je pro GIST typická exprese KIT proteinu s možností detekce imunohistochemickými metodami pro antigen CD 117 [15]. Uváděná frekvence KIT pozitivních GISTů je mezi 90 a 100 % v závislosti na použité metodě [16 ]. 60–80 % GISTů vykazuje pozitivitu pro CD 34, u 30–40 % GISTů je detekovatelný SMA (smooth muscle aktin) [11, 12]. KIT protein byl detekován u 85 % našich pacientů, u 77 % nemocných byl nalezen CD 34+.
Rozpoznání patogeneze GIStů vedlo v posledním desetiletí k vývoji cílené terapie inhibitory tyrozinkinázy. KIT protein je transmembránový receptor z rodiny receptorových tyrozinkináz ( RTK). Je produktem c-kit protoonkogenu lokalizovaného na dlouhém raménku 4. chromozomu. RKT jsou transmembránové proteiny složené z extracelulární, transmembránové a intracelulární části. Extracelulární část RTK vytváří receptor pro specifický ligand, po jehož navázání dochází ke strukturálním změnám RKT. Aktivuje se intracelulární část, která je nositelem tyrozinkinázové domény. Po aktivaci RTK dimenzuje a dochází k autofosforylaci tyrozinových zbytků v tyrozinkinázové doméně. Následuje spuštění kaskády přenosu signálu z vnějšího prostředí k buněčnému jádru [11, 12, 13, 14].
Gastrointestinální stromální tumor je spojován s mutacemi receptorových tyrozinkináz KIT a PDGFRA (platelet derived growth factor receptor alpha – vyskytuje se u 5 % GISTů). V důsledku těchto mutací nevyžadují mutované RTK vazbu specifického ligandu a výsledkem je aktivace buněčné proliferace [11, 12, 13, 14].
Inhibitory tirozinkinázy jsou kompetitivní antagonisté na vazebném místě adenosintrifosfátu (ATP). Blokují tak přenos fosfátu z ATP na tyrozinové zbytky v tyrozinkinázové doméně. Výsledkem je přerušení kaskády přenosu signálu z vnějšího prostředí k buněčnému jádru a dochází tak k desaktivaci buněčné proliferace [25].
GIST je považován za potencionálně maligní novotvar, protože v současné době není známé kritérium, které by umožňovalo vyloučit možnost maligního zvratu [13]. Podle rizika agresivního chování se GISTy rozdělují do čtyř skupin: s velmi nízkým, nízkým, středním a vysokým rizikem agresivního chování [17]. Základními kritérii jsou maximální rozměr tumoru a mitotický index (počet mitóz v 50 zorných polích 40násobného zvětšení). Mezi další rizikové faktory patří lokalizace tumoru (špatná prognóza EGIST a GISTů tenkého střeva, lepší prognóza nádorů lokalizovaných v žaludku) [18], vysoký proliferační index (KI-67), vysoká celularita, buněčné atypie, velký počet nekróz v nádoru, angioinvaze, perineurinální šíření a infiltrativní růst [2, 18, 19]. 54 % nemocných v našem souboru mělo GIST s nízkým rizikem agresivního chování byl u 1 pacienta a ve 38 % případů se jednalo o GIST s vysokým rizikem agresivního chování. Jediný nemocný v našem souboru s progresí a generalizací onemocnění byl zařazen podle standardních kritérií ke GISTům s nízkým rizikem agresivního chování,
Metodou volby v léčbě lokalizovaných GISTů je kompletní R0 resekce [11, 12, 13, 20, 21]. Dosud nebyl definován doporučený rozsah resekce ve zdravé tkáni [12, 20, 21]. Při prorůstání do okolních orgánů, by měla být provedena en-block resekce. Operační technika musí být vedena snahou neporušit kapsulu tumoru. Spontánní ruptura tumoru či ruptura při operaci je nepříznivým prognostickým faktorem se signifikantním rizikem pozdní recidivy a celkovým zkrácením přežití [11]. Lymfadenektomie regionálních lymfatických uzlin není standardem a provádí se pouze při suspektním postižení [12, 20]. Radikální výkon jsme provedli v 92 % případů, u 1 pacienta byl vzhledem k pokročilému a radikálně neošetřitelnému onemocnění proveden paliativní střevní bypass.
Primární resekci je možné provést u 50 až 90 % nemocných [20, 22, 23]. I při kompletní resekci 40 až 80 % GISTů recidivuje [20, 24]. Celkové pětileté přežití primárně resekovatelného onemocnění se udává v intervalu 48–70 %, u formy s velmi nízkým a nízkým rizikem agresivního chování dosahuje 90–95 % [12, 20, 22, 23].
10 % nemocných je v době diagnózy postiženo metastatickou chorobou. Maligní GIST je rezistentní k chemoterapii a radioterapii a do nedávné doby měli takto postižení nemocní velmi špatnou prognózu s mediánem přežití 12 měsíců [12].
Primární chirurgická léčba u metastatického onemocnění je vyhrazena jen pro nemocné s krvácením a obstrukcí [20, 24]. V několika institucích probíhají klinické studie sledující výsledky léčby u nemocných s metastatickým GISTem po neoadjuvanci inhibitory tyrozinkinázy s následným cytoredukčním výkonem a následnou biologickou léčbou [29].
Radiofrekvenční ablace a/nebo chemoembolizace jaterních metastáz je možným paliativím řešením u nemocných se selháním biologické léčby. Transplantace jater není doporučována [13].
Standardem léčby metastatické nemoci či recidivujího onemocnění je inhibitor tyrozinkináz imatinib mesilát (Glivec®), s léčebnou odpovědí mezi 60–70 % [26, 27]. Je indikován k léčbě pacientů s neradikální resekcí GISTu i nemocných s lokalizovaným onemocněním, jejichž celkový stav neumožňuje podstoupit chirurgický zákrok. Dlouhodobé výsledky léčby imatinibem nejsou k dispozici, ale ve velkých souborech léčených nemocných nebyl po 2 letech stanoven medián přežití [26, 27].
Pro pacienty s intolerancí či rezistencí na imatinib je k dispozici 2. linie biologické léčby sunitinib malát (Sutent®) [30, 31].
V současné době je otázkou adjuvantní podávání imatinib mesilátu u nemocných po radikální operaci. Ve studii ACOSOG Z9000 (9/2001–9/2003) bylo zařazeno 106 pacientů po radikálním chirurgickém odstranění nádoru a byl pozorován přínos z adjuvantní léčby. Do pokračovací studie ACOSOG Z9001 bylo zařazeno 708 pacientů po radikální resekci GIST s velkým rizikem agresivního chování a tumorem větším než 3 cm. Po vyhodnocení jednoročního přežití bez relapsu onemocnění (RSF – relaps-free survival) byl pozorován prospěch pacientů s adjuvantní léčbou imatinibem [28].
Soubor našich pacientů není velký, ale dosažené výsledky jsou srovnatelné se závěry v publikovaných klinických studiích [2, 20, 21, 22, 23]. K vyhodnocení dlouhodobého přežívání bude zapotřebí delšího časového intervalu. Vzhledem k malé frekvenci výskytu tohoto onemocnění a potencionální malignitě je třeba tyto pacienty racionálně centralizovat v onkochirurgických centrech.
ZÁVĚR
Gastrointestinální stromální tumory (GIST) jsou skupinou nádorů, kde v důsledku objevů v poslední dekádě proběhl bouřlivý vývoj jak v diagnostice, tak i v možnostech efektivní léčby. Pochopení podstaty onemocnění na úrovni molekulární biologie vedlo k zavedení cílené léčby zlepšující prognózu nemocných s GIST. Chirurgická léčba je základním prvkem v léčení lokalizované formy nemoci, zatímco u metastatického onemocnění je paliací pro nemocné s krvácením a obstrukcí. Léčba inhibitory tyrozinkinázy je standardem terapie metastatické nemoci či recidivujího onemocnění. Adjuvantní podávání Imatinibu mesilátu u nemocných po radikální resekci je přínosem v komplexní terapii GISTů.
MUDr. Radek Pohnan
U Vojenské nemocnice 1200
169 21 Praha 6 - Střešovice
e-mail: Radek.Pohnan@uvn.cz
Sources
1. Nilsson, B., Bumming, P., Meis-Kindblom, J. M., Odén, A., Dortík, A., Gustavsson, B., Sablinska, K., Kindblom, L. G. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era – a population based study in western Sweden. Cancer, 2005; 103 : 821–829.
2. Kindblom, L. G., Meis-Kindblom, J. M., Bümming, P. Incidence, prevalence, phenotype and biologic spektrum of gastrointestinal stromal cell tumors (GIST): a population-based study of 600 cases. Ann. Oncol., 2002; 13 : 157.
3. Mazur, M. T., Clark, H. B. Gastric stromal tumours. Reappraisal of histogenesis. Am. J. Surg. Pathol., 1983; 7 : 507–519.
4. Kindblom, L. G., Remotti, H. E., Aldenborg, F., Meis-Kindblom, J. M. Gastrointestinal Pagemaker cell tumor (GIPACT): Gastrointestinal stromal tumors show phenotypic characteristics of the intestinal cells of Cajal. Am. J. Pathol., 1998; 30 : 1213–1220.
5. van der Zwan, S. M., Dematteo, R. P. Gastrointestinal stromal tumor: 5 years later. Cancer, 2005; 104 : 1781–1788.
6. Miettinen, M., Monihan, J. M., Sarlomo-Rikala, M., et at. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: Clinicopathologic and immunohistochemical study of 26 cases. Am. J. Surg. Pathol., 1999; 23 : 1109–1118.
7. Mendosa-Marin, M., Hoang, M. P., Albores-Saavedra, J. Malignant stromal tumor of the gallblader with intestinal cell sof Cajal phenotype. Arch. Pathol. Lab. Med., 2002; 126 : 481–483.
8. Daum, O., Klecka, J., Ferda, J., et al. Gastrointestinal stromal tumor of the pankreas: case report with documentation of KIT gene station. Wirchows arch., 2005; 446 : 470–472.
9. Lasota, J., Carlsson, J. A., Miettinen, M. Spindle cell tumor of urinary bladder serosa with phenotypic and genotypic features of gastrointestinal stromal tumor. A clinical report with documentation of KIT expression and mutation. Arch. Pathol. Lab. Med., 2000; 124 : 894–897.
10. Ceballos, K. M., Francis, J. A., Mazurka, J. L. Gastrointestinal stromal tumor presenting as a recurrent vaginal mass. Arch. Pathol. Lab., 2004; 128 : 1442–1444.
11. Din, O. S., Woll, P. J. Treatment of gastrointestinal stromal tumor: focus on imatinib mesylate. Therapeutics and clinical risk man. 2008; 4 : 149–162.
12. Bucher, P., Villiger, P., Egger, J. F., Buhler, L. H., Morel, P. Management of gastrointestinal stromal tumours: from diagnosis to treatment. Swiss Med. Wkly., 2004; 134 : 145–153.
13. Daum, O., Vaněček, T., Šíma, R., Michal, M. Gastrointestinal stromal tumor: update. Klinická Onkologie, 2006; 19 : 203–211.
14. Corless, C. L., Fletcher, J. A., Heinrich, M. C. Biology of gastrointestinal stromal tumors. J. Clin. Oncol., 2004; 22 : 3813–3825.
15. Sarlomo-Ricala, M., Kovatich, A. J., Barusevicius, A., Miettinen, M. CD 117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD 34. Mod. Pathol., 1998; 11 : 728–734.
16. Miettinen, M., Majidi, M., Lasota, J. Pathology and diagnostic kriteria of gastrointestinal stromal tumors (GISTs): a review. Eur. J. Cancer, 2002; 38: S39–S51.
17. Fletcher, C. D. M., Berman, J. J., Corles, C., at al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum. Pathol., 2002; 33 : 459–465.
18. Emory, T. S., Sobin, L. H., Lukes, L., et al. Prognosis of gastrointestinal smoot-muscle (stromal) tumors: dependance on anatomic site. Am. J. Surg. Pathol., 1999; 23 : 82–87.
19. Miettinen, M., Lasota, J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Wirchows arch., 2001; 438 : 1–12.
20. De Matteo, R. P., Lewis, J. J., Leung, D., Mudan, S. S., Woodruff, J. M., Brennan, M. F. Two hundred gastrointestinal stromal tumours: recurrence patterns and prognostic factors for survival. Ann. Surg., 2000; 231 : 51–58.
21. Roberts, P., Eisenberg, B. Clinical presentation of gastrointestinal stromal tumours and treatment of operable disease. Eur. J. Cancer, 2002; 38: S37–38.
22. Rutkowski, P., Debiec-Rychter, M., Nowecki, Z. I., et al. Different factors are responsible for predicting relapses after primary tumors resection and for imatinib treatment outcomes in gastrointestinal stromal tumors. Med. Sci. monit., 2007; 13: CR515–522.
23. Hassan, I., You, Y. N., Shyyan, R., et al. Surgically managed gastrointestinal stromal tumors: a komparative and prognostic analysis. Ann. Surg. Oncol., 2007; 15 : 52–59.
24. Eilber, F. C., Rosen, G., Foscher, C., et al. Recurrent gastrointestinal stromal sarcomas. Surg. Oncol., 2000; 9 : 71–75.
25. Heinrich, M. C., Griffith, D. J., Druker, B. J., et al. Inhibition of c-kit receptor tyrosine kinase aktivity by STI 571, a selective tyrosine kinase inhibitor. Blood, 2000; 96 : 925–932.
26. Demetri, G. D. Identification and treatment of chemoresistant inoperable or metastatic GIST: experience with the selective tyrosin kinase inhibitor imatinib mesilate (STI 571). Eur. J. Cancer, 2002; 28: S52–59.
27. Demetri, G. D., von Mehren, M., Blanke, C. D., et al. Efficiacy and safety of imatinib mesilate in advanced gastrointestinal stromal tumours. N. Engl. J. Med., 2002; 347 : 472–480.
28. De Matteo, R., Owzar, K., Maki, R., et al. Adjuvant imatinib mesylate increases recurrence free survival (RFS) in patients with completely resected localized primary gastrointestinal stromal tumor (GIST): North American Intergroup Phase III trial ACOSOG Z9001. Proc. Am. Soc. Clin. Oncol., 2007; Abstract No 10079.
29. Raut, C. P., De Matteo, R. P. Prognostic Factors for primary GIST: prime time for pesonalized therapy? Ann. Surg. Oncol., 2007; 15 : 4–6.
30. Heindrich, M. C., Maki, R. G., Corless, C. L., et al. Sunitinib response in imatinib-resistant GIST correlates with KIT and PDGFR mutation status. J. Clin. Oncol., 2006; 24(Suppl): 9502.
31. Demetri, G. D., van Oosterom, A. T., Garrett, C. R., et al. Efficacy and safety of sunitinib in patients with advanced gastointestinal stromal tumor after failure of imatinib: a randomised controlled trial. Lancet, 2006; 368 : 1329–1338.
32. Hirota, S., Isozaki, K., Moriyama, Y., et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science, 1998; 279 : 577–580.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 11-
All articles in this issue
- Endovaskulární léčba spontánního hemotoraxu u neurofibromatózy I. typu
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Endoskopický odběr v. saphena magna – výskyt ranných komplikací
- Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
- Prodloužená profylaxe tromboembolické nemoci u pacientů po chirurgické resekci kolorekta pro malignitu
- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Peritonitidy způsobené perforací trávicí trubice – analýza gerontologické skupiny pacientů
- Transplantace tenkého střeva v experimentu
- Hybridní NOTES cholecystektomie transgastrickým a transrektálním přístupem v experimentu
- Laparoskopická chirurgie karcinomu rekta – dlouhodobé výsledky
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Karcinom prsu u nemocné po transplantaci ledviny – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

