-
Medical journals
- Career
Aortální alograft (homograft) v léčbě chlopenních srdečních vad dospělých s důrazem na léčbu infekční endokarditidy aortální chlopně
Authors: A. Mokráček 1; J. Špatenka 2; M. Šulda 1; F. Toušek 1; H. Pospíšilová 1; M. Vambera 1; M. Šetina 2; L. Pešl 1
Authors‘ workplace: Kardiocentrum Nemocnice České Budějovice, ředitel MUDr. Ladislav Pešl 1; Transplantační centrum a oddělení kardiovaskulární chirurgie Kardiovaskulárního centra FN Motol, Praha, přednosta prim. MUDr. Jaroslav Špatenka, CSc. 2
Published in: Vnitř Lék 2007; 53(1): 54-62
Category: Reviews
Overview
Po 40 letech intenzivního vývoje chlopenních protéz není k dispozici ideální náhrada lidské chlopně. Jednou z alternativ zůstává aortální alograft, který může být použit zejména k náhradě aortální či pulmonální chlopně. Tato biologická protéza je stále diskutována z aspektu zpracování tkáně (Tissue Banking) i z aspektu klinického použití - tedy chirurgické techniky implantace a dlouhodobých výsledků. Aktuální zůstává zejména implantace do aortální pozice. Autoři diskutují užití aortálního alograftu v léčbě infekční endokarditidy aortální chlopně, které je celosvětově rozšířeno a uznáváno. Implantace aortálního alograftu je na řadě pracovišť pokládána za metodu volby v této indikaci, zejména u protézové aortální endokarditidy a u endokarditidy destruující výtokový trakt levé komory srdeční. Metoda je sice technicky náročnější než implantace klasických chlopenních protéz (mechanických i biologických), ale literární údaje i vlastní zkušenosti autorů jsou speciálně v této indikaci velmi povzbudivé. Aortální alotransplantáty jsou v naší zemi trvale dostupné.
Klíčová slova:
endokarditida - aortální chlopeň - aortální alograft - aortální homograftÚvod
Během posledních 60 let se chirurgická léčba vad srdečních chlopní posunula od teoretických úvah do rutinní medicíny. Ani po 40 letech vývoje však nemáme k dispozici ideální chlopenní náhradu, tedy bezpečný jednocestný ventil, který by se technicky snadno implantoval, nepoškozoval by krevní elementy, byl netrombogenní, napodoboval by reologii nativní lidské chlopně a fungoval neomezeně dlouho. Prakticky od samého začátku jsou paralelně vyvíjeny chlopenní protézy mechanické (z ušlechtilých kovů, grafitu a umělých hmot) a biologické - xenotransplantáty z tkání zvířat (především hovězí a prasečí) a alotransplantáty (homografty) z lidské kadaverózní tkáně. Zvláštní skupinu biologických chlopní tvoří autotransplantáty (autologní plicnice pacienta může být použita k náhradě jeho vlastní aortální či mitrální chlopně).
Aortální alograft může být teoreticky použit k náhradě aortální, pulmonální, raritně i mitrální či trikuspidální chlopně. Tato specifická biologická protéza je stále diskutována z aspektu zpracování tkáně (Tissue Banking) i z aspektu klinického použití - tedy chirurgické techniky implantace a dlouhodobých výsledků. Aktuální zůstává zejména implantace do aortální pozice. Autoři diskutují literární i vlastní zkušenosti s použitím aortálního alograftu k náhradě aortální chlopně, zejména u nemocných s infekční endokarditidou aortální chlopně. Autoři diskutují literární i vlastní zkušenosti s použitím aortálního alograftu k náhradě aortální chlopně.
První kadaverózní lidskou tkáň použil v klinické praxi Robert E. Gross [1] v roce 1947 (alogenní arteriální štěp v léčbě cerebrovaskulárních onemocnění). V roce 1952 Lam a jeho kolegové poprvé představili koncept implantace lidské alogenní chlopně [2].
Rozvoj chirurgie s použitím alograftů (homograftů) se ve světě rozvíjel od konce 50. let 20. století a zasadili se o něj takové veličiny kardiochirurgie jakými jsou Donald Ross, Sir Magdi Yacoub, Carlos Duran, Brian Barrat-Boyes, Mark O’Brien a další.
Je nutno zdůraznit, že mluvíme-li o užití alogenní lidské tkáně v chlopenní chirurgii, máme na mysli zejména alografty aortální a pulmonální. V současnosti jsou alogenní chlopenní štěpy nejčastěji užívány v chirurgii vrozených srdečních vad v dětském a juvenilním věku, ale užití nalézají i v kardiochirurgické léčbě dospělých nemocných. Základní indikací pro použití aortálního alograftu u dospělých je infekční endokarditida aortální chlopně, což je nosné téma tohoto sdělení.
K průkopníkům kardiochirurgie s použitím chlopenních alograftů patřil M. Hubka (Bratislava), jehož pionýrské experimentální práce i klinické použití jsou dosud po zásluze citovány [3,4]. Aplikace této chirurgické metody v Čechách a na Moravě byla pomalejší a o její rozšíření se v 80. letech minulého století zasadili zejména Bohumil Hučín, Bohuslav Fišer a Jaroslav Špatenka, který v roce 1980 od Donalda Rosse (Londýn) dostal kompletní protokol pro odběr a zpracování aortálních alograftů. V roce 1991 potom založil specializovanou tkáňovou banku, která alogenní srdeční chlopně pro celou Českou republiku nabízí. Jaroslav Špatenka je i současným přednostou transplantačního centra FN Motol, Praha, jehož součástí je i tato specializovaná tkáňová banka. Způsob odběru, zpracování a dlouhodobého uskladnění byly popsány dříve [5,6].
Mezi obecné výhody, kterými se může aortální alograft použitý k náhradě aortální chlopně (ve srovnání s mechanickou a/nebo biologickou protézou) „pyšnit“ patří:
- Maximální možná (téměř fyziologická) EOA (Effective Orifice Area), která je srovnatelná s nativní chlopní, ev. pulmonálním autografem a současně výrazně větší než všechny používané stentované i bezstentové chlopně.
- Má potenciál „dilatace anulu“ a zvětšení EOA v případě zvýšených nároků na srdeční výdej (CO) - např. při zátěži.
- Je minimálně trombogenní, a není proto nutná žádná antikoagulační či antiagregační medikace.
- Je naprosto nehlučný.
- Je relativně odolný proti infekci.
Zejména poslední bod, relativní rezistence k infekci, je pro nás v tuto chvíli velmi zajímavý. Tato rezistence není dána schopností zbavit se infekce aktivně - tuto schopnost nemají žádné „avitální“ (resp. diskutabilně vitální) tkáně, mezi které alograft rovněž patří. Částečná odolnost k infekci souvisí jednak s optimální reologií, tedy minimálními turbulencemi na chlopni (alograftu) a jednak minimem syntetického (a tím pádem na infekci citlivého) materiálu v kontaktu s krví nemocného. Další výhodou aortálního alograftu v léčbě infekce aortální chlopně je flexibilita jeho použití - ten je totiž odebírán od dárce obvykle s obloukem aorty a předním cípem mitrální chlopně - tzn., že operatér má téměř vždy dostatek materiálu, který je možno využít při rekonstrukcích kořene aorty a výtokového traktu levé srdeční komory. Tím pádem lze být maximálně agresivní při debridementu infikované oblasti a zbavit nemocného veškeré, zjevně i suspektně infikované tkáně.
Vedle výhod má ale použití alograftu i své nevýhody:
- Limitovaná životnost (zejména u velmi mladých nemocných lze s vysokou pravděpodobností očekávat rozvoj degenerativních změn, které mohou vyústit až v potřebu nové náhrady).
- Vyšší technickou náročnost implantace.
- Limitaci v dostupnosti (danou počtem dárců a dostupností tkáňové banky), což neplatí v naší zemi.
Základní terminologie, používaná při diskusi o původu a zpracování chlopenních štěpů:
Alogenní (homologní) tkáň v biologii znamená tkáň stejného živočišného druhu. Alograftem (homograftem) tedy rozumíme štěp, odebraný od dárce (člověka), určený k implantaci příjemci (rovněž člověku).
Homovitální chlopeň je chlopeň odebraná za sterilních podmínek během srdeční transplantace (příjemci srdce, tedy žijícímu dárci) nebo kadaveróznímu dárci v rámci multiorgánového odběru po stanovení mozkové smrti. Tato, dále prakticky neošetřená tkáň bývala zhruba do 48 hodin transplantována příjemci.
Antibioticky sterilizovaná chlopeň (tzv. čerstvá - „fresh“ - chlopeň) je chlopeň odebraná při sekci z kadaverózního dárce do 48 hodin po smrti nebo častěji v rámci multiorgánového odběru po stanovení smrti mozku podle platné legislativy [12]. Chlopeň je poté sterilizována směsí antibiotik (obvykle 24 hodin při teplotě 37 °C) a následně skladována po dobu maximálně 6 týdnů při teplotě 1-10 °C .
Kryoprezervovaná chlopeň je chlopeň, která je po sterilizaci antibiotiky (viz bod c) kontrolovaně mražena (řízeným poklesem teploty ve tkání rychlostí -1 ºC/min (řízeným poklesem teploty ve tkání rychlostí -1 ºC/min) v roztoku 10% dimetylsulfidoxidu (DMSO) až na teplotu tekutého dusíku ( - 196 ºC) a následně skladována po dobu až 5 let při teplotě nižší než -140 ºC.
V klinické praxi je terminologicky aortální alograft a aortální homograft identický, a stejně tak tento termín promiskue používají tkáňoví bankéři. Lingvisticky však tyto termíny shodné nejsou, allo - znamená ‚jiný, odlišný‘ - v našem případě míněno odlišný jedinec stejného druhu a homo - znamená ‚stejný‘ - zde ve významu stejný druh - člověk. V naší práci preferujeme termín aortální alograft.
Léčba infekční endokarditidy aortální chlopně implantací aortálního alograftu - indikace a chirurgická technika
Léčba infekční endokarditidy se v České republice řídí doporučeními České kardiologické společnosti, která budou v nejbližší době inovována. V tomto sdělení se nebudeme zabývat obecnými principy diagnostiky a léčby infekční endokarditidy, ale zaměříme se pouze na případy infekční endokarditidy aortální chlopně, které již jsou indikovány k operační léčbě.
Základem úspěchu chirurgické léčby infekční endokarditidy nativní či umělé chlopně v aortální pozici je:
- Včasná (ale ne překotná) indikace k chirurgické intervenci v době, kdy je nemocný nejenom lokálně, ale i celkově na operaci optimálně připraven, kdy nejsou ještě rozvinuty dysfunkce ostatních orgánů atd.
- Kompletní odstranění veškeré infikované tkáně (radikální debridement aortálního anulu, případně i okolních, třeba i jen okrajově nebo pravděpodobně infikovaných tkání).
- Adekvátní antibiotická léčba (správná volba, dávkování a délka užívání kombinace antibiotik).
Už vlastní indikace k operačnímu řešení infekce nativní chlopně či protézy je ale problematická a diskutabilní. Protože rozbor těchto indikačních kritérií by učinil tento článek nepřehledným, přinášíme zde jenom přehled indikací, převzatý z Guidelines ESC (European Society of Cardiology) [7].
Indikace k operaci při nativní valvární aortální endokarditidě (NVE):
- městnavé srdeční selhávání ve vztahu ke stupni progrese nedomykavosti
- přetrvávání infekce/sepse více než 7-10 dní při adekvátní antibiotické léčbě
- lokálně nebo systémově nekontrolovatelná infekce
- agresivní a obvykle konzervativně špatně reagující typ mikroorganizmu, který infekci vyvolává (houby, Brucella sp., Coxiella sp., Staphylococcus lugunensis, Enterococcus sp., gramnegativní mikroorganizmy)
- morfologie vegetací a přítomnost periferních embolizačních příhod (zejména opakovaných)
- neurologické komplikace (zejména embolizačního charakteru)
Indikace k operaci při protézové aortální endokarditidě (PVE):
- časná PVE (do 1 roku od předchozí operace)
- hemodynamicky významná prostetická dysfunkce
- perivalvární expanze
- perzistující infekce (více než 7-10 dní) při adekvátní antibiotické léčbě
- rekurentní embolizace navzdory adekvátní antibiotické léčbě
- infekce organizmy špatně reagujícími na antibiotickou léčbu (viz výše)
- destruktivní vegetace
Jsou-li respektovány tato operační zásady (indikace i operační pravidla), je v principu možno pomýšlet na jakýkoliv typ chlopenní náhrady. V případě progrese infekce do okolních tkání (což je zejména u reoperací z předoperačního ultrazvukového vyšetření často obtížné stanovit) či destrukce výtokového traktu levé komory je obvykle potřeba, vedle náhrady vlastní aortální chlopně, uzavřít i patologické komunikace a nahradit kořen aorty, či dokonce rekonstruovat výtokový trakt levé komory. Právě v těchto případech se pak jeví aortální alograft jako velmi vhodná, možná nejlepší, varianta. Nicméně existují důvody pro použití aortálního alograftu i při izolovaném postižení nativní aortální chlopně (viz výše, viz níže).
Rozhodne-li se chirurg použít aortální alograft, je jedním z prvních problémů, které musí vyřešit, volba operační techniky (debridement infikované chlopně i anulu a implantace štěpu). V zásadě existují 3 možnosti implantace aortálního alograftu:
- subkoronární technika (tzv. „free hand“)
- inkluzní technika (tzv. „miniroot“)
- náhrada kořene aorty (tzv. „root technika“)
Ad 1. subkoronární - tzv.„free hand“ - technika (obr. 1) představuje původní metodu, kterou vypracovali v laboratoři Duran a Gunning v Oxfordu. První ji v klinice aplikoval Heimbecker v Torontu v roce 1962 s krátkodobým přežitím. Ve stejném roce provedl a publikoval náhradu aortální chlopně aortálním alograftem Ross [8]. Nezávisle na něm ji vyvinul a o týden později i uskutečnil Barrat-Boyes v Aucklandu [9]. U nás tuto techniku zavedl Špatenka v roce 1994.
Image 1. Subkoronární technika, tzv. „free hand“. 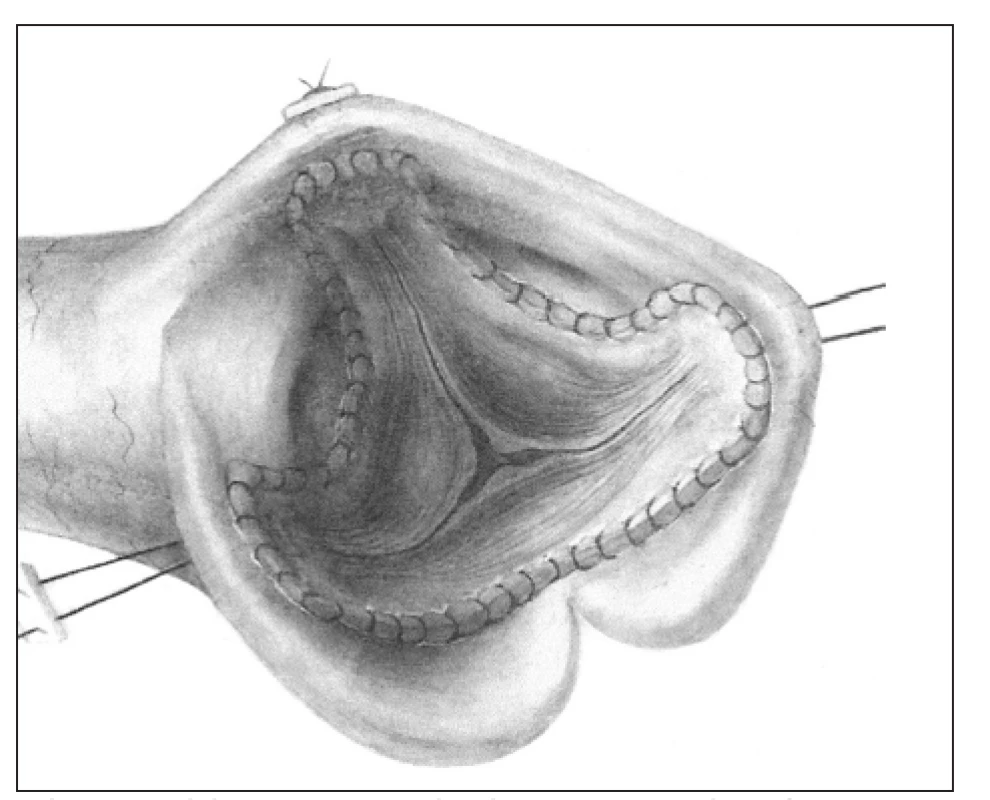
Štěp je k implantaci upraven odstřižením tkáně kolem anulu pod úponem cípů chlopně a také aortálních sinů kolem komisur nad úponem cípů. Zbude nám pouze semilunárně obkroužená vlastní aortální chlopeň s asi 5mm lemem z kořene aorty, který slouží k přišití. Takto upravený aortální štěp se všívá do nativní aorty ve 2 vrstvách. Proximální anastomózu představuje našití vtokové části štěpu, tvořené lemem komory kolem anulu dárce do anulu příjemce. Distální anastomóza kopíruje cípy původní vystřižené chlopně dárce a kotví je i s komisurami do kořene příjemce - je tedy pod koronárními tepnami. Tato technika je velmi náročná na prostorovou představivost a předpokladem úspěchu je vytvoření kořene příjemce rozměry i geometrií odpovídající kořeni dárce. Na přesnosti kopie kořene aorty dárce štěpu potom závisí dlouhodobý výsledek rekonstrukce.
Ad 2. inkluzní technika - tzv. „mini root“ (obr. 2) je technika, kterou také zavedl již Donald Ross. Štěp je k implantaci upravován minimálně, ponechává se jako kořen a celý je všit do aorty příjemce, která je následně přes alograft v plném rozsahu přešita. Koronární tepny dárcovského kořene jsou odstřiženy a do otvorů jsou implantována koronární ústí příjemce. Aortální terčíky věnčitých tepen příjemce se nevystřihují.
Image 2. Inkluzní technika, tzv. „mini root“. 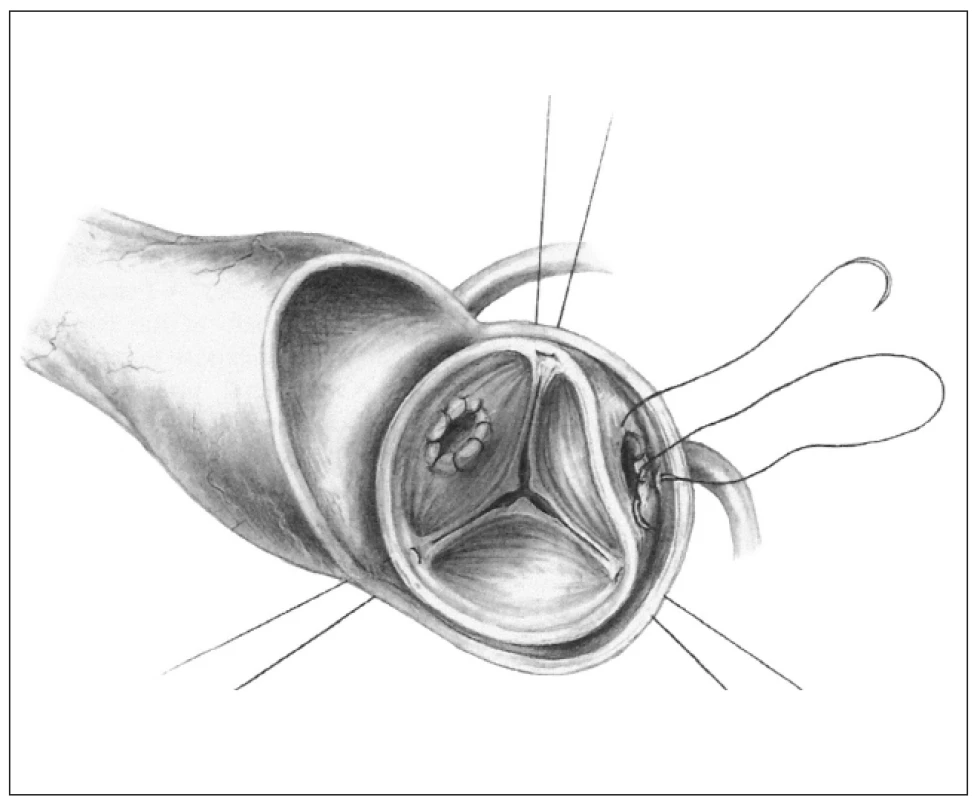
Ad 3. Celý kořen - „full root“ (obr. 3) - tuto techniku použil prvně k náhradě celého kořene aorty opět Ross v roce 1972 [10], u nás zavedl v roce 1994 Špatenka. Tato metoda implantace je dnes nejrozšířenější a její obliba stále stoupá, zejména proto, že je nejlépe reprodukovatelná. Příjemci je transplantován celý kořen dárce tak, jak fungoval před odběrem. Nemocnému je vytnuta postižená aortální chlopeň a veškerá, byť jen suspektně infikovaná tkáň. Dále jsou vystřiženy i terčíky věnčitých tepen příjemce. Následně je aortální alograft jako celý kořen implantován ortotopicky. Centrální anastomóza štěpu je našita end to end na výtokový trakt levé komory srdeční a periferní anastomózou je graft napojen na ascendentní aortu pacienta, také end to end technikou. Mobilizované terčíky koronárních tepen příjemce jsou následně bez napětí implantovány na původní ale někdy náhradní místo kořene nové aorty.
Image 3. Technika implantace celého kořene, tzv. „full root“. 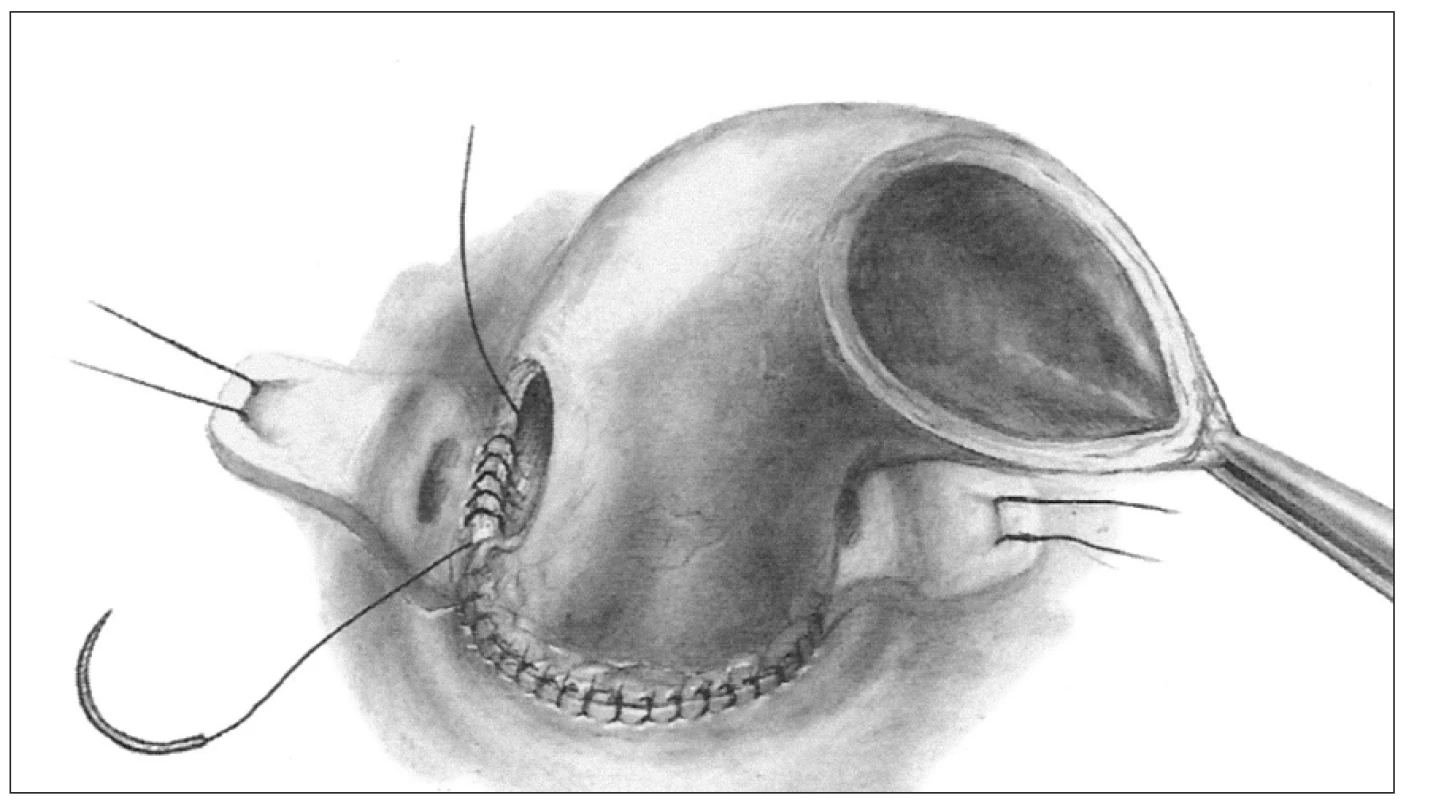
Podstatným problémem ve vztahu k jednotlivým chirurgickým technikám ale zůstává, že nebylo jednoznačně (prospektivní, randomizovanou a dostatečně velikou studií) prokázáno, že některý typ z protéz používaných k náhradě aorty dává lepší dlouhodobé výsledky než typ jiný. Diskuse na toto téma zůstává aktuálním literárním tématem, stejně jako oblíbeným tématem kongresů a konferencí. S ohledem na problémy, které by konstrukce takovéto imaginární studie přinesla je jen velmi málo pravděpodobné, že bude kdy takováto studie postavena.
Diskuse
Jednotlivé výše popsané operační techniky mají své výhody a úskalí:
Po optimálně provedené náhradě aortální chlopně dvouvrstevnou subkoronární technikou (tzv. „free hand“ - obr. 1) je zachována ideální anatomie chlopně dárce, což znamená po operaci optimální reologii v těle příjemce. Zakotvení štěpu do anulu a koronárních sinů příjemce zachovává fyziologickou funkci kořene aorty příjemce, který svoji elasticitou snižuje mechanickou zátěž cípů a komisur štěpu v diastole. Určitou výhodou, zejména při reoperaci je zachování stěny nativní aorty příjemce. Na rozdíl od devitalizované stěny alograftu nekalcifikuje, ale zůstává elastická a pevná. Technicky velmi náročné je použití této metody při primárně dvojcípé aortální chlopni. Ta, díky patologické turbulenci, bývá často podkladem pro nativní infekční endokarditidu v této lokalizaci (viz výše). Eliminaci dilatace sinotubulární junkce u subkoronární techniky nabízí její modifikace s ponecháním nekoronárního sinu dárcovské aorty a jeho všití do aorty příjemce inkluzně. Toto posiluje nekoronární sinus jako takový (jde o nejčastější a nejranější místo dilatace ascendentní aorty) a zároveň stabilizuje sinotubulární junkci tím, že fixuje obě krajní komisury nekoronárního cípu v původním vztahu dárce. Ve vztahu k operacím infekční destrukce aortálního anulu má ale „free hand“ technika ještě jednu podstatnou nevýhodu - jen velmi obtížně umožňuje dodržet nutnou radikalitu. Nutí nás být příliš „konzervativní“ při exkluzi paraanulárních abscesů, či při řešení aortomitrální diskontinuity, což je jedna ze základních chirurgických chyb v léčbě infekční endokarditidy. Proto tuto techniku v léčbě infekční endokarditidy, až na vzácné výjimky, stejně jako většina současných autorů nedoporučujeme.
Při použití inkluzní techniky náhrady chlopně a kořene aorty (tzv. „mini root“ - obr. 2) je dvojitá vrstva aortální stěny v oblasti sinusů dobrým stabilizujícím prvkem a prevencí následné dilatace. Výhodou oproti předešlé technice je snadné zachování anatomie kořene dárce, což dává předpoklady pro jeho dobrou funkci. Na druhou stranu je všitá tkáň do aorty příjemce vždy určitým potenciálem pro turbulence a gradient (menší EOA). Tato technika má tři větší nedostatky. Prvním je nutnost všívat koronární tepny do alograftu podle rozložení příjemce což může být zejména u dvojcípé chlopně problém. Koronární tepny pak mohou být pod napětím zúženy nebo mohou místa sutur krvácet - riziko nepravé výdutě. Druhým nedostatkem je relativně veliké riziko rotace distální oproti periferní anastomóze, což může vézt k nedomykavosti a selhání funkce štěpu. Poslední slabinou této techniky je závislost na naprosto ideálním změření a odhadnutí rozměrů kořene dárce, a tím optimální výběr adekvátního alograftu. Této dokonalosti a výběru „identického“ kořene, ale brání to, že:
- a. poměry při infekci mohou být zkresleny paraanulárními abscesy, anulárními diskontinuitami a původní rozměr anulu se odhaduje z rozměru výtokového traktu levé komory (cave při hypertrofii septa LK),
- b. jen obtížně se definuje přesná tloušťka stěny alograftu (ta je individuální),
- c. rozměry a vztahy anulu, sinů a junkce jsou rovněž individuální a těžko nalézáme dva stejné kořeny. Při této technice se navíc jen svízelně přesně redukuje rozměr aorty příjemce.
Z vlastní zkušenosti víme, že splnit standardně všechny tato podmínky je ve 100 % nereálné, a proto ani hemodynamický výsledek není často optimální. Vznikají turbulence, určité „zkrabacení“ cípů a další „nepřesnosti“ - to vše vede k většímu riziku rychlejší degenerace. Inkluzní technika není výrazně rozšířena, ale v rukách zkušeného týmu může fungovat velmi dobře.
Největší předností náhrady celého kořene (tzv. „full root“ - obr. 3) je fakt, že implantovaná chlopeň je našita zcela fyziologicky a koronární tepny jsou implantovány bez napětí v optimální lokalizaci. Největší slabinou je pak skutečnost, že devitalizovaná část aorty dárce je jedinou zevní oporou krevnímu toku s vyšším potenciálem následné dilatace zejména při delším přetrvávání vysokého krevního tlaku pooperačně. Rovněž případná reoperace je někdy velmi složitá, zejména je-li jejím důvodem kompletní zvápenatění celého alograftu. Pro léčbu infekční endokarditidy je však tato technika ideální - umožňuje nám velmi dobře exkludovat a řešit všechny diskontinuity anulu, anulární i subanulární abscesy či případné extra - a intrakardiální patologické komunikace apod.
Samostatnou otázkou problematiky chirurgické léčby infekční endokarditidy zůstává léčba vlastní infekce chlopně, ev. dalších primárních nebo sekundárních ložisek. Jedná se především o strategii podávání antibiotik, a to jak z hlediska typu (resp. kombinace), tak délky a cesty podávání. Vše je dopodrobna řešeno v nových doporučeních České kardiologické společnosti (ČKS), které jsou v tuto chvíli v oponentském řízení na internetových stránkách ČKS a doufáme, že budou velmi brzy v definitivní podobě zveřejněny [22]. Zásadnější změnou těchto nových doporučení ČKS oproti předchozím je indikace k operaci v akutním stadiu choroby. Neznáme-li infekční agens, je důležité podat předoperačně vysokou dávku baktericidních, širokospektrých antibiotik, nejlépe 24-48 hodin před operací a definitivně tuto léčbu upravit po vyhodnocení mikrobiologického vyšetření peroperačních vzorků. Správná volba spektra antibiotik musí vycházet ze spolupráce s infektology a ATB-centry a odpovídat klinice onemocnění (lokalizace primárního infektu, stav pacienta, známky nežádoucích účinků podávaných antibiotik apod). Rovněž je nutno podle kliniky modifikovat délku aplikace ATB - kupříkladu hodnoty CRP jsou pooperačně výrazně ovlivněny celkovou zánětlivou reakcí (nutno porovnávat a hodnotit např. ve vazbě s hladinu prokalcitoninu apod). Délka podávání ATB může být výrazně ovlivněna souběžným léčením primárního infektu - například některé torpidní osteomyelitidy si mohou vyžádat i několikaměsíční léčbu a některé případy chronické a neeradikovatelné bakteriemie i doživotní podávání ATB. Vždy je však nutno mít na paměti negativní dopady podávání ATB a strategii léčby každého nemocného individualizovat.
Nezodpovězenou otázkou rovněž zůstává problém, zdali i při náhradě chlopně alograftem je nutnost podávat ATB stejným způsobem jako při užití komerčních chlopenních protéz, či zda je možno tento proces zkrátit bez rizika zvýšení reinfekce (s ohledem na nežádoucí účinky dlouhodobého podávání antibiotik).
Z chirurgického hlediska je v léčbě infekční endokarditidy aortální chlopně nepochybně zásadní odstranění veškeré infikované tkáně. Platí to pro postižení nativní chlopně a zejména pro endokarditidu na chlopenní protéze. Blumberg et al [19] ve své práci rozebírají fakt, že přesah infekce - paraprosteticky - na aortální stěnu, myokard, apod. - je patrný v 56-100 % případů prostetické endokarditidy. Jinými slovy prosté odstranění infikované protézy neodstraní veškerou infekci, a to ani v případech, kdy se tkáň zdá „čistá“. Důvodem je asi skutečnost, že primárním místem infekce protézy je šicí prstenec, a ten je v úzkém kontaktu s anulem a perianulární tkání. Toto pozorování podporuje agresivní resekování tkání v případech prostetické infekční endokarditidy a následně nutnost náhrady chlopně i jejího kořene.
Jak již bylo zmíněno výše, je použití alograftů v léčbě infekce aortální chlopně i součástí nejnovějšího vydání doporučení Evropské kardiologické společnosti [7]. Jedna z nejpodstatnějších změn, která se v guidelines odráží, je totiž důraz na včasnost operačního řešení (v indikovaných případech) i ještě „nezhojené infekce“. Tato změna je vedena snahou předejít lokální devastaci vlastní chlopně i celkovým komplikacím vyplývajícím z infekce chlopně v případě, že konzervativní léčba bude s vysokou pravděpodobností neúčinná. Zejména v těchto případech (akutní a subakutní operace) může mít relativní rezistence chlopenní náhrady na infekci veliký význam. Jistou „rezistenci vůči reinfekci“ dává ideální reologie kořene aorty po operaci, tedy ideální laminární tok štěpem v systole s „fyziologickým“ mechanizmem uzávěru cípů v diastole a usměrněním toku krve do ústí věnčitých tepen. Při některých typech zpracování štěpu se na rezistenci proti infekci může podílet i zachovaná „vitalita“ tkáně štěpu, tedy zachovaná viabilita fibrocytů štěpu (především u homovitálních chlopní a u ideálně zpracovaných kryoprezervovaných štěpů).
Závěry, které se v těchto doporučeních odráží, jsou výsledkem mnoha předchozích studií a pozorování a navazují rovněž na celou řadu osobních zkušeností předních světových chirurgů. Rozsah odkazů je tak obsáhlý, že jejich kompletní rozbor zcela překračuje možnosti tohoto sdělení. Proto jsme se pokusili diskutovat jen některá z těch, které považujeme za zásadní.
Jedna z prvních prací, která se zabývala srovnáním jednotlivých chlopenních náhrad při léčbě endokarditidy aortální chlopně spojené s její dysfunkcí, byla multicentrická studie prezentována již v roce 1992 Haydockem et al [13]. Autoři hodnotí soubor 108 nemocných s aktivní endokarditidou (z celkového počtu 348 nemocných operovaných pro endokarditidu v letech 1965-1984). Použili alograft, xenoprotézy Hancock a Carpentier Edwards a mechanické protézy Starr-Edwards a Bjork-Shiley. Ve většině kritérií dopadl aortální alograft statisticky významně lépe. Časná mortalita byla 17 % (alograft) vs 25 % (bioprotéza), resp. 33 % (mechanická protéza). Bez recidivy infekce 15 let po operaci zůstávalo 72 % alograftů, ale jen 24 % ostatních protéz (biologických xenoprotéz a mechanických), přičemž mezi xenoprotézami a mechanickými protézami nebylo rozdílu. Nepřekvapuje proto, že autoři doporučují použití aortálního alograftu v léčbě infekční endokarditidy aortální chlopně jako metodu volby.
Další prací z tohoto ranného období publikací na toto téma byla studie Petrou et al z Royal Brompton Hospital, Londýn (skupina Sira Magdi Yacouba), kteří prezentovali velmi dobré výsledky léčby prostetické endokarditidy použitím aortálního homograftu [14]. Jednalo se o 23leté zkušenosti a soubor 48 nemocných. Riziko recidivy infekce při použití alograftu bylo v 10letém sledování jen 3 % (u prostetické endokarditidy) a 5leté přežívání 97 % bez započtení časné mortality, která byla 8,7 % a souvisela zejména s celkovým předoperačním stavem nemocného. Srovnatelný soubor autoři nemají, nicméně tyto výsledky samy o sobě jsou výjimečně dobré. Je otázkou, zda jsou tyto výsledky reprodukovatelné, šlo totiž v naprosté většině případů o homovitální štěpy, které jsou v současnosti prakticky nedostupné.
V poslední době své zkušenosti prezentoval kupříkladu Grinda et al [15]. Ve své práci hodnotí výsledky operací 104 nemocných (průměrný věk 51 let s intervalem 14-77 let) s aktivní nativní aortální endokarditidou, kteří byli léčeni implantací kryoprezervovaného aortálního alograftu: 10leté akturiální přežívání dosáhlo 83 % a 10letý akturiální interval bez reoperace pak 76 % a bez reinfekce 93 %. Reoperovali celkem 14 nemocných, 2krát pro operační technickou chybu, 6krát pro strukturální selhání (degeneraci) a 6krát pro reinfekci. Ze 6 nemocných s reinfekcí se 3krát jednalo i intravenózní narkomany, kteří v intravenózní aplikaci léku s největší pravděpodobností pokračovali i po operaci. U 6 reoperací pro strukturální dysfunkci se jednalo 4krát o nedomykavost a 2krát o stenózu. Domníváme se, že alespoň částečně je vznik nedomykavosti v souvislosti s operační technikou, protože autoři používali subkoronární techniku a zejména ze zkušeností Yacouba (a Rosse) víme, že tato technika je pro vznik nedomykavosti daleko náchylnější než „full root“. Je možné se jenom domnívat, zdali by jiná než subkoronární technika implantace nesnížila rovněž riziko reinfekce či zda by toto riziko nemohlo být dále redukováno jiným antibiotickým schématem (to autoři ve své práci vůbec nerozvádějí). Souhlasíme se závěry autorů, že použití alograftu u aktivní infekce nezvyšuje riziko reinfekce ve srovnání jinými typy náhrad či odkladem operace, a je tudíž vhodnou náhradou pro časné operační řešení. Srovnatelný soubor akutních operací se standardní chlopenní náhradou však ani tito autoři nemají.
Rovněž reoperacemi pro infekci protézy se v další práci zabýval MUDr. Sabik [16]. Ze 103 nemocných, operovaných pro prostetickou endokarditidu v aortální pozici, byl u 78 % perioperačně patrný periprostetický absces a u 40 % aortoventrikulární diskontinuita. U všech nemocných provedli autoři radikální odstranění veškerého infikovaného materiálu a poté implantovali aortální alograft metodou náhrady kořene. Výsledky při použití této techniky (v součinnosti s adekvátní antibiotickou léčbou) byly velmi dobré s hospitalizační mortalitou 3,9 % a 1-, 2-, 5 - a 10letým přežíváním 90 %, 86 %, 73 % a 56 %. Riziko recidivy infekce bylo velmi malé a pouze 4 nemocní byli reoperování pro recidivu infekce a bez recidivy infekce bylo 95 % nemocných při sledování trvajícím 4,3 ± 2,9 let. Vlastní kapitolou jejich manuálu je protiinfekční léčba: pooperační podávání antibiotik trvalo přinejmenším 8 týdnů a v případě mykotické etiologie jsou nemocným antimykotika doživotně. K tomuto schématu podávání antibiotik a antimykotik lze mít řadu námitek a kolegové infektologové a bakteriologové by je jistě měli, nicméně pro tyto kriticky nemocné se zdá takto extendovaná antibiotická kúra jako odůvodnitelná a akceptovatelná. Z práce nevyplývá, kolik komplikací se vyskytlo v souvislosti s podáváním antibiotik či antimykotik. Průměrný věk jejich nemocných byl jen lehce nad 50 let. Z tohoto lze nepřímo vyvozovat, že staří a velmi staří nemocní (nad 80 let) reoperaci pro prostetickou endokarditidu prakticky nepodstupují, a to i přesto, že infekcí protézy zcela jistě postiženi jsou. V této věkové kategorii jsou výsledky operací výrazně negativně ovlivněny celou řadou komorbidit. Rovněž známky infekce ve vyšším věku přichází plíživě a i sama infekce probíhá často mitigovaně, takže diagnóza je často stanovena pozdě, obvykle již v době malnutrice či kachexie.
Samozřejmě ale existují práce, prezentující dobré výsledky i s použitím jiných typů chlopenních protéz při chirurgickém řešení infekční endokarditidy aortální chlopně. Velmi zajímavé je především srovnání implantace kompozitní protézy a alograftu pro infekční endokarditidu, čemuž se věnovali němečtí autoři z Hannoveru [17]. Ti porovnávali výsledky léčby akutní prostetické endokarditidy implantací kořene aorty s radikálním odstraněním infikovaného materiálu buď kompozitní protézou (St. Jude Medical, Carbomedics, ATS) - 13 pacientů nebo kryoprezervovaným alograftem - 16 nemocných. Antibiotika byla podávána pooperačně po dobu 6 týdnů intravenózně. 1 - a 5leté přežívání bylo bez statistického rozdílu, a to 81 a 81 % pro kompozitní protézu a 85 a 85 % pro homograft. Žádný nemocný nebyl reoperován pro reinfekci. Autoři uzavírají, že při patřičné radikalitě není významnějšího rozdílu v recidivě infekce nebo přežívání bez ohledu na typ použité protézy v případě, že byla provedena náhrada vzestupné aorty a aortální chlopně najednou.
Stejnou problematikou se rovněž zabývají autoři z Mount Sinai v New Yorku [18] a ve své práci hodnotí 12leté výsledky léčby akutní aortální prostetické endokarditidy kompletní resekcí kořene a náhradou kombinovanou protézou v kombinaci s button-technikou všívání koronárních terčíků do cévní protézy (28 nemocných). Newyorské pracoviště je známo tím, že prosazuje tuto cestu léčby infekční endokarditidy a jistě má s tímto způsobem léčby nejvíce zkušeností. Nedílnou součástí jejich schématu léčby je intenzivní podávání antibiotik, která autoři aplikovali intravenózně a perorálně 2-8 týdnů po operaci, a to v závislosti na původci endokarditidy. Autoři zdůrazňují, že chirurgická léčba je u tohoto onemocnění téměř nevyhnutelná. Velmi často je pak urgentní či emergenční (v tomto souboru to bylo ve více než 70 % pacientů). Odstranění veškeré i jen potenciálně infikované tkáně a náhrada kombinovanou protézou je pak podle autorů velmi dobrým způsobem léčby, perioperační mortalita byla pouze 11% a pouze 1 nemocný (4 %) měl rekurenci infekce 3 měsíce po iniciální operaci. Hagl tyto výsledky porovnával s vlastním souborem nemocných, když ve stejném sledovacím období jako výše zmíněný soubor s implantací kombinované protézy, provedl náhradu pouze aortální chlopenní protézou s menší radikalitou výkonu (primárně se snahou o minimalizaci operační zátěže). Tato menší radikalita byla ale zatížena 29% perioperační mortalitou! Práce tedy podporuje tvrzení, že odstranění veškerého infikovaného materiálu dává větší šanci na přežití, a to i za cenu větší operační zátěže. Nejčastější komplikací této radikální metody je poté, podle očekávání, AV-blok až III. stupně - v 18 %. V závěru autoři, v souladu s doporučeními AHA (American Heart Association), jednoznačně doporučují podávat antibiotika alespoň 6 týdnů po tomto výkonu, nasadit je perioperačně - buď podle předoperační citlivosti, či silná baktericidní naslepo (negativní předoperační bakteriologie). Vždy alespoň 24-48 hodin před operací. Další odklad operace s úvahou tzv. „sterilizaci“ infikované oblasti nedoporučují s ohledem na možnost rychlého rozvoje lokálních či celkových fatálních komplikací. V závěru autoři rovněž poukazují na to, že v jejich rukou tato metoda přináší srovnatelné výsledky s náhradou alograftem, a není tudíž nutno čekat na dodání lidského štěpu, nebo nemocného transportovat do center s těmito zkušenostmi (Mount Sinai alogenní aortální protézu historicky nikdy nepoužíval). Nedostatkem sdělení je, že vůbec nehodnotí nežádoucí účinky a komplikace spojené s užitím mechanické aortální protézy (warfarin), které nejsou zanedbatelné a mohou středně a dlouhodobé výsledky výrazně ovlivnit. Podstatný pro toto tvrzení je fakt, že na území USA je dostupnost alograftů velmi omezená díky zcela odlišné koncepci distribuce těchto štěpů (především cestou velkých komerčních firem - např. CryoLife, LifeNet a další) s centrálními sklady, což je při dopravě na velké vzdálenosti problém a což významně zvyšuje cenu takového štěpu. Z toho pramení i malé či žádné zkušenosti naprosté většiny severoamerických kardiochirurgů s touto technikou.
I přes problémy s dopravou, zpracováním a cenou alograftů v USA existují i tam pracoviště, která mají aortální alotransplantáty kdykoliv k dispozici, a mohou proto prezentovat srovnání s jinými typy protéz. Problematice implantace alograftů se dlouhodobě věnují kolegové z Cleveland Clinic, USA. Lytle et al [20] ve své práci prezentuje zkušenosti s operacemi infekce protézy po náhradě ascendentní aorty izolovaně nebo v kombinaci s chlopenní aortální protézou - Bentall. Jejich soubor činí 27 nemocných za 12 let. K léčbě použili ve všech případech radikální resekci a implantaci kryoprezervovaného homograftu s intravenózně aplikovanou ATB-kúrou prodlouženou na alespoň 8 týdnů po operaci. V případě mykotické infekce byla antimikrobiální léčba perorální. Perioperační mortalita činila 3,9 %, a přežívání 1, 2, 5 a 7,5 roku – 92 %, 88 %, 70 % a 56 %. Jeden nemocný byl reoperován pro rekurentní infekci za 8 měsíců po iniciální operaci. Autoři rovněž výrazně podporují radikalitu resekce v kombinaci s užitím alograftu a intenzivní ATB-kúry jako optimální způsob léčby tohoto, jinak fatálního, onemocnění.
V Evropě je situace odlišná. Odběry, zpracování i distribuci chlopenních alograftů zajišťují vesměs specializované tkáňové banky, pracující na „neziskovém“ principu. Znamená to, že evropské štěpy jsou levnější a v řadě zemí i dostupnější. V Čechách je situace výjimečně výhodná. Specializovaná tkáňová banka kardiovaskulární tkáně (registrovaná Ministerstvem zdravotnictví ČR jako STB 85) působí v rámci transplantačního centra FN Motol. Má tím pádem přímý přístup do zdroje (pool) dárců v rámci státu. Naprostá většina chlopenních štěpů je odebírána v rámci multiorgánových odběrů od kadaverózních dárců (v případech, kdy srdce dárce nemůže být z medicínských či organizačních důvodů transplantováno). Banka má zajištěnu trvalou pohotovostní službu, a tak jsou pro české pacienty alografty trvale a prakticky okamžitě dostupné.
Nakonec bychom zmínili velmi cennou práci, v níž Delay et al posuzují krátko - a dlouhodobé výsledky operací pro infekční endokarditidu aortální chlopně s použitím mechanických a biologických stentovaných protéz pro nativní i prostetickou endokarditidu (tedy ne implantaci kořene v jakékoliv formě) [21]. Operační mortalita je srovnatelná s ostatními pracemi na toto téma a činila 8 % ze 77 operovaných. Z práce není jasné, jaké procento nemocných bylo operováno urgentně, resp. elektivně, ale všichni byli předoperačně léčeni určitou dobu antibiotiky, a lze tudíž předjímat, že alespoň část nemocných byla operována v chronické fázi. To, co vyznělo nepříznivě, je relativně vysoké množství recidiv infekce, přitom event-free interval bez recidivy infekce činil za 1, 5 a 7 let po operaci 80 %, 76 % a 76 % při nativní valvární endokarditidě a 45 %, 40 % a 36 % při prostetické endokarditidě - což jsou čísla významně vyšší než u prací s alograftem či při užití kombinované aorto-aortální protézy. Riziko recidivy infekce bylo výrazně vyšší u prostetické endokarditidy, která byla jediným nezávislým rizikovým faktorem recidivy v této práci. Jinými slovy i tato práce v zásadě podporuje radikalitu výkonu a užití celého kořene jako metodu volby zejména v případě léčby infekční protetické endokarditidy.
Na našem pracovišti preferujeme v této indikaci implantaci alograftu, a to jednak obecně pro výhody plynoucí s užití biologického materiálu, ale i proto, že podle našeho názoru je fyziologické proudění bez turbulencí pro prevenci rekurence infekce výhodnější než reologie mechanické, ev. stentované xenoprotézy. Tato otázka ale zůstane pravděpodobně navždy nevyřešena, protože randomizovanou studii s dostatečným počtem těchto nemocných je nemožné postavit.
Závěr
Tento článek si klade za úkol přiblížit pouze tu část problematiky infekční endokarditidy, která se týká postižení aortální chlopně, jako asi nejjasnější indikace aortálního alograftu v léčbě chlopenních onemocnění u dospělé populace.
Vlastní zkušenosti autorů, stejně jako údaje řady pracovišť ukazují, že aortální alotransplantát je vhodnou chlopenní náhradou pro řešení infekční endokarditidy aortální chlopně. Metoda má řadu teoretických i praktických výhod, proto je na pracovištích autorů dále rozvíjena. Velkou výhodou je u nás snadná a trvalá dostupnost tohoto typu chlopenních štěpů.
Na kardiochirurgickém oddělení Nemocnice České Budějovice a.s., bylo od roku 2002 do června roku 2006 provedeno celkem 32 náhrad aortální chlopně aortálním homograftem pro nativní či protézovou*/ infekční endokarditidu. Žádný nemocný, který byl primárně operován pro infekční endokarditidu, neměl recidivu infekce - na rozdíl od souboru 15 nemocných, které jsme operovali před zahájením programu implantace aortálního homograftu pro tuto diagnózu. U těchto 15 nemocných, kterým jsme pro infekci chlopně provedli náhradu mechanickou či stentovanou biologickou protézou, jsme zaznamenali časnou či pozdní recidivu infekce (stejným agens) u 23 % pacientů.
Použití aortálních alograftů v klinické praxi je spojeno s celou řadou dalších otázek a problémů, které přesahují rámec tohoto sdělení - jde o problematiku dárců tkání, zpracovávání a dlouhodobého uchovávání chlopenních štěpů v tkáňových bankách nebo antigenicity a degenerace tkáně štěpu. Je zkoumána fyziologie a patofyziologie vlivu excelentní hemodynamiky na rychlost a kompletnost regrese masy hypertrofické levé komory srdeční. Nebyla podrobněji diskutována problematika antikoagulace, fyzické výkonnosti a kvality života vůbec.
Zlepšení výsledků chirurgické léčby infekční endokarditidy obecně i postižení aortální chlopně je možno dosáhnout jenom při komplexním přístupu a vzájemném propojení sil kardiologů, infektologů, bakteriologů a chirurgů. Tento interdisciplinární přístup by se měl stát našim cílem.
MUDr. Aleš Mokráček, CSc.
Kardiocentrum České Budějovice
www.nemcb.cz
e-mail: a.mokracek@seznam.cz
Doručeno do redakce: 17. 8. 2006
Přijato po recenzi: 20. 9. 2006
Sources
1. Gross RE, Hurvit ES, Bill AH et al. Prelimitary observations on the use of human arterial grafts. N Engl J Med 1948; 239 : 587-595.
2. Lam CR, Aram HH, Munnell ER. An experimental study of aortic valve homografts. Surg Gyneacol Obstetr 1952; 94 : 129-135.
3. Hubka M, Siska K, Brozman M et al. Replacement of mitral and tricuspid valves by mitral homograft. J Thorac Cardiovasc Surg 1966; 51 : 195-204.
4. Hubka M, Holec V. Experimental replacement of the mitral valve by mitral homograft. Bratisl Lek Listy 1966; 46 : 261-272.
5. Špatenka J, Honěk T, Kostelka M et al. Odběr srdce pro přípravu alotransplantátů srdečních chlopní. Rozhl Chir 1997; 76 : 113-117.
6. Špatenka J, Kostelka M, Kobylka P et al. Příprava, skladování, transport a použití alotransplantátů srdečních chlopní. Rozhl Chir 1997; 76 : 118-125.
7. Horstkotte D, Follath F, Gutschik E et al. Guidelines on prevention, diagnosis and treatment of infective endocarditis. ESC guidelines. Eur Heart J 2004; 25 : 1-37.
8. Ross DN. Homograft replacement of the aortic valve. Lancet 1962; 487
9. Barrat-Boyes BG. Homograft aortic valve replacement in aortic incompetence and stenosis. Thorax 1964; 19 : 131-150.
10. Kersten TE, Ross D. Aortic root replacement with aortic homograft. In: Emery RW, Arom KV. The aortic valve. Philadelphia, St. Louis, Baltimore, Boston, Chicago, London, Philadelphia, Sydney, Toronto: Mosby, Hanley & Belfus 1991; 245-261
11. Heimbecker RO, Baird RJ, Lajos RJ et al. Homograft replacement of the human valve. A preliminary report. Can Med Assoc J 1962; 86 : 805-807.
12. Zákon č. 285/2002 Sb., tzv. Transplantační zákon.
13. Haydock D, Barrat-Boyes B, Macedo T et al. Aortic valve replacement for active infectious endocarditis. J Thorac and Cardiovasc Surg 1992; 103 : 130-139.
14. Petrou M, Wong K, Albertucci M et al. Evaluation of unstented homografts for treatment of prostetic valve endocarditis. Circulation 1994; 90 : 198-204.
15. Grinda JM, Mainardi JL, Berrebi A et al. Cryopreserved aortic allografts for treatment of active aortic endocarditis. Ann Thorac Surg 2005; 79 : 767-771.
16. Sabik JF, Lytle BW, Blackstone EH et al. Aortic root replacement with cryopreserved allograft for prosthetic valve endocarditis. Ann Thorac Surg 2002; 74 : 650-659.
17. Leyh RG, Knobloch K, Hagl CH et al. Replacement of the aortic root for acute prosthestic valve endocarditis: Prosthetic composite versus aortic allograft root repacement. J Thorac Cardiovasc Surg 2004; 127 : 391-398.
18. Hagl CH, Galla JD, Lansman SL et al. Replacing the ascending aorta and aortic valve for acute prosthetic valve endocarditis: Is it using of prosthetic material contraindicated? Ann Thorac Surg 2002; 74 : 1781-1785.
19. Blumberg I et al. Endocarditis-associated paravalvular abscesses. Chest 1995; 107 : 898-903.
20. Lytle BW, Sabik JF, Blackstone EH et al. Reoperative cryopreserved root and ascending aorta replacement for acute aortic prosthetic valve endocarditis. Ann Thorac Surg 2002; 74 : 1754-1757.
21. Delay D, Pellerin M, Carrier M et al. Immediate and long term results of valve replacement for native and prosthetic valve endocarditis. Ann Thorac Surg 2000; 70 : 1219-1223.
22. Beneš J, Gregor P, Mokráček A. Infekční endokarditida. Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe. www.kardio-cz.cz/resources/upload/data/53_Infekcni_endokarditida.pdf
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 1-
All articles in this issue
- Metabolický syndrom a tuková tkáň: opravdu za všechno mohou adipocyty? - editorial
- Intermediární stadium Hodgkinova lymfomu - citius, altius, nebo fortius? - editorial
- Aortální alograft (homograft) v léčbě chlopenních srdečních vad dospělých s důrazem na léčbu infekční endokarditidy aortální chlopně
- FEVER studie (The Felodipine EVEnt Reduction), randomizovaná, dvojitě slepá, placebem kontrolovaná studie u čínských hypertenzních pacientů
- Plicní hypertenze u Takayasuovy arteritidy: kazuistika
- Metodické pokyny pro farmakoterapii akutní a chronické nenádorové bolesti
- Metodické pokyny pro farmakoterapii nádorové bolesti
- Zdravé osoby versus pacienti s diagnózou diabetes mellitus 2. typu: vybrané parametry v séru a v subkutánní abdominální tukové tkáni
- Porucha regulace glukózového metabolizmu u pacientů s mnohočetným myelomem léčených vysokými dávkami kortikosteroidů na naší klinice v roce 2004
- Smoothness index betaxolol hydrochloridu u pacientů s čerstvě zjištěnou hypertenzí
- Chemoterapie BOVAPEC v primární léčbě středně pokročilých stadií Hodgkinova lymfomu
- Význam stanovení Nt-proBNP a big-endotelinu pro diagnostiku chronického srdečního selhání u nemocných v pravidelném hemodialyzačním programu
- Epilepsia a reprodukčné poruchy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aortální alograft (homograft) v léčbě chlopenních srdečních vad dospělých s důrazem na léčbu infekční endokarditidy aortální chlopně
- Metodické pokyny pro farmakoterapii akutní a chronické nenádorové bolesti
- Epilepsia a reprodukčné poruchy
- Význam stanovení Nt-proBNP a big-endotelinu pro diagnostiku chronického srdečního selhání u nemocných v pravidelném hemodialyzačním programu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

