-
Medical journals
- Career
Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Authors: doc. MUDr. Ludmila Brunerová, Ph.D. 1; L. Trešlová 1; Š. Průhová 2; J. Vosáhlo 2; J. Brož 1; J. Lebl 2; M. Anděl 1
Authors‘ workplace: Diabetologické centrum II. interní kliniky 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Michal Anděl, CSc. 1; Diabetologické centrum Kliniky dětí a dorostu 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Jan Lebl, CSc. 2
Published in: Vnitř Lék 2006; 52(3): 275-279
Category: Case Report
Overview
MODY 3 diabetes patří mezi monogenně podmíněné formy diabetes mellitus. Je způsoben monoalelickou mutací genu HNF-1α, který kóduje transkripční faktor nezbytný pro regulaci funkce β-buněk. Klinicky se MODY 3 projevuje podobně jako diabetes mellitus 1. typu. I když postižení pacienti nejsou ohroženi ketoacidózou, kvalitní metabolická kontrola je zcela zásadní pro prevenci pozdních komplikací diabetu. U sourozeneckého páru se projevil diabetes mellitus v 18 letech (bratr) a v 15 letech (sestra) hyperglykemií s osmotickými příznaky. U obou byla zahájena léčba intenzifikovaným inzulinovým režimem. Kompenzace diabetu u bratra byla vynikající (HbA1c 3,3 %), ovšem za cenu častých hypoglykemií. U sestry se však vlivem nespolupráce dlouhodobě nedařilo dosáhnout uspokojivé kontroly glykemií (HbA1c 10,9 % dle IFCC). Molekulárně-genetické vyšetření u obou sourozenců následně prokázalo mutaci Arg200Gly v genu HNF-1α. Na základě literárních údajů byla u sourozenců ve věku 22 let (bratr), resp. 19 let (sestra) zahájena perorální léčba derivátem sulfonylurey glibenklamidem v dávce 1,25 mg/den (bratr) resp. 7,5 mg/den (sestra) a ukončeno podávání inzulinu. Hladina HbA1c po 3 měsících léčby glibenklamidem sice zůstala u bratra nízká, ale frekvence hypoglykemií kupodivu poklesla, u sestry došlo k významnému snížení HbA1c z 10,9 % na 10 % (po 2 měsících léčby glibenklamidem). Převod z parenterální na perorální medikaci vedl nepochybně ke zlepšení kvality života a dokonalejší metabolické kontrole. Molekulárně-genetická diagnostika může u těchto pacientů otevřít cestu k léčbě přinášející vyšší kvalitu života a lepší metabolickou kontrolu, i když její dlouhodobé účinky a bezpečnost bude nutné ověřit.
Klíčová slova:
MODY 3 diabetes - terapie - metabolická kontrola - glibenklamid - kvalita životaÚvod
MODY 3 je autozomálně dominantně dědičná forma diabetes mellitus způsobená mutacemi genu HNF-1α, který je umístěn na dlouhém raménku 12. chromozomu. Produktem tohoto genu je transkripční faktor HNF-1α (hepatocytární nukleární faktor), který je nezbytný pro funkci transkripční regulační sítě β-buněk [1,2]. Podle kvalifikovaných odhadů představují pacienti se všemi formami MODY diabetu 2-5 % z celkového počtu diabetických pacientů, což může představovat až 35 000 nemocných v ČR. Ze skupiny MODY diabetu reprezentuje typ 3 v různých zemích 21 % (Francie) až 64 % (Velká Británie, Spojené státy americké) a zdá se být nejčastějším typem MODY diabetu [3,4]. V České republice může na základě těchto údajů žít 7 000-24 500 pacientů s MODY 3.
Klinická manifestace se poněkud liší nejen mezi rodinami, ale také mezi členy jedné rodiny. Penetrance MODY 3 je silná, ale není kompletní a na fenotypu se podílejí ještě další faktory genetické [5] či faktory zevního prostřední, např. inzulinová rezistence z důvodu váhového přírůstku či během těhotenství [6].
Symptomy MODY 3 jsou také variabilní. Nejčastěji se MODY 3 manifestuje po pubertě (22-26 let) u štíhlých lidí (BMI < 25 kg/m2), bez známek metabolického syndromu. Objevují se osmotické příznaky z hyperglykemie, bez rozvoje ketoacidózy (ev. jen s mírnou ketoacidózou) [3]. Na diabetes mellitus typu MODY 3 je tedy vhodné myslet v případě mladého pacienta s hyperglykemií, bez ketoacidózy a se sugestivní rodinnou anamnézou charakteru autozomálně dominantní dědičnosti (optimálně přítomnost diabetu ve 3 generacích) [3,4,7].
Diferenciálně diagnosticky bychom měli vyloučit diabetes mellitus 1. typu (screeningem autoprotilátek), diabetes mellitus 2. typu a sekundární diabetes (na základě anamnézy a určitých klinických a laboratorních parametrů). Vhodnými diferenčními kritérii mezi MODY 3 a diabetem 2. typu mohou být mimo jiné normální hladiny triacylglycerolů a absence hypertenze u pacientů s MODY 3 [8,9].
Mezi mladými diabetickými pacienty s negativními autoprotilátkami (anti-GAD a anti-IA2) bylo zjištěno 5-10 % MODY 3 [9]. V dánské studii z 39 pacientů s předpokládaným diabetem 1. typu bez rizikového genotypu (nepřítomnost HLA DR3, DR4) a pozitivní rodinnou anamnézou diabetu měli 4 pacienti mutaci HNF-1α [10].
U pacientů s MODY 3 se často vyskytují mikrovaskulární komplikace. S ohledem na dobu trvání diabetu a úroveň glykemické kontroly je prevalence specifických komplikací u pacientů s MODY 3 srovnatelná jako u osob s diabetem 1. či 2. typu [11]. Makrovaskulární komplikace se naopak vyskytují s menší četností než při diabetu 2. typu [3,4,11].
Terapie pacientů s MODY 3 není dosud standardizovaná. Ve studii Hattersleyho čítající 100 pacientů s MODY 3 byla třetina léčena pouze dietou, třetina deriváty sulfonylurey a třetina inzulinem [12]. Ovšem mladí pacienti s MODY 3 diabetem jsou dosud obvykle léčeni intenzifikovaným inzulinovým režimem. Některé zahraniční studie prokázaly bezpečnost a účinnost terapie glibenklamidem (s naprostým vynecháním inzulinové léčby), která také vede ke zlepšení spolupráce pacientů a zvyšuje kvalitu jejich života [13,14,15]. Studie českých autorů hodnotící kvalitu života u pacientů s diabetem jednoznačně ukázala nižší kvalitu života všech diabetických pacientů bez ohledu na typ diabetu, pokud jsou léčeni inzulinem [16].
MODY 3 typ diabetu je charakterizován sníženou bazální a glukózou stimulovanou sekrecí inzulinu [6,17], zatímco inzulinová odpověď na deriváty sulfonylurey (glibenklamid, gliburid, tolbutamid, gliklazid) je dobře zachována [1,14,18,19,20].
Patogenetické mechanizmy MODY 3 typu diabetu vyplývají z porušené funkce mutantního transkripčního faktoru HNF-1α, který se exprimuje v buňkách pankreatických ostrůvků, jater, ledvin a tenkého střeva. Dysfunkce β-buňky u pacientů s MODY 3 způsobuje poruchu glukózou stimulované sekrece inzulinu, jež vede k chronické hyperglykemii. Uplatňuje se také následné snížení exprese GLUT 2 a některých glykolytických enzymů v β-buňkách v důsledku selhání transkripční regulační sítě [21,22].
Přes výrazně sníženou inzulinovou odpověď na stimulaci glukózou je dokumentovaná dobře zachovaná inzulinová odpověď na deriváty sulfonylurey (glibenklamid), která je teoretickým předpokladem pro úspěšnou léčbu pacientů s MODY 3 tímto perorálním antidiabetikem. Deriváty sulfonylurey zvyšují sekreci inzulinu z β-buněk prostřednictvím vazby na SUR1 receptor, podjednotku ATP dependentního kaliového kanálu [23]. Podstatou dobré účinnosti glibenklamidu u nosičů mutantní alely pro HNF-1α je pravděpodobně zachovalá citlivost vůči účinkům inzulinu u těchto jedinců a může se též uplatňovat vyšší účinek glibenklamidu při jeho zvýšené hladině z důvodu snížené hepatální clearance [18,19].
Kazuistika
Uvádíme kazuistiku mladého sourozeneckého páru - sestry (*1985) a bratra (*1982) s MODY 3 typem diabetu. Genealogické šetření prokázalo výskyt diabetu ve 3 generacích rodiny. Prarodiče z otcovy strany měli oba diagnostikován diabetes mellitus před 40. rokem, oba byli léčeni perorálními antidiabetiky, sestra otce má také diabetes a je léčena perorálními antidiabetiky. Sestřenice sourozeneckého páru byla od 15 let léčena intenzifikovaným inzulinovým režimem. Na základě detekce mutace HNF-1α genu (Arg200Gly) molekulárně genetickým vyšetřením byl u všech sledovaných členů rodiny diabetes překlasifikován na MODY 3. Otec našich probandů je jistě nositelem mutace, pro vyšetření však nebyl k dispozici. Proto je v rodokmenu je vyznačen pouze šrafovaně (obr. 1).
Image 1. Rodokmen. 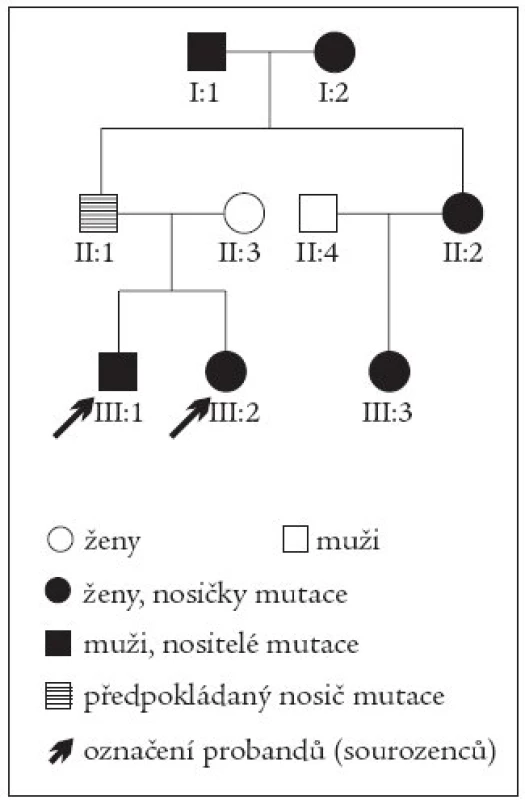
Genealogické šetření v rodině sourozenců prokázalo výskyt diabetu ve 3 generacích (prarodiče z otcovy strany, sestra otce a její dcera). Molekulárně geneticky byla u všech sledovaných členů prokázána mutace HNF-1α genu (Arg200Gly). Otec našich probandů je jistě nositelem mutace, protože však nebyl k dispozici pro vyšetření, je v rodokmenu je vyznačen pouze šrafovaně. Diabetes mellitus se u sestry manifestoval ve věku 15 let v časové koincidenci s krátkodobou léčbou Prednisonem pro infekční mononukleózu. Projevil se osmotickými příznaky (hyperglykemií a glykosurií), bez známek diabetické ketoacidózy. Léčba intenzifikovaným inzulinovým režimem byla od počátku vlivem nespolupráce pacientky problematická, přetrvávaly významné hyperglykemie vedoucí k neuspokojivé kompenzaci diabetu (tab. 1).
Table 1. Přehled vývoje HbA1c jako ukazatele kompenzace diabetu sestry v letech 2000–2003. 
Záhy došlo k rozvoji specifických mikrovaskulárních komplikací. Incipientní diabetická nefropatie s přetrvávající mikroalbuminurií a neproliferativní diabetická retinopatie byly diagnostikovány již po dvou letech trvání diabetu. V tomtéž roce potvrdilo EMG vyšetření diagnózu lehké distální senzorimotorické neuropatie. Největší terapeutický problém představovala recidivující a špatně se hojící kožní komplikace - rozpadlá a infikovaná nekrobióza levého bérce, která si vyžádala transplantaci kožního štěpu 3 roky po zjištění diabetu.
Z provedených antropometrických vyšetření (srpen roku 2004) jsou k diagnóze MODY 3 diabetu relevantní: BMI v pásmu normy (20,8 kg/m2, hmotnost 58 kg, výška 167cm) a normotenze (TK 120/70 mm Hg). Z laboratorních výsledků zaujme nativní hladina C-peptidu 187 pmol/l, tedy hluboce pod pásmem normy (90-1320 pmol/l), negativní autoprotilátky anti-GAD a anti-IA2, normální lipidogram (celkový cholesterol 3,95 mmol/l, HDL-cholesterol 1,44 mmol/l a triacylglyceroly 0,85 mmol/l), alarmující je glykemický profil: 12,9-12,5-16,1-14,7 mmol/l) a hladina HbA1c 10,9 % dle IFCC (norma HbA1c u léčených diabetiků je < 6 %).
Na základě literárních údajů o úspěšnosti terapie deriváty sulfonylurey u pacientů s MODY 3 jsme pacientku v srpnu roku 2004 (4 roky po stanovení diagnózy diabetu) převedli na perorální terapii glibenklamidem v dávce 7,5 mg/den (5 mg-0-2,5 mg). Změna terapie byla provedena za hospitalizace s pečlivou monitorací acidobazické rovnováhy (bez rozvoje acidózy) a ketolátek v moči (negativní). Současně došlo ke zvýšení hladiny C-peptidu do pásma normy (1152 pmol/l).
Při léčbě glibenklamidem došlo po 2 měsících ke zlepšení kompenzace diabetu (glykemický profil 9,6-4,7-10,7-8,5 mmol/l, HbA1c 10 % dle IFCC). Porovnání glykemických profilů, hladiny HbA1c a C-peptidu při léčbě inzulinem a glibenklamidem je shrnuto v tab. 2.
Table 2. Srovnání hodnot C-peptidu, glykemického profilu a HbA1c sestry při léčbě inzulinem a glibenklamidem. 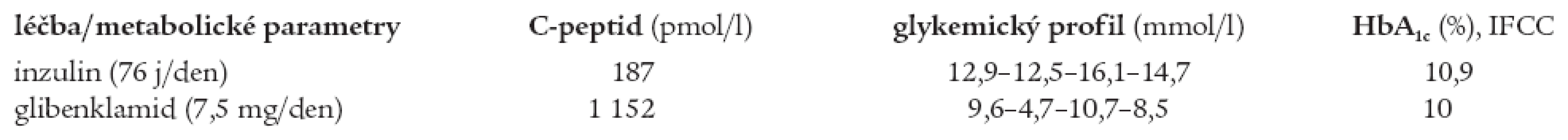
Další průběh byl komplikován recidivou nekrobiózy bérce s nutností antibiotické terapie (leden roku 2005). Během terapeutické hospitalizace byla pacientka převedena na intenzifikovaný inzulinový režim. Po zhojení defektu se pacientka opět vrátila k léčbě glibenklamidem v původní dávce, její spolupráce zůstala bohužel i nadále velmi špatná, kompenzace diabetu vyjádřená hodnotou HbA1c je sice téměř o 1 % lepší než při léčbě inzulinem, ovšem stále neuspokojivá (HbA1c 10 %).
U bratra naší pacientky byl diabetes mellitus zjištěn ve věku 18 let náhodně záchytem glykosurie (rok 2000). Na základě orálně glukózového tolerančního testu (oGTT) byla u našeho pacienta nejprve diagnostikována porucha glukózové tolerance, pacient byl dále ponechán na dietní terapii. Vzhledem k přetrvávajícím hyperglykemiím, pozitivní rodinné anamnéze a negativitě autoprotilátek byl po roce odeslán obvodním diabetologem k přesnému určení poruchy sacharidového metabolizmu. oGTT a intravenózní glukózový toleranční test (ivGTT), provedené na pediatrické klinice, ukázaly jasně patologickou křivku: glykemie 12,0 mmol/l ve 120. minutě oGTT a porušená časná fáze inzulinové sekrece se součtem v 1. a 3. minutě ivGTT (tab. 3 a 4). Byla zahájena terapie intenzifikovaným inzulinovým režimem v dávce 32 j/den.
Table 3. oGTT bratra s uvedením glykemií, inzulinemií a hladin C-peptidu v minutě 0, 30, 60, 120 a 180. 
Table 4. ivGTT bratra s uvedením glykemií, inzulinemií a hladin C-peptidu v minutě 0, 1, 3, 5, 10, 30 a 60. 
Ze specifických mikrovaskulárních komplikací byla roku 2004 diagnostikována incipientní diabetická nefropatie. Z antropometrických parametrů relevantních k diagnóze MODY typu diabetu lze uvést normální BMI (24,2 kg/m2, hmotnost 75 kg, výška 176 cm) a normotenzi (TK 130/80 mm Hg), z laboratorních parametrů normální lipidogram (celkový cholesterol 3,5 mmol/l, HDL-cholesterol 0,95 mmol/l, triacylglyceroly 0,95 mmol/l), normální acidobazické parametry, glykemický profil: 5,5-4,4-5,8-6,8 mmol/l a hladinu C-peptidu pod dolní hranicí normy (256 pmol/l). Kompenzace diabetu při léčbě inzulinem byla velmi těsná (HbA1c 3,3 % dle IFCC), ovšem za cenu opakovaných hypoglykemií několikrát týdně.
Pacienta jsme vzhledem k úspěchu nově zavedené léčby u jeho sestry a s ohledem na vyšší kvalitu života bez nutnosti aplikace inzulinu převedli na terapii glibenklamidem v počáteční denní dávce 1,25 mg/den, která byla po měsíci léčby zvýšena na dosud konečnou dávku 2,5 mg/den.
Po změně terapie zůstala kompenzace diabetu výborná (HbA1c 2,8 % po 3 měsících léčby, při další kontrole 3,3 %), glykemický profil se pohyboval v mezích normy (4,8-3,9-5,5-4,8 mmol/l). Během monitorace při hospitalizaci nebyly při léčbě glibenklamidem zachyceny ketolátky ani změny v acidobazické rovnováze a podle očekávání se zvýšila hladina C-peptidu (791 pmol/l). Porovnání glykemických profilů, HbA1c a hladiny C-peptidu při léčbě inzulinem a glibenklamidem je přehledně shrnuto v tab. 5.
Table 5. Srovnání hodnot C-peptidu, glykemického profilu a HbA1c bratra při léčbě inzulinem a glibenklamidem. 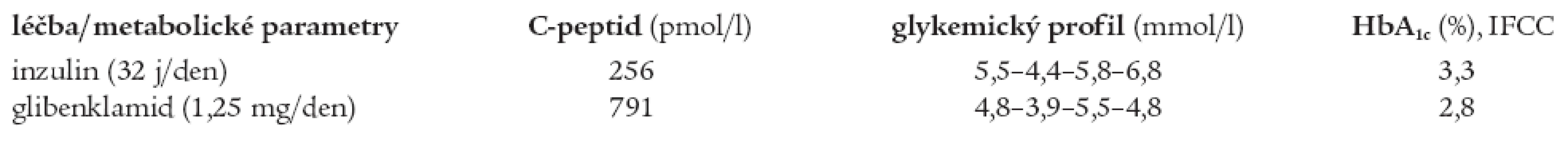
Důležitým aspektem nové léčby bylo i přes velmi těsnou kompenzaci diabetu snížení frekvence hypoglykemií (maximálně 1krát týdně) a zvýšení kvality života (pacientovo hodnocení). Udávaná hladina HbA1c po prvních 3 měsících léčby je velmi nízká, vzhledem k poklesu frekvence hypoglykemií nelze vyloučit, že se jednalo o laboratorní chybu. Při další kontrole již hladina HbA1c dosáhla 3,3 % a frekvence hypoglykemií se nezměnila.
Závěr
Kazuistika mladého sourozeneckého páru dokazuje význam molekulárně genetického vyšetření pro životní osudy konkrétních pacientů. Přesná diagnostika typu diabetu, založená na molekulárně genetických metodách, a evidence-based medicine, prokazující dlouhodobou bezpečnost a účinnost terapie deriváty sulfonyulrey u pacientů s MODY 3, umožnila převést mladé diabetiky z terapie intenzifikovaným inzulinovým režimem na léčbu glibenklamidem.
Změna terapie vedla ke zlepšení kvality života našich pacientů, aniž došlo ke zhoršení kompenzace jejich diabetu.
Práce byla podpořena VZ MSM 0021620814 a grantem IGA MZ ČR č. 7420-3/2003.
MUDr. Ludmila Brunerová
www.fnkv.cz
e-mail: brunerova@seznam.cz
Doručeno do redakce: 11. 10. 2005
Přijato po recenzi: 10. 1. 2006
Sources
1. Yamagata K, Oda N, Kausami PJ et al. Mutations in the hepatocyte nuclear factor-1α gene in maturity-onset diabetes of the zouny (MODY 3). Nature 1996; 384 : 455-458.
2. Brunerová L, Brož J, Průhová Š et al. Maturity-onset diabetes of the young 3. DMEV 2006; (rukopis).
3. Timsit J, Bellanné-Chantelot Ch, Dubois-Laforgue D et al. Diagnosis and management of Maturity-Onset Diabetes of the Young. Treat Endocrinol 2005; 4 : 9-18.
4. Mitchell S, Frayling T. The role of transcription factors in maturity-onset diabetes of the young. Mol Genet Metab 2002; 77 : 35-43.
5. Kim SH, Ma X, Klupa T et al. Genetic modifiers of the age at diagnosis of diabetes (MODY 3) in carriers of HNF-1α mutations map to chromosomes 5p15, 9q22 and 14q24. Diabetes 2003; 52 : 2182-2186.
6. Lehto M, Tupni T, Mahtani MM et al. Characterization of the MODY 3 phenotype: early onset diabetes caused by an insulin secretion defect. J Clin Invest 1997; 99 : 582-591.
7. Klimeš I, Gašperíková D, Michálek J. DNA diagnostika monogennych foriem diabetu na Slovensku: január 2005. DMEV 2005; 8 : 27.
8. Owen KR, Shepherd M, Stride A et al. Heterogenity in young adult onset diabetes - aetiology alters clinical characteristics. Diabet Med 2002; 19 : 758-761.
9. Owen KR, Stride A, Ellard S et al. Etiological investigation in young adults presenting with apparent type 2 diabetes. Diabetes Care 2003; 26 : 2088-2093.
10. Moller AM, Dalgaard LT, Pociot F et al. Mutations in the hepatocyte nuclear factor 1-α gene in Caucasian families originally classified as having type 1 diabetes. Diabetologia 1998; 41 : 1528-1531.
11. Isomaa B, Henricsson M, Lehto M et al. Chronic diabetic complications in patients with MODY 3 diabetes. Diabetologia 1998; 41 : 467-473.
12. Hattersley AT. Maturity onset diabetes of the young: clinical heterogenity explained by genetic heterogenity. Diabet Med 1998; 15 : 15-24.
13. Shepherd M, Hattersley A. I don´t feel like a diabetic any more: the impact of stopping insulin in patients with maturity-onset diabetes of the young following genetic testing. Clin Med 2004; 4 : 144-147.
14. Pearson E, Starkey B, Powell R et al. Genetic cause of hyperglycaemia and response to treatment in diabetes. Lancet 2003; 362 : 1275-1281.
15. Shepherd M, Pearson E, Houghton J et al. No deterioration in glycaemic control in HNF-1α Maturity-Onset Diabetes of the Young following transfer from long-term insulin to sulphonylureas. Diab Care 2003; 26 : 3191-3192.
16. www.dawnstudy.com
17. Vaxillaire M, Pueyo ME, Clément K et al. Insulin secretion and insulin sensitivity in diabetic and non-diabetic subjects with HNF-1α mutations. Eur J Endocrinol 1999; 141 : 609-618.
18. Pearson E, Liddell W, Shepherd M et al. Sensitivity to sulphonylureas in patients with HNF-1α gene mutations: evidence for pharmacogenetics in diabetes. Diabet Med 2000; 17 : 543-545.
19. Boileau P, Wolfrum Ch, Shih D et al. Decreased glibenclamide uptake in hepatocytes of HNF-1α defficient mice. Diabetes 2002; 51: S343-S348.
20. Sagen JV, Pearson ER, Johansen A et al. Preserved insulin response to tolbutamide in HNF-1alpha mutation carriers. Diabet Med 2005; 22 : 406-409.
21. Yamagata K, Nammo T, Moriwaki M et al. Overexpression of dominant-negative mutant HNF-1α in pancreatic β-cells causes abnormal islet architecture with decreased expression of E-cadherin, reduced β-cell proliferation and diabetes. Diabetes 2002; 51 : 114-123.
22. Richter S, Shih D, Pearson E et al. Regulation of apolipoprotein M gene expression by MODY3 gene hepatocyte nuclear factor-1alpha: haploinsufficiency is associated with reduced serum apolipoprotein M levels. Diabetes 2003; 52 : 2989-2995.
23. Dunne M, Cosgrove K, Shepherd M et al. Potassium channels, sulphonylurea receptors and control of insulin release. Trends Endocrinol Metab 1999; 10 : 146-152.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 3-
All articles in this issue
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Hypertenze v těhotenství
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

