-
Medical journals
- Career
Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
Authors: Kajzrlíková Mikoviny I. 1; Vitek P. 1,2
Authors‘ workplace: Interní oddělení, Beskydské Gastrocentrum, Nemocnice ve Frýdku-Místku, p. o. 1; Lékařská fakulta OU 2
Published in: Gastroent Hepatol 2020; 74(3): 228-232
Category: Digestive Endoscopy: Review Article
doi: https://doi.org/10.14735/amgh2020228Overview
Eozinofilní ezofagitida je imunitně podmíněný zánět jícnu. Jedná se o chronické progresivní onemocnění provázené postupnou remodelací jícnu. Diagnostika nemoci se opírá o příznaky dysfunkce jícnu, histologický nález > 15 eozinofilů/HPF v biopsii z jícnu a vyloučení dalších příčin hypereozinofilie. Léčebné možnosti zahrnují podání inhibitorů protonové pumpy, topických steroidů a eliminační dietu. Po dosažení remise je doporučována dlouhodobá udržovací léčba. Endoskopicky lze u symptomatických pacientů řešit stenózy jícnu pomocí pneumatické dilatace nebo dle potřeby provést extrakci impaktovaného sousta.
Klíčová slova:
eozinofilní ezofagitida – progrese – kortikoidy – dieta – inhibitory protonové pumpy – dilatace
Definice, epidemiologie, etiologie
Eozinofilní ezofagitida (EoE) je lokální imunitně podmíněný chronický zánět jícnu charakterizovaný klinicky symptomy dysfunkce jícnu a histologicky hypereozinofilií sliznice jícnu. V současnosti je to nejčastější příčina chronické ezofagitidy po gastroezofageální refluxní nemoci (GERD) a je to nejčastější příčina dysfagie a váznutí sousta u dětí a mladých dospělých [1]. Kazuistiky pacientů s EoE byly publikovány již v 70. letech 20. století, ale jako samostatná jednotka byla EoE poprvé popsána až v roce 1993 a 1994 [2,3].
Incidence i prevalence EoE mají vzrůstající tendenci. Incidence se momentálně udává 1–20/100 000, průměrně 7/100 000 osob, a prevalence se pohybuje mezi 14 a 49/100 000 osob [4]. Všechny studie zabývající se incidencí EoE potvrzují, že incidence narůstá velmi rychle, ve studiích z Evropy je patrné zvýšení incidence od konce 90. let 20. století v rozmezí 6× až ≥ 100×. Nárůst incidence EoE byl daleko vyšší než nárůst biopsií z jícnu a také zpětná analýza bioptických vzorků z jícnu z minulosti neukázala velké počty nediagnostikovaných pacientů. Jedná se tedy o reálný nárůst incidence onemocnění, nikoli o vyšší povědomí o této diagnóze a větší počet biopsií z jícnu [4–6].
Podle studie ze Španělska z roku 2018 narůstá výskyt EoE s věkem postupně, vrcholu dosahuje mezi 34. a 45. rokem a pak strmě klesá [7]. Rozdíl mezi vysokým výskytem nemoci v rozvinutých zemích a nízkým výskytem v rozvojových zemích poskytuje prostor pro studium etiologických faktorů, zejména faktorů vlivu prostředí [4].
Etiologie je multifaktoriální, roli hraje genetická predispozice i faktory prostředí, za nejkritičtější období se považují situace v raném dětství jako kojení, způsob vedení porodu, užívání antibiotik nebo expozice infekcím [8,9]. K dalším možným rizikovým faktorům patří vyšší hygienický standard nebo inverzní asociace s infekcí Helicobacter pylori [10–12].
EoE je chronické progresivní onemocnění, v jehož průběhu dochází k remodelaci jícnu a trvalým změnám. S každým rokem opoždění diagnózy se zvyšuje riziko striktury o 9 %. V průběhu nemoci postupně mizí známky akutního zánětu a naopak jsou častější fibrotické změny a striktury [13,14]. Spontánní vymizení jícnové eozinofilie u EoE je vzácné [4]. Vzhledem k tomu, že se jedná o progresivní onemocnění, je klíčová časná diagnostika a léčba.
Diagnostika
Diagnostika EoE se opírá o tři základní pilíře, kterými jsou symptomy dysfunkce jícnu, histologický nález > 15 eozinofilů/HPF, a to pouze v jícnu, ne v jiných orgánech, a dále je nutno vyloučit ostatní příčiny hypereozinofilie. Pravděpodobnost nemoci dále zvyšuje mužské pohlaví, přítomnost atopie a endoskopické známky EoE [1]. Podle mezinárodního konsenzu z roku 2018 již není součástí diagnostiky test s inhibitory protonové pumpy (PPI – proton pump inhibitor), který by prokázal inefektivitu PPI [15].
Klinické příznaky nemoci se liší u dětí a u dospělých. U dětí dominuje zvracení, bolest na hrudi a neprospívání, u dospělých se nejčastěji projevuje dysfagií a váznutím sousta [16]. Příznaky, zejména dysfagie, se objevují průměrně 4,5 roku před stanovením diagnózy [17]. Při podezření na EoE je indikováno gastroskopické vyšetření, kde mohou být přítomny některé endoskopické známky (obr. 1). Endoskopický nález je vhodné popisovat pomocí klasifikace EREFS, která hodnotí přítomnost a tíži otoku, prstenců, exsudátů, rýhování a striktur – edema (0, 1), rings (0, 1, 2, 3), exudates (0, 1, 2), furrows (0, 1), stricture (0,1). Endoskopické známky jsou přítomny u 93 % pacientů s EoE, i když samy o sobě přesně nevypovídají o aktivitě nemoci a efekt léčby nelze hodnotit pouze z endoskopického obrazu bez odběru histologie [18]. I endoskopický nález se liší u dětí a dospělých, u dětí převažují exsudáty, zarudnutí a častější je normální vzhled jícnu, u dospělých dominuje nález prstenců, zúžení a vzhled krepového papíru [16].
Image 1. Endoskopický obraz podélných rýh a striktury v oblasti dolního jícnu.
Fig. 1. Endoscopic appearance of longitudinal furrows and stricture of distalesophagus.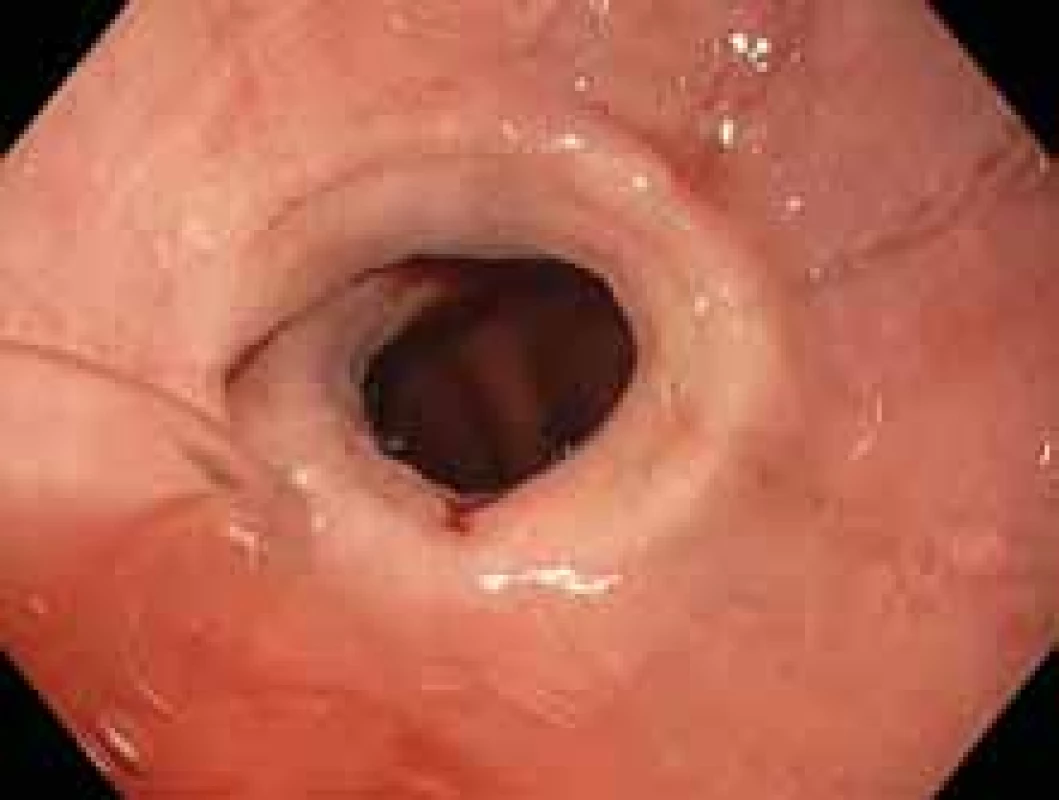
K diagnostice je klíčový nález 15 a více eozinofilů/HPF (60 eozinofilů/mm²) v jícnové biopsii ve standardním barvení pomocí hematoxylin-eozinu. Je doporučeno odebírat min. šest biopsií z různých míst, přičemž nejvýtěžnější jsou biopsie z distálního jícnu. Biopsie by měly být odebírány z patologických míst, zejména z podélných rýh a exsudátů, kde byla prokázána největší denzita eozinofilů [19].
Nově lze při sledování pacientů s EoE využít i endoluminální funkční zobrazovací sondu EndoFLIP, což je funkční vyšetření měřící distenzibilitu jícnu. Ta je u nemocných s EoE výrazně snížena, koreluje s tíží onemocnění a predikuje váznutí sousta v jícnu [1,20].
Dle studie z USA byly definovány tři subtypy EoE lišící se na histologické, endoskopické i molekulární úrovni. Typ 1je mírný, s normálním vzhledem jícnu, s mírnými histologickými, endoskopickými a molekulárními změnami. Typ 2je zánětlivý, s největší expresí zánětlivých cytokinů a genů reagujících na steroidy. Typ 3 je fibrostenotický, se zúženým jícnem, charakterizovaný pokročilým endoskopickým a histologickým nálezem [17,21].
Diferenciální diagnostika
K tomu, abychom mohli stanovit diagnózu EoE, je třeba vyloučit další onemocnění spojená s hypereozinofiií, nejčastěji jde o GERD a achalázii. K dalším diagnózám provázeným hypereozinofilií patří eozinofilní gastroenteritida, hypereozinofilní syndrom, Crohnova nemoc, infekce, onemocnění pojiva, autoimunitní onemocnění, vaskulitidy, poléková hypersenzitivita, kožní onemocnění s postižením jícnu, Marfanův syndrom a další.
Diferenciální diagnostika EoE a GERD je často svízelná. Je prokázáno, že přibližně 20 % pacientů s GERD nereaguje na léčbu PPI, a naopak až u 50 % pacientů s EoE je léčba PPI efektivní [22]. V doporučeních z roku 2014 se ještě psalo o tzv. PPI-responsive jícnové eozinofilii jako o samostatné jednotce, ale dnes se bere jako jeden z fenotypů EoE s odpovědí na PPI [23,24]. V současné době je přístup k oběma diagnózám takový, že EoE a GERD se vzájemně nevylučují, odpověď na PPI můžeme zaznamenat u EoE i GERD. Obě nemoci mohou koexistovat a vzájemně se ovlivňovat. EoE může vést k sekundárnímu refluxu kvůli poruše motility jícnu, a naopak GERD může vést k poruše integrity epiteliální bariéry s následnou hypereozinofilií [4].
Léčba
Cílem léčby by mělo být klinické zlepšení pacienta, úprava histologického nálezu a úprava endoskopického nálezu se zabráněním remodelace jícnu. V současné době jsou k dispozici tři různé léčebné modality. Volba léčebného postupu by měla být individuální a zohledňovat preference pacienta. Kontrola efektu by měla následovat po 8–12 týdnech léčby pomocí endoskopie s odběrem biopsií.
Jedním z možných léků první volby jsou PPI v dávce ekvivalentní 40 mg omeprazolu/den. Podle metaanalýzy z roku 2016 zahrnující 619 pacientů bylo dosaženo histologické remise u 50,5 % pacientů a úpravy symptomů u 60,8 % pacientů [22]. Kromě antisekrečního účinku mají PPI i účinek protizánětlivý, a to zejména díky blokádě exprese eotaxinu 3 [25].
Dalším možným lékem první volby jsou lokálně aplikované topické kortikosteroidy, které mají vliv na genovou regulaci v epiteliálních buňkách jícnu, spouští buněčnou apoptózu a působí proti fibrotizaci jícnu [26]. Topické steroidy jsou léky bezpečné, systémové účinky nebyly u EoE pozorovány, jejich nejčastějším vedlejším účinkem je kandidóza jícnu, která se může objevit u 10 % pacientů a projeví se obvykle zhoršením dysfagie, případně odynofagií. Lék je třeba polknout a po užití být přibližně 30 min nalačno. Používá se buď flutikason inhaler (880–1 760 µg denně pro dospělého, udržovací dávka 880 µg denně), nebo budesonid suspenze (2 mg denně, udržovací dávka 1 mg denně) [27]. Léčbu je doporučeno podávat dlouhodobě, protože po vysazení většina pacientů relabuje. V roce 2019 byla publikována první randomizovaná studie srovnávající flutikason s budesonidem, která prokázala, že oba preparáty mají srovnatelný efekt na úpravu obtíží, endoskopického nálezu a snížení počtu eozinofilů [28]. Recentně byla publikována multicentrická randomizovaná studie, která prokázala účinnost budesonidu ve formě orálně rozpustných tablet [29]. Budesonid je již v této formě v ČR registrován (preparát JORVEZA), zatím však není běžně dostupný a je jej možno pouze individuálně dovézt. Alternativně je však možno připravit suspenzi magistraliter (tab. 1) [26]. Systémové kortikosteroidy nejsou pro léčbu EoE doporučovány.
Table 1. Magistraliter předpis suspenze budesonidu, adaptováno z Menclová et al [26].<{r> Tab. ͷ. Magistraliter prescription of oral viscous budesonide, adapted from Menclová et al [26]. ![Magistraliter předpis suspenze budesonidu, adaptováno
z Menclová et al [26].<{r>
Tab. ͷ. Magistraliter prescription of
oral viscous budesonide, adapted
from Menclová et al [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b5237159bb93a167f190c1e9906c352b.png)
Další léčebnou možností jsou eliminační diety, kterých se popisuje několik druhů podle počtu vysazených potravin. Největší efekt u téměř 80 % pacientů má six food elimination diet (SFED), kdy pacient vynechá mléko, obiloviny obsahující lepek, vejce, luštěniny, ořechy a mořské plody [1,30]. Ukázalo se, že efektivnější je step-up přístup, to znamená začít s vynecháním dvou druhů potravin, už to má efekt u 40 % pacientů, pak postupně přejít na vynechání čtyř druhů a eventuálně i šesti druhů potravin. Prokázalo se, že tato strategie šetří množství endoskopií o 20 % [31]. Možná je i elementární dieta, při které se pacient vyhne všem potravinovým alergenům. Je popsána také dieta 1-4-8, kdy pacient vynechá nejprve pouze mléko, pak mléko, vejce, pšenici a sóju a při neefektivitě omezí k předchozímu i kukuřici, kuřecí, hovězí a vepřové maso, což mělo efekt u 78 % pacientů [32]. Dlouhodobé udržování diety může být v klinické praxi problémem a s nutričním specialistou by měly být konzultovány případné nutriční deficity.
Plošné testování na potravinové alergie u všech pacientů s EoE není dle evropských doporučení efektivní a vynechání zjištěných potravin ve většině případů nevede k úpravě obtíží [1].
U pacientů se symptomatickou stenózou jícnu je vhodná endoskopická léčba pneumatickou dilatací (obr. 2). Dle metaanalýzy z roku 2017 zahrnující 1 820 dilatací u 845 pacientů, z toho 87 pediatrických, je dilatace u EoE bezpečná, s velmi nízkým rizikem perforace. Ve zmiňované metaanalýze byla popsána perforace u 0,38 %, krvácení u 0,05 % a nutnost hospitalizace u 0,67 % pacientů, klinický efekt byl pozorován u 95 % pacientů [33]. Dalším častým endoskopickým výkonem u pacientů s EoE je extrakce impaktovaného sousta, většinou jde o primomanifestaci choroby (obr. 3).
Image 2. Pneumatická dilatace stenózy jícnu.
Fig. 2. Pneumatic dilation of esophageal stenosis.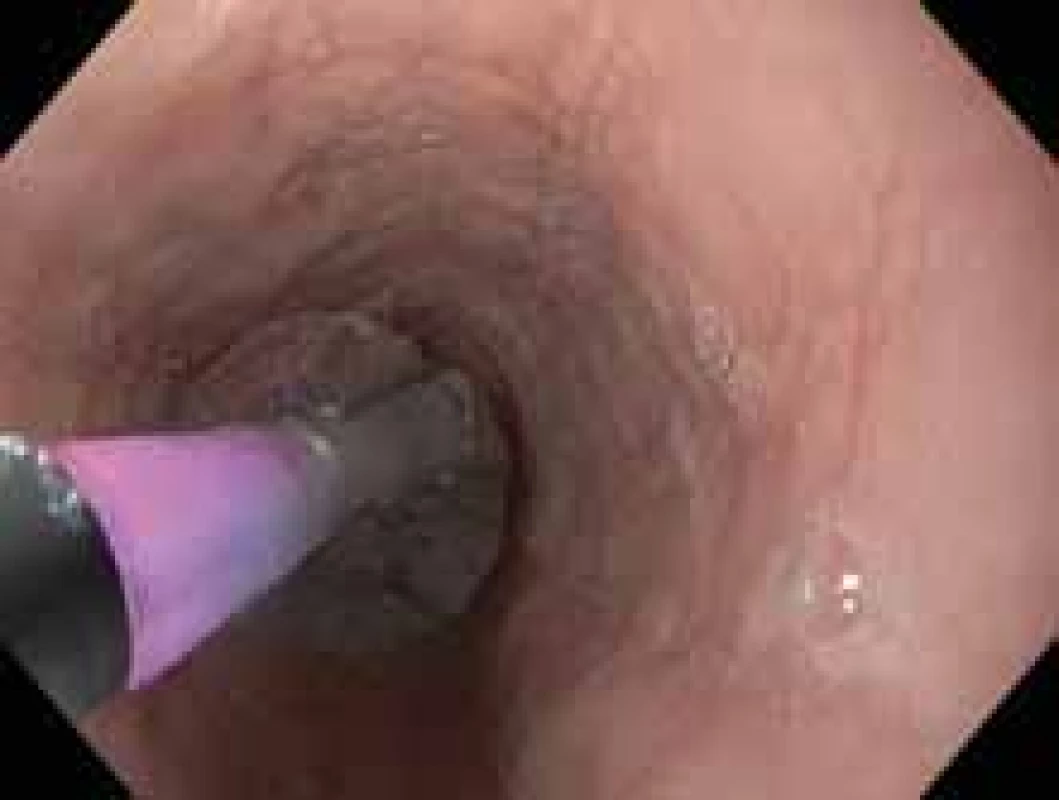
Image 3. Impaktované sousto.
Fig. 3. Impacted food bolus.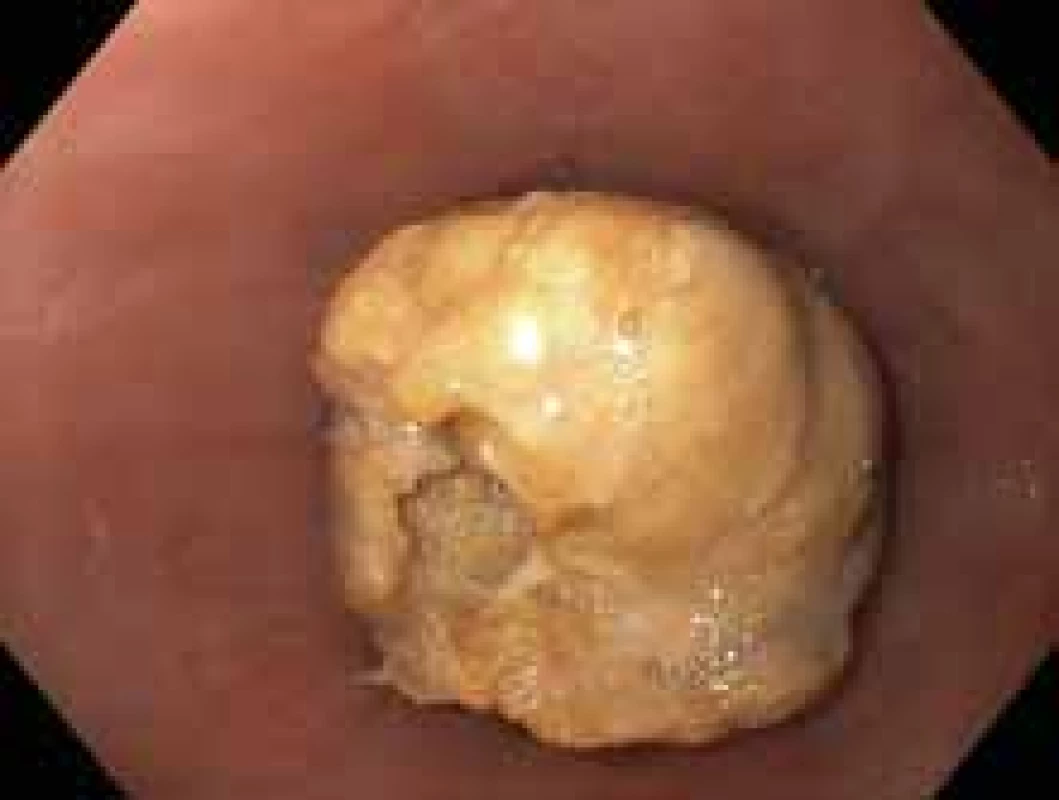
V klinických studiích byl prokázán efekt inhibitorů interleukinu 13, interleukinu 4 (dupilumab), interleukinu 5 (mepolizumab, reslizumab), monoklonálních protilátek anti-IgE, antagonistů prostaglandinových D2 receptorů, antihistaminink a kromolynu, montelukastu a lze použít i thiopuriny nebo infliximab [27]. Při neúspěchu zvolené léčebné metody následuje další možná léčebná modalita až do dosažení remise. Při přetrvávání obtíží a přítomnosti stenózy vhodné k dilataci následuje endoskopická léčba. Po dosažení remise by měla následovat dlouhodobá udržovací léčba (obr. 4).
Image 4. Léčebný algoritmus eozinofilní ezofagitidy pro klinickou praxi, adaptováno z Lucendo et al [1].
Fig. 4. Therapeutic algorithm proposed for eosinophilic esophagitis in clinical practice, adapted from Lucendo et al. [1].![Léčebný algoritmus eozinofilní ezofagitidy pro klinickou praxi, adaptováno z Lucendo et al [1].<br>
Fig. 4. Therapeutic algorithm proposed for eosinophilic esophagitis in clinical practice, adapted from Lucendo et al. [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2e7535b6031fe3f5cc10a198d5d4a993.png)
EoE – eozinofilní ezofagitida, PPI – inhibitory protonové pumpy
EoE – eosinophilic esophagitis, PPI – proton pump inhibitorZávěr
EoE je chronické progresivní onemocnění, proto je klíčová včasná diagnostika a léčba. Diagnostická kritéria zahrnují příznaky dysfunkce jícnu, histologický nález 15 a více eozinofilů/HPF v biopsii z jícnu a vyloučení dalších příčin hypereozinofilie. Měli bychom odebírat min. šest biopsií z různých míst jícnu, zejména z patologicky změněné sliznice. K diagnostice se již nepoužívá test s PPI; PPI jsou však jednou z léčebných možností spolu s topickými steroidy, dietou a pneumatickou dilatací. Po dosažení remise je doporučována dlouhodobá udržovací léčba.
Doručeno/Submitted: 8. 3. 2020
Přijato/Accepted: 23. 3. 2020
MUDr. Ivana Mikoviny Kajzrlíková, Ph.D.
Interní oddělení, Beskydské Gastrocentrum,
Nemocnice ve Frýdku-Místku, p. o.
Elišky Krásnohorské 321
738 01 Frýdek-Místek
Sources
1. Lucendo AJ, Molina-Infante J, Arias Á et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5 (3): 335–358. doi: 10.1177/2050640616689525.
2. Attwood SE, Smyrk TC, Demeester TR et al. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci 1993; 38 (1): 109–116. doi: 10.1007/BF01296781.
3. Straumann A, Spichtin HP, Bernoulli R et al. Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings. Schweiz Med Wochenschr 1994; 124 (33): 1419–1429.
4. Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018; 154 (2): 319–332. doi: 10.1053/j.gastro.2017.06.067.
5. Giriens B, Yan P, Safroneeva E et al. Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993-2013: a population-based study. Allergy 2015; 70 (12): 1633–1639. doi: 10.1111/all.12733.
6. Whitney-Miller CL, Katzka D, Furth EE. Eosinophilic esophagitis: a retrospective review of esophageal biopsy specimens from 1992 to 2004 at an adult academic medical center. Am J Clin Pathol 2009; 131 (6): 788–792. doi: 10.1309/AJCPOMPXJFP7EB4P.
7. Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC et al. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007–2016). United European Gastroenterol J 2018; 6 (1): 29–37. doi: 10.1177/2050640617705913.
8. Jensen ET, Kuhl JT, Martin LJ et al. Early-life environmental exposures interact with genetic susceptibility variants in pediatric patients with eosinophilic esophagitis. J Allergy Clin Immunol 2018; 141 (2): 632–637. doi: 10.1016/j.jaci.2017.07.010.
9. Jensen ET, Dellon ES. Environmental factors and eosinophilic esophagitis. J Allergy Clin Immunol 2018; 142 (1): 32–40. doi: 10.1016/j.jaci.2018.04.015.
10. Okada H, Kuhn C, Feillet H et al. The hygiene hypothesis for autoimmune and allergic diseases: an update. Clin Exp Immunol 2010; 160 (1): 1–9. doi: 10.1111/j.1365-2249.2010.04139.x.
11. Elitsur Y, Alrazzak BA, Preston D et al. Does Helicobacter pylori protect against eosinophilic esophagitis in children? Helicobacter 2014; 19 (5): 367–371. doi: 10.1111/hel.12129.
12. Dellon ES, Peery AF, Shaheen NJ et al. Inverse association of esophageal eosinophilia with Helicobacter pylori based on analysis of a US pathology database. Gastroenterology 2011; 141 (5): 1586–1592. doi: 10.1053/j.gastro.2011.06.081.
13. Warners MJ, Oude Nijhuis RA, de Wijkerslooth LR et al. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort. Am J Gastroenterol 2018; 113 (6): 836–844. doi: 10.1038/s41395-018-0052-5.
14. Schoepfer AM, Safroneeva E, Bussmann C et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology 2013; 145 (6): 1230–1236. doi: 10.1053/j.gastro.2013.08.015.
15. Dellon ES, Liacouras CA, Molina-Infante J et al.Updated international consensus diagnostic criteria for eosinophilic esophagitis: proceedings of the AGREE conference. Gastroenterology 2018; 155 (4): 1022–1033. doi: 10.1053/j.gastro.2018.07.009.
16. Dellon ES, Gibbs WB, Fritchie KJ et al. Clinical, endoscopic and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009; 7 (12): 1305–1313. doi: 10.1016/j.cgh.2009.08.030.
17. Bonis PA, Gupta SK. Clinical manifestations and diagnosis of eosinophilic esophagitis. 2020. [online]. Available from: www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-eosinophilic-esophagitis.
18. Hirano I, Moy N, Heckman MG et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013; 62 (4): 489–495. doi: 10.1136/gutjnl-2011-301817.
19. Salek J, Clayton F, Vinson L et al. Endoscopic appearance and location dictate diagnostic yield of biopsies in eosinophilic oesophagitis. Aliment Pharmacol Ther 2015; 41 (12): 1288–1295. doi: 10.1111/apt.13201.
20. Nicodème F, Hirano I, Chen J et al. Esophageal distensibility as a measure of disease severity in patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2013; 11 (9): 1101–1107. doi: 10.1016/j.cgh.2013.03.020.
21. Shoda T, Wen T, Aceves SS et al. Eosinophilic oesophagitis endotype classification by molecular, clinical and histopathological analyses: a cross-sectional study. Lancet Gastroenterol Hepatol 2018; 3 (18): 477–488. doi: 10.1016/S2468-1253 (18) 30096-7.
22. Lucendo AJ, Arias Á, Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2016; 14 (1): 13–22. doi: 10.1016/j.cgh.2015.07.041.
23. Molina-Infante J, Gonzalez-Cordero PL, Lucendo AJ. Proton pump inhibitor – responsive esophageal eosinophilia: still a valid diagnosis? Curr Opin Gastroenterol 2017; 33 (4): 285–292. doi: 10.1097/MOG.0000000000000371.
24. Molina-Infante J, Lucendo AJ. Proton pump inhibitor therapy for eosinophilic esophagitis: a paradigm shift. Am J Gastroenterol 2017; 112 (12): 1770–1773. doi: 10.1038/ajg.2017.404.
25. Cheng E, Zhang X, Huo X et al. Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD. Gut 2013; 62 (6): 824–832. doi: 10.1136/gutjnl-2012-302250.
26. Menclová A, Hojný M, Dulavová M et al. Nové možnosti léčby eozinofilní ezofagitidy pomocí magistraliter připravovaného léčiva. Prakt lékáren 2016; 12 (1): 26–28. doi: 10.36290/lek.2016.006.
27. Bonis PA, Gupta SK. Treatment of eosinophilic esophagitis. 2019. [online]. Available from: www.uptodate.com/contents/treatment-of-eosinophilic-esophagitis.
28. Dellon ES, Woosley JT, Arrington A et al. Efficacy of budesonide vs fluticasone for initial treatment of eosinophilic esophagitis in a randomized controlled trial. Gastroenterology 2019; 157 (1): 65–73. doi: 10.1053/j.gastro.2019.03.014.
29. Lucendo AJ, Miehlke S, Schlag C et al. Efficacy of budesonide orodispersible tablets as induction therapy for eosinophilic esophagitis in a randomized placebo-controlled trial. Gastroenterology 2019; 157 (1): 74–86. doi: 10.1053/j.gastro.2019.03.025.
30. Arias A, Gonzalez-Cervera J, Tenias JM et al.Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology 2014; 146 (7): 1639–1648. doi: 10.1053/j.gastro.2014.02.006.
31. Molina-Infante J, Arias A, Alcedo J et al. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: the 2–4–6 study. J Allergy Clin Immunol 2018; 141 (4): 1365–1372. doi: 10.1016/j.jaci.2017.08.038.
32. Zhan T, Ali A, Choi JG et al. Model to determine the optimal dietary elimination strategy for treatment of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2018; 16 (11): 1730–1737. doi: 10.1016/j.cgh.2018.04.013.
33. Moawad FJ, Molina-Infante J, Lucendo AJ et al.Systematic review with meta-analysis: endoscopic dilation is highly effective and safe in children and adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017; 46 (2): 96–105. doi: 10.1111/apt.14123.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 3-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Impact of the COVID-19 pandemic on endoscopy practice in the Czech Republic – survey research
- Disconnected pancreatic duct syndrome – a neglected complication of acute pancreatitis
- Motorized spiral enteroscopy – our first experience
- Eosinophilic esophagitis – current overview of diagnostic and treatment modalities
- Projekt „Endoskopická centra“v České republice
- Current scientific background of Crohn’s Disease Exclusion Diet (CDED)
- Budesonide MMX in the treatment of ulcerative colitis
- An unusual case of upper type dysphagia
- Renal illness in patients with inflammatory bowel disease
- In memory of assoc. prof. Jan Kotrlík
- MUDr. Marek Beneš died on June 18, 2020 at the age of 44
- The selection from international journals
- Správná odpověď na kvíz: Ischemická kolitida na podkladě trombózy dolní mezenterické žíly
- Perioperative oesophagogastroduodenoscopy in the prevention and therapy of anastomotic complications – a review
- Herpetic esophagitis in a 7-year-old immunocompetent patient
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eosinophilic esophagitis – current overview of diagnostic and treatment modalities
- MUDr. Marek Beneš died on June 18, 2020 at the age of 44
- An unusual case of upper type dysphagia
- Motorized spiral enteroscopy – our first experience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

