-
Medical journals
- Career
Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
: H. Gottfriedová 1; E. Honsová 2; D. Cupalová 3; M. Oliverius 4; D. Kautznerová 3; L. Morávková 1; J. Špičák 1; P. Trunečka 5
: Klinika hepatogastroenterologie, IKEM, Praha 1; Pracoviště klinické a transplantační patologie, IKEM, Praha 2; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 3; Klinika transplantační chirurgie, IKEM, Praha 4; Transplantcentrum, IKEM, Praha 5
: Gastroent Hepatol 2015; 69(1): 56-64
: Hepatology: Review article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh201556Fokální nodulární hyperplazie a adenomy jsou benigní hepatocelulární afekce. Riziko život ohrožujícího krvácení a maligního zvratu u adenomů vyžaduje přesnou diagnózu obou jednotek a jejich odlišení nejen od sebe navzájem, ale i od jiných tumorů jater. Pokrok v oblasti zobrazovacích metod a zejména v histopatologické diagnostice významně zpřesnil odlišení těchto lézí nejen na úrovni zobrazovacích metod, ale i v resekátech a jehlových biopsiích. Magnetická rezonance s hepatospecifickou kontrastní látkou hraje důležitou roli v diagnóze, v odlišení některých subtypů adenomů a v detekci komplikací adenomů; umožňuje také diferenciální diagnózu adenomu a fokální nodulární hyperplazie. Využití genetických a na ně navazujících imunohistochemických metod dovoluje odlišit podskupiny adenomů s různým rizikem krvácení a maligního zvratu – to umožňuje individualizovanou léčbu chirurgickou u vysoce rizikových forem a konzervativní léčbu u malých ložisek s nízkým rizikem maligní transformace. Diagnóza je výsledkem komplexního zhodnocení klinického a laboratorního obrazu, zobrazovacích metod a morfologického zhodnocení. Terapeutický přístup je individuální a vyžaduje multidisciplinární spolupráci zkušených odborníků.
Klíčová slova:
fokální nodulární hyperplazie – adenom jater – subtypy adenomů – diagnóza – léčba
Fokální nodulární hyperplazie (FNH) a hepatocelulární adenomy (HCA) jsou benigní afekce jater, které se vyskytují významně častěji u žen (FNH 8 : 1, HCA 9 : 1). V posledních letech došlo k významnému posunu v oblasti rentgenové a zejména histopatologické diagnostiky. Molekulárně‑genetické metody a navazující imunofenotyp využívající imunohistochemické postupy zpřesnily morfologickou diagnostiku a umožnily odlišení těchto dvou afekcí. HCA byly podle molekulárních charakteristik rozděleny do čtyř subtypů, které se liší biologickým chováním a rizikem maligního zvratu. Tímto se mění i klinický přístup, který umožňuje rozlišit jedince s nutností resekce a jedince, u nichž je možné se resekci vyhnout a nález pouze sledovat. Vzhledem k tomu, že se ve většině případů jedná o ženy v reprodukčním věku, nelze opominout vliv těhotenství.
Fokální nodulární hyperplazie
FNH je druhým nejčastějším benigním ložiskem v játrech (po hemangiomu), v běžné populaci se vyskytuje v 0,6 – 3 %. Významně častěji postihuje ženy, v 80 – 90 % případů je u nich diagnostikována ve 3. a 4. dekádě života. Ve 2/ 3 případů se jedná o solitární výskyt, v 1/ 3 o mnohočetný, ve 20 % případů se vyskytuje společně s hemangiomy. Koexistence s HCA je též možná.
S největší pravděpodobností představuje typická FNH proliferaci hepatocytů jako reakci na arteriální malformaci, tj. vývojovou vrozenou anomálii [1]. Jde tedy spíše o hyperplastickou než neoplastickou lézi. Tuto myšlenku podporuje výskyt FNH spolu s některými vzácnějšími onemocněními s vaskulárními anomáliemi jako hereditární teleangiektázie (m. Osler ‑ Weber ‑ Rendu), ageneze portální žíly a Budd‑Chiari syndrom.
Diagnóza FNH
Makroskopicky je FNH tuhý uzel různé velikosti (od několika mm do desítek cm), na řezu je patrna centrální jizva, která se paprsčitě rozbíhá do periferie. Centrální jizva nebývá přítomna u menších ložisek. FNH se může z jater vyklenovat, dokonce může z jater „viset“ a s ostatním parenchymem být spojena jen tenkým můstkem.
Většina FNH je diagnostikována náhodně při zobrazovacích vyšetřeních z jiné indikace nebo během operace. Velké FNH mohou působit tlak a bolesti břicha. Laboratorně bývají obvykle normální hodnoty jaterních enzymů, bilirubinu i nádorových markerů. Hlavním diferenciálně‑diagnostickým problémem je odlišení FNH od jiných benigních (HCA) nebo maligních nádorů jater (hepatocelulární karcinom – HCC).
Zobrazovací metody
FNH v ultrazvukovém obraze: v normálních játrech je většinou izoechogenní či lehce hypoechogenní, celkově je špatně odlišitelná od okolí, někdy je patrna dislokace cév (obr. 1).
1. UZ vyšetření – ložisko FNH má stejnou echogenitu jako okolní jaterní parenchym, částečně se vyklenuje z jater. Fig. 1. Ultrasound examination – FNH has the same echogenity as the surrounding liver parenchyma, FNH is partially outside the liver. 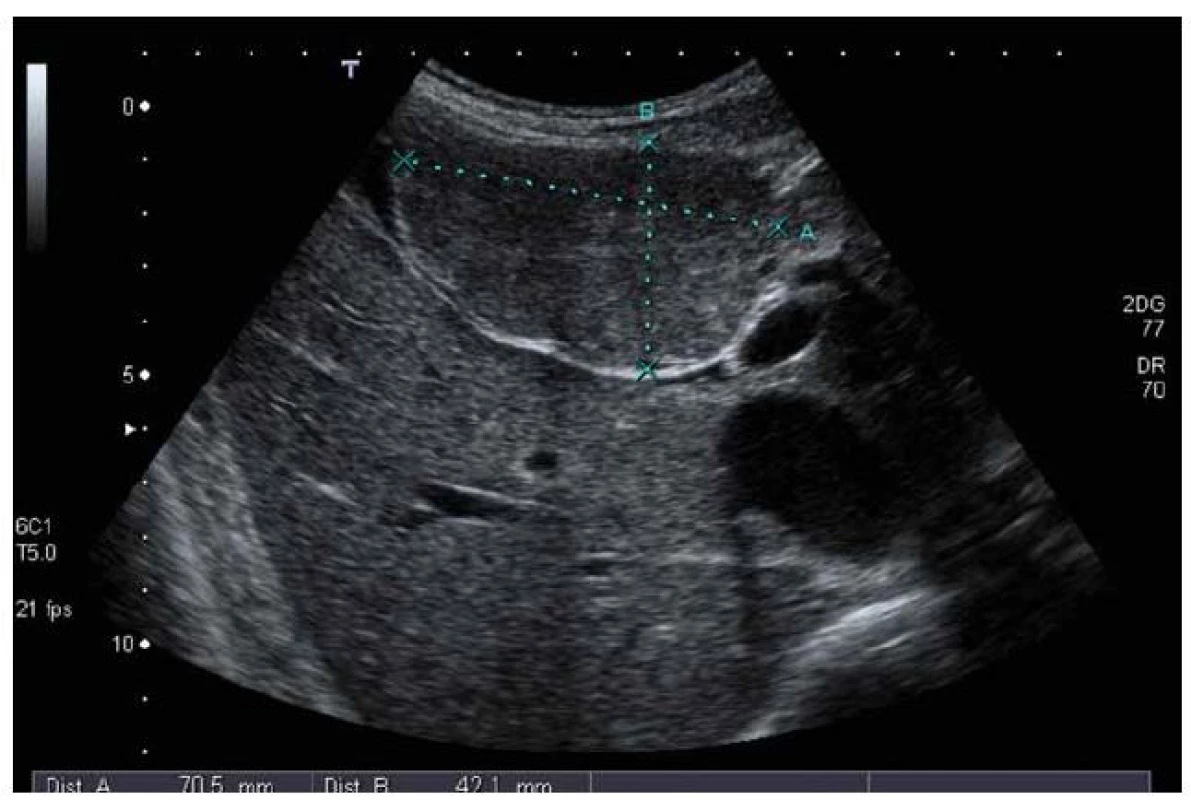
V terénu steatózy je relativně lépe vidět – hypoechogenní ložisko v hyperechogenním jaterním parenchymu. Při dopplerovském vyšetření je patrno nápadné prokrvení, které má loukoťovité uspořádání. Při aplikaci echokontrastní látky dochází k rychlému nasycení a následně k pomalému vymývání mikrobublin.
FNH v CT obraze: v normálních játrech je na nativních obrazech izodenzní či lehce hypodenzní, po aplikaci kontrastní látky ((KL)) intravenózně se v arteriální fázi nápadně převážně homogenně sytí a je přítomna centrální hypodenzní jizva. Ve venózní fázi sycení přetrvává (obr. 2).
2. CT vyšetření u stejného pacienta jako na obr. 1 – FNH v arteriální (a) a venózní (b) fázi. V arteriální fázi se FNH oproti játrům výrazně sytí, ve venózní fázi sycení přetrvává. Fig. 2. CT scans from the same patient as in fig. 1 – FNH in arterial (a) and venous (b) phase. In the arterial phase FNH significantly feeds contrast medium in comparison with surrounding liver parenchyma, in venous phase saturation persists. 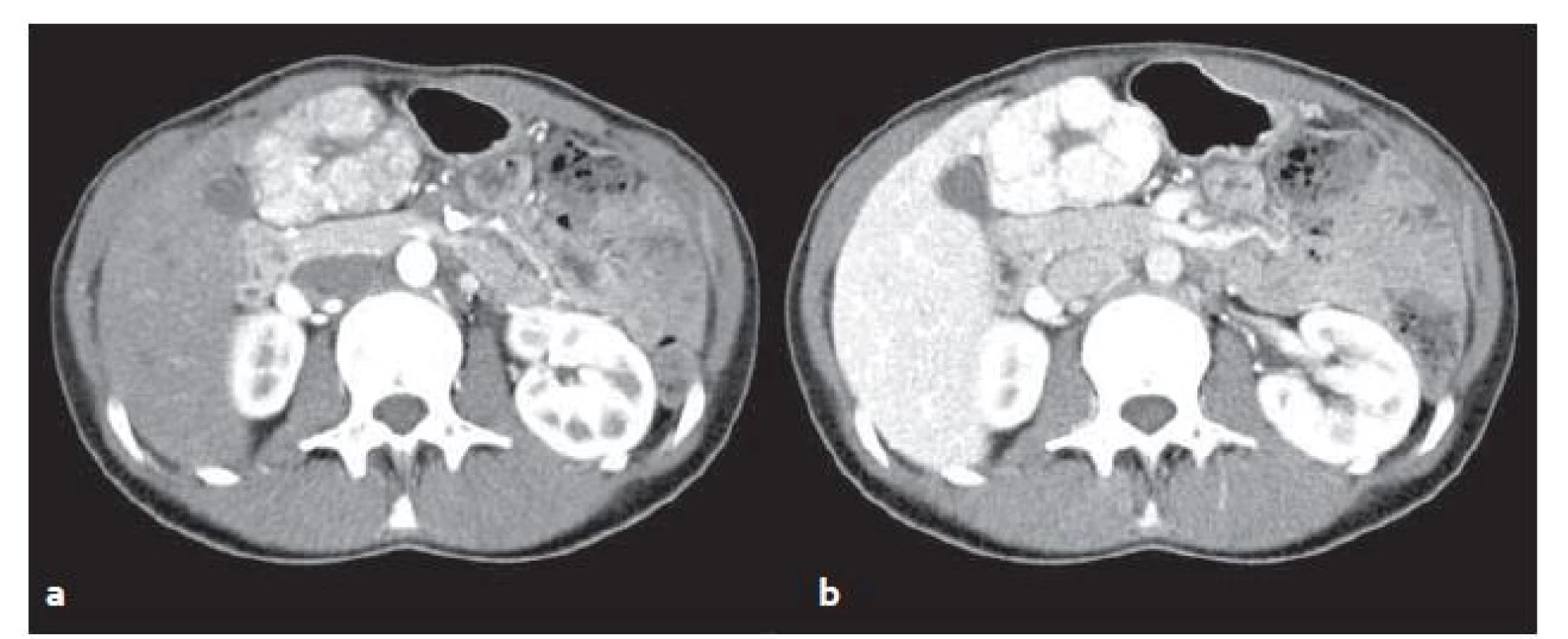
U typické FNH jsou patrny lobulované kontury. U malých FNH (menší než 3 cm) může chybět centrální jizva.
FNH v MR obraze: MR s použitím hepatospecifické KL má nejvyšší senzitivitu i specificitu. V nativních sekvencích je FNH izo ‑ či lehce hyperintenzní v T2 vážených obrazech (T2W) a izo ‑ či lehce hypointenzní v T1 vážených obrazech (T1W). Pokud je přítomna jizva, tak je typicky T2 hyperintenzní (fibrolamelární HCC může mít též centrální jizvu, ale je T2 hypointenzní). Pokud jsou játra steatotická, vynikají ložiska FNH v T1W v protifázi, jelikož okolní parenchym se stává nápadně hypointenzní. Po aplikaci KL se FNH nápadně sytí v arteriální fázi, sycení přetrvává do venózní fáze. Centrální jizva ve FNH má typicky pozdní sycení. FNH má poměrně typický obraz v pozdní, hepatobiliární fázi (za 15 – 20 min po aplikaci KL intravenózně), pokud se podá hepatospecifická KL. V této fázi je FNH izo ‑ či lehce hyperintenzní vůči okolnímu parenchymu (obr. 3) [2].
3. MR vyšetření – FNH v T2 vážené sekvenci (T2W ) transverzální (tra) haste 2D trigované (synchronizované s dýcháním) bez potlačení tuku (a), v T1 vážené sekvenci (T1W) vibe tra s potlačením tuku v arteriální fázi (b), ve venózní fázi (c) a v hepatobiliární fázi (d). Centrální jizva viditelná ve všech sekvencích, v T2W (a) je hyperintenzní (bílá), po aplikaci KL je hypointenzní (černá). Fig. 3. MR examination – FNH in T2 weighted sequence (T2W) transverse (tra) haste 2D triggered (synchronized with the breathing) without fat suppression (a), in T1 weighted sequence (T1W) vibe tra without fat in the arterial phase (b), in the venous phase (c) and in the hepatobiliary phase (d). The central scar is visible in all the sequences, in T2W (a) is hyperintense (white), after application of contrast medium is hypointense (black). 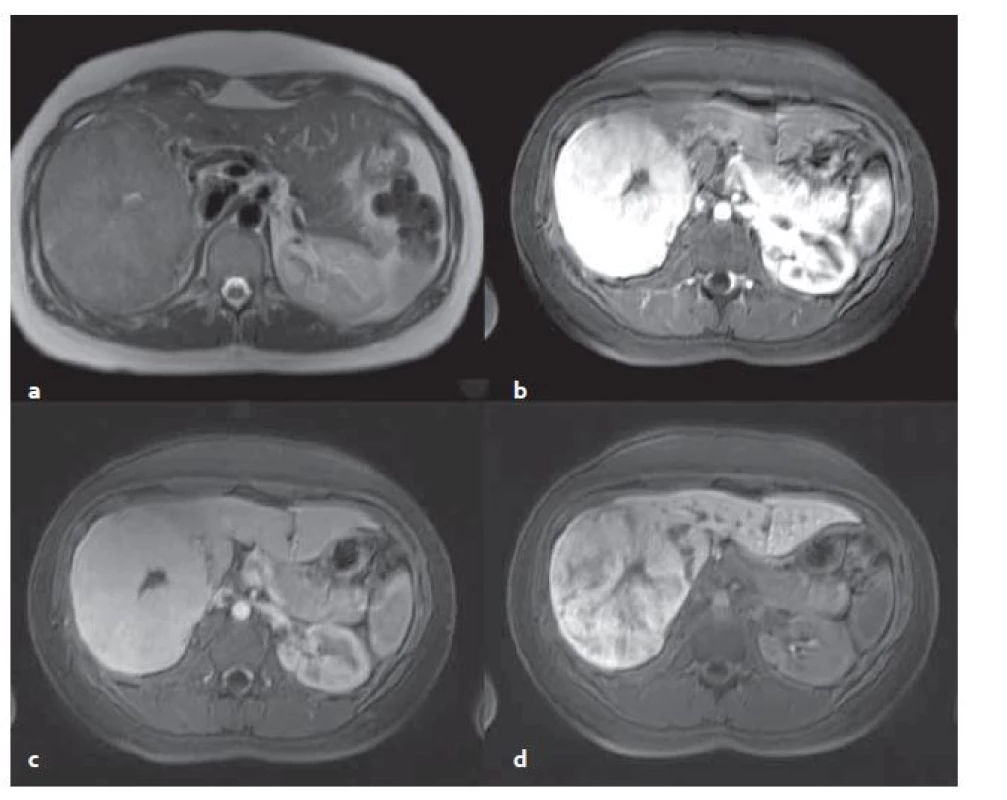
Histopatologie
Pokud jsou nálezy na zobrazovacích metodách jednoznačné, není třeba provádět biopsii. V nejasných případech vyžaduje diagnóza histologické ověření. Histologická diagnóza v resekátu bývá jednodušší, protože patolog má přehled přes celou afekci. Typickou FNH, kterou tvoří oproti okolní tkáni dobře ohraničené ložisko bez pouzdra, na řezu s centrální paprsčitou jizvou, rozpozná patolog již z makroskopického nálezu. Jizva se paprsčitě rozbíhá do periferie a vytváří vazivová septa s aberantními cévami a na periferii sept je duktulární proliferace. Proto periferní části velmi napodobují cirhotickou přestavbu a v mikroskopu je FNH popisována jako fokální cirhóza v necirhotických játrech. K odlišení od cirhózy přispívá imunohistochemický průkaz glutamin syntetázy (GS), který je ve FNH mapovitý. Exprese β ‑ cateninu je normální (tj. membránová). V jehlové biopsii se může stát, že zachytíme periferii FNH, kde není centrální jizva a ani vazivová septa nemusí být zachycena. Vodítkem v takových případech je nepravidelné uspořádání tkáně bez normálně konfigurovaných portálních polí. Výše zmíněné imunohistochemické průkazy podpoří diagnózu.
Komplikace FNH
V dlouhodobém průběhu ložiska FNH ve většině případů neprogredují. Riziko krvácení nebo maligní transformace prakticky neexistuje. V literatuře je popsáno jen několik případů intraperitoneálního krvácení [3]. Vzácná je rekurence FNH po předchozí resekci [4].
Léčba FNH
Přístup k jedincům s FNH je konzervativní. Pokud je diagnóza jednoznačná, nejsou doporučována klinická ani zobrazovací vyšetření v rámci pravidelného sledování s výjimkou symptomatických a velkých ložisek a ložisek v terénu chronického jaterního onemocnění.
Chirurgická resekce je zvažována v případech velkých FNH s bolestmi břicha, s útlakem cév a žlučovodů, v případech diagnostických rozpaků, progrese velikosti nebo při výrazné změně charakteru ložiska. V těchto případech je nutné postupovat individuálně.
FNH a těhotenství
Estrogeny významně neovlivňují klinický průběh FNH, ale omezenou roli v jejím průběhu pravděpodobně mají [5]. Hormonální antikoncepce není zakázána, v praxi ji však většinou nedoporučujeme. Těhotenství je možné. Průběh gravidity bývá většinou nekomplikovaný. V případě větších FNH je vhodné indikovat porod císařským řezem.
Hepatocelulární adenomy
HCA jsou poměrně vzácné nádory s incidencí kolem 3 – 4/ 100 000 v Evropě a Severní Americe. Zřetelně nižší incidence HCA je v Asii, je to velmi pravděpodobně důsledek omezeného užívání hormonální antikoncepce a používání jiných metod kontrolované reprodukce v této oblasti [6]. Nádor se vyskytuje vzácně u mužů, dětí a starých jedinců.
Postižené jsou nejčastěji ženy v reprodukčním věku, které mají v anamnéze užívání hormonální antikoncepce. Poprvé byla tato asociace popsána v roce 1973 [7]. Roční incidence HCA je u dlouhodobých uživatelek hormonální léčby cca 30krát vyšší než u žen, které ji nikdy neužívaly [8]. Po vysazení antikoncepce nebo po menopauze adenomy mohou regredovat. Dalšími rizikovými faktory jsou anabolické steroidy, některé vzácnější poruchy metabolizmu – glykogenózy I a III a tyrozinemie, častá je asociace s obezitou, steatózou jater a metabolickým syndromem.
HCA podle molekulárních charakteristik rozdělujeme do čtyř skupin:
- hepatocyte nuclear factor 1α (HNF 1α), HNF 1 inaktivovaný HCA (H ‑ HCA),
- HCA s aktivací β ‑ cateninu (b ‑ HCA),
- zánětlivý HCA (I ‑ HCA),
- blíže nespecifikovaný HCA.
Diagnóza HCA
HCA obvykle tvoří solitární ložisko o velikosti od několika mm až po desítky cm. Není ohraničen vazivovým pouzdrem. Až 1/ 3 jedinců s adenomy má mnohočetná ložiska.
Klinické projevy HCA jsou rozmanité: od klinicky němých forem, kdy je adenom náhodným nálezem při vyšetření z jiných příčin, přes bolesti břicha a hmatnou rezistenci při palpačním vyšetření jater až po náhlou příhodu břišní.
U větších ložisek může být přítomna laboratorní cholestáza, u zánětlivých adenomů bývá zvýšená hladina C reaktivního proteinu, pro kterou není jiné vysvětlení. Nádorové markery jsou v normálním rozmezí.
Zobrazovací metody
Obraz adenomů v zobrazovacích metodách je rozmanitý a záleží na obsahu jednotlivých složek – tuk, nekrózy, krvácení.
HCA v UZ obraze: jsou většinou nehomogenní s komplexní strukturou a jsou dobře ohraničené.
HCA v CT obraze: jsou nápadné sycením v arteriální fázi, rychlost vymývání KL závisí na typu adenomu (obr. 4).
4. CT vyšetření – mnohočetné zánětlivé adenomy v arteriální (a) a venózní (b) fázi. Sytí se v arteriální fázi, ve venózní fázi sycení přetrvává. Fig. 4. CT scans – multiple inflammatory adenomas in arterial (a) and venous (b) phase. Adenomas feed contrast medium in the arterial phase, in venous phase saturation persists. 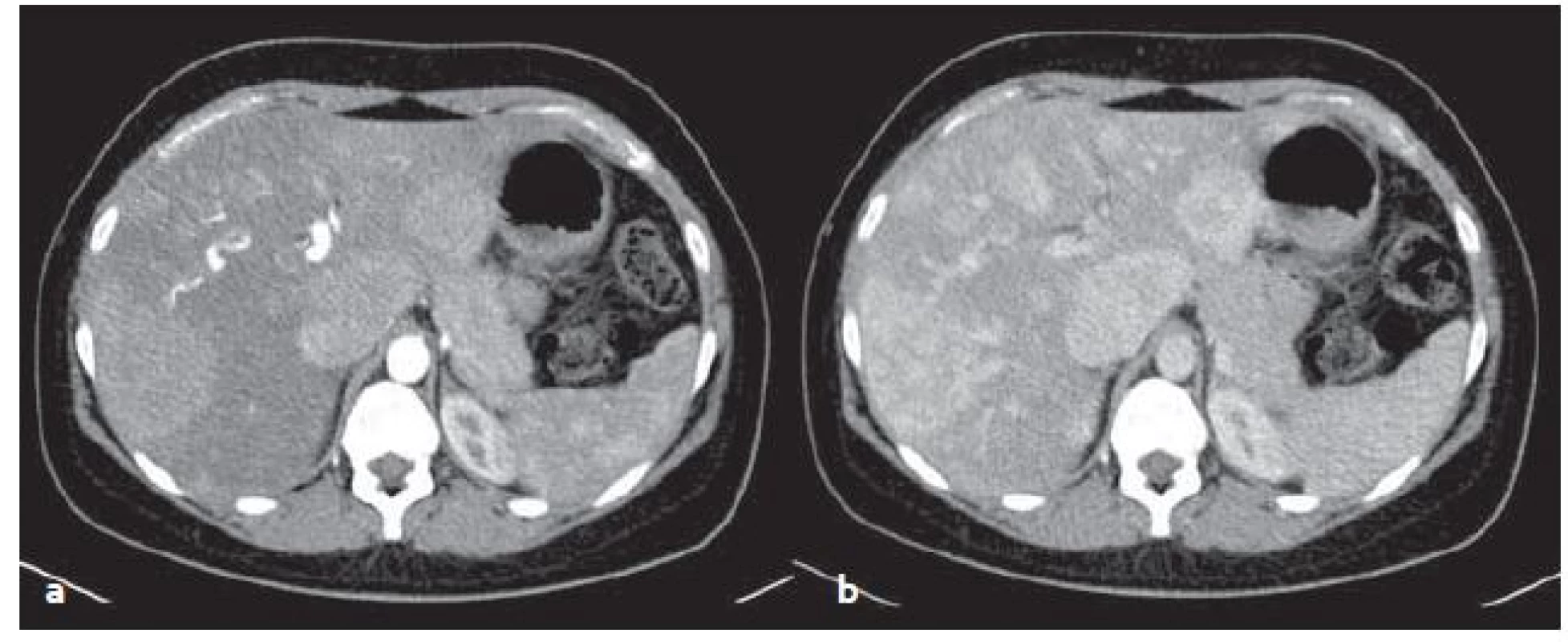
HCA v MR obraze: typický obraz mají H ‑ HCA a I ‑ HCA a tyto dva typy adenomů lze odlišit.
H ‑ HCA jsou homogenní, lehce hyperintenzní na T2W a lehce hypointenzní na T1W obrazech, na T1W obrazech ve fázi a protifázi (in‑opp sekvence) homogenně snižují signál v protifázi, což svědčí pro obsah tuku v hepatocytech (steatóza uvnitř adenomu). Po aplikaci KL intravenózně se sytí v arteriální fázi. V hepatobiliární fázi (při aplikaci hepatospecifické KL) jsou hypointenzní.
Zánětlivé adenomy mají nehomogenní strukturu, jsou přítomny okrsky nekróz či krvácení. V T1W jsou zde hyperintenzní okrsky – krvácení, tuk, střádání glykogenu. Dále jsou v T2W sekvencích přítomny ohraničené hyperintenzity, což je typické právě pro tento typ adenomů – senzitivita 85,2 %, specificita 87,5 % [9]. Po aplikaci KL se sytí v arteriální fázi, ve venózní fázi kontrast přetrvá. V hepatobiliární fázi jsou tyto adenomy hypointenzní vůči okolnímu parenchymu, někdy může vzniknout obraz atolu – periferní hyperintenzita s centrální hypointenzitou (obr. 5).
5. MR vyšetření – stejný pacient jako na obr 4. Mnohočetné adenomy v T2W tra haste 2D trigované bez potlačení tuku (a), v T1W vibe tra s potlačením tuku v arteriální fázi (b), ve venózní fázi (c) a v hepatobiliární fázi (d) . Typický pro zánětlivý adenom je jeho vyšší signál v T2W. Fig. 5. MR examination from the same patient as in fig. 4. Multiple adenomas in T2W tra haste 2D triggered without fat suppression (a), in T1W vibe tra without fat in the arterial phase (b), in the venous phase (c) and in the hepatobiliary phase (d). Typical for the inflammatory adenoma is its‘ higher signal in T2W. 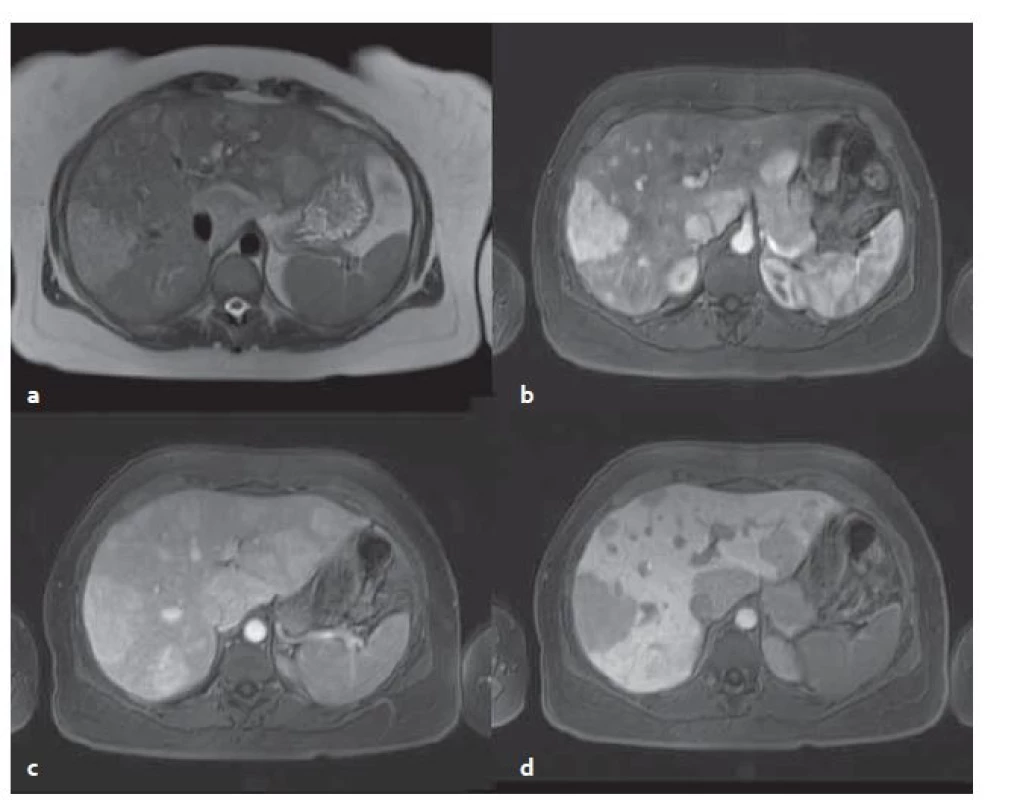
Zbylé dva typy adenomů b ‑ HCA a blíže nespecifikovaný adenom nemají při MR vyšetření typický obraz (obr. 6).
6. MR vyšetření – blíže nespecifikovaný adenom v levém laloku s okrsky nekróz a krvácení v terénu steatózy. T2W tra haste 2D trig bez potlačení tuku (a), v T1W ge 2D in (b), opp (c) – dobře patrná změna signálu jater při steatóze. Fig. 6. MR examination – unclassified adenoma in the left lobe of steatotic liver with necrosis and bleeding. T2W tra haste 2D trig without fat suppression (a) in TW1 ge 2D in (b), opp (c) – change of the signal in steatosis is evident. 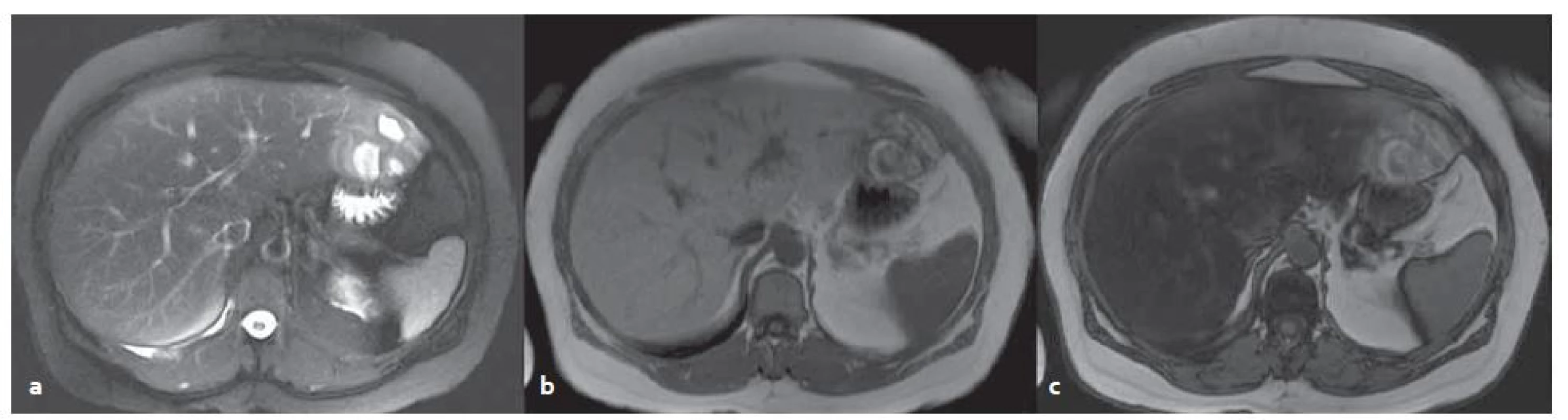
Někdy je velmi obtížné zobrazovacími metodami odlišit HCA od dobře diferencovaného HCC.
Histopatologie
Molekulární klasifikace HCA umožnila rozlišení čtyř subtypů, které se liší některými morfologickými znaky, klinickou symptomatologií a prognózou. V histopatologické diagnostice se využívá fenotypu HCA, který odpovídá molekulárním charakteristikám a současně umožňuje diagnosticky použít imunohistochemické metody, které jsou technicky méně náročné a relativně levné [10,11].
Genotypická klasifikace
Skupina 1: hepatocyte nuclear factor 1α (HNF 1α), HNF 1 inaktivovaný HCA (H ‑ HCA)
Gen TCF1/ HNF1A kóduje „hepatocyte nuclear factor 1α“, který ovlivňuje diferenciaci hepatocytů. Inaktivace genu u tohoto typu adenomu jsou bialelické a somatické (více než 90 %). Heterogenní zárodečné mutace HNF1A jsou příčinou familiárního non‑inzulin dependentního DM u mladých pacientů (typu MODY3) a pacienti s jednou germinální a jednou somatickou mutací mají vedle MODY3 i adenomatózu jater.
H ‑ HCA představuje 35 – 40 % ze všech adenomů jater a objevuje se téměř výhradně u žen.
Diagnóza adenomu této podskupiny je vysoce suspektní již na úrovni hematoxylinu ‑ eozinu (HE). Ve většině případů je v ložisku steatóza a hepatocyty nemají cytologické atypie. Současně není v adenomu zánětlivá celulizace.
V diagnostice se využívá chybění exprese L ‑ FABP (liver fatty acid binding protein), který je cílovým proteinem transkripce HNF1 a zcela chybí v hepatocytech tohoto typu adenomu. V okolních normálních hepatocytech je vždy difuzní exprese.
Hranice pozitivního a negativního průkazu je tak jednoznačná, že umožní definovat nepravidelné okraje často lobulárně uspořádaného tumoru. Negativní průkaz L ‑ FABP potvrzuje diagnózu H ‑ HCA.
Skupina 2: HCA s aktivací β ‑ cateninu (b ‑ HCA)
Mutace aktivující β ‑ catenin se objevuje u cca 10 – 15 % HCA a navíc u 10 % zánětlivých HCA (viz další skupina).
V diagnostice na úrovni HE bývá minimum steatózy, jsou nukleární atypie a architektura rozetovitých formací, což vyvolává diferenciálně diagnostické rozpaky při odlišení od HCC.
K zařazení se používá průkaz β ‑ cateninu a glutamin syntetázy (GS). Glutamin syntetáza je cílovým genem pro β ‑ catenin (GS katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky). V normálních játrech je cytoplazmatická exprese GS lokalizovaná pouze v centrolobulární oblasti, zatímco exprese β ‑ cateninu je normálně membránová a difuzní. V nádoru se změní exprese β ‑ cateninu na jadernou a pozitivní průkaz GS se rozšíří a je plošný (obr. 7,8).
7. Imunohistochemický průkaz β-cateninu. Normální membránová pozitivita v adenomu (tj. bez mutace β-cateninu). Fig. 7. Immunohistochemical detection of β-catenin. Normal membrane positivity in adenoma (i.e. without a mutation of β-catenin). 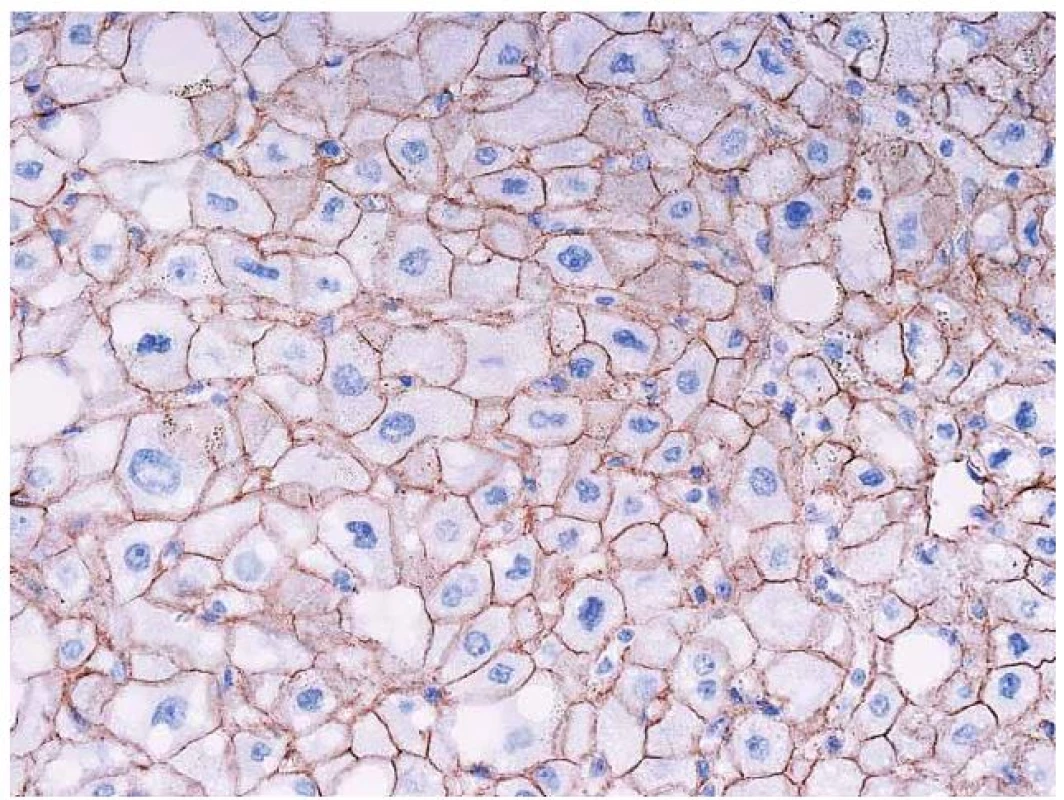
8. Imunohistochemický průkaz glutamin syntetázy (GS). Dole normální detekce v hepatocytech centrolobulárně (šipky). Nahoře plošně pozitivní průkaz v adenomu. Fig. 8. Immunohistochemical detection of glutamine synthetase (GS). At the bottom of image is normal detection in centrolobular hepatocytes (arrows). At the top of image GS is diffusely expressed. 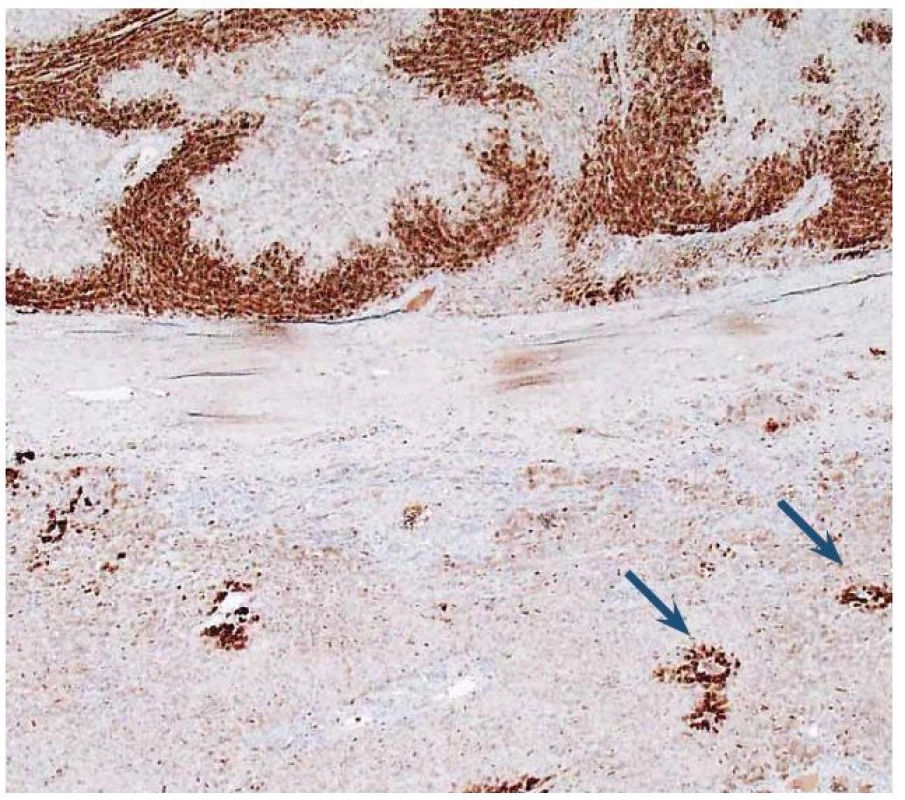
HCA v této kategorii představují vysoké riziko maligní transformace do HCC. Někteří autoři se domnívají, že tumory v této kategorii již představují dobře diferencované HCC [12].
Skupina 3: zánětlivý HCA (I ‑ HCA)
Tento typ adenomu představuje 40 – 50 % z celkového počtu. Jde o nejčastější variantu HCA vyskytující se u mužů. Část z těchto případů spadala dříve do podskupiny FNH, tzv. teleangiektatické formy. Tato varianta často neměla centrální jizvu, na druhé straně její mikroskopické uspořádání s dilatovanými sinusy, nepárovými arteriemi a hemoragiemi stavělo afekci na pomezí mezi FNH a adenom. Pozdější genetické studie s průkazem klonality vedly k reklasifikování jednotky, která je nyní považována za adenom a prakticky vždy spadá do podskupiny I ‑ HCA. Pacienti s touto formou nádoru jsou často obézní, kuřáci s kladným vztahem k alkoholu. Mají známky tzv. zánětlivého syndromu včetně vysokých hladin sérum reaktivního proteinu (CRP). Na pozadí afekce jsou genetické mutace ovlivňující gen interleukinu 6 (> 60 %), který kóduje gp130, součást IL‑6 receptoru. Mutace vede k aktivaci receptoru, což následně indukuje odpověď s produkcí proteinů akutní fáze zánětlivé odpovědi v hepatocytech. Toho se s úspěchem využívá v morfologické diagnostice. Nádorové buňky jsou difuzně sérum amyloid A (SAA) pozitivní bez ohledu na rozsah zánětlivé celulizace ve tkáni (obr. 9).
9. Imunohistochemický průkaz serum amyloid A (SAA) s granulární pozitivitou v hepatocytech odpovídá tzv. zánětlivému adenomu. Fig. 9. Immunohistochemical detection of serum amyloid A (SAA) with granular positivity in hepatocytes corresponds to the inflammatory adenoma. 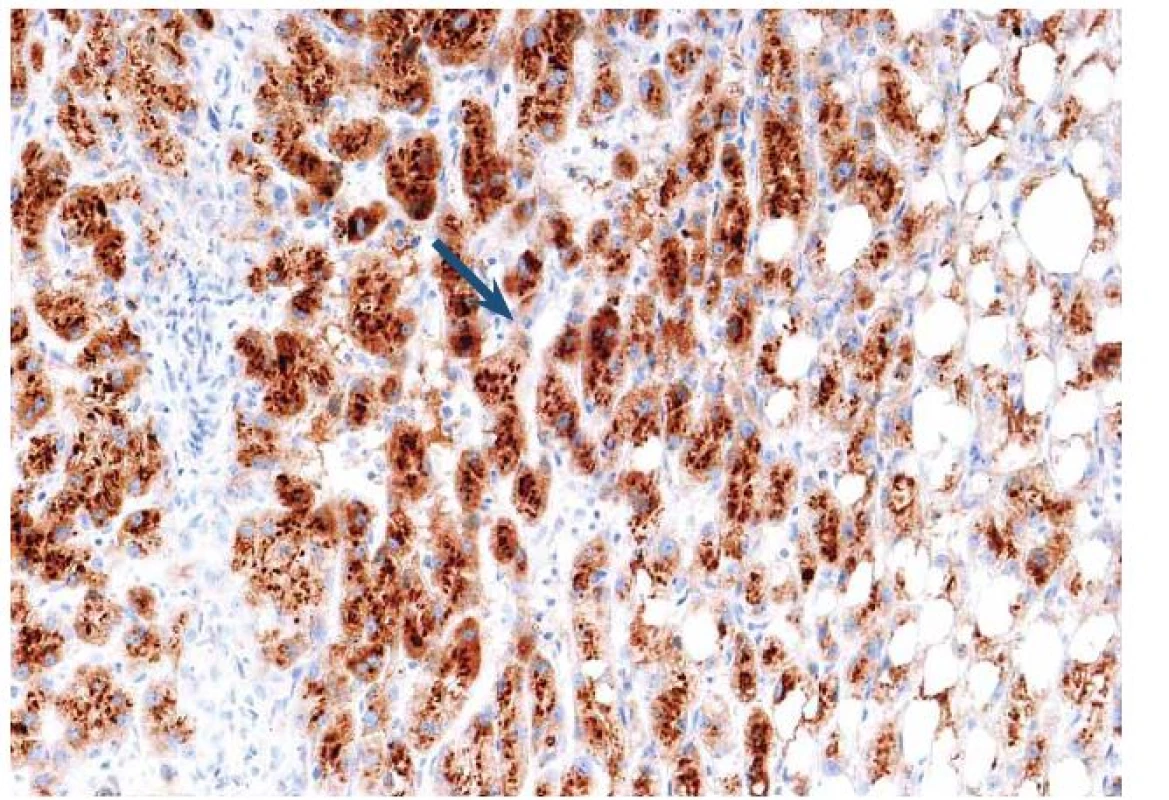
Jak již bylo uvedeno ve skupině 2, cca 10 % HCA se zánětlivými charakteristikami má také pozitivní průkaz β ‑ cateninu a tato podskupina (I ‑ HCA s pozitivním průkazem β ‑ cateninu) sdílí s předchozí kategorií vysoké riziko maligního zvratu.
Skupina 4: blíže nespecifikovaný HCA
Tato skupina představuje méně než 10 % HCA a jsou zde zařazeny případy, které nespadají do žádné z předchozích kategorií (negativní průkaz L ‑ FABP, β ‑ cateninu i SAA); navíc jsou zde zařazeny tumory s rozsáhlým krvácením nebo nekrózou, které neumožňují seriózní hodnocení imunohistochemických průkazů.
Komplikace HCA
Obě hlavní komplikace HCA krvácení a maligní transformace se vyskytují převážně u adenomů větších než 5 cm. V případě mnohočetných adenomů riziko komplikací nestoupá s počtem ložisek, ale s jejich velikostí.
Krvácí asi 20 – 25 % adenomů, u ložisek > 5 cm dochází ke krvácení ve 20 – 40 % a je spojeno s 8% rizikem úmrtí [13]. Vyšší riziko krvácení mají zánětlivé adenomy. Může se jednat o krvácení intratumorální, subkapsulární nebo intraperitoneální.
Riziko maligního zvratu je 5 – 10 % a existuje u všech typů adenomů. Rizikovými faktory jsou velikost > 5 cm, přítomnost mutace β ‑ cateninu, mužské pohlaví (6 – 10krát vyšší riziko maligní transformace bez ohledu na velikost adenomu) a léčba androgeny. HCC vznikající na podkladě adenomu bývá většinou dobře diferencovaný, s normální sérovou hladinou alfa‑fetoproteinu (AFP), bez angioinvaze, bez satelitních ložisek. Po resekci má obvykle dobrou prognózu [14].
Léčba HCA
Rozhodování o léčebném postupu může být obtížné. Většinou se jedná o jedince mladé, často ženy v produktivním věku, které plánují otěhotnění. Každý případ je proto nutné posuzovat do jisté míry individuálně a komplexně s ohledem na klinickou symptomatologii, nálezy na zobrazovacích metodách, morfologické vyšetření a možnosti pacienta.
Ve všech případech přerušujeme hormonální léčbu, po jejím vysazení může dojít k regresi adenomu. I po kompletním odstranění adenomu ji doživotně nedoporučujeme.
U mužů je indikováno odstranění adenomu bez ohledu na jeho velikost, protože riziko maligního zvratu je u nich velké.
U žen s HCA < 5 cm přerušujeme hormonální léčbu a ložisko sledujeme pomocí MR vyšetření 1 – 2krát ročně až do menopauzy.
U žen s HCA se zvýšeným rizikem komplikací, tzn. adenomy > 5 cm, adenomy s aktivací β ‑ cateninu, zánětlivé adenomy, indikujeme jeho odstranění.
HNF 1α HCA mají obecně nižší riziko maligní transformace než ostatní subtypy, proto při typickém obrazu na MR není nutno provádět biopsii a nález sledujeme.
Většina center resekuje adenomy > 5 cm, zejména pokud se nezmenšují po vysazení hormonální léčby. Některá pracoviště preferují odstranění i menších nádorů.
Při diagnostických pochybnostech, zda se nejedná o HCC, indikujeme resekci. Zvyšuje se podíl laparoskopického přístupu. Transplantace jater u solitárních, byť rozměrných ložisek většinou není indikována vzhledem k nízké morbiditě a mortalitě (< 1 %) i u rozsáhlých resekcí ve specializovaných centrech [14,15].
Metodou volby v případě krvácení je transarteriální embolizace, která může vést k ústupu nebo dokonce kompletnímu vymizení adenomu [16]. Případná resekce je indikována až po resorpci hematomu. Celý postup tak může být méně invazivní a pro pacienta šetrný.
Mnohočetné adenomy a adenomatóza
Adenomatózu jater (AJ) popsali jako přítomnost deseti a více adenomů v jinak normálním jaterním parenchymu Flejou et al v roce 1985. Revidovali všechny do té doby publikované případy a popsali pět nových případů adenomatózy u svých nemocných. Postižení mužů a žen bylo stejné (na rozdíl od izolovaných adenomů) a tito autoři nezaznamenali asociaci s hormonální antikoncepcí [17]. Pozdější práce konstatují častější výskyt u žen ve spojení se steatózou a souvislost s hormonální antikoncepcí [18,19]. Současná terminologie dělí AJ na dvě podskupiny: typ 1 vznikající ve zdravých játrech, typ 2 vznikající v játrech s preexistujícím onemocněním (glykogenóza, steatóza, vaskulární onemocnění). Onemocnění se vyskytuje v masivní a multifokální formě.
Diagnóza je komplikovaná, protože adenomy mají na zobrazovacích metodách velmi variabilní obraz kvůli zastoupení různých složek uvnitř nádoru (tuk, krvácení, nekróza, cévy). Histopatologické vyšetření je důležité k definitivní diagnóze. Vzorky pro histologické vyšetření odebíráme během laparoskopie nebo laparotomie (kontrola krvácení) z většího počtu ložisek, protože v játrech jednoho jedince se mohou vyskytovat různé subtypy adenomů.
Krvácení je v případě adenomatóz častější (46 – 63 %) než u solidních nádorů, zatímco riziko maligní transformace je menší [18,19].
Léčebný přístup je konzervativní. Resekce jater má být zvážena u ložisek > 5 cm, u ložisek, kde nelze vyloučit maligní potenciál, a u výrazně symptomatických ložisek. Po resekci lze očekávat progresi zbylých nádorů až u 43 % nemocných. To má za následek indikaci k reresekci až u jedné čtvrtiny pacientů. Obava z nepředpověditelnosti krvácení a maligního zvratu vedla logicky k úvaze o transplantaci jater [20]. AJ představuje vzácnou indikaci (cca 0,03 % všech transplantací v Evropě) s dobrými výsledky. Jedno ‑ , pěti ‑ a desetileté přežívání příjemců je 94, 90 a 90 % a štěpů 89, 81 a 81 % (databáze European Liver Transplantation Registry – ELTR). Transplantace jater zůstává léčebnou alternativou u symptomatických, agresivně rostoucích nádorů, u rizikových nádorů hrozících komplikacemi nebo maligní transformací v případě, že konvenční chirurgická resekce není možná [21].
HCA a těhotenství
Častější výskyt adenomů v těhotenství souvisí se zvýšenými hladinami steroidních hormonů. Nepředpověditelný hormony indukovaný růst adenomu s možnou rupturou a krvácením je spojen s vysokou mortalitou matky i plodu (44 a 38 %) [22]. Riziko ruptury je nejvyšší ve třetím trimestru. Po porodu neklesá, protože náhlý pokles estrogenů vede k rychlé regresi adenomu a ta může vést ke krvácení. Na základě výše uvedených skutečností bylo ženám s adenomy často doporučeno neotěhotnět nebo již probíhající těhotenství přerušit. Diagnóza HCA tak zásadním způsobem zasahovala do života mladých, fertilních a jinak zdravých žen. Sporadické literární údaje a zkušenosti nasvědčují tomu, že většina adenomů v průběhu gravidity zůstává stabilní a že není třeba přerušovat těhotenství u jinak asymptomatických žen s adenomem < 5 cm. Samozřejmostí je pečlivé sledování v pravidelných intervalech (šest týdnů) ultrazvukem [23].
Ženy, které mají velký adenom a které měly s tím související komplikace v předchozím těhotenství, by měly podstoupit resekci před dalším otěhotněním a do té doby neotěhotnět.
Závěry a praktická doporučení
- FNH a HCA jsou benigní afekce jater, které se vyskytují významně častěji u žen.
- Odlišení těchto dvou afekcí od jiných tumorů jater a zejména odlišení od sebe navzájem je velmi důležité, protože HCA mají riziko krvácení a maligní transformace.
- Upřesněné charakteristiky HCA a FNH zlepšily možnosti jejich odlišení nejen na úrovni zobrazovacích metod, ale i v resekátech a jehlových biopsiích.
- V různých zobrazovacích metodách mají FNH a adenomy svůj typický obraz. K diferenciální diagnóze přispívá hlavně MR. Pokud nalezneme všechny typické charakteristiky pro daný typ léze, můžeme se s velkou pravděpodobností k původu ložisek vyjádřit již ze zobrazovacích metod. Pomocí MR s hepatospecifickou KL lze diagnostikovat a odlišit od sebe navzájem H ‑ HCA a I ‑ HCA. Diagnostický problém představují malá ložiska, ložiska ve steatóze a ložiska, která nemají všechny zásadní znaky. Ve steatóze se obraz ložisek relativně mění, protože jejich echogenita, denzita či intenzita se vždy posuzuje k okolnímu jaternímu parenchymu.
- Histopatologická diagnóza není nutná u FNH, která má typický obraz na MR.
- HCA jsou podle fenotypu, který odpovídá molekulární charakteristice, rozděleny do čtyř skupin, které se liší rizikem maligního zvratu. Určení této skupiny je nezbytnou součástí histopatologické diagnózy a lze ho provést pomocí detekce imunohistochemických markerů.
- Diagnóza je výsledkem komplexního zhodnocení klinického průběhu, laboratorních nálezů, zobrazovacích metod a morfologického zhodnocení.
- Terapeutický přístup je individuální a vyžaduje multidisciplinární spolupráci hepatologa, radiologa, patologa a chirurga, kteří jsou v této problematice vzdělaní a zkušení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 8. 12. 2014
Přijato: 3. 2. 2015
MU Dr. Halima Gottfriedová, CSc.
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/ 9, 140 21 Praha 4
halima.gottfriedova@ikem.cz
Sources
1. Wanless IR, Mawdsley C, Adams R. On the pathogenesis of focal nodular hyperplasia of the liver. Hepatology 1985; 5(6): 1194 – 1200.
2. Braga L, Armao D, Elazzazi M et al. Liver. In: Semelka RC. Abdominal ‑ pelvic MRI. New Jersey: John Willey & Sons 2010 : 107 – 121.
3. Demarco MP, Shen P, Bradley RF et al. Intraperitoneal hemorrhage in a patient with hepatic focal nodular hyperplasia. Am Surg 2006; 72(6): 555 – 559.
4. Sadowski DC, Lee SS, Wanless IR et al. Progressive type of focal nodular hyperplasia characterized by multiple tumors and recurrence. Hepatology 1995; 21(4): 970 – 975.
5. Mathieu D, Kobeiter H, Maison P et al. Oral contraceptive use and focal nodular hyperplasia of the liver. Gastroenterology 2000; 118(3): 560 – 564.
6. Kim H, Jang JJ, Kim DS et al. Clinicopathological analysis of hepatocellular adenoma according to new bordeaux classification: report of eight korean cases.Korean J Pathol 2013; 47(5): 411 – 417. doi: 10.4132/ KoreanJPathol.2013.47.5.411.
7. Baum JK, Bookstein JJ, Holtz F et al. Possible association between benign hepatomas and oral contraceptives. Lancet 1973; 2(7835): 926 – 929.
8. Rooks JB, Ory HW, Ishak KG et al. Epidemiology of hepatocellular adenoma. The role of contraceptive use. JAMA 1979; 242(7): 644 – 648.
9. Thomeer MG, Bröker ME,de Lussanet Q et al. Genotype ‑ phenotype correlations in hepatocellular adenoma: an update of MRI findings. Diagn Interv Radiol 2014; 20(3): 193 – 199. doi: 10.5152/ dir.2013.13315.
10. Bioulac ‑ Sage P, Balabaud C, Zucman ‑ Rossi J. Subtype classification of hepatocellular adenoma. Dig Surg 2010; 27(1): 39 – 45. doi: 10.1159/ 000268406.
11. Honsová E, Lodererová A, Gottfriedová H.Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie). Čes Slov Patol 2013; 49(4): 149 – 152.
12. Evason KJ, Grenert JP, Ferrell LD et al. Atypical hepatocellular adenoma‑like neoplasms with β ‑ catenin activation show cytogenetic alterations similar to well‑differentiated hepatocellular carcinomas. Hum Pathol 2013; 44(5): 750 – 758. doi: 10.1016/ j.humpath.2012.07.019.
13. Cho SW, Marsh JW, Steel J et al. Surgical management of hepatocellular adenoma: take it or leave it? Ann Surg Oncol 2008; 15(10): 2795 – 2803. doi: 10.1245/ s10434 ‑ 008 ‑ 0090 ‑ 0.
14. Dokmak S, Paradis V, Vilgrain V et al. A single‑center surgical experience of 122 patients with single and multiple hepatocellular adenomas. Gastroenterology 2009, 137(5): 1698 – 1705. doi: 10.1053/ j.gastro.2009.07.061.
15. Cescon M, Vetrone G, Grazi GL et al. Trends in perioperative outcome after hepatic resection: analysis of 1500 consecutive unselected cases over 20 years. Ann Surg 2009; 249(6): 995 – 1002. doi: 10.1097/ SLA.0b013e3181a63c74.
16. Erdogan D, van Delden OM, Busch OR et al. Selective transcatheter arterial embolization for treatment of bleeding complications or reduction of tumor mass of hepatocellular adenomas. Cardiovasc Intervent Radiol 2007; 30(6): 1252 – 1258.
17. Flejou JF, Barge J, Menu Y et al. Liver adenomatosis. An entity distinct from liver adenoma? Gastroenterology 1985; 89(5): 1132 – 1138.
18. Chiche L, Dao T,Salamé E et al. Liver adenomatosis: reappraisal, diagnosis, and surgical management: eight new cases and review of the literature. Ann Surg 2000; 231(1): 74 – 81.
19. Veteläinen R, Erdogan D, de Graaf W et al.Liver adenomatosis: re‑evaluation of aetiology and management. Liver Int 2008; 28(4): 499 – 508. doi: 10.1111/ j.1478 – 3231.2008.01669.x.
20. Marino IR, Scantlebury VP, Bronsther O et al.Total hepatectomy and liver transplant for hepatocellular adenomatosis and focal nodular hyperplasia. Transpl Int 1992; 5 (Suppl 1): S201 – S205.
21. Ercolani G, Grazi GL, Pinna AD. Liver transplantation for benign hepatic tumors: a systematic review. Dig Surg 2010; 27(1): 68 – 75. doi: 10.1159/ 000268628.
22. Cobey FC, Salem RR. A review of liver masses in pregnancy and a proposed algorithm for their diagnosis and management. Am J Surg 2004; 187(2): 181 – 191.
23. Noels JE, van Aalten SM, van der Windt DJ et al. Management of hepatocellular adenoma during pregnancy. J Hepatol 2011; 54(3): 553 – 558. doi: 10.1016/ j.jhep.2010.07.022.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2015 Issue 1-
All articles in this issue
- News in 2015
- Not only anti-TNF for IBD patients
- Recommended surgical treatment methods in patients with idiopathic infl ammatory bowel dis eases – part 1: pre-operative preparation
- Eradication of perianal fistulas in IBD patients using the Advancement Flap method and risk factors associated with poor healing
- Vedolizumab in the therapy of ulcerative colitis patients
- Topical treatment of inflammatory bowel diseases
- The importance of fecal calprotectin in the diagnostics and treatment of inflammatory bowel diseases
- Immunoablative therapy and autologous hematopoietic stem cell transplantation in a patient with aggressive Crohn’s disease refractory to medical therapy
- A practical contribution to the diagnostics and treatment of focal nodular hyperplasia and adenomas in the liver from the perspective of a hepatologist, radiologist, pathologist and surgeon
- Short-term results of the treatment of superficial neoplastic lesions of the stomach using endoscopic submucosal dissection
- Small intestinal bacterial overgrowth syndrome
- Exviera, Viekirax
- Nutricia enteral nutrition products for children
- New members of the editorial board
- Calling for cooperation
- VIII. Beskydy Endoscopic Workshop
- Biologic therapy does not affect results of endoscopic balloon dilations in Crohn’s disease patients
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A practical contribution to the diagnostics and treatment of focal nodular hyperplasia and adenomas in the liver from the perspective of a hepatologist, radiologist, pathologist and surgeon
- Small intestinal bacterial overgrowth syndrome
- Topical treatment of inflammatory bowel diseases
- Eradication of perianal fistulas in IBD patients using the Advancement Flap method and risk factors associated with poor healing
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

