-
Medical journals
- Career
Nealkoholická steatohepatitida (NASH) – týká se nás všech
Authors: K. Dvořák
Authors‘ workplace: IV. interní klinika 1. LF UK a VFN v Praze
Published in: Gastroent Hepatol 2012; 66(5): 377-383
Category: Hepatology: Review article
Overview
Nealkoholická steatohepatitida (NASH) prodělala během posledních 30 let bouřlivý vývoj a postupně se stala nejčastějším chronickým jaterním onemocněním „západního“ světa. Klíčovým bylo objasnění souvislosti NASH s obezitou a zejména s inzulinovou rezistencí, nealkoholická steatohepatitida je nyní považována za integrální součást metabolického syndromu. Představuje závažný socioekonomický problém, ve vyspělých zemích se prevalence odhaduje na 20–30 %, více u pacientů s nadváhou a obézních. Může existovat samostatně nebo nasedá na ostatní jaterní choroby a zhoršuje jejich průběh. V rutinní praxi se diagnostika opírá o ultrasonografické vyšetření jater a zvýšené jaterní testy, což pravděpodobně vede k vysoké míře poddiagnostikování. V současné době neexistuje prokazatelně účinná farmakologická léčba, doporučována jsou zejména režimová opatření zahrnující dietu k dosažení redukce hmotnosti a dostatek pohybu. Do budoucna se dá očekávat nárůst počtu pacientů s diagnostikovanou nealkoholickou steatohepatitidou, k jejich léčbě bude potřeba integrovaný interdisciplinární přístup.
Klíčová slova:
steatohepatitida – obezita – technické a diagnostické metodyHistorické poznámky
Že tlustí lidé mají tučná játra, bylo známo dávno. Stejně tak byla známa přítomnost zánětlivých změn a fibrózy v jaterních biopsiích některých těchto pacientů. Tato skutečnost však byla minimálně do 60. let 20. stol. ignorována [1]. Zájem o postižení jater u morbidně obézních pacientů přinesly až zkušenosti s chirurgickou léčbou obezity, zejména případy pacientů, u kterých se po takových operacích vyvinula těžká steatohepatitida. V jaterních biopsiích pak u nich byly patrné histologické změny nalézané jinak u pacientů s alkoholickou hepatitidou [2].
V roce 1980 popsal Ludwig et al z Mayo Clinic skupinu 20 pacientů, kteří nepili žádný alkohol, ale u nichž se nacházely histologické změny obvyklé u alkoholického jaterního postižení. Tento stav pojmenoval nealkoholická steatohepatitida a závěr zněl, že tato zatím špatně vysvětlená choroba histologicky napodobuje alkoholickou hepatitidu, vyskytuje se častěji u žen a může progredovat do jaterní cirhózy [3]. Tři z těchto pacientů byli ve skutečnosti nosiči HBsAg a další byli pravděpodobně infikováni hepatitidou C, která byla objevena až v roce 1989.
Pro charakterizaci tohoto onemocnění však byla podstatná dvě pozorování. Všichni až na jednoho pacienta měli nadváhu nebo byli obézní a část z nich měla diabetes nebo další choroby typicky asociované s obezitou. To podpořilo předchozí pozorování spojitosti mezi obezitou a jaterním postižením. Druhou důležitou skutečností bylo odlišení od alkoholické hepatitidy, trvalo však ještě dlouho dobu, než bylo toto rozlišení obecně akceptováno. Choroba, která do té doby neměla jméno a jejíž příčina nebyla známá, se během následujících 30 let stala nejčastějším jaterním onemocněním západního světa.
Vztah k obezitě a inzulinové rezistenci
Steatohepatitida u morbidně obézních pacientů po střevních bypassových operacích byla zpočátku vysvětlována nutričními změnami souvisejícími s provedeným výkonem nebo s bakteriálním přerůstáním, později metabolickými změnami souvisejícími s redukcí hmotnosti. Zjištění z 60. a 70. let minulého století, že existují pacienti s jaterním postižením připomínajícím alkoholickou steatohepatitidu, kteří nepijí alkohol a neprodělali žádný chirurgický výkon [4], byla ignorována.
Podstatným krokem v objasnění patofyziologie bylo prokázání těsného vztahu mezi NASH a inzulinovou rezistencí, a to jak periferní [5], tak jaterní [6]. Tato asociace je přítomna i u jedinců bez nadváhy či zjevné poruchy glukózové tolerance, a může tak představovat jednu z nejčasnějších manifestací inzulinové rezistence a metabolického syndromu. Dále bylo prokázáno, že pacienti se steatohepatitidou vykazují vyšší míru inzulinové rezistence než pacienti s prostou steatózou, kteří mají taktéž vyšší inzulinovou rezistenci než kontroly [7]. Míra inzulinové rezistence tak může korelovat s progresí jaterního postižení. Jaterní choroby jsou navíc čtvrtou nejčastější příčinou mortality pacientů s diabetem a známa je i vysoká prevalence diabetu u pacientů s jaterní cirhózou (12–57 %).
Identifikování příčiny nealkoholické steatohepatitidy ve svém důsledku změnilo způsob, jakým diagnostikujeme chronické jaterní choroby. Mnoho studií prokázalo, že NASH zhoršuje přirozený průběh a zejména progresi fibrózy u ostatních jaterních chorob, jako jsou chronická hepatitida C, hemochromatóza, alkoholické jaterní postižení a pravděpodobně také chronická hepatitida B. Tímto se stal původní koncept diagnózy per exclusionem obsolentní. Choroba v jasně definovaném epidemiologickém kontextu (přítomnost rizikových faktorů metabolického syndromu) se známou etiologií (inzulinová rezistence) nepřestane existovat, když se vyskytne v epidemiologicky náhodné asociaci u pacienta infikového hepatitidou C nebo u pijáka.
Přirozený průběh
Postižení jater při steatóze (NAFLD – Non-Alcoholic Fatty Liver Disease) zahrnuje spektrum stavů od prosté steatózy jater přes nealkoholickou steatohepatitidu s typickým zánětlivým postižením jaterního parenchymu s různým stupněm fibrózy po jaterní cirhózu s jejími komplikacemi včetně hepatocelulárního karcinomu [8]. Steatóza jater a nealkoholická steatohepatitida jsou z minulosti stále vnímány jako benigní stavy, jejichž závažnost je často zpochybňována. Retrospektivními studiemi bylo prokázáno, že cca 25–30 % pacientů se steatohepatitidou má pokročilou fibrózu již v době diagnózy, 10–15 % z nich má již dokonce jaterní cirhózu [9]. Jaterní cirhóza dříve označovaná jako kryptogenní souvisí z větší části právě s NASH. Tato kauzální souvislost je hůře prokazatelná kvůli faktu, že původní steatóza regreduje, jakmile se pacienti dostanou do katabolizmu kvůli vzniklé jaterní cirhóze. Pro tuto souvislost navíc svědčí i fakt, že velká část pacientů s kryptogenní jaterní cirhózou vykazuje mnohé rizikové faktory metabolického syndromu [10].
Nejpřesvědčivější ukázkou potenciální závažnosti NASH je nárůst mortality. Pacienti s nealkoholickou steatohepatitidou mají vyšší jak celkovou mortalitu, tak mortalitu na jaterní choroby [11], zatímco pacienti se samotnou prostou steatózou mají mortalitu identickou s kontrolami. Navíc populační studie jasně prokázaly, že jaterní cirhóza je nezávislá příčina úmrtí u těchto pacientů řadící se na třetí místo příčin smrti po kardiovaskulárních chorobách a neoplaziích. To kontrastuje s obecnou populací, kde je jaterní cirhóza až na 13. místě v příčinách smrti. Riziko úmrtí na jaterní choroby je u pacientů s NASH zvýšeno 10–20krát [12].
U pacientů s nealkoholickou steatohepatitidou se může rovněž vyskytnout hepatocelulární karcinom, a to i bez přítomnosti jaterní cirhózy [13], riziko hepatocelulárního karcinomu je u pacientů s diabetem 2–3násobné ve srovnání s běžnou populací [14]. Diagnóza hepatocelurácního karcinomu může být závažně zpožděna, protože pacienti jsou většinou asymptomatičtí a nebývají sledováni v rámci dispenzarizačních programů obvyklých pro pacienty s chronickým jaterním onemocněním [15].
Epidemiologie a ohrožená skupina pacientů
Prevalence NAFLD není přesně známá, protože chybí dostatečně senzitivní a specifické diagnostické markery pro tuto chorobu. Studie, které užívají zvýšené aminotransferázy jako screeningový test, nachází nevysvětlené zvýšení aminotransferáz u 3–6 % běžné populace, což by zařazovalo steatohepatitidu na první nebo druhé místo příčin zvýšených jaterních testů v závislosti na tom, zda je ve studované populaci vysoká [16], nebo nízká [17] prevalence obezity. Vzhledem k faktu, že většina pacientů s NAFLD má normální aktivitu aminotransferáz, jsou tyto údaje jistě podhodnoceny. Studie založené na ultrasonografickém vyšetření jater nebo MR spektroskopii, což jsou senzitivnější metody než zvýšené jaterní testy, konzistentně ukazují prevalenci NAFLD mezi 20 a 30 % v západních zemích, na Blízkém východě a v Japonsku [18]. Autoptické studie obětí dopravních nehod a jiných tragických úmrtí udávají prevalenci NAFLD 16–64 % [19].
Kolem jedné miliardy lidí na světě má nadváhu, kolem 300 milionů je obézních. Narůstající prevalence obezity dosahuje i v Evropě epidemických rozměrů a je nejvyšší právě v zemích střední a východní Evropy. V ČR je obézních (BMI > 30) cca 30 % mužů a 32 % žen a více než 70 % dospělé populace trpí nadváhou (BMI > 25). V naší zemi je také jasně patrný inverzní vztah mezi prevalencí obezity a vzděláním [20]. S obezitou souvisí i narůstající prevalence s ní spjatých komplikací. Prevalence diabetu mellitus se v ČR pohybuje kolem 8 %.
Narůstající obezita však není problémem pouze vyspělých zemí. Prevalence diabetu v Číně byla v roce 2011 odhadována na 9 %, stejně tak jako v Indii, a prevalence má v těchto zemích v následujících 20 letech vzrůst na 12 %. V socioekonomicky méně vyspělých zemích se diabetes navíc vyskytuje u mladších věkových skupin (ve věku 40–60 let). Dalším velmi významným problémem do budoucna je pak narůstající prevalence obezity u dětí a dospívajících. Těžká obezita (BMI > 40) ve věku kolem 20 let vede ke snížení očekávané délky života o 20 %, tedy cca o 13 let.
Diagnostika
Většina pacientů, u kterých je v současné době diagnostikován NAFLD//NASH, má vyšší jaterní testy. Pacienti jsou většinou asymptomatičtí, mají-li symptomy, jedná se nejčastěji o únavu a pocit tlaku nebo dyskomfortu v pravém podžebří. ALT je obvykle vyšší než AST a transaminázy jsou většinou zvýšeny do dvojnásobku normy. Je třeba zdůraznit, že elevace GGT není specifická pro poškození alkoholem, ale že je velmi častá i u NAFLD, kde může GGT dosahovat až desetinásobku normy. Pro alkohol je naopak typické zvýšení AST a poměr AST/ALT > 2 (tab. 1). Poslední studie ukázaly, že pacienti ve všech stadiích nealkoholické steatohepatitidy včetně pokročilé fibrózy a cirhózy mohou mít normální jaterní testy. Cca 50 % pacientů s NASH má vyšší ferritin.
Table 1. Symptomy, klinické a laboratorní známky NAFLD. Tab. 1. Symptoms, clinical and laboratory findings. 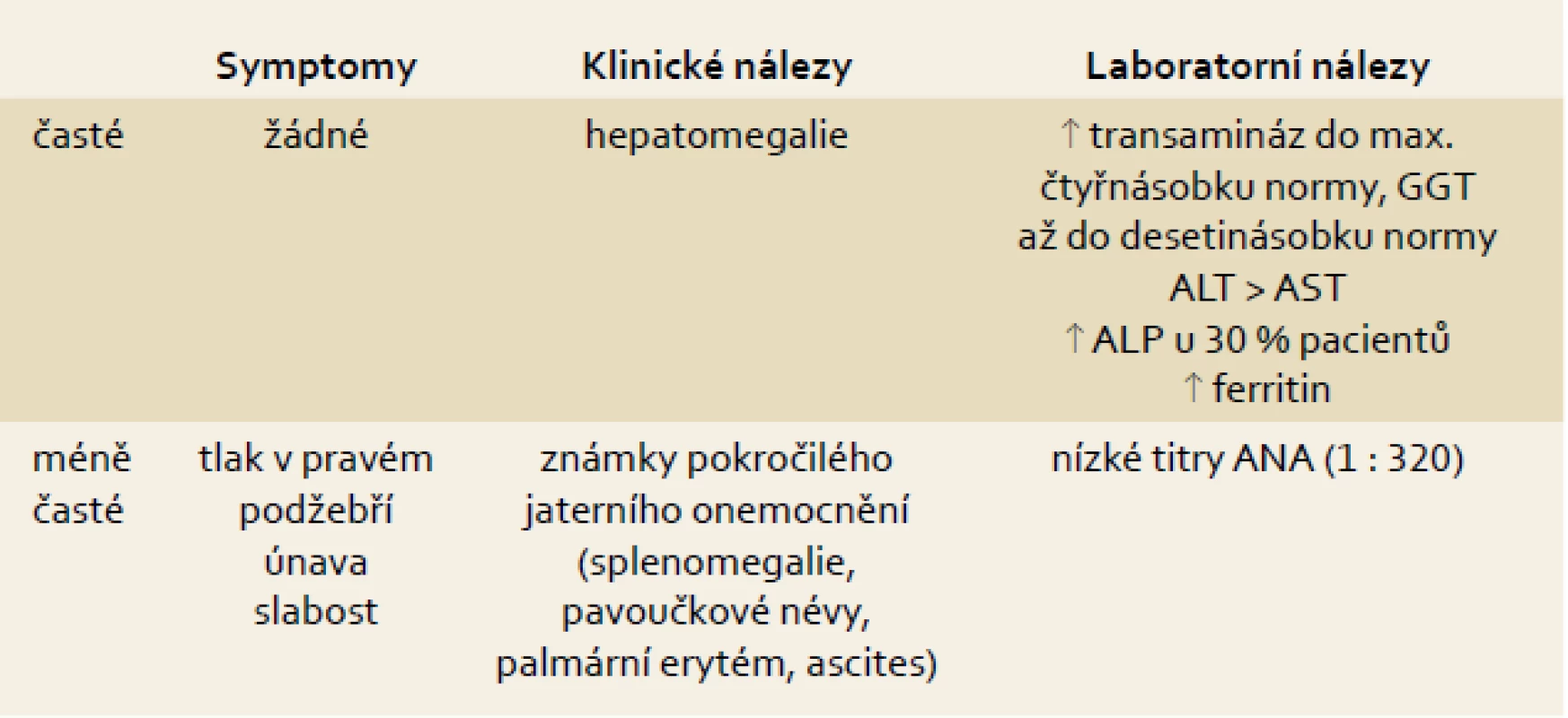
NASH se obvykle vyskytuje současně s ostatními komponentami metabolického syndromu (tab. 2). Tab. 3 ukazuje ostatní možné příčiny jaterní steatózy (NAFLD/NASH).
Table 2. Metabolické rizikové faktory. Tab. 2. Metabolic risk factors. 
Table 3. Sekundární příčiny NAFLD. Tab. 3. NAFLD secondary causes. 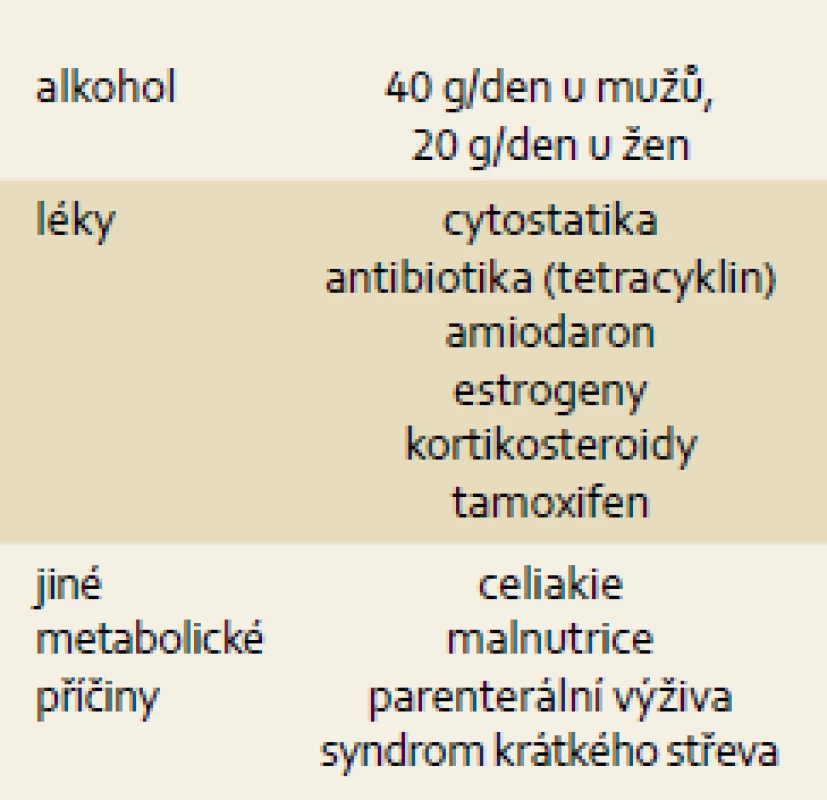
Běžný klinický postup u pacienta s chronicky vyššími jaterními testy zahrnuje vyloučení virových hepatitid a vzácných metabolických jaterních chorob (autoimunitní hepatitida, Wilsonova choroba, hemochromatóza, deficit α1-antitrypsinu), dále ultrasonografické vyšetření jater (více echogenní jaterní parenchym je patrný při obsahu tuku v játrech vyšším než 10 %) a vyloučení nadměrného pití alkoholu. Podmínkou diagnózy NAFLD není absolutní abstinence, tuto diagnózu lze připustit i při konzumaci alkoholu v množství, které samo o sobě nepůsobí jaterní poškození. Názory na bezpečné množství alkoholu pro zdravá játra se různí, běžně se udává cca 40 g/den pro muže a 20 g/den pro ženy. Existují i studie připouštějící i vyšší denní dávky. Chronické každodenní pití alkoholu je pro játra horší než nárazové pití.
Stejně jako u dalších chronických jaterních chorob je pro prognózu pacienta nejpodstatnější míra jaterní fibrózy. Zlatým standardem v její diagnostice zatím stále zůstává jaterní biopsie, v rozlišení prosté steatózy a steatohepatitidy je zatím nezastupitelná. Do budoucna lze očekávat integrovaný diagnostický algoritmus jaterní fibrózy zahrnující jak laboratorní markery či validované skórovací systémy, tak neinvazivní metody typu elastotografie.
Léčba: režimová opatření, cvičení, udržení hmotnosti, farmakoterapie a léky ve vývoji
V současné době neexistuje kauzální léčba nealkoholické steatohepatitidy. Léčebná strategie se většinou opírá o režimová opatření a léčbu přítomných komponent metabolického syndromu. Je prokázáno, že snížení hmotnosti o 10 % v průběhu 6–12 měsíců vede u jedinců s NASH ke zlepšení inzulinové rezistence i ke zlepšení histologického nálezu v játrech [21].
Pacientům bývají doporučována tzv. režimová opatření zahrnující změnu životního stylu a zejména redukci hmotnosti. Bylo prokázáno, že tyto prostředky vedou ke snížení obsahu triglyceridů v játrech, snížení jaterních testů a zlepšení parametrů glukózové tolerance a inzulinové senzitivity [22]. Stejně tak bylo i zvýšení aerobní zdatnosti ve studiích spojeno se snížením obsahu triglyceridů v játrech a se snížením jaterních testů.
Redukce hmotnosti a léčba obezity
Snížení hmotnosti o 4–14 % vede ke statisticky významnému snížení triglyceridů v játrech, a to o 35–81 %. Míra jejich snížení je závislá na výši redukce hmotnosti [23]. Poněkud omezenější jsou i důkazy pro to, že k redukci jaterních triglyceridů vede zvýšená fyzická aktivita, která není provázena snížením tělesné hmotnosti. Ve studiích zaměřených na NAFLD/NASH vedla dieta s nízkým (800–1 800 kcal/den) a velmi nízkým obsahem kalorií (pod 800 kcal/den) a se současnou restrikcí sacharidů (20–50 g/den) k nejrapidnější redukci hmotnosti a redukci triglyceridů v játrech. Tyto diety však nepředstavují změnu životního stylu a jejich dodržování je nutně časově omezeno. Ideální dietní opatření u pacientů s nealkoholickou steatohepatitidou zatím zůstává nejasné.
Problémem v léčbě obezity je zejména strategie udržení hmotnosti, protože téměř každý obézní člověk ví, jak zhubnout, ale neví, jak si hmotnost udržet. Udržet si dosaženou nižší váhu totiž bezpodmínečně vyžaduje komplexní změnu životního stylu (například častější chůze pěšky a do schodů, pravidelné cvičení, méně času při sledování televize, méně sladkých limonád, pravidelná kontrola váhy [24]).
Cvičení
Množství fyzické aktivity k dosažení redukce hmotnosti a zlepšení inzulinové senzitivity je dobře známo. Pacienti s nealkoholickou steatohepatitidou vykazují méně než poloviční fyzickou aktivitu než odpovídající kontroly [25]. Důvodem jsou únava, snížená výkonnost, artróza nosných kloubů, kardiovaskulární choroby a také psychologické faktory. Několik studií docílilo snížení jaterních testů díky aerobnímu cvičení bez současné úpravy jídelníčku nebo redukce tělesné hmotnosti. Cvičení pravděpodobně zlepšuje obsah jaterních lipidů díky jejich redistribuci a díky změnám inzulinové senzitivity.
Doporučení týkající se fyzické aktivity odvozená ze studií prevence diabetu mohou být aplikována i na nealkoholickou steatohepatitidu. Doporučeno je tedy minimálně 150 min týdně aktivit střední intenzity (rychlá chůze) a minimálně 75 min výraznější fyzické aktivity, jako je například jogging, a dvakrát týdně posilování svalů. Zamezení sedavému způsobu trávení volného času mimo cvičení je stejně důležité jako cvičení samotné [26].
Farmakologická léčba obezity
Jediným lékem, který je v současné době schválen pro klinické užití v léčbě obezity, je inhibitor střevní lipázy orlistat. V malých studiích byl popsán příznivý vliv užívání orlistatu na jaterní histologický nález, není však jasné, zda se nejedná jen o efekt samotné redukce tělesné hmotnosti [27]. Dalšími studovanými léky v tomto směru byly sibutramin a rimonabant, které nejsou v současné době povoleny pro klinické užití.
Bariatrická chirurgie
V případech morbidní obezity (u pacientů s BMI > 35) představuje alternativu farmakoterapie a dietních a režimových opatření bariatrická chirurgie. Nejužívanější metodou je v současnosti gastrický bypass. Pacienti nejen dosáhnou výrazné redukce hmotnosti, ale poté svou hmotnost i dlouhodobě udržují. Byl popsán příznivý vliv nejen na metabolické parametry a jaterní steatózu, ale i na zánětlivé změny a fibrózu v histologii [28]. Vzhledem k nepříznivým epidemiologickým trendům týkajících se obezity se dá v blízké budoucnosti očekávat další vzestup počtu těchto výkonů. Tato v západním světě stále častěji užívaná metoda by měla být v indikovaných případech častěji využívána i u nás.
Farmakologická léčba diabetu
Důkazy o zásadním vlivu inzulinové rezistence na vznik nealkoholické steatohepatitidy vedly ke studiu účinku látek užívaných k léčbě diabetu i u pacientů s NASH.
Nejčastěji byl v této souvislosti studován biguanid metformin, který snižuje výdej inzulinu játry a snižuje inzulinovou rezistenci svalů a tukové tkáně. V dosud publikovaných pracích vykazoval nekonzistentní výsledky a poslední publikovaná metaanalýza těchto studií neprokázala jeho efekt na zlepšení histologického nálezu u pacientů s NASH [29]. V zahrnutých studiích byla ale pacientům většinou podávána nízká dávka metforminu 2 × 500 mg denně, maximálně 2 × 850 mg denně. U pacientů s prokázanou poruchou glukózové tolerance je metformin podáván bez ohledu na výsledky uváděné metaanalýzy z diabetologické indikace.
Další studovanou skupinou perorálních antidiabetik jsou thiazolidinediony (glitazony). Působí jako agonisté PPARγ a zlepšují inzulinovou senzitivitu v játrech a svalech. Glitazony vykazovaly významné zlepšení steatózy a zánětlivých změn v játrech. Na zvířecích modelech byl navíc prokázán jejich přímý antifibrotický efekt [30]. Rosiglitazon však byl stažen z klinické praxe pro nežádoucí kardiovaskulární účinky a antifibrotický účinek pioglitazonu v klinických studiích byl pouze mírný a nedosahoval statistické významnosti. Léčba glitazony je navíc provázena vzestupem hmotnosti a zvýšeným rizikem srdečního selhání a fraktur.
Slibnými léky do budoucnosti jsou nová perorální antidiabetika: inkretiny – analoga glucagon-like peptidu 1 (GLP-1) liraglutid, exenatid a gliptiny – inhibitory dipeptidylpeptidázy-4 (DPP-4) blokující odbourávání GLP-1 (sitagliptin, linagliptin), GLP-1 je peptid secernovaný střevem po pozření potravy. Indukuje sekreci inzulinu z beta--buněk a zvyšuje pocity sytosti, čímž zlepšuje kontrolu glykemie a vede k poklesu tělesné hmotnosti. Užití těchto látek je v klinické praxi již zavedeno při léčbě diabetu mellitus 2. typu, kde jsou tyto léky efektivní a jsou dobře tolerovány. Tyto látky mohou zpomalovat progresi jaterní steatózy a zlepšovat zánětlivé změny jak přes zvýšenou aktivitu GLP-1, tak přes jejich potenciální přímý, nebo nepřímý protizánětlivý účinek [31]. O jejich účinku na nealkoholickou steatohepatitidu však zatím neexistují data z randomizovaných klinických studií.
Farmakologická léčba hyperlipoproteinemií
Hyperlipoproteinemie se vyskytuje u většiny pacientů s nealkoholickou steatohepatitidou. Fibráty užívané k léčbě hypertriglyceridemie fungují jako agonisté PPARα receptoru, jejich slibný účinek na zvířecích modelech však nebyl klinickými studiemi potvrzen [32]. Stejně tak nebyl potvrzen účinek statinů. Protože elevace jaterních testů po statinech bývá častým důvodem k vyšetření pacienta hepatologem, je z klinického pohledu důležitější zjištění, že statiny mohou být bezpečně používány v jejich běžných indikacích (diabetická dyslipidemie a léčba ostatních hyperlipoproteinemií, vysoké kardiovaskulární riziko), protože nebylo prokázáno, že by pacienti s preexistujícím NASH vykazovali zvýšené riziko statiny indukované idiosynkratické hepatototoxicity [33].
Ostatní léky
Dalšími látkami se slibným terapeutickým potenciálem v léčbě nealkoholické steatohepatitidy jsou inhibitory renin-angiotenzin-aldosteronového systému, zejména AT₁-blokátor telmisartan, který na zvířecích modelech vykazuje srovnatelné zlepšení steatózy a fibrózy jako pioglitazon [34].
Z antioxidantů, jejichž efekt byl v tomto ohledu studován, byl prokázán efekt pouze vitaminu E, který v dávce 800 IU/den zlepšoval histologický nález, ale ne fibrózu [35]. Vyšší dávkování vitaminu E je však dle některých metaanalýz spojeno s vyšší mortalitou.
Jediná velká randomizovaná placebem kontrolovaná studie zkoumající efekt ursodeoxycholové kyseliny neprokázala žádný významný efekt [36], stejně tak nejsou účinná často předepisovaná hepatoprotektiva.
Pacienti s NASH a jaterní transplantace
Pacienti s nealkoholickou steatohepatitidou, kteří dospějí do stadia dekompenzované jaterní cirhózy nebo u kterých se vyvine hepatocelulární karcinom, jsou kandidáty transplantace jater. Dobrý efekt jaterní transplantace lze očekávat zejména za předpokladu, když je eliminována původní příčina jaterního onemocnění. Proto nepřekvapuje, že jaterní steatóza rekuruje u většiny pacientů do 4 let, u 50 % z nich se vyvine NASH a fibróza a byly popsány i případy rekurence jaterní cirhózy. Rizikovými faktory jsou přítomnost inzulinové rezistence a diabetu mellitus 2. typu před transplantací a po ní, přírůstek na váze po transplantaci a vysoká kumulativní dávka steroidů. Tato zjištění tak ještě zvýrazňují důležitost kontroly hmotnosti a metabolické kompenzace u pacientů s metabolickým syndromem po jaterní transplantaci, kterých bude v budoucnu jistě přibývat [37].
Závěr
Nealkoholická steatohepatitida se během posledních 30 let stala kvůli epidemii obezity a metabolického syndromu zásadním problémem. NAFLD je nyní považován za integrální součást metabolického syndromu a zásadním úkolem do budoucna je toto jaterní postižení ve větší míře diagnostikovat a v péči o tyto pacienty spolupracovat s ostatními specialisty (diabetology, kardiology, endokrinology, obezitology). Je již jasně prokázáno, že se nejedná o benigní, ve vyšším věku prakticky normální stav, jak se v minulosti běžně myslelo. Nealkoholická steatohepatitida může mít pro pacienta závažné důsledky a je po ní potřeba aktivně pátrat. Dosud panující názor, že normální jaterní testy u pacientů s jaterní steatózou vylučují závažnější jaterní postižení, se také ukázal jako nepravdivý. Tento stav je u pacientů s NASH zcela běžný.
U pacienta se známým metabolickým syndromem je potřeba po jaterním postižení aktivně pátrat, a to ve stejné míře, jako se dnes pátrá po ostatních komplikacích diabetu, jako jsou diabetická mikro - a makroangiopatie. Všichni pacienti s diabetem mellitus 2. typu by měli podstoupit ultrazvukové vyšetření jater a dále se doporučuje kontrolovat jaterní testy v intervalu minimálně jednou ročně. U všech diabetiků s jednou zjištěnými vyššími jaterními testy by měla být stanovena příčina jaterní léze. Jaterní postižení je u těchto pacientů potřeba dále pravidelně sledovat. U pacientů s NAFLD bez dalších známých složek metabolického syndromu je třeba po nich aktivně pátrat (hypertenze, dyslipidemie, porušená glukózová tolerance, diabetes).
Dosud prokázanými postupy v léčbě nealkoholické steatohepatitidy jsou redukce hmotnosti a cvičení. Vágní doporučení „musíte zhubnout a pravidelně cvičit“ je předem odsouzeno k neúspěchu. Zatím žádná farmaka neprokázala efekt ve velkých randomizovaných studiích, v současnosti lze uvažovat o léčbě vitaminem E, slibnými se zdají být zejména moderní perorální antidiabetika (glitazony, gliptiny). Pro morbidně obézní pacienty je také dobrou alternativou bariatrická chirurgie. Dále je potřeba vyhnout se potenciálně hepatotoxickým lékům a jistě je nutné pacienty upozornit na vhodnost omezení pití alkoholu.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Podpořeno IGA MZ ČR NK-11247/4.
Doručeno: 8. 3. 2012
Přijato: 1. 5. 2012
MUDr. Karel Dvořák
IV. interní klinika 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
k2dvorak@gmail.com
Sources
1. Zelman S. The liver in obesity. Arch Intern Med 1958; 90(2): 141–156.
2. Peters RL, Gay T, Reynolds TB. Post-jejuno--ileal-bypass hepatic disease. Its similarity to alcoholic liver disease. Am J Clin Pathol 1975; 63(3): 318–331.
3. Ludwig J, Vigiano TR, McGill DB et al. Nonalcoholic steatohepatitis. Mayo Clinic expieriences with a hitherto unnamed disease. Mayo Clin Proc 1980; 55(7): 434–438.
4. Thaler H. Morphologische Befunde bei chronischer Alkoholintoxikation. In: Gerok W, Sickinger K, Hennkeuser HH (Eds). Alcohol and the Liver. Stuttgart: Schattauer Verlag 1971 : 257–265.
5. Sanyal AJ, Campbell-Sargent C, Mirshahi F et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology 2001; 120(5): 1183–1192.
6. Marchesini G, Brizi M, Bianchi G et al. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes 2001; 50(8): 1844–1850.
7. Marchesini G, Bugianesi E, Forlani G et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology 2003; 37(4): 917–923.
8. Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002; 346(16): 1221–1231.
9. Adams LA, Sanderson S, Lindor KD et al. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies. J Hepatol 2005; 42(1): 132–135.
10. Caldwell SH, Oelsner DH, Iezzoni JC et al. Cryptogenic cirrhosis: clinical characterization and risk factors for underlying disease. Hepatology 1999; 29(3): 664–669.
11. Ratziu V, Poynard T. Assesing the outcome of nonalcoholic steatohepatitis? It´s time to get serious. Hepatology 2006; 44(4): 802–805.
12. Ong JP, Pitts A, Younossi ZM. Increased overall mortality and liver-related mortality in non-alcoholic fatty liver disease. J Hepatol 2008; 49(4): 608–612.
13. Ertle J, Dechene A, Sowa JP et al. Nonalcoholic fatty liver disease progreses to hepatocelular carcinoma in absence of apparent cirrhosis. Int J Cancer 2011; 128(10): 2436–2443.
14. El-Serag HB, Hampel H, Javadi F. The association between diabetes and hepatocellular carcinoma: a systematic review of epidemiologic evidence. Clin Gastroenterol Hepatol 2006; 4(3): 369–380.
15. Marrero JA, Fontana RJ, Su GL. NAFLD may be a common underlying liver disease in patients with hepatocellular carcinoma in the United States. Hepatology 2002; 36(6): 1349–1354.
16. Clark JM, Brancati FL, Diehl AM. The prevalence and etiology of elevated aminotransferase levels in the United States. Am J Gastroenterol 2003; 98(5): 960–967.
17. Pendino GM, Mariano A, Surace P et al. Prevalence and etiology of altered liver tests: a population based survey in a Medierranean town. Hepatology 2005; 41(5): 1151–1159.
18. Bellentani S, Bedogni G, Miglioli L et al. The epidemiology of fatty liver. Eur J Gastroenterol Hepatol 2004; 16(11): 1087–1093.
19. Hilden M, Christoffersen P, Juhl E et al. Liver histology in a ‚normal‘ population – examinations of 503 consecutive fatal traffic causalities. Scand J Gastroenterol 1977; 12(5): 593–597.
20. Pikhart H, Bobak M, Malyutina S et al. Obesity and education in three countries of the central and eastern Europe: The HAPIEE Study. Centr Eur J Public Health 2007; 15(4): 140–142.
21. Ueno T, Sugawara H, Sujaku K et al. Therapeutic effects of restricted diet and exercise in obese patients with fatty liver. J Hepatol 1997; 27(1): 103–107.
22. Thoma C, Day CP, Trenelli MI. Lifestyle interventions for the treatment of non-alcoholic fatty liver disease in adults: A systematic review. J Hepatol 2012; 56(1): 255–266.
23. Promrat K, Kleiner DE, Niemeier HM et al. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology 2010; 51(1): 121–129.
24. Boutelle K, Libbey H, Neumark-Sztainer D et al. Weight control strategies of overweight adolescents who succesfully lost weight. J Am Diet Assoc 2009; 109(12): 2029–2035.
25. Zelber-Sagi S, Nitzan-Kaluski D, Goldsmith R et al. Role of leisure time physical activity in nonalcoholic fatty liver disease: a population based study. Hepatology 2008; 48(6): 1791–1798.
26. Helmerhorst HJ, Wijndaele K, Brage S et al. Objectively measured sedentary time may predict insulin resistance independent of moderate - and vigorous-intensity physical activity. Diabetes 2009; 58(8): 1776–1779.
27. Harrison SA, Fecht W, Brunt EM et al. Orlistat for overweight subjects with nonalcoholic steatohepatitis: A roandomized prospective trial. Hepatology 2009; 49(1): 80–86.
28. Dixon JB, Bhathal PS, Hughes NR et al. Nonalcoholic fatty liver disease: Improvement in liver histological analysis with weight loss. Hepatology 2004; 39(6): 1647–1654.
29. Musso G, Gambino R, Cassader M et al. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease. Hepatology 2010; 52(1): 79–104.
30. Galli A, Crabb DW, Ceni E et al. Antidiabetic thiazolidinediones inhibit collagen synthesis and hepatic stellate cell activation in vivo and in vitro. Gastroenterology 2002; 122(7): 1924–1940.
31. Yilmaz Y, Atug O, Yonal O et al. Dipeptidyl peptidase IV inhibitors: therapeutic potential in nonalcoholic fatty liver disease. Med Sci Monit 2009; 15(4): 1–5.
32. Laurin J, Lindor K, Crippin J et al. Ursodeoxycholic acid or clofibrate in the treatment of nonalcoholic induced steatohepatitis: a pilot study. Hepatology 1996; 23(6): 1464–1467.
33. Browning J. Statins and hepatic steatosis: Perspectives from the Dallas Heart Study. Hepatology 2006; 44(2): 466–471.
34. Jin H, Yamamoto N, Uchida L et al. Telmisartan prevents hepatic fibrosis and enzyme-altered lesions in liver cirrhosis rat induced by a choline-deficient L-amino acid defined diet. Biochem Biophys Res Commun 2007; 364(4): 801–807.
35. Sanyal AJ. A randomized controlled trial of piglitazone or vitamin E for nonalcoholic steatohepatitis (PIVENS). N Engl J Med 2010; 362 : 1675–1685.
36. Lindor K, Koowdley KV, Heathcote EJ et al. Urodeoxycholic acid fo treatment of nonalcoholic steatohepatitis: results of a randomized trial. Hepatology 2004; 39(3): 770–778.
37. De Alwis WN, Day CP. Current and future therapeutic strategies in NAFLD. Curr Pharm Des 2010; 16(17): 1958–1962.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2012 Issue 5-
All articles in this issue
- Gastrointestinální onkologie – realita blízké budoucnosti?
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Zamyšlení nad finančními aspekty péče o nemocné s kolorektálním karcinomem
- Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost
- Karcinom pankreatu
- Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia
- Karcinom jícnu a rizikové faktory podle histologických typů
- Diagnostika a liečba celiakie: dnes a zajtra
- Nealkoholická steatohepatitida (NASH) – týká se nás všech
- Endoskopie u nemocných s antikoagulační a antiagregační terapií
- Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty
- Jak zlepšit screening kolorektálního karcinomu?
- XXI. jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Prague Hepatology Meeting 2012
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Karcinom pankreatu
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

