-
Medical journals
- Career
Léčba jaterního selhání při Wilsonově chorobě
: H. Petrášková; F. Novák; R. Humlová; R. Brůha
: IV. interní klinika – klinika gastroenterologie a hepatologie, VFN a 1. LF UK v Praze
: Gastroent Hepatol 2011; 65(4): 220-223
: Hepatology: Case Report
Kazuistika popisuje průběh léčby jaterního selhání u pacientky s akutní manifestací Wilsonovy choroby. 23letá pacientka byla přijata ve fázi dekompenzace cirhózy původně neznámé etiologie s projevy jaterního selhávání (Child-Pugh, 12 bodů). Podezření na Wilsonovu chorobu bylo vysloveno na základě anamnézy a vysokého odpadu Cu do moči. Diagnóza byla potvrzena jaterní biopsií a následně genetickým vyšetřením. K jaterní transplantaci nebyla indikována pro obezitu (BMI 60). Při maximální intenzivní konzervativní léčbě a současné léčbě cheláty došlo k postupné stabilizaci stavu a normalizaci jaterních funkcí. Původně nasazený penicilamin musel být vzhledem k alergické reakci a dřeňovému útlumu zaměněn za trientin. 18 měsíců od zahájení léčby je pacientka zcela bez subjektivních obtíží, plně kompenzovaná po stránce jaterní cirhózy s Child-Pugh klasifikací A (5 bodů).
Klíčová slova:
cirhóza – jaterní selhání – penicilamin – trientin – Wilsonova chorobaPopis případu
Třiadvacetiletá žena s těžkou obezitou, jinak bez závažného onemocnění v osobní anamnéze, byla přijata na naše pracoviště počátkem prosince 2009 ze spádové oblastní nemocnice pro nově zjištěnou jaterní cirhózu nejasné etiologie s jaterním selháním a oligurií. Důvodem přijetí do spádové nemocnice koncem listopadu 2009 byla progredující námahová dušnost, otoky dolních končetin a váhový přírůstek cca 20 kg za poslední měsíc (přírůstek hmotnosti byl 70 kg za poslední rok na současných 176 kg při přijetí, významnou měrou se na nárůstu tělesné hmotnosti podílela retence tekutin).
Kromě obezity (již v roce 2004 tělesná hmotnost kolem 100 kg při výšce 162 cm) neměla pacientka v minulosti žádné závažnější onemocnění s výjimkou údaje o infekční mononukleóze prodělané v roce 2004. Při podrobnějším pátrání jsme zjistili, že nemocná byla v roce 2004 krátkodobě hospitalizována na spádovém infekčním oddělení pro febrilní stav provázený bolestmi hlavy a alterací jaterních testů. Při ultrazvukovém vyšetření jater byly popsány změny charakteru jaterní steatózy, sérologicky byla zjištěna hraniční hodnota IgM proti CMV. Onemocnění bylo tehdy na základě výsledků lumbální punkce hodnoceno jako CMV infekce s průvodní serózní meningitidou.
V následujícím období byla pacientka několikrát vyšetřena pro trvalý pocit únavy, dle dostupné dokumentace v roce 2007 přetrvávala alterace jaterních testů (ALT 2,4 µkat/l; AST 1,72 µkat/l; GGT 4,6 µkat/l a ALP 2,25 µkat/l). Nemocné byla doporučena jaterní a redukční dieta a hepatoprotektiva (silymarin). Alterace jaterních testů byla dávána do souvislosti s výraznou obezitou. Většinu svých dalších obtíží (občasné bolesti hlavy, depresivní stavy) přisuzovala pacientka progredující obezitě a další lékařské vyšetření nevyhledala.
V listopadu 2009 byla přijata na interní oddělení spádové nemocnice, kde byly verifikovány projevy jaterní cirhózy s počínající jaterní insuficiencí, a proto byla přeložena na naše pracoviště.
V objektivním nálezu při přijetí na naši JIP dominovala monstrózní obezita (BMI = 62,1) s masivní anasarkou a ascitem, klidová dušnost, akrocyanóza, ikterus, snížená hydratace sliznic, oligurie. Pacientka byla při vědomí, plně orientovaná, bez známek jaterní encefalopatie. Dle Child-Pugh klasifikace měla při přijetí 12 bodů (skupina C).
Při pátrání po etiologii jaterního selhání jsme revidovali toxikologickou a pracovní anamnézu, avšak žádnou zjevnou souvislost, která by pomohla objasnit etiologii jaterní cirhózy, jsme nenalezli. Při opakovaném a podrobném rozboru rodinné anamnézy jsme však zjistili, že sestřenice matky nemocné se léčí s Wilsonovou chorobou.
Základní laboratorní vyšetření při přijetí na naše pracoviště vykazovala makrocytovou anémii a hraniční trombocytopenii (hemoglobin 104 g/l, MCV 110 fl; trombocyty 131 × 109/l), výraznou poruchu koagulace (INR 2,1; APTT 64,5 s; trombinový čas: 32,3 s; fibrinogen 0,62 g/l, antitrombin III 19 %; D-dimery: 1 777), těžkou poruchu proteosyntézy (urea 3,5 mmol/l, kreatinin 83 µmol/l; albumin 28,9 g/l, celková bílkovina 64,2 g/l, prealbumin 0,08 g/l), elevaci jaterních testů (celkový bilirubin: 111 µmol/l, přímý bilirubin 68,6 µmol/l, ALT 1,37 µkat/l, AST 2,18 µkat/l, GGT 4,21 µkat/l, ALP: 2,04 µkat/l, cholinesteráza 43 µkat/l), středně zvýšenou hodnotu CRP (25,9 mg/l) a normální hladinu amoniaku v séru (44 µmol/l).
1. Skiaskopický obrázek provedení transjugulární jaterní biopsie – bioptická jehla v pravé jaterní žíle v pozici před samotným vpichem Fig. 1. X-ray imaging of the transjugular liver biopsy – biopsy needle is placed in the right hepatic vein; position just before the puncture. 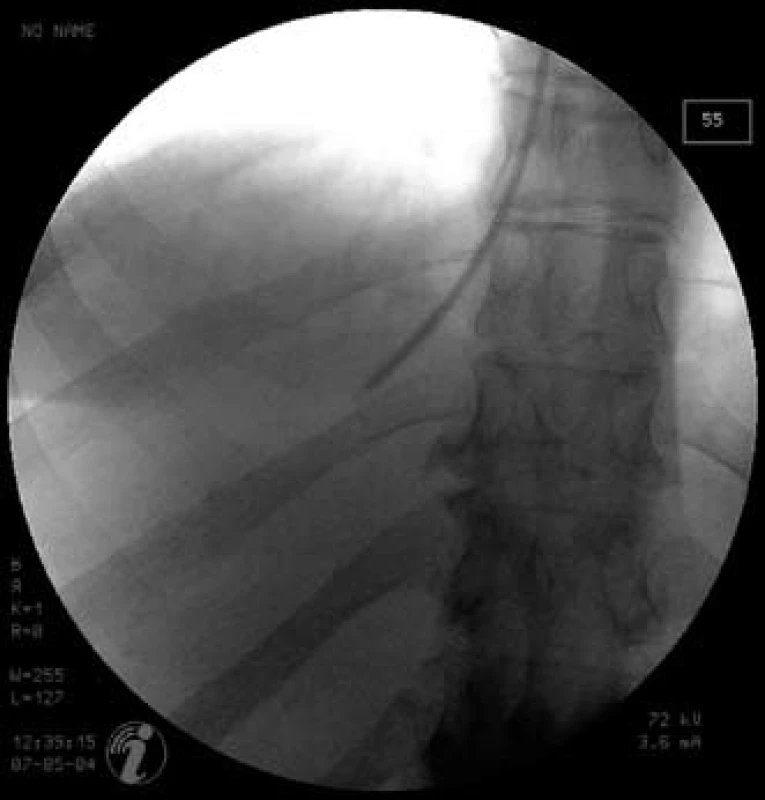
Byl zaznamenán zvýšený odpad mědi v moči za 24 hod (7,38 µmol; norma do 1,0 µmol) a zvýšená hodnota volné mědi v séru (2,30 µmol/l; norma do 1,6 µmol/l), koncentrace ceruloplasminu v séru byla ve fyziologických mezích (0,28 g/l; norma 0,20–0,60 g/l). Kayser-Fleischerův prstenec nebyl prokázán. Při gastroskopickém vyšetření byly popsány velké jícnové varixy.
Zároveň s překvapivým nálezem v rodinné anamnéze byl tedy zjištěn vysoký odpad mědi do moči slučitelný s diagnózou Wilsonovy choroby [1], dalším podporujícím faktem pak byla normální hodnota ALP při jinak zvýšených ostatních jaterních testech.
Při katetrizaci jaterních žil prováděné současně s jaterní biopsií byla prokázána významná portální hypertenze (HVPG 26 mm Hg); histologický nález potvrdil přítomnost cirhózy. Koncentrace mědi v játrech byla 625 µg/g sušiny jaterní tkáně. Diagnóza Wilsonovy nemoci byla posléze potvrzena i genetickým vyšetřením – pacientka je homozygotní pro prevalentní mutaci Wilsonovy choroby H1069Q.
Nemocná byla hospitalizována na jednotce intenzivní metabolické péče v závažném stavu s těžkou jaterní dysfunkcí (funkčně Child-Pugh C), s respirační insuficiencí, masivní anasarkou a ascitem, oligurií a významnou koagulopatií. V úvodu byla vzhledem k přítomnosti jaterního selhání zvažována jaterní transplantace [2]. Tato možnost však byla transplantačním centrem vyloučena pro monstrózní obezitu (BMI přes 60, i při odečtu 30 kg předpokládaného podílu retinovaných tekutin bylo BMI kolem 50).
Již ve fázi naléhavého podezření na možnou Wilsonovu nemoc jsme kromě komplexní klasické symptomatické léčby jaterního selhání časně zahájili kauzální terapii penicilaminem v dávce 300 mg/den. Tato léčba však musela být ukončena po 20 dnech pro výsev toxoalergického exantému a dřeňový útlum (pokles leukocytů na 1,43 × 109/l). Proto byla nemocná přechodně léčena zinkem (Zn sulphuricum) do doby, než se podařilo zajistit trientin [3]. Tímto preparátem v dávce 900 mg/den je léčena dosud.
Při komplexní metabolické péči na kontinuální i.v. diuretické léčbě bylo pozvolna dosaženo negativní tekutinové bilance a relativní stabilizace stavu. Další průběh onemocnění byl komplikován vznikem těžké uroinfekce (Klebsiella pneumoniae EBSL pozitivní) a přítomností spontánní bakteriální peritonitidy (počet leukocytů v ascitu 0,65 × 109/l při negativní kultivaci), s následnou progresí ascitu a oligurií. Přistoupili jsme k vazoaktivní léčbě podáváním terlipresinu (Remestyp v dávce 0,5 mg i.v. po 6 hod) v kombinaci s i.v. podáváním albuminu. Současně byla několikrát provedena odlehčovací punkce ascitu a byla zahájena antibiotická terapie (ciprofloxacin 400 mg i.v. po 12 hod).
Komplexní terapie byla velmi efektivní a postupně bylo dosaženo vymizení ascitu, ústupu anasarky (celkem dosaženo negativní kumulativní bilance tekutin 30–35 l) a postupného zlepšování syntetických funkcí jater. Při propuštění domů v lednu 2010 vážila pacientka 133 kg, albumin v séru měla 35,0 g/l, celkovou bílkovinu 63,2 g/l, bilirubin 83 µmol/l a INR 2,0. Jaterní dysfunkce byla klasifikována jako Child-Pugh B (9 bodů).
Nemocná je dosud v péči nutriční a hepatologické ambulance IV. interní kliniky VFN v Praze, udržuje redukční dietu s omezením při Wilsonově chorobě a s dostatkem bílkovin. Má sestavený individuální jídelníček s doporučeným příjmem 1 500 kCal a 100 g bílkovin denně s cílem pozvolné redukce tělesné hmotnosti. Pacientka aktuálně váží 115 kg (BMI 43,8). Při terapii trientinem došlo postupně k reparaci jaterních funkcí a stabilizaci jaterního onemocnění. Při poslední ambulantní kontrole v květnu 2011 měla normální hodnotu bilirubinu, albuminu, INR, neměla ascites a byla bez subjektivních obtíží, funkční klasifikace Child-Pugh A (5 bodů).
Diskuze
Celý průběh onemocnění je zajímavý a neobvyklý z několika hledisek. V anamnéze je údaj o zvýšení jaterních testů mnoho let před stanovením diagnózy Wilsonovy choroby – tento stav byl přisuzován CMV (!) hepatitidě a jaterní steatóze při těžké obezitě. Nepochybně se již tehdy jednalo o projev Wilsonovy choroby. Na toto dědičné onemocnění navíc mohla upozornit pečlivě odebraná rodinná anamnéza a základní screeningová vyšetření pro tuto chorobu.
Wilsonova choroba je vzácné hereditární onemocnění s autozomálně recesivním typem dědičnosti, s prevalencí 1 : 30 000. Podkladem choroby je vrozená porucha vylučování mědi do žluče způsobená mutací v genu kódujícím měď transportující P-typ ATPázu s následnou akumulací mědi v játrech i jiných orgánech. Nadměrné množství mědi pak vede k poškození především jater a mozku. Klinicky se nejčastěji manifestuje jaterním postižením (akutní či chronická hepatitida, steatóza nebo cirhóza) nebo neuropsychiatrickými příznaky [4]. Wilsonova choroba je chronické onemocnění, které se však může akutní hepatitidou manifestovat. Ta se nejčastěji objeví v dětství nebo dospívání a klinicky se podobá akutní hepatitidě jiné etiologie (infekční, autoimunní) s elevací transamináz, mírným ikterem, únavou a případně dyspepsií. U většiny pacientů akutní fáze odezní, většinou pak přetrvávají vyšší jaterní testy i jiné známky chronické jaterní choroby (hepatomegalie). U části pacientů však může progredovat do fulminantního jaterního selhání. Akutní jaterní selhání se vyskytuje přibližně u 15 % pacientů s jaterní formou onemocnění [5]. Jaterní cirhóza se většinou manifestuje po 20. roce věku. V námi popisovaném případě se jednalo o typickou jaterní formu Wilsonovy choroby s akutním jaterním selháním nasedající na chronickou jaterní chorobu (jaterní cirhózu) s manifestací v obvyklém věku (adolescence/časná dospělost).
Wilsonova choroba není časté onemocnění a její diagnostika bývá na nespecializovaných pracovištích obtížná. Jejím základem je však pečlivý rozbor osobní a rodinné anamnézy. Na Wilsonovu chorobu bychom měli pomýšlet zejména u všech mladých lidí s alterací jaterních testů nejasné etiologie.
Hladina ceruloplasminu v séru není vždy spolehlivým diagnostickým testem, neboť asi u 10 % postižených jedinců je normální a navíc se jedná o typický protein akutní fáze, jehož koncentrace může být zvýšena při jakémkoli zánětlivém procesu v organizmu. Tak tomu bylo i u naší pacientky, která měla vstupně normální hodnotu ceruloplasminu v séru, a teprve po odeznění akutní fáze choroby jsme zaznamenali pokles k hodnotám typickým pro Wilsonovu chorobu (0,16 g/l). Stejně tak se nelze spolehnout na Kayser-Fleischerův prstenec. Zatímco u pacientů s neuropsychiatrickou formou onemocnění bývá nalezen až v 99 % případů, u pacientů s hepatální formou pouze ve 30–50 %. Absence prstence či normální hladina ceruloplasminu v séru tedy diagnózu Wilsonovy choroby nevylučují.
Užitečným diagnostickým nástrojem je stanovení odpadu mědi do moči. Ve fázi akutního jaterního selhání jsou vysoké odpady mědi převyšující několikanásobně normu (ta je do 1,6 µmol/24 hod) téměř patognomické pro Wilsonovu chorobu. Výsledek vyšetření může být zkreslen při technicky špatně provedeném sběru moči.
Genetické vyšetření přineslo velký pokrok v diagnostice Wilsonovy choroby. Problémem je však skutečnost, že v dnešní době je známo více než 500 různých mutací, které mohou chorobu způsobit, a stále se objevují nové (aktuální údaje o známých mutacích lze nalézt na internetové adrese: http://www.wilsondisease.med.ualberta.ca/database.asp). V daném geografickém regionu by většina pacientů měla mít jen několik nejčastěji se opakujících mutací, ale stále existuje až 20 % pacientů, u kterých se nepodaří genetický defekt jednoduchými metodami nalézt. Dřívější dlouhý časový interval nutný ke genetickému vyšetření již naštěstí není nutný, výsledek běžně se vyskytujících mutací lze získat během několika dnů. Negativní genetické vyšetření však nevylučuje diagnózu Wilsonovy choroby. Další význam genetického vyšetření tkví v rodinném screeningu. U naší pacientky byla nalezena mutace H1069Q, která je prevalentní pro střední Evropu a vyskytuje se u nás u 55–60 % pacientů s Wilsonovou chorobou.
Jaterní biopsie s kvantitativním stanovením mědi v jaterní sušině bývala a často stále ještě je zlatým standardem diagnostiky této choroby. Pacienti s Wilsonovou chorobou mají hodnoty mědi vyšší než 250 µg/g sušiny jaterní tkáně. Za ideální situace lze diagnózu stanovit na základě genetického vyšetření, jaterní biopsie však krom diagnostiky slouží i ke stagingu jaterního postižení, a proto ji na našem pracovišti rutinně provádíme. Histologický obraz může být velmi různý od prosté steatózy až po jaterní cirhózu a není specifický. U naší pacientky byla biopsie navíc prováděna v době, kdy se zvažoval další možný etiologický faktor jaterního postižení, a to NASH. Vzhledem k poruše koagulace, přítomnosti ascitu i obezity byla klasická perkutánní jaterní biopsie kontraindikována a biopsie provedena transjugulární cestou. Tento přístup navíc umožnil současné změření portosystémového gradientu, které prokázalo významnou portální hypertenzi.
Podorobnější komentář si zasluhují také složitosti v terapii této nemocné. V době přijetí na IV. interní kliniku splňovala pacientka stran jaterních funkcí jednoznačně kritéria indikace k jaterní transplantaci, která však nemohla být pro extrémní obezitu provedena. Stav se podařilo zvládnout konzervativní léčbou, i když dle všech předpokladů měla infaustní prognózu [2]. Celý průběh tak ukazuje možnosti současné intenzivní medicíny.
Klíčovou roli v terapii měla intenzivní metabolická péče [6]. Pozornost byla od počátku věnována nutriční podpoře s cílem zajistit optimální příjem proteinů, zejména aminokyselin, minimalizovat katabolizmus proteinů a zároveň dosáhnout redukce tukové tkáně. Připomeňme, že pacientka, byť monstrózně obézní, byla již v době přijetí na nemocniční lůžko v těžké proteinové malnutrici způsobené samotným jaterním onemocněním a zároveň i snahou pacientky snížit tělesnou hmotnost pomocí drastické redukční diety. Takto těžká malnutrice sama o sobě nepříznivě ovlivnila jaterní funkce a vedla k imunokompromitaci nemocné. Zejména z počátku hospitalizace byl v rámci celkové alterace perorální příjem nemocné nedostatečný, od prvního dne hospitalizace byla zavedena parenterální výživa cestou nejprve centrálního žilního katétru a po stabilizaci stavu cestou PICC (Peripherally Inserted Centralvenous Catheter – centrální žilní katétr zavedený cestou periferní žíly). Parenterální výživa byla řešena individuálními vaky „all in one“ připravovanými v nemocniční lékárně se zvýšeným zastoupením VLI aminokyselin a omega-3 mastných kyselin. Velká péče byla věnována rehabilitaci, kdy při velmi dobré spolupráci nemocné byla udržována mobilita s cílem udržení svalové hmoty.
V terapii refrakterního ascitu s oligurií a zhoršením renálních funkcí, k nimž došlo v návaznosti na závažný uroinfekt a přítomnost SBP, byla využita léčba terlipresinem a albuminem. Ačkoli stav nesplňoval všechna diagnostická kritéria hepatorenálního syndromu, uvedená léčba běžně používaná k terapii hepatorenálního syndromu [7] měla i zde velmi příznivý efekt.
Dle všech dostupných doporučení je lékem volby v případě akutní manifestace jaterní formy Wilsonovy choroby chelát penicilamin. Ten jsme bohužel museli vysadit pro nežádoucí účinky a zvolili jsme léčbu trientinem (tetraetylentetramin dihydrochlorid), s jehož podáváním jsme dosud neměli zkušenosti. Léčba zinkem (který je jinak běžnou alternativou penicilamine) v této akutní fázi není vhodná [2].
Trientin je podobně jako penicilamin chelát vážící měď, liší se však strukturou, neboť nemá sulfhydrylovou skupinu. Podobně jako penicilamin zvyšuje vylučování mědi do moči, nelze však vyloučit, že v organizmu uvolňuje měď z jiného kompartmentu než penicilamin. Jeho účinek v léčbě Wilsonovy choroby je nicméně prokázán a je doporučován jako alternativa penicilaminu u pacientů, kteří penicilamin netolerují. Trientine má minimum nežádoucích účinků a je velmi dobře snášen. Monitorace léčby se provádí stejně jako u penicilaminu sledováním odpadů mědi do moči. Trientine sice není v ČR kategorizován, je dražší než penicilamin, ale vzhledem k registraci v ostatních zemí EU jej lze v případě potřeby a po souhlasu zdravotní pojišťovny zajistit prostřednictvím individuálního dovozu.
V případě příznivého vývoje onemocnění předpokládáme v budoucnu změnu léčby za klasickou léčbu zinkem. Závěrem lze konstatovat, že výše uvedená kazuistika ukazuje v plné šíři problematiku screeningu, diagnózy i léčby Wilsonovy choroby a také ukazuje na problém, se kterým se určitě budeme setkávat stále častěji: koincidence různých chorob s obezitou, která maskuje projevy základního onemocnění a limituje jak diagnostické, tak i léčebné postupy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Podpořeno: IGA MZ ČR NR-9406/3.
Doručeno/Submitted: 30. 4. 2011
Přijato/Accepted: 5. 6. 2011MUDr. Hana Petrášková
IV. interní klinika VFN v Praze
U Nemocnice 2; 128 08 Praha 2
Petraskova.Hana@seznam.cz
Sources
1. Brůha R, Mareček Z, Martásek P et al. Wilsonova choroba. Čas Lék čes 2009; 148: 544–548.
2. Huster D, Leonhardt K, Mossner J. Wilson disease – update on pathophysiology and management. Čes a Slov Gastroent a Hepatol 2008; 62(4): 220–228.
3. Wiggelinkhuizen M, Tilanus MEC, Bollen CW et al. Systematic review: Clinical efficacy of chelator agents and zinc in the initial treatment of Wilson disease. Aliment Pharmacol Ther 2009; 29(9): 947–958.
4. Ferenci P, Caca K, Loudianos G et al. Diagnosis and phenotypic classification of Wilson disease. Liver Int 2003; 23(3): 139–142.
5. Mareček Z. Wilsonova choroba. Praha: Galén 1996. 143 s.
6. Fink M, Abraham E, Vincent JL et al. Critical Care. Philadelphia: Elsevier Saunders: 2005.
7. Sherlock S, Dooley J (Eds.). Diseases of the Liver and Biliary System. Oxford: Blackwell Science 2004 : 413–420.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2011 Issue 4-
All articles in this issue
- Standard of the Czech Society of Gastroenterology for capsule endoscopy of the small intestine
- What to do when invasive colorectal carcinoma is found in endoscopic resection specimens?
- Feasibility of a novel single loop-and-clip gastrotomy closure (‘King’s closure’) after NOTES procedures in an experimental study
- Autoimmune pancreatitis in a patient with Crohn’s disease
- Single-balloon enteroscopy in patients with Crohn’s disease – single centre’s experience
- Treatment of liver failure caused by Wilson´s disease
- Professor C. Mulder, guest at the 5th International Endoscopy Workshop in Hradec Králové
- 12th Endoscopic day in IKEM
- Are we still pioneers in the field of colorectal cancer screening? The meeting report from the WEO/OMED/IDCA Colorectal Cancer Screening Committee
- XXXIXth may hepatologic days
- Interview with the recent sexagenarian, Prof. MUDr. Václav Mandys, CSc.
- Thanks to Prof. Vavrečka!
- From Dítě to Špičák
- Digestive endoscopy professionally, practically and economically
- Position and yield of colonoscopy within the faecal occult bleeding test (FOBT) based screening program
- Training in endoscopic methods using a pig ex-vivo simulator – assessment by participants
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Standard of the Czech Society of Gastroenterology for capsule endoscopy of the small intestine
- Autoimmune pancreatitis in a patient with Crohn’s disease
- What to do when invasive colorectal carcinoma is found in endoscopic resection specimens?
- Treatment of liver failure caused by Wilson´s disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

