-
Medical journals
- Career
Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
Authors: Milan Grofik; Egon Kurča
Authors‘ workplace: Neurologická klinika Jesseniovej lekárskej fakulty UK a Univerzitná nemocnica Martin, prednosta prof. MUDr. Egon Kurča, PhD.
Published in: Forum Diab 2013; 2(2): 108-116
Category:
Overview
Pacienti s diabetes mellitus sú vystavení riziku vzniku rôznych komplikácií, pričom ich veľká časť je priamo alebo nepriamo spojená s poškodením periférneho alebo centrálneho nervového systému. Cieľom predloženej práce je oboznámenie čitateľov so spektrom možných komplikácií v oblasti periférneho nervového systému spojených s diabetes mellitus. V práci je relatívne podrobne opísaný klinický obraz rôznych typov a foriem neuropatie a ich diagnostika vrátane nových diagnostických metód detekcie neuropatie. Práca podáva aj prehľad recentných odporúčaní pre liečbu diabetickej neuropatie.
Kľúčové slová:
autonómna neuropatia – diabetes mellitus – komplikácie – periférna neuropatiaÚvod
Diabetická neuropatia predstavuje najčastejšiu chronickú komplikáciu DM, ktorá postihuje tenké alebo hrubé vlákna somatických nervov (nervy končatín, trupu a hlavy) a autonómne nervy (vegetatívny sympatikový a parasympatikový systém).
Diabetická neuropatia má vážny dopad na kvalitu života a mortalitu diabetikov. Je najčastejšou príčinou bolesti v skupine pacientov s DM (neuropatická bolesť), je najčastejšou príčinou vzniku syndrómu diabetickej nohy a je aj nezanedbateľne častou príčinou náhleho úmrtia diabetikov v dôsledku kardiálnej autonómnej neuropatie. Diabetická neuropatia je značne heterogénne ochorenie. Patofyziologický proces je odlišný v závislosti od typu diabetu a súčasne postihuje rôzne časti nervového systému. Prezentuje sa tak rôznymi klinickými príznakmi, na základe ktorých môžeme vymedziť viacero klinických foriem diabetickej neuropatie.
Diabetická neuropatia
Diabetická neuropatia je definovaná ako poškodenie periférnych somatických alebo autonómnych nervov, pričom je vylúčená iná príčina neuropatie [1]. V patogenéze neuropatie sa uplatňujú najmä metabolicko-vaskulárne faktory a pri atypických formách zohrávajú dôležitú úlohu aj imunitné mechanizmy.
Jednotlivé údaje o prevalencii diabetickej neuropatie v skupine pacientov s DM sa v literatúre významne odlišujú a pohybujú sa v rozmedzí od 25–90 % [2,3,4,5,6]. Tento veľký rozptyl prevalencie priamo súvisí s použitými diagnostickými metódami na detekciu klinickej alebo subklinickej formy neuropatie a zložením skúmanej populácie diabetikov (vek, dĺžka trvania DM a metabolická kompenzácia ochorenia). Epidemiologické štúdie spred 20–30 rokov udávali prevalenciu do 50 %. Recentné epidemiologické štúdie hovoria najčastejšie o prevalencii okolo 60 % . Keď zoberieme do úvahy údaj o skoršej a kvalitnejšej liečbe diabetu v posledných rokoch, dá sa prepokladať, že zvyšujúca sa prevalencia a incidenica diabetickej neuropatie je zapríčinená skôr lepšou detekciou neuropatie.
Prítomnosť neuropatie musíme predpokladať u pacientov s DM 1. typu v trvaní viac ako 5 rokov a u pacientov s DM 2. typu bez ohľadu na dĺžku jeho trvania, nakoľko sa DM 2. typu obvykle diagnostikuje s výrazným oneskorením oproti času skutočného vzniku DM. Neuropatia môže byť prvým klinickým prejavom, ktorý vedie k stanoveniu vlastnej diagnózy DM.
Neuropatia môže byť aj pri tzv. prediabete (porucha glukózovej tolerancie alebo zvýšená glykémia nalačno) [7]. Populačné štúdie udávajú 11–25 % prevalenciu neuropatie pri prediabete [8]. Je často označovaná ako prediabetická neuropatia, pričom klinicky ide prevažne o neuropatiu tenkých vlákien alebo senzitívnu polyneuropatiu dolných končatín, často bolestivú formu.
Typické formy diabetickej neuropatie
Distálna senzitívna a senzitívne-motorická polyneuropatia
Je to najčastejšia forma diabetickej neuropatie, ktorá postihuje dominantne dolné končatiny. Klinický obraz je kombináciou príznakov poškodenia senzitívnych, motorických a autonómnych vlákien. Typické je stranovo symetrické poškodenie s distálnym akcentom.
Poškodenie senzitívnych vlákien sa manifestuje hlavne parestéziami. Fakultatívne môžu byť prítomné bolesti (bolestivá alebo nebolestivá forma distálnej senzitívne-motorickej polyneuropatie). Zriedkavá nie je ani neistota v postoji a pri chôdzi v dôsledku porušenej aferentácie. Klinickým vyšetrením zisťujeme poruchy povrchovej (taktilná, diskriminačná, algická, termická) citlivosti a hlbokej citlivosti (vibračná citlivosť, polohocit a pohybocit). Typická je hypestézia ponožkovitého typu a zníženie šľachovookosticových reflexov.
Poškodenie motorických vlákien sa prejavuje ako zvýšená únavnosť a slabosť dolných končatín s častým výskytom nočných svalových kŕčov. Klinické vyšetrenie opäť ukazuje zníženie úrovne šľachovookosticových reflexov, zníženie svalovej sily a hypotóniu a hypotrofiu svalov s akrálnou predominanciou.
Pri poškodení autonómnych vlákien sú prítomné pocity chladu a presiaknutia končatiny. Klinickým vyšetrením zisťujeme suchú, tenkú a popraskanú kožu s fisúrami a neprirodzeným leskom. Časté sú aj hyperkeratózy, úbytok ochlpenia, dystrofické zmeny nechtov a edémy končatín. V dôsledku sudomotorickej dysfunkcie dochádza k atrofii potných a mazových žľiaz. Vazomotorická dysfunkcia má za následok vazodilatáciu a otvorenie arteriovenóznych spojov.
Pri tejto forme neuropatie patofyziologický proces poškodzovania periférnych nervov môže predilekčne postihovať buď tenké nemyelinizované alebo hrubé myelinizované nervové vlákna. Na základe toto rozdeľujeme diabetickú polyneuropatiu na neuropatiu tenkých a neuropatiu hrubých vlákien. Uvedené delenie je dôležité najmä preto, že klinický obraz ako aj výsledky pomocných vyšetrení sú pri každom type rozdielne. Pri neuropatii hrubých vlákien je často pacient bez subjektívnych ťažkostí ale neurologický objektívny nález a rovnako aj EMG-nález sú presvedčivo abnormné. Chýbanie subjektívnych ťažkostí pacienta s klinicky výraznou poruchou citlivosti robí týchto pacientov vysoko rizikových z hľadiska vzniku syndrómu diabetickej nohy. Neuropatia tenkých vlákien je typická prítomnosťou neuropatickej bolesti ale klinický neurologický nález (s výnimkou abnormalít pri vyšetrení algickej a termickej citlivosti) a EMG-nález sú v norme. Uvedený fakt dokumentuje dôležitosť vyšetrenia najmä termickej citlivosti (keďže algická citvosť môže mať interindividuálnu variabilitu) v klickej praxi.
Table 1. Neuropatia tenkých a hrubých vlákien 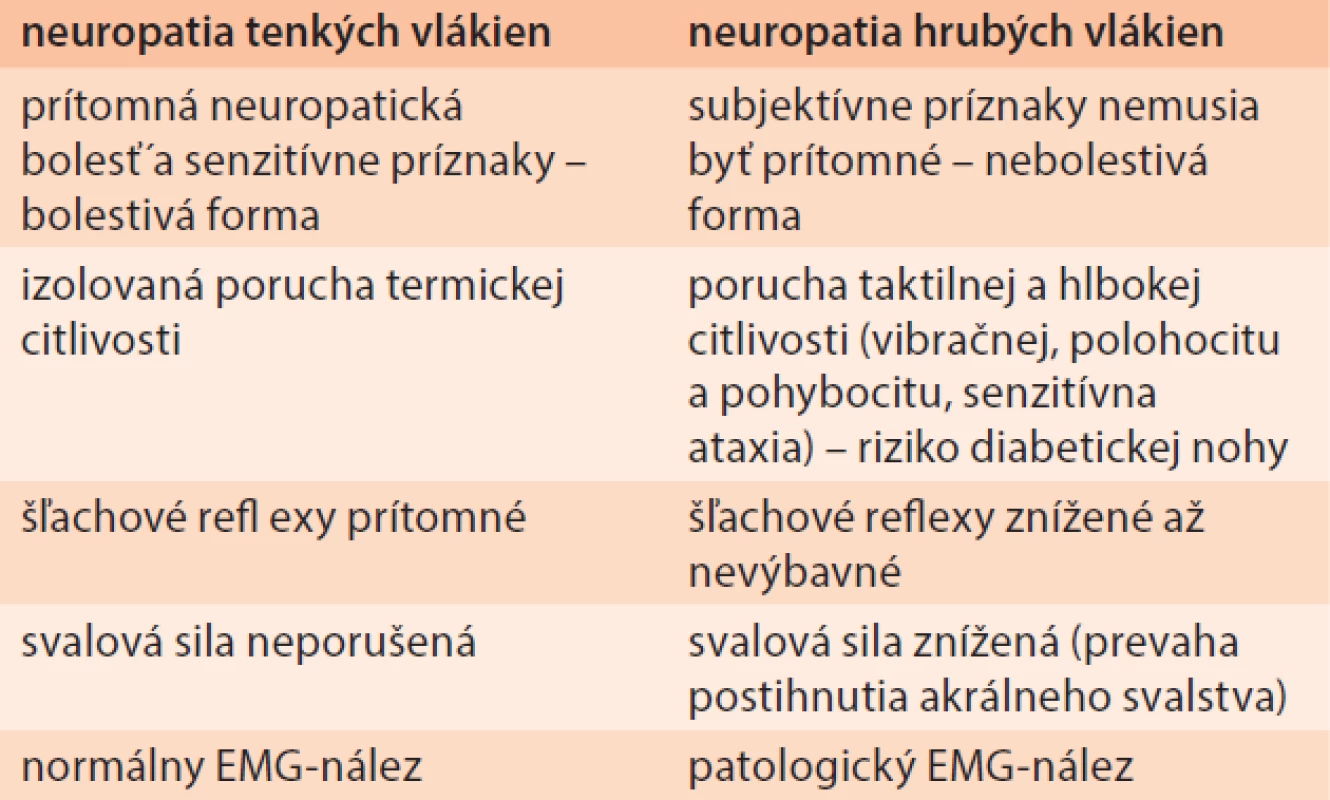
Distálna senzitívne-motorická polyneuropatia je často sprevádzaná tvorbou neuropatických vredov na dolných končatinách (ulcus neuropaticus). Na rozdiel od ischemických vredov býva koža teplá, ružová a suchá a periférne pulzácie sú dobre hmatné. Defekty vznikajú v miestach zvýšeného lokálneho tlaku (chôdza, nevhodná obuv) a majú charakteristický hyperkeratózny val.
Proximálna motorická polyneuropatia
Charakterizuje ju pomalý vývoj symetrickej slabosti a hypotrofie svalov panvového pletenca a stehenného svalstva. Skôr výnimočne býva postihnuté proximálne svalstvo horných končatín. Zriedkavé sú bolesti a poruchy citlivosti, resp. ak sú prítomné, tak potom v akrálnej distribúcii v rámci koexistujúcej distálnej senzitívne-motorickej polyneuropatie.
Bolestivé formy diabetickej neuropatie
Distálna senzitívna a senzitívne-motorická polyneuropatia – bolestivá forma
Bolestivá forma sa vyskytuje asi u 26 % pacientov s distálnou senzitívne-motorickou polyneuropatiou [9,10,11,12]. Zaujímavým údajom je to, že 12,5 % pacientov s bolestivou formou diabetickej neuropatie nikdy neinformovalo ošetrujúceho lekára o bolestivých príznakoch a 39,3 % pacientov nikdy nedostalo liečbu ovplyvňujúcu neuropatickú bolesť [13]. Dominujúcim klinickým prejavom je neuropatická bolesť dolných končatín.
Neuropatická bolesť je definovaná ako bolesť spôsobená poškodením centrálneho alebo periférneho nervového systému (centrálna a periferna neuropatická bolesť). V prípade diabetickej neuropatie ide o periférnu neuropatickú bolesť, ktorá má iné charakteristiky ako nociceptívna (fyziologická) bolesť. Je to spontánna alebo stimulom provokovaná bolesť (pričom samotný stimul nemusí byť algický – napr. dotyk ponožky, posteľnej prikrývky). Pre periférnu neuropatickú bolesť je typická alodýnia (nebolestivý, napríklad taktilný podnet je vnímaný ako bolestivý podnet) a hyperalgézia (zvýšená percepcia bolesti na algický podnet mechanického alebo termického charakteru nadprahovej intenzity) [14]. Pacienti sa najčastejšie sťažujú na pokojové, hlavne nočné pálivé bolesti dolných končatín.
Funkčná hyperglykemická neuropatia
Funkčná hyperglykemická neuropatia sa prejavuje dysestéziami a bolesťami dolných končatín v čase zvýšenej glykémie. Po normalizácii glykémie ťažkosti s určitým časovým posunom ustupujú.
Akútna bolestivá diabetická neuropatia (diabetická neuropatická kachexia)
Je to zriedkavá forma diabetickej neuropatie charakterizovaná rýchlym a výrazným úbytkom hmotnosti, ktorý je spojený s neuropatickou bolesťou v oblasti dolných končatín alebo trupu, pričom sa nezistí iná príčina bolesti a váhového úbytku. Tento typ diabetickej neuropatie sa častejšie vyskytuje v úvodných štádiach DM a postihuje viac mužské pohlavie. Akútna bolestivá diabetická neuropatia (napriek adjektívu akútna v oficiálne uznanom názve) má protrahovaný priebeh ale dobrú prognózu.
Inzulínová neuritída (liečbou navodená neuropatia, akútna bolestivá neuropatia z rýchlej kompenzácie DM)
Inzulínová neuritída predstavuje tiež zriedkavú formu diabetickej neuropatie, ktorá je charakterizovaná dysestéziami a neuropatickou bolesťou dolných končatín po začatí liečby DM inzulínom a teda po normalizácii sérovej hladiny glukózy. Prognóza je dobrá. Časť autorov o jej existencii ako samostatnej nozologickej jednotky pochybuje.
Atypické formy diabetickej neuropatie
Ataktická neuropatia
Podstatou ataktickej neuropatie je poškodenie hrubých myelinizovaných aferentných vlákien dolných končatín, ktoré zabezpečujú propriocepciu a epikritickú citlivosť. Klinicky sa prejavuje proprioceptívnou ataxiou postoja a chôdze, ktorá sa zásadne zhoršuje v tme a pri vyradení zrakovej kontroly (Rombergov príznak). Šľachovookosticové reflexy sú znížené alebo nevýbavné.
Akrodystrofická neuropatia
Vzniká poškodením tenkých nemyelinizovaných autonómnych vlákien dolných končatín a klinicky sa prejaví poruchami trofiky kože a podkožia. Koža je suchá a fragilná a v miestach vyššieho lokálneho tlaku na chodidle vzniká defekt so zlým hojivým potenciálom (malum perforans pedis). Typickými lokalitami na chodidle sú palec, prsty, koža pod metatarzofalangeálnymi kĺbmi, päta a členok. Vredy sú spravidla nebolestivé a môžu byť príčinou tzv. malých amputácií. Akrodystrofická neuropatia môže byť komplementárnou súčasťou distálnej senzitívne-motorickej polyneuropatie.
Neuropatická artropatia (Charcotova osteoartropatia)
Jedná sa o poškodenie autonómnych nervových vlákien v oblasti chodidla s následnou poruchou trofiky kĺbov, rozpadom kĺbových hlavíc a zánikom kĺbov. Najčastejšie sú postihnuté metatarzofalangeálne, tarzometatarzálne a interfalangeálne kĺby. Strata citlivosti v dôsledku poškodenia senzitívnych vlákien vedie k preťažovaniu chodidla. Súčasná hypotrofia a slabosť drobných svalov chodidla v dôsledku poškodenia motorických vlákien podmieňuje deformáciu nohy s porušením až zánikom pozdĺžnej aj priečnej klenby nohy. Vzniká valgózne postavenie palca a vzájomné stlačenie sa a prekrývanie prstov.
Fokálna a multifokálna neuropatia
Jedná sa o poškodenie jedného alebo viacerých nervov hlavy, trupu alebo končatín. Vzniká väčšinou vo veku viac ako 50 rokov v skupine pacientov s dlhším trvaním DM a obyčajne v teréne distálnej senzitívne-motorickej polyneuropatie.
Pri fokálnej neuropatii hlavových nervov ide najčastejšie o poškodenie okohybných nervov, najmä n. oculomotorius, menej často n. abducens a n. trochlearis. Klinicky sa ochorenie prejaví akútnou diplopiou spojenou s bolesťou v oblasti očnej gule – tzv. diabetická bolestivá oftalmoplégia. Pri poškodení n. oculomotorius je typická intaktnosť pupilomotoriky (na rozdiel od kompresívnej etiológie pri intrakraniálnych procesoch). Časté je aj poškodenie n. facialis. Zriedkavejšie je postihnutie viacerých kraniálnych nervov súčasne pod obrazom diabetickej kraniálnej polyneuropatie.
Pri fokálnej neuropatii trupu hovoríme o diabetickej kmeňovej (trunkálnej) mononeuropatii, o diabetickej torakoabdominálnej neuropatii alebo diabetickej trupovej radikulopatii. Môže ísť o poškodenie jedného alebo viacerých interkostálnych nervov, prípadne n. subcostalis, iliohypogastricus alebo ilioinquinalis. Klinicky sa poškodenie obyčajne prejavuje pásovou pálivou bolesťou v dermatóme postihnutého nervu s výraznou hyperestéziou a alodýniou. V uvedenom nervovom segmente môže vzniknúť oslabenie svalov, čo môže spôsobiť vyklenutie brušnej steny a klinický obraz napr. abdominálnej pseudohernie.
Pri fokálnej neuropatii končatinových nervov je na horných končatinách najčastešie postihnutý n. medianus, n. ulnaris a n. radialis a na dolných končatiných n. fibularis, n. femoralis a n. cutaneus femoris lateralis. Mononeuropatie môžu vznikať v miestach tzv. fyziologických úžin (karpálny tunel, oblasť lakťa, tarzálny tunel), v typických miestach vonkajšej kompresie (rameno) alebo v iných netypických lokalizáciach.
Diabetická amyotrofia (asymetrická proximálna bolestivá motorická neuropatia, amyotrofický pelvifemorálny syndróm)
Ochorenie postihuje skôr staršie osoby, častejšie mužov a obyčajne sa jedná o včasné štádium novodiagnostikovaného DM. Klinicky sú prítomné jednostranné bolesti vyžarujúce z gluteálnej oblasti do stehna spolu so slabosťou a hypotrofiou vybraných stehenných svalov. Príčinou klinického obrazu je axonálne poškodenie lokalizované v širokej oblasti koreňov (plexov, nervov). Obyčajne zisťujeme areflexiu patelárneho reflexu spolu s nekonštantnými poruchami citlivosti. Prognóza ochorenia je variabilná, pričom jedna tretina pacientov sa upravuje takmer ad integrum, jedna tretina sa upraví čiastočne a v jednej tretine pretrváva dlhodobo ťažký motorický deficit.
Autonómna neuropatia
Prejavy autonómnej neuropatie výrazne zhoršujú kvalitu života diabetikov a predstavujú aj riziko ohrozenia ich života (náhla kardiálna smrť pri kardiovaskulárnej neuropatii a ohrozenie života pri syndróme neuvedomovania si hypoglykémie).
Kardiovaskulárna autonómna neuropatia
Kardiovaskulárna autonómna neuropatia (KAN) je najčastejšie diagnostikovaná forma autonómnej neuropatie pri DM. Do určitej miery môžeme KAN považovať za monitor autonómnych funkcií pri DM, pretože pri potvrdení prítomnosti KAN je možné vo väčšine prípadov preukázať minimálne subklinické poškodenie aj ostatných vegetatívnych systémov.
Klinicky sa prejavuje syndrómom kardiálnej denervácie, ktorý zahŕňa poruchu variability srdcového rytmu v závislosti od dýchania, diurnálneho rytmu, polohy tela alebo telesnej záťaže. Typická je pokojová tachykardia (často nočná) a ortostatická hypotenzia. Do obrazu KAN ďalej patrí porucha vnímania anginóznej bolesti pri ischémii myokardu a možnosť vzniku tichej ischémie myokardu. Častejší je v tejto skupine osôb aj výskyt arytmií. Diabetici s KAN majú signifikantne vyššie riziko vzniku náhleho kardiálneho úmrtia ako aj vyššie perioperačné riziko v porovnaní s diabetikmi bez KAN ako aj v porovnaní s ostatnou zdravou populáciou.
Z vaskulárnych zmien je dôležitá mediokalcinóza tepien, čiže proces vápenatenia mediálnej vrstvy artérií v dôsledku sympatikovej denervácie. Častý je aj neuropatický edém, ktorý je taktiež dôsledkom sympatikovej denervácie s následnou vazodilatáciou a otvorením artériovenóznych spojov.
Gastrointestinálna autonómna neuropatia
Postihnutie pažeráka sa prejavuje hypomotilitou a z toho rezultujúcou dysfágiou. Postihnutie žalúdka, čiže tzv. diabetická gastroparéza, je charakterizovaná nauzeou, pocitom plnosti žalúdka a oneskoreným posunom potravy do tenkého čreva. Výsledkom gastroparézy môže byť aj zlá kompenzácia základného ochorenia (je to napr. jedna z príčin tzv. brittle diabetes) s paradoxnými hypoglykémiami po jedle. Atónia žlčníka spôsobuje žlčníkovú dyskinéziu a poruchy trávenia. Postihnutie črevného traktu spôsobuje často obstipačný synsróm alebo zriedkavejšie hnačky (najčastejšie nočné). Veľmi zriedkavá je neurogénna inkontinencia stolice.
Urogenitálna autonómna neuropatia
Urogenitálna autonómna neuropatia sa prejavuje hypotóniou až atóniou močového mechúra s postmikčným reziduom, čo je vhodný terén pre recidivujúce uroinfekty. Pacienti s atóniou mechúra a megavezikou sú ohrození poškodením obličiek hydronefrózou. Charakteristické je časté močenie s malými objemami moču. V pokročilom štádiu ochorenia môže byť prítomná aj močová inkontinencia. Závažným problémom mužskej populácie s DM je erektilná dysfunkcia. Ďalším prejavom autonómnej neuropatie je napr. necitlivosť semenníkov na bolesť. V ženskej populácii s DM sa udáva okrem iného znížená vaginálna lubrikácia.
Sudomotorická autonómna neuropatia
Charakterizuje ju znížená potivosť v oblasti dolných končatín a dolnej polovice trupu a naopak zvýšená potivosť v oblasti hlavy, krku a hrudníka. Potenie býva niekedy profúzne v nočných hodinách alebo po jedle (gustatory sweating). Sudomotorická neuropatia na dolných končatinách je rizikovým faktorom pre vznik končatinových ulcerácii [15].
Pupilárna autonómna neuropatia
Porucha činnosti m. sphincter et dilatator pupillae a m. ciliaris má za následok paralytické až fixované obyčajne úzke zrenice (Adieho syndróm) a poruchu situačnej adaptácie optickej mohutnosti šošovky. Postihnutí diabetici môžu mať ťažkosti s videním za šera a v tme a pri pohľade do blízka (napr. čítanie).
Endokrinná autonómna neuropatia
Je potrebné spomenúť najmä syndróm neuvedomenia si hypoglykémie. Tento bol donedávna považovaný za prejav autonómnej neuropatie podmienený poruchou sympatikovej inervácie drene nadobličiek s následným chýbaním sekrécie katecholamínov pri hypoglykémii. Výskyt tohto fenoménu v skupine osôb bez autonómnej neuropatie v začiatočných štádiach DM 1. typu, chýbanie sekrécie kontraregulačných hormónov iba pri hypoglykémii pri súčasnom zachovaní sekrécie na iné stimuly ako aj prítomnosť tohto javu u pacientov s inzulinómami svedčia pravdepodobne pre primárnu poruchu CNS (suspektná je oblasť ventromediálneho hypotalamu) [16].
Diagnostika diabetickej neuropatie
Diagnostický algoritmus diabetickej neuropatie štandardne pozostáva z nasledujúcich krokov:
Table 2. Diagnostika diabetickej neuropatie 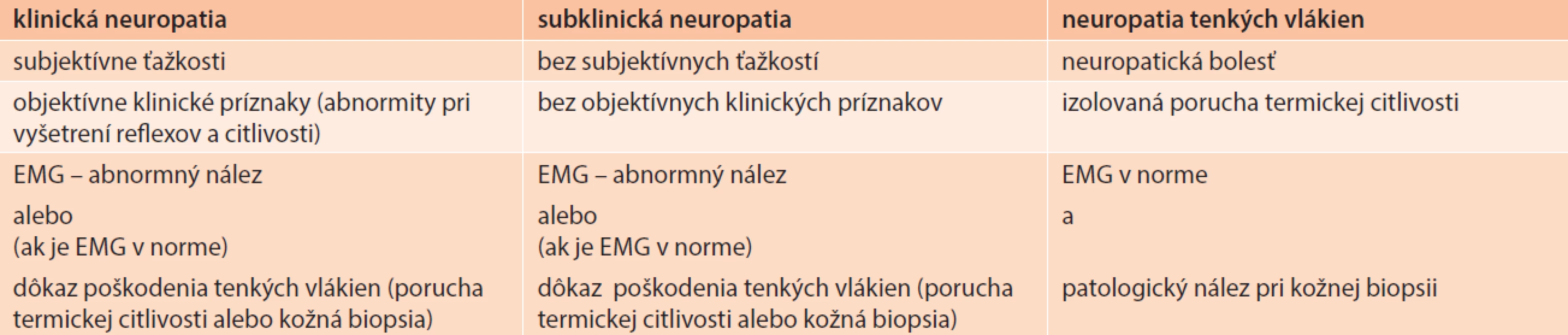
- anamnéza
- objektívne klinické neurologické vyšetrenie
- elektromyografia
- kvantitatívne vyšetrenie senzitívnych funkcií
- vyšetrenie jednotlivých autonómnych funkcií
- biopsia nervu a kože
- korneálna konfokálna mikroskopia
Anamnéza
Pri rozhovore s pacientom identifikujeme súbor patologických príznakov, ktoré môžu byť typické pre diabetickú neuropatiu (podporujú stanovenie diagnózy) alebo netypické pre diabetickú neuropatiu (spochybňujú stanovenie diagnózy). Pacient môže vyplniť aj rôzne nekvantifikované alebo kvantifikované dotazníky na detekciu neuropatie. Treba podotknúť, že asi polovica pacientov s diabetickou neuropatiou neudáva žiadne subjektívne ťažkosti a práve táto skupina asymptomatických pacientov (nebolestivá forma neuropatie) je najviac riziková pre vznik syndrómu diabetickej nohy.
Objektívne klinické neurologické vyšetrenie
Klinickým vyšetrením posudzujeme stav a trofiku kože a kožných adnex, tonus a silu vybraných svalov a svalových skupín. Zásadný význam má vyšetrenie šľachovo-okosticových reflexov, najmä reflexu Achillovej šľachy a vyšetrenie povrchovej a hlbokej citlivosti.
Poruchu funkcie povrchovej citlivosti najčastejšie detekujeme vyšetrením taktilnej citlivosti Semmes-Weinsteinovým monofilamentom (10 g). Vyšetrenie sa robí na 4 miestach plantárnej plochy nohy (palec, 1. a 5. metatarzofalangeálny kĺb a päta). Filamentum sa prikladá tak, aby došlo k jeho rýchlemu prehnutiu. Pri náleze jedného a viacerých necitlivých bodov ide o patologický nález.
Pre posúdenie funkcie tenkých vlákien je dôležité vyšetrenie termickej citlivosti, čiže schopnosti rozlišovať chladné a teplé podnety najlepšie s použitím rôznych prístrojov (NeuroQuick, Tiptherm). Porucha algickej a termickej citlivosti môže byť jedinou abnormitou v klinickom vyšetrení pri neuropatii tenkých vlákien.
Na posúdenie stavu hlbokej citlivosti využívame vyšetrenie polohocitu a pohybocitu a vyšetrenie vibračnej citlivosti kalibrovanou 8-stupňovou 128 Hz ladičkou alebo biothesiometrom. Ladička sa prikladá z dorzálnej strany chodidla na bázu distálneho falangu alebo na prvý metatarz, ďalej na distálny interfalangeálny kĺb II. a III. prsta. Za jednoznačne abnormný nález vo vekovej skupine do 50 rokov sa považuje prah vibračnej citlivosti nižší alebo rovný 3 a nad 50 rokov nižší alebo rovný 5.
Klinické vyšetrenie je možné zaznamenať do rôznych kvantifikovaných dotazníkov (napr. The Michigan Neuropathy Screening Instrument, Neuropathy Symptom Score, Neuropathy disability score, The Michigan diabetic neuropathy score, neuropathy impairment score), ktorých výhodou je možnosť longitudinálneho sledovania vývoja neuropatie.
Elektromyografia (EMG)
Štandardom je stimulačná elektroneurografia, čiže elektrická stimulácia nervov s registráciou odpovede z príslušných svalov a kožných senzitívných areí povrchovými elektródami (kondukčné štúdie). Na dolných končatinách štandardne vyšetrujeme motorické neurogramy a F-vlnu n. fibularis a n. tibialis, senzitívne neurogramy n. suralis a n. plantaris medialis a H-reflex n. tibialis. Kondukčné štúdie umožňujú stanoviť podiel axonálnej a demyelinizačnej zložky poškodenia a kvantifikovať stupeň poškodenia. Ihlová EMG podáva informácie napr. o stave kolaterálnej reinervácie pri axonálnom poškodení a o aktivite neuropatického procesu. Ihlové vyšetrenie má však svoje limitácie. Je to hlavne častý nález axonálneho typu poškodenia v distálnych svalových skupinách na dolných končatinách vo vyššom veku aj u osôb bez neuropatie, ďalej riziko infekcie a rany v teréne diabetickej neuropatie a samozrejme invazívnosť vyšetrenia.
Štandardný protokol EMG-vyšetrenia pri neuropatii zahŕňa testovanie funkcie hrubých myelinizovaných vlákien. Pri izolovanej neuropatii tenkých vlákien je EMG-nález v norme. Jednou z možností elektrofyziologického monitorovania funkcie tenkých vlákien je vyšetrenie kožného sympatikového reflexu.
Kvantitatívne vyšetrenie senzitívnych funkcií
Napriek názvu sa jedná o subjektívny diagnostický test založený na údajoch pacientov. V porovnaní s klinickým vyšetrením senzitivity je rozdiel v aplikácii kvantitatívne presne definovaných stimulov. Biothesiometria je vyšetrenie vibračnou sondou, ktorá sa prikladá na bazu distálneho falangu z dorzálnej strany chodidla. Pozvolne sa zvyšuje amplitúda až kým pacient začne cítiť vibrácie (VPT – vibratory perception threshold). Zvýšený vibračný prah je rizikovým faktorom neuropatických ulkusov a končatinových amputácii [17].
Prístroje rady CASE (computer assisted sensory examination) umožňujú vyšetrovať prah vibračnej, tepelnej aj algickej citlivosti. Nové možnosti poskytuje aj prístroj Neurometer, ktorý umožňuje stanovenie kondukčného prahu 3 typov senzitívnych vlákien (A-beta, A-delta a C) a prah tolerancie bolesti povrchovou elektrickou stimuláciou frekvenciami 5, 250 a 2 000 Hz.
Pedografia
Pedografia je metóda, ktorá slúži na kvantifikáciu statického tlaku chodidla. Zariadenie pozostáva z aktívnej podložky pre chodidlo spojenej s počítačovým systémom, ktorý graficky zobrazí rozloženie tlaku chodidla s určením miest maximálneho zaťaženia. Pomáha pri diagnostike patologickej klenby nohy a pri tvorbe špeciálnej ortopedickej obuvi. Samotná metóda netestuje priamo inerváciu chodidla, informuje nás skôr o jej dôsledkoch a je prínosná v diagnostike neuropatickej artopatie.
Vyšetrenie jednotlivých autonómnych funkcií
Diagnostika jednotlivých foriem diabetickej autonómnej neuropatie je v rukách špecialistu príslušného odboru a stanovuje sa vylúčením iných príčin ťažkostí pacienta. K dispozícii sú aj rôzne dotazníky na detekciu prejavov autonomnej neuropatie. Pozitívny nález je však už neskorým štádiom autonómnej neuropatie.
KAN je väčšinou prvá a súčasne najčastejšia klinická manifestácia autonómnej neuropatie. Samozrejmou súčasťou jej vyšetrenia je EKG-záznam a klinický ortostatický test. Základom diagnostiky KAN sú štandardizované kardiovaskulárne testy [18,19]. Predpokladom kvalitne realizovaného vyšetrenia KAN sú v súčasnej dobe telemetrické prístroje slúžiace k počítačovému spracovaniu variability srdcovej frekvence (napr. VariaPulseTF3, VariaCarioTF4). Prístroje vyhodnotia časovú analýzu variability srdcovej frekvencie, tzv. Ewingova batéria (1. test pokojového dýchánia, 2. test hlbokého dýchania, 3. Valsalvov manéver, 4. reakcia na ortostázu a 5. izometrický úchop) a robí sa tiež spektrálna analýza variability srdcovej frekvencie z polohy ľah – stoj – ľah. Z ďalších možností prichádzajú do úvahy radionuklidové metódy (123 I MIBG – myokardiálny SPECT s cieľom stanoviť denzitu noradrenalínových receptorov) a stanovenie hladiny katecholamínov.
V diagnostike gastrointestinálnej autonómnej neuropatie využívame vyšetrenie pasáže gastrointestinálnym traktom a fibroskopické techniky. Osobitné endoskopické vybavenie umožňuje kombinovať manometriu a registráciu mechanogramu a EMG-signálu v jednotlivých častiach gastrointestinálneho traktu. Osobitnou technikou je povrchová elektrogastrografia. Patrí sem aj napr. vyšetrenie rýchlosti žalúdočného vyprázdňovania scintigrafickou metódou.
Diagnostika urogenitálnej autonómnej neuropatie zahŕňa urodynamické vyšetrenie a viaceré ultrazvukové techniky. Stanovenie príčiny erektilnej dysfunkcie môže byť zložité s určením podielu psychologickej zložky, toxických alebo endokrinných faktorov a prípadného poškodenia cievneho alebo nervového systému. Pomocný môže byť test na intrakavernóznu aplikáciu PGE1.
Presná diagnostika sudomotorickej autonómnej neuropatie vyžaduje vysoko sofistikované zariadenia (napr. QSART – quantitative sudomotor axon reflex test, TST – thermoregulatory sweat test). K posúdeniu sudomotorickej funkcie možno použiť aj snímanie kožných potenciálov na EMG (SSR – skin sympathetic response).
V klinickej praxi postačujú aj farebné kožné testy (sweat imprints), pri ktorých sa mení farba v závislosti na množstve vylúčeného potu alebo kožná náplasť Neuropad, ktorá sa prikladá na planty oboch nôh, pričom pri poruche funkcie nedôjde k zmene farby [20]. Pri meraniu elektrického odporu kože (napr. prístrojom EZSCAN) využívame princíp závislosti kožného odporu od aktivity potných a mazových žliaz, ktorá je diabetickej neuropatii znížená.
V diagnostike pupilárnej autonómnej neuropatie postačuje klinické vyšetrenie pupilárneho reflexu. Užitočné môžu byť niekedy aj klasické farmakologické testy podľa Foerster-Gagelovej schémy. Vyšetrenie latencie pupilárneho reflexu vyžaduje osobitné technické vybavenie (infračervená reflexná pupilografia).
Biopsia nervu a kože
Biopsia n. suralis môže pomôcť stanoviť podiel demyelinizačnej a axonálnej zložky poškodenia. Osobitne dôležité je posúdenie prítomnosti zápalového mononukleárneho infiltrátu alebo prítomnosti vaskulitídy v prípadoch, keď predpokladáme zásadný podiel imunopatologických mechanizmov v genéze neuropatie. Biopsia nervu môže detekovať poškodenie nemyelinizovaných vlákien, pokiaľ sú ešte myelinizované vlákna intaktné. Je to však invazívna metóda, ktorá nie je vhodná pre rutinnú klinickú prax [21].
Biopsia kože zásadne rieši problematiku diagnostiky tzv. neuropatie tenkých vlákien (small fiber neuropathy). Ide o minimálne invazívnu techniku – punkčnú biopsiu s odberom malej časti kože (do priemeru 3 mm) v oblasti nad členkom s následným imunohistochemickým stanovením hustoty intraepidermálnych senzitívnych nemyelinizovaných vlákien, ktorá je pri tejto neuropatii znížená [22,23].
Korneálna konfokálna mikroskopia
Korneálna konfokálna mikroskopia je neinvazívna oftalmologická technika používaná na detekciu neuropatie tenkých vlákien. Redukcia tenkých nervových vlákien v rohovke koreluje s redukciou intraepidermálnych nervových vlákien pri kožnej biopsii a so stupňom neuropatie u diabetikov [24,25].
Stanovenie diagnózy
Diagnózu klinickej neuropatie môžeme stanoviť vtedy, ak sú prítomné EMG-abnormity typické pre neuropatiu a klinické symptómy alebo príznaky neuropatie. V prípade normálneho EMG-nálezu je nutný dôkaz poruchy funkcie tenkých vlákien.
Diagnóza subklinickej neuropatie je stanovená vtedy, ak nie sú prítomné symptómy a klinické príznaky neuropatie, ale sú prítomné abnormity v EMG-náleze alebo (v prípade normálneho EMG-náleze) je dokázaná porucha funkcie tenkých vlákien.
Diagnóza neuropatie tenkých vlákien predpokladá výskyt klinických príznakov neuropatie tenkých vlákien (neuropatická bolesť), normálny EMG-nález a patologický nález pri kožnej biopsii alebo poruchu termickej citlivosti na chodidlách [26].
Liečba diabetickej neuropatie
Kauzálna liečba
Podstatou kauzálnej liečby je dobrá metabolická kompenzácia DM, ktorá vedie k oddialeniu vzniku a progresie diabetickej neuropatie [27].
Schéma 1. Liečba diabetickej neuropatie 
Patogenetická liečba
Jedná sa o liečbu, ktorá určitým spôsobom zasahuje do patogenézy diabetickej neuropatie a niektorí autori ju označujú ako ochorenie modifikujúcu liečbu [28]. V súčasnej dobe považujeme za takúto liečbu, potvrdenú aj recentnými klinickými štúdiami, liečbu kyselinou alfa-lipoovou, benfotiamínom a aktovegínom [29]. Účinnosť liečby kyselinou alfa-lipoovou bola potvrdená viacerými veľkými klinickými štúdiami intravenózne v dávke 600 mg/deň a perorálne v dávkach 600–1 800 mg/deň [29,30,31]. Klinická účinnosť benfotiamínu bola potvrdená v dávke 300 mg/deň [32] a aktovegínu v dávke 2 000 mg/deň intravenózne a 1 800 mg/deň perorálne [33]. Mechanizmus účinku všetkých uvedených liekov je veľmi komplexný, v prípade kyseliny alfa-lipoovej a aktovegínu je dominantný antioxidačný účinok.
Symptomatická liečba
Symptomatická liečba prejavov autonomnej neuropatie je v rukách príslušného špecialistu (kardiológ, gastroenterológ, urológ atď). Aj v tomto prípade platí, že základom liečby je dobrá metabolická kompenzácia DM a patogenetická liečba.
Symptomatická liečba bolesti je v kompetencii neurológa a prípadne algeziológa.
Predpokladá sa, že neuropatická bolesť je poddiagnostikovaná a veľká časť pacientov nemá liečbu na neuropatickú bolesť [34].
Schéma 2. Symptomatická liečba bolestivej formy diabetickej neuropatie 
Nesteroidné antiflogistiká a bežné analgetiká sú v tejto indikácii nedostatočne účinné. Potvrdenú účinnosť má tramadol, avšak pre návykovosť a navodenie tolerancie je vhodný len na krátkodobé užívanie. Liekmi voľby su vybrané antikonvulzíva a antidepresíva.
Zásadne uprednostňujeme monoterapiu. Z antidepresív máme na výber staršie tricyklické antidepresíva (TCA), ako je amitriptylin alebo novšie antidepresíva z rady inhibítorov spätného vychytávania serotonínu a noradrenalínu (SNRI). Konkrétny výber lieku závisí od pridruženej komorbidity, nežiadúcich účinkov liečby a potenciálnych liekových interakcií. Pokiaľ nie je monoterapia v plnej terapeutickej dávke a počas minimálne mesačnej liečby dostatočne účinná, môžeme zameniť liek alebo zvoliť kombinovanú terapiu.
Antidepresíva pôsobia na bolesť inhibíciou noradrenalínového a serotonínového reuptake na synapsách centrálnej descendentnej dráhy kontroly bolesti a antagonistickým pôsobením na NMDA-receptoroch. Tricyklické antidepresíva sa stále považujú za vysoko účinné v liečbe neuropatickej bolesti, avšak ich použitie je limitované nežiadúcimi účinkami hlavne u starších pacientov a v skupine pacientov s autonómnou neuropatiou. Amitriptylín sa používa v dávke 25–100 mg denne [35]. Z okruhu antidepresív typu SNRI bola potvrdená účinnosť a bezpečnosť duloxetínu v dávke 60–120 mg/deň [36].
Z antikonvulzív sa používa gabapentín a pregabalín, ktoré sú štrukturálne podobné gamaaminomaslovej kyseline – neurotransmiteru, ktorý hrá dôležitú úlohu v modulácii bolesti. Gabapentín je účinný v dávke 900–3 600 mg/deň [36] a pregabalín sa používa v dávke 300–600 mg/deň [37].
Kapsaicín je alkoloid z chilli papričiek, ktorý má lokálny anestetický účinok a v liečbe neuropatickej bolesti sa používa vo forme 0,075% krému [38]. Naopak 8% kapsaicínová náplasť je v prípade diabetickej neuropatickej bolesti kontraindikovaná, lebo zapríčiňuje desenzitizáciu nociceptívnych nervových zakončení, ktorá môže zvýšiť riziko diabetických ulcerácií.
MUDr. Milan Grofik
milangrofik@gmail.com
prof. MUDr. Egon Kurča, PhD.
Neurologická klinika JLF UK a UNM, Martin
www.unm.sk
Doručené do redakcie 22. apríla 2013
Prijaté do tlače po recenzii 23. mája 2013
Sources
1. Boulton AJ, Vinik AI, Arezzo JC et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care 2005; 28(4): 956–962.
2. Dyck PJ, Melton LJ, O´Brien PC et al. Approaches to improve epidemiological studies of diabetic neuropathy. Diabetes 1997; 46(S2): S5-S8.
3. Centers for Disease Control and Prevention. National diabetes fact sheet: general information and national estimates on diabetes in the United States, 2003. Rev ed. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention 2004. Dostupné z WWW: <http://www.cdc.gov/diabetes>.
4. Tesfaye S. Diabetic neuropathy. In: Wass JAH et al. Oxford Textbook of Endokrinology and Diabetes 2002 : 1789–1798.
5. Callaghan BC, Hur J, Feldman EL. Diabetic neuropathy. Curr Opin Neurol 2012; 25(5): 536–541.
6. Centers for Disease Control and Prevention. National diabetes fact sheet: national estimates and general information on diabetes and prediabetes in the United States, 2011. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention 2011. Dostupné z WWW: <http://www.cdc.gov/diabetes>.
7. Shakher J, Stevens MJ. Update on the management of diabetic polyneuropathies. Diabetes, Metabolic Syndrome and Obesity. Targes and Therapy 2011. Diabetes Metab Syndr Obes 2011; 4 : 289–305.
8. Papanas N, Ziegler D. Prediabetic Neuropathy: Does It Exist? Curr Diab Rep 2012; 12(4): 376–383.
9. Daousi C, Benbow SJ, Woodward A et al. The natural history of chronic painful peripheral neuropathy in a community diabetes population. Diabet Med 2006; 23(9): 1021–1024.
10. Davies M, Brophy S, Williams R et al. The prevalence, severity, and impact of painful diabetic peripheral neuropathy in type 2 diabetes. Diabetes Care 2006; 29(7): 1518–1522.
11. Ziegler D, Rathmann W, Dickhaus T (eds) et al. KORA Study Group. Neuropathic pain in diabetes, pre-diabetes and normal glucose tolerance:the MONICA/KORA Augsburg Surveys S2 and S3. Pain Med 2009; 10(2): 393–400.
12. Ziegler D, Rathmann W, Meisinger C(eds) et al. KORA Study Group. Prevalence and risk factors of neuropathic pain in survivors of myocardial infarction with pre-diabetes and diabetes. The KORA myocardial infarction registry. Eur J Pain 2009; 13(6):582–587.
13. Daousi C, MacFarlane IA, Woodward A et al. Chronic painful peripheral neuropathy in an urban community: a controlles comparison of people with and without diabetes. Diabetic Medicine 2004; 21(9): 976–982.
14. Treede RD, Jensen TS, Campbell JN et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology 2008; 70(18): 1630–1635.
15. Tentolouris N, Marinou K, Kokotis P et al. Sudomotor dysfunction is associated with foot ulceration in diabetes. Diabet Med 2009; 26(3): 302–305.
16. Mokáň M. Fenomén neuvedomovania si hypoglykémie. In: Krahulec B. Diabetická polyneuropatia II. Arimes, Bratislava 2002 : 120–131.
17. Abbott CA, Vileikyte L, Williamson S et al. Multicenter study of the incidence of and predictive risk factors for diabetic neuropathic foot ulceration. Diabetes Care 1998; 21(7): 1071–1075.
18. Opavský J. Autonomní nervový systém a diabetická autonomní neuropatie. Klinické aspekty a diagnostika. Galén: Praha 2002. ISBN 8072621947.
19. Rušavý Z et al. Diagnostika a klasifikace diabetické neuropatie. In: Diabetická neuropatie. Konsensuální konference. Žinkovy, 20.–22. března 1997. Galén: Praha 1998. ISBN 8085824728.
20. Papanas N, Papatheodorou K, Christakidis D et al. Evaluation of a new indicator test for sudomotor function (Neuropad) in the diagnosis of peripheral neuropathy in type 2 diabetic patients. Exp Clin Endocrinol Diabetes 2005; 113(4): 195–198.
21. Malik RA, Tesfaye S, Newrick PG et al. Sural nerve pathology in diabetic patients with minimal but progressive neuropathy. Diabetologia 2005; 48(3): 578–585.
22. Lauria G, Hsieh ST, Johansson O et al. European Federation of Neurological Societies; Peripheral Nerve Society. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on the use of skin biopsy in the diagnosis of small fiber neuropathy. Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society. Eur J Neurol 2010; 17(7): 356–363.
23. Lauria G, Bakkers M, Schmitz C et al. Intraepidermal nerve fiber density at the distal leg: a worldwide normative reference study. J Peripher Nerv Syst 2010; 15(3): 202–207.
24. Quattrini C, Tavakoli M, Jeziorska M et al. Surrogate markers of small fiber damage in human diabetic neuropathy. Diabetes 2007; 56(8): 2148–2154.
25. Tavakoli M, Quattrini C, Abbott C et al. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy. Diabetes Care 2010; 33(8): 1792–1797.
26. Tesfaye S, Boulton AJ, Dyck PJ et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care 2010; 33(10): 2285–2293.
27. Ziegler D. Current Concepts in the Management of Diabetic Polyneuropathy. Curr Diabetes Rev 2011; 7(3): 208–220.
28. Shakher J, Stevens MJ. Update on the management of diabetic polyneuropathies. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy 2011; 4 : 289–305.
29. Ziegler D, Nowak H, Kempler P et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpa-lipoic acid: a meta-analysis. Diabet Med 2004; 21(4): 114–121.
30. Ziegler D, Ametov A, Barinov A et al. Oral treatment with alphalipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care 2006; 29(11): 2365–2370.
31. Ziegler D, Hanefeld M, Ruhnau KJ et al. The ALADIN III Study Group. Treatment of Symptomatic Diabetic Polyneuropathy with the Antioxidant alfa-Lipoic Acid. Diabetes Care 1999; 22(8): 1296–1301.
32. Stracke H, Gaus W, Achenbach U et al. Benfotiamine in diabetic polyneuropathy (BENDIP): results of a randomised, double blind, placebo-controlled clinical study. Exp Clin Endocrinol Diabetes 2008; 116(10): 600–605.
33. Ziegler D, Movsesyan L, Mankovsky B et al. Treatment of symptomatic polyneuropathy with actovegin in type 2 diabetic patients. Diabetes Care 2009; 32(8): 1479–1484.
34. Daousi C, Benbow SJ, Woodward A et al. The natural history of chronic painful peripheral neuropathy in a community diabetes population. Diabet Med 2006; 23(9): 1021–1024.
35. Finnerup NB, Sindrup SH, Jensen TS. The evidence for pharmacological treatment of neuropathic pain. Pain 2010; 150(3): 573–581.
36. Kajdasz DK, Iyengar S, Desaiah D et al. Duloxetine for the management of diabetic peripheral neuropathic pain: evidence-based findings from post hoc analysis of three multicenter, randomized, double-blind, placebo-controlled, parallel-group studies. Clin Ther 2007; 29(Suppl): 2536–2546.
37. Freeman R, Durso-Decruz E, Emir B. Efficacy, safety, and tolerability of pregabalin treatment for painful diabetic peripheral neuropathy: findings from seven randomized, controlled trials across a range of doses. Diabetes Care 2008; 31(7): 1448–1454.
38. Mason L, Moore RA, Derry S et al. Systematic review of topical capsaicin for the treatment of chronic pain. BMJ 2004; 328(7446): 991–995.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2013 Issue 2-
All articles in this issue
- Dermoepidermálne štepy v liečbe chronických defektov diabetickej nohy: kazuistika
- Syndrom diabetické nohy: nezávislý prediktor kardiovaskulární a cerebrovaskulární morbidity a mortality?
- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Diabetická nefropatia: epidemiológia a diagnostika
- „Ušitie inzulínovej liečby na mieru pacientovi“: kazuistika
- Léčba hypertenze u pacientů s diabetes mellitus 2. typu
- Diabetická noha: epidemiologické údaje a aktuálne možnosti lokálnej liečby
- Patofyziologické aspekty syndrómu diabetickej nohy
- Rádiointervenčná diagnostika a terapia diabetickej nohy
- Aktuálne indikačné obmedzenia pre gliptíny, agonisty GLP1-receptorov a bazálne analógy inzulínu
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Diabetická nefropatia: epidemiológia a diagnostika
- Patofyziologické aspekty syndrómu diabetickej nohy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

