-
Medical journals
- Career
Diagnostika melanomu a současná doporučení pro léčbu a sledování
Authors: I. Krajsová
Authors‘ workplace: Dermatovenerologická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. Jiří Štork, CSc.
Published in: Čes-slov Derm, 93, 2018, No. 1, p. 4-16
Category: Reviews (Continuing Medical Education)
Základem účinné léčby melanomu je jeho včasné rozpoznání a chirurgické odstranění. V případech pokročilých melanomů s vysokým rizikem metastazování, je nutné uvažovat o adjuvantní terapii, která by dokázala progresi zcela zabránit nebo jí alespoň oddálit. Léčebné postupy účinné v terapii metastazujícího melanomu prokázaly podle nejnovějších výsledků klinických studií účinnost i v adjuvantním podávání. Základem současné léčby metastazujícího melanomu je imunoterapie zaměřená na kontrolní body imunity CTLA-4 a PD-1 a cílená léčba u BRAF V600 pozitivních nádorů.
Overview
Základem účinné léčby melanomu je jeho včasné rozpoznání a chirurgické odstranění. V případech pokročilých melanomů s vysokým rizikem metastazování, je nutné uvažovat o adjuvantní terapii, která by dokázala progresi zcela zabránit nebo jí alespoň oddálit. Léčebné postupy účinné v terapii metastazujícího melanomu prokázaly podle nejnovějších výsledků klinických studií účinnost i v adjuvantním podávání. Základem současné léčby metastazujícího melanomu je imunoterapie zaměřená na kontrolní body imunity CTLA-4 a PD-1 a cílená léčba u BRAF V600 pozitivních nádorů. Obě léčebné metody prokazují proti chemoterapii významné zvýšení léčebných odpovědí, prodloužení doby do relapsu (PFS) i prodloužení celkové doby přežití (OS). Jedná se o odborně i finančně náročnou terapii, která je soustředěna do několika specializovaných center. Péče o pacienty s pokročilým melanomem by měla být primárně směrována na tato pracoviště, protože jen tam mají nemocní šanci na včasný záchyt relapsu onemocnění a na zahájení nejvhodnější a nejúčinnější léčby.
Klíčová slova:
melanom – diagnostika – adjuvantní léčba – cílená léčba – imunoterapie – sledování
ÚVOD
Metastazující melanom patří mezi nádory, jejichž léčba doznala v posledních 5 letech významných změn. U původně téměř neléčitelného onemocnění s mediánem přežití na úrovni 6–9 měsíců došlo díky novým léčebným postupům k neuvěřitelnému zlepšení prognózy nemocných. Objev významných řídicích onkogenních mutací vedl k zavedení cílené léčby s využitím kinázových inhibitorů a lepší pochopení role imunitního systému při kontrole a rozvoji maligních nádorů umožnilo vývoj nových imunoterapeutických postupů, jejímiž hlavními představiteli jsou monoklonální protilátky proti kontrolním bodům imunity. Pacientům tak můžeme nabídnout několik nových léčebných postupů, které vyvolávají dlouhodobé léčebné odpovědi a prodlužují celkové přežívání (OS, overall survival). To vše při velmi dobré kvalitě života, protože i když jsou nežádoucí účinky relativně časté a pestré, jsou již dostatečně známé a dobře zvládnutelné. Díky těmto zcela novým a jedinečným léčebným postupům, s dosud u melanomu nevídanou účinností, se hovoří o tom, že právě vstupujeme do zlaté éry léčby metastazujícího melanomu.
INCIDENCE A EPIDEMIOLOGIE
Melanom patří mezi nádory, které provází lidstvo od samých počátků, ale díky své kdysi velmi nízké incidenci zůstával na okraji zájmu. Teprve v posledních desetiletích nastal závratný vzestup incidence, který podpořil výzkum základních etiologických faktorů i odkrytí jeho biologické podstaty. Melanom se vyvíjí z melanocytů, které v průběhu časného vývoje putují z neurální lišty do kůže, sliznic, mening i oka. Procházejí měkkými tkáněmi, vnitřními orgány i aponeurózami šlach, což je příčinou, že sice vzácně, ale přesto může vzniknout primární melanom i mimo kůži. Základní podmínkou pro jeho vznik jsou samotné melanocyty, ne melanogeneze (samotný proces syntézy melaninu), což dokazuje například rozvoj melanomu u albínů [30]. Od padesátých let minulého století můžeme pozorovat trvalý vzestup incidence všech kožních nádorů včetně melanomu. Příčiny jsou jednoznačně spojeny s expozicí kůže slunečnímu záření, ale důležitou roli hrají též kožní fototyp, genetická dispozice a další dosud ne zcela objasněné vlivy. Melanom je významně častější nádor u bělochů, kteří mají životní riziko vzniku melanomu cca 2,4 %, zatímco hispánci pouze 0,5 % a černoši 0,1 %. Typickým jedincem s vysokým rizikem vzniku melanomu je člověk se světlou kůží a mnohočetnými melanocytárními névy, který se v průběhu života opakovaně spálil na slunci nebo často docházel do solárií. Dalším významnými etiologickými faktory je intermitentní a intenzivní nárazové slunění a také spálení kůže v dětství. Melanom postihuje obě pohlaví stejně, ale v posledních letech, se zvyšující se incidencí, je pozorován trend k mírně vyššímu výskytu u mužů. V ČR se incidence melanomu v posledních desetiletích významně zvýšila, z 5,5/100 tisíc obyvatel v roce 1982 na 24,5/100 000 v roce 2015. Při přepočtu na světový standard to bylo 13,7/100 000. Naproti tomu mortalita vykazuje pouze mírný vzestup z 2,5 na 4,2/100 000. Jedním z důvodů může být zlepšení diagnostiky časných melanomů. Některé epidemiologické studie ukazují, že nejvíce stoupá záchyt zcela počínajících melanomů in situ s ročním nárůstem 9,5 %, což je disproporční k záchytu ostatních klinických typů melanomu, u kterých dochází ke zvýšení pouze o 2,5 % [9].
KLINICKÁ DIAGNOSTIKA MELANOMU
Základem účinné léčby melanomu je jeho včasné rozpoznání a následné odstranění. Základem je tak vyšetřování celého kožního povrchu vždy při dostatečném osvětlení. Vodítkem pro stanovení diagnózy je dobře známý akronym ABCDE označující nejvýraznější charakteristiky počínajícího melanomu, tedy asymetrii tvaru (Asymetry), nepravidelnost okrajů (Border), skvrnitou pigmentaci (Color), velikost přesahující 5–6 mm (Diameter) a trvalé zvětšování či vývoj ložiska (Enlargement, Evolution). Vzhledem k tomu, že zpřesnění klinické i histopatologické diagnostiky vede ke stále častějšímu záchytu i melanomů menších než 5 mm, objevují se návrhy na ABCD akronym, ve kterém by D již neznamenalo Diameter, ale Dynamics. Označovalo by to charakteristický trvalý vývoj ať již ve zbarvení nebo velikosti melanomu, a nahradilo tak původně přidané E. Řada melanomů ale nesplňuje ABC ukazatele, a proto je nejdůležitějším vodítkem změna, zejména u nodulárních či amelanotických lézí [4]. Naproti tomu ABC rysy bez jakékoliv dynamiky vývoje ukazují spíše na benigní povahu ložiska a jsou typické například u dysplastických névů. Za podezřelé je nutné považovat všechny léze, které se výrazně odlišují od ostatních pacientových projevů (ošklivé káčátko) – obrázek 1. Samozřejmostí je také indikace k excizi všech rychle rostoucích a ulcerovaných útvarů, zejména v případě suspektních nodulárních melanomů. Ne vždy je ale melanom pouhým klinickým vyšetřením dobře rozpoznatelný. Přínosné je potom pro včasné rozpoznání melanomu vyšetření dermatoskopem, což je technika vyvinutá už v padesátých letech minulého století s cílem usnadnit klinickou diagnostiku pigmentových projevů, která byla přijata většinou dermatologů. Umožňuje vizualizaci rysů typických pro melanom, jenž nejsou patrné pouhým okem. V rukou zkušených a vyškolených odborníků výrazně zvyšuje přesnost diagnostiky proti běžnému vyšetření pouhým pohledem. Postupně je nahrazována digitální dermatoskopií, která kromě zlepšení diagnostiky umožňuje též sledování pigmentových projevů v čase, čímž dokáže zabránit zbytečným excizím benigních lézí. Je nutné ale vědět, že nikdy není indikováno sledování projevů, které svým vzhledem odpovídají počínajícímu melanomu, v těchto případech je vždy indikována excize s histologickým ověřením diagnózy. Digitální dermatoskopie znamená také velký přínos pro telemedicínu, umožňuje díky digitalizaci obrazu konzultovat obtížné a nejasné případy s mnoha odborníky bez nutnosti osobní přítomnosti pacienta [32].
Image 1. Melanom – většinou se liší od okolních névů 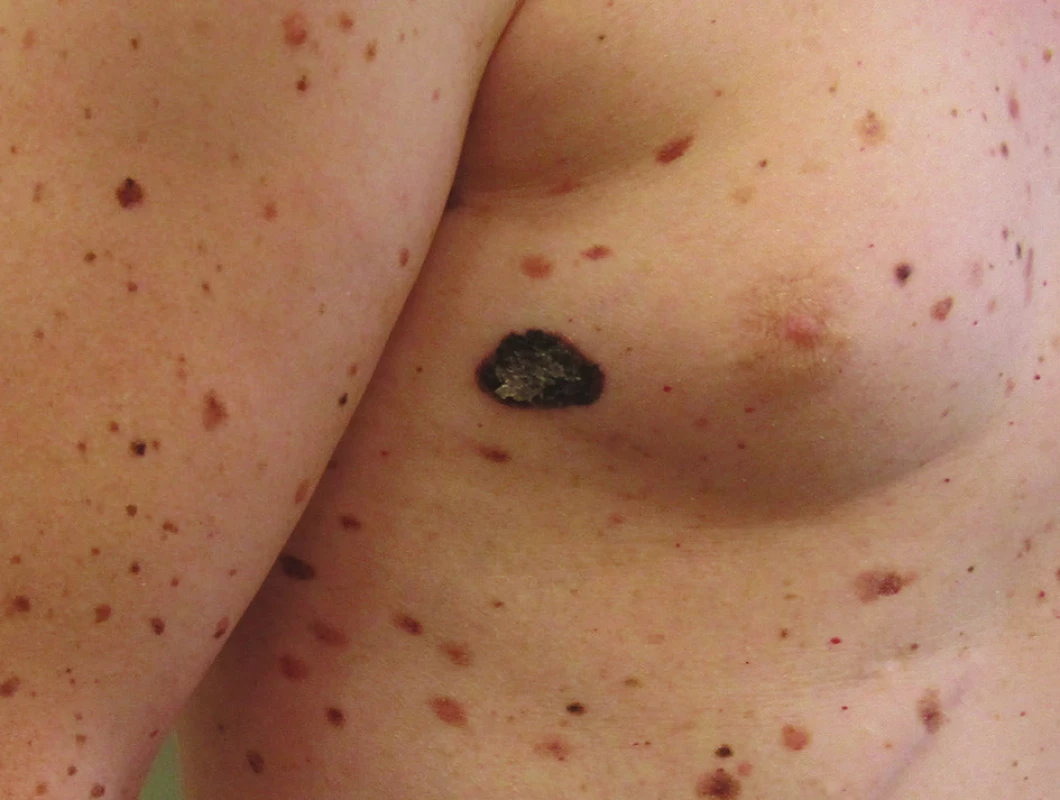
HISTOLOGICKÁ DIAGNOSTIKA MELANOMU
Každé podezření na melanom by mělo být indikaci k chirurgickému odstranění a histologické verifikaci, která je pro stanovení diagnózy zásadní. Histologický obraz se liší podle jednotlivých typů melanomu, existují ale též obecné společné rysy svědčící pro maligní povahu melanocytární léze. Patří mezi ně asymetrie obrysů i uspořádání léze a její neostré ohraničení nebo tvorba nepravidelných různě velkých, často i splývajících hnízd nádorových buněk. Typické je také šíření melanocytů v epidermis i do vyšších vrstev, a na rozdíl od benigních melanocytárních névů, ztráta jejich vyzrávání směrem do hlubších vrstev léze. Typický je též buněčný a jaderný pleiomorfismus a možná přítomnost mitóz v hlubších oblastech nádoru. Histologické zhodnocení melanomu by mělo kromě morfologického popisu zahrnovat minimálně všechny požadavky AJCC klasifikace (American Joint Committee on Cancer) uvedené v tabulce 1.
Table 1. Základní požadavky při histologickém vyšetření primárního melanomu 
Od roku 2018 bude platná nová již 8. verze AJCC klasifikace melanomu přinášející několik změn. V T klasifikaci primárního nádoru zahrnuje T1 kategorie bez další specifikace melanomy tloušťky ≤ 1,0 mm, jenž nemají uveden údaj o ulceraci. Dále se rozděluje na kategorie T1a, do které spadají melanomy s tloušťkou < 0,8 mm bez ulcerace. A kategorie T1b nově zahrnuje dvě podskupiny“:
- melanomy < 0,8 mm s ulcerací,
- melanomy s tloušťkou 0,8–1,0 mm s ulcerací či bez ulcerace.
Ostatní T kategorie se nemění. Nově se též v 8. verzi AJCC při stanovení T kategorií již nehodnotí mitózy, nicméně je doporučováno, aby byl jejich počet uveden v histologickém popisu i nadále. Je to významný parametr využitelný při zpracovávání různých prognostických modelů a mitotická aktivita označuje nemocné s vysokým rizikem postižení sentinelových uzlin [11]. Při histologickém hodnocení melanomu je přínosné též uvedení odpovídající klinické varianty melanomu.
Klinické a histopatologické varianty melanomu
Superficiálně se šířící melanom (SSM) je nejčastější varianta s převažující horizontální fází růstu, která představuje asi 70 % všech melanomů. Má také velmi typický klinický obraz, odpovídající obecné představě, kterou si laici i odborníci při slově melanom vybaví. Ve většině případů splňuje všechna ABCDE kritéria včetně trvalého zvětšování. Pokud se včas neodstraní, přechází v pokročilejší variantu sekundárně nodulárního SSM se všemi atributy agresivního chování (obr. 2). Roste převážně na místech intermitentně vystavených slunečnímu záření, jako jsou trup či dolní končetiny, spíše u jedinců mladšího a středního věku.
Image 2. Superficiálně se šířící melanom 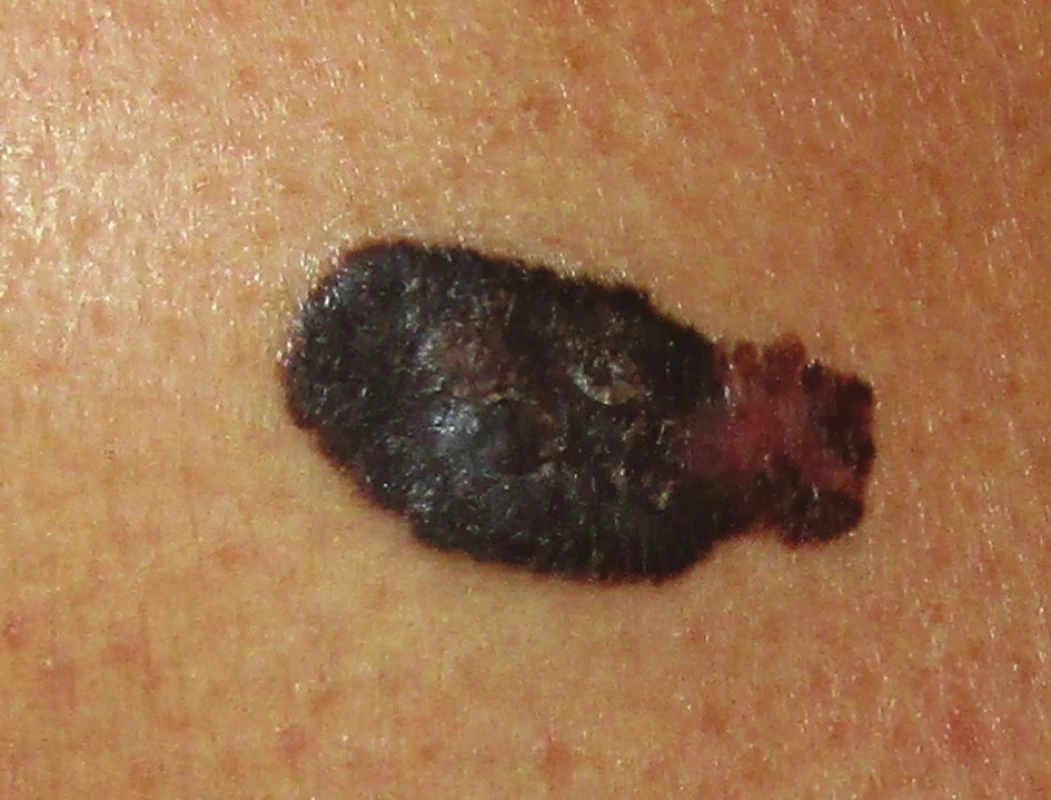
Nodulární melanom (NM) je druhou nejčastější variantou, tvořící asi 15 % melanomů. Představuje velmi závažnou formu nádoru s vysokou tendencí k metastazování. Současně způsobuje časté diagnostické potíže, protože obvykle nesplňuje ABCD kritéria, bývá často málo pigmentovaný či amelanotický a brzy se na jeho povrchu objevuje ulcerace a krvácení. Postihuje spíše starší jedince a bývá nepatrně častější u mužů.
Lentigo maligna melanom LMM, tvořící 10–15 % melanomů, začíná jako plošné ložisko melanoma in situ označované lentigo maligna (LM), dalšími synonymy jsou Hutchinson’s freckle nebo melanosis praecancerosa circumscripta Dubreiulh. Objevuje se zejména na obličeji a krku, na místech chronicky vystavených slunečnímu záření, častější je u starších jedinců. Má sklon k pomalému plošnému šíření a může někdy postihovat rozsáhlé partie obličeje. Při dlouhodobém zvětšování dochází u určité části nemocných k vertikálnímu růstu, s přechodem v plně vyvinutý, pokročilý a agresivní melanom.
Akrolentiginózní melanom (ALM) představuje u bělochů pouze 1–3 % všech melanomů, je ale nejčastější variantou melanomu u jedinců žluté a černé rasy. Má typickou lokalizaci na ploskách, dlaních a oblastech nehtů (obr. 3). Etiologie tohoto typu melanomu není příliš jasná, souvislost s UV zářením se nepředpokládá.
Table 2. Akrolentiginózní melanom 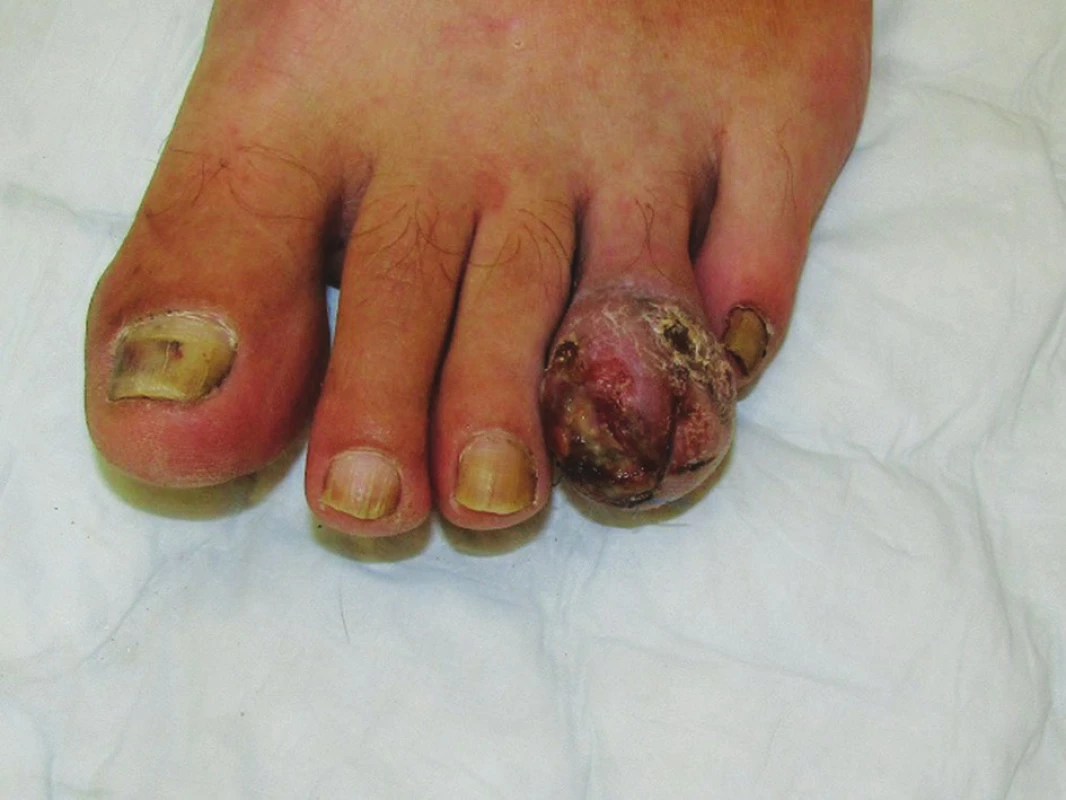
Řadu dalších vzácnějších variant, např. desmoplastický melanom (DM), névoidní melanom, melanom v modrém névu, animální typ melanomu či melanom z balonových buněk, odkryje většinou až histologické vyšetření. Tyto atypické melanomy však představují maximálně 5 % nádorů.
Onkogenní mutace u melanomu
Rozdělení melanomů podle zastoupení onkogenních mutací je další možností podrobnější specifikace jednotlivých typů melanomu. Aktivační mutace onkogenů BRAF a NRAS vedou k trvalé signalizaci MAPK (mitogen activated protein kinase) signální dráhy provázené proliferací nádorových buněk a progresí onemocnění. Mutace genu BRAF bývá detekována přibližně u 40–50 % melanomů a NRAS mutace asi u 20 % nádorů. Nejčastěji jsou prokazovány u superficiálně se šířících melanomů a u primárně nodulárních forem. Současná detekce obou mutací v jednom nádoru je velmi vzácná a bývá popisována pouze asi u 2 % melanomů. Za třetí nejčastější je považována mutace cKIT, které provází zejména slizniční a akrolentiginózní melanomy, ale její záchyt je v evropských zemích poměrně malý. Podle zastoupení jednotlivých mutací pak hovoříme o BRAF, NRAS či cKIT pozitivních melanomech. Prognostický význam těchto mutací pro průběh onemocnění v různých vývojových fázích nebo jejich schopnost ovlivnit biologické vlastnosti melanomu nebyla zatím jednoznačně objasněna. Některé práce naznačují, že NRAS mutace vyvolává vyšší agresivitu melanomu, zejména v časných stadiích onemocnění u vysoce rizikových nádorů, zatímco BRAF mutace se projevuje spíše v pozdější fázi a podílí se na závažnějším průběhu metastatického onemocnění proti nádorům s negativní BRAF mutací (BRAF WT, BRAF wild type) [13]. V práci profesorky Long byl například prokázán medián přežití u metastazujícího BRAF pozitivního melanomu, který nebyl léčen BRAF inhibitory, pouze 5,7 měsíců, zatímco pacienti s BRAF WT přežívali 8,5 měsíců [21].
Průběh onemocnění u melanomů s pozitivní BRAF mutaci je již možné terapeuticky ovlivnit, a proto se i její testování stává součástí základních vyšetřovacích metod u melanomu. Vyšetření BRAF mutace se v současné době rutinně provádí u metastazujícího a inoperabilního melanomu stadia III a IV a je možné ho zvážit i po operaci vysoce pokročilých melanomů stadia IIC a III B/C indikovaných k adjuvantní léčbě. Její vyšetřování u počínajících či středně pokročilých melanomů s minimálním rizikem progrese není v současné době ani podle ESMO doporučení indikováno. Testování BRAF mutace je možné provádět buď metodou real time PCR pomocí diagnostického kitu cobas® BRAF mutation test, nebo metodou PCR s následnou hybridizací s použitím kitu B-RAF600/601 StripAssay. Testování by měla provádět pouze akreditovaná, dostatečně kvalifikovaná pracoviště. V případě negativity BRAF mutace je možné zvážit vyšetření NRAS či cKIT mutací, což se ale v současné době provádí pouze v rámci klinických studií či výzkumných plánů.
LÉČBA MELANOMU
Léčbu melanomu můžeme rozdělit na základní léčbu primárního nádoru v době stanovení klinické diagnózy, dále na adjuvantní léčbu v případech pokročilých vysoce rizikových nádorů a na terapii metastazujícího melanomu.
Léčba primárního melanomu
Excize je základní léčbou melanomu. V případech jisté klinické diagnózy je indikována radikální excize nádoru, při které se rozsah zajišťovacího lemu pohybuje od 5 mm u melanomů in situ po 20 mm u nádorů s hodnotou Breslowa 2,0 mm a vyšší. Podezřelé nejednoznačné léze mají být excidovány kompletně neradikálně a teprve v případě potvrzení diagnózy melanomu následuje reexcize jizvy s odpovídajícím lemem zdravé tkáně. Konečný chirurgický výkon by měl být proveden nejpozději v odstupu 4–6 týdnů od primární excize. Některé lokalizace, jako je například obličej, plosky či dlaně neumožňují většinou velkou radikalitu, a tak je zde doporučováno dodržení šířky lemu alespoň 10 mm.
U pacientů s melanomy, jejichž tloušťka přesahuje 1 mm (či 0,75 mm v případě přídatných rizikových faktorů jako je ulcerace nebo vysoký mitotický index) bez klinicky hmatných zvětšených regionálních uzlin, se provádí ještě vyšetření sentinelové uzliny (SLN) [1]. Stav sentinelových uzlin je významný prognostický faktor, který informuje přesněji o rozsahu postižení a pomáhá předurčit další průběh onemocnění. Při pozitivitě sentinelových uzlin hovoříme o uzlinových mikrometastázách, bez závislosti na velikosti metastatických ložisek v SLN, zatímco palpovatelné klinicky zvětšené uzliny se označují jako makrometastázy. Vyšetření sentinelové uzliny by mělo být prováděno pouze na specializovaných pracovištích, protože vyžaduje přesné předoperační zhodnocení lymfatického spádu z místa nádoru, správné a kvalifikované chirurgické provedení výkonu, které zajišťuje nalezení všech sentinelových uzlin a následně odborné histologické zhodnocení vysoce zkušeným patologem, který tkáň zpracovává a odečítá podle standardizovaného postupu.
Pozitivita sentinelové uzliny označuje nemocné s vyšším rizikem další progrese a znamená indikaci k následné exenteraci odpovídající lymfatické oblasti. Pouze v případech, kdy byly prokázány jen ojedinělé nádorové buňky, či ložiska menší než 0,2 mm, není exenterace většinou doporučována. Vyšetření sentinelové uzliny s následnou exenterací oddaluje další uzlinový relaps onemocnění, ale nebylo zatím prokázáno, že by prodlužovalo celkové přežití (OS) pacientů. Přesné zhodnocení primárního nádoru a sentinelové uzliny je ale nezbytné pro stanovení stadia onemocnění, které určuje prognózu i případnou následnou léčbu. Také N kategorie doznaly v nové AJCC klasifikaci verze 8 několika změn. Hlavní se týká zejména přesného rozlišení okultního a klinicky detekovatelného uzlinového postižení. Jednotlivá stadia se dělí na 3 podskupiny. N1 (postižení 1 uzliny nebo mikrosatelitní či intranzitní metastázy) se tak rozděluje na N1a – 1 klinicky okultní uzlina, N1b – 1 klinicky detekovatelná uzlina a N1c – bez uzlinového postižení, ale intranzitní metastázy či mikrosatelity. Stejně to platí i ve skupinách N2 (postižení 2–3 uzlin) a N3 (postižení 4 a více uzlin) [11]. Čím více postižených uzlin, tím vyšší riziko další progrese melanomu.
U nádorů s vysokým rizikem další progrese je možné zvážit podávání adjuvantní terapie.
Adjuvantní léčba melanomu
Jak již bylo řečeno, primární léčbou melanomu je včasné chirurgické odstranění nádoru. Tento postup je ale dostatečně účinný pouze v případech, kdy je melanom rozpoznán včas, v době, kdy ještě není schopen metastazovat. Se stoupající pokročilostí primárního nádoru stoupá též významně agresivita nádoru a riziko metastazování. U pokročilých melanomů nelze vyloučit, že ještě před odstraněním nádoru došlo k vycestování nádorových buněk lymfatickým či krevním řečištěm mimo oblast nádoru do regionálních uzlin či vzdálených orgánů. Cílem adjuvantní léčby je pak likvidace těchto zatím nedetekovatelných mikrometastatických ložisek, oddálení relapsu onemocnění a prodloužení celkového přežití.
V historii adjuvantní léčby se zkoušela řada léčebných modalit jako chemoterapie, radioterapie, nespecifická imunoterapie Iscadorem, transfer faktorem, levamizolem a mnoho dalších. Jedinou široce využívanou metodou je od osmdesátých let minulého století adjuvantní aplikace interferonu alfa pro jeho imunomodulační i antiproliferační účinky. Účinnost interferonu alfa (IFN alfa) byla nejprve studována v léčbě metastazujícího melanomu, kde bylo popisováno 10–20 % léčebných odpovědí. Účinek IFN alfa nastupoval později než při použití cytostatik, ale v případě léčebných odpovědí, zejména pak kompletních remisí bylo možné pozorovat dlouhodobý efekt. Léčebný účinek IFN alfa byl prokazatelný zejména u pacientů s poměrně malým rozsahem metastatického postižení a téměř výlučně v případě kožních nebo uzlinových metastáz, zcela vzácně u orgánového postižení. Podávání IFN α v adjuvantní léčbě melanomu nejvíce ovlivnily výsledky studie ECOG 1684, která byla zahájena již v roce 1984 a jako první a v zásadě i jediná prokázala statisticky významné prodloužení celkového přežívání pacientů [16]. Další studie prokazovaly převážně schopnost IFN alfa prodloužit dobu do relapsu onemocnění a jen u malé skupiny nemocných docházelo k prodloužení OS. Nejvyšší účinnost prokazuje IFN alfa u ulcerovaných melanomů [6]. O nejvhodnější dávce i délce podávání IFN alfa nebylo dosud jednoznačně rozhodnuto. V současné době se v řadě zemí od adjuvantního podávání IFN alfa ustupuje i proto, že již byly publikovány příznivé výsledky adjuvantních studií s novými terapeutickými postupy, jako je cílená léčba BRAF a MEK inhibitory či imunoterapie využívající anti CTLA-4 či anti PD-1 protilátky.
Již v roce 2015 prokázala studie EORTC 18071, že ipilimumab významně prodlužuje dobu přežití do relapsu (Relaps free survival, RFS) a následně v roce 2016 bylo potvrzeno, že tento lék dokáže prodloužit dobu přežití bez vzdálených metastáz (distant metastases free survival, DMFS), a dokonce i celkové přežití pacientů po operaci pokročilého vysoce rizikového melanomu stadia III A, B a C [7]. Terapie ipilimumabem však byla provázena relativně vysokou toxicitou, jenž byla způsobena zejména výší zvolené terapeutické dávky 10 mg/kg. V průběhu studie došlo k úmrtí 5 léčených pacientů, a tak se objevily otázky ohledně vhodnosti takto zatěžující léčby v adjuvantním podávání, zejména u nemocných ve stadiu III A. I když byla terapie ipilimumabem na základě výsledků uvedené studie schválena pro adjuvantní podávání, velkou překážkou jejího využití v rutinní praxi byla též vysoká finanční náročnost. Následně se ale objevily výsledky dalších adjuvantních klinických studií s imunoterapií anti PD-1 protilátkami a cílenou léčbou BRAF a MEK inhibitory, tedy s preparáty, které již prokázaly dostatečnou účinnost v léčbě metastatického onemocnění.
Studie Checkmate 238 jednoznačně potvrdila vyšší účinnost nivolumabu proti ipilimumabu v adjuvantní imunoterapii pacientů po operaci melanomů stadií IIC, IIIB a stadia IV po kompletním odstranění případných solitárních orgánových metastáz. Pacienti zařazení do studie byli randomizováni buď na léčbu nivolumabem v dávce 3 mg/kg podávané každé 2 týdny, nebo na ipilimumab v dávce 10 mg/kg každé 3 týdny celkem 4krát a dále každých 12 týdnů. Léčba probíhala po dobu 1 roku nebo do progrese či nezvládnutelné toxicity. Primárním cílem studie bylo hodnocení doby přežití bez relapsu onemocnění. V době prvního hodnocení, při minimálním sledování po dobu 18 měsíců bylo hodnoceno dvanáctiměsíční období bez relapsu, kterého dosáhlo 70,5 % pacientů léčených nivolumabem a 60,8 % nemocných s ipilimumabem. Nivolumab snížil riziko progrese či úmrtí o 35 % proti ipilimumabu (p < 0,001). Současně prokázal nivolumab významně nižší toxicitu, nežádoucí účinky (NÚ) stupně závažnosti 3–4 byly zaznamenány pouze u 14,4 % pacientů, zatímco při terapii ipilimumabem byly popsány u 45,9 % nemocných [33]. Z výsledků studie je zřejmé, že nivolumab díky vyšší účinnosti a nižší toxicitě nahrazuje v adjuvantním podávání ipilimumab i interferon alfa [8].
Také výsledky studie COMBI-AD prokázaly vyšší účinnost kombinované léčby BRAF a MEK inhibitory proti placebu v adjuvantní terapii po resekci pokročilého melanomu stadia III s pozitivní BRAF V600E a BRAF V600K mutací. Jednalo se o dvojitě zaslepenou placebem kontrolovanou studii, ve které byli pacienti randomizováni buď na terapii dabrafenibem v dávce 150 mg 2krát denně společně s trametinibem v dávce 2 mg 1krát denně, nebo na placebo. Léčba byla podávána po dobu 12 měsíců. Primárním cílem studie byla doba přežití bez relapsu a sekundárními cíli celkové přežití, přežití bez vzdálených metastáz a bezpečnost léčby. Při mediánu sledování 2,8 roku bylo odhadované tříleté přežití bez relapsu 58 % u léčených pacientů a 39 % u pacientů s placebem. Riziko úmrtí či relapsu snížila kombinovaná terapie dabrafenibem s trametinibem o 53 % proti kontrolní skupině (p < 0,001). V léčené kohortě pacientů přežívalo 3 roky 86 % pacientů, v neléčené 77 % (p = 0,0006). Bezpečnostní profil kombinované léčby odpovídal dosavadním pozorováním u terapie metastazujícího melanomu a nepřinesl žádnou neočekávanou toxicitu [14]. Výsledky studie COMBI-AD jsou podobné výsledkům studie Checkmate 238 a ukazují podobnou účinnost cílené léčby a imunoterapie v adjuvantním podávání po operaci pokročilého a vysoce rizikového melanomu.
Řada dalších léčebných modalit pro podávání v adjuvanci je stále ještě v oblasti výzkumu a i již ověřené metody nebudou ještě po dlouhou dobu běžné klinické praxi dostupné. Je proto důležité dispenzarizovat všechny nemocné s pokročilými melanomy ve specializovaných centrech, kde mají vyšší šanci na zařazení do klinických studií či na moderní a nově zaváděnou terapii.
Léčba metastazujícího melanomu
Přibližně polovina metastáz vzniká do prvních 5 let po operaci, výjimkou ale nejsou ani pozdní metastázy objevující se v odstupu 10 i více let. Nejčastěji bývají postiženy regionální lymfatické uzliny, kůže, plíce, játra, CNS; metastázy mohou ale vzniknout v kterémkoliv orgánu i v jakémkoliv počtu. Také M kategorie byly v 8. AJCC klasifikaci melanomu mírně změněny. Kategorie M1a nově označuje nemocné s kožními a podkožními metastázami či ložisky ve svalech a neregionálních lymfatických uzlinách. Do M1b patří nemocní s plicními metastázami, s metastázami nebo bez metastáz označovaných jako M1a. Kategorie M1c zahrnuje pacienty s ostatními orgánovými metastázami, mimo CNS, a nově byla přidána kategorie M1d pro pacienty s metastázami v CNS s postižením dalších orgánů nebo bez něj. Každá z těchto skupin se ještě rozděluje na M1a,b,c,d (0) v případech normální hladiny LDH (laktátdehydrogenázy) a M1a,b,c,d (1) u nemocných se zvýšenou hodnotou LDH [11].
Podle lokalizace se metastázy rozdělují na lokoregionální, které jsou v regionálních lymfatických uzlinách nebo v místech mezi jizvou po excizi primárního nádoru a regionální lymfatickou oblastí. Pokud jsou ve vnitřních orgánech, kůži či uzlinách až za odpovídajícím lymfatickým spádem hovoříme o vzdálených metastázách.
Lokální léčba
V léčbě lokoregionálních metastáz se uplatňuje zejména chirurgické řešení či radioterapie, pokud to je technicky možné a pacient nemá současně i vzdálená ložiska. Před zahájením léčby je tak vždy nezbytné provést kompletní staging k určení rozsahu onemocnění, pomocí zobrazovacích vyšetření, jako je rentgen (RTG), sonografie, CT (počítačová tomografie) či PET/CT (pozitronová emisní tomografie). Chirurgicky nebo radioterapií je možné ošetřit také některé solitární orgánové metastázy, zejména pokud jsou lokalizovány v CNS, střevech, játrech či plicích. Radioterapie hraje též nezanedbatelnou roli v paliativní léčbě, přináší výraznou úlevu u bolestivých kostních metastáz, u symptomatických mozkových metastáz či u rozsáhlých inoperabilních uzlinových metastáz.
Z novějších léčebných postupů ukazuje vysokou účinnost v lokální terapii kožních či některých uzlinových metastáz aplikace onkolytických vakcín, které využívají geneticky modifikované viry k cílené lýze nádorových buněk. Největšího pokroku v dosavadním klinickém využití dosáhl talimogene laherparepvec, rekombinantní geneticky upravený HSV-1 (herpes virus 1) exprimující GM-CSF (granulocyte-macrophage colony-stimulating factor). Množí se pouze v nádorových buňkách, a tak například na rozdíl od chemoterapie šetří zdravé nenádorové buňky. Virus vyvolává replikací v nádorových buňkách jejich imunogenní smrt, která odkrývá nádorové antigeny, které mohou následně stimulovat lokální i systémovou imunitní reakci. T-VEC (talimogene laherparepvec) vakcína získala v roce 2015 schválení FDA (Food and Drug Administration) pro léčbu inoperabilního metastazujícího melanomu s injikovatelnými kožními nebo uzlinovými metastázami. Studie prokázaly, že po aplikaci T-VEC vakcíny dochází k regresi ošetřovaných i neošetřovaných lézí, což potvrzuje i systémové působení vakcíny. Léčebné odpovědi se objevují u necelé třetiny nemocných, a proto se pro zesílení účinnosti zkouší kombinace vakcíny s dalšími preparáty jako je ipilimumab nebo pembrolizumab [3].
Systémová léčba metastazujícího melanomu
Systémová léčba metastatického melanomu doznala v posledních 5 letech významných změn. Byly objeveny a do klinické praxe zavedeny nové léčebné postupy, které jednoznačně zlepšují průběh onemocnění. Klasická chemoterapie využívaná v posledních desetiletích zůstává v současné době již pouze pro nemocné, u kterých jsou moderní terapeutické modality z různých důvodů kontraindikovány. Základní léčbu představuje cílená léčba BRAF a MEK inhibitory u BRAF V600 pozitivních nádorů a imunoterapie blokující kontrolní inhibiční body imunitních reakcí, receptory CTLA-4 (cytotoxic T lymfocyte antigen 4) a PD-1 (programme death 1). K rozhodnutí, který z postupů zvolit, je nezbytné vyšetření BRAF mutace. Pro její stanovení je nejvhodnější využít tkáň z metastatického ložiska, primární nádor se doporučuje testovat pouze v případech, kdy nejsou metastázy biopticky dosažitelné [21].
Cílená léčba
Název cílená léčba je odvozen od jejího zaměření na konkrétní cíl, v tomto případě na BRAF mutaci melanomových buněk, kterou je možné identifikovat u 40–50 % melanomů. Nejčastěji bývá prokazována mutace BRAF V600E, přibližně v 80–90 % a dále V600K, asi u 10–20 % nádorů. Zavedení selektivních BRAF V600 inhibitorů (BRAFi) znamenalo zásadní pokrok v léčbě metastazujícího melanomu. Již v prvních studiích prokázaly BRAFi významně vyšší četnost léčebných odpovědí, prodloužení doby do progrese (progression free survival, PFS) i doby celkového přežití (overal survival, OS) proti chemoterapii u BRAF V600 pozitivních melanomů [2]. Bohužel se též prokázalo, že v průběhu této léčby dochází u vysokého počtu nemocných ke vzniku rezistence, která se projevuje často rychlou progresí onemocnění. Její příčiny zatím nebyly jednoznačně odhaleny, za jeden z důvodů se předpokládá aktivace paralelních signálních drah. Jednou z možností, jak oddálit vznik rezistence, je zablokování MAPK signální dráhy na dvou místech najednou, na úrovni BRAF a MEK. Vysokou účinnost prokázaly MEK inhibitory trametinib a cobimetinib, které při společném podávání s BRAF inhibitory dabrafenibem a vemurafenibem dokáží významně zvýšit účinnost cílené léčby [12]. Od roku 2015 uvádějí mezinárodní doporučení jako základní léčbu BRAF V600 pozitivních metastazujících melanomů právě kombinovanou léčbu BRAF a MEK inhibitory. Účinnost kombinované léčby dabrafenibu s trametinibem potvrdily dvě studie fáze 3, COMBI-v a COMBI-d, které hodnotily, jak je kombinovaná léčba schopná oddálit vznik rezistence k monoterapii BRAF inhibitory a prodloužit PFS i OS takto léčených nemocných. Studie COMBI-d porovnávala účinnost kombinace dabrafenibu s trametinibem proti monoterapii dabrafenibem. Její výsledky prokázaly statisticky významné prodloužení PFS u kombinované léčby (poměr rizik [hazard ratio, HR] 0,75, CI95% 0,57–0,99; p = 0,03). I následné prodloužené sledování pacientů potvrdilo přetrvávající a klinicky ještě více významnou účinnost kombinované léčby proti monoterapii. Po dvou letech léčby zůstávalo bez progrese 30 % pacientů na kombinované terapii proti pouhým 16 % u monoterapie. Medián OS byl 25,1 měsíců u kombinované léčby proti 18,7 měsícům u monoterapie a 3 roky přežívalo 44 % pacientů proti 32 % [26]. Podobně vysokou účinnost kombinované terapie dabrafenibu s trametinibem prokázala též studie COMBI-v, ve které byla kontrolní léčbou monoterapie vemurafenibem [27]. Klinickou účinnost další kombinace cílené léčby vemurafinibu s cobimetinibem u metastazujícího BRAF V600 pozitivního melanomu ověřovala studie fáze 3 coBRIM. Opět zde byla patrná významně vyšší četnost léčebných odpovědí u pacientů léčených kombinací – 68 % proti 45 % na monoterapii (p < 0,001) a současně byla potvrzena i vyšší četnost kompletních remisí – 10 % proti 4 %. Medián PFS byl 9,9 měsíců u kombinace, u monoterapie 6,2 měsíců (HR 0,51, p < 0,001) [18]. Konečná aktualizace celkového přežití pacientů ve studii coBRIM byla přednesena na SMR (Society for Melanoma Research) na podzim 2015. Nemocní léčení kombinací vemurafenibu s cobimetinibem měli medián OS 22,3 měsíce proti 17,4 měsícům při monoterapii vemurafenibem (HR 0,70, p = 0,005) [24]. Kombinovaná cílená léčba prokazuje dokonce účinnost i u pacientů s mozkovými metastázami BRAF V600 pozitivního melanomu, tedy u nemocných s prognosticky velmi nepříznivým onemocněním. Jednou ze studií, která se věnovala terapii mozkových metastáz, byla COMBI-MB. Pacienti museli mít metastázy v CNS maximálně velikosti 0,5–4,0 cm a kromě kombinované léčby dabrafenibem a trametinibem byla v průběhu léčby povolena v případě potřeby paliativní radioterapie necílových lézí. Výsledky studie potvrdily účinnost kombinované terapie dabrafenibu s trametinibem u mozkových metastáz BRAF V600 pozitivního melanomu. Intrakraniální odpovědi u nemocných ve skupině A (dosud neléčení pacienti s asymptomatickými BRAF V600E pozitivními metastázami) dosáhly 58 % s mediánem trvání 6,5 měsíců. I když doba trvání léčebných odpovědí byla kratší než u nemocných bez mozkových metastáz, závěry studie naznačují, že kombinovaná léčba BRAF a MEK inhibitory je pro pacienty s BRAF V600 pozitivním melanomem metastazujícím do CNS jednou z účinných léčebných možností [17].
Výsledky řady studií s kombinovanou léčbou BRAF a MEK inhibitory prokázaly, že monoterapie BRAF inhibitory již nemůže být standardní léčbou první linie u metastazujícího BRAF V600 pozitivního melanomu. Nahrazuje ji právě společné podávání BRAF a MEK inhibitorů, dabrafenibu s trametinibem nebo vemurafenibu s cobimetinibem. Kterou z těchto kombinací zvolit je obtížné rozhodnout, protože se neprovádělo nikdy přímé porovnání obou léčebných režimů. Různá nepřímá porovnání výsledků jednotlivých studií ale ukazují, že obě kombinace mají podobnou účinnost. V ČR má však v současné době stále úhradu ZP (zdravotní pojišťovna) pouze monoterapie vemurafenibem či dabrafenibem v první linii léčby inoperabilního BRAF V600 pozitivního metastazujícího melanomu. Výhodou cílené léčby je možnost perorálního podávání, terapie probíhá trvale do progrese, či nezvládnutelné toxicity. Vemurafenib se podává v dávce 2krát 960 mg (2 x 4 tbl) denně, dabrafenib 2krát 150 mg (2 x 2 tbl) denně. Oba BRAF inhibitory se metabolizují převážně játry přes cytochrom P450, hlavními enzymy jsou CYP2C8 and CYP3A4, pacienti proto v průběhu léčby nesmí jíst například grapefruity a je nezbytné věnovat pozornost společnému užívání s některými léky, jejichž seznam je dostupný v informačním letáku v každém balení léku.
Nežádoucí účinky cílené léčby
Stejně jako mají BRAF inhibitory dabrafenib a vemurafenib i jejich kombinace s MEK inhibitory trametinibem a cobimetinibem podobnou léčebnou účinnost, mají i podobnou toxicitu. Častými NÚ pozorovanými u obou preparátů jsou bolesti kloubů a svalů, únava, různé kožní exantémy, tvorba palmárních a plantárních hyperkeratóz, vypadávání či změněná kvalita vlasů, suchá a zhrubělá kůže, únava, zhoršená chuť k jídlu, pestrá řada zažívacích potíží, včetně průjmů či hepatotoxicity. Zvýšenou pozornost je potřeba věnovat také nemocným se srdečním onemocněním, před zahájením léčby BRAF inhibitory musí všichni nemocní podstoupit EKG a ECHO (echokardiografie) vyšetření, za kontraindikaci léčby je považováno NYHA (New York Heart Association) > 2 a QTc interval (Corrected QT Interval) > 500 ms. Velmi vzácně je pozorována oční nebo renální toxicita. Naopak nejčastějším závažným nežádoucím účinkem terapie BRAF inhibitory je růst keratoakantomů a dlaždicobuněčných kožních karcinomů, které bývají popisovány asi u 10–20 % pacientů. Nejsou ale většinou důvodem ukončení léčby, odstraňují se chirurgicky, kryalizací tekutým dusíkem, některé se i spontánně odhojí. Zajímavé je, že jejich tvorba většinou okolo 6.–10. měsíce terapie odeznívá. Vemurafenib a dabrafenib mají ale také odlišné nežádoucí účinky. Pro terapii vemurafenibem je typická fototoxicita vznikající i při nepatrném oslunění. Projevuje se u více než 90 % léčených pacientů, bývá velmi výrazná a mnoho nemocných jí zpočátku podceňuje, takže se i při krátkém pobytu na slunci spálí. Je vyvolávána zejména UVA zářením a pro ochranu před spálením je proto nezbytné používat opalovací přípravky s UVB i s UVA ochranným faktorem. Po ukončení terapie vemurafenibem fotosenzitivita mizí [10]. Pro terapii dabrafenibem jsou naopak typické horečnaté stavy, které u vemurafenibu popisovány nebývají. Příčiny pyrexie nejsou zcela zřejmé, objevuje se většinou brzy po zahájení léčby, medián doby do jejího vzniku se pohybuje okolo 19 dní a medián doby trvání je 9 dní. Vysoké horečky jsou někdy komplikovány třesavkou, zimnicí, hypotenzí nebo dehydratací. Při teplotách nad 38,5 °C se doporučuje léčbu dočasně přerušit a vrátit se k ní, ve stejné nebo snížené dávce, až po ústupu horečky. Ve většině případů je pyrexie zvládnutelná antipyretiky a dostatečnou hydratací, někdy je nutná aplikace kortikoidů. Správná péče o tyto pacienty umožňuje rychlé překonání komplikací a možnost navrácení léčby [25]. Kombinovaná léčba BRAF a MEK inhibitory není překvapivě provázena zvýšenou toxicitou, naopak dochází k méně časté tvorbě keratoakantómů a dlaždicobuněčných karcinomů.
IMUNOTERAPIE
Současná imunoterapie metastazujícího melanomu je založená na inhibici kontrolních bodů imunity, receptorů CTLA-4 a PD-1. Jejich úkolem je za fyziologického stavu tlumit imunitní reakce tak, aby nebyly zbytečně agresivní a nedocházelo ke vzniku autoimunity. Nepříznivým projevem jejich funkce je však možnost vzniku nádorové tolerance, protože utlumený imunitní systém nerozpoznává antigeny nádorových buněk jako cizí, proti kterým by měl reagovat. Zablokování těchto inhibičních receptorů monoklonálními protilátkami potom umožňuje trvalou aktivaci a proliferaci T lymfocytů, provázenou imunitní reakcí proti nádorovým buňkám. Ipilimumab, monoklonální protilátka proti CTLA-4 receptoru, prokázal schopnost prodloužit celkové přežívání nemocných s metastazujícím melanomem při podávání v první i v dalších liniích léčby u nemocných po selhání chemoterapie i po selhání cílené léčby [14]. Jeho účinnost není vázána na stav BRAF mutace. Hlavní nevýhodou terapie ipilimumabem je nízká četnost objektivních léčebných odpovědí (objective response rate, ORR) dosahující pouze 20 %. Nespornou výhodou je naopak dlouhá doba trvání léčebného účinku, která se projevuje nejen u nemocných s částečnou nebo kompletní léčebnou odpovědí, ale i u nemocných, u nichž došlo pouze ke stabilizaci onemocnění (stable disease, SD). Ipilimumab dokázal u pacientů, kteří na léčbu odpověděli, významně prodloužit celkové přežívání, které již dosahuje u některých nemocných více než deseti let.
V současné době je ale ipilimumab postupně nahrazován anti-PD-1 monoklonálními protilátkami, které prokazují vyšší účinnost a nižší toxicitu. Na rozdíl od CTLA-4 ovlivňuje receptor PD-1 pozdější, efektorovou fázi imunitní reakce a působí spíše v místě nádoru [23]. PD-1 receptor bývá exprimován na T lymfocytech při dlouhodobé zvýšené expozici cizorodým antigenům, např. u chronických infekcí či nádorových onemocnění. Po vazbě PD-1 s ligandem PD-L1 dochází ke spuštění inhibičního signálu, jehož výsledkem je anergie T lymfocytů a zablokování protinádorové imunitní reakce. Exprese PD-L1 bývá prokazována u řady nádorů včetně melanomu a je považována za jeden z obranných mechanismů, kterými nádor uniká z dosahu imunitní kontroly. Zablokování PD-1 receptoru monoklonální protilátkou brání jeho vazbě s ligandem PD-L1, a tím nemůže dojít ke spuštění inhibičního signálu. T lymfocyty zůstávají aktivní i v místě nádoru a mohou proti nádorovým buňkám reagovat. V současné době existují dvě anti PD-1 protilátky nivolumab, plně humánní IgG4 monoklonální protilátka a pembrolizumab, humanizovaná IgG4 monoklonální protilátka. Neliší se svou účinností ani toxicitou. Na rozdíl od cílené terapie se imunoterapie aplikuje intravenózně. Nivolumab se podává v dávce 3 mg/kg ve dvoutýdenních intervalech v nitrožilní infuzi, pembrolizumab v dávce 2 mg/kg á 3 týdny v nitrožilní infuzi. Účinnost obou preparátů byla primárně porovnávána s účinností chemoterapie, kde prokázala jednoznačně vyšší četnost léčebných odpovědí, prodloužení doby do relapsu i prodloužení celkové doby přežití. Následně byly anti PD-1 protilátky porovnávány s ipilimumabem a i v tomto případě prokázaly významně vyšší účinnost. Léčebné odpovědi nastupují dříve než u ipilimumabu, již okolo 8. týdne léčby, dochází k nim u 30–40 % pacientů a medián doby do progrese prodlužuje nivolumab i pembrolizumab na 5–7 měsíců. Anti PD-1 protilátky, stejně jako ipilimumab vyvolávají dlouhodobé léčebné odpovědi, a bylo prokázáno, že i v případech ukončení léčby pro toxicitu pokračuje u nezanedbatelného počtu nemocných dlouhodobá léčebná odpověď. Imunoterapie anti PD-1 protilátkami i ipilimumabem také prodlužuje významně celkové přežívání. U pacientů léčených anti PD-1 protilátkami ještě nejsou na rozdíl od ipilimumabu k dispozici data z dlouhodobých sledování, ale například ve studii Keynote 006 přežívalo 24 měsíců 55 % pacientů léčených pembrolizumabem [29].
Anti PD-1 protilátky se díky svým účinkům dostaly na vedoucí pozici v imunoterapii metastazujícího melanomu. Stejně jako v případě ipilimumabu není účinnost nivolumabu a pembrolizumabu vázána na stav BRAF mutace, a tak je možné je využít i v terapii BRAF pozitivního melanomu. Anti PD-1 protilátky se podávají do progrese či nezvládnutelné toxicity, nicméně objevují se studie hodnotící jejich dlouhodobou účinnost i při kratším podávání například po dobu 24 měsíců. V současné době má v ČR úhradu ZP nivolumab, a to pouze v první linii léčby u nemocných, kteří dosud nebyli pro metastazující melanom léčeni. Úhrada pembrolizumabu se ve stejné indikaci očekává v průběhu několika měsíců.
Stejně jako v případě cílené léčby se i u imunoterapie zkouší podávání kombinované imunoterapie, společná aplikace ipilimumabu a anti PD-1 protilátek. Inhibice CTLA-4 se projevuje převážně v časných stadiích aktivace T lymfocytů, zatímco inhibice PD-1 receptoru ovlivňuje T lymfocyty v efektorové fázi, v mikroprostředí nádoru. Rozdílnost místa působení těchto monoklonálních protilátek naznačovala jejich možné komplementární účinky, což se ověřovalo v řadě klinických studií. Například studie Checkmate 067 hodnotící účinnost kombinace ipilimumabu s nivolumabem prokázala vysokou četnost léčebných odpovědí dosahující až 57,6 % ORR, tedy více, než je obvyklé u monoterapie anti PD-1 protilátkami. Medián PFS byl 11,5 měsíců u kombinované léčby proti 2,9 měsícům u monoterapie ipilimumabem a 6,9 měsícům u monoterapie nivolumabem. Na hodnocení OS je zatím příliš brzy, kdy podle prvních dat z dlouhodobého sledování, kde při minimálním sledování 36 měsíců nebylo ve skupině pacientů na kombinované terapii dosaženo mediánu celkového přežití. Ve skupině pacientů léčených nivolumabem bylo dosaženo celkového přežití 37,6 měsíce (95% CI [confidence interval, CI] 29,1 – nebylo dosaženo) ve srovnání s 19,9 měsíce (95% CI 16,9–24,6) u pacientů léčených v monoterapii ipilimumabem [19, 34]. Výsledky naznačují, že kombinovaná léčba je významně účinnější než monoterapie ipilimumabem i než monoterapie nivolumabem. Vyšší je bohužel také toxicita [34].
Nežádoucí účinky imunoterapie
Nežádoucí účinky (NÚ) imunoterapie jsou odvozeny z mechanismu jejího účinku, tedy zesílení aktivity T lymfocytů, což může vést až ke spuštění autoimunitních reakcí. Vzhledem k základní příčině vzniku NÚ se označují jako imunitně zprostředkované nežádoucí účinky (irAE, immune related adverse events). Základní princip účinku ipilimumabu a anti PD-1 protilátek je podobný, podobná je proto také toxicita. Vzhledem k oblasti působení ipilimumab ovlivňuje spíše systémové imunitní reakce, zatímco anti PD-1 protilátky působí zejména v mikroprostředí nádoru, je toxicita nivolumabu a pembrolizumabu na rozdíl od ipilimumabu výrazně méně častá a méně závažná. Spektrum nežádoucích účinků je u obou typů imunoterapie v zásadě stejné, nejčastější je kožní toxicita, popisovaná u 40–50 % léčených pacientů. Zahrnuje vitiligo, různé i necharakteristické exantémy, exacerbaci předchozích dermatóz, zejména ekzému, psoriázy, ale také rosacey či alopecie. Vzácně může být imunoterapie provázena i vznikem Sweetova syndromu, Stevens Johnsonova syndromu, kožní sarkoidózy, zaznamenáno bylo i pyoderma gangrenosum či toxická epidermální nekrolýza. Nejzávažnějším NÚ bývá gastrointestinální toxicita projevující se převážně průjmovitou stolicí či kolitidou. Objevuje se mezi 6.–8. týdnem léčby a bývá významně častější při terapii ipilimumabem. Nedostatečně léčená může přecházet v kolitidu a v nejtěžších případech vzácně i v perforaci střeva. Potíže bývají podobné jako u Crohnovy choroby. Jaterní toxicita se projevuje převážně elevací jaterních testů a bilirubinu bez výrazné klinické symptomatologie. Endokrinní toxicita postihuje asi 5–10 % pacientů a zahrnuje autoimunní thyreoiditidu či hypofyzitidu. U pacientů léčených anti PD-1 protilátkami se objevuje až ve 47 % případů únava, podobná jako například při terapii IFN alfa. Asi u 5 % nemocných bývají popisovány artralgie a různé muskuloskeletální potíže. Mezi méně časté NÚ se řadí plicní a renální toxicita provázející zejména terapii anti PD-1 protilátkami, dále hematologická, oční či neurologická toxicita. Pokud jsou NÚ správně léčeny, jsou reverzibilní a v řadě případů je možné v imunoterapii pokračovat. Pokud jsou přehlédnuty, zanedbány či nesprávně léčeny, mohou být velmi závažné a vyžadují ukončení léčby. Základní terapií imunitně zprostředkovaných NÚ je aplikace kortikoidů, u závažných stavů minimálně v dávce 1–2 mg/kg, nejlépe intravenózně. Po ústupu příznaků je nezbytné jejich pomalé postupné vysazování alespoň po dobu 4 týdnů. U endokrinní toxicity je základem léčby odpovídající hormonální substituce [31]. Byla vypracována doporučení pro léčbu jednotlivých typů toxicity a při jejich znalosti a dodržování je naprostá většina NÚ dobře zvládnutelná, bez ohrožení pacienta i bez nutnosti ukončení terapie.
CHEMOTERAPIE
V současné terapii melanomu již chemoterapie jednoznačně ztrácí svůj význam, přichází v úvahu pouze u nemocných, u kterých je kontraindikována jak cílená léčba, tak imunoterapie. Nejčastěji používanou chemoterapií je stále dacarbazin, případně se podávají kombinace cytostatik samotných nebo jejich kombinace s imunoterapií. Nejčastěji používanými cytostatiky jsou dacarbazin, cisplastina, vinblastin, cycloplatina, bleomycin či paclitaxel, z imunoterapeutických preparátů jsou to zejména IFN alfa a interleukin 2. I když některé kombinace dokáží vyvolat relativně vysokou četnost léčebných odpovědí dosahující až 40 %, nemají dlouhého trvání a neprodlužují ani období do relapsu, ani celkové přežití pacientů s metastazujícím melanomem [15].
Všichni pacienti s metastazujícím melanomem by měli být sledováni a léčeni ve specializovaných centrech, kde jsou dostupné nejnovější léčebné modality a klinické studie. I přes významně zvýšenou účinnost nových terapeutických postupů existuje stále přibližně polovina nemocných, kteří neodpovídají ani na současnou moderní a účinnou léčbu a jejich šancí mohou být klinické studie s novými léky a kombinacemi dostupnými právě pouze na těchto pracovištích.
SLEDOVÁNÍ PACIENTŮ S MELANOMY
Se zvyšující se incidencí melanomu rostou i počty pacientů, kteří by měli být pravidelně sledováni a kontrolováni. Cílem sledování nemocných po odstranění melanomu je včasná detekce relapsu onemocnění i případného duplicitního kožního nádoru. Uvádí se, že v průběhu prvních 2 let po operaci mají pacienti 5–8% riziko vzniku dalšího melanomu [5]. Primárně by proto měli být všichni nemocní informováni o škodlivosti spálení kůže i intenzivniho slunění a poučeni o vhodnosti samovyšetřování celého kožního povrchu, v závažnějších případech i o kontrole regionálních lymfatických uzlin. Jedním z důvodů pro sledování nemocných je předpoklad, že pravidelné vyšetření umožní včas odhalit možnou recidivu onemocnění. Na druhou stranu dosud žádná studie neprokázala, že by časná detekce metastáz dokázala prodloužit celkové přežívání pacientů [28]. V současné době bohužel stále neexistují jednotná mezinárodní doporučení pro kontroly pacientů po operaci melanomu. V roce 2015 byly publikovány výsledky prospektivního hodnocení pravidelného vyšetřování 668 pacientů po operaci melanomů in situ, či stadií IA–IIC z 67 center v Německu. V průběhu 3–4 let sledování byla pouze polovina, 55,6 % lokoregionálních metastáz zachycena během návštěvy lékaře a přibližně třetina pacientů, (33,3 %) odhalila uzlinový relaps náhodně během samovyšetřování v období mimo plánovanou kontrolu. Někteří nemocní uváděli, že častější kontroly v nich vyvolávají pocity úzkosti. Jedním ze závěrů studie pak bylo zejména doporučení prodloužení intervalů kontrol u pacientů s prognosticky příznivými melanomy [20]. Základním rozhodovacím kritériem pro volbu četnosti a náplně kontrol je pokročilost primárního nádoru. Pacienti po operaci melanoma in situ jsou, vzhledem k minimálnímu riziku progrese, sledováni většinou v ročních intervalech po dobu prvních 5 let a dále i v intervalech delších. Zobrazovací vyšetření nejsou nutná. U pacientů s pokročilými melanomy dochází nejčastěji k progresi v průběhu prvních 3–5 let po operaci primárního nádoru, proto by měla být klinická vyšetření včetně zobrazovacích metod prováděna v tomto období v kratších intervalech, doporučovaná rozmezí se pohybují mezi 3–6 měsíci. V následujících letech se období mezi návštěvami prodlužují na 6–12 měsíců. Melanom je nádor s rizikem vzniku pozdních metastáz, v některých případech se objevují i v odstupu 15, 20 a více let. Pacienti po operaci melanomu jsou proto většinou sledováni po celý život. Náplně kontrol se liší v různých zemích i na různých pracovištích. U vysoce rizikových melanomů by měla být kromě klinických kontrol prováděna také zobrazovací radiologická vyšetření. Pro zhodnocení stavu uzlin je nejpřínosnější sonografické vyšetření, pro odhalení orgánového postižení CT či PET/CT vyšetření. Z laboratorních vyšetření je možné sledování hladin LDH a S-100 proteinu, nicméně neexistuje shoda, zda se vůbec mají jakákoliv laboratorní vyšetření v rámci dispenzárních kontrol provádět. Zcela odlišná situace ale nastává, pokud je pacientovi podávána adjuvantní léčba, nebo se objeví metastázy. V těchto případech se již volí intervaly kontrol i jejich náplň individuálně podle stavu a potřeb jednotlivých pacientů.
Do redakce došlo dne 12. 1. 2018.
Adresa pro korespondenci
prim. MUDr. Ivana Krajsová, MBA
Dermatovenerologická klinika VFN a 1. LF UK
U Nemocnice 499/2
128 00 Praha 2
e-mail: ivana.krajsova@vfn.cz
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST
1. Z uvedených národností má nejvyšší riziko vzniku melanomu
- a) Čech
- b) Španěl
- c) Ital
- d) Maročan
2. Nová 8. AJCC klasifikace melanomu bere v úvahu u T klasifikace
- a) tloušťku nádoru, ulceraci, počet mitóz na 1 mm2
- b) ulceraci, tloušťku nádoru, hodnotu Clarka
- c) pouze tloušťku nádoru a počet mitóz na 1 mm2
- d) pouze tloušťku nádoru a ulceraci
3. Hutchinson’s freckle je synonymum pro
- a) pihy na zádech po spálení kůže na slunci
- b) pigmentace pod nehtovými ploténkami
- c) lentigo maligna
- d) slizniční melanom
4. BRAF mutace bývá prokazována
- a) u 20 % melanomů
- b) u 40–50 % melanomů
- c) u 80–90 % melanomů
- d) její záchyt je velmi vzácný
5. Lem zdravé tkáně při excizi melanomu musí být vždy minimálně
- a) 10 mm
- b) 30 mm
- c) 5 mm
- d) řídí se tloušťkou nádoru
6. Léčba lokoregionálních metastáz melanomu
- a) je vždy chirurgická
- b) nezbytná je systémová léčba
- c) nejúčinnější je kombinace lokální a systémové léčby
- d) zřídka se uplatní radioterapie
7. Pro cílenou léčbu BRAF inhibitory je charakteristická
- a) vysoká četnost léčebných odpovědí
- b) vzácně se objevující rezistence k léčbě
- c) vysoká toxicita
- d) nitrožilní podávání
8. Kombinovaná léčba BRAF a MEK inhibitory
- a) významně zvyšuje toxicitu léčby
- b) je účinná pouze u BRAF negativních melanomů
- c) oddaluje vznik rezistence k léčbě
- d) podává se pouze po dobu 6 měsíců
9. Současná imunoterapie metastazujícího melanomu
- a) je využívána pouze u BRAF pozitivních melanomů
- b) nedokáže prodloužit celkové přežívání léčených pacientů
- c) vyvolává vysokou četnost léčebných odpovědí
- d) aktivuje T lymfocyty zablokováním jejich inhibičních receptorů
10. Nivolumab a pembrolizumab
- a) jsou IgG1 monoklonální protilátky proti PD-1 receptoru
- b) jsou monoklonální protilátky proti CTLA-4 receptoru
- c) vyvolávají častou a závažnou toxicitu
- d) jsou účinnější než ipilimumab
Správným zodpovězením otázek kontrolního testu získáte 2 kredity kontinuálního vzdělávání lékařů ČLK, které budou zasílány redakcí jedenkrát ročně po uzavření ročníku časopisu. Správné odpovědi na otázky kontrolního testu budou uveřejněny v příštím čísle časopisu. Odpovědi posílejte na e-mailovou adresu kozni@lf1.cuni.cz vždy nejpozději do jednoho měsíce od vydání daného čísla.
Odpovědi na otázky kontrolního testu v č. 6/2017:
Kodet O., Lacina L.: Základy molekulární biologie nádorů pro praxi
Správné odpovědi: 1a,b,c, 2a,c, 3a,b,c, 4a,b,d, 5a,c,d, 6a,c, 7a,b,d, 8a,c, 9a, b, c, d, 10c.
Sources
1. BALCH, C. M., MORTON, D. L., GERSHENWALD, J. E. et al. Sentinel node biopsy and standard of care for melanoma. J. Am. Acad. Dermatol., 2009, 60, p. 872–875.
2. CHAPMAN, P. B., HAUSCHILD, A., ROBERT, C. et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N. Engl. J. Med., 2011, 364, p. 2507–2516
3. CHESNEY, J. A., PUZANOV, I., ROSS, M. I. et al. Primary results from a randomized (1 : 1), open label phase II study of talimogene laherparepvec (T) and ipilimumab (I) vs I alone in unresected stage IIIB – IV melanoma. J. Clin. Oncol., 2017, 35, suppl; abstr e14556.
4. DUMMER, R., GUGGENHEIM, M., ARNOLD, A. W. et al. Updated Swiss guidelines for the treatment and follow up of cutaneous melanoma. Swiss Med. Wkly., 2011,141, p. 13320.
5. DUMMER, R., HASCHILD, A., LINDENBLATT, N. et al. Cutaneous melanoma: ESMO clinical practise guidelines for diagnosis, treatment and follow up. Annals of Oncology, 2015, 26, Suppl. 5, p. 126–132.
6. EGGERMONT, A. M. M., SUCIU, S., TESTORI, A. et al. Ulceration and stage are predictive of interferon efficacy in melanoma: results of the phase III adjuvan trails EORTC 18952 an d EORTC 18991. Eur. J. Cancer, 2012, 48, p. 218–225.
7. EGGERMONT, A. M. M., CHIARIO-SILENI, V., GROB, J. J. et al. Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N. Engl. J. Med., 2016, 375, 19, p. 1845–1855. Published online 2016 Oct 7. doi: 10.1056/NEJMoa1611299.
8. EGGERMONT, A. M. M., DUMMER, R. The 2017 complete overhaul of adjuvant therapies for high-risk melanoma and its consequences for staging and management of melanoma patients. Eur. J. Cancer, 2017, 86, p. 101–105.
9. FRANGOS, J. E., DUNCAN, L. M., PIRIS, A. et al. Increased diagnosis of thin superficial spreading melanomas: A 20 - year study. J. Am. Acad. Dermatol., 2012, 67, p. 181–190.
10. GABEFF, R., DUTARTRE, H., DRENO, B. et al. Phototoxicity of BRAF inhibitors: exclusively due to UVA radiation and rapidly regressive. Eur. J. Dermatol., 2015, 25, 5, doi:10.1684/ejd.2015.2628.
11. GERSHENWALD, J. E., SCOLYER, A. R., HESS, K. R. et al. Melanoma staging: evidence based changes in the American Joint Committee on Cancer eight edition cancer staging manual. Cancer J. Clin., 2017, doi:10.3322/caac.21409.
12. GRIMALDI, A. M., SIMEONE, E., FESTINO, L. et al. MEK inhibitors in the treatment of metastatic melanoma and solid tumors. Am. J. Clin. Dermatol., 2017, 23, DOI:10.1007/s40257-017-0292-y.
13. HEPPT, M. V., SIEPMANN, T., ENGEL, J. et al. Prognostic significance of BRAF and NRAS mutations in melanoma: a German study from routine care. BMC Cancer, 2017, 17, 536. DOI 10.1186/s12885-017-3529-5.
14. HODI, F. S., O‘DAY, S. J., MCDERMOTT, D. F., WEBER, R. W. et al. Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med., 2010, 363, 8, p. 711–723.
15. IVES, N. J., STOWE, R. L., LORIGAN, P. et al. Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta analysis of 18 trials involving 2,621 patients. J. Clin. Oncol., 2007, 25, p. 5426–5434.
16. KIRKWOOD, J., MANOLA, J., IBRAHIM, J. A Pooled Analysis of Eastern Cooperative Oncology Group and Intergroup Trials of Adjuvant High-Dose Interferon for Melanoma. Clin. Cancer Res., 2004, 10, p. 1670–1677.
17. KUBALA, E. Léčba kombinací BRAF a MEK inhibitory (dabrafenib + trametinib) u metastazujícího melanomu. Výsledky léčby mozkových metastáz studie COMBI-MB a 5 letého celkového přežití. Melanoma News, 2017, 2, s. 6–10.
18. LARKIN, J., ASCIERTO, P. A., DRENO, B. et al. Combined vemurafenib and cobimetinib in BRAF mutated melanoma. N. Engl. J. Med., 2014, 371, p. 1867–1876.
19. LARKIN, J., CHIARION-SILENI, V., GONZALES, R. et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N. Engl. J. Med., 2015, 373, 1, p. 23–34.
20. LIVINGSTONE, E., KRAJEWSKI, C., EIGENTLER, T. K. et al. Prospective evaluation of follow up in melanoma patients in Germany-results of a multicentre and longitudinal study. Eur. J. Cancer, 2015, 51, 5, p. 653–667.
21. LONG, G. V., MENZIES, A. M., NAGRIAL, A. M. et al. Prognostic and clinicopathologic associations of oncogenic BRAF in metastatic melanoma. J. Clin. Oncol., 2011, 29, 10, p. 1239–1246.
22. LONG, G. V., HAUSCHILD, A., SANTINAMI, M. et al. Adjuvant dabrafenib plus trametin ib in stage III BRAF-mutated melanoma. N. Engl. J. Med., 2017. DOI:10.1056/NEJMoa1708539.
23. LUKE, J. J., OTT, P. A. PD-1 pathway inhibitors: The next generation of immunotherapy for advanced melanoma. Oncotarget, 2014, 6, 6, p. 3479–3492.
24. MEDINA, T. M., LEWIS, K. D. The evolution of combined molecular targeted therapies to advance the therapeutic efficacy in melanoma: a highlight of vemurafenib and cobimetinib. OncoTargets and Therapy, 2016, 9, p. 3739–3752.
25. MENZIES, A. M., ASHWORTH, M. T., SWANN, S. et al. Characteristics of pyrexia in BRAFV600E/K metastatic melanoma patients treated with combined dabrafenib and trametinib in a phase i/II clinical trial. Ann. Oncol., 2015, 26, 2, p. 415–421.
26. QUEIROLO, P., SPAGNOLO, F. BRAF plus MEK targeted drugs: a new standard of treatment for BRAF mutant advanced melanoma. Cancer Metastasis Rev., 2017. doi:10.1007ús10555-017-9660-6.
27. ROBERT, C., KARASZEWSKA, B., SCHACHTER, J. et al. Three-year estimate of overal survival in COMBI-v, a randomized phase 3 study evaluating first-line dabrafenib + trametinib in patients with unresectable or metastatic BRAFV600E/K mutant cutaneous melanoma. Annals of Oncology, 2016, 27, Supplement 6, p. 552–587.
28. SAIAG, P., BAQUET, L., GUILLOT, B. et al. Management of adult patients with cutaneous melanoma without distant metastasis. 2005 update of the french standards, options and recommendations guidelines. Summary report. Eur. J. Dermatol., 2007, 17, p. 325–331.
29. SCHACHTER, J., RIBAS, A., LONG, G. V. et al. Pembrolizumab versus ipilimumab for advanced melanoma: final overal survival results of a multicentre, randomised, open-label phase 3 study (Keynote 006). Lancet, 2017, 390, 10105, p. 1853–1862.
30. SCHWARTZ, R. A. Skin Cancer. Recognition and management. Springer-Verlag, 1988, p. 99–140.
31. STUCCI, S., PALMIROTTA, R., PASSARELLI, A. et al. Immune-related adverse events during anticancer immunotherapy: pathogenesis and management (review). Oncology Letters, 2017, 14, p. 5671–5680.
32. THOMAS, L., PUIG, S. Dermoscopy, digital dermoscopy and other digital tools in the early detection of melanoma and follow up of high risk cancer patients. Acta Derm. Venereol., 2017, Suppl 218, p. 14–21.
33. WEBER, J., MANDALA, M., DELVECCHIO, M. et al. Adjuvant nivolumab versus ipilimumab in resected stage III ir IV melanoma. N. Engl. J. Med., 2017. DOI:10.1056/NEJMoa1709030.
34. WOLCHOK, J. D., CHIARION-SILENI, V., GONZALEZ R. et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N. Engl. J. Med., 2017, 377, p. 1345–1356.
Labels
Dermatology & STDs Paediatric dermatology & STDs Clinical oncology
Article was published inCzech-Slovak Dermatology
2018 Issue 1
Most read in this issue- Diagnostika melanomu a současná doporučení pro léčbu a sledování
- Kožní leiomyosarkom – popis případu
- Rothmundův-Thomsonův syndrom sdružený s anaplastickým velkobuněčným T lymfomem – popis případu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

