-
Medical journals
- Career
Obštrukčné spánkové apnoe a prietok krvi mozgom
Authors: P. Šiarnik; M. Jurík; P. Karapin; K. Klobučníková; B. Kollár; P. Turčáni
Authors‘ workplace: I. neurologická klinika LF UK a UN Bratislava
Published in: Cesk Slov Neurol N 2019; 82(3): 268-273
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2019268Overview
Spánkové poruchy dýchania patria medzi časté ochorenia, ktoré postihujú približne jednu štvrtinu bežnej populácie dospelých ľudí. Početné štúdie potvrdzujú úzky vzťah medzi spánkovým apnoe a ložiskovou ischémiou mozgu, ako aj medzi spánkovým apnoe a kognitívnym deficitom. Kľúčovým mechanizmom podieľajúcim sa na oboch procesoch by mohla byť cerebrálna hypoperfúzia a hemodynamické zmeny pri apnoických epizódach. V nasledujúcom texte uvádzame prehľad vyšetrovacích metód použiteľných na stanovenie prietoku krvi mozgom u pacientov s obštrukčným spánkovým apnoe. Uvádzame taktiež naše skúsenosti s použitím UZ modulovanej „blízkej“ infračervenej spektroskopie v priebehu celonočnej polysomnografie, ktoré doteraz nebolo v literatúre opísané.
Klíčová slova:
prietok krvi mozgom – cerebrálna ischémia – transkraniálná Dopplerovská ultrasonografia – ultrazvukom modulovaná NIRS
Úvod
Obštrukčné spánkové apnoe (OSA) predstavuje nezávislý rizikový faktor pre vznik CMP [1]. O významnej úlohe OSA na vzniku cerebrálnej ischémie svedčí signifikantne vyšší výskyt závažných foriem spánkového apnoe v populácii s ischemickou CMP vzniknutou počas spánku [2]. Asociácia medzi OSA a CMP je nezávislá od iných rizikových faktorov vrátane arteriálnej hypertenzie, fibrilácie predsiení, diabetes mellitus či dyslipidémie [1,3,4]. Z daného dôvodu sa okrem vplyvu OSA na typické vaskulárne rizikové faktory uvažuje aj o ďalších patomechanizmoch, ktoré by mohli zvyšovať riziko vzniku CMP. Významným mechanizmom, ktorý môže OSA spájať so vznikom ložiskovej ischémie mozgu, sú hemodynamické dôsledky spánkového apnoe. Pribúdajú dôkazy o tom, že v priebehu OSA dochádza k významným zmenám cerebrálnej perfúzie a k poklesu prietoku krvi mozgom [5–7]. Zmeny prietoku krvi mozgom však môžu mať okrem ložiskového ischemického postihnutia komplexnejšie dôsledky. Cerebrálna hypoperfúzia môže predstavovať jeden z kľúčových patomechanizmov podieľajúcich sa napríklad na vzniku kognitívneho deficitu či dokonca neurodegenerácie [8]. U pacientov s OSA je už známe aj zhoršenie kognitívnych funkcií hlavne v oblasti pozornosti, pamäte a exekutívnych funkcií [9]. Preukázaná bola taktiež asociácia medzi kognitívnymi funkciami a mierou hypoxémie počas spánku [10]. Preto si myslíme, že analýza zmien prietoku krvi mozgom vo vybranej populácii pacientov s OSA by mohla pomôcť objasniť patofyziológiu vzniku ložiskového ischemického cerebrálneho postihnutia ako aj vznik kognitívneho deficitu v tejto populácii pacientov. V nasledujúcom texte uvádzame prehľad perspektívnych vyšetrovacích metód použiteľných na stanovenie prietoku krvi mozgom u pacientov s OSA, ako aj prvý opis využitia UZ modulovanej „blízkej“ infračervenej spektroskopie (near-infrared spectroscopy; NIRS) v tejto indikácii.
Patofyziológia obštrukčného spánkového apnoe
OSA je charakterizované opakovanými epizódami kompletného alebo čiastočného kolapsu horných dýchacích ciest počas spánku [11]. Počas kolapsu horných dýchacích ciest dochádza k zvýšeniu inspiračného úsilia, ktoré má za následok výrazné zníženie intratorakálneho tlaku, ktorý klesá až na hodnotu –65 mm Hg [12,13]. Zníženie intratorakálneho tlaku vedie k zväčšeniu rozdielu medzi extrakardiálnym a intrakardiálnym tlakom. Tým dôjde k zvýšeniu transmurálneho tlaku v ľavej srdcovej komore a následnému nárastu afterloadu ľavej komory. Zvýšenie afterloadu ľavej komory vedie k zhoršeniu jej diastolickej funkcie. V priebehu obštrukčnej apnoickej pauzy sa tiež zvyšuje aj venózny návrat do pravej komory, dochádza k jej dilatácii a posunu medzikomorového septa, čo prispieva k ďalšiemu obmedzeniu diastolickej funkcie. Kombinácia zvýšeného afterloadu a zhoršenia diastolickej funkcie vedie k zníženiu vývrhového objemu ľavej komory počas obštrukčnej apnoickej pauzy [14].
Negatívny intratorakálny tlak vedie k vzostupu centrálneho venózneho návratu, ktorý spôsobuje vzostup intrakraniálneho tlaku. Apnoická pauza je ukončená prebúdzacou reakciou, pri ktorej dochádza k poklesu saturácie krvi kyslíkom a k chrápaniu. Hemodynamické zmeny počas apnoickej pauzy sú ovplyvnené taktiež zmenami v parciálnom tlaku kyslíka (PaO2) a parciálnom tlaku oxidu uhličitého (PaCO2). Vzostup PaCO2 a pokles PaO2 vedú k vazodilatácii a následnému zvýšeniu cerebrálneho prietoku krvi. K zmenám hemodynamiky prispievajú aj zmeny v aktivite sympatikového nervového systému, ktorý má vplyv na tonus cievnej steny, pulz aj na respiračné úsilie [15–17].
Uvedené hemodynamické zmeny môžu pri zhoršenom cerebrálnom kolaterálnom obehu predstavovať spúšťajúci faktor cerebrálnej ischémie [18].Stanovenie prietoku krvi mozgom pomocou transkraniálneho Dopplera
Viaceré štúdie využívali na stanovenie prietoku krvi mozgom vyšetrenie transkraniálnym Dopplerom (TCD). Výhodou danej vyšetrovacej metódy je možnosť neinvazívneho sledovania aktuálnych zmien cerebrálneho krvného prietoku v reálnom čase. Limitáciou metódy je skutočnosť, že vyšetrením je stanovená len rýchlosť krvného toku a nie absolútna hodnota prietoku krvi mozgom [19]. Vyšetrenie vychádza z predpokladu, že zmeny v rýchlosti prietoku krvi pri nemennom priemere arteria cerebri media odzrkadľujú zmeny prietoku krvi mozgom. Údaje získané meraním rýchlosti prietoku krvi v arteria cerebri media pomocou TCD naznačujú, že v priebehu obštrukčnej apnoickej pauzy dochádza k prudkému vzostupu rýchlosti prietoku krvi. Rýchlosť prietoku krvi v priebehu apnoickej pauzy stúpa podľa literárnych údajov v rozmedzí 19–219 % [20]. Po ukončení apnoickej pauzy a obnovení respirácie dochádza k následnému prudkému poklesu rýchlosti prietoku pod východiskové hodnoty [20–22]. Vzostup prietoku krvi môže byť dôsledkom vzostupu tlaku krvi (TK) a taktiež vzostupu PaCO2 v priebehu apnoickej pauzy. Neinvazívnym meraním bol v priebehu apnoickej pauzy preukázaný vzostup TK o 13–83 %. Štúdiou bola taktiež zistená korelácia rýchlosti prietoku krvi s PaCO2, ako aj inverzná korelácia s PaO2 na konci apnoickej pauzy [22,23]. Predpokladá sa, že následný pokles prietoku krvi po obnovení respirácie je príliš prudký na to, aby bol spôsobený samotným poklesom PaCO2. Úlohu pravdepodobne zohráva skôr prudký pokles TK a vplyv neuronálnej aktivácie pri prebúdzacej reakcii [21,22]. Usudzuje sa, že zmeny cerebrálneho prietoku krvi sú bezprostredne spôsobené prudkými výkyvmi hodnôt TK, ktoré sú výraznejšie ako možnosti cerebrálnej autoregulácie. Cerebrálna autoregulácia môže byť v takýchto prípadoch nedostatočná.
Vzostupy hodnôt TK, ktoré dosahujú v terminálnej fáze apnoickej pauzy až úroveň 200/ 100 mm Hg sa pripisujú hlavne aktivácii sympatikového nervového systému. Maximálny vzostup TK a srdcovej frekvencie je pozorovaný najneskôr do 5–7 s od ukončenia apnoickej pauzy [24,25]. U pacientov s OSA boli v štúdiách okrem akcentovaných hodnôt TK pozorované taktiež výrazné poklesy TK so systolickým TK < 50 mm Hg. Pokles hodnôt TK môže byť spôsobený zvýšenou odpoveďou parasympatikového nervového systému [26]. Pokles cerebrálneho krvného prietoku, nízky arteriálny TK a hypoxémia bezprostredne po ukončení apnoickej pauzy môžu byť predisponujúcimi faktormi pre vznik ischémie mozgu [16]. Na obr. 1 uvádzame typické zmeny krvného prietoku v arteria cerebri media a zmeny hodnôt stredného TK v priebehu obštrukčnej apnoickej pauzy.
Image 1. Typické zmeny v rýchlosti krvného prietoku v arteria cerebri media a zmeny hodnôt stredného tlaku krvi v priebehu obštrukčnej apnoickej pauzy. Upravené podľa [17,22].
Fig. 1. Typical changes of the blood flow velocity in the middle cerebral artery and changes of the mean blood pressure during obstructive apnea. Adapted from [17,22].![Typické zmeny v rýchlosti krvného
prietoku v arteria cerebri media a zmeny
hodnôt stredného tlaku krvi v priebehu
obštrukčnej apnoickej pauzy. Upravené
podľa [17,22].<br>
Fig. 1. Typical changes of the blood flow
velocity in the middle cerebral artery and
changes of the mean blood pressure
during obstructive apnea.
Adapted from [17,22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7bbca045d5b5a4d6fd048b6bb10e0e80.jpeg)
Pojmami cerebrálna autoregulácia, cerebrovaskulárna rezerva, prípadne cerebrovaskulárna reaktivita sa označuje miera schopnosti mozgových ciev prispôsobiť sa metabolickým potrebám mozgu a miera schopnosti zabezpečiť adekvátnu perfúziu aj v prípade fluktuácie PaO2 alebo PaCO2. Zníženie tejto schopnosti je považované za rizikový faktor pre vznik cerebrálnej ischémie. Predpokladá sa, že zhoršenie cerebrálnej vazoreaktivity u pacientov s OSA je následkom opakovanej expozície cievneho endotelu hypoxickému stresu. Ten vedie v dôsledku nadmernej stimulácie k postupnej down-regulácii receptorov pre CO2 nachádzajúcich sa v cievach a v predĺženej mieche [27]. Na regulácii prietoku krvi mozgom sa významnou mierou podieľa endotel cerebrálnych ciev, ktorý secernuje účinné vazoaktívne faktory, najmä oxid dusnatý, a tým udržuje bazálny tonus cievnej steny [28]. Na postihnutí cerebrovaskulárnej reaktivity sa na základe uvedených skutočností môže podieľať aj postihnutie vazodilatácie závislej od endotelu, ktoré bolo u pacientov s OSA opakovane dokumentované [29]. Postihnutie cerebrálnej vazoreaktivity sa preukázalo jednak v štúdiách používajúcich TCD, no taktiež v štúdiách skúmajúcich cerebrálnu vazoreaktivitu na základe funkčnej MR [27,30,31]. Doteraz najrozsiahlejšia štúdia v tejto oblasti sa zrealizovala na populácii 373 pacientov (v rámci Wisconsin Sleep Cohort). U pacientov s OSA bola na základe vyšetrenia rýchlosti prietoku krvi TCD pozorovaná pozitívna korelácia medzi priemernou nočnou saturáciou krvi kyslíkom a medzi cerebrálnou cievnou reaktivitou na hyperkapniu [32].
Stanovenie prietoku krvi mozgom pomocou tzv. „blízkej“ infračervenej spektroskopie
Ďalšou vyšetrovacou metódou umožňujúcou neinvazívne monitorovanie prietoku krvi mozgom je NIRS. Vyšetrenie umožňuje sledovanie koncentrácie oxygenovaného a deoxygenovaného hemoglobínu, na základe čoho je možné stanovenie saturácie mozgového tkaniva kyslíkom. V objeme tkaniva ožiareného svetlom so spektrom blízkym infračervenému svetlu je pri vyšetrení NIRS možné určiť celkovú koncentráciu hemoglobínu. Tá je považovaná za ekvivalent pre objem krvi, ktorý sa v danom objeme tkaniva nachádza [33]. Štúdiami bol v priebehu apnoickej pauzy opakovane preukázaný pokles koncentrácie oxygenovaného hemoglobínu a saturácie mozgového tkaniva kyslíkom so súčasným vzostupom koncentrácie deoxygenovaného hemoglobínu a celkovej koncentrácie hemoglobínu. Opísané zmeny korelovali s trvaním apnoickej pauzy a so saturáciou krvi kyslíkom [34–36]. V priebehu apnoickej pauzy dochádza v iniciálnej fáze k poklesu koncentrácie oxygenovaného hemoglobínu a paralelnému vzostupu koncentrácie deoxygenovaného hemoglobínu, čo svedčí pre desaturáciu tkaniva kyslíkom. Následne dochádza k prudkému vzostupu koncentrácie oxygenovaného hemoglobínu a koncentrácie celkového hemoglobínu so súčasným poklesom koncentrácie deoxygenovaného hemoglobínu, čo poukazuje na zvýšenie lokálneho prietoku krvi a následnú fokálnu hyperoxygenáciu. Kým v priebehu hypopnoe dokáže byť desaturácia mozgového tkaniva kyslíkom vykompenzovaná vzostupom celkovej koncentrácie hemoglobínu a lokálnou hyperoxygenáciou, počas obštrukčných apnoických páuz naopak prevláda cerebrálna hypoxia [33]. Zistenia štúdií, ktoré využívali NIRS, sú konzistentné so zisteniami štúdií používajúcich TCD. Naznačujú, že prechodný vzostup krvného prietoku počas apnoickej pauzy (zistený TCD) nedokáže úplne zabrániť cerebrálnej hypoxii, resp. poklesu saturácie mozgového tkaniva kyslíkom (zistenej pomocou NIRS). Toto zistenie podporuje hypotézu o poruche autoregulačných mechanizmov v priebehu OSA. Porucha cerebrálnych kompenzačných mechanizmov je pritom výraznejšia u závažných foriem OSA. Výsledky štúdie používajúcej NIRS naznačujú, že rekurentné apnoické pauzy, ktorých frekvencia presiahne určitú kritickú hodnotu, dokážu „vyčerpať“ cerebrovaskulárnu rezervu. Na základe toho je možné predpokladať, že akútne zmeny cerebrálnej hemodynamiky v dôsledku OSA sú ovplyvnené hlavne frekvenciou a typom respiračných udalostí, ktorých kombinácia môže viesť k poruche autoregulačných mechanizmov cerebrálnej cirkulácie a eventuálne aj k cerebrálnej hypoxii [33]. Vyšetrenie pomocou NIRS má však aj určité limitácie. Tie spočívajú hlavne v nízkej rozlišovacej schopnosti. Do úvahy je potrebné vziať aj skutočnosť, že koncentrácia hemoglobínu je pri vyšetrení pomocou NIRS stanovovaná v zmesi arteriálnej a venóznej
krvi.Stanovenie prietoku krvi mozgom pomocou jednofotónovej emisnej počítačovej tomografie a magnetickej rezonancie
Viaceré štúdie využívali na stanovenie cerebrálnej cirkulácie jednofotónovú emisnú počítačovú tomografiu (single-photon emission computed tomography; SPECT) s venóznym podaním 99Tc. Ďalšími alternatívnymi vyšetrovacími metódami na stanovenie cerebrálnej cirkulácie sú MR spektroskopia a perfúzne MR vyšetrenie. Hneď na úvod je potrebné pripomenúť významnú limitáciu týchto metód, ktorou je skutočnosť, že nie sú použiteľné pre sledovanie okamžitých zmien cerebrálneho prietoku [37,38]. Pomocou SPECT bola u pacientov so spánkovým apnoe preukázaná hypoperfúzia vo frontálnom, parietálnom, okcipitálnom laloku, cerebelle a ponse [39,40]. MR spektroskopiou bolo na základe nízkeho pomeru N-acetyl aspartát/ cholín zistené u pacientov s OSA cerebrálne poškodenie v oblasti frontálneho laloka [41]. Pomocou perfúzneho MR vyšetrenia sa u pacientov so spánkovým apnoe zistili zmeny perfúzie vo viacerých oblastiach (hipokampus, talamus, gyrus parahypocampi, predné cingulum, putamen a temporálny kortex) [42].
Realizované boli aj viaceré experimentálne štúdie na animálnych modeloch. Tie napríklad preukázali, že pokles cerebrálneho prietoku o 25 ml/ 100 g/ min viedol v inkriminovaných oblastiach k mozgovým infarktom [43]. U jedincov s OSA bol v pokojových podmienkach použitím perfúzneho MR vyšetrenia v niektorých oblastiach mozgu pozorovaný pokles cerebrálneho prietoku krvi od 7 do 16 ml/ 100 g/ min. Možno samozrejme dôvodne a logicky predpokladať, že tento pokles perfúzie môže byť ešte väčší v priebehu apnoických páuz, ktoré sa v priebehu noci často opakujú. Na základe uvedenej skutočnosti môžu zvýraznenie poklesu cerebrálneho prietoku krvi v priebehu apnoických prestávok a opakovaná rekurencia apnoických páuz významne prispievať k poškodeniu mozgu. Takéto štrukturálne a funkčné postihnutie mozgu bolo už doteraz preukázané vo viacerých jeho oblastiach [44].
Stanovenie prietoku krvi mozgom pomocou ultrazvukom modulovanej „blízkej“ infračervenej spektroskopie – naše skúsenosti
C-FLOW (Ornim Medical, Kfar Saba, Izrael) je zariadenie na priamy monitoring cerebrálneho krvného prietoku, ktoré je schválené pre použitie v USA a EÚ Americkým úradom pre potraviny a lieky (FDA). Zariadenie sa používa na kontinuálny neinvazívny monitoring prietoku krvi v tkanivách a mozgu, pričom meria relatívne zmeny v perfúzii krvi. Monitoruje v reálnom čase miestnu mikrocirkuláciu krvi v tkanivách pomocou senzorov umiestnených v blízkosti vyšetrovanej oblasti. Prístroj využíva technológiu nazývanú UTLight [45]. Zariadenie vysiela do tkaniva laserové svetlo (podobne ako NIRS). Paralelne vysiela do tkaniva aj rýchle, krátke UZ impulzy. Šírením UZ lúča tkanivom sú lokálne rozptylové centrá periodicky posúvané akustickými signálmi. Pri šírení svetla takto modulovaným objemom tkaniva dochádza k „označeniu“ (modulácii) jeho fázy a dá sa následne identifikovať. Modulované svetlo je možné fotosenzorom zhromaždiť a sériovo filtrovať ako funkciu času, ktorá zodpovedá danej relatívnej hĺbke. Analyzované sú fotóny vychádzajúce z vopred stanoveného objemu tkaniva (asi 1 cm3). Zariadenie analyzuje Dopplerov posun „označeného“ svetelného signálu a určí tak prúdenie krvi pod senzorom [45,46]. Zariadenie preukázalo signifikantnú koreláciu získaných údajov s dátami získanými invazívnym laser Dopplerom a xenónovým SPECT. Prietok krvi mozgom je tu vyjadrený pomocou indexu cerebrálneho prietoku krvi (cerebral flow index; CFI), ktorého vyššie hodnoty určujú vyššiu mieru prietoku krvi. Senzory cerebrálneho prietoku sa najčastejšie umiestňujú do frontálnej alebo temporálnej oblasti a umožňujú tak stanovenie kortikálnej mikrocirkulácie krvi v danej oblasti [47]. Zariadenie C-FLOW, senzory cerebrálneho prietoku krvi, ich umiestnenie a grafické zobrazenie CFI uvádzame na obr. 2.
Image 2. Zariadenie C-FLOW, snímače cerebrálneho prietoku krvi, ich umiestnenie a grafické zobrazenie indexu cerebrálneho prietoku krvi.
Fig. 2. C-FLOW device, blood flow sensors, their placement and a display of the cerebral flow index.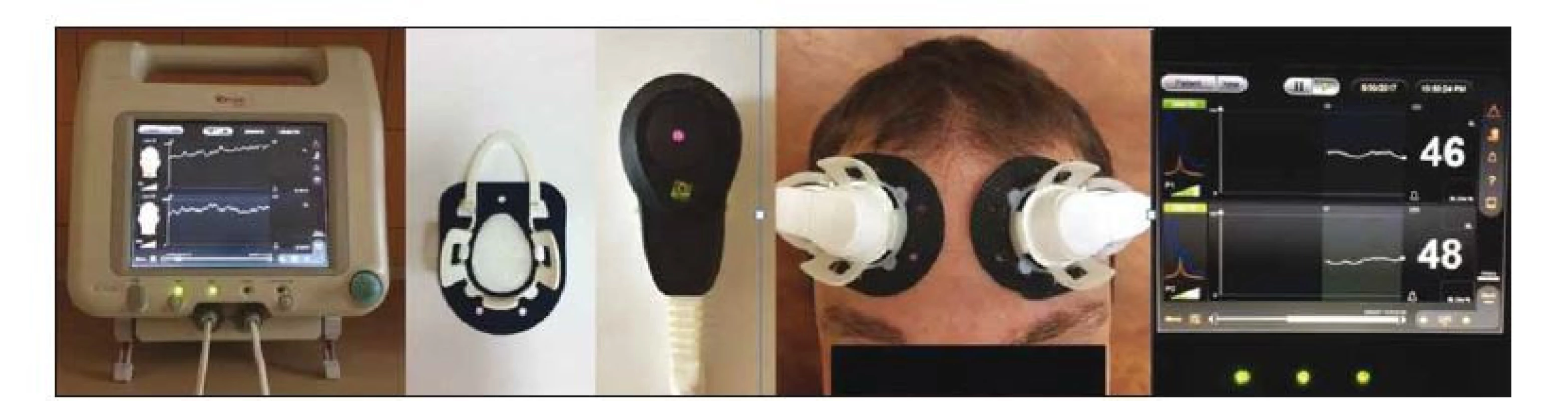
Použitie zariadenia C-FLOW na stanovenie cerebrálneho krvného prietoku u pacientov s OSA nebolo doteraz v literatúre opísané, preto pripájame aj našu prvú skúsenosť s použitím tohto zariadenia v uvedenej indikácii. V spánkovom laboratóriu I. Neurologickej kliniky LF UK a UNB sme realizovali monitorovanie prietoku krvi mozgom pomocou UZ modulovanej NIRS (zariadenie C-FLOW) súbežne s polysomnografickým vyšetrením u pacienta s anamnézou chrápania a nálezom opakovaných desaturácií pri ambulantnom nočnom vyšetrení pulznou oximetriou. Monitorovanie prietoku krvi mozgom bolo realizované počas diagnostickej noci aj počas nasledujúcej titračnej noci s použitím pretlakovej ventilácie. Synchronizácia dát z polysomnografu (Alice 6, Philips-Respironics, Andover, MA, USA) a prístroja C-FLOW bola realizovaná pomocou programu Biograph (Beset, Bratislava, Slovensko). Monitorovanie prietoku krvi mozgom pomocou prístroja C-FLOW počas polysomnografie je zobrazené na obr. 3.
Image 3. Stanovenie prietoku krvi mozgom pomocou prístroja C-FLOW počas polysomnografie.
Fig. 3. The use of C-FLOW device for the assessment of cerebral blood fl ow during polysomnography.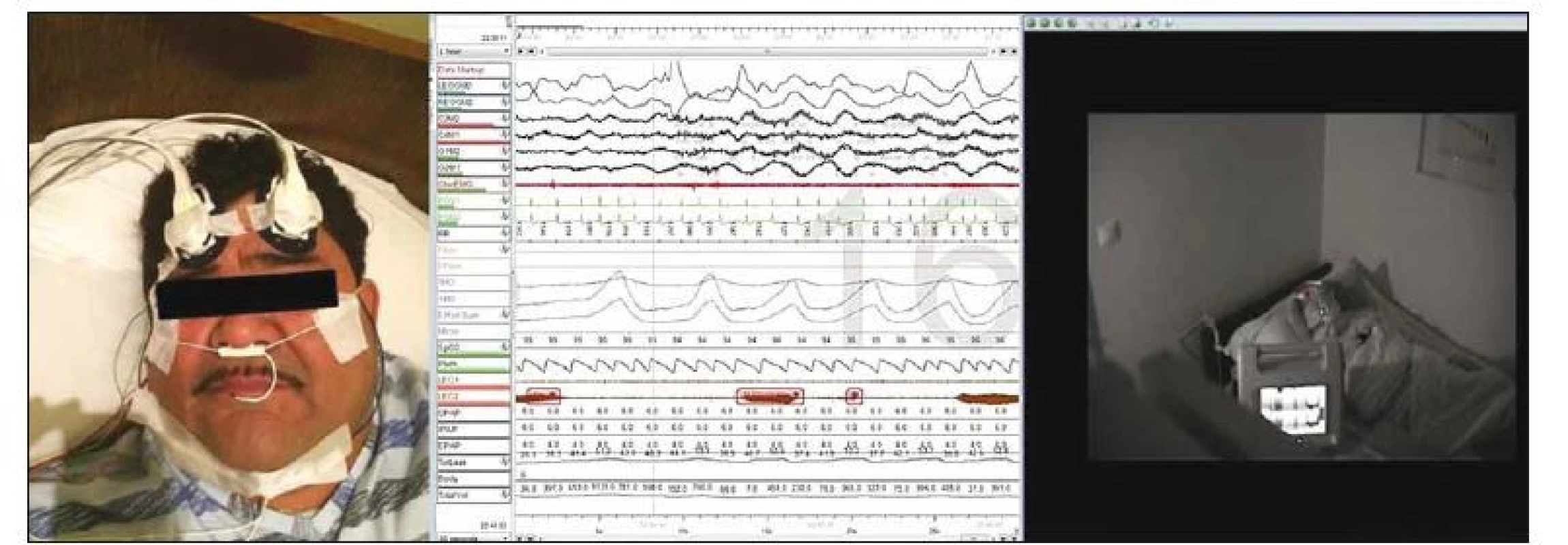
Počas diagnostickej noci sme u pacienta potvrdili OSA závažného stupňa. Respiratory disturbance index (RDI; počet respiračných udalostí za hodinu spánku) dosahoval hodnotu 59,6. Priemerná saturácia krvi kyslíkom bola 82 % a minimálna saturácia krvi kyslíkom bola 62 %. Priemerná hodnota CFI bola 43,4. Počas titračnej noci bola u pacienta aplikovaná pretlaková ventilačná liečba, ktorá bola pacientom dobre tolerovaná. Pomocou nej došlo k významnému zlepšeniu respiračných parametrov. „Zvyškové“ RDI dosahovalo hodnotu 3,6. Pozorovali sme aj vzostup priemernej saturácie krvi kyslíkom na hodnotu 89 %, minimálna saturácia krvi kyslíkom stúpla na 75 %. Počas titračnej noci sme zaznamenali aj vzostup priemernej hodnoty CFI na 51, čo vzhľadom k umiestneniu senzorov poukazuje na zvýšenie kortikálnej mikrocirkulácie krvi vo frontálnych lalokoch. Samozrejme že na formuláciu valídnejších záverov bude potrebné naše prvé výsledky overiť na väčšej populácii pacientov. Napriek tomu sa nám však zariadenie C-FLOW javí ako perspektívna metóda na monitoring cerebrálneho krvného prietoku (vzhľadom na svoju jednoduchú aplikáciu). Táto neinvazívna metóda by mohla predstavovať významný a výhodný doplnok k štandardnej polysomnografii vo vybranej populácii pacientov. Grafické zobrazenie polysomnografických premenných synchronizovaných s parametrom CFI uvádzame na obr. 4.
Image 4. Grafické zobrazenie polysomnografických premenných synchronizovaných s indexom cerebrálneho prietoku krvi (cerebral flow index) pomocou programu Biograph.
Fig. 4. Polysomnographic variables synchronized with the cerebral flow index using Biograph software.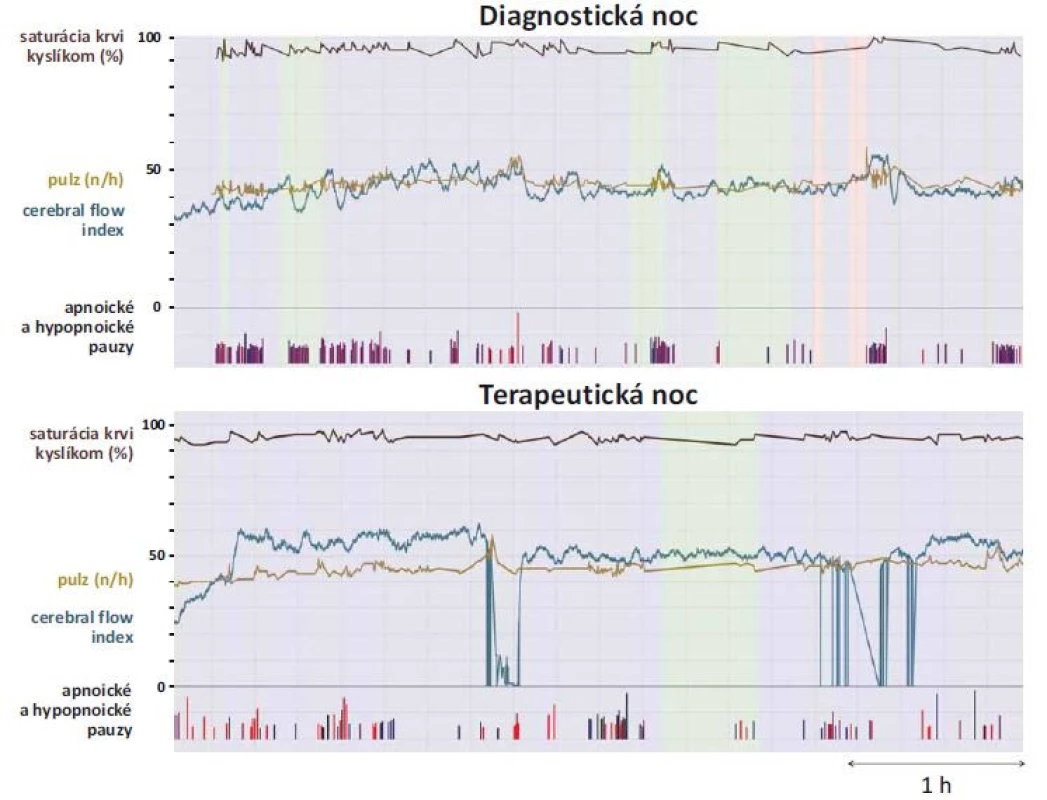
Záver
Na základe súčasných znalostí možno konštatovať, že vplyv OSA na prietok krvi mozgom zohráva významnú úlohu pri vzniku cerebrovaskulárnych komplikácií spánkových porúch dýchania. Medzi najčastejšie používané vyšetrovacie metódy, ktoré umožňujú sledovanie prietoku krvi mozgom, patrí TCD, NIRS, SPECT či MR spektroskopia. Na jednej strane doposiaľ nie je k dispozícii ideálna vyšetrovacia metóda, ktorá by spĺňala všetky požadované atribúty v zmysle neinvazívnosti, vysokej rozlišovacej schopnosti, monitorovania v reálnom čase, jednoduchosti použitia a štandardizovanosti merania. Na strane druhej však treba dodať, že zariadenia NIRS zatiaľ vyzerajú ako perspektívna metóda na monitorovanie cerebrálneho krvného prietoku. Táto metóda by mohla predstavovať doplnok aj k štandardnej polysomnografii vo vybranej populácii pacientov. Samozrejme, že vedeckovýskumný a klinický prínos tejto metodiky musia ešte overiť budúce prospektívne štúdie.
Práca bola podporená projektom „Dobudovanie centra excelentnosti pre náhle cievne mozgové príhody na Lekárskej fakulte UK v Bratislave“ spolufinancovaného zo zdrojov ES z Európskeho fondu regionálneho rozvoja – Podporujeme výskumné aktivity na Slovensku (ITMS 26240120023).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 11. 12. 2018
Přijato do tisku: 29. 4. 2019
MUDr. Pavel Šiarnik, Ph.D.
I. Neurologická klinika LF UK a UN Bratislava
Mickiewiczova 13 813 69 Bratislava
Slovenská republika
e-mail: palo.siarnik@gmail.com
Sources
1. Yaggi HK, Concato J, Kernan WN et al. Obstructive sleep apnea as a risk factor for stroke and death. N Engl J Med 2005; 353(19): 2034–2041. doi: 2010.1056/ NEJMoa043104.
2. Siarnik P, Kollar B, Carnicka Z et al. Association of sleep disordered breathing with wake-up acute ischemic stroke: a full polysomnographic study. J Clin Sleep Med 2016; 12(4): 549–554. doi: 510.5664/ jcsm.5688.
3. Munoz R, Duran-Cantolla J, Martinez-Vila E et al. Severe sleep apnea and risk of ischemic stroke in the elderly. Stroke 2006; 37(9): 2317–2321. doi: 10.1161/ 01.STR.0000236560.15735.0f.
4. Redline S, Yenokyan G, Gottlieb DJ et al. Obstructive sleep apnea-hypopnea and incident stroke: the sleep heart health study. Am J Respir Crit Care Med 2010; 182(2): 269–277. doi: 10.1164/ rccm.200911-1746OC.
5. Urbano F, Roux F, Schindler J et al. Impaired cerebral autoregulation in obstructive sleep apnea. J Appl Physiol (1985) 2008; 105(6): 1852–1857. doi: 10.1152/ japplphysiol.90900.2008.
6. Balfors EM, Franklin KA. Impairment of cerebral perfusion during obstructive sleep apneas. Am J Respir Crit Care Med 1994; 150(6 Pt 1): 1587–1591. doi: 10.1164/ ajrccm.150.6.7952619.
7. Klingelhöfer J, Hajak G, Sander D et al. Assessment of intracranial hemodynamics in sleep apnea syndrome. Stroke 1992; 23(10): 1427–1433.
8. Daulatzai MA. Cerebral hypoperfusion and glucose hypometabolism: key pathophysiological modulators promote neurodegeneration, cognitive impairment, and Alzheimer‘s disease. J Neurosci Res 2017; 95(4): 943–972. doi: 910.1002/ jnr.23777.
9. Kielb SA, Ancoli-Israel S, Rebok GW et al. Cognition in obstructive sleep apnea-hypopnea syndrome (OSAS): current clinical knowledge and the impact of treatment. Neuromolecular Med 2012; 14(3): 180–193. doi: 110.1007/ s12017-12012-18182-12011.
10. Kiratli PO, Demir AU, Volkan-Salanci B et al. Cerebral blood flow and cognitive function in obstructive sleep apnea syndrome. Hell J Nucl Med 2010; 13(2): 138–143.
11. American Academy of Sleep Medicine. International classification of sleep disorders. 3rd ed. Darien: American Academy of Sleep Medicine 2014 : 383.
12. Shiomi T, Guilleminault C, Stoohs R et al. Leftward shift of the interventricular septum and pulsus paradoxus in obstructive sleep apnea syndrome. Chest 1991; 100(4): 894–902.
13. Somers VK, White DP, Amin R et al. Sleep apnea and cardiovascular disease: an American Heart Association/ American College of Cardiology Foundation scientific statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing In Collaboration With the National Heart, Lung, and Blood Institute National Center on Sleep Disorders Research (National Institutes of Health). J Am Coll Cardiol 2008; 52(8): 686–717. doi: 10.1016/ j.jacc.2008.05.002.
14. Tkáčová R. Spánkové apnoe a ochorenia kardiovaskulárného systému. Praha: Galén 2006 : 194.
15. Hedner J, Ejnell H, Sellgren J et al. Is high and fluctuating muscle nerve sympathetic activity in the sleep apnoea syndrome of pathogenetic importance for the development of hypertension? J Hypertens 1988; 6 (Suppl 4):S529–S531.
16. Franklin KA. Cerebral haemodynamics in obstructive sleep apnoea and Cheyne-Stokes respiration. Sleep Med Rev 2002; 6(6): 429–441.
17. Somers VK, Javaheri S. Cardiovascular effects of sleep-related breathing disorders. In: Kryger MH (ed). Principles and practice of sleep medicine. Saunders: Elsevier Inc. 2005 : 1180–1191.
18. Hill CM, Hogan AM, Onugha N et al. Increased cerebral blood flow velocity in children with mild sleep-disordered breathing: a possible association with abnormal neuropsychological function. Pediatrics 2006; 118(4): e1100–e1108.
19. Aaslid R, Markwalder TM, Nornes H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries. J Neurosurg 1982; 57(6): 769–774. doi: 710.3171/ jns.1982.3157.3176.0769.
20. Klingelhöfer J, Hajak G, Sander D et al. Assessment of intracranial hemodynamics in sleep apnea syndrome. Stroke 1992; 23(10): 1427–1433.
21. Balfors EM, Franklin KA. Impairment of cerebral perfusion during obstructive sleep apneas. Am J Respir Crit Care Med 1994; 150 (6 Pt 1): 1587–1591. doi: 1510.1164/ ajrccm.1150.1586.7952619.
22. Hajak G, Klingelhöfer J, Schulz-Varszegi M et al. Sleep apnea syndrome and cerebral hemodynamics. Chest 1996; 110(3): 670–679.
23. Rieke K, Poceta JS, Mitler MM et al. Continuous blood flow velocity measurements in obstructive sleep apnea syndrome. J Neuroimag 1992; 2(4): 202–207. doi: 10.1016/ j.permed.2012.02.021.
24. Narkiewicz K, Somers VK. Sympathetic nerve activity in obstructive sleep apnoea. Acta Physiol Scand 2003; 177(3): 385–390. doi: 10.1046/ j.1365-201X.2003.01091.x.
25. Dincer HE, O‘Neill W. Deleterious effects of sleep-disordered breathing on the heart and vascular system. Respiration 2006; 73(1): 124–130. doi: 10.1159/ 000089814.
26. Somers VK, Dyken ME, Mark AL et al. Parasympathetic hyperresponsiveness and bradyarrhythmias during apnoea in hypertension. Clin Auton Res 1992; 2(3): 171–176.
27. Prilipko O, Huynh N, Thomason ME et al. An fMRI study of cerebrovascular reactivity and perfusion in obstructive sleep apnea patients before and after CPAP treatment. Sleep Med 2014; 15(8): 892–898. doi: 810.1016/ j.sleep.2014.1004.1004.
28. Faraci FM, Heistad DD. Regulation of the cerebral circulation: role of endothelium and potassium channels. Physiol Rev 1998; 78(1): 53–97. doi: 10.1152/ physrev.1998.1178.1151.1153.
29. Jelic S, Padeletti M, Kawut SM et al. Inflammation, oxidative stress, and repair capacity of the vascular endothelium in obstructive sleep apnea. Circulation 2008; 117(17): 2270–2278. doi: 2210.1161/ CIRCULATIONAHA.2107.741512.
30. Jiménez Caballero PE, Coloma Navarro R, Ayo Martín O et al. Cerebral hemodynamic changes in obstructive sleep apnea syndrome after continuous positive airway pressure treatment. Sleep Breath 2013; 17(3): 1103–1108. doi: 1110.1007/ s11325-11013-10810-y.
31. Coloma Navarro R, Jiménez Caballero PE, Vega G et al. Cerebral hemodynamics is altered in patients with sleep apnea/ hypopnea syndrome. Springerplus 2016; 5 : 51. doi: 10.1186/ s40064-40016-41691-x.
32. Morgan BJ, Reichmuth KJ, Peppard PE et al. Effects of sleep-disordered breathing on cerebrovascular regulation: a population-based study. Am J Respir Crit Care Med 2010; 182(11): 1445–1452. doi: 1410.1164/ rccm.201002-200313OC.
33. Pizza F, Biallas M, Wolf M et al. Nocturnal cerebral hemodynamics in snorers and in patients with obstructive sleep apnea: a near-infrared spectroscopy study. Sleep 2010; 33(2): 205–210.
34. Hayakawa T, Terashima M, Kayukawa Y et al. Changes in cerebral oxygenation and hemodynamics during obstructive sleep apneas. Chest 1996; 109(4): 916–921.
35. Valipour A, McGown AD, Makker H et al. Some factors affecting cerebral tissue saturation during obstructive sleep apnoea. Eur Respir J 2002; 20(2): 444–450.
36. McGown AD, Makker H, Elwell C et al. Measurement of changes in cytochrome oxidase redox state during obstructive sleep apnea using near-infrared spectroscopy. Sleep 2003; 26(6): 710–716.
37. Meyer JS, Sakai F, Karacan I et al. Sleep apnea, narcolepsy, and dreaming: regional cerebral hemodynamics. Ann Neurol 1980; 7(5): 479–485. doi: 410.1002/ ana.410070515.
38. Fischer AQ, Chaudhary BA, Taormina MA et al. Intracranial hemodynamics in sleep apnea. Chest 1992; 102(5): 1402–1406.
39. Shiota S, Inoue Y, Takekawa H et al. Effect of continuous positive airway pressure on regional cerebral blood flow during wakefulness in obstructive sleep apnea. Sleep Breath 2014; 18(2): 289–295. doi: 210.1007/ s11325-11013-10881-11329.
40. Ficker JH, Feistel H, Möller C et al. [Changes in regional CNS perfusion in obstructive sleep apnea syndrome: initial SPECT studies with injected nocturnal 99mTc-HMPAO]. Pneumologie 1997; 51(9): 926–930.
41. O‘Donoghue FJ, Wellard RM, Rochford PD et al. Magnetic resonance spectroscopy and neurocognitive dysfunction in obstructive sleep apnea before and after CPAP treatment. Sleep 2012; 35(1): 41–48. doi: 10.5665/ sleep.1582.
42. Innes CR, Kelly PT, Hlavac M et al. Decreased regional cerebral perfusion in moderate-severe obstructive sleep apnoea during wakefulness. Sleep 2015; 38(5): 699–706. doi: 610.5665/ sleep.4658.
43. Murphy BD, Chen X, Lee TY. Serial changes in CT cerebral blood volume and flow after 4 hours of middle cerebral occlusion in an animal model of embolic cerebral ischemia. AJNR Am J Neuroradiol 2007; 28(4): 743–749.
44. Yadav SK, Kumar R, Macey PM et al. Regional cerebral blood flow alterations in obstructive sleep apnea. Neurosci Lett 2013; 555 : 159–164. doi: 10.1016/ j.neulet.2013.1009.1033.
45. C-FLOW Specifications. [online]. Available from URL:http: / / www.ornim.com/ wp-content/ uploads/ 2016/ 03/ ornim_medical-c_flow-cflow-MGG1087A_specs.pdf.
46. UTLight Technology. [online]. Available from URL: http: / / www.ornim.com/ wp-content/ uploads/ 2015/ 11/ UTL_MGG1020C_1cm.pdf.
47. Schytz HW, Guo S, Jensen LT et al. A new technology for detecting cerebral blood flow: a comparative study of ultrasound tagged NIRS and 133Xe-SPECT. Neurocrit Care 2012; 17(1): 139–145. doi: 110.1007/ s12028-12012-19720-12022.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue 3-
All articles in this issue
- Neuromuskulární choroby a gravidita
- Sú neskoré komplikácie Parkinsonovej choroby skutočne neskoré? ÁNO
- Jsou pozdní hybné komplikace u Parkinsonovy nemoci skutečně pozdní? NÉ
- Jsou pozdní hybné komplikace u Parkinsonovy nemoci skutečně pozdní?
- Obštrukčné spánkové apnoe a prietok krvi mozgom
- Stručná analýza četnosti použití a spektra animálních modelů ve výzkumu cévních mozkových příhod
- Faktory ovlivňující školní život dětí s epilepsií
- Poruchy cirkadiánního systému u Huntingtonovy choroby – implikace pro terapii světlem
- Zkušenosti s elektrofyziologickou diagnostikou profesionální léze loketního nervu v oblasti lokte
- Test mince v ruce k detekci předstírání oslabeného paměťového výkonu ve srovnání s mírnou kognitivní poruchou a s mírnou demencí u Alzheimerovy nemoci
- Neuropatická komponenta bolesti u pacientů s myotonickou dystrofií 2. typu – pilotní studie
- Může být prospěšná endarterektomie zevní karotické tepny? Kritický přehled
- Vliv multidisciplinárního rehabilitačního programu během hospitalizace na posturální stabilitu a stabilitu chůze u Huntingtonovy nemoci – pilotní studie
- Měření terče zrakového nervu a sítnice pomocí optické koherentní tomografie u nově diagnostikované idiopatické intrakraniální hypertenze bez ztráty zraku
- Ekvivalence alternativních verzí Montrealského kognitivního testu
- Bezrámová a bezpinová metoda pro provedení hluboké mozkové stimulace
- Využití vakuově-kompresní terapie v léčbě syndromu karpálního tunelu jako součást fyzioterapie – pilotní studie
- Aneuryzma arteria choroidea anterior
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Test mince v ruce k detekci předstírání oslabeného paměťového výkonu ve srovnání s mírnou kognitivní poruchou a s mírnou demencí u Alzheimerovy nemoci
- Neuromuskulární choroby a gravidita
- Měření terče zrakového nervu a sítnice pomocí optické koherentní tomografie u nově diagnostikované idiopatické intrakraniální hypertenze bez ztráty zraku
- Využití vakuově-kompresní terapie v léčbě syndromu karpálního tunelu jako součást fyzioterapie – pilotní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

