-
Medical journals
- Career
Genetické a neurobiologické aspekty komorbidního výskytu poruch autistického spektra a epilepsie
Authors: P. Danhofer 1; O. Horák 1; Š. Aulická 1; K. Česká 1; J. Pejčochová 1; L. Fajkusová 2; H. Ošlejšková 1
Authors‘ workplace: Klinika dětské neurologie LF MU a FN Brno, Centrum pro epilepsie Brno 1; Centrum molekulární biologie a genové terapie Interní hematoonkologické kliniky LF MU a FN Brno 2
Published in: Cesk Slov Neurol N 2019; 82(2): 148-154
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2019148Overview
Poruchy autistického spektra (PAS) se řadí mezi neurovývojové a neuropsychiatrické poruchy s klinickou manifestací v dětském věku. V posledních letech se tato porucha dostává do popředí vědeckého zájmu, a to především z důvodu narůstající prevalence až na 1/ 68 v roce 2014. Odhalují se genetické příčiny poruchy a patofyziologické mechanizmy, které by se na rozvoji PAS mohly podílet. Komorbidní výskyt s epilepsií je poměrně častý, a to až ve 46 % případů. Práce shrnuje dosavadní poznatky v této oblasti se zaměřením na hypotézu excitačně-inhibiční nerovnováhy. Jsou probrány i některé genetické příčiny PAS a současné možnosti diagnostiky. Patofyziologie komorbidního výskytu PAS a epilepsie je diskutována z pohledu možných terapeutických intervencí.
Klíčová slova:
autizmus – epilepsie – poruchy autistického spektra – genetika – PAS
Poruchy autistického spektra
Poruchy autistického spektra (PAS) se řadí mezi neurovývojové a neuropsychiatrické poruchy s klinickou manifestací v dětském věku charakterizované potížemi v sociální interakci a komunikaci, omezenými zájmy a repetitivními prvky v chování. Příznaky přetrvávají celoživotně a děti s PAS proto po 18. roce věku přecházejí do péče lékařů pro dospělé pacienty.
Častěji se PAS vyskytují u mužů v poměru 4 : 1. Odhadovaná prevalence PAS v populaci se zvýšila z 1/ 476 – 1/ 323 v 90. letech 20. století [1,2] na 1/ 68 v roce 2014 [3]. Takový značný nárůst prevalence může být dán zčásti zvýšenou informovaností a povědomím populace o této poruše, zčásti i změnami v diagnostických postupech. Svůj podíl mohou mít i faktory ze strany matky a faktory prostředí. Infekce plodu v prenatálním období může negativně zasáhnout do vývoje imunoregulačních mechanizmů [4], podstatný vliv je přikládán febriliím [5]. Dále jsou studovány např. zvýšená koncentrace toxických látek v ovzduší [6] a vliv těžkých kovů, kde výsledky jsou kontroverzní [7,8].
V oblasti klasifikace PAS byla během posledních let provedena celá řada změn. Autizmus lze dělit na vysokofunkční a nízkofunkční (na podkladě kognitivního profilu), autizmus s regresí nebo bez ní (s ohledem na vývojové aspekty), syndromický nebo nesyndromický aj. U nesyndromického autizmu je PAS primární diagnózou a není součástí komplexní poruchy, která je charakterizována vývojovými abnormitami a malformacemi. Naproti tomu u syndromického (atypického) autizmu je znám genetický syndrom, v rámci něhož část pacientů vykazuje PAS (např. Angelmanův syndrom, syndrom fragilního chromozomu X, Rettův syndrom).
Pro klinické účely vycházejí v ČR diagnostická kritéria PAS z mezinárodní klasifikace nemocí MKN-10. Zde se autizmus řadí mezi pervazivní neurovývojové poruchy (F84.0–F84.9). Praktičtější je, a to především z pohledu možnosti srovnání pacientů se soubory publikovanými ve světovém písemnictví, využití klasifikace DSM (diagnostický a statistický manuál). Tato klasifikace nemocí zařadila PAS do svého obsahu ve svém třetím vydání a od té doby prošla celou řadou změn. Kritéria PAS v DSM-III [9] vycházela z původních Kannerových případů [10] a byla poměrně přísná. DSM-IV [11] poté spektrum autizmu rozšířilo o případy méně závažně (pervazivní vývojové poruchy jinak nespecifikované [PDD-NOS] a Aspergerův syndrom). Poslední revize DSM-V z roku 2013 [12] kombinuje všechny podskupiny do jedné diagnózy poruch autistického spektra. PAS se již nedělí do jednotlivých subkategorií, ale diferencují se pouze varianty autizmu [12].
Současným zlatým standardem v diagnostice autizmu je podrobná psychologicko-psychiatrická anamnéza a testování alespoň dvěma škálami – celosvětově uznávaným nástrojem je The Autism Diagnostic Interview – Revised (ADI-R) a The Autism Diagnostic Observation Schedule (ADOS). Testování musí provádět specialista na PAS. ADI-R je velmi podrobná dotazníková škála založená na strukturovaném pohovoru s rodiči. ADOS je standardizovaný diagnostický test, který skóruje na základě přímé observace dítěte a zohledňuje i jeho vývojový stupeň a věk. Je doporučován jako vhodný standardizovaný diagnostický observační nástroj. Vyšetřující nabízí dítěti interaktivní aktivity, které jsou navrženy tak, aby bylo možno hodnotit sociální interakci a komunikaci i repetitivní prvky v chování, jež jsou podkladem diagnostiky PAS [13].
Na Klinice dětské neurologie LF MU a FN Brno byla v roce 2007 provedena retrospektivní studie 204 dětí s PAS s cílem zjistit, zda je diagnóza stanovena časně nebo dochází ke zpoždění v diagnostickém procesu. Závěrem této studie bylo, že diagnostika autizmu je často provedena pozdě, a tím je znemožněno zahájení časných edukačních, behaviorálních a léčebných intervencí [14]. Zvýšené povědomí o PAS, lepší informovanost široké veřejnosti a formování týmů specialistů, kteří se zabývají diagnostikou této poruchy, přináší v tomto ohledu slibné výsledky a v současné době lze konstatovat, že u většiny pacientů je diagnostika PAS dokončena před dosažením 5. roku věku [15].
Epilepsie u pacientů s PAS
Komorbidní výskyt autizmu a epilepsie byl znám již od doby, kdy byl autizmus poprvé popsán Leo Kannerem v roce 1943 [10]. Je všeobecně známo, že u pacientů s autizmem je výskyt epilepsie vyšší než v běžné populaci. Prevalence však kolísá v poměrně širokém rozmezí – 2 [16] až 46 % [17]. Na Klinice dětské neurologie LF MU a FN Brno bylo hodnoceno 205 dětí s PAS ve vztahu ke komorbidnímu výskytu epilepsie nebo epileptiformní aktivity v EEG. PAS byly spojeny s epileptickými záchvaty ve 40 % případů a s epileptiformní aktivitou v EEG bez manifestních záchvatů ve 20 % případů. Nejvyšší výskyt epilepsie byl ve skupině dětí s dětským autizmem (66 %) a atypickým autizmem (30,1 %). Nejnižší výskyt byl zjištěn u dětí s Aspergerovým syndromem (3,9 %) [18]. Výsledky studií jsou značně nekonzistentní [16,17]. Je to dáno především opakovanými změnami v klasifikačních schématech a různými diagnostickými postupy. Velký podíl nese i spektrum vyšetřovaných pacientů. Obecně lze říci, že soubory z terciárních center soustřeďující „komplikovanější“ pacienty (tj. často farmakorezistentní s četnějšími komorbiditami) vykazují vyšší výskyt komorbidního výskytu PAS a epilepsie ve srovnání se soubory „běžných“ pacientů s PAS dispenzarizovaných v sektorovém ambulantním provozu.
Faktory diskutované v souvislosti s výskytem epilepsie u pacientů s PAS
Deficit intelektu
Přítomnost intelektového deficitu u PAS (tj. IQ < 70) je běžně asociována se zvýšenou mírou výskytu komorbidní epilepsie. Metaanalýza z roku 2008, která studovala data z publikovaných studií z let 1963 – 2006, ukazuje prevalenci epilepsie u dětí s PAS mladších 12 let 21,4 % v případě přítomného intelektového deficitu ve srovnání s 8 % u dětí bez deficitu v intelektu [19]. Další metaanalýza – z roku 2012, která zahrnula jen studie, kde follow-up byl delší než 12 měsíců, ukázala prevalenci 23,7, resp. 1,8 % [20]. Silná asociace mezi intelektovým deficitem a epilepsií u dětí s PAS vysvětluje nižší výskyt epilepsie u pacientů s Aspergerovým syndromem, kde je intelekt normální.
Pohlaví
Existuje zvýšené riziko epilepsie u dívek s PAS ve srovnání s chlapci [21].
Etiologie onemocnění
Výskyt epilepsie u pacientů s nesyndromickým neboli idiopatickým autizmem je nižší než u pacientů se syndromickým (atypickým) autizmem. Například dle výsledků jedné studie 20 % u nesyndromické formy ve srovnání s 33 % u syndromických PAS [22]. I přesto je ale i u pacientů s idiopatickou formou PAS výskyt epilepsie vyšší než v běžné populaci. Syndromické formy PAS spojené s epilepsií jsou popsány např. u Rettova syndromu, Rett-like syndromů (mutace v genu pro methyl CpG binding protein 2 [MECP2], mutace v genu pro cyclin-dependent kinase-like 5 [CDKL5]), Angelmanova syndromu (mutace v genu pro ubiquitin-protein ligázu E3A [UBE3A]), tuberózní sklerózy (mutace v genu pro tuberous sclerosis complex [TSC] 1 a TSC2), neurofibromatózy typu I (mutace v genu pro neurofibromin 1 [NF1]), Dravetova syndromu (mutace v genu pro sodium voltage-gated channel alpha subunit 1 [SCN1A]), tedy syndromů, se kterými se v praxi setkáváme nejčastěji.
Vývojový regres
Vývojový regres je definován jako ztráta již dříve naučených dovedností. Odhaduje se, že zhruba 30 % pacientů s PAS prochází vývojovým regresem, který se typicky objevuje mezi 18. a 24. měsícem věku [23]. Výskyt epilepsie a/ nebo epileptiformní patologie v EEG je považován za rizikový faktor pro přítomnost vývojového regresu [23,24].
Vliv epilepsie a/ nebo epileptiformní aktivity v EEG na rozvoj PAS
Předpokládá se, že epileptiformní abnormita se může spolupodílet na rozvoji neuropsychologického deficitu u pacientů s PAS. Studie 77 dětí s PAS prokázala, že epileptiformní výboje v EEG jsou signifikantně více spojeny s abnormálním vývojem v 1. roce života [24]. Například u Rettova syndromu, syndromu fragilního X, Angelmanova syndromu nebo Prader-Williho syndromu lze současně nalézt jak patologii v EEG, tak i příznaky PAS. Je však nutné brát v úvahu, že nejsme schopni přesně vystopovat, kdy se epileptiformní aktivita v EEG u daného pacienta objevila poprvé. Je ovšem možné, že epileptiformní výboje v EEG, které se objeví v kritickém období vývoje, jsou částečně odpovědné za rozvoj autistických symptomů [25] nebo se mohou asociovat s autistickým regresem u těchto dětí [24].
Epileptiformní výboje mohou mít negativní dopad na senzorické, paměťové a vyšší kognitivní funkce, a to především pokud se vyskytují ve spánku, který je považován za klíčový v procesech učení a paměti. Toto je patrno zvláště u pacientů s Landau-Kleffnerovým syndromem, kde se ve spánku setkáváme s kontinuálními výboji v EEG. Pacienti mají těžký kognitivní deficit a často i PAS [26]. Potlačení výbojů antiepileptickou medikací však nepřináší vždy jednoznačný a předvídatelný efekt [27].
Vidíme tedy, že epileptiformní výboje v EEG mají dopad na kognitivní funkce pacienta, ale potlačení výbojů nevede k předpokládanému zlepšení neuropsychologického profilu. V takovém případě je nutné zvažovat i jiné faktory, které se dostávají do hry, jak je probíráno dále v textu.
Zvířecí modely ukazují, že pokud je epilepsie provokována epileptickým statem (status epilepticus; SE), lze pozorovat rozvoj aseptického zánětu, objevují se poruchy buněčného metabolizmu a poruchy na úrovni iontových kanálů a receptorů. Rozvíjí se poruchy vedení vzruchu, tvoří se aberantní neuronální sítě. Nakonec může dojít až k apoptóze buněk. Zároveň jsou poškozeny neuronální okruhy citlivé na rozvoj dalších záchvatů a nejsou schopny udržet normální kognitivní funkce [28]. Pravda je, že samotný SE se často objevuje jako důsledek zánětu, infekce nebo traumatu. Pak je obtížné rozlišit, jaký je podíl samotného etiologického procesu a jak se v rozvoji kognitivního deficitu uplatňuje následný SE. Potlačení záchvatů však vede jen k minimálnímu zlepšení kognitivního profilu pacientů. Proto je možné, že samotná příčina epilepsie může vést přímo k poškození neuropsychologických funkcí autistických pacientů [25] více než další epileptický proces.
Etiopatogeneze komorbidního výskytu epilepsie a PAS
Genetické aspekty v patogenezi komorbidního výskytu epilepsie a PAS
Studie s dvojčaty ukazují, že dědičnost PAS je zhruba 85 – 92 % [29,30]. I v případě, že se nepodaří identifikovat mutaci odpovědnou za rozvoj PAS, je riziko pro další potomky vyšší [31]. V etiopatogenezi PAS se předpokládá role jak vzácných, tak běžných variant genů. S pokrokem na poli molekulárně-genetických technologií (jako jsou chromozomální microarray technologie nebo celoexomové sekvenování – whole exome sequencing) bylo identifikováno více než 800 chromozomálních lokusů a genů, které by mohly být asociovány s PAS, což poukazuje na vysoce heterogenní genetickou architektoniku této poruchy [3]. Geny a jejich příslušné proteiny se uplatňují v celé řadě biologických procesů, např. remodelaci chromatinu, regulaci genové transkripce, buněčném růstu a proliferaci a v neuronálně specifických procesech, jako jsou např. synaptická organizace a aktivita, dendritická morfologie a axonogeneze [3].
Přehlednou databází genů asociovaných s PAS je Simons Foundation Autism Research Initiative (SFARI) gene [32]. Databáze podává informace o hladině významnosti dané mutace na podkladě výsledků zvířecích a humánních studií. Všechny geny, pro které existuje hladina úrovně důkazu v diagnostice PAS, jsou skórovány v databázi: 1 – vysoce důvěryhodný a 2 – silný kandidátní gen. Je jich 51 (aktuální počet v roce 2018) a jsou uvedeny souhrnně v tab. 1.
Table 1. Přehled genů se skóre 1 a 2 z databáze genů asociovaných s autismem SFARI gene: „1“ – vysoce důvěryhodný a „2“ – silný kandidátní gen. 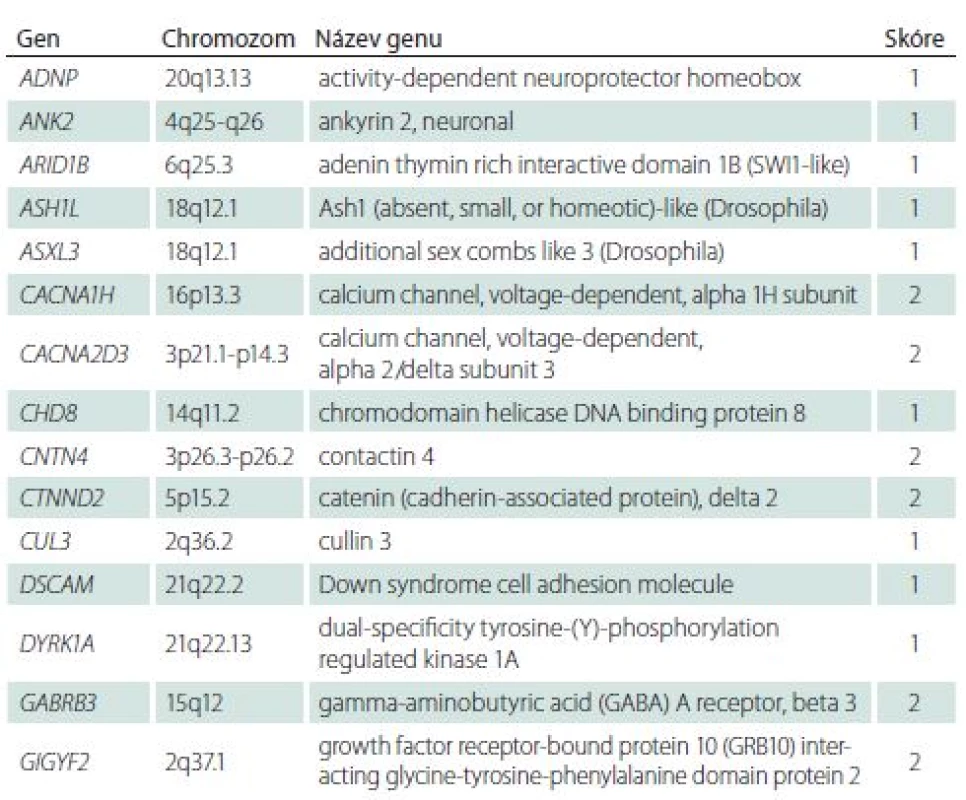
FYVE – Fab 1 (yeast orthologue of PIKfyve), YOTB, Vac 1 (vesicle transport protein), and EEA1 SFARI – Simons Foundation Autism Research Initiative 
Co se týká komorbidního výskytu PAS a epilepsie, riziko rozvoje epilepsie u dětí s PAS je 12,8 %, u jejich sourozenců 2,3 %, což je 2× vyšší riziko než v běžné populaci. Genetické pozadí se tedy týká nejen PAS, ale i epilepsie v rodinách s mnohočetným výskytem autizmu [33,34]. Vztah mezi PAS a epilepsií zůstává nejasný; může zde být kauzální vztah mezi těmito dvěma poruchami (především v případě epileptických encefalopatií či syndromického autizmu) nebo jsou obě výsledkem stejného neuropatofyziologického procesu. V každém případě se předpokládá, že na rozvoj PAS a epilepsie mají vliv nejen dědičné, ale i další faktory [25], jak bude detailněji probráno dále.
Imunitní faktory v patogenezi komorbidního výskytu epilepsie a PAS
Zánětlivé procesy v CNS hrají poměrně významnou roli ve společné patogenezi epilepsie a PAS. Jejich dopadem mohou být změny indukované mediátory zánětu v excitačních neuronálních sítích.
U komorbidního výskytu PAS a epilepsie nacházíme zvýšení HMBG-1 (high mobility group box protein 1), klíčové zánětlivé molekuly, která aktivuje signální cestu přes interleukin (IL)-1 a IL-1ß. U pacientů s PAS toto zvýšení koreluje s postižením v sociální interakci [35]. Stejně tak zvýšení exprese HMBG-1 bylo detekováno v hipokampu pacientů s epilepsií temporálního laloku (TLE) [36] a dětí s febrilními křečemi [37]. Poznatky opět ukazují na aktivaci IL-1 signální kaskády vedoucí k zánětlivé reakci se zvýšenou excitabilitou v neuronálních sítích. Ukazuje se, že antagonisté HMBG-1 jsou v preklinických studiích účinné v kontrole záchvatů [36].
U pacientů s PAS bylo detekováno zvýšení Th1 prozánětlivých cytokinů (např. IL-6, tumor necrosis factor α [TNF-α] a interferon γ [IFN-γ]), hladina protizánětlivých Th2 cytokinů (např. IL-4, IL-5, IL-10) zůstává nezměněna. U pacientů tím dochází ke zvýšení poměru Th1/ Th2 (T-helper lymphocytes 1/ T-helper lymphocytes 2). Periferní lymfocyty u pacientů s PAS vykazují 2× vyšší hladiny prozánětlivých cytokinů ve srovnání s kontrolami. Pokud byl TNF-α vyšetřen u všech nepostižených sourozenců pacientů s PAS, byla zjištěna opět signifikantně vyšší hladina této molekuly, což svědčí pro určitý podíl genetiky v nastavení zánětlivých signálních kaskád [38]. Stejně tak byla zjištěna elevace prozánětlivých cytokinů (TNF-α, IL-1β a IL-6) u pacientů s TLE. Tyto cytokiny mají in vivo i in vitro prokázaný prokonvulzivní efekt [39].
Dalšími společnými patofyziologickými vodítky mezi PAS a epilepsií mohou být porucha integrity hematoencefalické bariéry (HEB), mikrogliální aktivace a zánět indukovaný stresem. Mastocyty lokalizované v hypotalamu mohou být aktivovány stresem, jak bylo pozorováno u pacientů s PAS, a mohou vést k poruše HEB. Aktivace mastocytů vede ke spuštění prozánětlivých kaskád (např. exprese IL-6, vaskulárního endoteliálního růstového faktoru – vascular endothelial growth factor [VEGF]), které mají dopad na úrovni tight junctions HEB, což způsobuje poruchu její integrity [40]. Porucha integrity HEB byla zjištěna i na modelech chronické epilepsie, kde je opět důsledkem aktivace prozánětlivých signálních kaskád [41].
Společným důsledkem aktivace zánětlivého procesu u pacientů s PAS a epilepsií je zvýšení excitability mozku a progrese klinického vyjádření obou syndromů. Následkem zvýšení excitability v mozkových neuronálních okruzích nastane porucha excitačně-inhibiční (E/ I) rovnováhy, která představuje velmi křehké ekvilibrium mezi excitačními a inhibičními vlivy mozku. Dochází pak k nekontrolovatelným neuronálním výbojům a rozvoji záchvatů, jak bude blíže vysvětleno v další kapitole [25]. U pacientů s PAS a epilepsií byla v post mortem studiích zjištěna astroglióza, odpovědná za poruchu zpětného vychytávání glutamátu, což vede ke zvýšení jeho extracelulárních hladin a zvýšení excitability. Aktivace mikroglie (opět pozorována u obou procesů) zvýšení glutamátu ještě podporuje. Stejný efekt má aktivace IL-6, která stimuluje tvorbu excitačních synapsí [42].
Hypotéza společného patofyziologického mechanizmu komorbidní epilepsie a PAS
Shrnutím výše uvedených pozorování a výsledků lze předpokládat, že autizmus a epilepsie mohou mít alespoň v některých případech společný neurobiologický podklad. Jak bylo uvedeno v úvodu, existují syndromy, pro které je společný výskyt těchto dvou diagnóz typický. Právě v těchto případech je patrné a všeobecně přijímané, že jak PAS, tak epilepsie mohou mít společnou genetickou příčinu, která postihuje synaptické funkce a vývoj mozku. Jedna z nejrozšířenějších hypotéz, která popisuje komorbidní výskyt PAS a epilepsie, předpokládá, že neurovývojový defekt různého původu (např. genetického, metabolického, imunitního nebo působením faktorů vnějšího prostředí) vede ke změně struktury excitačních a inhibičních okruhů, což má za následek rozvoj perzistující E/I nerovnováhy [42]. Tento vztah ilustruje obr. 1 [43].
Image 1. Schematické znázornění patofyziologického modelu komorbidního výskytu poruch autistického spektra a epilepsie – hypotéza excitačně-inhibični nerovnováhy. Převzato a modifikováno z [43]. GABA – gama aminomáselná kyselina
Fig. 1. Schematic representation of the pathophysiological model of the comorbid occurence of autism spectrum disorder and epilepsy – hypothesis of excitatory-inhibitory dysbalance. Taken and modified from [43]. GABA – gamma-aminobutyric acid![Schematické znázornění patofyziologického modelu komorbidního výskytu poruch autistického spektra a epilepsie – hypotéza excitačně-inhibični nerovnováhy. Převzato a modifikováno z [43]. GABA – gama aminomáselná kyselina<br>
Fig. 1. Schematic representation of the pathophysiological model of the comorbid occurence of autism spectrum disorder and epilepsy – hypothesis of excitatory-inhibitory dysbalance. Taken and modified from [43]. GABA – gamma-aminobutyric acid](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/37bd2254c37987e6d082383f454cff61.jpeg)
Podkladem hypotézy E/ I rovnováhy je předpoklad, že normální mozkové funkce závisí na dokonalé rovnováze mezi excitačními a inhibičními vstupy do klíčových mozkových buněk. Pokud je přítomna nadměrná excitace nebo nedostatečná inhibice, dojde k hyperexcitabilitě neuronální sítě a rozvoji záchvatů. U celé řady epileptických syndromů může být za rozvoj záchvatů odpovědná nedostatečná inhibice, např. alterace receptorů pro gama aminomáselnou kyselinu (GABA) nebo funkce interneuronů. Může také dojít k nadměrné excitaci např. na úrovni excitačních receptorů nebo excitačních neuronálních okruhů. V souladu s teorií E/ I rovnováhy je i princip terapie antiepileptiky, který známe z běžné neurologické praxe: použití GABAergních agonistů ke zvýšení inhibice nebo snižování excitačních vlivů blokátory sodíkových nebo vápníkových kanálů.
V oblasti rozvoje PAS je hypotéza excitačně-inhibiční rovnováhy přijímána již více než 10 let. Pokud E/ I nerovnováha vede k rozvoji záchvatů, pak samotná přítomnost záchvatů může indikovat rozvoj E/ I nerovnováhy i u pacientů s PAS [25]. Ztráta inhibice cestou alterace GABAergní transmise, dysfunkce interneuronů nebo abnormální migrace byla dokumentována i u pacientů s PAS. Bylo zjištěno snížení hladin GABA v kortikálních oblastech mozku u těchto pacientů [44] a snížení GABAA receptorů v oblasti frontálního kortexu [45]. Post mortem studie ukazují redukci parvalbuminových interneuronů v mediálním prefrontálním kortexu [46]. E/ I nerovnováha může být vysvětlením v patogenezi i u celé řady genetických syndromů, které spojují epilepsii a PAS – mutace v genu pro SCN1A, mutace v genu pro podjednotku epsilon-1 glutamátového receptoru (GRIN2A) nebo mutace v genu pro phosphatase and tensin homolog (PTEN) [25].
Logickým důsledkem této hypotézy je úvaha, že antiepileptika by mohla zlepšit kognitivně-behaviorální komorbidity u autistických pacientů. Zvířecí modely nabízí velmi slibné výsledky, např. u SCN1A +/ - myší bylo prokázáno zlepšení sociálních a paměťových funkcí po léčbě klonazepamem [47]. Bohužel antiepileptika v případě podání pacientům s autizmem tento efekt nevykazují [48,49]. Naše zkušenosti ukazují, že podání klonazepamu pacientům se syndromem Dravetové nevede ke zlepšení kognitivních a behaviorálních funkcí (vlastní nepublikované pozorování).
Z předchozího vyplývá, že problematika autistických projevů u pacientů s epilepsií nebude jen důsledkem samotné epilepsie nebo E/ I nerovnováhy. Do hry vstupují další faktory. E/ I rovnováhu nelze chápat jako statické ekvilibrium. Dokonce i v klidovém stavu jsou mozkové struktury aktivní a informace v mozku jsou zpracovávány prostřednictvím specifických rytmů. Právě tyto mozkové rytmy jsou schopny koordinovat neuronální výboje, a tak je umožněn přenos informací. Základní roli v uvedených procesech hraje GABAergní inervace. GABAergní inhibice vytváří rytmickou aktivitu oscilací a „rytmické ticho“ neuronů během oscilací způsobuje okno, ve kterém jsou informace rozmělňovány na „sousta“, která mohou být účinně přenášena a interpretována [50]. Díky alterované GABAergní transmisi u pacientů s PAS jsou pozměněny mozkové rytmy a koordinace oscilací [25]. Objevuje se celá řada důkazů, že u těchto pacientů jsou redukovány γ a α rytmy a fázová synchronizace po zrakovém nebo sluchovém stimulu. Maturační profil oscilací a synchronizací neuronálních sítí během klidového stavu je u dětí a adolescentů s PAS abnormální [51]. E/ I nerovnováha tedy vede ke změně mozkových rytmů a špatné koordinaci v oblasti neuronálních sítí. Funkční konektivita je poškozena a to může mít za následek rozvoj senzorických, percepčních a sociálních potíží u pacientů s PAS [52] (obr. 1).
Terapeutické perspektivy
Pochopení patofyziologického substrátu komorbidního výskytu PAS a epilepsie je stěžejní z pohledu možných terapeutických intervencí. Hypotéza porušené E/ I rovnováhy nabízí hned několik cílových molekul v léčebných možnostech těchto onemocnění.
GABA agonisté
Pokusy na SCN1A myších modelech ukázaly zlepšení chování po léčbě klonazepamem [47]. Chybí však konzistentní data na dalších zvířecích modelech a je nutno také brát v potaz možnou paradoxní reakci léků ovlivňujících GABAA receptory u pacientů s PAS díky perzistující excitační GABA aktivitě. Ostatně příkladem může být zvýšení úzkosti u některých pacientů s PAS po léčbě diazepamem [53]. Naproti tomu GABAB agonista R-baklofen (arbaclofen, STX209) byl účinný v léčbě zvířecích modelů s PAS [54]. Dokonce jsou již výsledky klinických studií na pacientech s fragilním syndromem X. Ukazuje se, že STX209 může zlepšit symptomatiku u pacientů s PAS [55]. Co se týká ostatní GABAergních látek v klinické praxi, jako např. riluzol, tiagabin, vigabatrin, zlepšení symptomatiky PAS je rozporuplné a nepřesvědčivé [56].
Neurosteroidy
Řadí se mezi pozitivní modulátory GABAA receptorů. Příkladem je syntetický derivát progesteronového metabolitu allopregnanolonu, ganaxolon. Ukázal se efektivní v redukci záchvatů na myších modelech epileptických spazmů [57] a chování u myší s PAS [58]. Výzkum ganaxolonu se nachází ve fázi II u pacientů s refrakterní epilepsií a u pacientů s PAS a syndromem fragilního X.
Antagonisté glutamátového receptoru
Předpokládá se jejich efekt na snížení hyperexcitability u pacientů s PAS a komorbidní epilepsií a byla provedena celá řada studií u pacientů s PAS a syndromem fragilního X. Výsledky jsou opět nekonzistentní a rozporuplné. Antagonista N-metyl-D-aspartát receptoru memantin ukázal pozitivní efekt na myších modelech [59] a dokonce i v klinické studii u pacientů s autizmem [60].
Mammalian Target of Rapamycin (mTOR) inhibitory
Zapojení mTOR inhibitorů je klíčové v regulaci řady buněčných procesů – růstu, proliferaci a translaci proteinů. Komponenty mTOR signální cesty v mozku jsou lokalizovány na synapsích, kde kontrolují synaptogenezi. mTOR inhibitor rapamycin je schopen zlepšit neurobehaviorální deficit u myší s PAS [61]. Probíhají klinické studie s mTOR inhibitory u pacientů s tuberózní sklerózou a refrakterní epilepsií, kde měly pozitivní vliv na redukci záchvatů, jak ukazuji výsledky III. fáze klinické studie [62].
Závěr
Komorbidní výskyt PAS a epilepsie není zřejmě pouhou koincidencí, ale jedná se o velmi komplexní a vícesubstrátový proces. Porozumění patofyziologickému substrátu tohoto komorbidního výskytu je stěžejní nejen pro pochopení procesů probíhajících v mozku u pacientů, ale může být zásadní i z pohledu možných terapeutických intervencí. Hypotéza porušené E/ I rovnováhy nabízí hned několik cílových molekul v léčebných možnostech těchto onemocnění (GABA agonisté, neurosteroidy, antagonisté glutamátových receptorů, mTOR inhibitory a další). Výsledky na zvířecích modelech jsou slibné. Jejich aplikace na člověka ale musí projít ještě složitou cestou, která je vzhledem k závažnosti těchto diagnóz a limitovaným terapeutickým možnostem velkou výzvou v celosvětovém vědeckém měřítku.
Tento projekt a publikace byly podpořeny z fondu Lékařské fakulty Masarykovy univerzity pro juniorského výzkumníka MU Dr. Pavlínu Danhofer, Ph.D. a MU Dr. Štefánii Aulickou, Ph.D. (č. projektu: 2726 - IRP 2018-ROZV/ 24/ LF/ 18).
MUDr. Pavlína Danhofer, Ph.D.
Klinika dětské neurologie LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: pavlina.cahova@seznam.cz
Přijato k recenzi: 11. 10. 2018
Přijato do tisku: 14. 1. 2019
Sources
1. Arvidsson T, Danielsson B, Forsberg P et al. Autism in 3-6-year-old children in a suburb of Goteborg, Sweden. Autism 1997; 1(2): 163 – 173. doi: 10.1177/ 1362361397012004.
2. Baird G, Charman T, Baron-Cohen S et al. A screening instrument for autism in 18 months of age: a 6-year-follow-up study. J Am Acad Child and Adolesc Psychiatry 2000; 39(6): 694 – 702. doi: 10.1097/ 00004583-200006000-00007.
3. Yin J, Schaaf CP. Autism genetics – an overview. Prenatal Diagn 2017; 37(1): 14 – 30. doi: 10.1002/ pd.4942.
4. Meltzer A, Van der Water J. The role of the immune system in autism spectrum disorder. Neuropsychopharmacology 2017; 42(1): 284 – 298. doi: 10.1038/ npp.2016.158.
5. Brucato M, Ladd-Acosta C, Li M et al. Prenatal exposure to fever is associated with autism spectrum disorder in the boston birth cohort. Autism Res 2017; 10(11): 1878 – 1890. doi: 10.1002/ aur.1841.
6. Talbott EO, Marshall LP, Rager JR et al. Air toxics and the risk of autism spectrum disorder: the results of a population based case-control study in southwestern Pennsylvania. Environ Health 2015; 14 : 80. doi: 10.1186/ s12940-015-0064-1.
7. Golding J, Rai D, Gregory S et al. Prenatal mercury exposure and features of autism: a prospective population study. Mol Autism 2018; 9 : 30. doi: 10.1186/ s13229-018-0215-7.
8. Gump BB, Dykas MJ, MacKenzie JA et al. Background lead and mercutry exposures: psychological and behavioral problems in children. Environ Res 2017; 158 : 576 – 582. doi: 10.1016/ j.envres.2017.06.033.
9. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 3rd ed. Washington, DC: American Psychiatric Association 1980.
10. Kanner L. Early infantile autism. J Pediatr 1944; 25 : 211 – 217.
11. American Psychiatric Association. Diagnostic and statistic manual of mental disorders, 4th ed. (DSM-IV). Washington, DC: American Psychiatric Association 1994.
12. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 5th ed. Arlington, VA: American Psychiatric Association 2013.
13. Lord C, Rutter M, DiLavore PC et al. Autism diagnostic observation schedule. Los Angeles: Western Psychological Services 2001.
14. Ošlejšková H, Kontrová I, Foralová R et al. D. The course of diagnosis in autistic patients: the delay between recognition of the first symptoms by parents and correct diagnosis. Neuro Endocrinol Lett 2007; 28(6): 895 – 900.
15. Juříková Z, Jambrikovičová M, Ošlejšková H. Vývoj socioekonomického statu u pacientů s poruchou autistického spektra v průběhu let. Neurol praxi 2016; 17(2): 108 – 112.
16. Amiet C, Gourfinkel-An I, Laurent C et al. Epilepsy in simplex autism pedigrees is much lower than the rate in multiplex autism pedigrees. Biol Psychiatry 2013; 74(3): e3 – e4. doi: 10.1016/ j.biopsych.2013.01.037.
17. Hughes JR, Melyn M. EEG and seizures in autistic children and adolescents: further findings with therapeutic implications. Clin EEG Neurosci 2005; 36(1): 15 – 20.
18. Ošlejšková H. Dušek L, Makovská Z et al. The incidence of epileptic seizures and/ or epileptiform EEG abnormalities in children with childhood and atypical autism. Cesk Slov Neurol N 2008; 71/ 104(4): 435 – 444.
19. Amiet C, Gourfinkel-An I, Bouzamondo A et al. Epilepsy in autismis associated with intellectual disability and gender: evidence from a meta-analysis. Biol Psychiatry 2008; 64(7): 577 – 582. doi: 10.1016/ j.biopsych.2008.04.030.
20. Woolfenden S, Sarkozy V, Ridley G et al. A systematic review of two outcomes in autism spectrum disorder – epilepsy and mortality. Dev Med Child Neurol 2012; 54(4): 306 – 312. doi: 10.1111/ j.1469-8749.2012.04223.x.
21. Danielsson S, Gillberg IC, Billstedt E et al. Epilepsy in young adults with autism: a prospective population-based follow-up study of 120 individuals diagnosed in childhood. Epilepsia 2005; 46(6): 918 – 923. doi: 10.1111/ j.1528-1167.2005.57504.x.
22. Parmeggiani A, Barcia G, Posar A et al. Epilepsy and EEG paroxysmal abnormalities in autism spectrum disorders. Brain Dev 2010; 32(9): 783 – 789. doi: 10.1016/ j.braindev.2010.07.003.
23. Barger BD, Campbell JM, McDonough JD. Prevalence and onset of regression within autism spectrum disorders: a meta-analytic review. J Autism Dev Disord 2013; 43(4): 817 – 828. doi: 10.1007/ s10803-012-1621-x.
24. Hrdlicka M, Komarek V, Propper L et al. Not EEG abnormalities but epilepsy is associated with autistic regression and mental functioning in childhood autism. Eur Child Adolesc Psychiatry 2004; 13(4): 209 – 213. doi: 10.1007/ s00787-004-0353-7.
25. Velíšková J, Silverman JL, Benson M et al. Autistic traits in epilepsy models: why, when and how? Epilepsy Res 2018; 144 : 62 – 70. doi: 10.1016/ j.eplepsyres.2018.05.009.
26. Deonna T, Roulet-Perez E. Early-onset acquired epileptic aphasia (Landau-Kleffner syndrome, LKS) and regressive autistic disorders with epileptic EEG abnormalities: the continuing debate. Brain Dev 2010; 32(9): 746 – 752. doi: 10.1016/ j.braindev.2010.06.011.
27. Besag FM. Epilepsy in patients with autism: links, risks and treatment challenges. Neuropsychiatr Dis Treat 2017; 14 : 1 – 10. doi: 10.2147/ NDT.S120509.
28. Lenck-Santini PP, Scott RC, Mechanisms responsible for cognitive impairment in epilepsy. Cold Spring Harb Perpect Med 2015; 5(10): pii: a022772. doi: 10.1101/ cshperspect.a022772.
29. Steffenburg S, Gillberg C, Hellgren L et al. A twin study of autism in Denmark, Finland, Iceland, Norway and Sweden. J Child Psychol Psychiatry 1989; 30(3): 405 – 416.
30. Folstein S, Rutter M. Infantile autism: a genetic study of 21 twin pairs. J Child Psychol Psychiatry 1977; 18(4): 297 – 321.
31. Ozonoff S, Young GS, Carter A et al. Recurrence risk for autism spectrum disorders: a baby siblings research consortium study. Pediatrics 2011; 128(3): e488 – e495. doi: 10.1542/ peds.2010-2825.
32. Simons Foundation. Simons Foundation Autism Research Initiative Gene. [online]. Available from URL:http:/ / sfari.org/ .
33. Amiet C, Gourfinkel-An I, Laurent C et al. Does epilepsy in multiplex autism pedigrees define a different subgroup in terms of clinical characteristics and genetic risk? Mol Autism 2013; 4(1): 47. doi: 10.1186/ 2040-2392-4-47.
34. Ekinci O, Arman AR, Isik U et al. EEG abnormalities and epilepsy in autistic spectrum disorders: clinical and familial correlates. Epilepsy Behav 2010; 17(2): 178 – 182. doi: 10.1016/ j.yebeh.2009.11.014.
35. Emanuele E, Boso M, Brondino N et al. Increased serum levels of high mobility group Box 1 protein in patients with autistic disorder. Prog Neuropharmacol Biol Psychiatry 2010; 34(4): 681 – 683. doi: 10.1016/ j.pnpbp.2010.03.020.
36. Maroso M, Balosso S, Ravizza T et al. Toll-like receptor 4 and high mobility group Box 1 are involved in ictogenesis and can be targeted to reduce seizures. Nat Med 2010; 16(4): 413 – 419. doi: 10.1038/ nm.2127.
37. Choi J, Min HJ, Shin JS. Increased levels of HMGB1 and pro-inflammatory cytokines in chldren with febrile seizures. J Neuroinflammation 2011; 8 : 135. doi: 10.1186/ 1742-2094-8-135.
38. Jyonouchi H, Sun S, Le H. Proinflammatory and regulatory cytokine production associated with innate and adaptive immune responses in children with autism. J Neuroimmunol 2001; 120(1 – 2): 170 – 179.
39. Vezzani A, Granata T. Brain inflammation in epilepsy: experimental and clinical evidence. Epilepsia 2005; 46(11): 1724 – 1743. doi: 10.1111/ j.1528-1167.2005.00298.x.
40. Theoharides TC, Zhang B. Neuroinflammation, blodd.brain barrier, seizures and autism. J Neuroinflammation 2011; 8 : 168. doi: 10.1186/ 1742-2094-8-168.
41. Benson MJ, Manzanero S, Borges K. The effects of C5aR1 on leukocyte infiltration following pilokarpine-induced status epilepticus. Epilepsia 2017; 58(4): e54 – e58. doi: 10.1111/ epi.13698.
42. Nelson TE, Olde Engberink A, Hernandez R et al. Altered synaptic transmission in the hippocampus of transgenic mice with enhanced central nervous system expression of interleukin-6. Brain Behav Immun 2012; 26(6): 959 – 971. doi: 10.1016/ j.bbi.2012.05.005.
43. Bozzi Y, Provenzano G, Casarosa S. Neurobiological bases of autism-epilepsy comorbidity: a focus on excitation/ inhibition imbalance. Eur J Neurosci 2018; 47(6): 534 – 548. doi: 10.1111/ ejn.13595.
44. Puts NA, Wodka EI, Harris AD et al. Reduced GABA and somatosensory function in children with autism spectrum disorder. Autism Res 2017; 10(4): 608 – 619. doi: 10.1002/ aur.1691.
45. Zurcher NR, Bhanot A, McDougle CJ et al. A systematic review of molecular imaging (PET and SPECT) in autism spectrum disorder: current state and future research opportunities. Neurosci Biobehav 2015; 52 : 56 – 73. doi: 10.1016/ j.neubiorev.2015.02.002.
46. Ariza J, Rogers H, Hashemi E et al. The number of chandelier and basket cells are differentially decreased in prefrontal cortex in autism. Cereb Cortex 2018; 28(2): 411 – 420. doi: 10.1093/ cercor/ bhw349.
47. Han S, Tai C, Westenbroek RE et al. Autistic like behavior in Scn1a + - mice and rescue by enhanced GABA-mediated neurotransmission. Nature 2012; 489(7416): 385 – 390. doi: 10.1038/ nature11356.
48. Frye RE, Rossignol D, Casanova MF et al. A review of traditional and novel treatments for seizures in autism spectrum disorder: findings from a systematic review and expert panel. Front Public Health 2013; 1 : 31. doi: 10.3389/ fpubh.2013.00031.
49. Hellings JA, Nickel EJ, Weckbaugh M et al. The overt aggression scale for ratin aggression in outpatient youth with autistic disorder: preliminary findings. J Neuropsychiatry Clin Neurosci 2005; 17(1): 29 – 35. doi: 10.1176/ jnp.17.1.29.
50. Buzsaki G. Neural syntax: cell assemblies, synapsemblies and readers. Neuron 2012; 68(3): 362 – 385. doi: 10.1016/ j.neuron.2010.09.023.
51. Vakorin VA, Doesburg SM, Leung RC et al. Developmental changes in neuromagnetic rhythms and network synchronyin autism. Ann Neurol 2017; 81(2): 199 – 211. doi: 10.1002/ ana.24836.
52. Simon DM, Wallace MT. Dysfunction of sensory oscillations in autism spectrum disorder. Neurosci Biobehav Rev 2016; 68 : 848 – 861. doi: 10.1016/ j.neubiorev.2016.07.016.
53. Marrosu F, Marrosu G, Rchel MG et al. Paradoxical reactions elicited by diazepam in children with classic autism. Funct Neurol 1987; 2(3): 355 – 361.
54. Silverman JL, Pride MC, Hayes JE et al. GABAb receptor agonist R-baclofen reverses social deficits and reduces repetitive behavior in two mouse models of autism. Neuropsychopharmacology 2015; 40(9): 2228 – 2239. doi: 10.1038/ npp.2015.66.
55. Veenstra-VanderWeele J, Cook EH, King BH et al. Arbaclofen in children and adolescents with autism spectrum disorder: a randimizes controlled, phase II trial. Neuropsychopharmacology 2016; 42(7): 1390 – 1398. doi: 10.1038/ npp.2016.237.
56. Brondino N, Fusar-Poli L, Panisi C et al. Pharmacological modulation of GABA function in autism spectrum disorders: a systematic review of human studies. J Autism Dev Disord 2016; 46(3): 825 – 839. doi: 10.1007/ s10803-015-2619-y.
57. Yum MS, Lee M, Ko TS et al. A pottential effect of ganaxolone in an animal model of infantile spasms. Epilepsy Res 2014; 108(9): 1492 – 1500. doi: 10.1016/ j.eplepsyres.2014.08.015.
58. Kazdoba TM, Hagerman RJ, Zolkowska D et al. Evaluation of the neuriactive steroid ganaxolone on social and repetitive behaviors in the BTBR mouse model of autism. Psychopharmacology (Berl) 2016; 233(2): 309 – 323. doi: 10.1007/ s00213-015-4115-7.
59. Kim KC, Rhee J, Park JE et al. Overexpressiono of telomerase reverse transcriptase induces autism-like excitatory phenotypes in mice. Mol Neurobiol 2016; 53(10): 7312 – 7328. doi: 10.1007/ s12035-015-9630-3.
60. Joshi G, Wozniak J, Faraone SV et al. A prospective open-label trial of memantine hydrochloride for the treatment of social deficits in intellectually capable adults with autism spectrum disorder. J Clin Psychopharm 2016; 36(3): 262 – 271. doi: 10.1097/ JCP.0000000000000499.
61. Huber KM, Klann E, Costa-Mattioli M et al. Dysregulation of mammalian target of rapamycin signaling in mouse models of autism. J Neurosci 2015; 35(41): 13836 – 13842. doi: 10.1523/ JNEUROSCI.2656-15.2015.
62. French JA, Lawson JA, Yapici Z et al. Adjunctive everolimus therapy for treatment resistant focal-onset seizures associated with tuberous sclerosis (EXIST-3): a pahes 3, randomised, double-blind, placebo conrolled study. Lancet 2016; 388(10056): 2153 – 2163. doi: 10.1016/ S0140-6736(16)31419-2
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue 2-
All articles in this issue
- Intradurálne extramedulárne nádory chrbtice
- Roztroušená skleróza mozkomíšní, úloha střevní mikrobioty v poškozujícím zánětu
- Genetické a neurobiologické aspekty komorbidního výskytu poruch autistického spektra a epilepsie
- Extra-intrakraniální bypass iniciovaný rehabilitačním lékařem pro kognitivní deterioraci
- Traumatické pseudoaneuryzma arterie temporalis superficialis
- Roztroušená skleróza mozkomíšní, těhotenství, mateřství a kojení
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
- Moderní mikrochirurgie jako trvalé, bezpečné a šetrné řešení nekrvácejících mozkových výdutí
- Explantace stimulátoru nervus vagus odpovídající protokolu vyšetření magnetickou rezonancí
- Obecné pohyby a neurologický vývoj raného věku u dětí s novorozeneckou hypoglykemií
- Srovnání kosmetického efektu krátkého podélného a příčného kožního řezu při karotické endarterektomii
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Analýza dat v neurologii LXXIV. - Neparametrický Spearmanův koeficient korelace
- Recenze knih
- Doc. Vladimír Škorpil, 100 let od narození zakladatele naší elektromyografie
- Hraje leptin roli v rozvoji intrakraniálních meningeomů?
- Srovnávací studie pacientů s myastenií České a Slovenské republiky
- Změny v obsahu esenciálních a stopových prvků v lidských degenerujících meziobratlových ploténkách nekorespondují s klinickým stavem pacientů
- Jak náhrada extracelulárního sodíku ovlivňuje distribuci rychlosti vedení periferním nervem u krysy
- Aneuryzmatické subarachoidální krvácení v těhotenství – úspěšný kliping po selhání koilingu
- Klíšťová meningitida komplikovaná kardioembolickým intraluminálním trombem v krkavici a mozkovou mrtvicí
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intradurálne extramedulárne nádory chrbtice
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

