-
Medical journals
- Career
Kožní léze komplikující Parkinsonovu nemoc
Authors: J. Búřil 1; P. Búřilová 2
Authors‘ workplace: I. neurologická klinika LF MU a FN u sv. Anny v Brně 1; Ústav zdravotnických informací a statistiky ČR, Praha 2
Published in: Cesk Slov Neurol N 2017; 80(Supplementum 1): 50-53
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2017S50Overview
Cíl:
Zjistit výskyt dekubitálních lézí (L89) a granulomatózních onemocnění kůže a podkožního vaziva (L92) u vybraného souboru pacientů s Parkinsonovou nemocí (G20).Soubor a metodika:
U souboru pacientů s Parkinsonovou nemocí dispenzarizovaných na specializované ambulanci Centra pro abnormní pohyby a parkinsonizmus I. neurologické kliniky LF MU a FN u sv. Anny v Brně byla provedena retrospektivní analýza dat nemocničního informačního systému (NIS) za rok 2016.Výsledky:
Z 3 158 záznamů u 776 pacientů bylo identifikováno 24 (3,1 %) pacientů s dekubitální lézí a 16 (2,1 %) s hypergranulací v pooperační jizvě v místě zavedení perkutánní endoskopické gastrostomie (PEG) jejunální. Všichni hodnocení pacienti měli hlavní diagnózou Parkinsonova nemoc v rozsahu od incipientní diagnostikované nemoci až po fázi onemocnění s pozdními hybnými komplikacemi a rozvinutými symptomy (70 %). U 94 % pacientů s dekubitálními lézemi byla klinickým vyšetřením zjištěna částečná nebo úplná imobilita.Závěr:
Výskyt dekubitálních lézí byl relativně nízký, což může být dáno reálně nízkou incidencí anebo nedostatečně propracovanou metodikou sběru dat na lokální úrovni a také ztrátou významných dat z pracovišť následné a domácí zdravotní péče. Prokázán byl výskyt komplikací u pacientů léčených intraduodenální aplikací L-DOPA formou PEG jejunální sondy v podobě granulací v oblasti zavedení PEG jejunální sondy.Klíčová slova:
Parkinsonova nemoc – kožní léze – dekubitální léze – granulomatózní léze – komplikaceÚvod
Parkinsonova nemoc (G20) je chronické progresivní neurodegenerativní onemocnění centrálního nervového systému. V klinickém obrazu jsou nejnápadnější motorické symptomy, ale součástí jsou také desítky symptomů nemotorických [1,2]. Pacienti s Parkinsonovou nemocí mají rozmanitou motorickou symptomatologii, která zahrnuje jak hypokineticko-rigidní syndrom (v pokročilém stadiu též s poruchami stability a chůze, freeezingem), tak i hyperkinetické syndromy (např. tremor, dystonii, choreatické dyskineze v rámci tzv. pozdních hybných komplikací a tremor) [3].
Uvedená klinická symptomatologie je spojována s dalšími komplikacemi nejen v průběhu hospitalizační péče, ale i v následné rehabilitační a domácí zdravotní a laické péči. Konkrétní komplikace lze rozdělit na ty, které se dají do jisté míry lékařským a nelékařským zdravotnickým personálem a zdravotními službami ovlivnit, a ty, které lze ovlivnit zlepšením odborné péče pouze omezeně anebo vůbec.
Pacienti jsou během hospitalizace při dominanci posturální nestability ohroženi především pády s možností traumatického postižení pacienta s rizikem rozvoje dekubitů a event. i poškozením mechanizmu (hardwaru) zavedených systémů terapie pozdních hybných komplikací (hluboká mozková stimulace, apomorfinová pumpa, terapie L-DOPA formu perkutánní endoskopické gastrostomie (PEG) jejunální sondy) [4]. Komplikace jsou do značné míry ovlivnitelné intervencí lékaře s pečlivou kompenzací terapie Parkinsonovy nemoci (úprava dávky antiparkinsonské medikace nebo změna nastavení terapie intraduodenální L-DOPA, parametrů hluboké mozkové stimulace, dávky apomorfinu). Četnou skupinu komplikací představuje v případě dekompenzace parkinsonské symptomatologie a rozvoje výrazné rigidity s omezením hybnosti pacienta nebo imobilizace z jiné příčiny rozvoj dekubitálních lézí u pacientů se zvýšeným rizikem dle škály Nortonové, což následně vyžaduje intenzivní ošetřovatelskou a event. i chirurgickou péči [5,6]. Pacienti s uvedenými komplikacemi obvykle potřebují i další péči v rámci domácí zdravotní péče a rehabilitačního zařízení.
Zvláštní skupinou komplikací, které jsou do značné míry zdravotnickým personálem neovlivnitelné, je rozvoj granulací v oblasti zavedení PEG jejunální sondy. Povytažení PEG jejunální sondy zapříčiňuje vznik vnitřního dekubitu v oblasti žaludeční stěny při tlaku terče vnitřní části PEG jejunální sondy. V případě zavedení hardwaru v rámci operace hluboké mozkové stimulace (Deep Brain Stimulation; DBS) mohou vznikat kožní změny v oblasti implantátu s hrozbou rozvoje septické komplikace v místě implantace stimulátoru DBS, event. elektrod DBS a s možnou rejekcí implantovaného stimulátoru DBS [7,8].
Cíle
Cílem průzkumu bylo zjistit výskyt dekubitálních lézí (L89) a granulomatózních onemocnění kůže a podkožního vaziva (L92) u vybraného souboru pacientů s Parkinsonovou nemocí (G20).
Metodika
Analyzována byla data z nemocničního informačního systému (NIS) FN u sv. Anny v Brně za období leden – prosinec 2016. Zařazeny byly záznamy u pacientů s hlavní diagnózou Parkinsonova nemoc, kteří jsou dispenzarizováni na specializované ambulanci I. neurologické kliniky (I. NK) FN u sv. Anny v Brně. U pacientů s diagnózou G20 byl zjišťován záznam diagnózy dekubitální léze (L89) a granulomatózních onemocnění kůže a podkožního vaziva (L92) dle MKN-10.
Soubor
Celkem bylo analyzováno 3 158 záznamů u 776 pacientů s Parkinsonovou nemocí (MNK-10, G20) jako hlavní diagnózou u 100 % pacientů v daném souboru. V souboru bylo 58,4 % (n = 453) žen a 41,6 % (n = 323) mužů. Průměrný věk pacientů činil 64,8 let (min. věk 30, max. věk 82). Dekubitální léze a granulomatózní onemocnění kůže a podkožního vaziva byly identifikovány u celkem 40 (5,2 %) pacientů z celkového počtu 776 dispenzarizovaných pacientů na specializované ambulanci (I. NK) za stanovené období (stanoven leden – prosinec 2016 s ohledem na celkové množství záznamů a v souvislosti s v té době realizovanými změnami v hlášení nežádoucích událostí ve sledovaném zdravotnickém zařízení). Ve sledovaném souboru pacientů bylo 30 % v incipientní fázi onemocnění s plně rozvinutými symptomy Parkinsonovy choroby a u 70 % byly již rozvinuty pozdní hybné komplikace s fluktuacemi stavu ON/ OFF. Hybné komplikace byly ověřovány klinickým neurologickým vyšetřením pomocí škály Unified Parkinson‘s Disease Rating Scale (UPDRS) a Hoehn and Yahr škály (H-Y scale) [9,10], zobrazovacími metodami (počítačová tomografie mozku) a elektroencefalografií. Celý soubor pacientů byl diagnostikován dle standardních kritérií pro diagnostiku Parkinsonovy nemoci [11].
Graf 1 prezentuje počet pacientů ošetřených od ledna 2011 do prosince 2016 a nárůst kontrolních klinických vyšetření na specializované ambulanci. Přehled počtu klinických vyšetření uvádíme s cílem zjistit, zda ve sledovaném roce nedošlo k významné odchylce od let předchozích, kterou by nebylo možno vysvětlit s ohledem na dosavadní praxi na pracovišti.
Graph 1. Trend vývoje počtu dispenzarizovaných pacientů a klinických kontrol a vyšetření. 
Kontinuální zvyšování počtu kontrolních klinických vyšetření patrné v grafu souvisí zřejmě jednak se zvyšujícím se věkem dispenzarizovaných pacientů, jednak s faktem využívaných terapeutických intervencí, které vyžadují častější sledování pacientů (např. DBS). Frekvence kontrol ale také může souviset s výskytem komplikací, které je nezbytné odpovídajícím způsobem dokumentovat, což byl také jeden z hlavních motivů naší práce.
Výsledky a diskuze
Výskyt Parkinsonovy nemoci se má do roku 2030 zdvojnásobit [12]. Nejčastější výskyt onemocnění je prokázán ve věku 65 let, avšak jsou diagnostikováni i pacienti v mladším věku, asi 5 – 10 % je diagnostikovaných ve věku pod 50 let. U mužů je pozorováno o něco vyšší riziko rozvoje onemocnění než u žen [13]. V rámci realizovaného průzkumu byl potvrzen vyšší počet dispenzarizovaných mužů (58,4 %), průměrný věk v celém souboru byl 65 let a pouze 7 % pacientů ve sledovaném souboru bylo ve věku pod 50 let.
V České republice nejsou aktuálně k dispozici přesná data o počtu nemocných s Parkinsonovou nemocí. Poslední dostupné statistické údaje se vzájemně liší, přičemž Ústav zdravotnických informací a statistiky (ÚZIS ČR) uváděl v roce 2012 celkem 26 680 nemocných, podle Evropské asociace Parkinsonovy nemoci (EPDA) to bylo 18 000 a podle publikace Parkinsonova nemoc z různých pohledů to bylo 15 000 [14]. Jak bylo uvedeno výše, zejména pacienti s pokročilým onemocněním trpí omezenou mobilitou a ta je rizikovým faktorem vzniku dekubitálních lézí. Dle další podrobné analýzy, v níž byl využit Národní registr hospitalizovaných (NRHOSP), ve sledovaném období let 2007 – 2014 bylo zjištěno celkem 1 707 (34,7 %) vykázaných diagnóz L89 u skupin pacientů s neurodegenerativním a onkologickým onemocněním z celkového počtu 4 924 hodnocených záznamů. Jednalo se především o dekubitální léze vyššího stupně, avšak ve skupině neurodegenerativních onemocnění nebyla Parkinsonova nemoc přímo specifikována [15]. V rámci specializované ambulance na I. NK bylo hodnoceno celkem 776 pacientů. Záchyt dekubitálních lézí byl 3,1 % a granulomatózních onemocnění kůže a podkožního vaziva 2,7 %. Dekubitální léze se vyskytovaly v lokalizaci: sakrum v 62,5 %, paty ve 25 % a kombinace obou v 12,5 %. Granulomatózní onemocnění bylo přítomno pouze u pacientů léčených intraduodenální aplikací L-DOPA formou PEG jejunální sondy (obr. 1), kteří podstupovali pravidelná kontrolní vyšetření na sledovaném pracovišti. Celkový počet léčených pacientů intraduodenální aplikaci L-DOPA činil 45 za vybrané období, u 16 (35,5 %) z nich se vyskytly kožní komplikace. U pacientů s granulomatózní komplikací byla jediná možnost léčby chirurgické snesení granulátu, jak doporučuje odborná literatura [16].
Image 1. Granulomatózní komplikace v místě PEG jejunální sondy. Fig. 1. Hypergranulomatosis complication in place of jejunal PEG insertion. 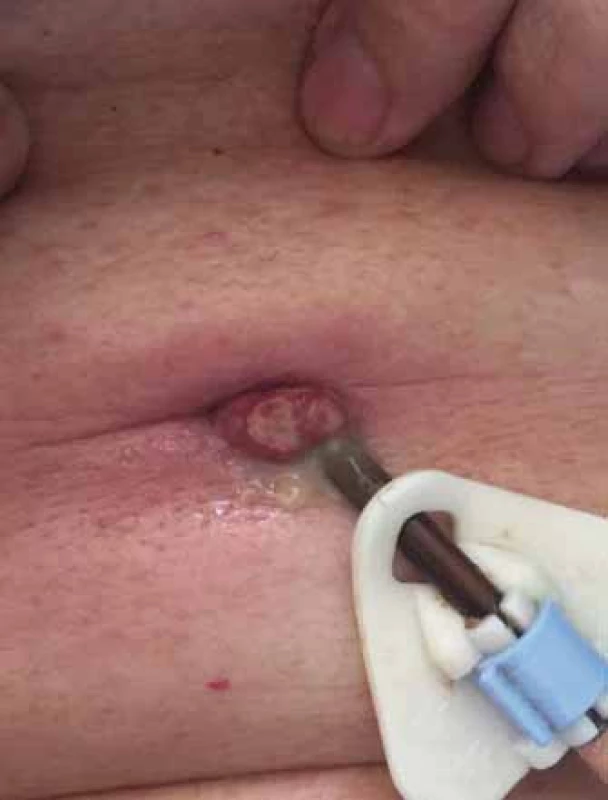
Bylo prokázáno, že mezi časté nemotorické příznaky u pacientů s Parkinsonovou nemocí patří poruchy autonomních nervových funkcí. Vyskytují se až u 80 % nemocných a pro svůj výrazný negativní dopad na každodenní život představují závažný zdravotní problém [17]. Souvisí také s rizikem vzniku poruchy tkáňové a kožní integrity. Dochází též k dalším změnám kůže, které se objevují v důsledku Parkinsonovy nemoci, a to hypersalivace, hyperhidróza, seborea či maligní kožní léze [18]. Podráždění a léze kožního krytu mohou vyvolat také aplikace transdermálních náplastí využívaných v symptomatické terapii příznaků Parkinsonovy nemoci nebo kognitivní dysfunkce, což je zatím ověřeno na pracovišti autorů empiricky. Mezi další faktory zvyšující riziko vzniku dekubitálních lézí řadíme imobilitu, s níž souvisí jiné rizikové faktory, jako zvýšené pocení a inkontinence. U 94 % pacientů s nálezem dekubitů zařazených v průzkumu byla klinickým vyšetřením potvrzena částečná nebo úplná imobilita (UPDRS, H-Y). Ta je jedním z rizikových faktorů vzniku dekubitálních lézí, avšak dokumentovaný výskyt dekubitálních lézí byl nízký (n = 24; 3,1 %). Lze předpokládat, že za hospitalizace byl výskyt dekubitálních lézí nízký vzhledem k poskytování kvalitní ošetřovatelské péče nelékařského zdravotnického personálu za spoluúčasti rehabilitační péče. Možným důvodem nízkého záchytu v rámci ambulantní dispenzární péče je nedostatečně propracovaná metodika sběru dat na lokální úrovni [19]. Dalším možným vysvětlením, které by vyžadovalo doplňující analýzu, je nedostatečná kontinuita péče a transfer informací při zajištění péče v rámci pracovišť následné a domácí zdravotní péče.
Závěr
V České republice aktuálně chybí národní strategie pro Parkinsonovu nemoc. Neexistuje doposud propracovaný mezioborový systém péče a zajištění kontinuity péče a návaznost na domácí zdravotní péči s cílem zvýšit kvalitu života a prodloužit tím soběstačnost pacientů, což by vedlo k předcházení a zmírnění úpadku psychických i fyzických sil u nemocných. Retrospektivní analýzou dat z nemocničního informačního systému byl prokázán výskyt komplikací u pacientů léčených intraduodenální aplikací L-DOPA formou PEG jejunální sondy ve formě granulomatózního onemocnění v ústí sondy. Výskyt dekubitálních lézí byl zjištěn nízký (3,1 %), což může být dáno reálně nízkou incidencí. Druhým možným zdůvodněním je nedostatečně propracovaná metodika sběru dat na lokální úrovni sledovaného pracoviště a potenciálně riziko ztráty významných dat z pracovišť následné a domácí zdravotní péče. Vhodným řešením by byl terénní pracovník v rámci specializované ambulance I. NK, který by docházel za dispenzarizovanými pacienty do domácího prostředí a edukoval je a příbuzné o preventivních a režimových opatřeních v rámci léčby. Dalším východiskem je úprava metodického materiálu pro lokální sběr dat zaměřených na výskyt kožních komplikací (dekubitální léze a nehojící se rány), která je aktuálně naplánována a měla by umožnit další sledování komplikací u dispenzarizovaných pacientů.
Děkujeme členům týmu Centra pro abnormní pohyby a parkinsonizmus při I. neurologické klinice LF MU a FN u sv. Anny v Brně za poskytnutí dat k provedení průzkumu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 15. 6. 2017
Přijato do tisku: 3. 7. 2017
MUDr. Jiří Búřil
I. neurologická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: jiri.buril@fnusa.cz
Sources
1. Pfeiffer RF, Wszolek ZK, Ebadi M. Parkinson‘s Disease. 2nd ed. CRC Press 2012 : 14 – 6.
2. Tarakad A, Jankovic J. Diagnosis and Management of Parkinson‘s Disease. Semin Neurol 2017;37(2):118 – 26. doi: 10.1055/ s-0037-1601888.
3. National Institue of Neurological Disorders and Stroke. Parkinson‘s Disease Information Page 2017. [online]. Available from URL: https:/ / www.ninds.nih.gov/ Disorders/ All-Disorders/ Parkinsons-Disease-Information-Page.
4. Menšíková K, Bareš M, Kaňovský P, et al. Atypické parkinsonské syndromy. Praha: Galén 2015 : 13 – 21.
5. Majkusová K, Jarošová D. Falls risk factors in an acute – care setting: a retrospective study. Cent Eur J Nurs Midwifery 2014;5(2):47 – 53.
6. Jurásková D. Pády a zranění pacientů v souvislosti s poskytováním zdravotní a sociální péče. Ošetřovatelství teorie a praxe moderního ošetřovatelství 2008;10(34):58 – 75.
7. Bareš M, Kianička B. Léčba Parkinsonovy nemoci. Neurol Praxi 2014;15(2):105 – 8.
8. Leibson CL, Maraganore DM, Bower JH, et al. Comorbid conditions associated with Parkinson’s disease: a population-based study. Mov Disord 2006;21(4):446 – 55.
9. Goetz CG, Tilley BC, Shaftman SR, et al. Movement Disorder Society-sponsored revision of the unified Parkinson’s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord 2008;23(15):2129 – 70. doi: 10.1002/ mds.22340.
10. Goetz CG, Poewe W, Racol O, et al. Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations. Mov Disord 2004;9(9):1020 – 8. doi: 10.1002/ mds.20213.
11. Sorbi S, Hort J, Erkinjuntti T, et al. EFNS-ENS Guidelines on the diagnosis and management of disorders associated with dementia. Eur J Neurol 2012;19(9):1159 – 79. doi: 10.1111/ j.1468-1331.2012.03784.x.
12. National Parkinson Foundation. Parkinson’s DiseaseOverview 2016. [online]. Available from URL: www.parkinson.org/ parkinson-s-disease.aspx.
13. Henchcliffe C, Severt WL. Disease modification in Parkinson’s disease. Drugs Aging 2011;28(8):605 – 15. doi: 10.2165/ 11591320-000000000-00000.
14. Kolektiv autorů. Parkinsonova nemoc z různých pohledů. Společnost Parkinson, Praha 2013. [online]. Dostupné z URL: http:/ / parkinson-help.cz/ tiskova-zprava-2/ .
15. Pokorná A, Benešová K, Mužík J, et al. Sledování dekubitálních lézí u pacientů s neurologickým onemocněním – analýza Národního registru hospitalizovaných. Cesk Slov Neurol N 2016;79(Suppl 1):S8 – 14. doi: 10.14735/ amcsnn2016S8.
16. Fischer M, Gemende I, Marsch W, et al. Skin function and skin disorders in Parkinson’s Disease. J Neur Trans 2001;108(2):205 – 13.
17. Beitz JM. Skin and wound issues in patients with Parkinson’s disease: an overview of common disorders. Ostomy Wound Manage 2013;59(6):26 – 36.
18. Průzkum agentury STEM/ MARK pro Parkinson – Help, o.s., březen 2015. [online]. Dostupné z URL: http:/ / parkinson-help.cz/ tiskova-zprava-2/ .
19. Pokorná A, Benešová K, Jarkovský J, et al. PressureInjuries in Inpatient Care Facilities in the Czech Republic: Analysis of a National Electronic Database. J WoundOstomy Continence Nurs 2017;44(4):1 – 5. doi: 10.1097/ WON.0000000000000344.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue Supplementum 1-
All articles in this issue
- Léčba ran – farmakoekonomická data z pohledu poskytovatele a plátce péče
- Využití lalokových plastik v operační léčbě dekubitů
- Výskyt dekubitů u pacientů s lézí míšní na spinální jednotce Kliniky úrazové chirurgie LF MU a FN Brno 2013– 2016
- Kožní léze komplikující Parkinsonovu nemoc
- Validizace ošetřovatelské diagnózy akutní a chronická bolest dle NANDA International u pacientů s ránou
- Dekubity jsou pro mne stále noční můrou
- Deformace je „zabiják“ buněk – implikace pro ochranu osob s poraněním míchy před vznikem dekubitů
- Vztah mezi rizikovými faktory, hodnocením rizika a patologií vzniku dekubitální léze
- Diferenciální diagnostika dekubitů a dekubity vznikající v souvislosti s přístrojovou technikou
- Možnosti hodnocení psychometrických vlastností škál pro hodnocení rizika vzniku tlakových lézí na vybraných pracovištích v intenzivní péči – pilotní studie
- Editorial
- Datové zdroje pro sledování nehojících se ran v Národním zdravotnickém informačním systému – epidemiologie nehojících se ran v České republice – analýza Národního registru hospitalizovaných v letech 2007– 2015
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Validizace ošetřovatelské diagnózy akutní a chronická bolest dle NANDA International u pacientů s ránou
- Využití lalokových plastik v operační léčbě dekubitů
- Diferenciální diagnostika dekubitů a dekubity vznikající v souvislosti s přístrojovou technikou
- Dekubity jsou pro mne stále noční můrou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

