-
Medical journals
- Career
Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
Authors: D. Krajíčková 1,2; A. Krajina 1,2; Miroslav Lojík 1,2; V. Chovanec 1,2; J. Raupach 1,2; I. Guňka 1,3; M. Vališ 1,2
Authors‘ workplace: Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové 1; Neurologická klinika, LF UK a FN Hradec Králové 2; Radiologická klinika, LF UK a FN Hradec Králové 3; Chirurgická klinika, LF UK a FN Hradec Králové 4
Published in: Cesk Slov Neurol N 2016; 79/112(3): 317-322
Category: Original Paper
Overview
Cíl:
Karotická angioplastika je preventivní metoda, jejímž účelem je snížit riziko mozkové ischemie způsobené stenózou odstupu vnitřní karotické tepny. K dosažení tohoto účelu je třeba, aby výkon měl nízké riziko komplikací a jeho efekt dlouho přetrvával. Cílem naší práce bylo ověřit bezpečnost karotických angioplastik a jejich dlouhodobý účinek v klinické praxi.Materiál a metodika:
Soubor tvoří 450 angioplastik, z nichž 442 bylo s implantací stentu, které jsme provedli od roku 1997 u 414 nemocných. Zaznamenávali jsme komplikace během tří dnů po výkonu (periprocedurální) a v průběhu dlouhodobého UZ a klinického sledování (medián 33 měsíců).Výsledky:
Riziko angioplastiky bylo nízké: hospitalizační mortalita = mozkové krvácení 0,5 %, mozková ischemie (minor stroke) 1,0 %, tranzitorní ischemická ataka 2,4 %. Restenózu > 70 % jsme v dalším průběhu zjistili u 3,6 % ze 76 % dlouhodobě sledovaných nemocných, 81 % restenóz bylo asymptomatických.Závěry:
Naše výsledky potvrzují, že angioplastika je při správné indikaci a provedení zkušeným operatérem metoda bezpečná a její pozitivní efekt dlouho přetrvává.Klíčová slova:
karotický stenting – periprocedurální komplikace – dlouhodobé sledování – restenózaÚvod
Intervenční léčba stenózy odstupu vnitřní karotické tepny (ACI) – karotická endarterektomie (CEA) nebo angioplastika – je vždy spojena s rizikem periprocedurální komplikace. Aby bylo toto riziko oprávněné, nesmí být vyšší než riziko medikamentózně léčené stenózy a efekt intervenční léčby spočívající v dlouhodobé ochraně nemocného před ischemickou mozkovou příhodou by měl dlouho přetrvávat.
Úspěch endovaskulární léčby je ve srovnání s CEA více závislý na anatomii tepny [1]. Z hlediska anatomického jsou relativní kontraindikací výkonu všechny situace znesnadňující hladké zavedení instrumentária – tj. pokročilé kalcifikace působící závažnou excentrickou stenózu, elongace tepny a extrémní vinutost přívodných tepen, a pro vysoké riziko distální embolizace při manipulaci katétrem vlající trombus v místě stenózy. Zvýšeně rizikové jsou ulcerace a trombus v poststenotickém úseku [2,3]. Nevhodní k endovaskulární léčbě jsou nemocní, kteří nemohou užívat duální protidestičkovou léčbu, jež má zásadní význam pro úspěch endovaskulární léčby. Méně vhodní jsou nemocní s těžkou renální insuficiencí pro nutnost opakovaného podání jodové kontrastní látky (k. l.) během výkonu – u nich lze však snížit použité množství k. l. a výkon modifikovat technicky. K endovaskulární léčbě jsou indikovány neaterosklerotické stenózy, např. postiradiační, při fibromuskulární dysplazii nebo Takayasuově arteritidě, při disekcích, a stavy zvyšující riziko CEA – restenózy, nemocní s druhostrannou okluzí [4] a ti, u nichž by byla chirurgická léčba technicky obtížná buď pro vysoko uloženou bifurkaci karotické tepny (úroveň C2 a výše) nebo příliš distální lézi – proximální část a. carotis communis (ACC) či pro silný krátký krk [5]. Endovaskulární léčba je optimální volbou v případě tandemové stenózy, protože je schopna vyřešit obě léze. Věk > 70 let riziko endovaskulární léčby zvyšuje [6–9].
Cílem naší práce bylo ověřit bezpečnost a dlouhotrvající efekt karotických angioplastik v klinické praxi.
Materiál a metodika
Prospektivně jsme sledovali všechny nemocné, kteří od roku 1997 do konce února 2013 prodělali neurgentní angioplastiku extrakraniálního úseku ACI. Kromě osmi samotných balónkových angioplastik (PTA) byla u všech dalších výkonů dilatace tepny doplněna implantací stentu (karotický stenting; CAS). Od roku 2002 jsme u všech výkonů ke snížení rizika distální embolizace použili protektivní filtr. Jednalo se plánované výkony, u symptomatických stenóz realizované nejdříve čtyři týdny po kvalifikující příhodě. Všichni nemocní byli zajištěni duální protidestičkovou léčbou, kterou jsme začali podávat tři dny před výkonem. Indikaci k výkonu, která byla společným rozhodnutím neurologa, intervenčního radiologa a chirurga, jeho metodiku a péči po ošetření jsme již dříve publikovali [10,11].
Periprocedurální komplikace zaznamenané neurologem během třídenní hospitalizace po výkonu jsme rozdělili na závažné (mozková ischemie typu minor nebo major stroke, intrakraniální krvácení či jiné potenciálně závažné extracerebrální krvácení, srdeční selhání a úmrtí) a tranzitorní (tranzitorní ischemické ataky; TIA; a hypoxické konvulze). Zdravotní stav ve 30 dnech jsme zjišťovali aktivně prostřednictvím telefonického kontaktu s nemocným nebo s jeho praktickým lékařem.
Po propuštění byli nemocní klinicky a sonograficky (UZ) v pravidelných půlročních intervalech kontrolováni stejným neurologem.
Výsledky
Základní charakteristika souboru
Provedli jsme 450 angioplastik u 414 nemocných, jejichž průměrný věk byl 68 roků. Muži tvořili 73 % souboru (303). U obou pohlaví byla o něco častěji ošetřena levá karotická tepna (54 %). Zastoupení symptomatických a asymptomatických tepen bylo prakticky stejné (49 %/220, resp. 51 %/230). U 59 % nemocných se jednalo o polystenotické postižení, 12 % tvořily restenózy po CEA.
Periprocedurální komplikace
Všechny periprocedurální komplikace se manifestovaly do 48 hod od výkonu (tab. 1). Závažné mozkové komplikace se objevily u šesti CAS (1,3 %), čtyřikrát (0,9 %) se jednalo o drobnou neinvalidizující ischemickou cévní příhodu (minor stroke), u dvou nemocných (0,4 %) došlo k závažnému intrakraniálnímu krvácení, které skončilo fatálně. Jeden případ extrakraniálního krvácení spočíval v hemodynamicky nevýznamném retroperitoneálním hematomu při poranění femorální tepny. Protrahovaná hemodynamická nestabilita po výkonu vedla u jednoho nemocného k levostrannému srdečnímu selhání s nutností přechodné umělé plicní ventilace, konečný výsledek byl dobrý. Hospitalizační i 30denní M/M (morbidita/ mortalita) zahrnující závažné cerebrální a extracerebrální komplikace vztažená na počet výkonů byla 1,8 %, na počet nemocných 1,9 % (tab. 1, 2). Ošetření symptomatických stenóz nebylo ve srovnání s asymptomatickými stenózami spojeno s vyšším rizikem závažné mozkové komplikace – 1,4 vs. 1,3 % (minor stroke 0,9 vs. 0,9 %, krvácení 0,5 vs. 0,4 %).
Table 1. Závažné periprocedurální komplikace a status tepny. 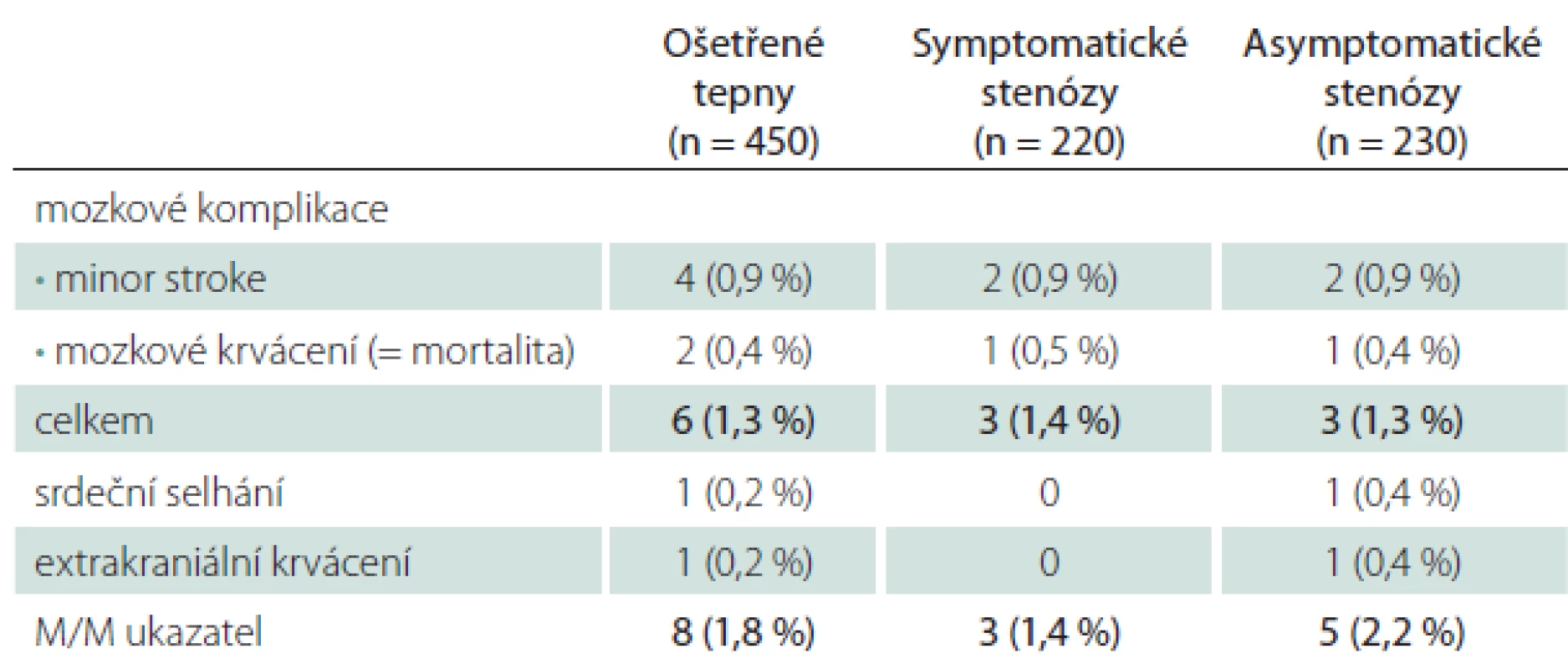
M/M – morbidita/mortalita. Table 2. Periprocedurální komplikace a věk. 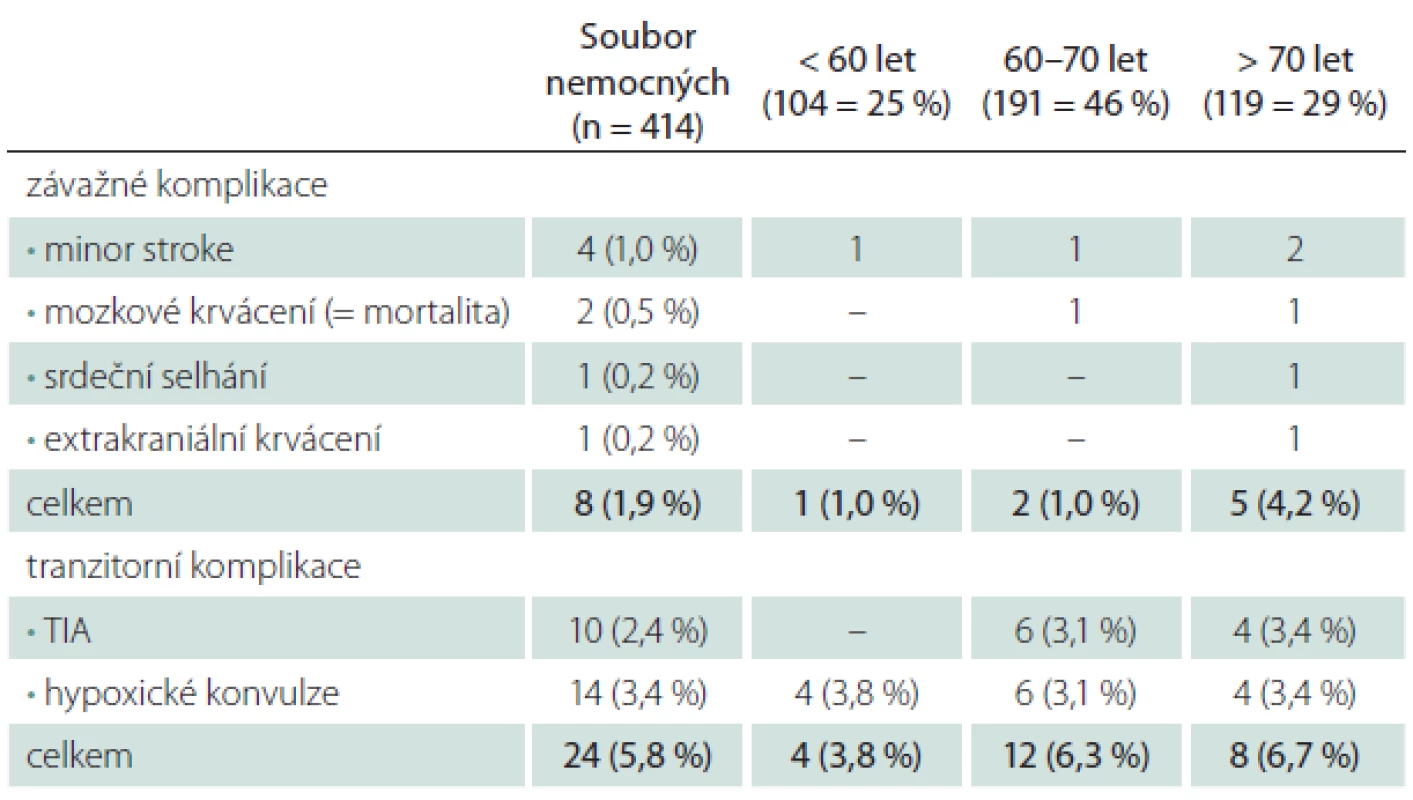
TIA – tranzitorní ischemická ataka. Tranzitorní komplikace jsme zaznamenali u 5,3 % CAS (TIA 2,2 %, hypoxické konvulze 3,1 %) (tab. 3). V šesti případech z celkového počtu 10 mužů s TIA vznikla komplikace intraprocedurálně, u zbývajících čtyř mužů v prvních hodinách po výkonu, v polovině případů při současných projevech hemodynamické nestability. Generalizované končetinové konvulze, které jsou projevem přechodné hypoxie mozku během dilatace tepny a rychle ustupují po desuflaci balónku, byly sice častější po ošetření symptomatických (3,6 %) než asymptomatických stenóz (2,6 %), v absolutních číslech se však jednalo o rozdíl dvou výkonů. Riziko této komplikace zvyšovalo současné ošetření dvou tepen (5,9 vs. 3,4 % v celém souboru) (tab. 4).
Table 3. Tranzitorní periprocedurální komplikace a status tepny. 
TIA – tranzitorní ischemická ataka. Table 4. Periprocedurální komplikace u rizikových skupin. 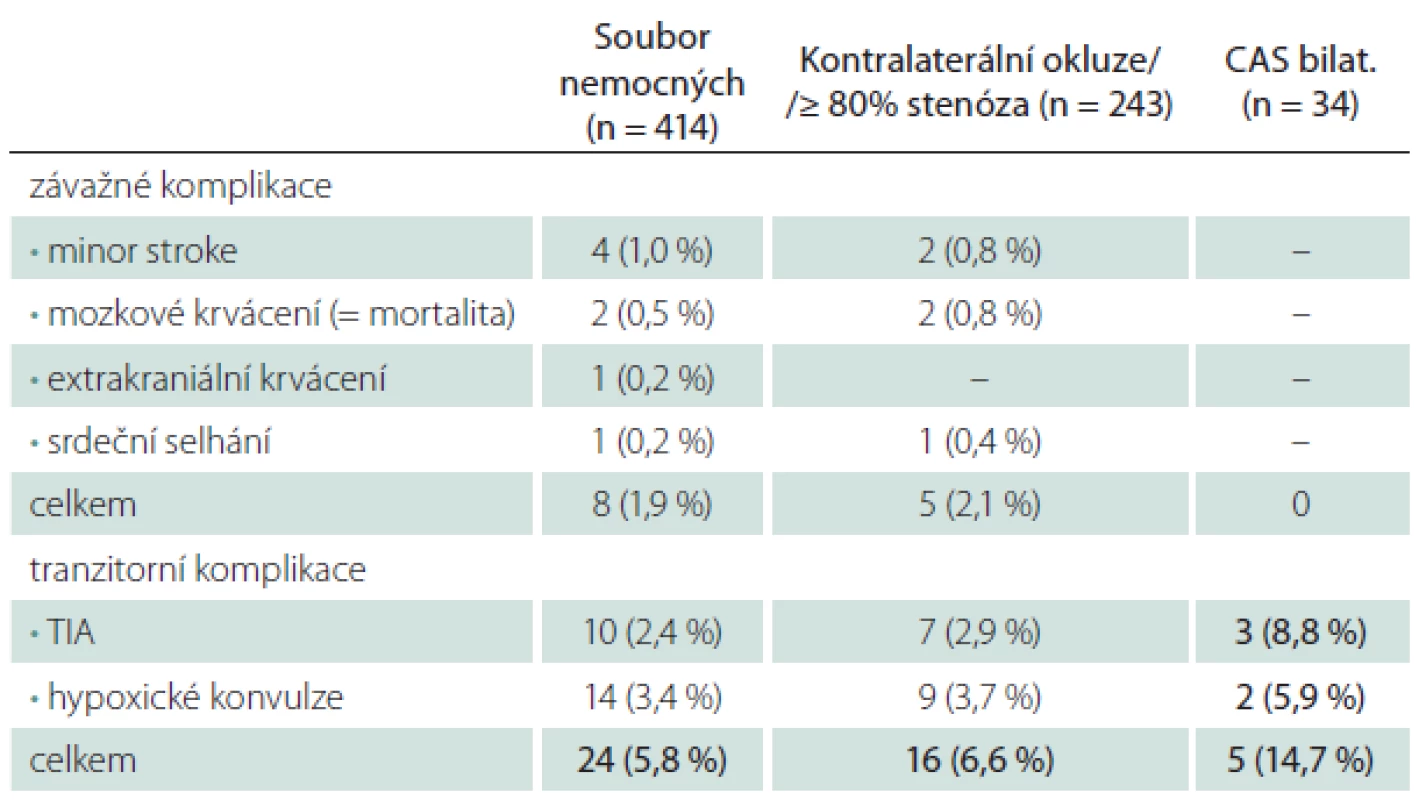
TIA – tranzitorní ischemická ataka, CAS – karotický stenting. Věk > 70 let při srovnání s věkem < 70 let znamenal čtyřnásobné riziko závažné periprocedurální komplikace, výskyt tranzitorních komplikací byl věkem ovlivněn méně (tab. 2).
Ženy měly vyšší riziko závažných komplikací (2,7 vs. 1,7 % u mužů), týkalo se však pouze krvácivých komplikací (tab. 5). Muži měli naopak větší dispozici k ischemickým komplikacím – všechny ložiskové ischemie (minor stroke, TIA) v našem souboru postihly jenom muže. Ženy měly i menší riziko hypoxických konvulzí během dilatace tepny.
Table 5. Periprocedurální komplikace a pohlaví. 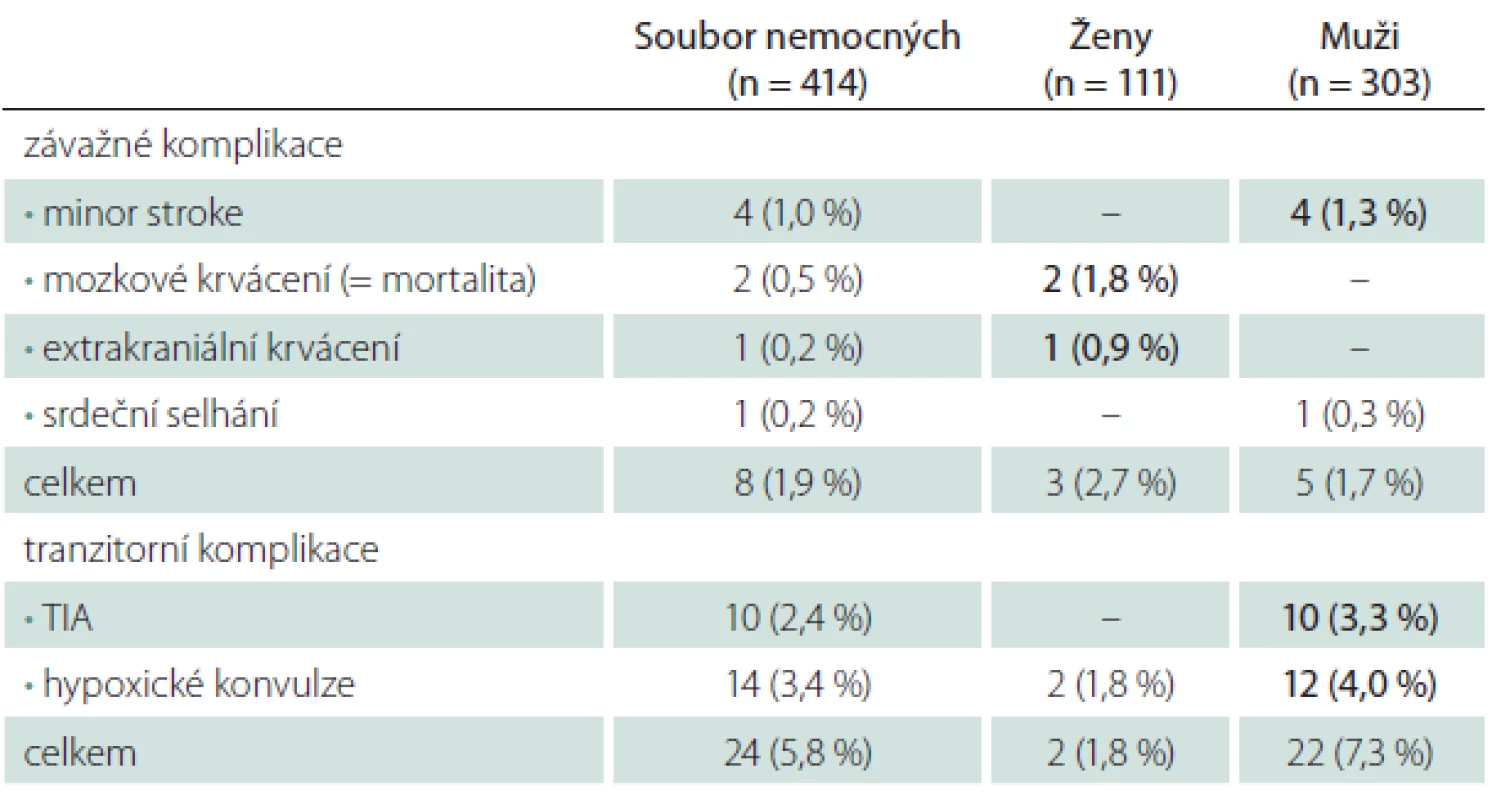
TIA – tranzitorní ischemická ataka. Za riziko pro CAS jsme považovali závažný polystenotický proces u 59 % nemocných a současné ošetření dvou tepen u 8 % nemocných (tab. 4). CAS v těchto skupinách byl provázen jen lehce vyšším počtem závažných periprocedurálních komplikací (M/M 2,1 vs. 1,9 % v celém souboru), u 34 případů současně oboustranného CAS se závažná komplikace nevyskytla ani jedenkrát. Tranzitorní komplikace byly jen lehce častější u polystenotického procesu (6,6 vs. 5,8 %), ale zřetelně častější při současném ošetření dvou tepen (14,7 vs. 5,8 %).
S narůstajícím počtem výkonů klesalo riziko periprocedurální komplikace. Po prvních 15 angioplastikách, které provázel větší počet hypoxických konvulzí (20 %), došlo v dalším období k významnému poklesu všech fokálních i nefokálních ischemických komplikací (minor stroke, TIA, hypoxické konvulze) a tento trend, i když již méně výrazný, dále pokračoval. Riziko mozkového krvácení rostoucí zkušeností nebylo ovlivněno (tab. 6).
Table 6. Periprocedurální komplikace vs. zkušenost. 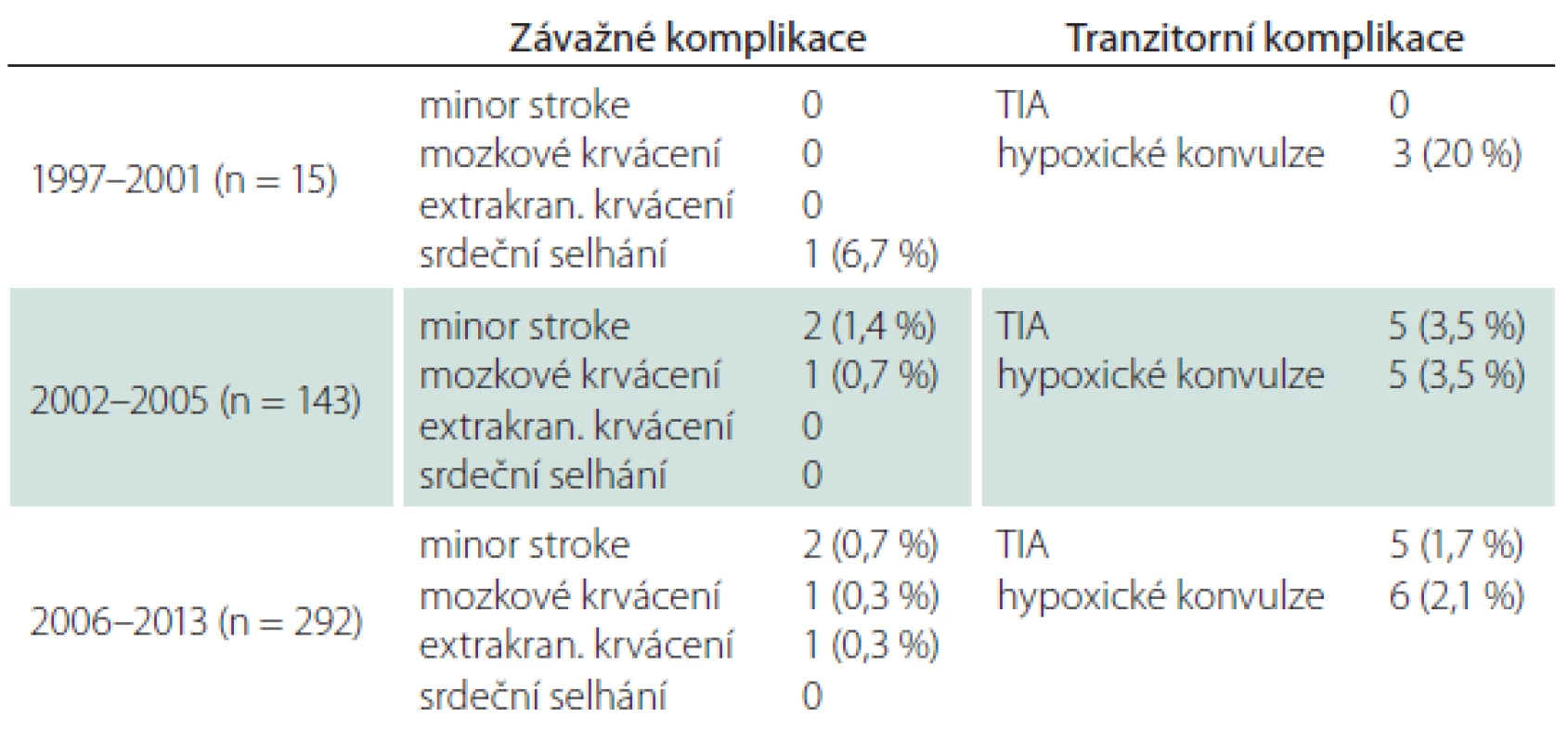
TIA – tranzitorní ischemická ataka. Dva případy mozkového krvácení představují nejzávažnější komplikace v našem souboru, protože byly jedinými komplikacemi, které vedly ke smrti. První bylo masivní intraventrikulární krvácení u 72leté ženy v roce 2003, které se manifestovalo 2 hod po CAS a které jsme popsali již dříve [12]. Druhé, tentokrát parenchymové krvácení o čtyři roky později se manifestovalo 28 hod po nekomplikovaném CAS u 65leté ženy. Nemocná zemřela třetí den a sekce prokázala masivní tříštivé destruující hemisferální krvácení. Vedlejším zjištěním byl karcinom ledviny s metastázami do plic a hilových uzlin.
Ze čtyř drobných mozkových ischemií (všechny u mužů) s projevy trvajícími > 60 min, které se všechny manifestovaly již během ošetření, neurodeficit plně regredoval ještě během hospitalizace u tří nemocných.
Dlouhodobé výsledky
Dlouhodobě jsme sledovali 315 nemocných (76 %) – 230 mužů a 85 žen – s 342 ošetřenými tepnami. Průměrná doba sledování byla 33,2 měsíce, medián 33 měsíce. Během této doby jsme identifikovali 4,7 % restenóz ≥ 70 % (16/342), u mužů 4,4 % (11/252), u žen 5,6 % (5/90) (tab. 7, 8). Faktorem, který významně snížil pravděpodobnost vývoje restenózy, byla implantace stentu. Zatímco v souboru šesti sledovaných samotných balónkových angioplastik (PTA) jsme zjistili čtyři restenózy (67 %), v souboru zbývajících dlouhodobě sledovaných 336 CAS jsme identifikovali pouhých 12 restenóz, což je 3,6 %. Vyšší výskyt restenóz u žen souvisel s častější PTA u žen (šest z celkového poštu osmi) – ze čtyř restenóz po PTA tři postihly ženy.
Nemocní, u kterých jsme identifikovali restenózu po CAS, měli vysokou dispozici k vývoji restenóz i po CEA. Ve skupině 16 restenóz vzniklých po angioplastice u všech šesti nemocných, kteří byli předtím léčeni metodou CEA, vznikla restenóza i po chirurgické léčbě (tab. 7, 8). Okluzi nebo ≥ 80% stenózu nejméně jedné další magistrální mozkové tepny mělo 73 % těchto mužů a 80 % žen (v celém souboru 59 %). Naprostá většina restenóz (u mužů 82 %, u žen 80 %) byla asymptomatická, což je stejné jako v případě 54 restenóz po CEA v celém souboru, z nichž bylo asymptomatických 78 %. Ze tří symptomatických restenóz po angioplastice se v jednom případě jednalo o drobný ischemický inzult (minor stroke), dvakrát o TIA. K reintervenci jsme se rozhodli u 75 % restenóz (12/16). Ačkoliv medián vzniku restenóz byl 13 měsíců u mužů a 19 měsíců u žen, v některých případech vznikly restenózy podstatně později.
Table 7. Restenózy u mužů. 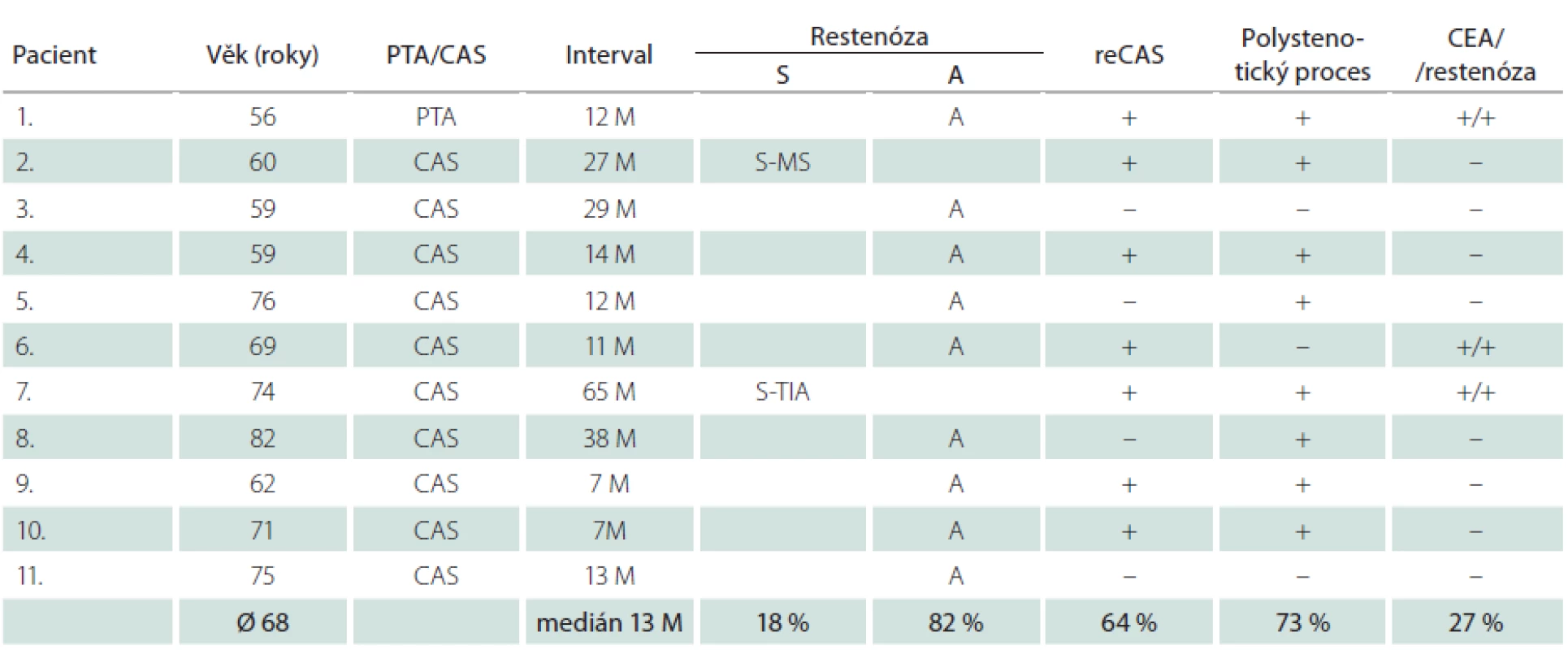
PTA – perkutánní transluminální angioplastika (bez implantace stentu), CAS – karotický stenting, reCAS – reintervence, CEA – karotická endarterektomie, M – měsíc, S – symptomatická, A – asymptomatická, MS – minor stroke, TIA – tranzitorní ischemická ataka. Table 8. Restenózy u žen. 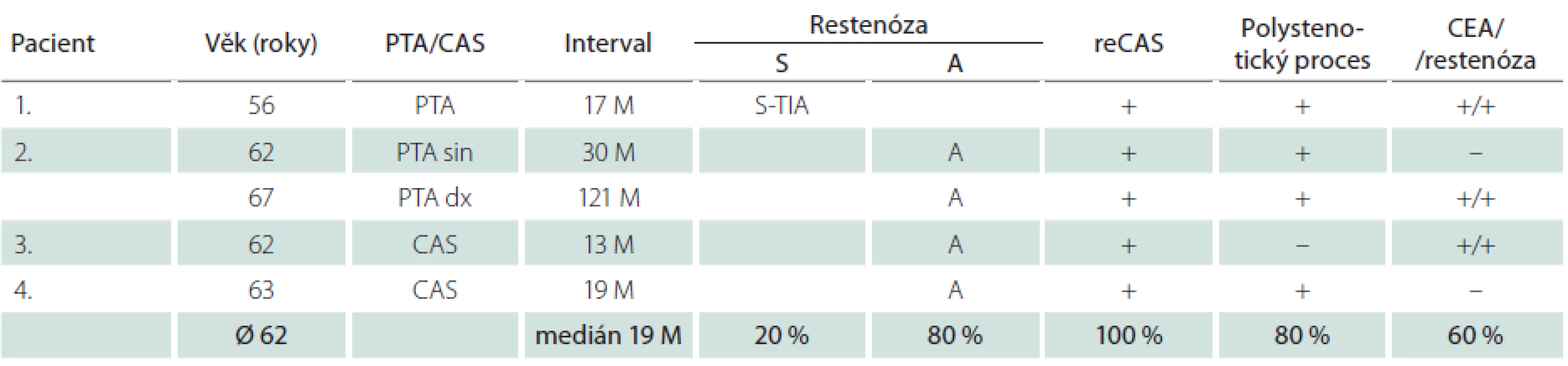
PTA – perkutánní transluminální angioplastika (bez implantace stentu), CAS – karotický stenting, reCAS – reintervence, CEA – karotická endarterektomie, M – měsíc, S – symptomatická, A – symptomatická, MS – minor stroke, TIA – tranzitorní ischemická ataka, sin – vlevo, dx – vpravo. Diskuze
Angioplastiky v našem souboru byly provedeny s nízkým procentem komplikací – u všech 450 angioplastik/ resp. 292 CAS v posledních šesti letech: M/M ukazatel 1,8/1,3 %, mortalita 0,4/0,3 %, minor stroke 0,9/0,7 %, TIA 2,2/1,7 %. Ošetření symptomatických stenóz nebylo spojeno s větším rizikem fokálních ischemických komplikací (minor stroke, TIA). Mechanizmus vzniku hypoxických konvulzí nasvědčuje tomu, že rozdíl dvou nemocných proti skupině asymptomatických stenóz je velmi pravděpodobně náhodný. Potvrdili jsme předchozí zjištění [13,14], že CAS při okluzi druhostranné karotické tepny nebo v terénu jiného polystenotického postižení nemá vyšší riziko periprocedurální komplikace. Současné ošetření dvou tepen však bylo provázeno větším počtem TIA a hypoxických konvulzí. Potvrdili jsme výsledky randomizovaných studií (RCT), že riziko CAS není vyšší pro ženy, ale významně narůstá s věkem > 70 let [7,15–17]. Vysvětlení spočívá ve větší pravděpodobnosti distální embolizace v důsledku pokročilých kalcifikací a tortuozit aterosklerotických tepen spolu se snížením cerebrovaskulární rezervy u těchto nemocných [18]. Podobně příznivé výsledky referují i další pracoviště v České republice, vyšší věkový průměr (72 let) mohl být důvodem lehce vyššího počtu periprocedurálních komplikací souboru 363 CAS [19,20].
Naše výsledky jsou srovnatelné s výsledky velkých registrů. V registru CAPTURE 2 s 5 297 nemocnými léčenými metodou CAS ve 186 centrech USA, s 22% podílem osmdesátníků, byl v celém souboru ukazatel ischemické cévní mozkové příhody (CMP)/úmrtí 3,3 % a samotné CMP 2,7 % (major stroke 0,8 %, minor stroke 1,9 %) [8]. Při analýze 10 598 pojištěnců Medicare léčených v letech 2004 – 2006 metodou CEA nebo CAS bylo zjištěno, že počet periprocedurálních komplikací byl u obou metod podobný – CMP u CAS 1,9 %, u CEA 1,4 % (p = 0,14) a mortalita u CAS 0,9 %, u CEA 0,6 % (p = 0,20) [21].
S rostoucí zkušeností operatéra v našem souboru klesala pravděpodobnost periprocedurálních ischemických komplikací. Operatérova zkušenost má pro bezpečný průběh výkonu zásadní význam. V souboru 2 124 po sobě následujících CAS provedených v letech 2000–2009 v jednom centru byla ve 30 dnech četnost TIA 2,72 %, drobné CMP 1,55 %, závažné CMP 1,18 % a úmrtí v důsledku CMP 0,61 % (téměř polovina způsobena mozkovým krvácením). Jediným protektivním faktorem proti periproceduální komplikaci byla zkušenost s > 100 provedenými výkony (OR 0,81; 95% CI 0,67–0,95) [22]. Riziko mozkového krvácení, ke kterému přispívá nutná duální protidestičková a antikoagulační léčba a ve které je na rozdíl od CEA pokračováno i po výkonu, lze ovlivnit méně.
Procento zjištěných > 70% restenóz v průběhu dlouhodobého sledování bylo v našem souboru nízké – 3,6 %, přičemž 81 % z nich bylo asymptomatických. Procento restenóz v RCT kolísá mezi 3,3 % v EVA-3S, 6 % v CREST a 11 % v SPACE [13,23–25]. Vysoké riziko restenóz po CAS nebývá zjišťováno ani v reálné praxi. Dokumentuje to multicentrická studie z roku 2000, v jejímž souboru 3 924 nemocných byla za jeden rok od CAS zjištěna restenóza > 50 % u 3,46 % nemocných [26].
Výsledky RCT i registrů nasvědčují tomu – a naše zkušenost s tím koresponduje – že naprostá většina restenóz zůstává asymptomatická. Ve studii SPACE pouze dva nemocní s restenózou prodělali během dvouletého sledování mozkovou ischemii. Podobně nízká byla incidence rekurentních mozkových ischemií i ve studii EVA-3S. V nizozemské studii se 178 nemocnými s > 50% restenózou pouze 13 z nich (7,3 %) během dalšího sledování prodělalo mozkovou ischemii. Reintervence byla provedena pouze u 15 restenóz (8,4 %) [27].
Pro indikaci reintervence chybí důkazy založené na výsledcích RCT a rozhodnutí tak většinou vychází z méně či více všeobecného konsenzu. Přesvědčivou indikací je symptomatičnost restenózy. Další indikací, která se ve snaze zlepšit mozkovou perfuzi jeví být oprávněná, je restenóza v terénu polystenotického postižení. Většinou indikujeme také reintervenci u restenózy, která jasně progreduje v čase, z obavy z dalšího vývoje. Zda je tato obava opodstatněná, v současné době však nevíme. První zjištění jednostranné restenózy by k indikaci reintervence dostačovat nemělo.
Dosahované výsledky CAS vedly k tomu, že v roce 2011 byly American Heart Association (AHA) a American Stroke Association (ASA) a 12 dalšími americkými odbornými společnostmi formulovány společné směrnice [28] a prakticky současně NICE směrnice [29], které zmírnily předešlá indikační kritéria. Podle nich je CAS indikován pro symptomatické nemocné s > 70% stenózou, kteří mají průměrné (nové doporučení) nebo nízké riziko endovaskulární léčby a k jeho provádění stačí standardní podmínky (starší směrnice vyžadovaly „special arrangements“). Poslední AHA/ASA směrnice z roku 2014 [30] doplnily, že zatímco pro nemocné > 70 let je vhodnější metodou CEA, u mladších nemocných je CAS z hlediska rizika periproceduálních komplikací a dlouhodobého výsledku rovnocenná s CEA.
CAS musí být vždy indikován na základě individuální pravděpodobnosti komplikací a očekávaného benefitu. Analogicky s CEA je za akceptovanou horní hranici periprocedurálních komplikací (úmrtí/ CMP) u symptomatických stenóz považováno 6 %, u asymptomatických stenóz 3 % [31,32].
V poslední době se i u CAS, obdobně jako již dlouho u CEA, objevuje trend k časným výkonům ≤ 14 dnů od okamžiku, kdy stenóza začala být symptomatická. Dosud publikované soubory referují rozdílné výsledky [33,34]. Naše zkušenosti s urgentními CAS provedenými pod protokolem léčby akutní CMP u pečlivě vybraných nemocných s tandemovými stenózami nasvědčují tomu, že tento trend je oprávněný.
Závěr
Výběr optimální léčebné metody – CEA nebo CAS – by měl rozhodnout multidiscipilinární tým sestávající z neurologa vzdělaného v cerebrovaskulární problematice, cévního chirurga nebo neurochirurga a intervenčního radiologa. Doporučení musí respektovat individuální riziko nemocného a mělo by přihlédnout i k jeho preferenci.
CAS je při pečlivém výběru nemocného a v rukou zkušeného operatéra bezpečná a účinná léčebná alternativa CEA u nemocných mladších 70 let.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: dagmar.krajickova@fnhk.cz
Přijato k recenzi: 9. 2. 2015
Přijato do tisku: 17. 3. 2015
Sources
1. Wimmer NJ, Yeh RW, Cutlip DE, et al. Risk prediction for adverse events after carotid stenting in higher surgical risk patients. Stroke 2012;4(12):3218–24. doi: 10.1161/STROKEAHA.112.673194.
2. Rothwell PM, Slattery J, Warlow CP. Clinical and angiographic predictors of stroke and death from carotid endarterectomy: systematic review. BMJ 1997;315(7122):1571–7.
3. Frawley JE, Hicks RG, Woodforth IJ. Risk factors for perioperative stroke complicating carotid endarterectomy: selective analysis of a prospective audit of 1,000 consecutive operations. Aust NZJ Surg 2000;70(1):52–6.
4. Touzé E, Trinquart L, Chatellier G, et al. Systematic review of the perioperative risks of stroke or death after carotid angioplasty and stenting. Stroke 2009;40(12):e683–93. doi: 10.1161/STROKEAHA.109.562041.
5. Al-Mubarak N, Roubin GS, Iyer SS, et al. Carotid artery stenting. Current practice and techniques. Philadelphia: Lippincott Williams & Williams 2004.
6. Chiam PT, Roubin GS, Iyer SS, et al. Carotid artery stenting in elderly patients: importance of case selection. Catheter Cardiovasc Interv 2008;72(3):318–24. doi: 10.1002/ccd.21620.
7. Bonati LH, Dobson J, Algra A, et al. Short-term outcomes after stenting versus endarterectomy for symptomatic carotid stenosis. A preplanned meta-analysis of individual patient data. Lancet 2010;376(9746):1062–73. doi: 10.1016/S0140-6736(10)61009-4.
8. Chaturvedi S, Matsumura JS, Gray W, et al. Carotid artery stenting in octogenarians. Periprocedural stroke risk predictor analysis from the multicenter carotid ACCULINK/ACCUNET Post Approval Trial to Uncover Rare Events (CAPTURE 2) clinical trial. Stroke 2010;41(4):757–64. doi: 10.1161/STROKEAHA.109.569426.
9. Voeks JH, Howard G, Roubin GS, et al. Age and outcomes after carotid stenting and endarterectomy: the carotid revascularization endarterectomy versus stenting trial. Stroke 2011;42(12):3484–90. doi: 10.1161/STROKEAHA.111.624155.
10. Krajina A, Náhlovský J, Krajíčková D. Endovaskulární léčebné výkony v neurochirurgii. In: Náhlovský J et al. Neurochirurgie. 1. vyd. Praha: Galén, Karolinum 2005 : 229–53.
11. Krajíčková D, Krajina A, Lojík M, et al. Naše zkušenosti s angioplastikami mozkových tepen. Cesk Slov Neurol N 2005;68/101(4):241–50.
12. Krajíčková D, Krajina A, Nová M, et al. Fatal intraventricular hemorrhage after the extracranial carotid artery angioplasty and stent placement. Cardiovasc Intervent Radiol 2005;28(4):502–5.
13. Eckstein HH, Ringleb P, Allenberg JR, et al. Results of the stent-protected angioplasty versus carotid endarterectomy (SPACE) study to treat symptomatic stenosis at 2 years: a multinational, prospective, randomized trial. Lancet Neurol 2008;7(10):893–902. doi: 10.1016/S1474-4422(08)70196-0.
14. Keldahl ML, Park MS, Garcia-Toca M. Does a contralateral carotid occlusion adversely impact carotid artery stenting outcomes? Ann Vasc Surg 2012;26(1):40–5. doi: 10.1016/j.avsg.2011.07.005.
15. Silver FL, Mackey A, Clark WM, et al. Safety and stenting and endarterectomy by symptomatic status in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST). Stroke 2011;42(3):675–80. doi: 10.1161/STROKEAHA.110.610212.
16. Hobson RW, Howard VJ, Roubin GS, et al. Carotid artery stenting is associated with increased complications in octogenarians: 30-day stroke and death rates in the CREST lead-in phase. J Vasc Surg 2004;40(6):1106–11.
17. Howard JV, Voeks JH, Lutsep HL, et al. Does sex matter? Thirty-day stroke and death rates after carotid artery stenting in women versus men. Results from the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST) lead-in phase. Stroke 2009;40(4):1140–7. doi: 10.1161/STROKEAHA.108.541847.
18. Lam RC, Lin SC, DeRubertis B, et al. The impact of increasing age on anatomic factors affecting carotid angioplasty and stenting. J Vasc Surg 2007;45(5):875–80.
19. Přibáň V, Fiedler J, Baránková L, et al. Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti. Cesk Slov Neurol N 2008;71/104(1):75–80.
20. Beneš V, Netuka D, Charvát F, et al. Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště. Cesk Slov Neurol N 2008;71/104(4):400–4.
21. Wang FW, Esterbrooks D, Kuo YF, et al. Outcomes after carotid artery stenting and endarterectomy in the Medicare population. Stroke 2011;42(7):2019–25. doi: 10.1161/STROKEAHA.110.608992.
22. Setacci C, Chisci E, Setacci F, et al. Siena carotid artery stenting score. A risk modelling study for individual patients. Stroke 2010;41(6):1259–65. doi: 10.1161/STROKEAHA.110.578583.
23. Arquizan C, Trinquart L, Touboul PJ, et al. Restenosis is more frequent after carotid stenting than after endarterectomy. Stroke 2011;42(4):1015–20. doi: 10.1161/STROKEAHA.110.589309.
24. Lal BK, Breach KW, Roubin GS, et al. Restenosis after carotid artery stenting and endarterectomy: a secondary analysis of CREST, a randomized controlled trial. Lancet Neurol 2012;11(9):755–63.
25. Lanzino G, Burrows AM, Tymianski M. Advances in stroke. Vascular neurosurgery. Stroke 2013;44(2):316–7. doi: 10.1161/STROKEAHA.111.000385.
26. Wholey MH, Wholey M, Mathias K, et al. Global experience in cervical carotid artery stent placement. Catheter Cardiovasc Intervent 2000;50(2):160–7.
27. van Lammeren GW, Peeters W, de Vries JP, et al. Restenosis after carotid surgery. The importance of clinical presentation and preoperative timing. Stroke 2011;42(4):965–71. doi: 10.1161/STROKEAHA.110.603746.
28. Brott TG, Halperin JL, Abbara S, et al. 2011 ASA/ ACCF/ AHA/ AANN/ AANS/ ACR/ ASNR/ CNS/ SAIP/ SCAI/ SIR/ SNIS/ SVM/ SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: a report of the American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines; American Stroke Association; American Association of Neurological Surgeons; American College of Radiology; American Society of Neuroradiology; Congress of Neurological Surgeons; Society of Atherosclerosis Imaging and Prevention; Society for Cardiovascular Angiography and Interventions; Society of Interventional Radiology; Society of NeuroInterventional Surgery; Society for Vascular Medicine; Society for Vascular Surgery; American Academy of Neurology; Society of Cardiovascular Computed Tomography. J Am Coll Cardiol 2011;57(8):1002–44. doi: 10.1016/j.jacc.2010.11.005.
29. Carotid artery stenting for symptomatic extracranial carotid stenosis, consultation document National Institute for Health and Clinical Excellence. [online]. Available from URL: http://www.nice.org.uk/guidance/index.jsp?action=article&o-52289.
30. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014;45(7):2160–236. doi: 10.1161/STR.0000000000000024.
31. Paraskevas KI, Mikhailidis DP, Veith FJ. Comparison of the five 2011 guidelines for the treatment of carotid stenosis. J Vasc Surg 2012;55(5):1504–8. doi: 10.1016/j.jvs.2012.01.084.
32. Furie KL, Kasner SE, Adams RJ, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2011;42 : 227–76. doi: 10.1161/STR.0b013e3181f7d043.
33. Gröschel K, Knauth M, Ernemann U. Early treatment after a symptomatic event is not associated with an increased risk of stroke in patients undergoing carotid stenting. Eur J Neurol 2008;15(1):2–5.
34. Rantner B, Goebel G, Bonati LH. The risk of carotid artery stenting compared with carotid endarterectomy is greatest in patients treated within 7 days of symptoms. J Vasc Surg 2013;57(3):619–26. doi: 10.1016/j.jvs.2012.08.107.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 3-
All articles in this issue
- MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
- Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
- Korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
- Validační studie české verze Bostonského testu pojmenování
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Baha jako možné řešení jednostranné hluchoty
- Léčba gama nožem u algických syndromů v inervační oblasti nervus glossopharyngeus
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
- Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty
- Pacient s homozygozitou mutácie E200K v rodine slovenského klastru genetickej formy Creutzfeldtovej-Jakobovej choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Schwannom nejspíše z krčního sympatiku – kazuistika
- Validační studie české verze Bostonského testu pojmenování
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

