-
Medical journals
- Career
Multimodální neurozobrazování pomocí simultánního EEG-fMR
Authors: R. Mareček 1; M. Mikl 1; I. Rektor1ihash2 ,2 ,2
Authors‘ workplace: Středoevropský technologický institut (CEITEC), MU, Brno 1; Centrum pro epilepsii Brno, I. neurologická klinika LF MU a FN u sv. Anny v Brně 2
Published in: Cesk Slov Neurol N 2012; 75/108(1): 18-22
Category: Review Article
Overview
Simultánní snímání elektroencefalografických dat a funkční magnetické rezonance je moderní multimodální zobrazovací metoda používaná v neurozobrazování. Integruje v sobě výhodné vlastnosti obou modalit. Uplatnění nachází především v epileptologii (identifikace epileptogenního ložiska) a dále obecně při studiu funkčních sítí v mozku. V přehledném referátu je popsána metodika akvizice dat, postupy zpracování dat a uvedeny jsou nejčastější aplikace této metody.
Klíčová slova:
elektroencefalografie – funkční magnetická rezonance – multimodální zobrazování – epilepsieÚvod
Multimodální neurozobrazovací techniky se používají a vyvíjejí paralelně se standardními unimodálními neurozobrazovacími technikami. Lidský mozek je velmi komplexní systém a je zřejmé, že informace obsažené v jedné modalitě nemohou tento systém plně popsat. Jako naprosto legitimní se tedy jeví snaha kombinovat různé modality mezi sebou, a získat tak lepší náhled na celý systém a snad ho poté i lépe chápat. Navíc některé jevy jsou lépe pozorovatelné pomocí jedné modality, zatímco pozorovatele zajímá s tímto jevem spjatá informace obsažená v druhé modalitě. Svou roli při rozvíjení multimodálních zobrazovacích technik jistě hraje i přirozená lidská snaha překonávat technické výzvy. Jednou z těchto multimodálních metod je simultánní snímaní elektroencefalografického (EEG) signálu během akvizice dat funkční magnetické rezonance (fMR). EEG-fMR v sobě spojuje dobré vlastnosti obou modalit. Výborné časové rozlišení EEG signálu v řádech ms dovoluje zkoumat detailně aktivitu mozku a taky velmi precizně kauzální souvislosti mezi signály generovanými v jeho různých částech. Velmi hrubé je však prostorové rozlišení, a tím i přesná představa o lokalizaci generátorů těchto signálů. To je kompenzováno vlastnostmi fMR, která umožňuje sledovat hemodynamické změny v mozku pomocí Blood Oxygen Level Dependent (BOLD) signálu naměřeného s prostorovým rozlišením v jednotkách mm. Rostoucí počet článků využívajících tuto metodu dokazuje, že benefit, který tato metoda přináší, převyšuje technické a ekonomické problémy.
Cílem předkládaného sdělení je seznámit čtenáře s metodou simultánního EEG-fMR. V první části budou popsána specifika EEG-fMR systému. V druhé pak specifické artefakty obsažené v EEG signálu a metody jejich odstranění. Dále budou uvedeny strategie zpracování EEG-fMR dat a dvě konkrétní aplikace diskutované multimodální zobrazovací metody.
EEG-fMR systém
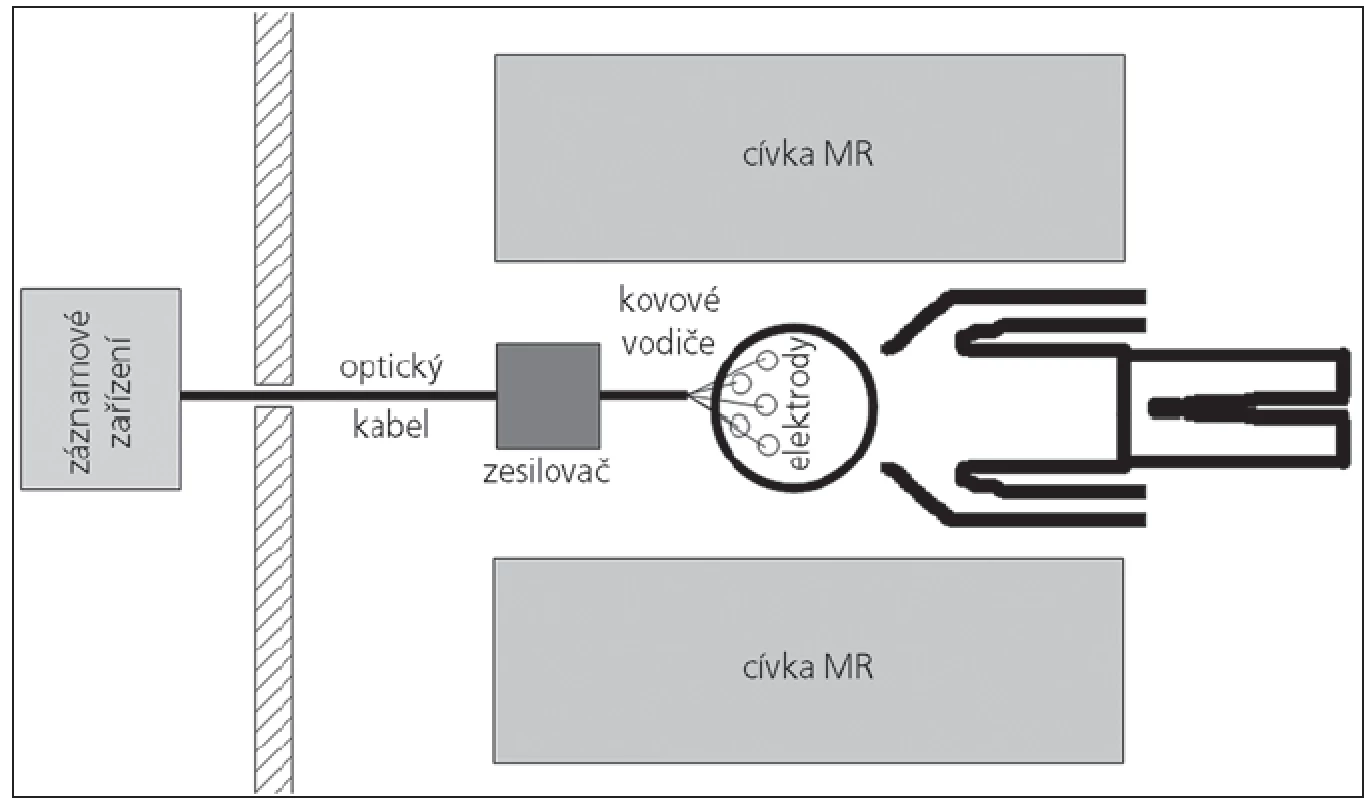
Popis jednotlivých modalit je nad rámec tohoto článku. Pro více informací o EEG odkazujeme na [1] a pro více informací o fMR na [2–4]. Základním specifikem EEG-fMR je MR kompatibilní EEG systém (obr. 1). Ten se skládá z čepice, která je spojena krátkým kabelem se zesilovačem. V něm je EEG signál převeden do digitální podoby a optickým kabelem přenesen mimo prostor MR do záznamového zařízení. Zároveň musí být zajištěna synchronizace akvizice MR dat s akvizicí EEG dat, typicky zanesením značek do EEG signálu. Ty označují okamžik akvizice jednotlivých MR skenů. Spolu s EEG signálem je třeba snímat také EKG signál (elektroda pro EKG bývá součástí snímací čepice), který je důležitý pro pozdější odstranění pulzních artefaktů v EEG signálu. Většina systémů umožňuje doplňkově snímat i další typy signálů, např. EOG, EMG atd. V současné době je na trhu několik komerčních systémů, jejichž uspořádání v zásadě odpovídá výše popsanému systému. Odlišnosti lze najít spíše ve zpracování jednotlivých komponent. Většina systémů pracuje se vzorkovací frekvencí nad 1kHz (až 5 kHz), což je dostačující pro klinické i vědecké využití. Určitý kompromis je třeba zvolit v počtu EEG kanálů. S vyšším počtem kanálů roste prostorové rozlišení EEG dat, a tím i přesnost výsledků, ale také časová náročnost přípravy měřeného subjektu – problém především v klinické praxi. Počet kanálů v zesilovači a počet EEG elektrod na čepici se tak pohybuje od 30 (většinou klinické aplikace) až po 256. Důležitým parametrem při výběru EEG-fMR systému je rovněž programové vybavení, především z hlediska odstranění artefaktů z EEG signálu.
Artefakty v EEG signálu
Specifickou vlastností EEG signálu naměřeného v MR je silná kontaminace artefakty. Ty lze rozdělit do dvou základních skupin podle zdroje: a) artefakty související s akvizicí MR skenů a b) pulzní artefakt.
a) Artefakty související s akvizicí MR skenů
Nejvýraznějším artefaktem v EEG je tzv. gradientní artefakt (obr. 2a). Snímání echoplanárních (EPI) sekvencí je doprovázeno rychlým přepínáním gradientních magnetických polí, která zajišťují prostorové kódování obrazu, a dále radiofrekvenčními budícími pulzy. V gantry MR se tedy rychle mění magnetické pole a v souladu s Faradayovým zákonem o elektromagnetické indukci se v elektrodách a kovových vodičích (spojujících čepici a zesilovač) indukuje rušivé elektrické napětí s amplitudami řádově většími než má fyziologický EEG signál. Tento rušivý aditivní signál má velmi pravidelný periodický průběh v rytmu akvizice EPI skenů a zanedbatelnou korelaci s fyziologickým EEG signálem. To umožňuje použití relativně jednoduchých subtrakčních metod k jeho odstranění. Standardně používanou metodu Average Artifact Subtraction (AAS) představili Allen et al v roce 2000 [5]. Korekce probíhá zvlášť pro každý kanál. EEG signál je segmentován na epochy odpovídající jednotlivým EPI akvizicím. Z každé epochy je poté odečten signál získaný zprůměrněním několika okolních epoch. Tato jednoduchá korekce předpokládá časovou stacionaritu EEG artefaktu – předpoklad, který v důsledku pohybu subjektu nebývá úplně splněn. K řešení tohoto problému byla navržena řada modifikací metody AAS, např. zanesení diskriminujících kritérií při výběru epoch pro výpočet průměrného artefaktu.
Image 2. Artefakty v EEG signálu. a) gradientní artefakt, b) pulzní artefakt, c) artefakt způsobený pumpou chladicí kapaliny ve formě špiček ve spektru EEG signálu, typicky kolem 40 Hz. 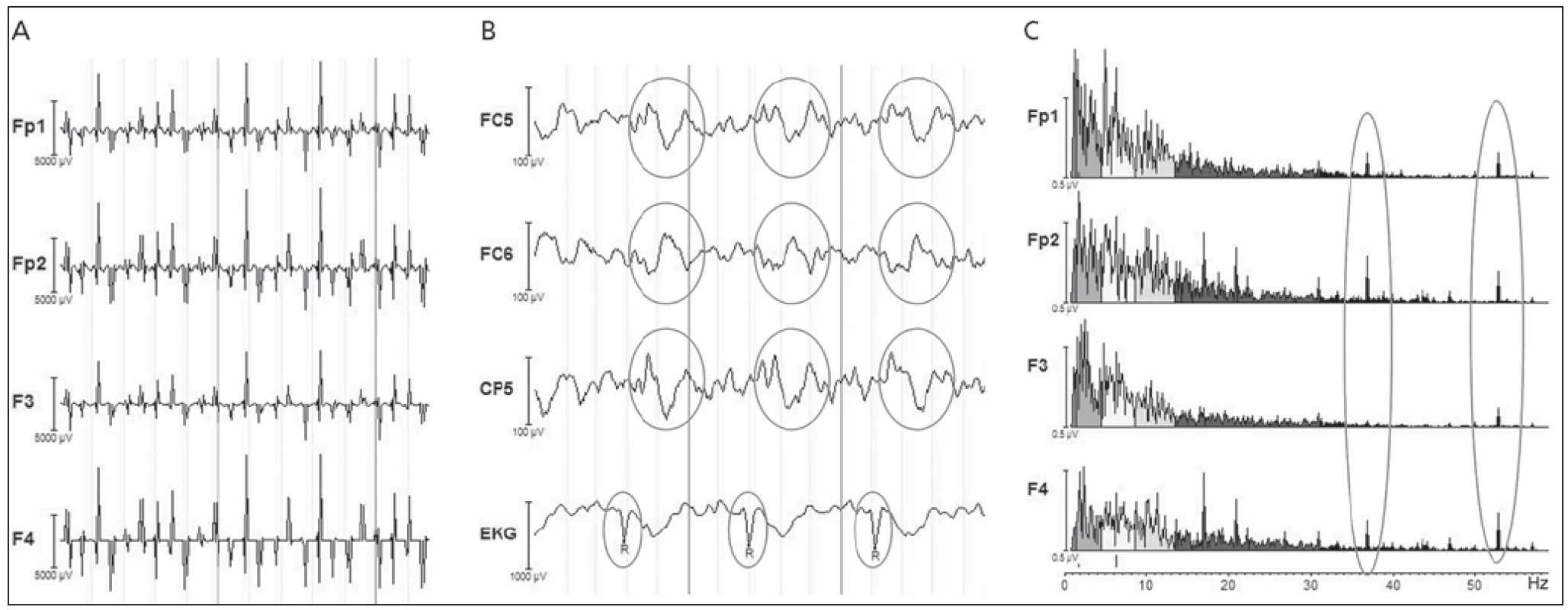
Dalším zdrojem artefaktů je pumpa chladicí kapaliny, která způsobuje vibrace celé konstrukce, a tím vířivé proudy v cívce magnetu. Ty poté indukují rušivé napětí ve vodičích, které se projeví špičkami ve výkonovém spektru EEG signálu (typicky kolem 40Hz včetně vyšších harmonických) (obr. 2c). Ke korekci těchto artefaktů lze využít standardní filtry typu pásmová zádrž. Vibrace konstrukce spolu s jakýmkoli pohybem hlavy pacienta se přenášejí na kovové vodiče mezi čepicí a zesilovačem, a jsou tak dalším významným zdrojem artefaktů, neboť pohyb vodičů v magnetické poli způsobuje indukci rušivého napětí. Tyto artefakty lze významně redukovat vhodným uspořádáním vodičů v gantry – zabráněním tvorby smyček, uložením paralelně s podélnou osou magnetického pole, uložením na měkkou podložku a zatížením např. pískovými pytlíky.
b) Pulzní artefakt
Pulzní artefakt [6] se vyznačuje kvaziperiodickými vlnami časově svázanými s R vlnou EKG signálu (obr. 2b). Tyto vlny mají amplitudy i frekvenční spektrum podobné jako fyziologické EEG a často připomínají ostré vlny či hroty interiktálního EEG záznamu u pacientů s epilepsií. Vznik pulzního artefaktu je přisuzován pohybu vodivých součástí EEG systému v magnetickém poli, který souvisí se srdečním rytmem (přímé přenesení pohybu srdečního svalu na hlavu, pulzující krev v cévách na skalpu poblíž elektrod). Tento pohyb vede k indukci rušivého napětí. Ke korekci tohoto artefaktu se opět využívají subtrakční metody, např. AAS [6]. Časová nestacionarita je u pulzního artefaktu větší problém než u gradientního artefaktu, a k odhadnutí správného tvaru artefaktu se proto využívají i další pokročilejší statistické metody, u kterých časová nestacionarita nehraje roli – typicky analýza hlavních a nezávislých komponent (PCA, ICA).
Některé výše uvedené metody korekce pracují na principu subtrakce rušivého signálu ze surového naměřeného EEG. To někdy může způsobit neúmyslnou subtrakci i části fyziologického EEG. Důležitým krokem korekce EEG signálu je tedy porovnání s EEG signálem naměřeným mimo MR. Metody pro odstranění artefaktů jsou zpravidla součástí programových balíků komerčně dostupných systémů.
Zpracování EEG-fMR dat
EEG-fMR data mohou být zpracována mnoha přístupy, které se dají obecně klasifikovat pomocí dvou kritérií [7]:
1. Asymetrické vs symetrické zpracování
Asymetrickými jsou nazývány ty metody, u kterých jsou informace odvozené z dat jedné modality využity ke zpracování dat druhé modality. Typickým příkladem je zpracování klidových EEG-fMR dat u epileptických pacientů, kdy výboje nalezené v EEG signálu jsou brány jako události „event-related“ (ER) fMR experimentu. U symetrických metod zpracování jsou informace obsažené v obou modalitách využívány symetricky bez preference jedné z metod a při interpretaci výsledků nelze mluvit o kauzalitě mezi modalitami.
2. „Model vs data driven“ metody zpracování
Termínem „data driven“ jsou označovány metody, jejichž cílem je zjišťovat vzájemný vztah mezi informacemi obsaženými v datech obou modalit bez využití znalosti o kontextu, při němž byla data nasnímána. Jsou-li data snímána v kontextu nějaké vnější nebo vnitřní stimulace, je vhodnější použít „model driven“ metody, které umožňují znalost stimulace zohlednit při zpracování dat.
Během posledních 10 let bylo simultánní EEG-fMR využito k vyšetřování lidského mozku v řadě různých aplikací s různým přístupem ke zpracování takových dat. Podle počtu publikovaných článků se dá říci, že EEG-fMR se uplatňuje především ve dvou aplikacích: a) využití fMR při zkoumání epilepsie a b) zkoumání vztahu mezi různými EEG rytmy a hemodynamickými změnami ve fMR datech:
EEG-fMR a epilepsie
Historicky první klinická aplikace, která vedla k mohutnému rozvoji EEG-fMR metodiky, je snaha o identifikace epileptogenního ložiska sledováním hemodynamických změn ve fMR datech, jež souvisejí se spontánní epileptiformní aktivitou v interiktálním EEG u pacientů s fokální epilepsií. Časový průběh epileptiformní aktivity (okamžiky, kdy se v EEG objevují výboje) je podklad pro hledání související odezvy BOLD signálu. K analýze se obvykle používá obecný lineární model (GLM), kde jedním z regresorů je právě časový průběh epileptiformní aktivity konvolvovaný s modelem hemodynamické impulzní odezvy (HRF). Výsledkem analýzy pomocí GLM je statistická parametrická mapa znázorňující místa v mozku, v nichž hemodynamické změny signifikantně souvisí s epileptiformní aktivitou nalezenou v EEG (obr. 3).
Image 3. Zpracování fMR dat pomocí výbojů nalezených v interiktálním EEG záznamu. a) interiktální EEG s výboji, b) stimulační funkce vytvořená na základě výbojů, c) GLM regresor vytvořený jako konvoluce stimulační funkce a HRF, d) výsledná statistická mapa znázorňující místa hemodynamických změn souvisejících s výboji (signifikantní efekt regresoru ve fMR datech). 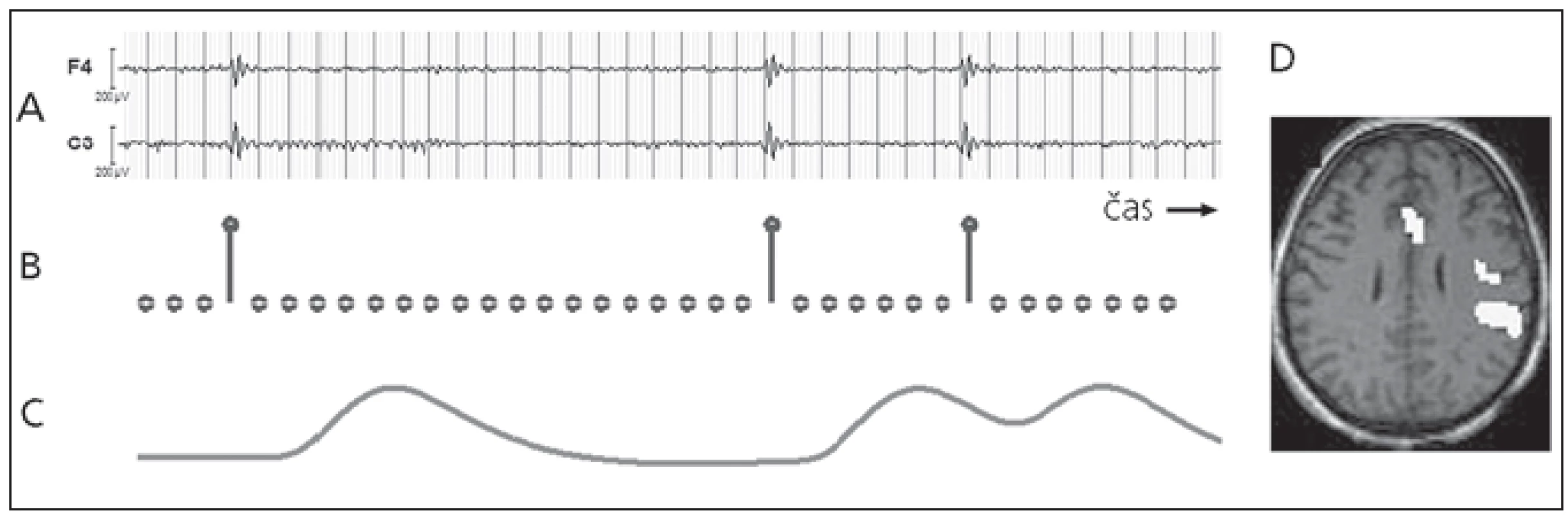
Interiktální aktivita pozorovaná v EEG signálu je vlastně forma „vnitřní“ stimulace, a data jsou tedy standardně snímána bez vnější stimulace (tzv. resting state data). Při zpracování těchto dat narážíme na celou řadu problémů, které v důsledku způsobují nízkou senzitivitu této metody, jež se zatím pohybuje kolem 35% [8]:
- Není znám přesný tvar HRF. Lemieux et al prokázali značnou variabilitu mezi jednotlivými subjekty ve tvaru HRF [9].
- Příliš nízká, resp. vysoká četnost epileptiformních událostí způsobuje pokles statistické síly použité metody. Navíc je známo, že epileptiformní aktivita nemusí být v řadě případů na skalpu vůbec patrná, event. se do skalpových EEG dat promítá jen část výbojů.
- Popis epileptiformní aktivity je subjektivní a záleží na erudici hodnotící osoby a jejích zkušenostech s charakterem EEG signálu získaného při simultánním EEG-fMR snímání.
- Prostorová souvislost EEG-fMR výsledků se skutečným primárním ložiskem je nejasná [10]. V některých případech může být EEG aktivita zaznamenaná na skalpu projevem šíření epileptogenního procesu, a EEG-fMR výsledek tak nemusí zobrazovat primární ložisko.
I přes výše zmíněné problémy a nízkou senzitivitu je tato metoda velmi slibná a již dnes se na některých pracovištích používá jako jedna z doplňkových modalit při řešení problému s lokalizací epileptogenní zóny. To dokazuje poměrně rozsáhlá publikační aktivita na dané téma [9,11,12] a zapojení sofistikovanějších statistických přístupů, např. ICA [13], nebo kombinace s metodami založenými na lokalizaci EEG zdrojů [14].
Velmi zajímavé je studium epileptických záchvatů v obraze fMR [15–17]. Tato metoda nabízí sledování přímé souvislosti mezi iktální epileptickou aktivitou nalezenou v EEG a lokálními hemodynamickými změnami v mozku. Nicméně tuto metodu lze využít jen ve vzácných případech s častými či snadno provokovatelnými záchvaty. Základní podmínkou získání validního výsledku je pak absence pohybových artefaktů v průběhu snímaného záchvatu, čehož u většiny pacientů nelze dosáhnout.
EEG rytmy a hemodynamické změny v mozku
Zkoumání vztahu mezi různými rytmy v EEG signálu a hemodynamickými změnami je v současnosti velmi populární oblast využití EEG-fMR. Nejčastěji se jedná o korelaci časového průběhu výkonu v určitém frekvenčním pásmu EEG signálu s hemodynamickými změnami v mozku s použitím klidových dat (data získaná bez vnější stimulace). Velmi konzistentní výsledek napříč studiemi je zjištění, že výkon v alfa pásmu signifikantně pozitivně koreluje s hemodynamickými změnami v oblasti thalamu a negativně koreluje bilaterálně s fronto-parietálními oblastmi [18,19]. To je v souladu s předchozími zjištěními pomocí fMR o zapojení fronto-parietálních oblastí do pozornostních sítí [20] a již klasickým pozorováním poklesu výkonu v alfa pásmu při úkolech vyžadujících zapojení pozornosti [21]. Laufs et al [18] dále zjistili pozitivní korelaci mezi beta2 pásmem (17–23 Hz) a oblastmi „Default Mode Network“ (DMN, jež byla poprvé pozorována v PET studiích jako síť oblastí s poklesem regionální perfuze/aktivace při provádění kognitivních úloh oproti pasivní vizuální fixaci nebo klidu při zavřených očích [22]). Současně však v literatuře existuje jistá nehomogenita výsledků. Mnohé studie ukazují rozdílné fMR sítě korelující s daným rytmem EEG signálu a naopak rozdílné EEG rytmy korelující se stejnou sítí ve fMR datech, což implikuje nutnou opatrnost při interpretaci výsledků. Korelace mezi EEG rytmy a hemodynamickými změnami nemůže být považována za přímou a je třeba dále zkoumat, jak se transformuje postsynaptická aktivita do EEG signálu a do BOLD signálu a jaké vnější i vnitřní faktory tuto transformaci ovlivňují.
EEG-fMR se uplatňuje také při studiu spánkových rytmů. Např. Kaufmann et al [23] ve své práci klasifikovali podle EEG spánková stadia a pomocí GLM nalezli jejich korelát ve fMR – především pokles aktivity v oblasti thalamu při přechodu z bdělosti do spánku a dále pokles aktivity v předním cingulu při přechodu do hlubších spánkových stadií. Britz et al [24] zkoumali souvislost mezi dynamikou topografie EEG a hemodynamickými změnami. Ve skupině devíti zdravých subjektů nalezl čtyři mikrostavy (úseky časově stabilní topografie trvající 80–120 ms) a jim odpovídající sítě ve fMR datech. Bénar et al [25] použili EEG-fMR při studiu vlny P300 vyvolané vzácnými podněty v oddball úkolu. Pomocí GLM na fMR datech zjistil, že větší amplituda vlny P300 byla doprovázena větší změnou BOLD signálu v předním cingulu. Rozsáhlejší přehled o aplikacích EEG-fMR lze najít např. v publikaci autorů Mulert a Lemieux [8].
Závěr
EEG-fMR je velmi dynamicky se rozvíjející multimodální neurozobrazovací technika. V současné chvíli se zdá, že technické problémy se snímáním EEG signálu v MR jsou vyřešeny a vývoj spojený s touto metodou bude pokračovat především v oblasti zpracování dat. S tím souvisí i současné limitace v použití této metody. Jako zcela zásadní se jeví problém odstranění artefaktů z EEG signálu naměřeného při akvizici fMR – první krok při zpracování. Tento proces nemůže být plně automatizován a vždy je potřeba validovat korigovaný EEG signál expertním vizuálním srovnáním s EEG signálem naměřeným mimo MR. Především v epileptologických aplikacích je dále potřebný co nejpřesnější popis EEG signálu. Důležitá je i otázka reprodukovatelnosti získaných dat a výsledků. Ta se v případě samotné fMR u jednotlivců pohybuje kolem 70 % [26]. Gholipour et al [27] naměřili a zpracovali u každého z 15 epileptických pacientů dvě časově nezávislé sady EEG-fMR dat. Shoda ve výsledcích byla nalezena v 80 % případů. Zdá se tedy, že kombinace těchto dvou modalit má spíše pozitivní vliv na reprodukovatelnost výsledků, nicméně jedná se o poměrně malý vzorek a ojedinělou studii. Největší limitací v použití EEG-fMR zřejmě zůstává neznalost přesné fyziologické souvislosti mezi BOLD a EEG signálem, a tím komplikovaná interpretace výsledků. Valdes-Sosa et al [7] ve své práci odvozují EEG a BOLD signál od postsynaptické aktivity pomocí série dopředných modelů. V dané oblasti neuronální aktivita generuje mnoho postsynaptických potenciálů. Sumací časově a prostorově synchronních potenciálů dojde k vytvoření primární proudové hustoty, která se transformuje do skalpového EEG v závislosti na vodivostních parametrech uvnitř hlavy. Na druhé straně neuronální aktivita vybudí změny ve vazomotorice cév, které se dále hemodynamickým modelem transformují na BOLD signál. Mnoho z uvedených metod zpracování EEG-fMR dat porovnává EEG signál (nebo parametry z něj odvozené) přímo s BOLD signálem s užitím jednoduchého dopředného modelu v podobě kanonické HRF. Její tvar byl experimentálně zjištěn jako odezva BOLD signálu na krátký stimul. Je jasné, že takový model jen velmi hrubě popisuje skutečný vztah mezi EEG a BOLD signálem. V budoucnu se dá očekávat výzkum a zpřesnění výše zmíněných dopředných modelů a jejich integraci do stávajících metod zpracování EEG-fMR signálu. To zřejmě povede k lepšímu pochopení fyziologie vztahu mezi BOLD signálem a EEG a umožní kvalitnější zpracování dat a interpretaci výsledků.
Ing. Radek Mareček
I. neurologická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: rmarec@med.muni.cz
Přijato k recenzi: 12. 4. 2011
Přijato do tisku: 7. 6. 2011
Tato práce byla podpořena projektem MŠMT MSM0021622404 a grantem P304/11/1318.
Sources
1. Vojtěch Z. EEG v epileptologii dospělých. Praha: Grada 2004.
2. Jezzard P, Matthews PM, Smith SM. Functional MRI. New York: Oxford University Press 2001.
3. Chlebus P, Mikl M, Brázdil M, Krupa P. Funkční magnetická rezonance – úvod do problematiky. Neurol pro praxi 2005; 3 : 133–138.
4. Tintěra J, Vymazal J. Funkční a metabolické zobrazení mozku. Čes Radiol 2005; 59(1): 3–14.
5. Allen PJ, Josephs O, Turner R. A method for removing imaging artifact from continuous EEG recorded during functional MRI. Neuroimage 2000; 12(2): 230–239.
6. Allen PJ, Polizzi G, Krakow K, Fish DR, Lemieux L. Identification of EEG events in the MR scanner: the problem of pulse artifact and a method for its subtraction. Neuroimage 1998; 8(3): 229–239.
7. Valdes-Sosa PA, Sanchez-Bornot JM, Sotero RC, Iturria-MedinaY, Aleman-Gomez Y, Bosch-Bayard J et al. Model driven EEG/fMRI fusion of brain oscillations. Hum Brain Mapp 2009; 30(9): 2701–2721.
8. Mulert C, Lemieux L. EEG-fMRI. Physiological Basis, Technique and Applications. Berlin: Springer-Verlag 2010.
9. Lemieux L, Laufs H, Carmichael D, Paul JS, Walker MC, Duncan JS. Noncanonical spike-related BOLD responses in focal epilepsy. Hum Brain Mapp 2008; 29(3): 329–345.
10. Bénar CG, Grova C, Kobayashi E, Bagshaw AP, Aghakhani Y, Dubeau F et al. EEG-fMRI of epileptic spikes: concordance with EEG source localization and intracranial EEG. Neuroimage 2006; 30(4): 1161–1170.
11. Kobayashi E, Bagshaw AP, Bénar CG, Aghakhani Y, Andermann F, Dubeau F et al. Temporal and extratemporal BOLD responses to temporal lobe interictal spikes. Epilepsia 2006; 47(2): 343–354.
12. Rodionov R, De Martino F, Laufs H, Carmichael DW, Formisano E, Walker M et al. Independent component analysis of interictal fMRI in focal epilepsy: Comparison with general linear model-based EEG-correalated fMRI. Neuroimage 2007; 38(3): 488–500.
13. Jann K, Wiest R, Hauf M, Meyer K, Boesch C, Mathis J et al. BOLD correlates of continuously fluctuating epileptic activity isolated by independent component analysis. Neuroimage 2008; 42(2): 635–648.
14. Boor R, Jacobs J, Hinzmann A, Bauermann T, Scherg M, Boor S et al. Combined spike-related functional MRI and multiple source analysis in the non-invasive spike localization of benign rolandic epilepsy. Clin Neurophysiol 2007; 118(4): 901–909.
15. Salek-Haddadi A, Diehl B, Hamandi K, Merschhemke M, Liston A, Friston K et al. Hemodynamic correlates of epileptiform discharges: an EEG--fMRI study of 63 patients with focal epilepsy. Brain Res 2006; 1088(1): 148–166.
16. Kobayashi E, Hawco CS, Grova C, Dubeau F, Gotman J. Widespread and intense BOLD changes during brief focal electrographic seizures. Neurology 2006; 66(7): 1049–1055.
17. Tyvaert L, Hawco C, Kobayashi E, LeVan P, Dubeau F, Gotman J. Different structures involved during ictal and interictal epileptic activity in malformations of cortical development: an EEG-fMRI study. Brain 2008; 131(8): 2042–2060.
18. Laufs H, Kleinschmidt A, Beyerle A, Eger E, Salek-Haddadi A, Preibish C et al. EEG-correlated fMRI of human alpha activity. Neuroimage 2003; 19(4): 1463–1476.
19. Mantini D, Perrucci MG, Del Gratta C, Romani GL, Corbetta M. Electrophysiological signatures of resting state networks in the human brain. Proc Natl Acad Sci U S A 2007; 104(32): 13170–13175.
20. Brázdil M, Dobšík M, Mikl M, Hluštík P, Daniel P, Pažourková M et al. Combined event-related fMRI and intracerebral ERP study of an auditory oddball task. Neuroimage 2005; 26(1): 285–293.
21. Berger H. Über das elektrenkephalogramm des menschen. Archiv für Psychiatrie und Nervekrankheiten 87 : 527–570.
22. Reichle ME, Snyder AZ. A default mode of brain function: a brief history of an evolving idea. Neuroimage 2007; 37(4): 1083–1090.
23. Kaufmann C, Wehrle R, Wetter TC, Holsboer F, Auer DP, Pollmacher T et al. Brain activation and hypothalamic functional connectivity during human non-rapid eye movement sleep: an EEG/fMRI study. Brain 2006; 129(Pt3): 655–667.
24. Britz J, Van De Ville D, Michel CM. BOLD correlates of EEG topography reveal rapid resting-state network dynamics. Neuroimage 2010; 52(4): 1162–1170.
25. Bénar CG, Schön D, Grimault S, Nazarian B, Burle B, Roth M et al. Single-trial analysis of oddball event-related potentials in simultaneous EEG-fMRI. Hum Brain Mapp 2007; 28(7): 602–613.
26. Bennet CM, Miller MB. How reliable are the results from functional magnetic resonance imaging? Ann N Y Sci 2010; 1191 : 133–155.
27. Gholipour T, Moeller F, Pittau F, Dubeau F, Gotman J. Reproducibility of interictal EEG-fMRI results in patients with epilepsy. Epilepsia 2011; 52(3): 433–442.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2012 Issue 1-
All articles in this issue
- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Multimodální neurozobrazování pomocí simultánního EEG-fMR
- Sonotrombolýza – mechanizmus účinku a její využití v léčbě ischemické cévní mozkové příhody
- Laboratorní disekce drah laterálního aspektu mozkové hemisféry
- Variabilita genu pro angiotenzinogen a vnímavost k roztroušené skleróze
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Neurologická profesionální onemocnění v České republice v letech 1994–2009
- Rekanalizace akutních uzávěrů mozkových tepen pomocí retrahovatelného stentu
- Paraneoplastická polymyozitida u karcinomu prostaty – kazuistika
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Diagnosticky specifické nálezy při posturografickém vyšetření – dvě kazuistiky
- Klinický standard pro farmakoterapii neuropatické bolesti
- Diabetes a schizofrenie
- Dětská intrakraniální aneuryzmata
- Správnost přednemocniční diagnózy cévní mozkové příhody
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Klinický standard pro farmakoterapii neuropatické bolesti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career