-
Medical journals
- Career
Nrf2 – dve tváre regulátora antioxidačného systému
Authors: M. Pastorek; P. Müller; B. Vojtěšek
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2015; 28(Supplementum 2): 26-31
doi: https://doi.org/10.14735/amko20152S26Overview
Signálna dráha riadená komplexom transkripčného faktora Nrf2 a jeho represora Keap1 je súčasťou jedného z najdôležitejších defenzívnych mechanizmov bunky, ktorý ju ochraňuje pred stresom. Po uvoľnení proteínu Keap1 z komplexu Nrf2 - Keap1 dochádza k translokácii Nrf2 do jadra, kde cez zvýšenie expresie cytoprotektívnych génov pomáha bunke zvládnuť oxidačný stres vyvolaný účinkom toxických či karcinogénnych látok. Nie je preto prekvapujúce, že indukcia Nrf2 chemopreventívnymi látkami môže mať potenciál pri prevencii nádorových ochorení. Podobne ako Nrf2 ochraňuje bunky zdravého tkaniva, v neoplastických bunkách môže zmierniť účinok chemoterapeutík, a podporiť tak progresiu rakoviny. Je dokázané, že zvýšená expresia a následná nadmerná akumulácia Nrf2 je u mnohých typov nádorov asociovaná so zlou prognózou liečby a prispieva aj k fenoménu liekovej rezistencie. Poznanie „dvoch tvárí“ Nrf2 ako aj aktivácie ním riadenej signálnej dráhy je preto dôležité nielen pre základný výskum, ale má aj klinické implikácie.
Kľúčové slová:
Nrf2 – Keap1 – antioxidant – lieková rezistencia – chemoprevenciaÚvod
Nrf2 - Keap1 signálna dráha je hlavným regulátorom bunkovej odpovede na stres spôsobený elektrofilmi a reaktivnými formami kyslíka (reactive oxygen species – ROS). Preto je tradične vnímaná ako dôležitý obranný mechanizmus. Aj keď je tento pohľad správny, v poslednej dobe sa objavujú dôkazy o jej zapojení do vytvárania vhodného prostredia podporujúceho prežívanie a proliferáciu nádorových buniek. Akumulácia Nrf2 pomáha nádorovým bunkám lepšie odolávať stresu vyvolanému terapiou a táto jej „druhá tvár“ sa stala predmetom záujmu výskumu, ktorého cieľom je lepšie pochopiť úlohu Nrf2 signálnej dráhy v rakovine a vytvoriť stratégie na jej inhibíciu.
Struktúra Nrf2 a Keap1
Pre pochopenie regulácie signálnej dráhy Nrf2 - Keap1 je najprv potrebné poznať štruktúru jej hlavných aktérov. Nrf2 (nuclear factor erythroid 2 [NF E2] related factor 2) je transkripčný faktor, ktorý obsahuje sedem funkčných domén, známych ako Neh1 – 7. Z nich je pre reguláciu Nrf2 kľúčová najmä doména Neh2. Obsahuje sedem lyzínových rezíduí, na ktoré sa viaže ubikvitín, a tiež dve väzobné miesta (ETGE a DLG), ktoré pomáhajú regulovať jeho stabilitu prostredníctvom interakcie s jeho partnerom Keap1 (Kelch like erythroid cell derived protein with CNC homology [ECH]‑associated protein 1)[1 – 4]. Pre stabilitu Nrf2 je rovnako dôležitá na serín bohatá doména Neh6 [5] a domény Neh3 – 5 sú potrebné pre transaktivačnú aktivitu Nrf2 [5,6]. Doména Neh1, ktorá obsahuje leucínový zips, zase reguluje väzbu transkripčného faktora na DNA a dimerizáciu Nrf2 s Maf [7].
Keap1 obsahuje tri hlavné domény, riadiace jeho aktivitu: Kelch, BTB a IVR. Kelch/ DGR doména sprostredkuje väzbu Keap1 s Neh2 doménou Nrf2 [2,8]. BTB doména je dôležitá pre homodimerizáciu Keap1 a väzbu s proteínom Cul3 a IVR doména s vyšším obsahom cysteínových reziduí spája BTB doménu s C koncom Kelch/ DGR domény [9].
Regulácia signálnej dráhy Nrf2 - Keap1
V bežných podmienkach je Nrf2 lokalizovaný v komplexe s Keap1, ktorý jeho hladinu udržiava na bazálnej úrovni. Prostredníctvom Kelch domén sa Keap1 viaže na Nrf2 v dvoch miestach Neh2 domény – prvá väzba na ETGE miesto má vyššiu afinitu a zabezpečuje naviazanie Keap1 na Nrf2 a následná väzba s nižšou afinitou na miesto DLG reguluje správnu orientáciu oboch proteínov. Po naviazaní oboch väzieb sa sedem ubikvitín akceptujúcich lyzínov dostane do pozície, v ktorej dochádza k ich polyubikvitinácii, a oba proteíny tak môžu byť degradované v 26S podjednotke proteazómu [10,11]. V celom procese hrá dôležitú úlohu aj USP15 (ubiquitin‑specific peptidase 15) – deubikvitinačný enzým, ktorý stabilizuje Keap1 a posilňuje jeho E3 ligázovú aktivitu, čo nakoniec umožňuje väzbu Nrf2 [12].
Ak je bunka vystavená pôsobeniu xenobiotík alebo oxidačnému stresu, dochádza k modifikácii cysteínov, ktoré sa nachádzajú v reakčnom mieste Keap1. Jeho schopnosť udržať si správnu terciárnu štruktúru je tým znížená, čo zabráni jeho väzbe na Nrf2 a jeho následnej polyubikvitinácii a degradácii. Podľa inej teórie následkom modifikácie tiolov dochádza k disociácii Cul3 ligázy od Keap1 [13]. Spoločným aspektom oboch modelov je znemožnenie interakcie Keap1 a Nrf2, ktorý môže byť po oddelení z komplexu aktivovaný a translokovaný do jadra. Tam s Maf proteínmi vytvorí transkripčný komplex rozpoznávajúci ARE (antioxidant response element) miesta v promótoroch a riadi expresiu génov, ako sú NAD(P)H chinón oxidoreduktáza 1, hém oxygenáza 1, glutatión S transferáza či glutamát‑ cysteín ligáza (obr. 1) [14].
Image 1. Regulácia signálnej dráhy Nrf2-Keap1. 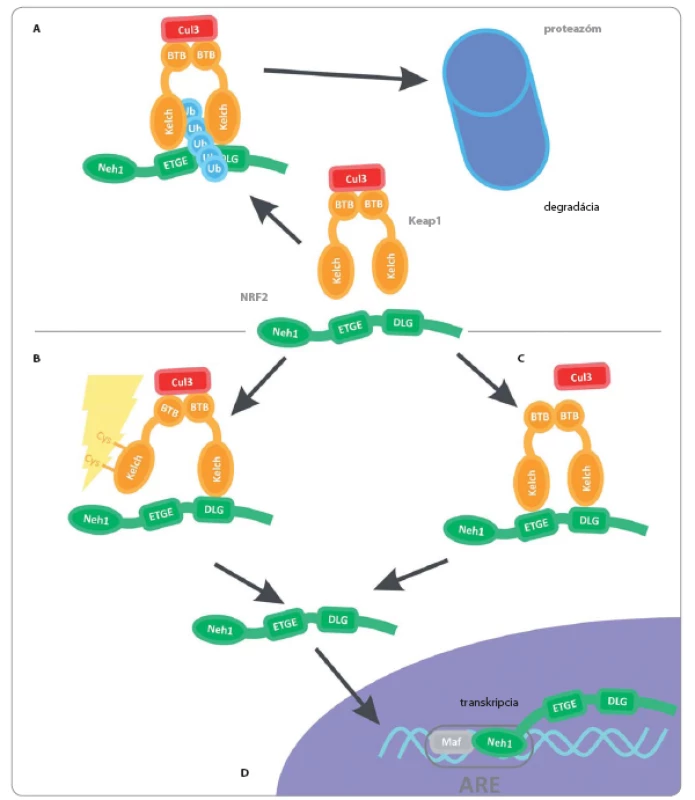
Nrf2 ako nádorový supresor
Hlavnou funkciou Nrf2 je aktivácia antioxidačnej odpovede pomocou trans-aktivácie širokého spektra génov (napr. gén kódujúci hém ‑ oxygenázu, gény riadiace syntézu glutatiónu). Vďaka rýchlej odpovedi na prítomnosť xenobiotík alebo oxidačného stresu je táto signálna dráha tradične vnímaná ako jeden z hlavných obranných mechanizmov bunky a dôležitý regulátor jej prežívania. Je dokázané, že aktivácia Nrf2 hrá dôležitú úlohu pri ochrane pred diabetom, starnutím, neurodegeneračnými a kardiovaskulárnymi ochoreniami a v neposlednom rade aj pred nádorovými ochoreniami [15,16]. Niekoľko štúdií na myšiach s vyradením génu pre Nrf2 – NFE2L2 – ukázalo, že v porovnaní s kontrolnými myšami jeho neprítomnosť zvyšuje po chemickej indukcii pravdepodobnosť výskytu rakoviny žalúdka, kože, čriev alebo močového mechúra [17]. Takisto bolo dokázané, že jedinci so špecifickým SNP v promótorovej oblasti NFE2L2 génu majú väčšie riziko výskytu nemalobunkového karcinómu pľúc spôsobené zrejme signifikantne zníženou hladinou NFE2L2 mRNA [18,19]. Ochranný potenciál tejto dráhy pravdepodobne spočíva v jej schopnosti redukovať množstvo ROS a s tým súvisiaceho poškodenia DNA [20].
Nrf2 ako onkoproteín
Napriek pozitívnej asociácii antioxidačnej odpovede riadenej Nrf2 signálnou dráhou so zníženým rizikom vzniku nádorových ochorení môže mať jej dlhodobá aktivácia negatívny efekt. Konštitutívne zvýšená hladina Nrf2 bola detekována v nádoroch hlavy a krku, vaječníkov, prsníkov a pľúc a bola dokázána aj jej spojitosť so zrýchlenou nádorovou progresiou [21 – 26]. Zhoršená prognóza liečby nádorov so zvýšenou hladinou Nrf2 je dôsledkom jej schopnosti podporovať proliferáciu a zvyšovať odolnosť na chemo a rádioterapiu [21,25,27]. Tento jav je podporený viacerými štúdiami, podľa ktorých Nrf2 prispieva k vlastnej aj získanej chemorezistencii pravdepodobne skrz zvýšenie odolnosti na stres [21,25,26,28,29]. Keďže viacero Nrf2 indukovaných génov kóduje cytoprotektívne proteíny, akými sú NAD(P)Hchinón oxidoreduktáza 1, hémoxygenáza 1, glutatión, glutatión S transferáza, potenciálnym mechanizmom môže byť zvýšená obrana bunky proti poškodeniu spôsobeného ROS, keďže ROS sú čiastočne generované pôsobením antineoplastických látok. Naviac proteíny ako GSH (redukovaná forma glutatiónu), ktoré obsahujú reaktívne tiolové skupiny, sa môžu viazať na elektrofilné medziprodukty metabolizmu antineoplastických látok a alkylačných činidiel a tak ich inaktivovať. Nádorové bunky so zvýšenou hladinou Nrf2 sú menej citlivé na často používané chemoterapeutiká, ako napr. cisplatinu, 5 - fluorouracil, či doxorubicín. Po inhibícii expresie Nrf2 pomocou siRNA sa ich rezistencia zase znížila [21,22,23,28,30 – 32]. Znížená alebo zvýšená expresia Nrf2 je v priamej korelácii s citlivosťou nádorových buniek na terapiu, čo je dôkazom jej dôležitosti vo vytvorení chemorezistencie. V nedávnej štúdii bola tiež ukázaná spojitosť medzi zvýšenou hladinou Nrf2 v nádorových bunkách pľúcneho karcinómu A549 s ich schopnosťou proliferácie prostredníctvom aktivácie expresie génov zodpovedných za regeneráciu NADPH (dihydronicotinamide-adenine dinucleotide phosphate)[3]. Pomocou microarray analýzy bolo navyše identifikovaných viacero génov kontrolovaných Nrf2, ktoré sa zúčastňujú biosyntézy purínov – stavebných kameňov RNA a DNA a tiež proteínov zapojených v metabolizme glukózy [34]. Uvedené skutočnosti potvrdzujú hypotézu o onkogénnom potenciáli Nrf2, ktorý aktivuje viacero mechanizmov podporujúcich nádorovú progresiu a prežívanie.
Deregulácia signálnej dráhy Nrf2
Doposiaľ bolo popísaných niekoľko mechanizmov, ktorými nádorové bunky konštitutívne aktivujú signálnu dráhu Nrf2. Napríklad epigenetické utlmenie expresie pomocou metylácie špecifických CpG miest v promótorovej oblasti Keap1 vedie k nedostatočnej represii Nrf2 vo viacerých typoch nádorov [26,35]. Modifikácia expresie Keap1 je klinicky signifikantná, v pľúcnych karcinómoch a malígnych gliómoch bola asociovaná so zhoršenou prognózou liečby [35]. Zvýšenie hladiny Nrf2 môže byť indukované aj sprostredkovane aktiváciou onkoproteínov ako B Raf, c Myc, K Ras [21,28,30,36 – 39], posttranslačnými modifikáciami cysteínov v Keap1, alebo nahromadením proteínov schopných rozrušiť komplex Nrf2 - Keap1 [13,40 – 45].
Komunikácia Nrf2 s inými signálnymi dráhami
So zvýšenou aktivitou signálnej dráhy Nrf2 môže úzko súvisieť aj jej interakcia s inými signálnymi dráhami, ktoré sú počas malígnej transformácie často deregulované. Proteín p53 negatívne reguluje transkripciu cieľových génov Nrf2 ako napr. GST1, NQO1 a x‑ ct [46]. Po kotransfekcii niekoľkých bunkových línií s vektormi obsahujúcimi kombináciu Nrf2 a p53 bola oproti transfekcii samotným Nrf2 pozorovaná znížená expresia jeho viacerých cieľových génov. Silná indukcia p53 tak môže zatiaľ nevysvetleným mechanizmom znížiť účinnosť antioxidačnej odpovede nádorových buniek a podporiť tak bunkovú smrť [34]. Na druhej strane je zaujímavé, že indukcia p21WAF1, terčového proteínu p53, pomáha Nrf2 stabilizovať [47]. Deje sa tak pomocou väzby p21WAF1 na Nrf2, ktorá zabraňuje jeho naviazaniu na Keap1 a následnej ubikvitinácii Nrf2 - Keap1 komplexu. Pri absencii p21WAF1 je bazálna a aj indukovateľná expresia génov regulovaných Nrf2 znížená.
Prostredníctvom interakcie proteínov Keap1 a p62 je signálna dráha Nrf2 veľmi úzko prepojená s procesom bunkovej autofágie. Priamym následkom nadmernej ektopickej expresie p62 alebo blokovania autofagického „toku” je zníženie hladiny Keap1 prostredníctvom jeho väzby na p62, ktorý ho nasmeruje do autofagozómov. Tam dochádza k jeho degradácii, čo vedie k zvýšeniu stability Nrf2 a teda aj k vyššej expresii ním riadených génov [48 – 50]. Zvýšenie stability Nrf2 týmto spôsobom sa nazýva nekanonická aktivácia Nrf2, pretože jej mechanizmus nie je závislý od modifikácie cysteínov na Keap1, ale od expresie p62. V myšiach, ktoré mali narušený proces autofágie bola zaznamenaná zvýšená akumulácia Nrf2, čo sa prejavilo poškodením pečene [50]. Naopak, použitie siRNA pre p62 zvýšilo hladinu a stabilitu Keap1 a nepriamo tak znížilo hladinu Nrf2 a expresiu jej cieľových génov [49,51]. Tieto experimenty potvrdzujú úzke spojenie aktivácie Nrf2 dráhy s procesom autofágie a dávajú nový pohľad na funkčné prepojenie jednotlivých mechanizmov, ktoré napomáhajú nádorovej bunke k prežitiu.
Inhibícia a modulácia Nrf2
Napriek negatívnej korelácii aktivity Nrf2 s úspešnosťou liečby je vývoj špecifických inhibítorov Nrf2 problematický, najmä kvôli jeho štruktúrnej podobnosti s inými transkripčnými faktormi z bZip rodiny. Z dostupných možností vychádzajúcich zo súčasných poznatkov sa tak ponúka využitie Nrf2 siRNA [52] či PI3K inhibítorov [33] a v neposlednom rade i prírodných látok so známou schopnosťou modulácie Nrf2 dráhy [53]. Nádejou by mohla byť aj alternatívna terapia lentivírusovými vektormi, ktoré obsahujú gén konvertujúci neškodné predliečivo na toxickú látku. Pri zaradení tohto génu za ARE miesta s vysokou väzbovou aktivitou Nrf2 by tak dochádzalo k efektívnemu zničeniu nielen nádorových buniek, ale aj okolitého nádorového mikroprostredia [54,55]. V budúcnosti by sa tiež dali využiť vedomosti o interakcii Nrf2 s inými signálnymi dráhami a využiť potenciál iných, lepšie modulovateľných cieľov. V tomto bode je zaujímavé spomenúť DMF (dimetyl fumarát), ktorý sa v klinickej praxi používa pri liečbe psoriázy, roztrúsenej sklerózy a iných autoimunitných ochorení [56 – 61]. Mechanizmus jeho účinku nebol doposiaľ úplne vysvetlený, no bolo potvrdené, že sa viaže na redukovanú formu glutatiónu a jeho metabolit monometyl fumarát je potentným aktivátorom Nrf2 signálnej dráhy [62,63]. Uvažuje sa dokonca aj o jeho využití pri liečbe nádorových ochorení. V literatúre bola popísaná jeho schopnosť inhibovať rast a metastázovanie na myšom modeli melanómu a bunkách derivovaných z pacientov s glioblastómom [64 – 66]. Tento fenomén je nesporne zaujímavý, keďže súčasťou účinku DMF je aktivácia Nrf2 dráhy, ktorá je u nádorov spájaná práve so zvýšenou proliferáciou a zrýchlenou progresiou. Poznatky získané s DMF naznačujú, že výsledok aktivácie Nrf2 dráhy je závislý aj od kontextu iných dejov a zasluhuje si ďalšie skúmanie.
Zhrnutie
Niekoľko štúdií uvedených v tomto prehľadnom článku potvrdilo schopnosť Nrf2 signálnej dráhy chrániť bunky zdravého tkaniva pred xenobiotikami alebo oxidačným stresom, ktorý môže potenciálne viesť k malígnej transformácii. Na druhej strane bola pozorovaná korelácia zvýšenia hladiny Nrf2 so zhoršenou prognózou liečby u viacerých typov nádorových ochorení. Otázkou zostáva, či sa aktivácia Nrf2 podieľa na vzniku nádorového ochorenia, alebo vzniká len sekundárne ako súčasť „malígneho fenotypu“. Za aktiváciu Nrf2 v nádoroch by tiež mohla byť zodpovedná jej interakcia s inými signálnymi dráhami, ktoré sú v nádoroch často deregulované.Potlačenie nadmernej aktivácie tejto signálnej dráhy by tak mohlo byť sprostredkované moduláciou signálnych dráh, ktoré s ňou priamo interagujú, alebo pomocou špecifických inhibítorov Nrf2. Tie sa však zatiaľ nachádzajú len vo fáze vývoja. Odpovede by mohla priniesť podrobnejšia analýza DMF vo vzťahu k nádorovým ochoreniam, ktorý sa v klinickej praxi zväčša používa pri liečbe autoimunitných ochorení. Napriek jeho vlastnosti aktivátora Nrf2 dráhy bola na experimentálnych modeloch pozorovaná jeho schopnosť inhibovať rast nádoru. Možné využitie DMF v onkologickej liečbe poukazuje na to, že modulácia Nrf2 signálnej dráhy je zaujímavá nielen z hľadiska výskumu, ale lepšie poznanie jej chemopreventívnych účinkov a fenoménu liekovej rezistencie má aj klinický potenciál.
Práca bola podporená Európskym fondom pre regionálny rozvoj a štátnym rozpočtom Českej republiky (RECAMO CZ.1.05/2.1.00/03.0101), projektom MŠMT – NPU I – LO1413, MZ ČR – RVO (MOÚ, 00209805) a BBMRI_CZ (LM2010004).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michal Pastorek, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: michal.pastorek@mou.cz
Obdržané: 9. 4. 2015
Prijaté: 15. 6. 2015
Sources
1. Zhang DD, Lo SC, Cross JV et al. Keap1 is a redox ‑ regulated substrate adaptor protein for a Cul3 - dependent ubiquitin ligase complex. Mol Cell Biol 2004; 24(24): 10941 – 10953. doi: 10.1128/ MCB.24.24.10941 ‑ 10953.2004.
2. McMahon M, Thomas N, Itoh K et al. Redox ‑ regulated turnover of Nrf2 is determined by at least two separate protein domains, the redox ‑ sensitive Neh2 degron and the redox ‑ insensitive Neh6 degron. J Biol Chem 2004; 279(30): 31556 – 31567.
3. Tong KI, Kobayashi A, Katsuoka F et al. Two site substrate recognition model for the Keap1 - Nrf2 system: a hinge and latch mechanism. Biol Chem 2006; 387(10 – 11): 1311 – 1320.
4. Kobayashi A, Kang MI, Okawa H et al. Oxidative stress sensor Keap1 functions as an adaptor for Cul3‑based E3 ligase to regulate proteasomal degradation of Nrf2. Mol Cell Biol 2004; 24(16): 7130 – 7139.
5. Moi P, Chan K, Asunis I et al. Isolation of NFE2‑related factor 2 (Nrf2), a NF ‑ E2‑like basic leucine zipper transcriptional activator that binds to the tandem NF ‑ E2/ AP1 repeat of the b ‑ globin locus control region. Proc Natl Acad Sci U S A 1994; 91(21): 9926 – 9930.
6. Nioi P, Nguyen T, Sherratt PJ et al. The carboxyterminal Neh3 domain of Nrf2 is required for transcriptional activation. Mol Cell Biol 2005; 25(24): 10895 – 10906.
7. Katoh Y, Itoh K, Yoshida E et al. Two domains of Nrf2 cooperatively bind CBP, a CREB binding protein, and synergistically activate transcription. Genes Cells 2001; 6(10): 857 – 868.
8. Itoh K, Wakabayashi N, Katoh Y et al. Keap1 represses nuclear activation of antioxidant responsive elements by Nrf2 through binding to the amino‑terminal Neh2 domain. Genes Dev 1999; 13(1): 76 – 86.
9. Lo SC, Li X, Henzl MT et al. Structure of the Keap1-Nrf2 interface provides mechanistic insight into Nrf2 signaling. EMBO J 2006; 25(15): 3605 – 3617.
10. McMahon M, Thomas N, Itoh K et al. Dimerization of substrate adaptors can facilitate cullin mediated ubiquitylation of proteins by a ‘tethering’ mechanism: a two‑site interaction model for the Nrf2 - Keap1 complex. J Biol Chem 2006; 281(34): 24756 – 24768.
11. Tong KI, Padmanabhan B, Kobayashi A et al. Different electrostatic potentials define ETGE and DLG motifs as hinge and latch in oxidative stress response. Mol Cell Biol 2007; 27(21): 7511 – 7521.
12. Villeneuve NF, Tian W, Wu T et al. USP15 negatively regulates Nrf2 through deubiquitination of Keap1. Mol Cell 2013; 51(1): 68 – 79. doi: 10.1016/ j.molcel.2013.04.022.
13. Taguchi K, Motohashi H, Yamamoto M. Molecular mechanisms of the Keap1 - Nrf2 pathway in stress response and cancer evolution. Genes Cells 2011; 16(2): 123 – 140. doi: 10.1111/ j.1365 ‑ 2443.2010.01473.x.
14. Kansanen E, Jyrkkanen HK, Levonen AL. Activation of stress signalling pathways by electrophilic oxidized and nitrated lipids. Free Radic Biol Med 2012; 52(6): 973 – 982. doi: 10.1016/ j.freeradbiomed.2011.11.038.
15. Kensler TW, Wakabayashi N, Biswal S. Cell survival responses to environmental stresses via the Keap1 - Nrf2 - ARE pathway. Annu Rev Pharmacol Toxicol 2007; 47 : 89 – 116.
16. Lau A, Villeneuve NF, Sun Z et al. Dual roles of Nrf2 in cancer. Pharmacol Res 2008; 58(5 – 6): 262 – 270. doi: 10.1016/ j.phrs.2008.09.003.
17. Ramos ‑ Gomez M, Kwak MK, Dolan PM et al. Sensitivity to carcinogenesis is increased and chemoprotective efficacy of enzyme inducers is lost in nrf2 transcription factor ‑ deficient mice. Proc Natl Acad Sci 2001; 98(6): 3410 – 3415.
18. Yamamoto T, Yoh K, Kobayashi A et al. Identification of polymorphisms in the promoter region of the human NRF2 gene. Biochem Biophys Res Commun 2004; 321(1): 72 – 79.
19. Suzuki T, Shibata T, Takaya K et al. Regulatory nexus of synthesis and degradation deciphers cellular Nrf2 expression levels. Mol Cell Biol 2013; 33(12): 2402 – 2412. doi: 10.1128/ MCB.00065 ‑ 13.
20. Morito N, Yoh K, Itoh K et al. Nrf2 regulates the sensitivity of death receptor signals by affecting intracellular glutathione levels. Oncogene 2003; 22(58): 9275 – 9281.
21. Shibata T, Ohta T, Tong KI et al. Cancer related mutations in NRF2 impair its recognition by Keap1 - Cul3 E3 ligase and promote malignancy. Proc Natl Acad Sci U S A 2008; 105(36): 13568 – 13573. doi: 10.1073/ pnas.0806268105.
22. Wang XJ, Sun Z, Villeneuve NF et al. Nrf2 enhances resistance of cancer cells to chemotherapeutic drugs, the dark side of Nrf2. Carcinogenesis 2008; 29(6): 1235 – 1243. doi: 10.1093/ carcin/ bgn095.
23. Jiang T, Chen N, Zhao F et al. High levels of Nrf2 determine chemoresistance in type II endometrial cancer. Cancer Res 2010; 70(13): 5486 – 5496. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 10 ‑ 0713.
24. Kim YR, Oh JE, Kim MS et al. Oncogenic NRF2 mutations in squamous cell carcinomas of oesophagus and skin. J Pathol 2010; 220(4): 446 – 451. doi: 10.1002/ path.2653.
25. Solis LM, Behrens C, Dong W et al. Nrf2 and Keap1 abnormalities in non‑small cell lung carcinoma and association with clinicopathologic features. Clin Cancer Res 2010; 16 : 3743 – 3753. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 09 ‑ 3352.
26. Zhang P, Singh A, Yegnasubramanian S et al. Loss of Kelch‑like ECH‑associated protein 1 function in prostate cancer cells causes chemoresistance and radioresistance and promotes tumor growth. Mol Cancer Ther 2010; 9(2): 336 – 346. doi: 10.1158/ 1535 ‑ 7163.MCT ‑ 09 ‑ 0589.
27. Sasaki H, Suzuki A, Shitara M et al. Genotype analysis of the NRF2 gene mutation in lung cancer. Int J Mol Med 2012; 31(5): 1135 – 1138. doi: 10.3892/ ijmm.2013.1324.
28. Singh A, Misra V, Thimmulappa RK et al. Dysfunctional KEAP1 - NRF2 interaction in non‑smallcell lung cancer. PLoS Med 2006; 3(10): e420.
29. Inoue D, Suzuki T, Mitsuishi Y et al. Accumulation of p62/ SQSTM1 is associated with poor prognosis in patients with lung adenocarcinoma. Cancer Sci 2012; 103(4): 760 – 766. doi: 10.1111/ j.1349 ‑ 7006.2012.02216.x.
30. Ohta T, Iijima K, Miyamoto M et al. Loss of Keap1 function activates Nrf2 and provides advantages for lung cancer cell growth. Cancer Res 2008; 68(5): 1303 – 1309. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 07 ‑ 5003.
31. Homma S, Ishii Y, Morishima Y et al. Nrf2 enhances cell proliferation and resistance to anticancer drugs in human lung cancer. Clin Cancer Res 2009; 15(10): 3423 – 3432. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 08 ‑ 2822.
32. Lister A, Nedjadi T, Kitteringham NR et al. Nrf2 is overexpressed in pancreatic cancer: implications for cell proliferation and therapy. Mol Cancer 2011; 10 : 37. doi: 10.1186/ 1476 ‑ 4598 ‑ 10 ‑ 37.
33. Mitsuishi Y, Taguchi K, Kawatani Y et al. Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming. Cancer Cell 2012; 22(1): 66 – 79. doi: 10.1016/ j.ccr.2012.05.016.
34. Jaramillo MC, Zhang DD. The emerging role of the Nrf2 - Keap1 signaling pathway in cancer. Genes Dev 2013; 27(20): 2179 – 2191. doi: 10.1101/ gad.225680.113.
35. Muscarella LA, Parrella P, D’Alessandro V et al. Frequent epigenetics inactivation of KEAP1 gene in non‑small cell lung cancer. Epigenetics 2011; 6(6): 710 – 719.
36. Padmanabhan B, Tong KI, Ohta T et al. Structural basis for defects of Keap1 activity provoked by its point mutations in lung cancer. Mol Cell 2006; 21(5): 689 – 700.
37. Nioi P, Nguyen T. A mutation of Keap1 found in breast cancer impairs its ability to repress Nrf2 activity. Biochem Biophys Res Commun 2007; 362(4): 816 – 821.
38. Ooi A, Dykema K, Ansari A et al. CUL3 and NRF2 mutations confer an NRF2 activation phenotype in a sporadic form of papillary renal cell carcinoma. Cancer Res 2013; 73(7): 2044 – 2051. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 12 ‑ 3227.
39. Sato Y, Yoshizato T, Shiraishi Y et al. Integrated molecular analysis of clear ‑ cell renal cell carcinoma. Nat Genet 2013; 45(8): 860 – 867. doi: 10.1038/ ng.2699.
40. Sporn MB, Liby KT. NRF2 and cancer: the good, the bad and the importance of context. Nat Rev Cancer 2012; 12(8): 564 – 571. doi: 10.1038/ nrc3278.
41. DeNicola GM, Karreth FA, Humpton TJ et al. Oncogene‑induced Nrf2 transcription promotes ROS detoxification and tumorigenesis. Nature 2011; 475(7354): 106 – 109. doi: 10.1038/ nature10189.
42. Hanada N, Takahata T, Zhou Q et al. Methylation of the KEAP1 gene promoter region in human colorectal cancer. BMC Cancer 2012; 12 : 66. doi: 10.1186/ 1471 ‑ 2407 ‑ 12 ‑ 66.
43. Adam J, Hatipoglu E, O’Flaherty L et al. Renal cyst formation in Fh1 - deficient mice is independent of the Hif/ Phd pathway: roles for fumarate in KEAP1 succination and Nrf2 signaling. Cancer Cell 2011; 20(4): 524 – 537. doi: 10.1016/ j.ccr.2011.09.006.
44. Ooi A, Wong JC, Petillo D et al. An antioxidant response phenotype shared between hereditary and sporadic type 2 papillary renal cell carcinoma. Cancer Cell 2011; 20(4): 511 – 523. doi: 10.1016/ j.ccr.2011.08.024.
45. Ma Q, He X. Molecular basis of electrophilic and oxidative defense: promises and perils of nrf2. Pharmacol Rev 2012; 64(4): 1055 – 1081. doi: 10.1124/ pr.110.004333.
46. Faraonio R, Vergara P, Di Marzo D et al. p53 suppresses the Nrf2 - dependent transcription of antioxidant response genes. J Biol Chem 2006; 281(52): 39776 – 39784.
47. Chen W, Sun Z, Wang XJ et al. Direct interaction between Nrf2 and p21(Cip1/ WAF1) upregulates the Nrf2 - mediated antioxidant response. Mol Cell 2009; 34(6): 663 – 673. doi: 10.1016/ j.molcel.2009.04.029.
48. Komatsu, Kurokawa H, Waguri S et al. The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1. Nat Cell Biol 2010; 12(3): 213 – 223. doi: 10.1038/ ncb2021.
49. Lau A, Wang XJ, Zhao F et al. A noncanonical mechanism of Nrf2 activation by autophagy deficiency: direct interaction between Keap1 and p62. Mol Cell Biol 2010; 30(13): 3275 – 3285. doi: 10.1128/ MCB.00248 ‑ 10.
50. Taguchi K, Fujikawa N, Komatsu M et al. Keap1 degradation by autophagy for the maintenance of redox homeostasis. Proc Natl Acad Sci U S A 2012; 109(34): 13561 – 13566. doi: 10.1073/ pnas.1121572109.
51. Copple IM, Lister A, Obeng AD et al. Physical and functional interaction of sequestosome 1 with Keap1 regulates the Keap1 - Nrf2 cell defense pathway. J Biol Chem 2010; 285(22): 16782 – 16788. doi: 10.1074/ jbc.M109.096545.
52. Singh A, Boldin‑Adamsky S, Thimmulappa RK et al. RNAi ‑ mediated silencing of nuclear factor erythroid ‑ 2‑related factor 2 gene expression in non‑small cell lung cancer inhibits tumor growth and increases efficacy of chemotherapy. Cancer Res 2008; 68(19): 7975 – 7984. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 08 ‑ 1401.
53. Ren D, Villeneuve NF, Jiang T et al. Brusatol enhances the efficacy of chemotherapy by inhibiting the Nrf2 - mediated defense mechanism. Proc Natl Acad Sci U S A 2011; 108(4): 1433 – 1438. doi: 10.1073/ pnas.1014275108.
54. Hurttila H, Koponen JK, Kansanen E et al. Oxidative stress ‑ inducible lentiviral vectors for genetherapy. Gene Ther 2008; 15(18): 1271 – 1279. doi: 10.1038/ gt.2008.75.
55. Leinonen HM, Ruotsalainen AK, Määttä AM. Oxidative stress ‑ regulated lentiviral TK/ GCV gene therapy for lung cancer treatment. Cancer Res 2012; 72(23): 6227 – 6235. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 12 ‑ 1166.
56. Nicholas JA, Boster AL, Imitola J et al. Design of oral agents for the management of multiple sclerosis: benefit and risk assessment for dimethyl fumarate. Drug Des Devel Ther 2014; 8 : 897 – 908. doi: 10.2147/ DDDT.S50962.
57. Bomprezzi R. Dimethyl fumarate in the treatment of relapsing ‑ remitting multiple sclerosis: an overview. Ther Adv Neurol Disord 2015; 8(1): 20 – 30. doi: 10.1177/ 1756285614564152.
58. Gill AJ, Kolson DL. Dimethyl fumarate modulation of immune and antioxidant responses: application to HIV therapy. Crit Rev Immunol 2013; 33(4): 307 – 359.
59. Oh CJ, Kim JY, Choi YK et al. Dimethylfumarate attenuates renal fibrosis via NF ‑ E2‑related factor 2-mediated inhibition of transforming growth factor‑β / Smad signaling. PLoS One 2012; 7(10): e45870. doi: 10.1371/ journal.pone.0045870.
60. Ashrafian H, Czibik G, Bellahcene M et al. Fumarate is cardioprotective via activation of the Nrf2 antioxidant pathway. Cell Metab 2012; 15(3): 361 – 371. doi: 10.1016/ j.cmet.2012.01.017.
61. Belge K, Brück J, Ghoreschi K. Advances in treating psoriasis. F1000Prime Rep 2014; 6 : 4. doi: 10.12703/ P6 ‑ 4.
62. Brennan MS, Matos MF, Bing Li et al. Dimethyl fumarate and monoethyl fumarate exhibit differential effects on KEAP1, NRF2 activation, and glutathione depletion in vitro. PLoS One 2015; 10(3): e0120254. doi: 10.1371/ journal.pone.0120254.
63. Takaya K, Suzuki T, Motohashi H et al. Validation of the multiple sensor mechanism of the Keap1 - Nrf2 system. Free Radic Biol Med 2012; 53(4): 817 – 827. doi: 10.1016/ j.freeradbiomed.2012.06.023.
64. Odom RY, Dansby MY, Rollins ‑ Hairston AM et al. Phytochemical induction of cell cycle arrest by glutathione oxidation and reversal by N ‑ acetylcysteine in human colon carcinoma cells. Nutr Cancer 2009; 61(3): 332 – 329. doi: 10.1080/ 01635580802549982.
65. Loewe R, Valero T, Kremling S et al. Dimethylfumarate impairs melanoma growth and metastasis. Cancer Res 2006; 66(24): 11888 – 11896.
66. Ghods AJ, Glick R, Braun D et al. Beneficial actions of the anti‑inflammatory dimethyl fumarate in glioblastomas. Surg Neurol Int 2013; 4 : 160. doi: 10.4103/2152 ‑ 7806.123656.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 2-
All articles in this issue
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

