-
Medical journals
- Career
Syndrom pánevní kongesce
: M. Holý
: Interní oddělení Nemocnice České Budějovice, a. s.
: Kardiol Rev Int Med 2014, 16(4): 321-329
: Internal Medicine
Pánevní kongesce je zvláštní forma chronického žilního onemocnění postihující ženy. Definovaná je jako klinicko‑anatomický syndrom charakterizovaný chronickou pánevní bolestí, perineálním dyskomfortem, mikčními obtížemi a postkoitální bolestí, které jsou způsobeny ovariálním a/ nebo pánevním žilním refluxem. Bývá příčinou varixů vulvy, perinea, hýždí a dolních končetin. Těsný vztah je mezi symptomatickými pánevními varixy a renálním syndromem louskáčku. Duplexní ultrasonografie žil břicha, pánve, dolních končetin a vulvoperineální oblasti je hlavní neinvazivní diagnostickou metodou. Magnetická rezonanční venografie nebo jen MR venografie má vysokou senzitivitu v hodnocení pánevní kongesce a může být užita jako screeningové vyšetření nebo v případě nejasného nálezu na ultrazvuku a klinických pochybností. Možnosti medikamentózní terapie jsou omezené, základními léky jsou venofarmaka. Endovaskulární intervence – terapeutická embolizace ovariálních/ pánevních žil a implantace ilikokaválního a renálního endovenózního stentu – se stává léčbou první volby u žen s těžkými příznaky, které nereagují na konzervativní terapii.
Klíčová slova:
chronická pánevní bolest – varixy – pánevní kongesce – renální kongesce – anatomie – duplexní sonografie – diagnostická kritéria – terapeutická embolizace – renální žilní stentÚvod
Syndrom pánevní kongesce je specifická forma chronické žilní insuficience postihující výhradně ženy. Poprvé byl popsán v 50. letech 20. století Taylorem a Wrightem [1] jako cévní patologie spojující přítomnost pánevních varixů s pánevní bolestí, dysmenoreou a bolestivým vaginálním pohlavním stykem (dyspareunií). Přesto jde o onemocnění stále málo známé, často přehlédnuté a přehlížené. Souvislost mezi pánevními varixy a obtížemi byla a dosud je některými lékaři zpochybňována. Výrazem zmíněného stavu je i dlouhodobý nedostatek relevantních informací o této nemoci v české odborné literatuře.
Ke zvýšení zájmu o pánevní kongesci došlo díky rozvoji zobrazovacích metod (CT a MR kontrastní vyšetření), které mohou detekovat celou řadu cévních, zejména žilních abnormalit v oblasti pánve a břicha. Rozhodujícím momentem, který znamenal zásadní změnu v uvažování a přístupu k žilním patologiím pánve, byl pokrok v oblasti endovaskulárních intervencí, tedy v možnostech jejich miniinvazivní terapie.
V současné době je pánevní kongesce definována jako klinicko‑anatomický syndrom charakterizovaný chronickou pánevní bolestí (soustavná nebo trvale recidivující necyklická pánevní bolest po dobu delší než šest měsíců), perineálním dyskomfortem, mikčními obtížemi a postkoitální bolestí, které jsou způsobeny ovariálním a/ nebo pánevním žilním refluxem a/ nebo obstrukcí. Vyskytovat se mohou varixy vulvy, perinea a/ nebo varixy dolních končetin [2]. Definice pomíjí těsnou a dostatečně dokumentovanou souvislost kongesce pánve s renální kongescí (renálním syndromem louskáčku) a také se symptomatickým postižením vertebrálních žil a pletení (paravertebrálními a/ nebo lumbálními epidurálními varixy). Abnormality žilní drenáže bederní páteře provázející kongesci pánve, i když jsou zmiňovány pouze ojediněle [3,4], nejsou podle našich zkušeností raritní, ale spíše typické.
Obdobným onemocněním mužů je varikokéla, kde však nejde o žilní patologii pánve, ale varlat. Problematika varikokély je odlišná a v mnoha ohledech méně komplikovaná. Velmi vzácně se lze setkat s perineálními a hýžďovými varixy u mužů v souvislosti s těžkou sportovní zátěží (zejména statickou s přetížením pánevního dna) [5].
Epidemiologie
Prevalence není přesně známá a liší se výrazně v populacích žen s různou mírou porodnosti. Incidence se zvyšuje s počtem těhotenství, je proto relativně nízká například v USA, a naopak, v Jižní Americe je mimořádně vysoká [6]. Vzhledem k nedostatečné diagnostice je výskyt onemocnění pravděpodobně značně podhodnocen.
O klinickém významu pánevní kongesce svědčí následující údaje:
- chronická pánevní bolest postihne během života kolem 30 % žen a je důvodem 10 – 20 % ambulantních gynekologických vyšetření. U 30 % z nich je příčinou právě kongesce [5,7],
- pánevní varixy lze prokázat po porodu u 10 – 15 % žen, u 60 % z nich jsou symptomatické [8],
- varixy dolních končetin vznikají v 10 % následkem refluxů, které nepocházejí ze safenových žil. Kongesce pánve je zdrojem asi 30 % těchto refluxů a je příčinou každé páté pooperační recidivy varixů u žen [9,10].
Postiženy jsou typicky ženy v reprodukčním věku, vrchol výskytu v našich podmínkách je mezi 30. a 35. rokem. Manifestace symptomatické kongesce po 45. roce života je neobvyklá. V menopauze příznaky spontánně ustupují. Přítomnost nebo dokonce progrese obtíží u postmenopauzálních žen je raritní a zaznamenali jsme ji jen v případě, kde dominantním postižením byla kongesce renální a vertebrální.
Lze odhadnout, že 5 – 7 % všech rodiček může mít pánevní kongestivní syndrom. Na základě našich zkušeností je klinicky závažný a vyžaduje intervenci u každé druhé až třetí ženy, které je diagnostikován.
Etiologie a patogeneze
Etiopatogeneze pánevních varixů a souvisejících symptomů je multifaktoriální a není beze zbytku objasněna. Jako u ostatních forem chronické venózní insuficience jsou přítomny funkční a morfologické změny žilního systému – žilní reflux a hypertenze, distenze a varikózní degenerace postižených segmentů.
Žilní drenáž pánve je narušena, dochází zde ke stagnaci krve původem z pánevních orgánů, dolních končetin (častěji levé), levé ledviny nebo k regurgitaci krve z dolní duté žíly.
Společným nálezem u všech forem je inkompetence a/ nebo varikózní degenerace ovarických žil a/ nebo vnitřních ilických žil s propagací refluxu do pánevních žilních pletení a/ nebo do větví v povodí vnitřní ilické žíly. Nejčastěji postiženou žilou je levostranná v. ovarica (v našem souboru asi v 80 % případů), kombinovaný reflux ve více žilách je častý (podle našich zkušeností asi v 30 % případů, podle jiných autorů u většiny) [11 – 13].
Na vzniku a rozvoji pánevní kongesce se podílejí jak faktory mechanické – žilní abnormality a anomálie, tak vlivy hormonální. Společně se ve vysoké míře uplatňují během gravidity.
Patogenetické faktory lze rozdělit do následujících skupin [14]:
1. Disponující klinické stavy
- astenický habitus – převážná část pacientek jsou vyšší štíhlé ženy, ale nadváha/ obezita onemocnění nevylučuje,
- vícečetné gravidity – incidence a tíže pánevní kongesce se zvyšuje s počtem těhotenství (průměrný počet porodů u postižených žen je 2,4 – 4,0), ale vyskytuje se i u jednorodiček nebo nullipar [3,15,16].
2. Disponující gynekologické abnormality
- polycystická ovaria – ovariální cysty prokazujeme v 40 – 50 % případů [7,17] (nikoli však syndrom polycystických ovarií s hirsutizmem a amenoreou),
- retropozice dělohy.
3. Disponující žilní abnormality a anomálie
- komprese/ obstrukce levostranné renální žíly (renální syndrom louskáčku) [18],
- komprese/ obstrukce levostranné společné pánevní žíly, resp. ileokavální junkce (Mayův ‑ Thurnerův syndrom) [3,19],
- komprese/ obstrukce dolní duté žíly,
- vrozené anomálie dolní duté žíly a pánevních žil (ageneze, segmentální hypoplazie aj.) [3],
- absence/ dysfunkce chlopní ovarických žil (chybění chlopní uváděno u 15 %, inkompetence chlopní vlevo u 40 %, vpravo u 35 % žen) [20],
- kongenitální absence chlopní vnitřních ilických žil (pouze 10 % vnitřních ilických žil má chlopně a jen 9 % jejich větví) [21],
- perzistující patologické žíly podél ligamentum teres uteri (varixy kolem ligamenta zasahující do tříselného kanálu nebo velkého stydkého pysku nacházíme vzácně během gravidity [22], téměř vždy rychle regredují v poporodním období, ale mohou přetrvávat jako získaná žilní anomálie),
- anomálie a obstrukce portální žíly (velmi vzácně).
4. Gravidita
- komprese dolní duté žíly a ileokavální junkce gravidní dělohou,
- zalomení/ obstrukce odstupu vnitřní ilické žíly gravidní dělohou,
- zvýšení průtoku krve a zvýšení kapacity pánevních žil, vzrůst tlaku v pánevních žilách (žilní průtok a tlak se zvyšuje 2 – 3×, průtok gonadálními žilami až 60×) [5],
- funkční a morfologické žilní abnormality při vysoké hladině pohlavních hormonů (viz níže).
V těhotenství obecně dochází k akcentaci preexistujících žilních patologií. Změny jsou kompletně nebo částečně reverzibilní, ale zkušenosti ukazují na jejich fixaci druhou graviditou a exacerbaci s trvalou progresí/ dekompenzací po graviditě třetí.
Hormonální vlivy
Role ženských pohlavních hormonů v patogenezi pánevní kongesce je obecně přijímána, studována, přesto zůstává řada nezodpovězených otázek [5,9, 23 – 26].
Pro zásadní vliv hormonů svědčí následující skutečnosti (publikované i námi pozorované):
- žíly (zdravé i postižené) mají receptory pro estrogeny a progesteron,
- estrogeny a progesteron vedou v experimentu k žilní relaxaci a distenzi, snižují žilní vazomotorický tonus/ kontraktibilitu, oslabují žilní stěnu i chlopně [23,24],
- ovariální reflux vede k vyplavení pohlavních hormonů z vaječníků do žil pánve a dolních končetin, kde byla prokázána signifikantně zvýšená hladina estradiolu u pacientek s pánevní kongescí [25],
- u žen s ovariální žilní insuficiencí, varixy žil dolních končetin a premenstruační bolestí byla zjištěna 2 – 9× vyšší koncentrace estrogenů a kortikosteroidů v bolestivých varikózních segmentech ve srovnání s nebolestivými [26],
- symptomatické kongesce postihují ženy ve fertilním věku, v menopauze obtíže spontánně ustupují, přestože strukturální žilní abnormality trvají,
- hysterektomie s jednostrannou ovarektomií je méně účinná než s odstraněním obou ovarií [16],
- ovariální suprese medroxyprogesteronem zmírňuje obtíže, i když jen dočasně [27],
- zhoršení pánevní bolesti a bolestí varikózních žil nastává v období kolem menses,
- žilní bolesti (flebodynie) dolních končetin může vyvolat u disponovaných žen hormonální kontracepce,
- nápadná distenze/ dilatace žil (pánevníchi dolních končetin) se objevuje již na počátku gravidity (při vzestupu hladiny progesteronu) [5].
Námitkou proti hormonální teorii původu pánevní kongesce je, že dlouhodobé užívání kombinované hormonální kontracepce nevede k vyšší incidenci varixů žil dolních končetin a výskyt těžších forem žilní nedostatečnosti (stadium C4 – C6 dle CEAP klasifikace) je dokonce u uživatelek menší [5].
Familiární výskyt onemocnění není popisován.
Pánevní kongestivní syndrom nebývá typickou součástí venózních a venolymfatických cévních malformací typu Klippel ‑ Trenaunay syndrom nebo arteriovenózních malformací typu Parkes ‑ Weber syndrom.
Anatomie refluxu
Za fyziologických okolností zajišťují žilní drenáž pánevních orgánů (dělohy, močového měchýře, vaječníků a vejcovodů) vnitřní ilické žíly a jejich povodí. Většina krve z vaječníků a část z oblasti děložních rohů odtéká ovariálními žilami. Vnitřní ilické žíly také drenují pánevní dno, přilehlou část břišní stěny, hýždě a konečník. Do pánve je cestou vv. iliolumbales a vv. sacrales možný venózní odtok z lumbosakrálního segmentu páteře. Žilní krev z dolních končetin se vlévá do společných femorálních, resp. zevních ilických žil a plynule pokračuje do dolní duté žíly. Krev z pánevních orgánů se stéká do pletení, které široce komunikují nebo přímo přecházejí jedna v druhou. Existuje propojení mezi povodím ovarických žil, vnitřních ilických žil, žilami dolních končetin (extrapelvické spojky, únikové žíly) a vertebrálními žilami. Systém venózních plexů a jejich spojek je komplexní a variabilní [5,6,28]. Portokavální anastomózy v oblasti rekta nehrají obvykle větší roli. Levostranná ovarická žíla ústí dle různých sdělení do levostranné renální žíly v 80 – 98 % [29], obvykle v úhlu blízkém 90°. Pravostranná ovarická žíla ústí normálně do v. cava inferior, obvykle v úhlu blízkém 45°. Zřídka se vlévá v. ovarica do renální žíly také vpravo.
Situace se mění v přítomnosti výše uvedených abnormalit – drenáž pánve je blokována na jedné úrovni nebo na několika úrovních. Kongesce žilních pletení vysvětluje klinické projevy – městnání v plexus venosus ovaricus a uterinus hlubokou pánevní bolest, v plexus venosus (utero)vaginalis dyspareunii, v plexus v. vesicalis mikční obtíže, v plexus v. rectalis hemoroidální obtíže (překvapivě málo časté) a kongesce plexus v. vertebralis je příčinou lumbalgií. Reflux do větví v. iliaca interna je zdrojem vulvoperineálních obtíží (v. pudenda interna a v. obturatoria) a typického varikózního syndromu (v. pudenda interna a v. glutea superior a inferior).
Důležitá patologie, která se podílí nezřídka rozhodujícím způsobem na vzniku pánevní kongesce, se nazývá syndrom louskáčku [18,30 – 32]. Je způsoben renální žilní hypertenzí při obstrukci levostranné renální žíly (LRV).
Kongesce ledviny se manifestuje následujícími příznaky:
- renální varixy (dilatace hilových a kapsulárních žil),
- perirenální/ pararenální varixy (dilatace periureterálních, adrenálních a lumbálních žil),
- insuficience/ dilatace ovarické žíly,
- hematurie (makroskopická/ mikroskopická, trvalá/ recidivující),
- bolest dolní části zad (lumbalgie, velmi častá),
- bolest v levé bederní krajině (nefralgie, častá),
- renální kolika (z obstrukce krevním koagulem, vzácná),
- nízká tolerance zátěže, neurovegetativní labilita, námahová dušnost .
Příčiny obstrukce levostranné renální žíly:
- komprese žíly mezi aortou a horní mezenterickou tepnou (horní fenomén louskáčku) při abnormálním odstupu tepny (ostrý aortomezenterický úhel),
- komprese žíly mezi aortou a páteří (dolní fenomén louskáčku) při anomálním – retroaortálním průběhu žíly,
- strangulace žíly fibrózní tkání – extenze vaziva v místě odstupu mezenterické tepny, retroperitoneální fibróza (primární – Ormondova choroba, sekundární),
- komprese žíly aneuryzmatem renální tepny ,
- trakce žíly při dorzokaudální ptóze ledviny nebo aneuryzmatu abdominální aorty,
- trombóza nebo tumorózní (maligní) invaze žíly.
Nejčastěji je přítomen horní louskáčkový fenomén v kombinaci se strangulací žíly adhezemi.
Retroaortální průběh LRV je uváděn v rozmezí 1,7 – 3 % [4,29,33], dolní louskáčkový fenomén je tedy vzácný. Ostatní příčiny (kromě tumorózní obstrukce) jsou raritní. Je pozoruhodné, že rozvoj renální kongesce není popisován po chirurgické ligaci žíly, například při jejím perioperačním poranění. Žilní stenóza může být fixovaná (rigidní) nebo dynamická (elastická), jejíž stupeň/ tíže se mění s polohou těla nebo fází dechového cyklu (kraniokaudální posun ledviny/ žíly změnami polohy bránice). Pouze lehká stenóza se může stát hemodynamicky významnou v graviditě tlakem narůstající dělohy. Renální kongesce je jednou z příčin vzniku až 83 % symptomatických pánevních varixů [18]. Určení závažnosti/ tíže stenózy a její indikace k intervenci je častým diagnostickým problémem. Velmi důležitá je znalost propojení mezi žilami pánve a dolních končetin. Přítomnost četných extrapelvických spojek (únikových žil) dává možnost šíření refluxu z pánve zevně na vulvu, perineum, hýždě a dolní končetiny. Hlavními místy spojení – refluxními body – jsou [34]:
- inguinální perforátor (zdroj tříselných a labiálních varixů),
- klitoridální perforátor (zdroj vulvárních a předních perineálních varixů),
- perineální perforátor (zdroj zadních perineálních varixů),
- gluteální horní perforátor (zdroj hýžďových varixů),
- gluteální dolní perforátor (zdroj hýžďových, ischiadických a zadních stehenních varixů).
Reflux se může dále propagovat do povrchových i hlubokých žil obou končetin a způsobit vznik mnoha insuficientních segmentů (varikózních kmenů). K nejdůležitějším spojením s končetinovými žilami patří následující [3,9,28]:
- v. pudenda interna – v. pudenda externa – v. saphena magna (VSM),
- v. glutea inferior – v. intersaphena femoris (Giacomini) – kraniální extenze v. saphena parva (VSP),
- v. glutea inferior – perzistující v. ischiadica nebo v. femoralis dorsalis [35],
- v. glutea superior – v. circumflexa ilium superficialis,
- v. obturatoria – v. profunda femoris,
- vv. ligamentum teres uteri – přítoky safenofemorální junkce – VSM.
Klinika
Hlavními příznaky onemocnění jsou chronická pánevní bolest a atypický varikózní syndrom. Častým problémem bývá také bolest dolní části zad [16]. Projevy mohou být rozmanité a nespecifické. Subjektivní obtíže a objektivní nálezy různé tíže a závažnosti se obvykle kombinují a prolínají. Přehledně lze rozdělit symptomy do několika skupin [14]:
1. Bolest
- pánevní/ hypogastrická (častěji vlevo),
- perineální (spojená s varixy nebo bez nich),
- dolní části zad (lumbago),
- levého boku (nefralgie při kongesci ledviny),
- hýždí (spojená s varixy),
- dolních končetin (v průběhu varixů nebo sedacího nervu).
Bolest může být trvalá, častěji však bývá vyvolána a zhoršuje se za typických okolností a stavů: v těhotenství, v perimenstruačním a periovulačním období, během vaginálního styku a po něm (dyspareunie, postkoitální bolest), močením (dysurie), statickou zátěží (stání, sezení, cestování), sportovními aktivitami (jízda na kole, lyžování), stresem, pracovní zátěží. K akcentaci obtíží může dojít užíváním kombinované i monokomponentní – gestagenní – hormonální kontracepce. K úlevě dochází často vleže na zádech, nejméně problémů bývá počátkem dne.
2. Ostatní urogenitální příznaky
- mikční obtíže (urgence/ tenesmy, polakisurie, inkontinence moči),
- vaginální výtoky (neinfekční),
- otoky vulvy (převážně levého velkého stydkého pysku),
- poruchy menstruačního cyklu/ krvácení.
Močové obtíže jsou charakteristickou součástí klinického obrazu, u řady pacientek se dostavují zejména po pohlavním styku.
3. Varixy
- vulvární (poševního vchodu a/ nebo velkého labia),
- perineální (hráze a vnitřní strany stehna, vzácněji perianální),
- inguinální,
- hýžďové a zadní strany stehna,
- ischiadické (v povodí perzistující ischiadické žíly nebo podél ischiadického nervu, často zasahují až do podkolenní jámy).
Křečové žíly mohou být nenápadné (zejména při vyšetření vleže) nebo nemusí být přítomny vůbec. Vulvární a hýžďové varixy bývají skryté. Běžná je výrazná bolestivost postižených žil v premenstruačním období. V pokročilých případech se postižení šíří až na bérec. Varixy po operačním řešení obvykle časně recidivují.
4. Celkové příznaky
- sexuální dysfunkce,
- deprese,
- chronická únava,
- partnerské/ rodinné problémy.
Při výrazných trvalých potížích mají ženy deprese, nízkou toleranci zátěže, obávají se závažného onemocnění a také eventuální další gravidity, vyhýbají se sexuálním aktivitám. Jsou frustrované nepochopením ze strany partnera, rodiny a ošetřujícího lékaře.
Diagnostika
Stanovení diagnózy vychází z charakteristického klinického obrazu a provedení duplexní ultrasonografie žil břicha, pánve a dolních končetin. Ve velké většině případů jde o diagnózu per exclusionem. V některých situacích je vhodné/ nutné doplnit MR venografii nebo CT flebografii, u kandidátek invazivního řešení se provádí selektivní konvenční flebografie pánevních/ gonadálních žil. Vyšetřovací algoritmus se odlišuje podle pracoviště i konkrétní pacientky. K rozhodnutí o primárně konzervativní terapii nebo invazivním přístupu dostačuje obvykle klinické vyšetření a sonografie. MR venografie je často nadbytečná, ale při nediagnostickém ultrazvuku a pochybnostech velmi vhodná.
Klinické vyšetření
Anamnestický pohovor má klíčový význam. Cíleně se dotazujeme na tyto skutečnosti:
- souvislost obtíží s typickými provokujícími momenty (menstruací, koitem),
- počet a průběh těhotenství (vulvární varixy, otok genitálu),
- předchozí žilní operace/ intervence (lokalizace, recidivy),
- vliv léků (venofarmak, hormonálních preparátů),
- omezení aktivit (běžných denních, pracovních, sportovních, sexuálních).
Rodinná anamnéza nebývá přínosná.
Fyzikální vyšetření provádíme zásadně vestoje. Zaměřujeme se na přítomnost viditelných a/ nebo palpovatelných varixů v charakterizovaných lokalizacích a jizev po operacích. Negativní nález nevylučuje kongesci, ta se může manifestovat jak pánevní bolestí, tak varixy, ale jedno nebo druhé může chybět (nekompletní formy).
Ultrasonografie (US)
Sonografie je obvykle zobrazovacím vyšetřením první volby a základní screeningovou metodou. V Guidelines of the American Venous Forum z roku 2009 byla duplexní sonografie doporučena jako iniciální vyšetření při podezření na pánevní kongesci (síla doporučení 1B), ve stejném dokumentu z roku 2011 byla transabdominální ultrasonografie postavena na roveň ostatním neinvazivním metodám (CT/ MR venografie, transvaginální UZ, síla doporučení 1C) [36]. Senzitivita ultrazvuku je v rukou erudovaného diagnostika vysoká, podle našich vlastních zkušeností téměř stejná jako u kontrastní MR a podstatně vyšší než u CT angiografie. Validní hodnocení ovariálních žil (OV) se daří až v 93 % případů, sonograficky stanovený průměr OV > 6 mm má 83 – 96% pozitivní prediktivní hodnotu pro pánevní varixy [6,17].
Abdominální/ transparietální US je prováděna přísně na lačno, vleže i vestoje, při volném dýchání a Valsalvově manévru, podle potřeby opakovaně. Komplexní vyšetření probíhá v několika krocích a zahrnuje hodnocení:
- levostranné renální žíly (přítomnost/ hemodynamickou významnost stenózy/ obstrukce, aortomezenterický úhel),
- ovarických žil (průměr a reflux),
- dolní duté žíly a společné pánevní žíly vlevo (komprese/ stenóza, uzávěr, anomálie),
- vnitřních ilických žil (reflux),
- paravertebrálních žil (dilatace, charakter toku),
- anomálních/ atypických žil (vv. ligamentis teres uteri),
- portální žíly (známky portální hypertenze),
- pánevních/ parauterinních varixů (s nízkou senzitivitou).
Na břišní/ pánevní sonografii navazuje duplexní US žil dolních končetin a vulvoperineální oblasti, kde detekujeme:
- refluxní body (výše popsané),
- insuficientní/ varikózní žilní segmenty,
- varixy labií, perinea a hýždí,
- varixy v průběhu n. ischiadicus ,
- žilní atypie (perzistující v. ischiadica, v. femoralis dorsalis).
Většina žen již přichází s výsledkem transvaginální sonografie provedené gynekologem, kde jsou vyloučeny závažné patologie dělohy a ovarií. Citlivost transvaginálního vyšetření pro pánevní varixy závisí na způsobu provedení (polohování, dechové manévry).
CT a MR venografie
Ačkoli je CT flebografie jednou z doporučovaných diagnostických metod a může kvalitně vizualizovat ovariální žíly a pánevní varixy i u asymptomatických žen [8,22,37,38], není její spolehlivost v detekci pánevní kongesce dostatečně dokumentována a autoři většiny publikací CT vyšetření neindikují. Podle našich zkušeností má nízkou citlivost jak v zobrazení dilatovaných ovariálních žil a pánevních varixů, tak stenózy renální žíly, a může selhat i v hodnocení těžkých nálezů. Tento názor je v souladu s výsledky práce, které publikovali Kim et al v roce 2006 [39], kde senzitivita kontrastního CT pro pánevní kongesci byla pouhých 12,5 %. Přínosné je však CT vyšetření k vyloučení alternativní etiologie pánevní bolesti.
Naopak spolehlivost MR venografie (MRV) je dobře doložena a na některých pracovištích se stává preferovaným neinvazivním vyšetřením. Asciutto et al [40] nalezli 96% shodu mezi MR venografií a konvenční flebografií v hodnocení žilní anatomie a 70% shodu ve stanovení stupně kongesce. Senzitivita a specificita MRV pro OV byla 88 % a 67 %, pro hypogastrické žíly 100 % a 38 % a pro pánevní plexy/ varixy 91 % a 42 %. Falešně negativních bylo 24 % nálezů. Také MR velmi spolehlivě zobrazuje patologie pánevních orgánů. MR venografie někdy obtížně kvalifikuje abnormality renální žíly a kvantifikuje stupeň její stenózy, zejména je‑li průtok v postiženém úseku výrazně redukován (stagnace toku).
Flebografie
Selektivní flebografie (pánevní/ renální/ ovariální, event. lumbální) je zlatým standardem v diagnostice pánevní kongesce (obr. 1). Poskytuje podrobné anatomické informace, potvrzuje a upřesňuje nálezy neinvazivních vyšetření. Je nezbytná při indikaci endovaskulární intervence [3,12]. Provádí se z femorálních nebo jugulárních žil. Preferována je kanylace pravé společné femorální žíly, pouze při intervenci pravostranné ovarické žíly dávají někteří přednost transjugulárnímu přístupu. Vyšetřuje se vleže na zádech ve vodorovné a/ nebo anti‑Trendelenburgově poloze se sklonem 35°. Flebografie/ intervence vyžaduje krátkou hospitalizaci (24 – 48 hod), i když podle zahraničních zkušeností může být bezpečně uskutečněna i jako ambulantní výkon.
1. Selektivní fl ebografi e. Insuficientní/varikózní levostranná ovariální žíla. 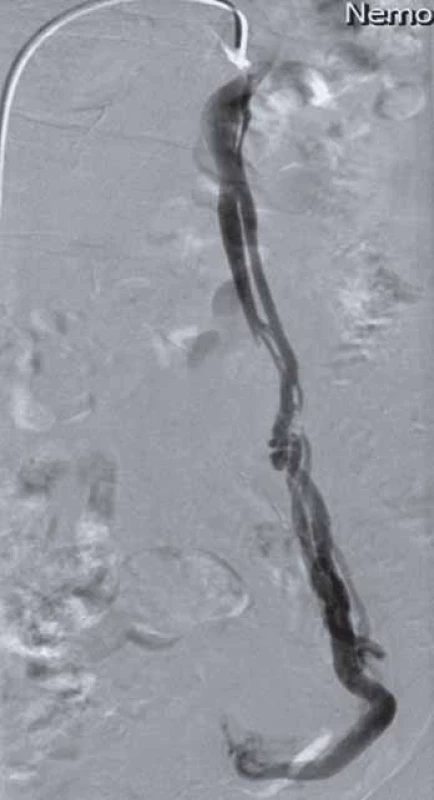
Laparoskopie
Gynekologická (probatorní) laparoskopie má malou senzitivitu v diagnostice pánevních varixů, podle publikovaných analýz nejvýše 20 – 40 % [7,19,40]. Příčinou je kolaps varixů při vyšetření ve standardní gynekologické poloze a jejich komprese vysokým intraperitoneálním tlakem po insuflaci dutiny břišní oxidem uhličitým.
Diagnostická kritéria
Přestože není úplná shoda mezi autory a uváděné hodnoty se poněkud liší, jsou zobrazovací kritéria pánevní kongesce všeobecně akceptována.
Kritéria pánevní kongesce [3,7,13,41]:
1. Patologie ovariálních žil
- průměr/ dilatace > 6 mm sonograficky (US),
- průměr/ dilatace > 8 mm na CT/ MR,
- průměr/ dilatace > 10 mm na flebografii (nebo > 6 – 8 mm, je‑li těžký reflux),
- reflux > 0,5 – 1,0 sek sonograficky (nebo trvale obrácený tok),
- spontánní retrográdní tok/ plnění ovariálních žil na CT/ MR a flebografii (retence kontrastu > 20 sek při flebografii).
2. Patologie pánevních žil
- průměr/ dilatace pánevních žil (parauterinních) > 5 – 6 mm sonograficky,
- průměr/ dilatace pánevních žil > 4 mm na CT/ MR,
- průměr/ dilatace pánevních žil > 6 mm na flebografii (kongesce plexů),
- průměr/ dilatace žil v děložní svalovině > 4 – 5 mm (US, CT, MR),
- retrográdní plnění vnitřní ilické žíly na flebografii,
- plnění pánevních žil přes střední čáru na flebografii,
- průkaz extrapelvických žilních spojek – plnění vulvárních a/ nebo stehenních varixů (ipsi/ kontralaterálních) na flebografii.
Hlavním sonografickým kritériem je průměr OV > 6 mm s průkazem retrográdního toku (refluxu). Flebografický nález umožňuje kvantifikovat tíži kongesce do tří stupňů [18], ale klinický význam takového hodnocení je nejasný.
Podstatně menší shoda panuje na kritériích renálního syndromu louskáčku (hemodynamicky významné stenózy levostranné renální žíly – LRV). Určení závažnosti stenózy renální žíly, jejího podílu na kongesci pánve a indikace k invazivnímu řešení jsou hlavními diagnostickými problémy. Situace je komplikovaná z několika důvodů:
- komprese/ stenóza LRV může být dynamická/ nekonstantní a měnit se s polohou těla, fází dechového cyklu nebo tlakem sonografické sondy,
- hemodynamické poměry v žíle významně závisí na stupni rozvoje kolaterálního oběhu (kapacitě ovariální žíly a/ nebo lumbálních kolaterál),
- CT/ MR venografie ani prostá konvenční flebografie nemá dostatečnou přesnost v hodnocení stupně stenózy,
- venózní manometrie – měření transstenotického tlakového gradientu je nespolehlivá (překrývání hodnot u symptomatických/ asymptomatických nálezů, pseudonormalizace tlaku před stenózou při kapacitních kolaterálách),
- intravaskulární ultrazvuk (IVUS) je málo dostupný, velmi nákladný a jeho přínos v této indikaci nebyl potvrzen,
- není jednotný názor na nutnost intervence stenózy LRV v případě kongesce způsobené insuficiencí levostranné OV – někteří autoři doporučují samotnou ablaci (embolizaci) ovarické žíly, jiní upozorňují na rizika zhoršení renální a páteřní kongesce a preferují přednostně zákrok na renální žíle [3].
Přes všechna výše uvedená omezení můžeme na základě publikovaných dat [18,31,32,42,43] a vlastních zkušeností určit následující kritéria pro přítomnost významné stenózy LRV:
1. Sonografická
- poměr průměru žíly před stenózou/ ve stenóze > 5 (před stenózou = průměr kmene paraaortálně nebo v hilu ledviny, ve stenóze = v preaortálním, resp. aortomezenterickém segmentu),
- poměr vrcholové rychlosti toku ve stenóze/ /v renálním hilu (PSVR) > 5,
- pomalý augmentovaný tok v hilu s Vmax < 15 – 20 cm/ s,
- dilatace kmene žíly – průměr > 8 – 10 mm,
- přítomnost pararenálních kolaterál a/ nebo dilatace ovarické žíly.
Stenózy působící závažnou renální kongesci a vyžadující intervenci mají obvykle přibližně tyto charakteristiky: PSVR > 10, Vmax. toku před stenózou nebo v hilu ledviny < 15 – 10 cm/ s, průměr kmene žíly > 10 mm, Vmax. toku ve stenóze > 200 – 300 cm/ s nebo obtížná detekce toku v kritickém segmentu. Pomocným kritériem je nález anomálního odstupu horní mezenterické tepny s ostrým aortomezenterickým úhlem (při vyšetření vstoje má úhel < 21° senzitivitu 87 % a specificitu 76,9 % pro přítomnost syndromu louskáčku) [44].
2. Flebografická
- stagnace toku v žíle,
- pruhovité projasnění v místě komprese a obtížný průchod vodičem u preokluzivních stenóz,
- renální a perirenální kolaterály,
- transstenotický tlakový gradient > 3 (4) mm Hg.
Žádná grafická metoda není schopna dát sama o sobě definitivní odpověď na významnost renální žilní stenózy. Korelace s klinickým obrazem a zkušenostmi jsou nezbytné.
Terapie
Léčebný přístup je podmíněn řadou skutečností – intenzitou a spektrem obtíží, reakcí na dosavadní terapii, očekáváním a preferencemi pacientky, patologicko‑anatomickým nálezem a zhodnocením poměru přínos/ riziko jednotlivých intervencí. Jiný je postup u pacientek s dominující pánevní bolestí, jiný v řešení varikózního syndromu. Terapii lze rozdělit na konzervativní (farmakologickou), invazivní (endovaskulární, chirurgické cévní rekonstrukce) a paliativní (po selhání obou předchozích).
Konzervativní terapie
Prvním krokem s „léčebným účinkem“ u všech pacientek je objasnění povahy onemocnění – příčiny jejich obtíží a rozptýlení obav z možných ohrožujících komplikací. Pohovor s doporučením režimových opatření je někdy dostačující u žen s lehkou klinickou formou. V případě závaznějších problémů je indikována farmakoterapie, její možnosti jsou ovšem limitované. K terapii chronické pánevní bolesti (nejen žilní etiologie) se užívají tato léčiva:
- hormony,
- analgetika,
- psychofarmaka (antidepresiva),
- látky ovlivňující neuropatickou bolest,
- venofarmaka.
Hormonální léčba medroxyprogesteron acetátem (syntetickým gestagenem tlumícím sekreci hypofyzárních gonadotropinů) nebo goserelinem (analogem gonadoliberinu blokujícím sekreci hypofyzárního luteinizačního hormonu), která vede k ovariálnímu útlumu, má pouze dočasný symptomatický účinek a není v této indikaci schválena [16,19,27,45]. Vliv analgetik ze skupiny nesteroidních antirevmatik nebo opioidů k léčbě středně silné bolesti bývá omezený. Navíc ochota pacientek užívat dlouhodobě léky tišící bolest v situaci, kdy často není zřejmý původ jejich obtíží, je minimální. Léčba psychofarmaky – nejčastěji tricyklickými antidepresivy nebo SSRI – je opodstatněná v případě sekundárních psychických problémů a může mít i mírný analgetický efekt. Významné místo v terapii chronické pánevní bolesti mají gabapentin a pregabalin. Účinnost gabapentinu byla ověřena ve studii, kde bolest zmírnil významně lépe než amitriptylin, také jejich kombinace byla vhodná [45]. Léky volby u prokázané kongesce jsou ale venofarmaka. Nejvíce důkazů svědčí pro užití mikronizované purifikované flavonoidní frakce (MPFF, Detralex/ Daflon tbl., Servier, Francie) v dávce 2 × 500 mg až 2 × 1 g [46]. Dobrou zkušenost máme i s preparátem z extraktu Ruscus aceluatus, hesperidinu a kyseliny askorbové (Cyclo 3 Fort cps., Pierre Fabre Medicament, Francie) v dávce 2 × 400 mg až 2 × 800 mg (2× 1 – 2 cps). Léky lze užívat trvale nebo epizodicky v kritickém perimenstruačním období, bezpečnost obou je prokázána i v těhotenství. Kompresivní terapie je samozřejmostí u žen s varixy dolních končetin i vulvy/ perinea. Předepisujeme punčochy nebo kalhoty 1. – 2. kompresní třídy.
Invazivní terapie
Invazivní přístup indikujeme u těžkého klinického stavu a po selhání konzervativní léčby. Jako „těžké“ označujeme obtíže trvale přítomné nebo pravidelné i mimo období menses, které omezují zásadním způsobem běžné denní, pracovní a sexuální aktivity. Dalším důvodem k intervenci je varikózní syndrom spojený s pánevní kongescí, kdy lze očekávat selhání standardní léčby varixů nebo již k takovému selhání došlo (65 – 71 % žen přichází s recidivou varixů po předchozí operaci) [13,40]. Možnosti invazivní léčby jsou:
1. Chirurgické [5,6,8,30 – 32,47 – 50]
- otevřená/ laparoskopická ligace ovarických žil (a všech jejich varikózních descendentních větví) [6],
- otevřená ligace/ venektomie anomálních žil,
- dekomprese levostranné renální žíly protětím adhezí [48],
- otevřená/ laparoskopická transpozice levostranné renální žíly [31,32],
- renokavální bypass (žilní nebo protetickým interponátem),
- gonadokavální bypass (reimplantace levostranné OV do dolní duté žíly) [30],
- implantace externího stentu (ePTFE prstence) do místa komprese LRV [30],
- transpozice anomálně odstupující a. mesenterica superior [48],
- laparoskopická skleroterapie pánevních žil [47],
- korekce renální malpozice (přední nefropexe), renální autotransplantace nebo odběr k dárcovství levé ledviny [8,48,31],
- klasická a/ nebo miniinvazivní chirurgie varixů dolních končetin,
- pěnová skleroterapie varixů vulvy, perinea a hýždí.
2. Endovaskulární [3,6,7,11 – 13,19,32,41,50 – 54]
- embolizace ovarických a/ nebo vnitřních ilických žil spirálami,
- chemoembolizace/ skleroterapie pánevních varixů,
- implantace ilikokaválního žilního stentu,
- implantace renálního žilního stentu .
Endovaskulární intervence – endovenózní ablace patologických gonadálních/ pánevních žil je nyní preferovanou metodou a má přednost před chirurgickým přístupem. Výkon spočívá v terapeutické embolizaci insuficientních/ dilatovaných ovarických a/ nebo vnitřních ilických žil a varixů v jejich povodí (obr. 2). Navazuje na selektivní flebografii a provádí se pomocí spirál (coilů) různého typu (materiálu, tvaru, průměru a délky). Na našem pracovišti používáme převážně InterlockTM ‑ 35 Coil Fibered IDC Occlusion Systems, Boston Scientific (helikální 8 – 15 mm × 10 – 40 cm). Embolizace spirálami nemusí být dostačující v případě rozsáhlých pánevních varikózních konvolutů a bývá někdy doplněna jejich chemoembolizací [3,12,19] sklerotizační pěnou, polymerizujícím tkáňovým lepidlem nebo absorbovatelnou želatinou. V literatuře je i zmínka o využití Amplatzova cévního okluderu. První okluze ovarických žil spirálami byla popsána v roce 1993 [55], až do současnosti pak bylo publikováno mnoho studií a kazuistických sdělení, které dokumentují efekt těchto intervencí [3,11 – 13]. V prvním období, v 90. letech 20. století, se úspěšnost v redukci pánevních bolestí pohybovala mezi 50 a 80 %, nyní je významné ovlivnění obtíží uváděno v 60 – 100 % případů. Asi u 60 % pacientek dochází k úplnému vymizení symptomů, u dalších 20 – 30 % k jejich výraznému zlepšení, beze změny zůstávají u 5 – 15 % a zhoršení příznaků bylo pozorováno u 1 – 4 % žen [7]. Výsledky jsou jistě ovlivněny celou řadou skutečností a nejsou zcela srovnatelné. Nedostatečný efekt lze očekávat u žen s nejtěžším klinickým obrazem, při insuficienci více žil a nekompletní eradikaci refluxu, při dyspareunii jako hlavním příznaku (i když v práci Cretona et al [15] nebyla přítomnost dyspareunie spojena s horším klinickým výsledkem), při atypických obtížích (nejsou‑li přítomny charakteristické provokační/ úlevové momenty) a v přítomnosti renální kongesce, není‑li tato vyřešena. Nejčastěji embolizovanou žilou je levostranná v. ovarica, ale v souborech pacientek z posledních let je vysoká četnost intervencí obou ovarických žil a kombinovaných embolizací žil ovarických a vnitřních ilických.
2. Endovenózní ablace. Embolizace levostranné ovariální žíly spirálami. 
Přestože souhlasíme, že kompletní eradikace refluxů – extenzivní embolizace – je nutná ke klinickému úspěchu a snižuje počet recidiv, jsme zdrženliví k indikaci uzávěru pravostranné ovarické žíly, neboť stejně jako d’Archambeau „silně věříme“ v „levo ‑ pravou“ teorii [18]: u nemalé části žen s refluxem do levostranné ovarické žíly (nejčastější typ postižení) nebo levostranné ilické žíly je patrna dilatovaná také pravostranná v. ovarica. V té však nemusíme detekovat reflux, ale naopak zesílený prográdní tok, neboť drenuje krev regurgitující do pánve zleva, a plní tak kompenzační funkci. Odstranění refluxu vlevo poté vede k úplné normalizaci nálezu také na pravostranné OV, což jsme opakovaně pozorovali. Embolizaci vpravo indikujeme až v druhé době (obvykle po třech měsících) a pouze tehdy, když perzistuje významná dilatace žíly, prokazujeme‑li v ní reflux, a současně nedošlo k uspokojivému ovlivnění potíží předchozím výkonem. Vzácně je popisováno izolované postižení pravostranné ovarické žíly [13], sami jsme takový případ neřešili.
Terapeutické embolizace jsou technicky úspěšné v 99 % případů s četností recidivy refluxu < 8 % [7]. Nezávažné komplikace (hematom v místě vpichu, extravazace kontrastu aj.) se vyskytují asi ve 4 % [19]. Závažné komplikace jsou velmi vzácné, nicméně migrace spirál do plic je popisována, zejména při embolizaci vnitřní ilické žíly [11]. Také fragmenty polymerizujícího lepidla mohou embolizovat do plic, přesto je užití okluzních balonků ke snížení tohoto rizika při skleroterapii v povodí vnitřních ilických žil považováno za kontroverzní [19]. Rozhodující je zkušenost intervenčního radiologa.
Důsledkem endovenózní ablace je arteficiální trombóza a flebitida pánevních žil, která se často (asi u poloviny žen) manifestuje jako bolestivý tlak v podbřišku s možnou iradiací do hýždě, přechodnými dyspeptickými obtížemi a zvýšenou tělesnou teplotou (horečkou). Tento tzv. postembolizační syndrom [12] se objevuje typicky 24 – 48 hodin po výkonu (tedy po propuštění z hospitalizace) a mizí obvykle během několika dnů. Příznaky korelují s velikostí nálezu a po rozsáhlých embolizacích mohou trvat i několik týdnů (3 – 4 týdny v nejtěžších případech). Pacientky musí být dostatečně poučeny, léčba je symptomatická (nesteroidní antirevmatika, prokinetika, antipyretika a venofarmaka), rehospitalizace není nutná ani při protrahovaném průběhu. Ojedinělý je náš případ s postembolizační aseptickou pánevní peritonitidou s přestupem zánětu na ureter a renální kolikou – také zde se stav plně upravil při ambulantní léčbě. Za komplikaci nesprávně indikované intervence lze považovat i zhoršení příznaků renální nebo páteřní kongesce [3]. Menstruační cyklus ani možnost otěhotnění nejsou negativně ovlivněny [11].
Dalším endovaskulárním výkonem, který je indikovaný u kongescí s přítomností obstrukce pánevních žil nebo dolní duté žíly (DDŽ), je implantace ilikokaválního žilního stentu. Dlouhodobá průchodnost stentů v této lokalizaci pro netrombotické léze je velmi dobrá s uváděnou primární, asistovanou primární a sekundární kumulativní průchodností 89 %, 100 % a 100 %. Po třech letech jsou hodnoty průchodnosti 65 %, 85% a 88 % [56].
Naopak při symptomatické renální kongesci (kritické stenóze renální žíly) mělo dosud přednost operační řešení před endovaskulární léčbou. Mezi standardní výkony patří zmíněné uvolnění stenotické žíly z adhezí (protětí fibrózní tkáně zmnožené při odstupu horní mezenterické tepny) nebo transpozice tepnami komprimované žíly – její reimplantace do v. cava inferior o 3 – 5 cm kaudálně [31,48]. Elegantní operací je provedení žilního renokaválního bypassu s využitím terminální části dilatované ovarické žíly (tento postup byl s úspěchem zvolen u jedné z našich pacientek). Ostatní operace (transpozice mezenterické tepny, autotransplantace ledviny aj.) jsou považovány za příliš rizikové a jsou raritní. Velmi zajímavá je práce, která se týká „zdravých“ dárkyň ledviny. U 10 % z vyšetřených kandidátek dárcovství byl na CT patrný reflux do levostranné OV, 59 % z nich mělo anamnesticky chronickou pánevní bolest. Po nefrektomii došlo k úplnému vymizení bolesti u 54 % žen a k významnému zlepšení u dalších 23 % [8].
Implantace renálního žilního stentu je stále hodnocena jako kontroverzní postup a není všeobecně akceptována. První zkušenosti nebyly příliš povzbudivé – vyskytly se migrace stentů do dolní duté žíly, jejich dislokace, restenózy a trombóza s recidivou symptomů [50]. Kazuistiky a velké kazuistické série z posledních let přinášejí více optimizmu. Stenty byly úspěšně implantovány do nativních renálních žil pro syndrom louskáčku manifestovaný jak pánevní kongescí u žen, tak hematurií a/ nebo varikokélou u mužů [52,53,57]. Také restenózy po transpozici LRV byly řešeny tímto způsobem [51]. Technická úspěšnost výkonu je vysoká, závažné komplikace vzácné a frekvence recidiv stenóz a příznaků nízká. Nejčastějším problémem je malpozice/ migrace stentu. Pro výraznou bolestivost, která může přetrvat i několik dnů, je vhodné provádět výkon v celkové anestezii. Užívají se samoexpandibilní stenty průměru 10 – 20 mm a délky 40 – 70 mm. Autoři sdělení doporučují preferovat endovaskulární terapii a chirurgický přístup v řešení renální kongesce rezervovat pro případy jejího selhání [32].
Paliativní terapie
Uvedená invazivní léčba pánevní kongesce je neúspěšná u 10 – 20 % pacientek. V takovém případě zvažujeme některý z následujících paliativních zákroků jako poslední možnost v ovlivnění refrakterních symptomů:
- hysterektomii s jednostrannou/ oboustrannou ovarektomií,
- invazivní léčbu bolesti.
Hysterektomie s jednostrannou ovarektomií se jeví jako málo účinná a ani výkon s odstraněním obou ovarií není vždy dostatečně efektivní [16]. Asi třetina žen má po hysterektomii (s ovarektomií/ bez ovarektomie) reziduální bolesti a u každé páté dojde k recidivě obtíží [19]. U dvou pacientek z našeho souboru nevedla tato operace k podstatnému zlepšení.
Invazivní léčba bolesti pak může znamenat poslední naději u žen s neztišitelnou pánevní a/ nebo vulvoperineální bolestí. Provádí se CT ‑ navigované chemické nervové blokády (absolutním alkoholem, fenolem, glycerinem) nebo laparoskopické nervové ablace (radiofrekvenční termokoagulace nebo kryoabalce). Cílem je destrukce sympatických nervových pletení a ganglií – v terapii pánevní bolesti je indikována neurolýza plexus hypogastricus superior a ganglion impar. Presakrální neurektomie (přetětí/ excize nervových vláken) je považována za obtížnou, ale účinnou chirurgickou metodu. Přednost má chemická blokáda, která je zatížena méně komplikacemi, trvalejšího efektu lze obvykle dosáhnout laparoskopickou cestou [45].
Diferenciální diagnostika
Diagnostika chronické pánevní bolesti bývá jednou z nejobtížnějších v medicíně. Často vyžaduje vyloučení řady gynekologických, urologických, gastrointestinálních, muskuloskeletálních i psychogenních příčin. Také varikózní syndrom popsaný výše nemusí vždy souviset s žilní patologií pánve. Varixy v oblasti hypogastria, třísla a vulvy mohou pocházet z insuficientní safenofemorální junkce a jejích přítoků. Příčinou varixů perineálních může být reflux do větví zadní velké akcesorní safeny nebo z hýžďových perforátorů, zdrojem křečových žil zadní strany stehna (obr. 3) jsou často dorzální a laterální stehenní perforátory nebo insuficientní kraniální extenze malé safeny [28].
3. Varixy zadní strany stehna v oblasti insuficientní v. Giacomini. 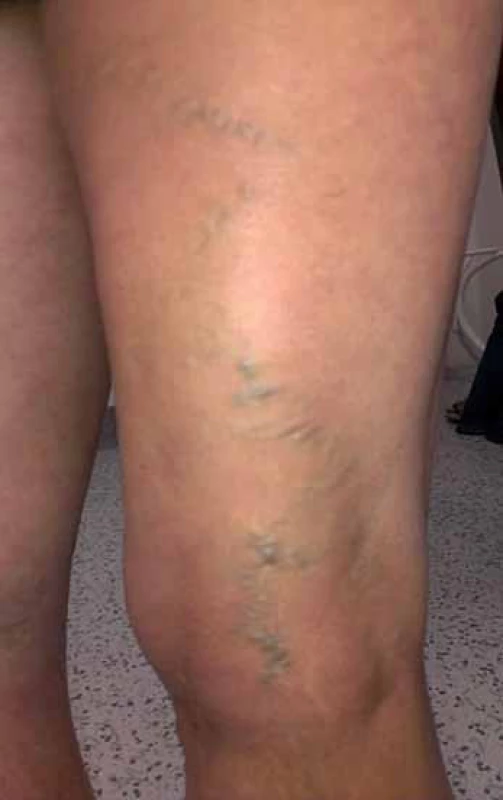
Prognóza
Pánevní kongesce není život ohrožující onemocnění. Trombotické žilní komplikace v těhotenství a závažná varikózní krvácení během porodu, i když obávaná, jsou raritní. Plodnost není narušena, v početí ženám s kongescí nebráníme. Těhotenství nelze považovat v pravém smyslu slova za rizikové, farmakologická prevence venózního tromboembolismu není paušálně indikovaná. V mnoha případech jsou obtíže mírné, přítomné pouze v perimenstruačním období a/ nebo po pohlavním styku, reagují na venofarmaka, nemají sklon k progresi a neznamenají zásadní životní omezení. Kvalita života pacientek s torpidními symptomy je naopak velmi nízká, těžké formy mohou vést k trvalé pracovní neschopnosti. Spontánní ústup pánevních bolestí v menopauze je běžný, přesto nevylučuje zhoršení varikózního syndromu ani ve vyšším věku.
Závěr
Symptomatická pánevní kongesce je jedním z projevů chronického žilního onemocnění. Na rozdíl od venózní insuficience dolních končetin je málo známá a nedostatečně diagnostikovaná. Negativním dopadem na život postižených žen dokáže překonat i bércové žilní ulcerace. Ačkoli může být terapeutický zásah do komplikovaného a variabilního systému žilní drenáže ženské pánve problematický a neúspěšný, je endovaskulární léčba pro značnou část pacientek nadějí na odstranění nebo podstatné zlepšení jejich obtíží.
Doručeno do redakce: 26. 3. 2014
Přijato po recenzi: 14. 7. 2014
MUDr. Martin Holý
www.nemcb.cz
holous@seznam.cz
Sources
1. Taylor HC jr. Vascular congestion and hyperaemia; their effect on structure and function in the female reproductive system. Am J Obstet Gynecol 1949; 57 : 211 – 230.
2. Eklof B, Perrin M, Delis KT et al. Updated terminology of chronic venous disorders: the VEIN ‑ TERM transatlantic interdisciplinary consensus document. J Vasc Surg 2009; 49 : 498 – 501. doi: 10.1016/ j.jvs.2008.09.014.
3. Greiner M, Gilling ‑ Smith GL. Leg varices originating from the pelvis: diagnosis and treatment. Vascular 2007; 15 : 70 – 78.
4. Marone EM, Psacharopulo D, Tshomba Y et al. A typical case of nutcracker phenomenon. J Vasc Surg 2011; 53 : 219. doi: 10.1016/ j.jvs.2010.01.086.
5. Ramelet AA, Perrin M et al. Phlébology. Issy ‑ les ‑ Moulineaux: Elsevier Masson 2008 : 61 – 82, 167 – 182, 429 – 431.
6. Richardson GD. Managament of pelvic venous congestion and perineal varicosities. In: Gloviczki P et al (eds). Handbook of venous disorders. 3rd ed. London: Hodder Arnold 2009 : 617 – 626.
7. Phillips D, Deipolyi AR, Hesketh RL et al. Pelvic congestion syndrome: etiology of pain, diagnosis, and clinical management. J Vasc Interv Radiol 2014; 25 : 725 – 733. doi: 10.1016/ j.jvir.2014.01.030.
8. Belenky A, Bartal G, Atar E et al. Ovarian varices in healthy female kidney donors: incidence, morbidity, and clinical outcome. AJR Am J Roentgeol 2002; 179 : 625 – 627.
9. Labropoulos N, Tiongson J, Pryor L et al. Nonsaphenous superficial vein reflux. J Vasc Surg 2001; 34 : 872 – 877.
10. Perrin MR, Labropoulos N, Leon LR jr. Presentation of the patient with recurrent varices after surgery (REVAS). J Vasc Surg 2006; 43 : 327 – 334.
11. Venbrux AC, Chang AH, Kim HS et al. Pelvic congestion syndrome (pelvic venous incompetence): impact of ovarian and internal iliac vein embolotherapy on menstrual cycle and chronic pelvic pain. J Vasc Interv Radiol 2002; 13 : 171 – 178.
12. Monedero JL, Zubicoa ES, Grimberg M et al. Subdiaphragmatic venous insufficiency: embolization treatment using mixed technique (coils and foam). Phlebolymphology 2004; 45 : 269 – 275.
13. Asciutto G, Asciutto KC, Mumme A et al. Pelvic venous incompetence: reflux patterns and treatment results. Eur J Vasc Endovasc Surg 2009; 38 : 381 – 386. doi: 10.1016/ j.ejvs.2009.05.023.
14. Holý M. Syndrom pánevní kongesce. In: Roztočil K (ed). Angiologie. Praha: Triton 2014 : 186 – 192.
15. Creton D, Hennequin L, Kohler F et al. Embolisation of symptomatic pelvic veins in women presenting with non‑saphenous varicose veins of pelvic origin – three‑year follow‑up. Eur J Vasc Endovasc Surg 2007; 34 : 112 – 117.
16. Chung MH, Huh CY. Comparison of treatments for pelvic congestion syndrome. Tohoku J Exp Med 2003; 201 : 131 – 138.
17. Park SJ, Lim JW, Ko YT et al. Diagnosis of pelvic congestion syndrome using transabdominal and transvaginal sonography. AJR Am J Roentgeol 2004; 182 : 683 – 688.
18. D’Archambeau O, Maes M, De Schepper AM. The pelvic congestion syndrome: role of the "nutcracker phenomenon" and results of endovascular treatment. JBR ‑ BTR 2004; 87 : 1 – 8.
19. Venbrux AC, Sharma GK, Jackson ET et al. Pelvic varices embolization. In: Ignacio E, Venbrux AC (eds). Women’s health in interventional radiology. Springer Science + Business Media, LLC 2012 : 37 – 59.
20. Kaufman JA, Waltman AC, Rivitz SM et al. Anatomical observations on the renal veins and inferior vena cava at magnetic resonance angiography. Cardiovasc Intervent Radiol 1995; 18 : 153 – 157.
21. LePage PA, Villavicencio JL, Gomez ER et al. The valvular anatomy of the iliac venous system and its implications. J Vasc Surg 1991; 14 : 678 – 683.
22. Jung SC, Lee W, Chung JW et al. Unusual causes of varicose veins in the lower extremities: CT venographic and Doppler US findings. Radiographics 2009; 29 : 525 – 536. doi: 10.1148/ rg.292085154.
23. Raffetto JD, Qiao X, Beauregard KG et al. Estrogen receptor ‑ mediated enhancement of venous relaxation in female rat: Implications in sex‑related differences in varicose veins. J Vasc Surg 2010; 51 : 972 – 981. doi: 10.1016/ j.jvs.2009.11.074.
24. Raffetto JD, Khalil RA. Mechanism of varicose vein formation: valve dysfunction and wall dilation. Phlebology 2008; 23 : 85 – 98.
25. Asciutto G, Mumme A, Asciutto KC et al. Oestradiol levels in varicose vein blood of patients with and without pelvic vein incompetence (PVI): diagnostic implications. Eur J Vasc Endovasc Surg 2010; 40 : 117 – 121. doi: 10.1016/ j.ejvs.2010.01.023.
26. Oswald M, Heintz C, Wohllaib U. How to prove incompetence of the ovarian vein as a source of varicogenesis by testing the hormone content of the varicose veins of the leg. In: Phlebolymphology. Special issue for European Congress of IUP, Bremen 1999.
27. Reginald PW, Adams J, Franks S et al. Medroxyprogesterone acetate in the treatment of pelvic pain due to venous congestion. Br J Obstet Gynaecol 1989; 96 : 1148 – 1152.
28. Rabe E. UIP Consensus Documents 2011. Bonn: Rabe Medical Publishing 2011 : 99 – 111, 131 – 150.
29. Eliáš P, Žižka J. Dopplerovská ultrasonografie. 1. vyd. Hradec Králové: Nucleus HK 1998 : 151 – 184.
30. Scultetus AH, Villavicencio JL, Gillespie DL. The nutcracker syndrome: its role in the pelvic venous disorders. J Vasc Surg 2001; 34 : 812 – 819.
31. Reed NR, Kalra M, Bower TC et al. Left renal vein transposition for nutcracker syndrome. J Vasc Surg 2009; 49 : 386 – 394. doi: 10.1016/ j.jvs.2008.09.051.
32. He Y, Wu Z, Chen S et al. Nutcracker syndrome – how well do we know it? Urology 2014; 83 : 12 – 17. doi: 10.1016/ j.urology.2013.08.033.
33. Hemalatha K, Narayani R, Moorthy M et al. Retro‑aortic left renal vein and hypertension. Bombay Hospital Journal 2008; 50 : 6 – 9.
34. Van Cleef JF. Treatment of vulvar and perineal varicose veins. Phlebolymphology 2011; 18 : 38 – 43.
35. Eberlová L, Tolar J, Mikuláš J et al. Variabilita hlubokých žil stehna. Cas Lek Cesk 2011; 150 : 344 – 346.
36. Gloviczki P, Comerota AJ, Dalsing MC et al. The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the Society for Vascular Surgery and American Venous Forum. J Vasc Surg 2011; 53 : 2S – 48S. doi: 10.1016/ j.jvs.2011.01.079.
37. Hiromura T, Nishioka T, Nishioka S et al. Reflux in the left ovarian vein: analysis of MDCT findings in asymptomatic women. AJR Am J Roentgeol 2004; 183 : 1411 – 1415.
38. Rozenblit AM, Ricci ZJ, Tuvia J et al. Incompetent and dilated ovarian veins: a common CT finding in asymptomatic parous women. AJR 2001; 176 : 119 – 122.
39. Kim HS, Malhorta AD, Rowe PC et al. Embolotherapy for pelvic congestion syndrome: long‑term results. J Vasc Interv Radiol 2006; 17 : 289 – 297.
40. Asciutto G, Mumme A, Marpe B et al. MR venography in the detection of pelvic venous congestion. Eur Vasc Endovasc Surg 2008; 36 : 491 – 496. doi: 10.1016/ j.ejvs.2008.06.024.
41. Moore CJ. Pelvic congestion syndrome update. Endovascular Today 2011; October: 24 – 30.
42. Takebayashi S, Ueki T, Ikeda N et al. Diagnosis of the nutcracker syndrome with color doppler sonography: correlation with flow patterns on retrograde left renal venography. AJR Am J Roentgeol 1999; 172 : 39 – 43.
43. Kim SH, Cho SW, Kim HD et al. Nutcracker syndrome: diagnosis with Doppler US. Radiology 1996; 198 : 93 – 97.
44. Fitoz S, Ekim M, Ozcakar ZB et al. Nutcracker syndrome in children. J Ultrasound Med 2007; 26 : 573 – 580.
45. Green IC, Cohen SL, Finkenzeller D et al. Interventional therapies for controlling pelvic pain: what is the evidence? Curr Pain Headache Rep 2010; 14 : 22 – 32. doi: 10.1007/ s11916 ‑ 009 ‑ 0089 ‑ 7.
46. Burak F, Gunduz T, Simsek M et al. Chronic pelvic pain associated with pelvic congestion syndrome and the benefit of Daflon 500 mg: a review. Phlebolymphology 2009; 16 : 290 – 294. doi: 10.1016/ j.ejvs.2008.06.024.
47. Ghosh A, Shafie ‑ Pour H, Ayers K. Laparoscopic sclerotherapy in a case of pelvic congestion syndrome. BJOG 2006; 113 : 610 – 611.
48. Ahmed K, Sampath R, Khan MR. Current trends in the diagnosis and managament of renal nutcracker syndrome: a review. Eur J Vasc Endovasc Surg 2006; 31 : 410 – 416.
49. Marone EM, Psacharopulo D, Kahlberg A et al. Surgical treatment of posterior nutcracker syndrome. J Vasc Surg 2011; 54 : 844 – 847. doi: 10.1016/ j.jvs.2011.01.038.
50. Hartung O, Grisoli D, Boufi M et al. Endovascular stenting in the treatment of pelvic vein congestion caused by nutcracker syndrome: lessons learned from the first five cases. J Vasc Surg 2005; 42 : 275 – 280.
51. Baril DT, Polanco P, Makaroun MS et al. Endovascular management of recurrent stenosis following left renal vein transposition for the treatment of Nutcracker syndrome. J Vasc Surg 2011; 53 : 1100 – 1103. doi: 10.1016/ j.jvs.2010.10.112.
52. Chen S, Zhang H, Shi H et al. Endovascular stenting for treatment of Nutcracker syndrome: report of 61 cases with long‑term follow up. J Urol 2011; 186 : 570 – 575. doi: 10.1016/ j.juro.2011.03.135.
53. Wang X, Zhang Y, Li C et al. Results of endovascular treatment for patients with nutcracker syndrome. J Vasc Surg 2012; 56 : 142 – 148. doi: 10.1016/ j.jvs.2012.01.007.
54. Monedero LJ, Zubicoa ES, Perrin M. Pelvic congestion syndrome: an update. Phlebolymphology 2013; 20 : 145 – 149.
55. Edwards RD, Robertson IR, MacLean AB et al. Case report: pelvic pain syndrome – successful treatment of a case by ovarian vein embolization. Clin Radiol 1993; 47 : 429 – 431.
56. Nicolaides AN, Allegra C, Bergan J et al. Management of chronic venous disorders of the lower limbs: guidelines according to scientific evidence. International Angiology 2008; 27 : 1 – 59.
57. Monedero JL, Zubicoa ES. Left renal vein compression syndrome (LRV): current evaluation and endovascular treatment. Téchnicas endovasculares – SITE 2013; 16 : 56 – 58. [online] Available from: http:/ / endovascular.es/ revista_XVI_numero1.php.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 4-
All articles in this issue
- Endothelial dysfunction, erectile dysfunction and cardiovascular risk
- Guidelines for sexual activity of patients and their partners after cardiovascular event – AHA, ESC GUIDELINES 2013
- Clinical significance of the parameter CAVI (Cardio‑ Ankle Vascular Index) in prevention, diagnosis and therapy
- Pharmacotherapy of erectile dysfunction – where we are today and where we are going
- Erectile dysfunction therapy according to the European Association of Urology Guidelines
- Urological causes of erectile dysfunction
- Psychogenic erectile dysfunction
- Male sexual dysfunctions as a couple’s problem
- Superficial vein thrombosis – epidemiology, diagnostics, treatment
- Chronic venous disease of the lower limbs – diagnosis and conservative treatment
- Chronic venous insufficiency – invasive therapy
- Pelvic congestion syndrome
- Deep vein thrombosis therapy options available in 2014
- Sulodexide in angiological patients
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pelvic congestion syndrome
- Superficial vein thrombosis – epidemiology, diagnostics, treatment
- Chronic venous disease of the lower limbs – diagnosis and conservative treatment
- Psychogenic erectile dysfunction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

