-
Medical journals
- Career
Výsledky léčby pomocí extrakorporální membránové oxygenace (ECMO) v souboru novorozenců a dětí
Authors: V. Vobruba 1; prof. MUDr. Jan Bělohlávek, Ph.D. 2; V. Rohn 4; T. Grus 3; M. Bašková 1; O. Černá 1; J. Fichtl 3; L. Hřídelová 1; J. Hřídel 1; G. Hodková 3; P. Klement 1; D. Lorenčík 1; F. Mlejnský 3; R. Nečasová 1; D. Nikitinský 3; P. Pokorná 1; P. Srnský 1; Z. Švorcová 3; I. Vykydal 3
Authors‘ workplace: Klinika dětského a dorostového lékařství VFN a 1. LF UK 1; II. interní klinika – klinika kardiologie a angiologie VFN a 1. LF UK 2; II. chirurgická klinika kardiovaskulární chirurgie VFN a 1. LF UK 3; Klinika kardiovaskulární chirurgie 2. LF UK a FN Motol 4
Published in: Anest. intenziv. Med., 26, 2015, č. 4, s. 213-219
Category: Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Zhodnocení souboru 21 novorozenců a dětí léčených pomocí extrakorporální membránové oxygenace (ECMO).Typ studie:
Observační, retrospektivní s prospektivním sběrem dat.Typ pracoviště:
Pediatrická a neonatologická jednotka intenzivní a resuscitační péče fakultní nemocnice.Materiál a metoda:
Od října 2010 do současnosti byla na základě splnění indikačních kritérií zahájena mimotělní membránová oxygenace u 21 pacientů (12 novorozenců a 9 dětí). Podle charakteru a závažnosti selhání bylo v 57 % indikováno veno-arteriální ECMO (V-A ECMO) (novorozenci 83 %, děti 22 %), u zbývajících veno-venózní ECMO (V-V ECMO).Výsledky:
Přežití ve skupině novorozenců bylo 58%, ve skupině dětí 77%. Práce porovnává výsledky s některými zahraničními studiemi. Vzhledem k četnosti souboru nebylo možné statistické zhodnocení.Závěr:
Na publikovaném souboru autoři dokazují, že uvedená péče je v dětské populaci naší republiky potřebná. Prezentované výsledky jsou v řadě parametrů i přes malý soubor srovnatelné s výsledky mezinárodního registru.Klíčová slova:
ECMO – respirační selhání – oběhové selhání – novorozenec – pediatrieÚVOD
Extrakorporální membránová oxygenace byla prvně použita v léčbě respiračního selhání v roce 1971 [1]. Bartlett et al. publikovali v roce 1976 zkušenosti s léčbou pomocí ECMO u dětí a novorozenců [2]. Technologické a terapeutické inovace v oblasti mimotělní oxygenace vedly v posledních letech k nárůstu počtu kriticky nemocných léčených uvedenou metodou. Extracorporeal Life Support Organization (ELSO) založená v roce 1989 kromě jiného organizuje velmi rozsáhlou mezinárodní databázi pacientů léčených pomocí mimotělní oxygenace. Podle ní je z důvodů respiračního selhání indikováno k ECMO ročně více než 600 novorozenců a přes 300 dětí. Vzestup počtu dospělých pacientů je exponenciální [3].
ECMO je způsob mimotělní podpory, při které je krev nemocného pomocí pumpy odváděna extrakorporálně. Při průtoku oxygenátorem se okysličuje a zároveň je částečně eliminován oxid uhličitý. Vysoce oxygenovaná krev se vrací zpět do organismu. Při respiračním selhání nezvládnutelném konvenční nebo nekonvenční ventilační technikou se zachovanou a farmakologicky ovlivnitelnou funkcí srdečních komor je indikováno veno-venózní ECMO (V-V ECMO). Při kombinovaném srdečním a respiračním selhání se používá veno-arteriální ECMO (V-A ECMO), kdy je funkce obou orgánů z velké části nahrazena.
Při V-V ECMO je u dětí s hmotností do 20 kg indikován přístup cestou v. jugularis interna l.dx. za použití double lumen katétru velikosti 12–18 F. U novorozenců a kojenců je dávána přednost chirurgickému zavedení. U dětí s hmotností větší než 20 kg je volen podobně jako u dospělých jugulo-femorální přístup se zavedením katétru seldingerovskou technikou. Oxygenace je ovlivněna poměrem extrakorporálního průtoku krve k srdečnímu výdeji pacienta a frakcí kyslíku ve směsi plynů protékající oxygenátorem. Průtok plynů ovlivňuje eliminaci CO2. Vysoké extrakorporální průtoky krve double lumen katétrem mohou způsobit recirkulaci okysličené krve v pravé síni a paradoxně snížit dodávku kyslíku. Částečně lze tomu zamezit správnou polohou výpustních otvorů kanyly směrovaných přímo proti trikuspidálnímu ústí.
Při V-A ECMO je u dětí do hmotnosti 20 kg zaváděna nasávací (inflow) kanyla přes v. jugularis interna do pravé síně a návratová (outflow) kanyla cestou a. carotis communis do aortálního oblouku. Účinnost oběhové podpory je určována průtokem krve a oxygenace frakcí kyslíku ve směsi plynů protékajících oxygenátorem.
Ve Všeobecné fakultní nemocnici v Praze (VFN) byl ECMO program zahájen v r. 2007 u dospělých pacientů a o tři roky později u dětí a novorozenců. VFN je tak jediným pracovištěm v České republice, které poskytuje mimotělní membránovou oxygenaci v celém věkovém rozmezí. V předložené práci jsou uvedeny výsledky léčby pomocí ECMO u novorozenců a dětí za uvedené období.
SOUBOR PACIENTŮ, METODIKA A VÝSLEDKY
Soubor pacientů a výsledky
Od října 2010 do současné doby bylo léčeno na našem pracovišti pomocí mimotělní membránové oxygenace 21 pacientů (12 novorozencůa 9 dětí). Demografické údaje souboru jsou uvedeny v tabulkách 1 a 2. ECMO bylo zahájeno po splnění respiračních indikačních kritérií (tab. 3) nebo při nezvladatelném oběhovém selhání. V tabulkách 1 a 2 jsou uvedeny hodnoty oxygenačního indexu vyjadřující závažnost respiračního selhání. Pro posouzení tíže oběhového selhání bylo použito Wernovského inotropní skóre a jeho modifikace vazoaktivníinotropní skóre (IS/VIS) – tabulka 4. Tyto parametry jsou v některých pracích zmiňovány jako prediktory morbidity a mortality. Hodnoty větší než 20 dosahují senzitivity 0,71 a specificity 0,8 [4, 5]. Zároveň je uvedena dynamika hodnot IS/VIS po 24 hodinách (viz tab. 1 a 2). V tabulkách jsou rovněž uvedeny hlavní diagnózy, doba trvání ECMO podpory a přežití.
Table 1. Demografické údaje skupiny novorozenců 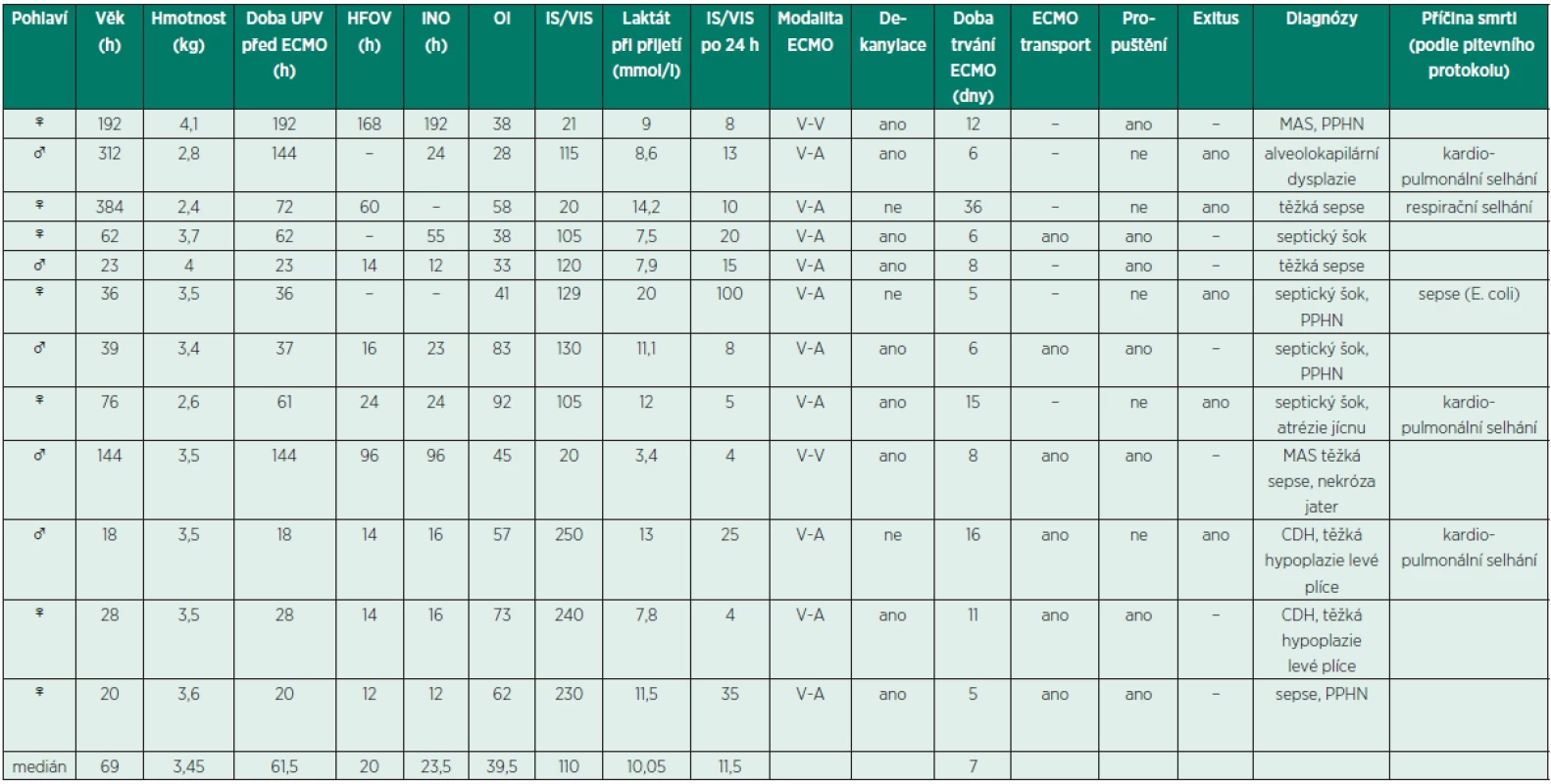
MAS - masivní aspirace mekonia; PPHN – perzistující plicní hypertenze; CDH – vrozená brániční kýla; HFOV - vysokofrekvenční oscilační ventilace; iNO – inhalovaný oxid dusnatý; OI – oxygenační index; WIS – Wernovského inotropní skóre, VIS – vazoaktivní inotropní skóre Table 2. Demografické údaje skupiny dětí 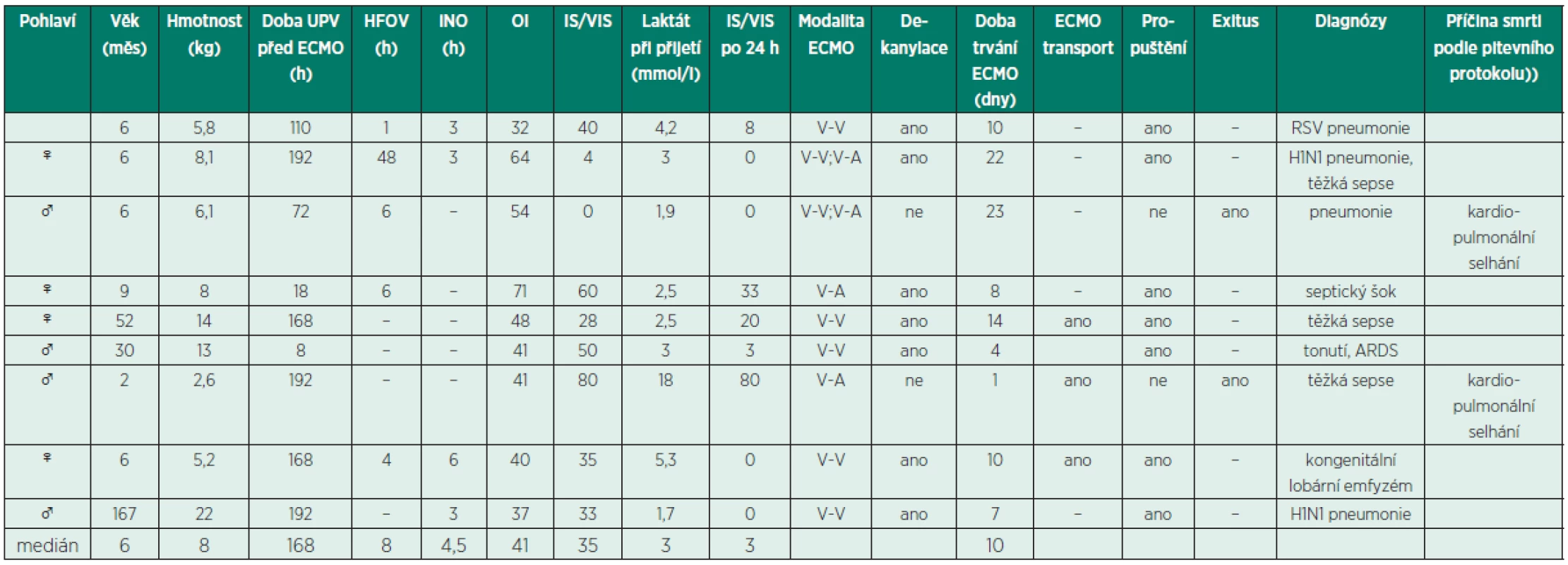
Table 3. Indikační kritéria k zahájení ECMO 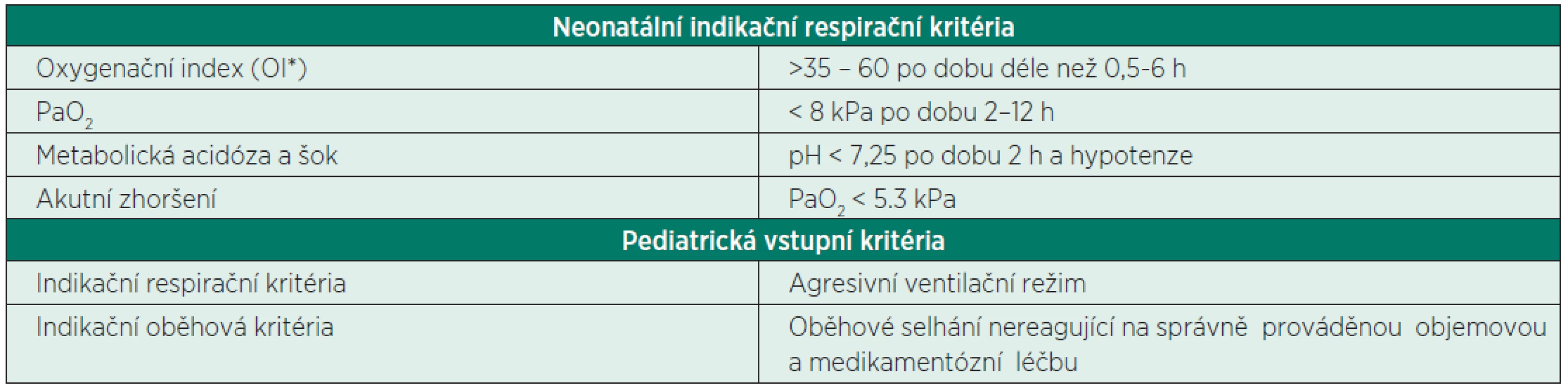
*OI = MAP x FiO2 x 100/paO2 MAP – střední tlak v dýchacích cestách Table 4. Wernovského inotropní skóre a jeho modifikace vazoaktivní-inotropní skóre (IS/VIS) 
Metodika
ECMO okruh je tvořen heparinizovaným hadicovým okruhem (MAQUET PLS tubing set), řídicí jednotkou (MAQUET PLS Permanent Life Support, MAQUET, Cardiopulmonary AG, Hirllingen, Germany), centrifugální pumpou Rotaflow RF 32,oxygenátorem Quadrox-iD Pediatric (MAQUET, Cardiopulmonary AG, Hirllingen, Germany) a směšovačem plynů Sechrist (Anaheim, CA, USA). ECMO kanyly velikosti 8–16 F (OriGen Biomedical, Austin, TX, USA, Edwards Life-sciences Researche Medical Inc., Midvale, UT, USA) byly kromě jednoho případu zavedeny chirurgickou cestou po předchozím sonografickém změření průsvitu příslušné cévy. Při dekanylacích byla vždy provedena rekonstrukce a. carotis communis.
Všichni pacienti byli heparinizováni. Krátce před zavedením kanyl byl podán heparin v dávce 50–100 j/kg. Kontinuální infuzí heparinu bylo udržováno APTT v rozsahu 65–90 s.
Nastavení parametrů ECMO
Při V-A ECMO byl nastaven průtok krve u novorozenců na 100 ml/kg/min, v pediatrické indikaci na 80 ml/kg/min, s cílem dosáhnout saturace ve smíšené žilní krvi (SvO2) více než 70%. Rychlost průtoku byla upravována tak, aby pulzový tlak byl větší než 10 torrů. Průtok plynů oxygenátorem se pohyboval v rozmezí 220–650 ml/min. Počáteční FiO2 bylo 1,0. Při V-V ECMO byl průtok krve u novoro-zenců 120 ml/kg/min a u dětí 100 ml/kg. Cílová hodnota SvO2 byla pro tuto modalitu vyšší než 60 %. FiO2 bylo zpočátku vždy 1,0. Výchozí průtok plynů oxygenátorem 800–1000 ml/min byl průběžně korigován podle aktuálních hodnot kapnie.
Při odvykání u V-A způsobu byl snižován průtok krve při důsledném monitorování oxygenace a echokardiografické kontrole srdce. Při průtocích 35–40 ml/kg/min bylo ECMO ukončeno. Při V-V ECMO bylo snižováno FiO2, průtok plynů oxygenátorem a posléze i rychlost průtoku krve. Fyziologické hodnoty krevních plynů a nízké nároky na ventilační režim byly indikací k ukončení V-V ECMO. Bezprostředně po ukončení cirkulační podpory byla provedena dekanylace. Arteria carotis communis byla na rozdíl od řady jiných pracovišť rekonstruována a sonograficky byl ve všech případech prokázán zachovaný průtok krve.
Po zahájení ECMO dále pokračovala umělá plicní ventilace protektivním způsobem (Evita XL, Dräger, SRN), ve 3 případech bylo nutné krátkodobě pokračovat v již zavedené vysokofrekvenční oscilační ventilaci (HFOV – SensorMedics 3100A).
Všem pacientům, kteří vyžadovali ECMO podporu, byla podávána analgosedace v kombinaci. Nejčastěji byly použity ultrakrátce působící hypnotika, barbituráty, opioidní analgetika a propofol. Při zvyšující se toleranci k analgetikům a při známkách syndromu z odnětí byl podáván klonidin. U dvou nemocných vyžadujících chirurgickou intervenci byla krátkodobě indikována myorelaxancia.
Kromě běžného invazivního monitorování byla u nemocných s V-V modalitou sledována hemodynamika systémem LIDCO (LIDCO, Ltd., UK), u dětí s V-A modalitou echokardiograficky (Philips CX 50). Cerebrální oxygenace byla monitorována pomocí INVOS (Covidien, Ireland). EEG bylo zaznamenáváno pomocí integrované amplitudy (aEEG) (Olympic CFM, Olympic Medical, Seattle, USA).
V případech akutního selhání ledvin byla indikována kontinuální eliminační metoda (CVVHD – kontinuální veno-venózní hemodialýza). Hemofiltr byl zapojen do venózní části ECMO okruhu, nebo byl zaveden další cévní vstup. K CVVHD byl použit přístroj Aquarius (Edwards Lifesciences Researche Medical).
Propuštění pacienti jsou sledováni ambulantně na našem pracovišti dětským neurologem a pediatrem.
Pro uvedenou práci nebyl vyžadován souhlas Etické komise.
DISKUSE
Extrakorporální membránová oxygenace představuje vysoce specializovanou léčbu respiračního a oběhového selhání v případech neúspěchu konvenčních léčebných postupů. Mugford et al. při srovnání přežití novorozenců léčených pomocí ECMO a konvenční mechanické ventilace (CMV) prokázali analýzou čtyř randomizovaných studií zařazených do třídy I v Cochranovské databázi významně vyšší přežití ve skupině léčené ECMO (77% vs. 44%; p < 0,00001). Na tři přeživší novorozence léčené ECMO připadl jeden zachráněný oproti skupině z konvenční léčby [6].
Výsledky v našem souboru byly porovnány s některými publikovanými studiemi a výsledky uvedenými v ELSO registru [7–9]. Izolovaně byly porovnávány výsledky ve skupině novorozenců a ve skupině dětí. V České republice je indikováno k ECMO podpoře podstatně méně pacientů ve srovnání s některými státy západní Evropy. Například v Nizozemsku, které má 16 miliónů obyvatel, je ročně léčeno pomocí mimotělní membránové oxygenace 40–50 dětí. V České republice je k ECMO podpoře indikováno 4–5 novorozenců a dětí ročně.
Výsledky mortality
Ve srovnání s údaji z ELSO registru je přežití v našem souboru novorozenců 58% (ELSO 85%) a ve skupině dětí 77% (ELSO 65%). Horší výsledky ve skupině novorozenců jsou pravděpodobně důsledkem několika faktorů. Prvním je závažnost především oběhového selhání v době připojení k ECMO charakterizovaná hodnotou IS/VIS a hodnotou laktátu (medián IS/VIS = 110 a medián hodnot laktátu při přijetí = 10,5 mmol/l). Dalším faktorem je složení souboru novorozenců, respektive jejich hlavní diagnózy. V 7 případech byla hlavní indikací k zahájení cirkulační podpory těžká sepse, respektive septický šok. Novorozenecká sepse vyžadující ECMO podporu je zatížena vyšší mortalitou. Skinner et al. uvádí u novorozenců se sepsí s nutností V-A podpory 70% přežití, zatímco Zabrocki v pediatrické populaci 40% [7, 8]. V našem souboru novorozenců byla jako hlavní diagnóza těžká sepse, respektive septický šok u sedmi pacientů, z nichž 3 zemřeli. V souboru jsou dále 2 pacienti s vrozenou brániční kýlou. V tomto případě je udávána 50% úmrtnost [7]. Z našich pacientů přežil jeden. Konečně v jednom případě byla post mortem stanovena diagnóza alveolokapilární dysplazie. Diskutabilní je včasnost indikace cirkulační podpory, kterou již zmiňoval Bartlett et al. [2].
Vliv způsobů V-A vs. V-V ECMO
Indikace V-V nebo V-A modality ECMO je velmi obtížná. O způsobu provedení rozhoduje stupeň hemodynamické nestability, věk a velikost pa-cienta a zvyklosti pracoviště. V-V ECMO je upřednostňováno především ve stavech respiračního selhání, zatímco V-A ECMO je indikováno při závažném oběhovém nebo kombinovaném selhání. V-A ECMO je zatíženo větším počtem komplikací, především ze strany CNS [10–12]. V posledních letech trvale stoupá počet pacientů léčených V-V způsobem. U novorozenců je to asi 1/3 a u pediatrických pacientů až 1/2 všech respiračních příčin. Zabrocki et al. v multicentrické retrospektivní studii udávají v období 1993–2007 vzestup V-V ECMO z 35 % na 46 % a užití double lumen V-V katétru z 1 % na 19 %. Celkově však podíl V-A převažuje (58 %). Citovaná studie udává přežití u pacientů léčených V-V ECMO (double lumen katétr) v 70 %, V-V ECMO (2 katétry – jugulo-femorální přístup) v 66 %. Pacienti vyžadující V-A ECMO měli signifikantně nižší přežití (51%; p = 0,488). Z nemocných, u kterých byla nutná konverze z V-V na V-A ECMO, přežilo 49 % [7]. Skinner et al. srovnávali přežití s ohledem na použitou modifikaci a věk u novorozenců a dětí s těžkou sepsí. Zdrojem pacientských údajů byl, stejně jako v předchozí práci, ELSO registr. Při srovnání V-V a V-A metody bylo ve všech věkových kategoriích přežití u pacientů léčených V-V metodou významně vyšší (novorozenci 83% vs. 70%, děti 54% vs. 37% a adolescenti 43% vs. 29 %p = 0,001) [8].
V našem souboru 21 nemocných bylo V-A ECMO indikováno v 57 % (novorozenci 83 %, děti 22 %). U dvou dětí byla nutná konverze z V-V na V-A ECMO (9,5 %). Přežilo 50 % novorozenců léčených V-A modalitou a 100 % léčených V-V způsobem. Ve skupině dětí s V-A podporou přežilo 50 % a 100 % s V-V podporou. Mortalita u dětí s nutností konverze byla 50%. Přežití pacientů léčených V-V způsobem je v kontextu s literárními údaji významně vyšší. Většina citovaných prací však neporovnává vstupní závažnost stavu k výsledku mortality. K V-A ECMO jsou indikováni převážně nemocní s těžším oběhovým a oxygenačním selháním, proto lze předpokládat i vyšší úmrtnost. Závažnost oxygenačního selhání v našem souboru ukazují vstupní hodnoty OI, stupeň oběhového selhání hodnoty laktátu a intenzita oběhové podporyIS/VIS skóre. Medián OI u novorozenců léčených V-V způsobem byl 41,5 a u novorozenců s V-A modifikací 57,5. Vstupní medián IS/VIS a laktátu byl ve skupině V-V 20,5, respektive 6,2 mmol/l ve srovnání s V-A, kde byl 124,5, respektive 11,3 mmol/l. Medián vstupních hodnot OI u dětí léčených V-V způsobem byl 41 a u dětí léčených V-A 56. Medián IS/VIS a medián hladiny laktátu byly ve skupině dětí s V-V modalitou 33, respektive 3 mmol/l a ve skupině V-A 70, respektive 10,2 mmol/l. Z důvodů velikosti souboru nebylo možné podrobnější statistické zhodnocení, přesto je z výsledků patrné, že k V-A ECMO jsou indikováni nemocní s výrazně závažnějším oxygenačním a oběhovým selháním.
Vztah doby trvání ECMO k přežití
S probíhající dobou ECMO klesá procento přežívajících pacientů. Brogan et al. prokázali stoupající mortalitu po 14 dnech trvání ECMO. U nemocných, u kterých byla ECMO podpora ukončena do 14 dnů, bylo přežití 61%, naopak u pacientů léčených déle jak 21 dní to bylo 38 % (p < 0,001) [13]. Medián doby trvání ECMO byl v našem souboru zemřelých novorozenců 15 dní ve srovnání s přeživšími, kde stejný parametr byl 8 dní. Ve skupině dětí byl medián doby trvání ECMO u zemřelých 12 a u přežívajících 10 dní.
Komplikace
Obávanou komplikací ECMO, zejména při V-A způsobu, je cerebrální ischémie a krvácení. Incidence ischémie je v ELSO registru uváděna u novorozenců a dětí 7%, respektive 4% a incidence krvácení 7%, respektive 6%. Reed et al. popsali v souboru dětských pacientů léčených ECMO v autoptickém materiálu incidenci trombózy v 69 % a trombózy a krvácení v 31 % [14]. V našem souboru novorozenců došlo k rozvoji intrakraniálního krvácení u dvou novorozenců (16 %). Ani v jednom případě nebylo příčinou úmrtí. Ve skupině dětí jsme krvácení nezaznamenali. Infekční komplikace jsou v ELSO registru uváděny u novorozenců v 6 % a u dětí v 18 %. V obou našich skupinách byla infekční komplikace zaznamenaná po jednom případě (8 %, respektive 11 %).
Transport pacientů při ECMO
Závažný stav pacientů indikovaných k ECMO často neumožňuje převoz zajištěný pouze umělou plicní ventilací a medikamentózní oběhovou podporou. V těchto případech je nezbytný výjezd ECMO týmu na odesílající pracoviště, kde je nemocný kanylován, připojen k mimotělnímu oběhu a transportován na naše pracoviště. Zkušenosti s mezinemocničním transportem jsou publikovány některými centry. Velikost souborů se pohybuje mezi 23–100 pacienty [15 až 17]. V našem souboru byl transport zajišťovánv 9 případech, a to u 6 novorozenců a 3 dětí. Všichni pacienti transport přežili, nebyla zaznamenána žádná komplikace.
ZÁVĚR
ECMO patří k vysoce specializované péči o nemocné s respiračním a oběhovým selháním, kde multioborová spolupráce je základem a nezbytností (intenzivista, kardiovaskulární chirurg, perfuzionista). Na publikovaném souboru autoři dokazují, že uvedená péče je v dětské populaci naší republiky potřebná. Prezentované výsledky jsou v řadě parametrů i přes malý soubor srovnatelné s výsledky mezinárodního registru.
Práce vznikla za podpory RVO-VFN64165.
Práce nebyla publikována v žádném jiném časopise.
Autoři nejsou v jakémkoliv střetu zájmů, které by ovlivnily publikované výsledky.
Do redakce došlo dne 18. 2. 2015.
Do tisku přijato dne 3. 4. 2015.
Adresa pro korespondenci:
MUDr. Václav Vobruba, Ph.D.
Klinika dětského a dorostového lékařství VFNa 1. LF UK
Ke Karlovu 2
121 09 Praha 2
e-mail: vaclav.vobruba@vfn.cz
Sources
1. Hill, J. D., Bramson, M. L.,Gerbode, F.,Osborn, J. J., et al. Prolonged Extracorporeal Oxygenation for Acute Posttraumatic Respiratory Failure (Shock-Lung Syndrome) – Use of Bramson Membrane Lung. New England Journal of Medicine,1972, 286, p. 629.
2. Bartlett, R. H., Gazzaniga, A. B., Jefferies, M. R., Huxtab-le, R. F., et al. Extracorporeal Membrane Oxygenation (Ecmo) Cardiopulmonary Support in Infancy. Transactions American Society for Artificial Internal Organs, 1976, 22, p. 80–93.
3. Extracorporeal Life Support Organization: ECLS Registry Report.Ann Arbor, MI, Extracorporeal Life Support organiza-tion 2012.
4. Wernovsky, G., Wypij, D., Jonas, R. A., Mayer, J. E., et al. Postoperative Course and Hemodynamic Profile after the Arterial Switch Operation in Neonates and Infants - a Comparison of Low-Flow Cardiopulmonary Bypass and Circulatory Arrest. Circulation, 1995, 92, p. 2226–2235.
5. Gaies, M. G., Gurney, J. G., Yen, A. H., Napoli, M. L., et al. Vasoactive-inotropic score as a predictor of morbidity and mortality in infants after cardiopulmonary bypass. Pediatric Critical Care Medicine, 2010, 11, p. 234–238.
6. Mugford, M., Elbourne, D., Field, D. Extracorporeal membrane oxygenation for severe respiratory failure in newborn infants. Cochrane Database of Systematic Reviews, 2008.
7. Zabrocki, L. A., Brogan, T. V., Statler, K. D., Poss, W. B., et al. Extracorporeal membrane oxygenation for pediatric respiratory failure: Survival and predictors of mortality. Critical Care Medicine, 2011, 39, p. 364–370.
8. Skinner, S. C., Iocono, J. A., Ballard, H. O., Turner, M. D., et al. Improved survival in venovenous vs venoarterial extracorporeal membrane oxygenation for pediatric noncardiac sepsis patients: a study of the Extracorporeal Life Support Organization registry. Journal of Pediatric Surgery, 2012, 47, p. 63–67.
9. Rehder, K. J., Turner, D. A., Cheifetz, I. M. Extracorporeal Membrane Oxygenation for Neonatal and Pediatric Respiratory Failure: An Evidence-Based Review of the Past Decade (2002–2012). Pediatric Critical Care Medicine, 2013, 14, p. 851–861.
10. Cengiz, P., Seidel, K., Rycus, P. T., Brogan, T. V., et al. Central nervous system complications during pediatric extracorporeal life support: Incidence and risk factors.Critical Care Medicine, 2005, 33, p. 2817–2824.
11. Guner, Y. S., Khemani, R. G., Qureshi, F. G., Wee, C. P., et al.Outcome analysis of neonates with congenital diaphragmatic hernia treated with venovenous vs venoarterial extracorporeal membrane oxygenation. Journal of Pediatric Surgery. 2009, 44, p. 1691–1701.
12. Rollins, M. D., Yoder, B. A., Moore, K. R., Barnhart, D. C., et al.Utility of neuroradiographic imaging in predicting outcomes after neonatal extracorporeal membrane oxygenation. Journal of Pediatric Surgery, 2012, 47, p. 76–80.
13. Brogan, T. V., Zabrocki, L., Thiagarajan, R. R., Rycus, P. T.,et al. Prolonged extracorporeal membrane oxygenation for children with respiratory failure. Pediatric Critical Care Medicine, 2012, 13, E249–E254.
14. Reed, R. C., Rutledge, J. C. Laboratory and Clinical Predictors of Thrombosis and Hemorrhage in 29 Pediatric Extracorporeal Membrane Oxygenation Nonsurvivors. Pediatric and Developmental Pathology, 2010, 13, p. 385–392.
15. Machin, D., Scott, R., Hurst, A. Ground transportation of a pediatric patient on ECMO support. J. Extra Corpor. Technol., 2007, 39, p. 99–102.
16. Coppola, C. P., Tyree, M., Larry, K., Digeronimo, R. A 22-year experience in global transport extracorporeal membrane oxygenation. J. Pediatr. Surg., 2008, 43, p. 46–52, discussion p. 52.
17. Foley, D. S., Pranikoff, T., Younger, J. G., Swaniker, F., et al.A review of 100 patients transported on extracorporeal lifesupport. ASAIO J., 2002, 48, p. 612–619.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2015 Issue 4-
All articles in this issue
- Vazopresin a jeho role v anesteziologii a intenzivní medicíně
- Echokardiografie – měření srdečního výdeje u kriticky nemocných
- Doporučení pro perioperační péči o obézní chirurgické pacienty 2015
- Zapojení interaktivní výuky do pregraduálního studia akutní medicíny: virtuální pacient, pokročilé simulace a přenosy z operačních sálů
- Výsledky léčby pomocí extrakorporální membránové oxygenace (ECMO) v souboru novorozenců a dětí
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vazopresin a jeho role v anesteziologii a intenzivní medicíně
- Echokardiografie – měření srdečního výdeje u kriticky nemocných
- Doporučení pro perioperační péči o obézní chirurgické pacienty 2015
- Výsledky léčby pomocí extrakorporální membránové oxygenace (ECMO) v souboru novorozenců a dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

