-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neceliakální glutenová senzitivita
Non-celiac gluten sensitivity
Non-celiac gluten sensitivity has recently been recognized by the scientific community as a part of gluten-related disorders, and is defined as a condition with gastrointestinal and/or extra-intestinal symptoms triggered by gluten ingestion in the absence of celiac disease and wheat allergy. Currently, there is no specific serological marker and non-celiac gluten sensitivity remains a diagnosis of exclusion: testing for celiac disease and wheat allergy must be negative, symptoms must improve with a gluten-free diet, and diagnosis must be confirmed by the gluten challenge. In this article, we discuss current knowledge of pathophysiology, clinical and epidemilogical spectrum, diagnosis, and treatment of NCGS.
Keywords:
celiac disease – FODMAPs – gluten-free diet – gluten-related disorders – irritable bowel syndrome – non-celiac gluten sensitivity – wheat allergy
Autoři: Iva Hoffmanová 1; Daniel Sánchez 2
Působiště autorů: II. interní klinika 3. LF UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Michal Anděl, CSc. 1; Laboratoř buněčné a molekulární imunologie Mikrobiologického ústavu AV ČR, v. v. i., Praha, ředitel RNDr. Martin Bilej, CSc. 2
Vyšlo v časopise: Vnitř Lék 2015; 61(3): 219-227
Kategorie: Přehledný referát
Souhrn
Neceliakální glutenová senzitivita byla recentně uznána odbornou veřejností jako součást spektra chorob vyvolaných lepkem. Je definována jako onemocnění projevující se gastrointestinálními nebo extraintestinálními symptomy, jež vyvolává konzumace stravy obsahující lepek u jedinců, kteří netrpí celiakií ani alergií na pšenici. V současnosti pro tuto jednotku není dostupný žádný specifický sérologický marker, a tak bývá diagnóza neceliakální glutenové senzitivity stanovena per exclusionem: vyžaduje vyloučení celiakie sérologickým a histologickým vyšetřením, vyloučení alergie na pšenici, zlepšení či vymizení symptomů po bezlepkové dietě a definitivní potvrzení expozičním testem. Článek popisuje současné znalosti o patofyziologii neceliakální glutenové senzitivity, rozebírá klinický a epidemiologický obraz, diagnózu a léčbu této nové klinické jednotky.
Klíčová slova:
alergie na pšenici – bezlepková dieta – celiakie – FODMAPs – choroby vyvolané lepkem – neceliakální glutenová senzitivita – syndrom dráždivého tračníkuObiloviny a gluten
Obiloviny byly zavedeny do výživy člověka teprve před zhruba 10 000 lety, v období neolitické revoluce. Za tuto dobu, jež představuje pouhých 300 generací, se trávicí trakt a imunitní systém určitých disponovaných jedinců nestačil optimálně adaptovat na příjem specifického obsahu pšenice, ječmene, žita a ovsa [1–3]. Původní odrůdy pšenice obsahovaly malá množství imunogenního lepku [4]. Šlechtěním uvedených obilovin, vedoucím k vývoji tetraploidních a hexaploidních odrůd, došlo ke značnému zvýšení obsahu proteinů a sacharidů v obilném zrnu. Hlavním proteinem pšenice je gluten (lepek) a jeho obsah se v moderních odrůdách pšenice pohybuje mezi 7–22 %. Dalším činitelem, který přispívá ke zvýšení obsahu glutenu v chlebu a v pekařských výrobcích, je dnes běžně používaný technologický postup spojený se zkrácenou dobou kvašení těsta. V západní civilizaci je tedy denní spotřeba glutenu velmi vysoká, průměrně 20–50 g [5]. Zvýšené množství glutenu v obilném zrnu je spojeno se zvýšením jeho imunogenicity a je zodpovědné za vznik řady onemocnění vyvolaných glutenem [1,6]. Vysoký obsah sacharidů v obilovinách je uváděn jako jeden z faktorů přispívajících k současné epidemii obezity [3].
Populární teorie o nezdravosti obilovin (především pšenice) je zejména vlivem medií vnímána širokou veřejností a vede ke zvýšené konzumaci bezlepkové stravy a zvýšení trhu s bezlepkovými potravinami. Např. průzkum trhu v USA ukázal, že 30 % obyvatel konzumuje bezlepkovou stravu či stravu s omezeným obsahem lepku [7]. Bezlepková dieta je chápána jako všeobecně zdravější a stává se módní i díky její propagaci řadou celebrit.
Gluten (lepek) je hlavním strukturálním proteinem zrna pšenice, žita, ječmene a ovsa. Mezi další proteiny obsažené v obilném zrnu patří např. albuminy a globuliny. Gluten je schopen vázat velké množství vody, umožňuje kynutí těsta, poskytuje mu elasticitu a viskozitu [5]. Gluten se skládá z polymerních gluteninů a monomerních prolaminů. Prolamin pšenice se nazývá gliadin, prolamin žita hordein, prolamin ječmene sekalin a prolamin ovsa avenin. Jde o velmi různorodou směs proteinů, např. pšeničných gliadinů je několik typů: α-gliadiny, β-gliadiny, γ-gliadiny a ω-gliadiny [8].
Gliadin a příbuzné prolaminy jsou polypeptidy, jež jsou rezistentní k enzymatické degradaci žaludečními a pankreatickými peptidázami a peptidázami kartáčového lemu enterocytů. Jejich aminokyselinové fragmenty prostupují v intaktní podobě do lamina propria mucosae a submukózy tenkého střeva, kde u různě disponovaných jedinců vedou k aktivaci různých složek imunitního systému [9].
Některé aminokyselinové sekvence gliadinu fungují jako antigenní struktury (epitopy). V současnosti je známo nejméně 50 gliadinových epitopů s různými imunomodulačními funkcemi [1]. Nejvíce imunogenním epitopem je gliadinový fragment obsahující přesně definovanou sekvenci 33 aminokyselin (tzv. 33-mer gliadin fragment), který je u celiakie zodpovědný za aktivaci systému adaptivní imunity [10]. Různé další epitopy mají rozličné funkce: indukují vrozenou imunitní odpověď; ovlivňují permeabilitu tenkého střeva (modifikací struktury cytoskeletu enterocytů a jejich těsných spojení – tight junction či zvýšením exprese zonulinu); mají cytotoxický efekt; inhibují růst epiteliálních buněk tenkého střeva; indukují apoptózu či jsou zodpovědné za uvolnění cytokinů ve sliznici tenkého střeva [11]. Kromě gliadinu disponují imunogenními vlastnostmi i hordein, sekalin a některé druhy aveninů. Bezlepková dieta tedy znamená vyloučení veškerých potravin z pšenice, ječmene, žita a řady odrůd ovsa.
Obilné zrno obsahuje vedle glutenu i další proteiny, u kterých byl dokumentován imunomodulační efekt: lektiny a inhibitory amylázy a trypsinu. Lektiny jsou součástí semen řady rostlin, u nichž fungují jako obranný mechanizmus proti plísním. Jde o velmi stabilní proteiny, které jsou rezistentní ke štěpení digestivními enzymy. Zvláště lektin zvaný wheat germ agglutinin (WGA) přímo stimuluje uvolnění několika prozánětlivých cytokinů z monocytů a makrofágů ve střevní sliznici a dosud neznámým mechanizmem může zvyšovat intestinální permeabilitu [12]. Inhibitory amylázy a trypsinu (ATIs – amylase/trypsin inhibitors) podobně jako lektiny fungují v zrnu jako obranný mechanizmus proti řadě infekcí a jsou rovněž rezistentní vůči proteolytickým enzymům trávicího traktu. Stimulují uvolnění prozánětlivých cytokinů z monocytů, makrofágů a dendritických buněk ve sliznici tenkého střeva u jedinců s celiakií i bez celiakie, a to prostřednictvím aktivace komplexu toll-like receptoru 4, TLR4-MD2-CD14 [13]. Jsou tedy považovány za aktivátory vrozeného imunitního systému. Proteiny z kategorie ATIs byly identifikovány jako alergeny u profesionálního astmatu pekařů a u gastrointestinální hypersenzitivity na pšenici. ATIs se uplatňují rovněž v patofyziologii celiakie, při níž aktivují složky vrozené imunity [5].
Choroby vyvolané lepkem
Choroby vyvolané lepkem (schéma), tedy stravou obsahující pšenici, ječmen, žito a některé odrůdy ovsa, jsou v současnosti rozdělovány podle patogeneze do 3 skupin [1]:
- onemocnění s autoimunitní patogenezí: celiakie, Duhringova herpetiformní dermatitida a glutenová ataxie
- onemocnění s alergickou patogenezí: alergie na pšenici,
- onemocnění s neautoimunitní a nealergickou patogenezí: neceliakální glutenová senzitivita
Schéma. Choroby vyvolané lepkem. Upraveno podle [1] ![Schéma. Choroby vyvolané lepkem. Upraveno podle [1]](https://pl-master.mdcdn.cz/media/image/6ea4014fb586592e3c75f4716dc45705.png?version=1537794522)
Celiakie je imunitně mediovaná enteropatie navozená konzumací glutenu u geneticky predisponovaných jedinců nesoucích HLA-DQ2 a HLA-DQ8 antigeny. Autoimunitní charakter onemocnění demonstruje přítomnost specifických sérových protilátek (protilátek proti tkáňové transglutamináze typu 2, proti endomyziu, proti deamidovaným gliadinovým peptidům). Spektrum klinických projevů celiakie je nesmírně variabilní a diagnóza celiakie je (zejména u dospělých) založena na kombinaci pozitivity celiakálních autoprotilátek v séru a histologického průkazu hyperplazie krypt či vilózní atrofie sliznice tenkého střeva [14].
Dermatitis herpetiformis Duhring (Duhringova nemoc) je kožní manifestací imunitně mediované enteropatie navozené konzumací glutenu, v literatuře je často označována jako „kožní forma celiakie“. Projevuje se výsevem drobných intenzivně svědících puchýřků připomínajících opar, lokalizovaných často nad extenzorovými oblastmi velkých kloubů, na hýždích a zádech. Patognomonickým nálezem je průkaz depozit IgA protilátek proti tkáňové transglutamináze typu 3 (anti-tTG3) v kožní biopsii [15]. Diagnóza dermatitis herpetiformis spočívá v imunofluorescenčním průkazu IgA depozit v kožní biopsii provedené z nepostižené kůže a v sérologickém průkazu specifických celiakálních autoprotilátek. Histologické vyšetření tenkého střeva nebývá ve většině případů nutnou součásti diagnózy. Základem léčby je jako u celiakie celoživotní přísná bezlepková dieta, využívá se i léčba dapsonem (diaminodifenyl sulfonem) a sulfapyridinem u pacientů netolerujících dapson [16].
Glutenová ataxie byla původně označována jako idopatická sporadická ataxie s pozitivními markery glutenové senzitizace v séru [17]. V současnosti je považována za autoimunitní onemocnění CNS, zejména mozečku, navozené glutenem. Byla prokázána zkřížená protilátková reaktivita mezi Purkyňovými buňkami mozečku a určitými antigenními epitopy glutenu. V mozečku pacientů s glutenovou ataxií byla nalezena depozita protilátek proti tkáňové transglutamináze typu 6 (anti-tTG6) podél mozkových cév. Pacienti s glutenovou ataxií mohu mít současně celiakii či pouze jen prokazatelné protilátky proti nativnímu gliadinu v séru, tj. antigliadinové protilátky (AGA) ve třídě IgA či IgG [1].
Alergie na pšenici je definována jako obranná imunologická reakce mediovaná specifickými IgE i non-IgE protilátkami na gluten a ostatní proteiny nacházející se v pšeničném zrnu. Imunoglobuliny E reagují s určitými repetitivními aminokyselinovými sekvencemi glutenových peptidů, které pronikly do organizmu. Následně dochází k uvolnění mediátorů alergické reakce, např. histaminu z bazofilů a žírných buněk [18]. V závislosti na cestě vstupu alergenu do organizmu a na ostatních imunologických mechanizmech se alergie na pšenici dále dělí na: potravinovou alergii, respirační alergii, kontaktní urtikarii a WDEIA (wheat dependent excercise induced anaphylaxis – anafylaxe na pšenici vyvolaná fyzickou aktivitou), klasická potravinová alergie na pšenici může postihovat gastrointestinální trakt, respirační trakt či kůži. K respirační pšeničné alergii patří profesionální astma pekařů a alergická rinitida. Za alergeny zodpovědné za profesionální astma pekařů jsou považovány pšeničné proteiny z kategorie ATIs. Kožní formou alergie na pšenici je kontaktní urtikarie. WDEIA je onemocnění, které vyžaduje k rozvoji symptomů 2 podmínky: jedinec musí konzumovat jídlo obsahující pšenici, a poté provádět aerobní cvičení. Samotná pšeničná potrava či samotné cvičení bez předchozí pšeničné stravy nevyvolávají obtíže. Kombinace obojího vede k rozvoji anafylaktického šoku. Zdá se, že v pšeničném zrnu je molekulou zodpovědnou za symptomy WDEIA ω-5-gliadin [in 1].
Neceliakální glutenová senzitivita (NCGS)
NCGS je syndromem, který je v posledním desetiletí v odborné veřejnosti intenzivně diskutován. Zájem o NCGS vzbudila pozorování, že existuje nemalá skupina pacientů, jež nemá ani celiakii a ani alergii na pšenici, a přesto trpí řadou symptomů (gastrointestinálních i extraintestinálních) při konzumaci stravy obsahující pšenici a příbuzné obiloviny nesoucí „toxický“ gluten. Zda je za symptomy zodpovědný pouze gluten či i jiné složky obilovin, je předmětem probíhající diskuse [1,5,19].
Pojem neceliakální glutenová senzitivita je nepřesný a nevystihuje současné, byť omezené, patofyziologické znalosti o této chorobě. Je považován za provizorní a kompromisní označení, které však takto uznal konsenzus odborníků. Alternativně navrhovaný termín neceliakální pšeničná senzitivita by totiž sice zohledňoval současné poznání, že symptomy nemusí vyvolávat pouze gluten samotný, ale i neglutenové součásti pšenice, avšak nebere v úvahu roli ostatních příbuzných imunogenních obilovin [1,9,19]. Ohledně NCGS existuje mnoho kontroverzí; někteří autoři dokonce existenci NCGS zpochybňují a hypotetizují, že může jít o obtížně diagnostikovatelnou non-IgE mediovanou potravinovou alergii na pšenici [20].
Za první popis neceliakální glutenové senzitivity je považována kazuistika publikovaná v časopise Lancet v roce 1978 a popisující případ pacienta s průjmy, intermitentními abdominálními bolestmi, normálním bioptickým nálezem v tenkém střevě a se zlepšením symptomů po bezlepkové dietě [21]. Následovala dvojitě zaslepená studie, ve které u 6 z 8 žen, jež trpěly chronickým průjmem a abdominálními bolestmi, po bezlepkové dietě došlo ke zlepšení stavu. Po opětovném zavedení lepku do stravy (gluten challenge) došlo k rekurenci symptomů. Celiakie nebyla sérologicky prokázána a v jejunální biopsii byla popsána pouze zvýšená celularita, jež vymizela po bezlepkové dietě [22]. NCGS byla posléze „znovuobjevena“ za dalších 20 let, když byla v roce 2000 publikována studie, ve které 63 % z 94 dospělých jedinců s gastrointestinálními symptomy nesplnilo kritéria ani celiakie, ani alergie na pšenici, a jejich symptomy se opět zlepšily po bezlepkové dietě [23].
V následujících letech byly studovány imunologické rozdíly mezi NCGS a celiakií. Rychle narůstající počet prací vedl k uznání existence NCGS vědeckou veřejností a k jejímu začlenění do spektra chorob vyvolaných glutenem [1,5].
Patogeneze NCGS
Patogeneze NCGS je zřejmě heterogenní. Ukazuje se však, že klíčovou roli hraje aktivace buněčných i humorálních složek systému přirozené imunity. U více než 50 % pacientů s NCGS jsou v séru nalézány anti-gliadinové protilátky ve třídě IgG (AGA IgG), což svědčí o imunitní odpovědi na nativní gliadin [5].
Imunitní systém prostřednictvím mechanizmů přirozené a adaptivní imunity hraje centrální roli v udržení tolerance k antigenům přijímaným potravou (včetně glutenu) a k ostatním patogenům. Tím chrání organizmus před vznikem onemocnění. Gluten a příbuzné peptidy fungují u disponovaných jedinců jako impulz, který spouští prolomení imunologické slizniční tolerance. Ztráta slizniční imunitní homeostázy vede k aktivaci systému přirozené či adaptivní imunity. Imunitní odpověď zprostředkovaná systémem přirozené imunity je bezprostřední a rychlá; její buněčná složka zahrnuje aktivaci makrofágů, neutrofilů, dendritických buněk, monocytů, mastocytů a přirozených „zabíječů“ (natural killer T-lymfocytů); humorální složka je charakteristická sekrecí složek komplementu, C-reaktivního proteinu a lipopolysacharid vázajícího proteinu [24]. Naproti tomu pro systém adaptivní imunity je charakteristický opožděný nástup a paměťová kapacita, zahrnující T-lymfocyty i B-lymfocyty. T-lymfocyty jsou aktivovány po interakci T buněčného receptoru s antigenem navázaným na HLA struktury antigen-prezentujících buněk [25].
U celiakie navozuje gluten ve sliznici tenkého střeva imunopatologickou reakci, ve které se uplatňuje především systém adaptivní imunity: v lamina propria mucosae tenkého střeva dochází k aktivaci cytotoxických T-lymfocytů specifických pro gluten, T helperů a B-lymfocytů [26].
Řada prací ukázala, že celiakie i NCGS sdílejí zapojení složek přirozené imunity. Na rozdíl od celiakie však u NCGS nebyla doložena aktivace adaptivních imunitních mechanizmů (nebyla např. prokázána zvýšená slizniční exprese interleukinů IL6, IL17A, IL17, IL21 a interferonu γ) [5]. U NCGS byla naopak (ve srovnání s celiakií) prokázána vyšší exprese receptorů přirozené imunity, tj. toll-like receptoru 2 (TLR2) [27], TLR1 či TLR4 a zvýšená produkce cytokinů systému přirozené imunity (TNFα, IL10 a GM-CSF) [28]. K dalším dokladům o aktivaci přirozené imunity u NCGS patří průkaz aktivace neutrofilů či zvýšená eozinofilní infiltrace lamina propria mucosae tenkého střeva [29] či aktivace cirkulujících bazofilů [30].
Vedle zmíněných imunitních mechanizmů existují určité náznaky, že se na vzniku gastrointestinálních symptomů NCGS mohou podílet změny neuromuskulární střevní aktivity navozené gliadinem. Např. u HLA-DQ8 transgenních myší vyvolává gliadin zvýšenou sekreci acetylcholinu z myenterického plexu střeva, což vede ke zvýšené střevní kontraktilitě a epiteliální hypersekreci [31]. Byla naopak popsána i opioidní aktivita glutenu: gluten napodoboval u zdravých dobrovolníků efekt opiátů zpomalující střevní „transit time“ a tento efekt byl reverzibilní po podání naloxonu [32]. Zmíněné rozdílné ovlivnění neuromuskulárních střevních funkcí gliadinem může vysvětlovat obtíže typu průjem či zácpa v rámci NCGS.
Kromě samotného glutenu mohou být symptomy NCGS navozeny také antigenními epitopy jiných proteinů obsažených v obilných zrnech, u kterých byla rovněž doložena schopnost aktivovat systém přirozené imunity. Jde např. o lektiny či inhibitory amylázy a trypsinu, jak bylo zmíněno výše [5,12,13].
K rozvoji NCGS mohou dále přispívat faktory, jakými jsou tzv. low-grade intestinální zánět, modifikace bariérové funkce tenkého střeva (některé práce popisují zvýšenou, jiné dokonce sníženou intestinální permeabilitu) [5], či změny složení střevní mikrobioty. Zvýšené zastoupení gramnegativních bakterií a snížený podíl grampozitivních laktobacilů vede ke změnám v zastoupení antigenů ve střevním lumen, což může spouštět imunitní odpověď vůči antigenům dietním, jakým je i gluten [33].
Nedávné studie naznačily, že i dieta bohatá na tzv. FODMAPs může být zodpovědná za funkční gastrointestinální symptomy v rámci syndromu NCGS. FODMAPs je zkratka pro fermentabilní oligosacharidy, disacharidy, monosacharidy a polyoly (fermentable oligo-, di - and mono-saccharide and polyols). Zdrojem FODMAPs je strava obsahující velké množství fruktózy, laktózy, fruktanů, galaktanů a polyolů (tab. 1), tedy i strava obsahující obiloviny typu pšenice, žita a ječmene. FODMAPs jsou špatně absorbovatelné a špatně digestibilní sacharidy o krátkém řetězci, které jsou substrátem pro bakteriální fermentaci v tenkém a tlustém střevě. Rychlá fermentace FODMAPs vede ke zvýšení obsahu plynu a osmotickým efektem i tekutiny v intestinálním lumen, jehož následná distenze vyvolává funkční gastrointestinální obtíže [34]. Bylo ukázáno, že dieta obsahující nízké množství FODMAPs výrazně zlepšuje funkční gastrointestinální obtíže u pacientů, kteří si sami diagnostikovali NCGS či u pacientů se syndromem dráždivého tračníku [35]. Nicméně FODMAPs samotné nemohou vysvětlit veškeré symptomy (zejména extraintestinální) u jedinců s NCGS.
Tab. 1. Potraviny obsahující FODMAPs. Upraveno podle http://www.ibsgroup.org 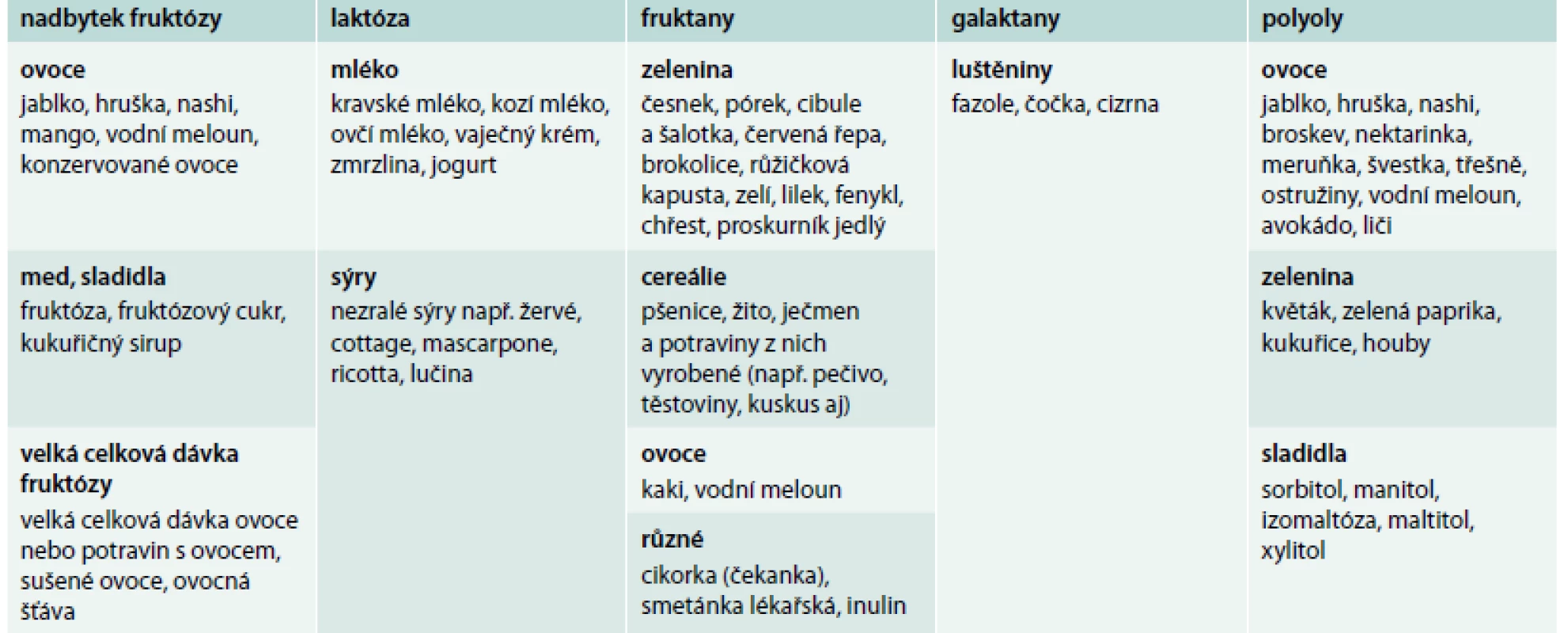
Funkční gastrointestinální symptomy u pacientů s NCGS (a se syndromem dráždivého tračníku) mohou být rovněž způsobeny potravinovými aditivy, jakými jsou glutamáty, benzoáty, sulfity a nitráty, a které jsou přidávány do komerčně vyráběných potravin pro zlepšení chuti, barvy a ke konzervaci. Tyto chemikálie jsou zdrojem aferentních stimulů pro enterický nervový systém, což může u pacientů s viscerální hypersenzitivitou způsobovat efektorovu odpověď v podobě luminální distenze [5,34].
Klinický obraz a epidemiologie NCGS
NCGS je definována jako syndrom projevující se širokým spektrem gastrointestinálních a extraintestinálních obtíží, které vznikají krátce po konzumaci stravy obsahující gluten a které se zlepší či vymizí po vynechání glutenu a znovu se objeví po opětovném zavedení glutenu do stravy. A to u jedinců, kteří netrpí ani celiakií ani alergií na pšenici [1,5,19].
Časový interval mezi požitím glutenu a objevením symptomů u NCGS kolísá mezi několika hodinami a několika dny, což je odlišné jak od alergie na pšenici (při níž se symptomy objevují do několika minut od expozice), tak od celiakie (při níž se symptomy objevují po týdnech až letech konzumace glutenu).
Většina symptomů spojených s NCGS je do velké míry subjektivních. Symptomy se rozdělují na intestinální i extraintestinální.
Mezi intestinální symptomy patří: průjem, nadýmání, bolesti břicha, zácpa, gastroezofageální reflux či aftózní stomatitida [1,5]. Některé práce naznačují, že 30–50 % jedinců trpících syndromem dráždivého tračníku splňuje kritéria NCGS [30,36].
Extraintestinální symptomy zahrnují projevy kožní (ekzém, rash), neurologicko-psychiatrické (bolesti hlavy, únava, brnění či necitlivost nohou, rukou a prstů, změny chování, zmatenost či „mlhavá mysl“, deprese, úzkost), dále bývají popisovány kloubní nebo svalové bolesti či anémie [1,5].
Byl rovněž studován vztah NCGS k neuropsychiatrickým onemocněním, zejména ke schizofrenii a autizmu. Děti s autizmem mají signifikantně vyšší hladiny antigliadinových protilátek třídy IgG (avšak ne třídy IgA) ve srovnání se zdravými kontrolami. U určitého procenta dětí s autizmem bezlepková a bezkaseinová dieta zlepšila behaviorální projevy a vedla k signifikantnímu snížení intestinální permeability (v porovnání s autistickými dětmi na volné stravě) [37]; zdá se tedy, že jen některé případy autizmu mohou patřit do spektra onemocnění spojených s NCGS a pouze malá skupina dětí s autizmem může profitovat z eliminační diety. K identifikaci fenotypu autizmu vhodného pro dietní intervence je nutný další výzkum [38,39]. Také u jedinců se schizofrenií byla prokázána vyšší prevalence (23 %) IgG protilátek proti gliadinu [40]. Na základě zmíněných pozorování vznikla hypotéza, že některé symptomy u autizmu a schizofrenie mohou být vyvolány opioidními peptidy (exorfiny), vzniklými nekompletním štěpením glutenu a kaseinu v lumen trávicího traktu. Exorfiny se vlivem zvýšené intestinální permeability u disponovaných jedinců více vstřebávají ze střevního lumen, posléze pronikají hematoencefalickou bariérou a v CNS ovlivňují endogenní opiodní systém a neurotransmisi [19].
NCGS se vyskytuje zejména u dospělých jedinců mladšího až středního věku, medián výskytu je 55 let (s popsaným rozpětím 18–80 let), v dětství je vzácná. Je 3–6krát častější u žen než u mužů. Signifikantně častěji se vyskytuje u osob, které trpí dalšími potravinovými intolerancemi (laktózová, fruktózová intolerance), či u osob, které jsou příbuznými prvního stupně pacientů s celiakií. Prevalence NCGS v populaci není přesně známa: řada pacientů totiž spontánně zahajuje bezlepkovou dietu bez předchozí konzultace s lékařem a tedy bez předchozího vyloučení celiakie či alergie na pšenici. Za těchto okolností je provedení spolehlivé epidemiologické studie problematické. Nicméně se odhaduje, že výskyt NCGS bude ve všeobecné populaci častější, než je výskyt samotné celiakie [1]. Podle toho, zda byl epidemiologický průzkum prováděn v primárních či terciálních centrech, kolísá nalezená prevalence ve všeobecné populaci mezi 0,5–6 % [5,19]. Dokonce podle dotazníkové akce prováděné ve Velké Británii byla zjištěna ve všeobecné populaci 13% prevalence NCGS [5].
Diagnóza NCGS
V současnosti neexistuje žádné objektivní kritérium či sérologický test specifický pro diagnózu NCGS.
U asi 56 % pacientů byla nalezena pozitivita antigliadinových protilátek ve třídě IgG (AGA IgG) [41]. AGA protilátky však nejsou považovány za specifický test, neboť bývají přítomny i u jiných chorob, jakými jsou např. autoimunitní hepatitida, syndrom dráždivého tračníku, řada onemocnění pojivové tkáně. Nicméně jejich pozitivita může podporovat diagnózu NCGS [5].
Diagnóza NCGS vychází z detailní anamnézy sestavené s pomocí zkušeného nutričního terapeuta [1]. Jde o diagnosis per exclusionem et ex iuvantibus (tab. 2). Po suspekci vzniklé rozborem anamnézy je nutné vyloučit celiakii a alergii na pšenici, a to v době, kdy pacient přijímá stravu bez omezení lepku. Při předčasném nasazení bezlepkové diety by totiž výsledky testů mohly být falešně negativní.
Tab. 2. Diagnostická kritéria pro neceliakální glutenovou senzitivitu. Upraveno podle [5] ![Diagnostická kritéria pro neceliakální glutenovou senzitivitu. Upraveno podle [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7424a46ddd1393effe340ec479bd4cec.png)
Vyloučení alergie na pšenici vyžaduje negativitu imuno-alergologických testů, tj. negativitu alergen-specifických IgE protilátek v séru (např. IgE protilátek proti pšenici, proti ječmeni a proti α-amyláze) a negativitu kožních testů [1,5].
Vyloučení celiakie zahrnuje sérologické vyšetření i histologické vyšetření sliznice tenkého střeva, resp. duodena. Diagnózu NCGS podporuje negativita sérologického vyšetření. Mezi sérologické testy celiakie patří: protilátky proti tkáňové transglutamináze (anti-t-TG), proti endomyziu (anti-EMA), popřípadě proti deamidovaným gliadinovým peptidům (anti-DGP) ve třídách IgA. Současně je nutno stanovit hladinu celkového imunoglobulinu A (IgA). V případě deficitu celkového IgA se totiž diagnostika opírá o uvedené autoprotilátky ve třídách IgG. I při negativitě celiakálních autoprotilátek je doporučováno provedení biopsie duodena při gastrofibroskopickém vyšetření a následné histologické vyšetření sliznice. NCGS je provázena buď normálním histopatologickým nálezem, nebo maximálně průkazem zvýšeného počtu intraepiteliálních lymfocytů (do 40 intraepitelálních lymfocytů na 100 enterocytů); jde tedy o nález v tenkém střevě odpovídající stadiu 0–1 dle Marshovy klasifikace. Na rozdíl od celiakie není u NCGS prokazováno zvýšení γ/δ T receptoru na povrchu intraepiteliálních lymfocytů [5]. V případě histopatologického nálezu stadia 2 a více dle Marshovy klasifikace je NCGS vysoce nepravděpodobná a je nutno uvažovat o nozologických jednotkách spojených s vilózní atrofií sliznice tenkého střeva, včetně např. tzv. séronegativní celiakie. Séronegativní celiakie se vyskytuje v 1–2 % případů celiakie [14].
Genetické vyšetření u NCGS není přínosné. NCGS nekoreluje s geny HLA-DQ2 a HLA-DQ8, které jsou přítomny u celiakie. Tyto geny byly nalezeny u zhruba 40–46 % pacientů s NCGS, což je sice mírně vyšší procento, než je jejich výskyt ve všeobecné populaci (30 %), ale nedosahuje více než 99% přítomnosti u celiakie [5].
Zjištění, že symptomy vymizí rychle (během několika hodin či dní) po bezlepkové dietě, dodává váhu diagnóze NCGS. Ta má být definitivně potvrzena otevřeným [1] nebo ideálně dvojitě slepým [5] glutenovým expozičním testem (gluten challenge): pacient konzumuje zhruba 3 týdny stravu obsahující lepek a sleduje se, kdy dojde k rekurenci obtíží. Požití stravy obsahující gluten v typickém případě vyvolá opět rychle (během několika hodin či dní) návrat intestinálních či extraintestinálních obtíží. Glutenový expoziční test má začít čtvrtkou krajíce běžného chleba či jednou sušenkou denně. Tato dávka je vždy zdvojena po 1–3 dnech, a to tak dlouho, dokud nevzniknou typické symptomy či dokud jedinec nekonzumuje ekvivalent 4 krajíců chleba či 2 porcí těstovin denně [42]. Cílem glutenového expozičního testu je vyloučení možného placebo efektu předchozího zlepšení symptomů bezlepkovou dietou. Řada pacientů však glutenový expoziční test odmítne. Zvláště jedinci, kteří si spontánně nasadili bezlepkovou dietu a pocítili její příznivý efekt, nejsou ochotni glutenový expoziční test podstoupit. Dvojitě slepý placebem kontrolovaný glutenový expoziční test se doporučuje k exaktnímu stanovení diagnózy NCGS zejména v epidemiologických studiích. Takový přístup je však v běžné klinické praxi téměř neproveditelný. Pro klinickou praxi nejsou dostupné standardizované testy s kapslemi obsahujícími pšeničnou mouku [43].
Léčba NCGS
Léčba NCGS spočívá ve změně dietních zvyklostí, které jsou zaměřeny několika směry. Za prvé je třeba konzumovat potravu s vyloučením lepku. Pšenice, ječmen, žito a řada odrůd ovsa musejí být nahrazeny cereáliemi, jako je rýže, kukuřice, pohanka, proso, čirok, bér či pseudocereáliemi (pohanka, amarant, merlík) a luštěninami (fazole, hrách, čočka, sója, cizrna).
K zamezení negativního vlivu potravinových aditiv a konzervantů je doporučováno vynechat z jídelníčku komerčně vyráběné bezlepkové výrobky a preferovat tzv. přirozeně bezlepkovou stravu (maso, ryby, vejce, brambory, zelenina, ovoce a výše zmíněné cereálie, pseudocereálie a luštěniny) [1,5].
Bezlepková dieta vede rychle k vymizení obtíží u většiny jedinců s NCGS, u některých nemocných je však její efekt jen částečný. U řady pacientů s gastrointestinálními obtížemi (charakteru dráždivého tračníku) je vhodné konzumovat potraviny obsahující malá množství FODMAPs (tab. 3) a pozorovat efekt takového opatření [1,5].
Tab. 3. Potraviny obsahující nízké množství FODMAPs – FODMAPs friendly dieta. Upraveno podle http://www.ibsgroup.org 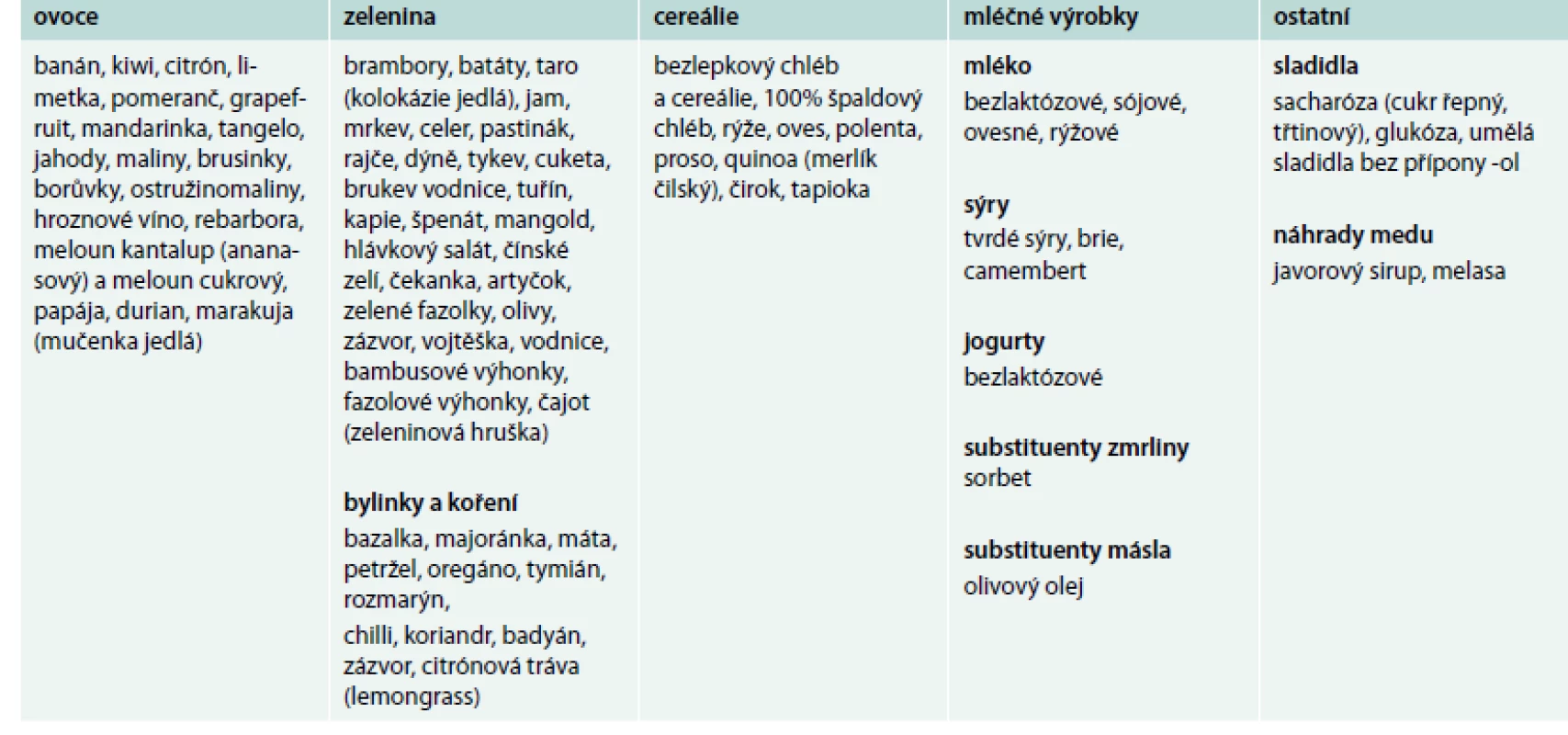
Dieta má být vedena zkušeným nutričním terapeutem a sestavena tak, aby zajistila nejen restrikci nevhodných potravin, ale především umožnila optimální příjem cukrů, tuků, bílkovin, minerálů, stopových prvků, vitaminů a vlákniny. Během kontrol je nutné sledovat trend hmotnosti a zamezit vzniku podvýživy i nadváhy. Pacient musí být edukován o všech aspektech bezlepkové diety, jakými jsou např. kontaminace bezlepkových potravin, problematika stopových množství lepku, legislativa označování potravin či seznámení se spolehlivými zdroji informací a s podporou pacientských sdružení.
Zatímco pacienti s celiakií a ostatními autoimunitními chorobami vyvolanými glutenem musejí dodržovat celoživotní striktní bezlepkovou dietu, nemocní s NCGS mohou být relativně liberálnější a mohou titrovat expozici lepku/pšenici podle symptomů. Na rozdíl od celiakie se jedinci s NCGS nemusejí tolik obávat kontaminace potravin lepkem, neboť jejich tolerance k stopovým množstvím glutenu bývá většinou dobrá. Hladina tolerance nepatrných množství lepku je však velmi individuální [1,5].
Není dosud jasné, zda individuální tolerance lepku kolísá v průběhu času a zda je NCGS přechodnou či trvalou poruchou. Z těchto důvodů je po 1–2 letech trvání bezlepkové diety doporučováno opětovné zavádění lepku do stravy, a to metodou desenzititace, tj. postupným zařazováním stravy s malým množstvím lepku [5].
Komplikace NCGS
Na základě současných znalostí se zdá, že jedinci s NCGS nemají (na rozdíl od pacientů s celiakií) zvýšené riziko dlouhodobých komplikací, jakými jsou nutriční deficity vlivem malabsorpce, lymfom tenkého střeva a ostatní intestinální malignity, a že se u nich nevyskytují ani přidružené autoimunitní choroby. Rovněž nebyl popsán vyšší výskyt NCGS mezi příbuznými [5,44].
Závěr
V posledním desetiletí vzbudil koncept neceliakální glutenové senzitivity zájem vědecké i laické veřejnosti. Byla publikována řada přesvědčivých pozorování o existenci jedinců, kteří nemají ani celiakii, ani alergii na pšenici, kteří přesto reagují množstvím gastrointestinálních i extraintestinálních symptomů na stravu obsahující lepek, a u kterých dochází ke zlepšení či vymizení těchto symptomů po bezlepkové dietě.
Dle recentních konsenzů je NCGS řazena do spektra chorob vyvolaných lepkem [1,9,19]. Každá jednotka tohoto spektra vyvolává unikátní a odlišnou imunitní reakci na stravu obsahující lepek, ačkoliv řada symptomů se vzájemně překrývá. Navíc v rámci NCGS je pozorován signifikantní překryv gastrointestinální symptomatologie se syndromem dráždivého tračníku.
Patofyziologie neceliakální glutenové senzitivity není zatím dostatečně objasněná. Není známo, zda syndrom vyvolává samotný gluten či i jiné složky obilného zrna. Existují určité doklady o aktivaci systému přirozené imunity na přítomnost glutenu i neglutenových složek obilného zrna (jakými jsou lektiny či inhibitory amylázy a trypsinu). Na vzniku gastrointestinálních symptomů se mohou podílet i FODMAPs či potravinová aditiva.
Diagnóza neceliakální glutenové senzitivity je založena na vyloučení celiakie a alergie na pšenici, na zlepšení symptomů po bezlepkové dietě a má být potvrzena glutenovým expozičním testem. Zvláště ten je však v klinické praxi často obtížně dosažitelným ideálem.
Od budoucího výzkumu se očekává objasnění patofyziologických souvislostí a identifikace vhodného sérologického markeru, který by NSGS odlišil od onemocnění s podobnou klinickou prezentací, jakými jsou celiakie a alergie na pšenici, ale i syndrom dráždivého tračníku či mnohočetná potravinová hypersenzitivita.
MUDr. Iva Hoffmanová
iva.hoffmanova@fnkv.cz
II. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
www.fnkv.cz
Doručeno do redakce 8. 12. 2014
Přijato po recenzi 19. 1. 2015
Zdroje
1. Sapone A, Bai JC, Ciacci C et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med 2012; 10 : 13. Dostupné z DOI: <http://doi: 10.1186/1741–7015–10–13>.
2. Frič P, Zavoral M, Dvořáková T. Choroby způsobené lepkem. Vnitř Lék 2013; 59(5): 376–382.
3. Nijeboer P, Bontkes HJ, Mulder CJ et al. Non-celiac gluten sensitivity. Is it in the gluten or the grain? J Gastrointestin Liver Dis 2013; 22(4): 435–440.
4. Molberg O, Uhlen AK, Jemsen T et al. Mapping of gluten T-cell epitopes in the bread wheat ancestors: implications for celiac disease. Gastroenterology 2005; 128(2): 393–401.
5. Volta U, Caio G, Tovoli F et al. Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness. Cell Mol Immunol 2013; 10(5): 383–392.
6. Sollid LM, Jabri B. Triggers and drivers of autoimmunity: lessons from celiac disease. Nat Rev Immunol 2013; 13(4): 294–302.
7. Percentage of U.S. adults trying to cut down or avoid gluten in their diets reaches new high in 2013. Reports NPD. Dostupné z WWW: <https://www.npd.com/wps/portal/npd/us/news/press-releases/percentage-of-us-adults-trying-to-cut-down-or-avoid-gluten-in-their-diets-reaches-new-high-in-2013-reports-npd>.
8. Tatham AS, Shewry PR. Allergens in wheat and related cereals. Clin Exp Allergy 2008; 38(11): 1712–1726.
9. Ludvigsson JF, Leffler DA, Bai JC et al. The Oslo definitions for coeliac disease and related terms. Gut 2013; 62(1): 43–52.
10. Shan L, Molberg O, Parrot I et al. Structural basis for gluten intolerance in celiac sprue. Science 2002; 297(5590): 2275–2279.
11. Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer. Physiol Rev 2011; 91(1): 151–175.
12. Pellegrina CD, Perbellini O, Scupoli MT et al. Effects of wheat germ agglutinin on human gastrointestinal epithelium: insights from an experimental model of immune/epithelial cell interaction. Toxicol Appl Pharmacol 2009; 237(2): 146–153.
13. Junker Y, Zeissig S, Kim SJ et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209(13): 2395–2408.
14. Volta U, Villanacci V. Celiac disease: diagnostic criteria in progress. Cell Mol Immunol 2011; 8(2): 96–102.
15. Rose C, Armbruster FP, Ruppert J et al. Autoantibodies against epidermal transglutaminase are a sensitive diagnostic marker in patients with dermatitis herpetiformis on a normal or gluten-free diet. J Am Acad Dermatol 2009; 61 : 39–43.
16. Caproni M, Antiga E, Melani L et al. Italian Group for Cutaneous Immunopathology. Guidelines for the diagnosis and treatment of dermatitis herpetiformis. J Eur Acad Dermatol Venereol 2009; 23(6): 633–638.
17. Hadjivassiliou M, Grunewald RA, Chattopadhyay AK et al. Clinical, radiological, neurophysiological and neuropathological characteristics of gluten ataxia. Lancet 1998; 352(9140): 1582–1585.
18. Inonata N. Wheat allergy. Cur Opin Aller Clin Immunol 2009; 9(3): 238–243.
19. Catassi C, Bai JC, Bonaz B et al. Non-Celiac Gluten sensitivity: the new frontier of gluten related disorders. Nutrients 2013; 5(10): 3839–3853.
20. Carroccio A, Mansueto P, D’Alcamo A et al. Non-celiac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108(12): 1845–1852.
21. Ellis A, Linaker BD. Non-celiac gluten sensitivity? Lancet 1978; 1(8078): 1358–1359.
22. Cooper BT, Holmes GK, Ferguson R et al. Gluten-sensitive diarrhea without evidence of celiac disease. Gastroenterology 1980; 79(5 Pt 1): 801–806.
23. Kaukinen K, Turjanmaa K, Mäki M et al. Intolerance to cereals is not specific for coeliac disease. Scand J Gastroenterol 2000; 35(9): 942–946.
24. Turvet SE, Broide DH. Innate immunity. J Allergy Clin Immunol 2010; 125(2 Suppl 2): S24-S32.
25. Bonilla FA, Oettgen HC. Adaptive immunity. J Allergy Clin Immunol 2010; 125(2 Suppl 2): S33-S40.
26. Schuppan D, Zimmer KP. The diagnosis and treatment of celiac disease. Dtsch Arztebl Int 2013; 110(49): 835–846.
27. Sapone A, Lammers KM, Casolaro V et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9 : 23.
28. Vazquez-Roque MI, Camilleri M, Smyrk T et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144(5): 903–911.
29. Holmes G. Non coeliac gluten sensitivity. Gastroenterol Hepatol Bed Bench 2013; 6(3): 115–119.
30. Carroccio A, Mansueto P, Iacono G et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: Exploring a new clinical entity. Am J Gastroenterol 2012; 107(12): 1898–1906.
31. Verdu EF, Huang X, Natividad J et al. Gliadin-dependent neuromuscular and epithelial secretory responses in gluten-sensitive HLA-DQ8 transgenic mice. Am J Physiol Gastrointest Liver Physiol 2008; 294(1): G217-G225.
32. Corazza GR, Frazzoni M, Strocchi A et al. Alimentary exorphin actions on motility and hormonal secretion of gastrointestinal tract. In: Fraioli F (ed). Opioid Peptides in the Periphery. Elsevier Sciences Publisher: Amsterdam 1984 : 243–247. ISBN 978–0444806246.
33. Natividad JM, Huang X, Slack E et al. Host responses to intestinal microbial antigensin gluten sensitive mice. PLos ONE 2009; 4(7): e6472. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0006472>.
34. Gibson PR, Sheperd SJ. Food choice as a key management strategy for functional gastrointestinal symptoms. Am J Gastroenterol 2012; 107(5): 657–666.
35. Biesiekirski JR, Peters SL, Newnham ED et al. No effects of gluten in patients with self-reported non-celiac gluten sensitivity following dietary reduction of low-fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology 2013; 145(2): 320–328.
36. Biesiekierski JR, Newnham ED, Irving PM et al. Gluten causes gastrointestinal symptoms in subjects without celiac disease: A double-blind randomized placebo-controlled trial. Am J Gastroenterol 2011; 106(3): 508–514.
37. De Magistris L, Familiari V, Pascotto A et al. Alterations of the intestinal barrier in patients with autism spectrum disorders and in their first-degree relatives. J Pediatr Gastroenterol Nutr 2010; 51(4): 418–424.
38. Millward C, Ferriter M, Calver S et al. Gluten - and casein-free diets for autistic spectrum disorder. Cochrane Database Syst Rev 2008; (2): CD003498. Dostupné z DOI: <http://doi: 10.1002/14651858.CD003498.pub3>.
39. Whiteley P, Haracopos D, Knivsberg AM et al. The ScanBrit randomised, controlled, single-blind study of a gluten - and casein-free dietary intervention for children with autism spectrum disorders. Nutr Neurosci 2010; 13(2): 87–100.
40. Cascella NG, Kryszak D, Bhatti B et al. Prevalence of celiac disease and gluten sensitivity in the United States clinical antipsychotic trials of intervention effectiveness study population. Schizophr Bull 2011; 37(1): 94–100.
41. Volta U, Tovoli F, Cicola R et al. Serological tests in gluten sensitivita (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46(8): 680–685.
42. Leffler D. Gluten intolerance: you mean I don’t have celiac disease? In: Dennis M, Leffler D (eds) Real Life With Celiac Disease: Troubleshooting and Thriving Gluten Free. Aga Institute Press: Bethesda (MD) 2010.
43. Lundin KE, Alaedini A. Non-celiac gluten sensitivity. Gastrointest Endosc Clin N Am 2012; 22(4): 723–734.
44. Kabbani TA, Vanga RR, Leffler DA et al. Celiac disease or non-celiac gluten sensitivity? An approach to clinical differential diagnosis. Am J Gastroenterol 2014; 109(5): 741–746.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 40. Angiologické dny 2015
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hormonální léčba transsexuálních pacientů – editorial
- Nejnovější aspekty diagnostiky a terapie hyponatremie – editorial
- Neceliakální glutenová senzitivita – editorial
- Neceliakální glutenová senzitivita – editorial
- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
- Má tělesná výška vliv na závažnost chronického žilního onemocnění na dolních končetinách?
- Zkušenosti s léčbou biosimilárními léky
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
- Neceliakální glutenová senzitivita
- Chronická tromboembolická plicní hypertenze
- Nové doporučené postupy ESC pro diagnostiku a léčbu akutní plicní embolie
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) -
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury - Hypersenzitivní reakce po podání heparinu s aktivací heparinem indukované trombocytopenie po zahájení intermitentní hemodialýzy
- Vybrané právní aspekty povinné mlčenlivosti
-
Lehké hypoglykemie jsou v České republice u pacientů s diabetem 2. typu léčených inzulinovými analogy běžné a jejich výskyt pacienty znepokojuje
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) - 40. Angiologické dny 2015
- Roman Herzig. Ischemické cévní mozkové příhody.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) - Neceliakální glutenová senzitivita
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



