-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunitní odpověď na vakcinaci u starších lidí
Immune response to vaccination in the elderly
The immune system develops from childhood until the late age. Each of these periods has its own specialities. Aging is typical for immunity, depending on the conversion of hematogenous bone marrow to adipose, involution of the thymus and persistent viral infections (e.g. CMV). In the elderly, whose numbers have been increasing in recent decades, there is a need to understand the changes in the immune system also called as immunosenescence. The substantial remodeling of the immune system during aging leads to a decline in its functional activity in both innate (complement, cytokines, granulocytes, NK cells, macrophages) and adaptive immunity (B lymphocytes and antibody production, T lymphocytes, cytokine production and cytotoxic response, NKT cells, regulatory T lymphocytes with suppressor activity) with advancing age, resulting in increased risk of chronic diseases, infections, autoimmunity and vaccination failure.
Keywords:
immunosenescence – adaptive and innate immunity – vaccination of the elderly
Autoři: Ivan Šterzl 1; Karolína Absolonová 1; Anna Fišerová 2,3
Působiště autorů: Endokrinologický ústav, Oddělení klinické imunoendokrinologie, Praha 1; Mikrobiologický ústav AV ČR, v. v. i., Praha 2; APIGENEX, s. r. o., Praha 3
Vyšlo v časopise: Vnitř Lék 2021; 67(E-8): 14-18
Kategorie: Přehledové články
Souhrn
Vývoj imunitního systému probíhá od dětských let až do pozdního stáří. Každé z těchto období má své zvláštnosti. Stárnutí je pro imunitu typické, a to v závislosti na přeměně hematogenní kostní dřeně na tukovou, na involuci thymu (brzlíku) a perzistujících virových infekcích (např. CMV). U starých lidí, jejichž počet v posledních dekádách narůstá, je potřeba porozumět změnám imunitního systému, které nazýváme imunosenescencí. Podstatná přestavba imunitního systému v průběhu stárnutí vede k poklesu jeho funkční aktivity v oblasti vrozené (komplement, cytokiny, granulocyty, NK buňky, makrofágy) i adaptivní imunity (B lymfocyty a tvorba protilátek, T lymfocyty, produkce cytokinů a cytotoxická reakce, NKT buňky, T regulační lymfocyty se supresorovou aktivitou) s postupujícím věkem, což má za následek zvýšené riziko chronických onemocnění, infekcí, autoimunity a selhání vakcinace.
Klíčová slova:
imunosenescence – adaptivní a vrozená imunita – vakcinace starších jedinců
Úvod
Demografické změny vedou ke globálnímu stárnutí populace a předpokládá se, že procento osob starších 65 let se zvýší z 9 % v roce 2019 na 16 % v roce 2050 na celém světě a z 18 na 25 % v Evropě a Severní Americe. Počet lidí starších 80 let roste ještě rychleji (1). Závažnost mnoha infekcí je u starších pacientů vyšší než u mladších dospělých a často se vyskytují infekční choroby spojené s dlouhodobými následky, jako je nástup celkového oslabení, únavy, zhoršení každodenních činností nebo ztráta nezávislosti (2).
Ve starším věku dochází k výraznějším změnám, především v primární imunitní reakci, a to jak v její buněčné složce, tak v její humorální složce. Imunitní nedostatečnost je způsobena chronickým zánětem a zvýšením cirkulujících zánětlivých faktorů, jako je CRP (C‑reaktivní protein), TNF‑α (tumor necrosis factor α) a IL-6 (interleukin 6), které se podílí i na mnoha komorbiditách v senescenci (např. kardiovaskulární nemoci, Alzheimerova choroba).
Změny v adaptivní imunitě jsou závislé na kooperaci s přirozenou imunitou, která může být rovněž oslabena. Ve starším věku záleží, zda se jedinec s patogenem již setkal, nebo se setkává se zcela novým patogenem prezentovaným neo‑antigeny. Setkává‑li se s novým patogenem, je adaptivní imunita ovlivněna především přeměnou hematogenní kostní dřeně na tukovou a involuci, thymu (brzlíku) a výrazným promořením starší generace cytomegaloviry (CMV) (3). Naopak u starších jedinců, pokud se s antigenem – patogenem již setkali, dochází k mohutnému rozvoji specifických paměťových T i B lymfocytů. Vzhledem k tomu, že u starší populace je velmi nebezpečné setkání jak s intracelulárními patogeny (viry), tak s extracelulárními patogeny (bakterie, paraziti), je nutno myslet na specifickou prevenci, a za optimální považujeme vakcinaci. Proto se v tomto přehledu budeme zabývat zkušenostmi s vakcinací starší populace, a to především u známých patogenů, jako je chřipka, herpes zoster, pneumonie apod.
Imunosenescence
Imunosenescence přispívá k dysregulaci složek vrozené a adaptivní imunity a je charakterizována neschopností vyvolat účinné (obranné) humorální a buněčné imunitní reakce proti patogenu nebo vakcíně, jakož i systémovým zánětlivým stavům (Tab. 1). Tyto projevy imunosenescence mají podklad na vrozené – genetické úrovni (4).
Tab. 1. Změny buněk imunitního systému v přirozené a adaptivní imunitě, upraveno podle (2, 4, 5) 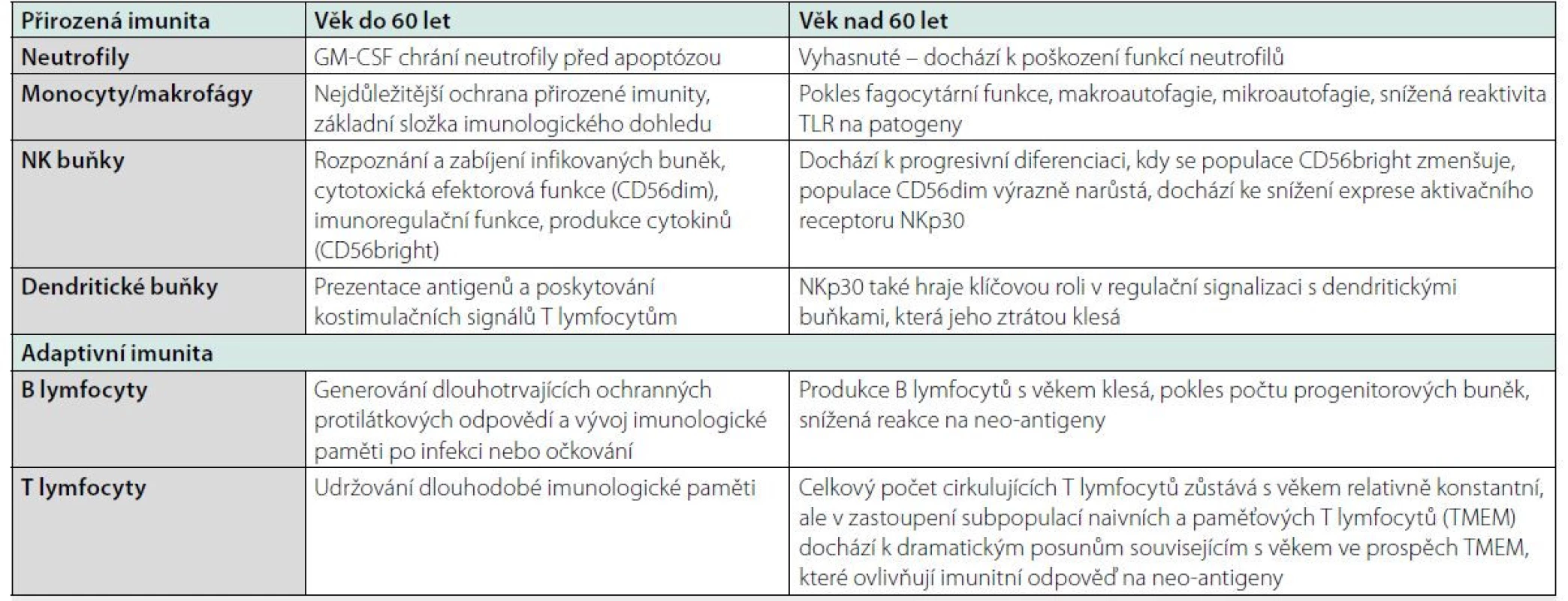
GM-CSF – granulocyte-macrophage colony-stimulating factor, TLR – toll-like receptor, CD56dim – nízká intenzita povrchového znaku CD56, CD56bright – vysoká intenzita povrchového znaku CD56, NKp30 – natural killer protein 30, TMEM – paměťový (memory) T lymfocyt Nejúčinnějším preventivním opatřením proti infekcím je bezpochyby vakcinace. Za snížení její účinnosti jsou odpovědné změny imunitního systému související s věkem. Jedná se o sníženou imunogenicitu a klinickou účinnost většiny v současnosti používaných vakcín. Proto v současnosti probíhá rozsáhlý výzkum vývoje nových a vylepšených vakcín, které se zaměří konkrétně na aktivaci specifické imunity u starších osob (2, 5).
Změny vrozené imunity ve stáří
Hlavní složku vrozené imunity představují neutrofily, které přispívají k prozánětlivému prostředí v místě podání vakcíny, čímž dochází k aktivaci dalších buněk vrozené imunity, např. monocytů, makrofágů a dendritických buněk (DC – dendritic cells). U starších osob dochází ke snížené produkci některých chemokinů, cytokinů a kyslíkových radikálů, a tím k poškození jejich funkční aktivity, migrace do lymfoidních orgánů a schopnosti zpracovávat a prezentovat antigen T buňkám např. v důsledku deficitu v prezentaci MHC (major histocompatibility complex, hlavní histokompatibilní komplex) proteinů a kostimulačních molekul (schéma 1). Ačkoli imunosenescence nejčastěji souvisí se selháním adaptivní imunity, stárnutí ovlivňuje také různé funkce vrozeného imunitního systému.
Schéma 1. Změny v přirozené imunitě ve stáří, upraveno podle (10). CD56dim – nízká intenzita povrchového znaku CD56, NKp30 a 46 – natural killer protein 30 a 46 
Neutrofily tvoří 45–75 % periferních leukocytů a plní fagocytární funkci v časných fázích infekce. Neutrofily jsou krátce žijící buňky, zánětlivé signály mohou prodloužit jejich životnost, ale poté, co byla infekce odstraněna, podléhají apoptóze. Počet neutrofilů se ve stáří nemění, ale je narušená jejich chemotaxe a tím dlouhodobě přetrvávají ve tkáních, které poškozují. Defekt v signalizaci pro tvorbu sítí usnadňuje průnik mikrobů a jejich rychlé šíření. Důsledkem dysregulace funkce neutrofilů je zvýšená vnímavost k infekcím, která je spojena s vyšším rizikem celkové morbidity a mortality při chronickém zánětu, který se vyvíjí se stárnutím (6).
Monocyty a makrofágy jsou rovněž fagocytární buňky, které jsou důležité pro imunologický dozor a vrozenou odpověď na infekci. Cirkulující monocyty jsou prekurzory makrofágů rezidentních ve tkáni; po diferenciaci tyto makrofágy slouží jako jedna z předních obranných linií vrozené imunity. Makrofágy jsou všestranné imunitní buňky, které vedle fagocytózy a opravy poškozených tkání spouštějí prozánětlivou odpověď. V klidovém stavu pomáhají udržet homeostázi organismu a regulaci imunitní odpovědi. Zde hrají významnou roli receptory rozpoznávající mikrobiální infekce a následně zvyšují produkci IFN I. typu (IFN – interferon) a expresi kostimulačních molekul CD80 a CD86 (CD – cluster of differentiation, diferenciační skupina). Jejich změny ve stáří korelují se sníženou odpovědí na vakcíny (7).
Dendritické buňky jsou profesionální antigen prezentující buňky (APC – antigen presenting cells) a slouží jako hlavní most mezi vrozenou a adaptivní imunitní odpovědí. Jejich primární funkcí je prezentace antigenů na MHC molekulách a poskytování kostimulačních signálů T lymfocytům, které jsou zásadní pro generování humorálních reakcí i pro přímé zprostředkování buněčné imunity (8). DC slouží jako dozor lokálního mikroprostředí, po zachycení antigenu migrují do lymfatických uzlin, kde předávají informace buňkám adaptivní imunity. DC buňky u starších dospělých mají sníženou expresi TLR receptorů (Toll‑like receptor) a tím sníženou odpovídavost na patogeny a produkci cytokinů.
NK buňky (natural killer cells, přirození zabíječi) jsou třídou přirozených cytotoxických buněk, které tvoří 5–15 % populace cirkulujících lymfocytů a hrají důležitou roli v časných imunitních reakcích. NK buňky jsou nezbytné v obraně organismu proti virovým infekcím, nádorům, ale také likvidaci senescentních buněk, čímž se podílejí na oddálení stárnoucího fenotypu imunitních a dalších tkáňových buněk. Většina funkčních změn ve starých NK buňkách může být spojena s fenotypovými posuny v subpopulacích. Snížení receptoru NKp30 a NKp46 (NKp – natural killer protein, aktivační receptory NK buněk) je spojeno se snížením výkonné funkce NK buněk u starších osob (9). NKp30 je zapojen také v regulační signalizaci s dendritickými buňkami, což by mohlo dále ovlivnit vývoj účinných adaptivních imunitních reakcí na infekci nebo očkování. Pokles normálních buněčných funkcí v kombinaci s produkcí zánětlivých cytokinů vážně ohrožuje schopnost DC koordinovat adaptivní odpověď u starších jedinců.
Změny v adaptivní imunitě
Dysregulace funkce v mnoha bodech životního cyklu B lymfocytů ovlivňuje jejich schopnost iniciovat primární nebo sekundární imunitní odpověď. Bylo prokázáno, že produkce B lymfocytů také s věkem klesá, a to je spojeno s útlumem vývoje progenitorových buněk v kostní dřeni. Snížená diverzita BCR (B cell receptor, receptor na B lymfocytech) v kombinaci s poškozenou funkcí B lymfocytů drasticky brání rozvoji ochranné humorální imunity v reakci na neznámé patogeny u starších osob. S věkem se mění poměr subpopulací B lymfocytů, kdy se zvyšuje počet autoreaktivních oproti efektorovým B lymfocytům. Funkční defekty B buněk jsou zapříčiněny somatickými hypermutacemi a izotopovým přesmykem, stejně jako sníženým počtem plazmatických buněk. To vše přispívá ke snížení tvorby protilátek po očkování (10).
Podobně dochází s věkem k výrazným změnám v zastoupení T lymfocytů kvůli poklesu krvetvorby a involuci thymu (Obr. 1). Atrofie thymu je způsobena na jedné straně snížením thymopoetických cytokinů a hormonů (IL-7, KGF – keratinocyte growth factor, růstový faktor keratinocytů), na druhé straně zvýšením thymosupresivních prozánětlivých cytokinů (IL-6, TNF‑α). Dramaticky snížený počet nově generovaných naivních T lymfocytů s věkem omezuje reakci na neo‑antigeny (nově se objevující patogeny). Naopak paměťové T lymfocyty opakovaně stimulované známými antigeny se hromadí jako vysoce diferencované T buňky (10).
Obr. 1. Změny v adaptivní imunitě ve stáří, upraveno podle (10). IL-7 – interleukin 7, KGF – keratinocyte growth factor, TNF-α – tumor necrosis factor α, IL-6 – interleukin 6. Mladí – do 60 let, staří – nad 60 let 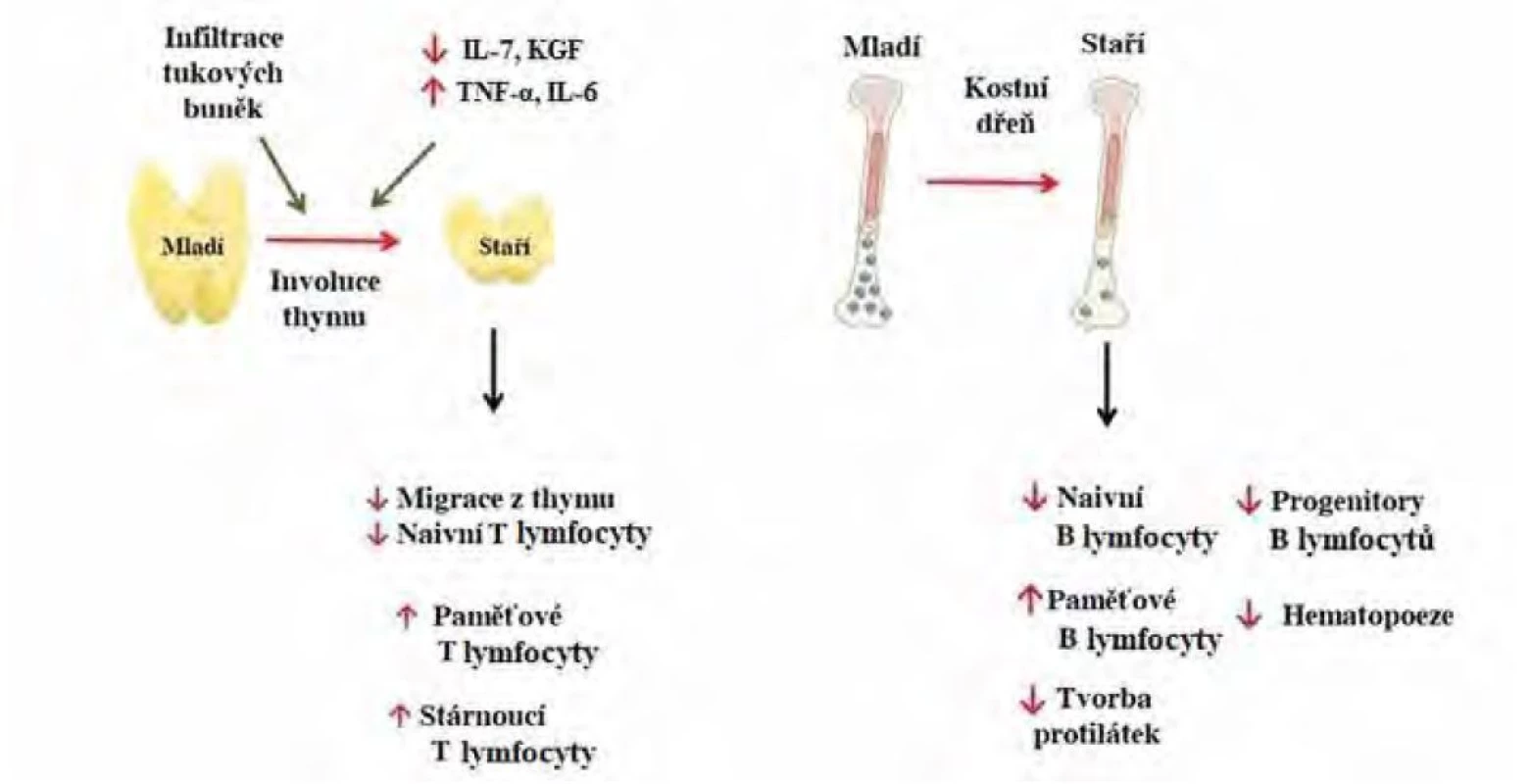
Jedním z charakteristických znaků imunosenescence T lymfocytů je ztráta kostimulačního receptoru CD28, který je rozhodující pro plnou aktivaci T lymfocytů a jeho snížená exprese je spojena s nedostatečnou imunitní odpovědí na infekce i očkování u starších osob. Při stárnutí dochází k postupné akumulaci vysoce diferencovaných paměťových T lymfocytů CD8+ TEM (TEM – effector memory T lymphocyte), které vykazují sníženou schopnost proliferace a zvýšenou cytotoxickou aktivitu (11). Progresivní akumulace terminálně diferencovaných paměťových buněk také ovlivňuje schopnost reagovat na podněty vyvolané infekcí nebo očkováním, protože tyto buňky vykazují sníženou reakci na nové antigeny (5).
Cytomegalovirus (CMV)
CMV je vysoce rozšířený β‑herpesvirus, který vytváří celoživotní persistenci po primární infekci. Perzistující CMV infekce má hluboký dopad na zastoupení a funkci T lymfocytů a NK buněk. Dlouhodobá perzistence specifické CMV‑pozitivity u starších osob vedla ke snížené imunitní reakci ve srovnání se séronegativními jedinci (3). Bylo také prokázáno, že chronická CMV infekce ovlivňuje paměť T lymfocytů, stimuluje oligoklonální expanzi CMV‑specifických paměťových CD8+ TEM lymfocytů. Tato inflace CMV‑specifickýchTEM lymfocytů na periferii neúměrně omezuje schopnost cirkulujících T lymfocytů reagovat na nové antigeny.
Zjištěná interakce mezi CMV a buněčnou imunitou může být podkladem pro využití CMV jako vektoru pro vakcíny další generace. Vakcíny vektorované CMV by zvýhodňovaly expanzi antigen‑specifických CD8+ TEM buněk, ale také dozrávání výkonných NK buněk spouštějících ADCC (antibody dependent cellular cytotoxicity, na protilátkách závislá buněčná cytotoxicita) (12).
Vakcíny
Po infekci nebo vakcinaci dochází k aktivaci buněk přirozené a diferenciaci a klonální expanzi patogen specifických buněk adaptivní imunity. Postupujícím věkem a setkáním s mnoha antigenními stimuly během života se vytváří převaha specifických paměťových T lymfocytů, které ve stáří převažují nad naivními T lymfocyty (Obr. 2).
Obr. 2. Imunitní odpověď na vakcíny, upraveno podle (7) 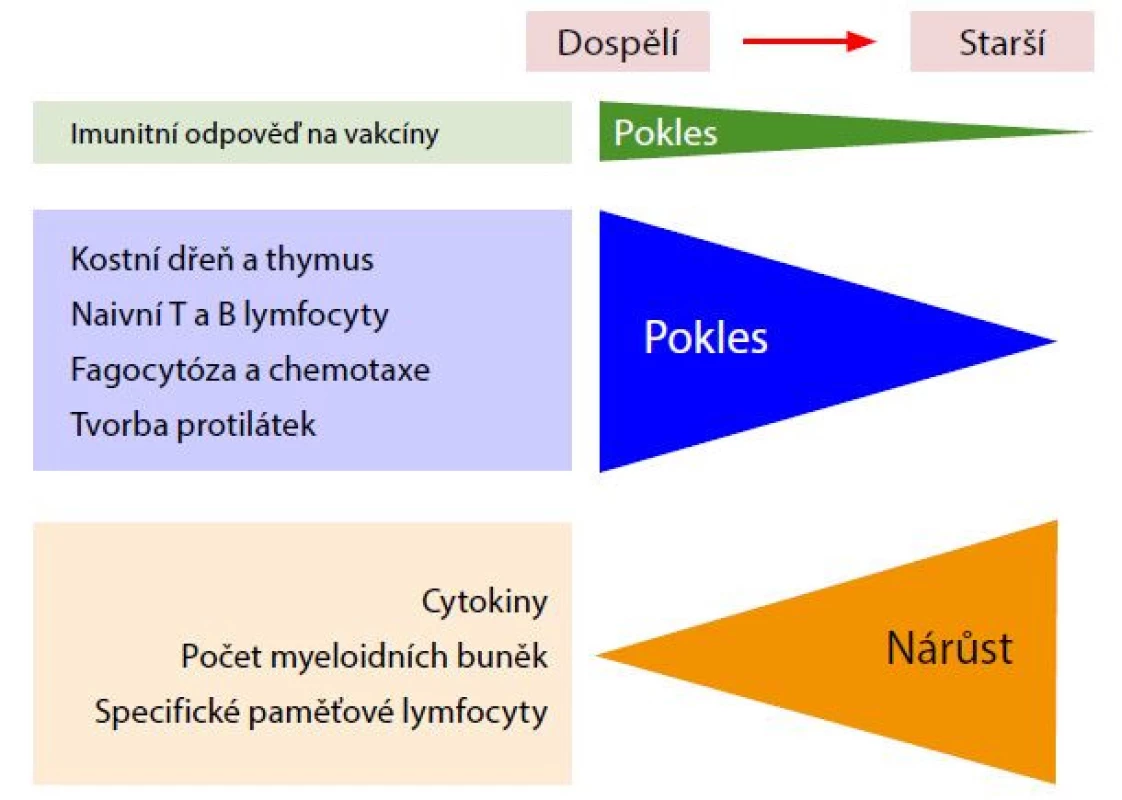
Imunitní odpověď na vakcínu je závislá na změnách spojených se stárnutím. Se stárnutím klesá jak přirozená, tak adaptivní imunitní reakce, což vede ke snížení reakcí na očkování. Imunosenescence zahrnuje involuci primárních lymfoidních orgánů (kostní dřeň a brzlík) s redukcí progenitorů B a T lymfocytů, nefunkčních paměťových buněk v důsledku chronické antigenní stimulace, sníženou funkcí fagocytárních buněk, se současným zvýšením hladin prozánětlivých cytokinů. Všechny tyto změny korelují s poklesem imunitní odpovědi na vakcinaci (7). Snížená funkce dendritických buněk, pomocných CD4 T lymfocytů a redukce B lymfocytů má za následek pokles tvorby protilátek a sníženou odpověď na vakcinaci. Dospělí – 18– 60 let, starší – nad 60 let. U starších lidí se uplatňuje mnoho dalších faktorů, které ovlivňují imunitní reakce na očkování. Základními komorbiditami jsou obezita, astma, cukrovka a chronická onemocnění srdce, jater nebo ledvin, ty jsou také spojeny s nižší imunitní odpovědí na očkování. Navíc byla identifikována interakce mezi humorální imunitní odpovědí na chřipku a střevním mikrobiomem (13).
Účinnost vakcíny např. při prvním setkání s pneumokokem po očkování byla v rizikové skupině snížena na 40,3 % ve srovnání s 66,7 % u zdravých probandů (14).
Chřipka a vakcinace
Virus chřipky (IFV – influenza virus) se přenáší přímým kontaktem, kapénkami a kontaminovanými předměty. Těžké formy onemocnění a smrtnost stoupají s věkem a jsou nejvyšší u osob nad 75 let. Bohužel účinnost v současnosti používaných vakcín proti chřipce dosahuje nejvíce 50 % a u starších jedinců pouze 30–50 % (7). S věkem titry specifických protilátek proti IFV klesají, vzhledem k poklesu paměťových B buněk a plazmocytů u starších osob ve srovnání s mladými i po opakovaném očkování. Buňkami zprostředkovaná imunita je důležitá pro boj s virem chřipky (např. produkce IFN‑γ a IL-10, Granzymu B) a může posílit klinickou ochranu (15). Staří lidé mají fixní repertoár paměťových B lymfocytů a postrádají adaptaci umožňující evoluci B lymfocytů proti různým kmenům IFV. V současnosti chřipkové vakcíny pro populaci starších lidí preferují (i) zvýšené množství antigenu, (ii) mukózní nebo intradermální aplikace a (iii) vývoj účinnějších adjuvancií (6).
Herpes zoster (HZ) a vakcinace
Primární infekce virem varicella‑zoster (VZV) se obvykle vyskytuje v dětství a projevuje se jako plané neštovice. Jako člen herpetických virů VZV zůstává celoživotně v lymfatických uzlinách. Pásový opar postihuje významnou část starší populace v důsledku oslabené imunity a reaktivaci VZV. Riziko rozvoje HZ se s věkem podstatně zvyšuje. Průměrný věk při nástupu je 59,4 let, přičemž 68 % případů se vyskytlo u lidí po 50. roce (16). Prevence HZ je proto důležitým cílem ke zlepšení kvality života starší populace a také pomáhá ulevit zdravotní péči a sociálnímu systému. Cílem očkování proti HZ je pomocí specifické vakcíny proti VZV obnovit buňkami zprostředkovanou imunitu, která byla generována během primární (dětské) fáze infekce. Proto u imunitní odpovědi vyvolané vakcinací jde hlavně o posílení paměťové reakce spíše než primární odpovědi.
Streptococcus pneumoniae a vakcinace
Pouze omezený počet sérotypů těchto grampozitivních diplokoků je patogenní. Incidence komunitní pneumonie s věkem dramaticky stoupá s odhadovaným výskytem od 18,2 na 1 000 osob/rok u lidí ve věku 65–69 let až do 52,3 na 1 000 osob/rok u osob starších 85 let (17). V této věkové skupině je nejčastěji izolovaným patogenem S. pneumoniae.
Bylo prokázáno, že starší dospělí mají nižší schopnost opsonizace bakterie pneumokoka, navzdory dostatečné koncentraci IgG. To je pravděpodobně způsobeno nedostatkem IgM protilátek s opsonizační funkcí, protože paměťové B lymfocyty produkující IgM s věkem klesají. Po očkování u starších lidí byl pozorován značný pokles opsonizujících protilátek po 6 letech, navzdory perzistenci protilátek IgG (18).
První vakcíny proti S. pneumoniae byly polysacharidové vakcíny (PPV – pneumokoková polysacharidová vakcína) obsahující purifikované bakteriální pouzdro. Aktuálně dostupná 23-valentní polysacharidová vakcína (PPV-23) byla schválena pro dospělé na začátku 80. let minulého století. Reakce B lymfocytů na polysacharidové antigeny je nezávislá na T lymfocytech a jako taková je schopna vyvolat výraznou imunitní odpověď. Vakcína PPV-23 není vhodná pro malé děti a je určena pouze pro dospělé. PPV-23 je tedy doporučena pro starší populaci (19).
Závěr
S věkem se vyvíjející defekty imunity přispívají ke snížení účinnosti vakcín u starší populace. Změny v genové regulaci nebo expresi zprostředkovávající fenotypové změny u mnoha typů buněk vedou ke změně buněčných funkcí a dysregulaci buněčné signalizace. Studie základních genetických a epigenetických mechanismů jsou potřebné a mají potenciál informovat o racionálním designu nových kandidátních vakcín, adjuvans nebo imunomodulačních terapeutik, které mohou u starších lidí stimulovat potřebnou imunitní reakci.
Ne každý reaguje na vakcíny stejným způsobem. Koncept personalizované vakcinace je podobný personalizované terapii u pacientů s rakovinou. Definování optimálního očkování (dávka, způsob podání, adjuvans atd.) pro každého jednotlivce se zdá být slibnou strategií k zajištění optimální ochrany s minimem vedlejších účinků. Nicméně, k dosažení tohoto cíle je ještě dlouhá cesta.
Stále existuje velký prostor pro zlepšení očkování starší populace. K tomu je zapotřebí nové vakcíny zaměřit na prevenci infekčních chorob způsobujících značnou nemocnost u starší populace, pro které nejsou zatím k dispozici žádné vakcíny. Vakcíny proti patogenům (např. Cl. difficile, S. aureus, Candida spp., E. coli) způsobující opakující se infekce jsou postupně vyvíjeny (5).
Protože hladiny protilátek u starších lidí klesají rychleji, některé země doporučují kratší intervaly pro několik rutinních vakcín (záškrt, tetanus, černý kašel, hepatitida B, klíšťová encefalitida) u starších dospělých (20).
Je třeba zvýšit povědomí o důležitosti očkování pro všechny věkové skupiny, čehož by bylo možné dosáhnout vzděláváním zdravotnického personálu a veřejně činných osob a zvyšováním zdravotní gramotnosti u široké veřejnosti.
Podpořeno MZ ČR – RVO (Endokrinologický ústav – EU, 00023761)
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Ivan Šterzl, CSc.
Endokrinologický ústav, Oddělení klinické imunoendokrinologie Národní 8, 110 00 Praha 1
Cit. zkr: Vnitř Lék 2021; 67(8): E14–E18
Článek přijat redakcí: 13. 9. 2021
Článek přijat po recenzích: 16. 11. 2021
Zdroje
1. United Nations, Department of Economic and Social Affairs, Population Division. World Population Prospects 2019: Highlights (ST/ESA/SER.A/423). United Nations: New York (NY) 2019. ISBN 978-92-1-148316-1.
2. Pereira B, Xu XN, Akbar AN. Targeting Inflammation and Immunosenescence to Improve Vaccine Responses in the Elderly. Front Immunol. 2020 Oct 14; 11 : 583019.
3. Wertheimer AM, Bennett MS, Park B et al. Aging and cytomegalovirus infection differentially and jointly affect distinct circulating T cell subsets in humans. J Immunol. 2014 Mar 1; 192(5): 2143–2155.
4. Xu W, Wong G, Hwang YY et al. The untwining of immunosenescence and aging. Semin Immunopathol. 2020 Oct; 42(5): 559–572.
5. Wagner A, Weinberger B. Vaccines to Prevent Infectious Diseases in the Older Population: Immunological Challenges and Future Perspectives. Front Immunol. 2020 Apr 23; 11 : 717.
6. Oh SJ, Lee JK, Shin OS. Aging and the Immune System: the Impact of Immunosenescence on Viral Infection, Immunity and Vaccine Immunogenicity. Immune Netw. 2019 Dec; 19(6): e37.
7. Ciabattini A, Nardini C, Santoro F et al. Vaccination in the elderly: The challenge of immune changes with aging. Semin Immunol. 2018 Dec; 40 : 83–94.
8. Mildner A, Jung S. Development and function of dendritic cell subsets. Immunity. 2014 May 15; 40(5): 642–656.
9. Almeida‑Oliveira A, Smith‑Carvalho M, Porto LC et al. Age‑related changes in natural killer cell receptors from childhood through old age. Hum Immunol. 2011 Apr; 72(4): 319–329.
10. Duggal NA. Reversing the immune ageing clock: lifestyle modifications and pharmacological interventions. Biogerontology. 2018 Dec; 19(6): 481–496.
11. Koch S, Larbi A, Derhovanessian E et al. Multiparameter flow cytometric analysis of CD4 and CD8 T cell subsets in young and old people. Immun Ageing. 2008 Jul 25; 5 : 6.
12. Goodier MR, Jonjić S, Riley EM et al. CMV and natural killer cells: shaping the response to vaccination. Eur J Immunol. 2018 Jan; 48(1): 50–65.
13. Oh JZ, Ravindran R, Chassaing B et al. TLR5-mediated sensing of gut microbiota is necessary for antibody responses to seasonal influenza vaccination. Immunity. 2014 Sep 18; 41(3): 478–492.
14. Suaya JA, Jiang Q, Scott DA et al. Post hoc analysis of the efficacy of the 13-valent pneumococcal conjugate vaccine against vaccine‑type community‑acquired pneumonia in at‑risk older adults. Vaccine. 2018 Mar 7; 36(11): 1477–1483.
15. Merani S, Kuchel GA, Kleppinger A et al. Influenza vaccinemediated protection in older adults: impact of influenza infection, cytomegalovirus serostatus and vaccine dosage. Exp Gerontol. 2018 Jul 1; 107 : 116–125.
16. Weinberg A, Lazar AA, Zerbe GO et al. Influence of age and nature of primary infection on varicella‑zoster virus‑specific cell‑mediated immune responses. J Infect, DiS. 2010 Apr 1; 201(7): 1024–1030.
17. Drijkoningen JJC, Rohde GGU. Pneumococcal infection in adults: burden of disease. Clin Microbiol Infect. 2014; 20 : 45–51.
18. MacIntyre CR, Ridda I, Trent MJ et al. Persistence of immunity to conjugate and polysaccharide pneumococcal vaccines in frail, hospitalised older adults in long‑term follow up. Vaccine. 2019 Aug 14; 37(35): 5016–5024.
19. Pollard AJ, Perrett KP, Beverley PC. Maintaining protection against invasive bacteria with protein‑polysaccharide conjugate vaccines. Nat Rev Immunol. 2009 Mar; 9(3): 213–220.
20. Weinberger B. Vaccines for the elderly: current use and future challenges. Immun Ageing. 2018 Jan 22; 15 : 3.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo E-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Imunitní odpověď na vakcinaci u starších lidí
- Tumorom indukovaná osteomalácia
- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Letálne prípady intoxikácie etylalkoholom: zamyslenie sa nad príčinami
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- 24hodinová mortalita seniorů akutně hospitalizovaných pro interní onemocnění – může být ovlivněna přítomností diabetu jako komorbidity?
- Přehled české literatury zaměřený na terminologii adherence k léčbě
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Tumorom indukovaná osteomalácia
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- Přehled české literatury zaměřený na terminologii adherence k léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



