-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasné názory na roli mírné hyperhomocysteinemie jako rizikového faktoru kardiovaskulárních chorob
Current opinions about the role of mild hyperhomocysteinaemia as a risk factor of cardiovascular diseases
Based on the available evidence, hyperhomocysteinaemia is an unquestionable and important risk factor in nearly all atherosclerotic and thrombotic vascular diseases. It is one of the newly classifi ed and researched factors that have been included in the latest Guidelines on cardiovascular diseases prevention in clinical practice. Pathophysiological mechanisms, by which hyperhomocysteinaemia impacts on the process of atherogenesis and thrombogenesis, have largely been explained in experimental and clinical studies. Hyperhomocysteinaemia is highly prevalent in the Czech population, similar to other populations with relatively low dietary folate intake. Replacement of folate alone or in combination with vitamin B12 and pyridoxine represents an inexpensive treatment option for mild hyperhomocysteinaemia and enables near normalization of homocystein levels. Hyperhomocysteinaemia used to be perceived as a causal risk factor and, based on observational studies, substitution with folate and other vitamins involved in methionine cycle had been recommended for many years as primary and secondary prevention of cardiovascular diseases. It was thus rather surprising that a randomised double blind placebo controlled study (NORVIT) confi rmed that substitution with folate and other B-group vitamins, used in secondary prevention, signifi cantly decreased homocysteine levels but had no effect on atherosclerotic vascular disease morbidity and mortality. These results challenged the hypothesis on causality of this risk factor. Consequently, hyperhomocysteinaemia is currently perceived more as a marker than the cause of the disease. Since further pharmacological studies of the effects of vitamin B intervention on mortality and morbidity are currently taking place, we need to wait for defi nitive evidence for causality of this risk factor before vitamin substitution is included in the Guidelines on cardiovascular disease prevention. Routine homocysteine levels’ testing is not currently recommended; it is indicated for the atherothrombotic processes for which clinical explanation of ethiopathogenesis is lacking following standard clinical and biochemical tests.
Keywors:
homocysteine – methionine cycle – vitamin B group – cardiovascular risk
Autoři: J. Šimon
Působiště autorů: Centrum preventivní kardiologie II. interní kliniky LF UK v Plzni
Vyšlo v časopise: Kardiol Rev Int Med 2009, 11(3): 129-133
Kategorie: Netradiční rizikové faktory kardiovaskulárních onemocnění
Souhrn
Hyperhomocysteinemie je na základě dostupné evidence nepochybným a významným rizikovým faktorem téměř všech aterosklerotických a trombotických vaskulárních chorob. Patří mezi nově zařazené a zkoumané rizikové faktory, které byly zařazeny do posledních Doporučených postupů pro prevenci kardiovaskulárních chorob v klinické praxi. Patofyziologické mechanizmy, jimiž hyperhomocysteinemie zasahuje do procesu aterogeneze a trombogeneze, byly většinou objasněny experimentálními i klinickými studiemi. Hyperhomocysteinemie je v české populaci vysoce prevalentní, podobně jako v jiných populacích vyznačujících se relativně nízkým příjmem folátů potravou. Substituce folátem samotným nebo v kombinaci s vitaminem B12 a pyridoxinem představuje levnou léčbu mírné hyperhomocysteinemie a umožňuje zvýšené hladiny homocysteinu prakticky znormalizovat. Hyperhomocysteinemie byla považována za kauzální rizikový faktor a na základě observačních studií byla substituce foláty a dalšími vitaminy zasahujícími do metioninového cyklu po řadu let běžně doporučována v primární i sekundární prevenci kardiovaskulárních chorob. Bylo proto spíše překvapením, když randomizovaná dvojitě slepá placebem kontrolovaná studie (NORVIT) prokázala, že substituce foláty a dalšími vitaminy skupiny B sice výrazně snížila hladiny homocysteinu, ale absolutně neovlivnila morbiditu a mortalitu na aterosklerotické vaskulární choroby v sekundární prevenci. Tím byla hypotéza o kauzalitě tohoto faktoru zpochybněna. Proto se soudí, že hyperhomocysteinemie je spíše markerem choroby. Protože dosud probíhají další farmakologické studie vlivu intervence vitaminy B na mortalitu a morbiditu, je nutno vyčkat definitivního důkazu kauzality tohoto faktoru, než zařadíme vitaminovou substituci do Doporučených postupů pro prevenci kardiovaskulárních chorob. Rutinní vyšetřování hladin homocysteinu se v současné době nedoporučuje a indikováno je u takových aterotrombotických procesů, pro něž chybí klinické vysvětlení etiopatogeneze na základě standardních klinických a biochemických testů.
Klíčová slova:
homocystein – metioninový cyklus – vitaminy skupiny B – kardiovaskulární rizikoÚvod
Přestože homocystein byl jako substance objeven již v padesátých letech, jako rizikový faktor kardiovaskulárních chorob má poměrně krátkou historii. První sporadické experimentální a klinické práce z šedesátých let vyvolaly pozornost snad pouze v úzkém kruhu biochemiků a genetiků. Zlom v problematice homocysteinu nastal v polovině devadesátých let, kdy byly poznatky základního výzkumu zkoumány z klinického hlediska. Zájem o problematiku homocysteinu byl ve vědecké obci stimulován natolik, že počet publikací stoupal geometrickou řadou. Zároveň se odborná kardiologická společnost ve vztahu k homocysteinu jako rizikovému faktoru vaskulárních chorob diverzifikovala, neboť překvapivě mnoho odborníků homocystein jako významný rizikový faktor buď zcela zavrhlo, nebo naopak nekriticky propagovalo. Toto sdělení je proto pokusem o kritické zhodnocení současných názorů.
Metabolické cesty homocysteinu a aterotrombotická vaskulární nemoc
Homocystein je aminokyselina popsaná poprvé v roce 1952 de Vigneaudem [1]. V plazmě se homocystein vyskytuje jako volný pouze asi v 10%, zbytek je vázán ve směsi disulfidů, homocystinu a homocystein cysteinu. Pro praktické potřeby se udává hladina celkového homocysteinu (tHcy), tedy hladina po redukci a uvolnění z popsaných sloučenin. Homocystein je v těle syntetizován metioninovým cyklem, který je součástí degradačního systému aminokyselin s obsahem síry (obr. 1). Metionin je esenciální aminokyselinou obsaženou zejména v živočišných bílkovinách. Homocystein je v metioninovém cyklu buď spolupřítomností vitaminu B12 (cobalaminu) zpětně remetylován enzymem metionin syntázou, kde jako donátor metylové skupiny působí folát (kyselina listová) a pyridoxin, nebo degradován transsulfurační dráhou na cystation a cystein, a to enzymem cystationin-β-syntázou (CBS), za spolupřítomnosti vitaminu B6 [2].
Obr. 1. Metioninový cyklus [2]. ![Metioninový cyklus [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cb75d8114cd84af67167883faa43a3f7.png)
Do klinického povědomí se tHcy dostal poprvé v roce 1962, kdy byl v Severním Irsku popsán soubor 38 dětí s vrozeným metabolickým omylem – homocystinurií, tedy vylučováním homocystinu močí. Jedná se o autozomálně recesivně dědičné onemocnění, způsobené defektem CBS v játrech, projevující se extrémně vysokými plazmatickými hladinami tHcy, více než 500 µmol/l. Tyto děti byly jednak mentálně retardovány, celkovým vzezřením připomínaly Marfanův syndrom a již v raném věku měly pokročilé aterosklerotické změny na tepnách, trpěly na opakované trombózy a ve vysokém procentu umíraly do 20 let na akutní vaskulární příhodu, obvykle na infarkt myokardu, mozkovou mrtvici nebo plicní embólii. V extremním případě došlo k úmrtí tříletého chlapce na intrakraniální, žilní i tepennou trombózu [3]. Typický vzhled těchto dětí ukazuje obr. 2.
Obr. 2. Somatotyp dětí s homocysteinurií. 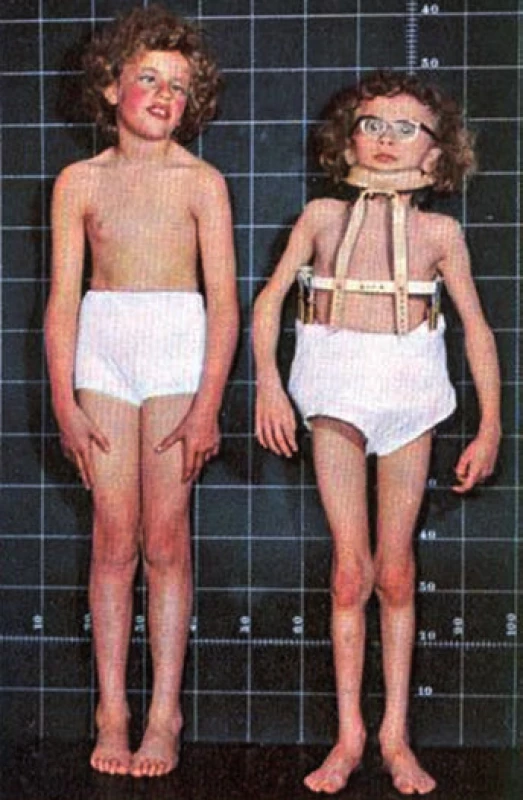
Kromě výše zmíněné těžké hyperhomocysteinemie vedoucí k homocystinurii působí i mírně zvýšené hladiny homocysteinu v plazmě negativně na kardiovaskulární systém. Za mírnou hyperhomocysteinemii (MHHcy) považujeme hladiny tHcy v rozmezí 15–30, vzácně 30–70 µmol/l. Arbitrální hranice normálních hladin celkového homocysteinu v krvi, rozsah hladin pro MHHcy a hladiny označované jako těžká hyperhomocysteinemie jsou uváděny následovně:
- normální hladina tHcy < 15 µmol/l,
- mírné zvýšení tHcy 15–30 µmol/l,
- střední zvýšení tHcy 31–100 µmol/l,
- velké zvýšení tHcy > 100 µmol/l.
U homocysteinurie, tj. u výše uvedeného dědičného defektu, jsou hladiny Hcy v krvi většinou vyšší než 500 µmol/l.
Etiologie MHHcy je multifaktoriální. Uplatňují se koreláty genetických, metabolických a vnějších faktorů, především některé enzymatické defekty. Jedním z nich je porucha transsulfurační dráhy (obr. 1). Zde je homocystein kondenzován se serinem na cystation. Tato pyridoxin dependentní, irreverzibilní reakce je katalyzována enzymem cystationin-b-syntázou (CBS). Prokázána byla vrozená heterozygotní deficience tohoto enzymu. Poměrně dobře objasněná je porucha remetylační dráhy homocysteinu. Dárcem metylové skupiny pro B12 dependentní konverzi Hcy na metionin je 5 metylentetrahydrofolát, který je syntetizován z 5,10 metylentetrahydrofolátu. Klíčovým enzymem této syntézy je metylentetrahydrofolát reduktáza (MTHFR). Objevena byla termolabilní forma MTHFR se sníženou metabolickou aktivitou, charakterizovaná záměnou cytozinu za tymin (C677T). Tato autozomálně recesivní mutace byla nalezena asi u 17% pacientů s ICHS (a v populaci u cca 5% [4], podle jiné práce dokonce u 12% [5]). Je zajímavé, že druhá dosti častá mutace genu pro tento enzym A1298C hladiny tHcy nijak neovlivňuje, přestože je rovněž spojena se sníženou aktivitou enzymu. Tato genetická složka mírné hyperhomocysteinemie se může exprimovat již v mladém věku. Homocystein je vyšší u mužů než u žen a stoupá poměrně kontinuálně s věkem [6]. Ve velké populačně zaměřené Hordalanské studii vykazovali muži o asi 1,5 µmol/l vyšší tHcy než ženy, stejný rozdíl byl nalezen mezi věkovou skupinou 40–42 a 65–67 let u obou pohlaví. Vliv věku a pohlaví potvrdily konzistentně takřka všechny epidemiologické studie [5,7].
Z faktorů vnějšího prostředí je pravděpodobně nejdůležitějším kofaktorem hladin tHcy plazmatická hladina folátu, což vyplývá z metabolické dráhy homocysteinu. Protože plazmatické hladiny folátu reflektují jeho nutriční příjem, je toto zdrojem výrazné mezipopulační variability v prevalenci MHHcy. Tak např. v české populaci (která je typickým příkladem populace s nízkým příjmem folátu) činila průměrná hladina tHcy u mužů a žen 12,5 a 11,2 µmol/l [6], zatímco ve studii NHANES III americké populace 9,6 a 7,9 µmol/l [7]. Podobně průměrné hladiny tHcy v souboru pacientů po akutní koronární příhodě v Severním Irsku (s podobnými nutričními zvyklostmi jako v ČR) činily 14,7 µmol/l [8], zatímco v populační studii ve Francii, kde je vyšší nutriční příjem folátů, byly hladiny tHcy 12,9 µmol/ [9].
Dalším důležitým kofaktorem remetylace homocysteinu je také vitamin B12. Nečetné práce popisují hladiny homocysteinu u vegetariánů (resp. veganů). Tyto osoby s nutriční deficiencí B12, danou vyloučením masných výrobků, vykazovaly významně vyšší průměrné hladiny tHcy než osoby se standardními nutričními návyky. Prevalence MHHcy činila v těchto pracích 5–16% u osob se standardní nutricí, 29–38% u lactoovovegetariánů a 53–67% u veganů [10]. Vysoké hodnoty byly nalezeny také u pacientů s renálním selháním či nefrotickým syndromem. Hladiny tHcy se zvyšují při poklesu glomerulární filtrace a korelují se stupněm snížení clearance kreatininu či markerů renální insuficience. Dochází totiž k poruše v metabolizmu aminokyselin, zvláště pak renální exkrece sulfoaminokyselin, resp. jejich degradačních produktů [11].
Homocystein může být také zvýšen vedlejšími účinky některých farmak. Jeho vzestup byl prokázán např. u cytostatik typu antagonistů folátového cyklu, např. metotrexátu či antagonistů pyridoxinu (6-azauridin triacetát), nitrátů a antiepileptik [2]. Z kardiologického hlediska má však zřejmě největší význam hyperhomocysteinemie navozená fibráty, které ovlivňují agonisty PPARγ (Peroxisome Proliferator Aactivated Receptor). Příčina tohoto jevu nebyla prozatím objasněna, ale pravděpodobně nukleární receptory PPARγ ovlivňují mnohočetné metabolické funkce. Vzestup tHcy po léčbě nebyl nalezen u myší s deficiencí PPARγ oproti kontrolní skupině [12]. Účinek na tHcy byl rovněž v klinických studiích prokázán pouze u fibrátů typu PPARγ agonistů [13–14], ale naopak se neprojevoval u gemfibrozilu, který působí zcela odlišným, na PPARγ nezávislým mechanizmem [15]. Fenofibrát zvyšoval hladiny tHcy v průměru o 35–46%, bezafibrát o 17–19% a ciprofibrát o 57%, gemfibrozil a rovněž některé zkoumané statiny (atorvastatin, fluvastatin) vykazovaly neutrální efekt [14].
Klinický význam tohoto nežádoucího účinku léčby fibráty může být významný. Proaterogenní a protrombogenní jevy provázející vzestup tHcy mohou potenciálně snižovat nebo vyrušit benefit vyplývající z hypolipidemického účinku léčby. To může být jedním z důvodů, proč se v některých velkých randomizovaných studiích s fibráty nepodařilo významně ovlivnit kardiovaskulární mortalitu [16–17].
Patofyziologický mechanizmus tHcy v etio-logii vaskulárních chorob je komplexní a mnohostranný. Jedním ze základních mechanizmů je prooxidativní působení dané jeho schopností autooxidace. Reaktivní oxidovaná species přímo toxicky působí na tepenný endotel, což vede k jeho mechanické destrukci či k funkční poruše lokální homeostázy endotelu, tj. endoteliální dysfunkci, která je jedním z prvních stadií aterosklerózy. Homocystein tedy působí na rozvoj aterosklerózy podobným patofyziologickým mechanizmem jako kouření [18].
Homocystein působí proaterogenně i v dalších stadiích rozvoje sklerotického plátu. Oxidativní stres provázející zvýšené hladiny tHcy působí vznik oxidovaných LDL částic. Ty jsou zachycovány systémem monocyt makrofág, což je jeden z prvních kroků vzniku pěnové buňky. Experimentální práce prokázaly i účinek homocysteinu na adhezi monocytu na endotel a jejich migraci do cévní stěny, migraci buněk hladké svaloviny do tvořícího se sklerotického plátu, a to cestou ovlivnění celé řady chemokinů, interleukinů a adhezivních molekul (MCP-1, IL 8, e-selectin, VCAM 1, NF-kappaB) [19–20].
Dalším známým vaskulární účinkem homocysteinu je prokoagulační působení. Ovlivňuje funkce trombocytů, mezi prokázané mechanizmy patří zvýšená ADP dependentní agregace, adhezivita a přežívání trombocytů. Řada studií prokázala vliv i na koagulační kaskádu, a to jak koagulační faktory, tak i jejich přirozené antagonisty: faktory V, VII a XII (antitrombin III), trombomodulin, aktivovaný protein C a tPa [21–22].
Epidemiologie mírné hyperhomocysteinemie a možnosti ovlivnění hladin homocysteinu
Význam tHcy v etiologii vaskulárních chorob potvrzuje řada retrospektivních i prospektivních studií, včetně mortalitních. Z těch retrospektivních je třeba zmínit velkou evropskou studii ECAP, která studovala relativní koronární riziko jednak tHcy samotného, a dále pak v kombinaci s ostatními rizikovými faktory. Bylo zjištěno, že riziko dané hyperhomocysteinemií několikanásobně stoupá za přítomnosti hypertenze či kouření [8]. Podobné výsledky dalo např. i naše vlastní pozorování na české populaci [6] a celá řada dalších retrospektivních studií. Meta analýzu 27 těchto studií (24 retrospektivních a tří prospektivních) provedl Boushey [23]. Nárůst relativního rizika ICHS o 60% u mužů a 80% u žen svědčil pro možnou kauzalitu tHcy pro vaskulární onemocnění. Zvýšení tHcy o 5 µmol podobně zvýšilo o 50% riziko cerebrovaskulární nemoci. Tato meta analýza stanovila, že MHHcy přispívá k celkovému populačnímu riziku ICHS asi 10%.
Pacienti s ICHS a tHcy 15–19,9 µmol/l či přes 20 µmol/l měli riziko úmrtí 3,8krát či až 6,2krát vyšší než pacienti s tHcy nižším než 9,0 µmol/l. Podobné výsledky dala i analýza Framinghamské kohorty, tHcy vyšší než 14,26 µmol/l byl spojen s více než 2,1krát vyšším rizikem celkové i kardiovaskulární mortality [24–25].
Také meta analýza Clarkea et al z roku 2005 prokázala, že vzestup tHcy o 5 µmol/l je spojen s 42% vzestupem rizika ICHS při analýze retrospektivních studií, respektive 32% nárůstem při analýze prospektivních studií [26].
Homocystein je rizikovým faktorem aterosklerózy i jiného než koronárního řečiště. Výše zmíněná studie ECAP zahrnovala kromě jiného též 156 pacientů s ischemickou chorobou dolních končetin (ICHDK). Relativní riziko ICHDK bylo v této studii 1,7krát vyšší pro pacienty v nejvyšším kvintilu tHcy při srovnání s nejnižším. Identicky ovlivňuje homocystein i cerebrální řečiště, meta analýza zjistila u MHHcy 59% nárůst rizika iktů, a to jak při analýze retrospektivních, tak i prospektivních studií [27].
Vzhledem k svému prokoagulačnímu působení je homocystein rovněž přinejmenším potenciálním rizikovým faktorem žilní tromboembolické choroby. Retrospektivní studie této asociace jsou sice méně konzistentní než v případě aterosklerotického postižení tepen (což je dáno pravděpodobně obtížnější definovatelností onemocnění), jejich meta analýza však prokázala, že MMHcy signifikantně zvyšuje riziko žilní trombózy asi 2,5krát. Bylo zjištěno, že koncentrace tHcy > 17,25 µmol/l byla spojena s 3,4krát vyšším rizikem idiopatické žilní trombózy. Termolabilní mutace MTHFR (jako vedoucí genetická příčina MHHcy) byla spojena s 60% nárůstem rizika hluboké žilní trombózy a plicní embolizace.
Mírná hyperhomocysteinemie a průkaz kauzality faktoru
Observační studie tedy prokázaly, že MHHcy je nepochybným a významným rizikovým faktorem pro všechny formy aterosklerotické vaskulární nemoci. Prokázalo se také mnohými studiemi, že hladinu tHcy je možno výrazně snížit a normalizovat suplementací foláty, ať už samotnými, nebo v kombinaci s dalšími vitaminy skupiny B, tj. B12 a pyridoxinu.
Zbývalo tedy dokázat kauzalitu Hcy v patogenezi kardiovaskulárních chorob randomizovanými dvojitě slepými intervenčními pokusy. Většina prací uveřejněných do roku 2006 považovala kauzalitu MHHcy za dostatečně prokázanou. Protože vitaminová substituce nebyla považována za komerčně atraktivní, tak aby bylo investováno do randomizovaného epidemiologického intervenčního pokusu za podpory farmaceutického průmyslu, čekali jsme až do roku 2006. Byly uveřejněny výsledky studie NORVIT [28]. Šlo o sekundárně preventivní intervenční pokus u 3 749 pacientů, mužů i žen, kteří prodělali akutní infarkt myokardu. Byli léčeni kombinací 0,8mg kys. listové, 0,4mg vitaminu B12 a 40mg pyridoxinu. Oproti skupině, která dostávala placebo, se hladina tHcy snížila o 27%, nicméně toto snížení hladin tHcy nemělo žádaný efekt na snížení rekurence infarktu myokardu, mozkové mrtvice nebo náhlé smrti. Závěr byl jednoznačný, vitaminová substituce, přesto, že snížila hladiny tHcy, neovlivnila morbiditu ani mortalitu na ischemickou chorobu srdeční. Závěrem bylo poučení, že léčba vitaminy skupiny B není indikována v sekundární prevenci ICHS. Nebylo jistě náhodou, že takto nepochybně komerčně málo perspektivní studie se realizovala v Norsku, proslulém velkými státními investicemi do epidemiologie a prevence chorob.
Přestože v současné době převažuje skepse o významu vitaminové substituce ke snížení hladin tHcy, jsou negativní data studie NORVIT dále ověřována a od roku 2006 následovala řada dalších intervenčních pokusů, z nichž některé dosud probíhají. Očekává se výsledek francouzské studie SU.FOL.OM3 [29]. Je to opět sekundárně preventivní studie u 2 501 pacientů po infarktu myokardu, u nichž se testuje účinnost suplementace foláty v kombinaci s vitaminem B12 a pyridoxinem oproti placebu. Probíhá také studie účinnosti vitaminů B snižujících hladiny tHcy k prevenci mozkové mrtvice VITATOPS (VITAmins TO Prevent Stroke trial). Zatím bylo randomizováno asi 8 000 nemocných po centrální mozkové příhodě. Ve výstupech se sleduje také výskyt infarktu myokardu a mortalita na ICHS [30]. V současné době tedy převládá názor, že hyperhomocysteinemie, i když se výrazně podílí na aterogenezi a trombogenezi, je spíše markerem choroby než kauzálním rizikovým faktorem. Intenzivně se studují genetické determinanty mírné hyperhomocysteinemie, zejména polymorfizmy MTHFR C677T a 1298AA [31].
Závěr
Závěrem možno konstatovat, že není doposud dostatečná evidence efektu folátů a dalších vitaminů skupiny B snižujících hladiny homocysteinu v sekundární prevenci aterosklerotické vaskulární nemoci. Není také evidence, zda je suplementace foláty účinná v primární prevenci kardiovaskulárních chorob. Preventivní účinek vitaminové substituce v těhotenství ke snížení rozštěpových vad páteře u novorozenců byl dostatečně prokázán [32]. Randomizovaná placebem kontrolovaná primárně preventivní studie u aterosklerotické vaskulární nemoci je prakticky zcela neproveditelná. Také přirozená konzumace potravin s vysokým obsahem folátů se výrazně liší jak u individuí, tak i mezi populacemi. Proto se v některých státech (USA, Kanada, Maďarsko) zavedla fortifikace mouky foláty. Jsou určité doklady, že v těchto státech klesla incidence ischemických mozkových příhod [33–34]. Rozřešení otázky kauzality homocysteinu bude vyžadovat řadu dalších studií a je třeba nečinit ukvapené závěry. Ostatně vzpomeňme, že přijetí cholesterolu jako kauzálního rizikového faktoru kardiovaskulárních chorob trvalo řadu desetiletí od prvních studií Aničkova.
Doručeno do redakce 8. 6. 2009
Přijato po recenzi 10. 7. 2009
prof. MUDr. Jaroslav Šimon, DrSc., FESC, emer.
Centrum preventivní kardiologie II. interní kliniky LF UK v Plzni
Jaroslav.Simon@lfp.cuni.cz
Zdroje
1. du Vigneaud VE. A trail of research in sulfur chemistry and metabolism, and related fields. Ithaca: Cornell University Press 1952.
2. Robinson K, Mayer E, Jacobsen DW. Homocysteine and coronary artery disease. Cleve Clin J Med 1994; 61 : 438–450.
3. Carson NA, Neill DW. Metabolic abnormalities detected in a survey of mentally backward individuals in Northern Ireland. Arch Dis Child 1962; 32 : 505–513.
4. Meisel C, Cascorbi I, Gerloff T et al. Identification of six methylenetetrahydrofolate reductase (MTHFR) genotypes resulting from common polymorphisms: impact on plasma homocysteine levels and development of coronary artery disease. Atherosclerosis 2001; 154 : 651–655.
5. Nygård O, Vollset SE, Refsum HM. Total plasma homocysteine and cardiovascular risk profile. The Hordaland Homocysteine Study. JAMA 1995; 274 : 1526–1533.
6. Frosst P, Blom HJ, Milos R et al. A candidate genetic risk factor for vascular disease: a common mutation in methylentetrahydrofolate reductase. Nat Genet 1995; 10 : 111–113.
7. Mayer O jr, Šimon J, Rosolová H et al. The effect of homocysteine on the coronary risk. Cor Vasa 1999; 41 : 16–19.
8. Jacques PF, Rosenberg IH, Rogers G et al. Serum total homocysteine concentrations in adolescent and adult Americans: results from the third National Health and Nutrition Examination Survey (NHANES III). Am J Clin Nut 1993; 3 : 482–489.
9. Graham IM, Daly EL, Refsum HM et al. Plasma homocysteine as a risk factor for vascular disease. JAMA 1997; 277 : 1775–1781.
10. Mallinow MR, Ducimetiere P, Luc G et al. Plasma homocysteine levels and graded risk for myocardial infarction: finding in two populations at contrasting risk for coronary heart disease. Atherosclerosis 1996; 126 : 27–34.
11. Krajčovičová-Kudláčková M, Blažíček P, Kopcova J et al. Homocysteine levels in vegetarians versus omnivores. Ann Nutr Metab 2000; 44 : 135–138.
12. Chaveau P, Chadefaux B, Coude M et al. Hyperhomocysteinemia, a risk factor for atherosclerosis in chronic uremic patients. Kidney Int 1993; 43 (Suppl 41): 72–77.
13. Dierkes J, Westphal S, Luley C. Serum homocysteine increases after therapy with fenofibrate or bezafibrate. Lancet 1999; 354 : 219–220.
14. Jonkers IJ, de Man FH, Onkenhout W et al. Implication of fibrate therapy for homocysteine. Lancet 1999; 354 : 1208.
15. Westphal S, Dierkes J, Luley C. Effect of fenofibrate and gemfibrozil on plasma homocysteine. Lancet 2001; 358 : 39–40.
16. Mayer O jr, Šimon J, Holubec L et al. The fenofibrate‑induced hyperhomocysteinemia may be prevented by folate co-administration. Eur J Clin Pharm 2003; 59 : 367–371.
17. Meade T, Zuhrie R, Cook C et al. Bezafibrate in men with lower remity arterial disease: randomised controlled trial. BMJ 2002; 325 : 1139–1141.
18. Ericsson CG, Nilsson J, Grip L et al. Effect of bezafibrate treatment over five years on coronary plaques causing 20% to 50% diameter narrowing. The Bezafibrate Coronary Atherosclerosis Intervention Trial (BECAIT). Am J Cardiol 1997; 80 : 1125–1129.
19. Kanani MP, Sinkey CA, Browning RL et al. Role of oxidant stress in endothelial dysfunction produced by experimental hyperhomocysteinemia in humans. Circulation 1999; 100 : 1161–1168.
20. Zeng X, Dai J, Remick DG et al. Homocysteine mediated expression and secretion of monocyte chemoattractant protein‑1 and interleukin‑8 in human monocytes. Circ Res 2003; 93 : 311–320.
21. Wang G, Siow YL, O K. Homocysteine induces monocyte chemoattractant protein‑1 expression by activating NF-kappaB in THP-1 macrophages. Am J Physiol Heart Circ Physiol 2001; 280: H2840–H2847.
22. Silverman MD, Tumuluri RJ, Davis M et al. Homocysteine upregulates vascular cell adhesion molecule‑1 expression in cultured human aortic endothelial cells and enhances monocyte adhesion. Arterioscler Thromb Vasc Biol 2002; 22 : 587–592.
23. Stangl V, Gunther C, Jarrin A et al. Homocysteine inhibits TNF‑alpha‑induced endothelial adhesion molecule expression and monocyte adhesion via nuclear factor-kappaB dependent pathway. Biochem Biophys Res Commun 2001; 280 : 1093–100.
24. Homocysteine Lowering Trialists‘ Collaboration. Lowering blood homocysteine with folic acid based supplements: meta‑analysis of randomised trials. BMJ 1998; 316 : 894–898.
25. Boushey CJ, Beresford SA, Omenn GS et al. A quantitative assesment of plasma homocysteine as a risk factor for vascular disease. Probable benefits of increasing folic acid intakes. JAMA 1995; 274 : 1049–1057.
26. Bostom AG, Silbershatz H, Rosenberg IH et al. Nonfasting plasma total homocysteine levels and all‑cause and cardivascular disease mortality in elderly Framingham men and women. Arch Intern Med 1999; 159 : 1077–1080.
27. Clarke B. Homocysteine‑lowering trials for prevention of heart disease and stroke. Semin Vasc Med 2005; 5 : 215–222.
28. Casais P, Alberto MF, Salviú MJ et al. Pilot study of homocysteine and cysteine in patients with thrombosis in different vascular sites. Epidemiology and response to folate. Thromb Res 2009; 123 : 592–596.
29. Bønaa KH, Njølstad I, Ueland PH et al. Homocysteine lowering and cardiovascular events after acute myocardial infarction (NORVIT Trial). N Engl J Med 2006; 354 : 1578–1588.
30. Galan P, Biancon SB, Blacher J et al. The SU.FOL.OOM3 Study: a secondary prevention trial testing the impact of supplementation with folate and B‑vitamins and/or Omega‑3 PUFA on fatal and non fatal cardiovascular events, design of a randomised trial of vitamin B, methods and participants characteristics. Trials 2008; 9 : 9–35.
31. VITATOPS Trial Study Group. Hankey GJ, Algra A,Chen C, Wong MC et al. VITATOPS, the VITAmins TO prevent stroke trial: rationale and design of a randomised trial of B‑vitamin therapy in patients with recent transient ischaemic attack or stroke (NCT00097 669) (ISRCTN74743444). Int J Stroke 2007; 2 : 144–150.
32. Khandanpour N, Willis G, Meyer FJ et al. Peripheral arterial disease and methylene tatrahydrofolate reductase (MTHFR) C677T mutations: A case‑control study and meta‑analysis. J Vasc Surg 2009; 49 : 711–718.
33. Selhub J. Public health signifcance of elevated homocysteine. Food Nutr Bull 2008; 29 (Suppl 2): S116–S125.
34. Pfeiffer CM, Caudilli SP, Gunter EW et al. Biochemical indicators of B-vitamin status in the US population after folic acid fortification: results from the National Health and Nutrition Examination Survey 1999–2000. Am J Clin Nutr 2005; 82 : 442–450.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Změny počasí a naše srdceČlánek Koronární příhody a zánětČlánek Holterova monitorace EKGČlánek Galerie autorů
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2009 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Změny počasí a naše srdce
- Vývoj prognostického skóre u pacientů s chronickým kardiorenálním syndromem
- Kardiovaskulární rizikové faktory u chronického selhání ledvin
- Jak ovlivňují diabetes mellitus 2. typu a zvýšená glykemie kardiovaskulární riziko?
- Kyselina močová a kardiorenální riziko
- Současné názory na roli mírné hyperhomocysteinemie jako rizikového faktoru kardiovaskulárních chorob
- HRT a kardiovaskulární riziko
- Koronární příhody a zánět
- Katetrizační implantace aortální chlopně
- Holterova monitorace EKG
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Změny počasí a naše srdce
- Holterova monitorace EKG
- Současné názory na roli mírné hyperhomocysteinemie jako rizikového faktoru kardiovaskulárních chorob
- Kyselina močová a kardiorenální riziko
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



