-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapeutické možnosti u aktinické keratózy a dlaždicobuněčného carcinoma in situ
Therapeutic Options for Actinic Keratoses and Squamous Cell Carcinoma in Situ
Actinic keratoses (AK) are the most common precancerous lesions in the white Caucasian population due to long - -term exposure to ultraviolet (UV) radiation. Observations indicate its possible development into invasive cutaneous squamous cell carcinoma (cSCC). About 60–70% of invasive cSCC arises in pre-existing AK. Bowen's disease, bowenoid papulosis together with intraepithelial neoplasias (erythroplasia Queyrat), including penile vulvar and anal intraepithelial neoplasias, are classified as a group of squamous cell carcinomas in situ (Cis). Number of risk factors, especially UV radiation, chronic inflammation and infections with high-risk oncogenic HPV types 16 and 18, contribute to the etiology of Cis. Dermatoscopy, which is a highly sensitive, reliable, rapid and non-invasive diagnostic method, plays an important role in the diagnosis of AK. AK and Cis therapy can be divided into treatment focused on individual lesions (so-called lesion-directed therapy – e.g. cryotherapy, curettage, electrodesication, shave excision) or treatment focused on large areas (so-called field-directed therapy – e.g. 5 fluorouracil, imiquimod, ingenol mebutate, diclofenac sodium, photodynamic therapy).
Keywords:
Actinic keratosis – carcinoma in situ – dermatoscopy – Bowen’s disease – bowenoid papulosis – erythroplasia of Queyrat – penile intraepithelial neoplasia – vulvar intraepithelial neoplasia – high-grade squamous intraepithelial lesions – chemoprevention – lesion-directed therapy – field-directed therapy
Autoři: M. Pásek 1
Působiště autorů: Dermatovenerologická klinika 3. LF UK a FNKV, Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA, FCMA 1
Vyšlo v časopise: Čes-slov Derm, 96, 2021, No. 5, p. 207-220
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Aktinické keratózy (AK) představují u bílé kavkazské populace nejčastěji se vyskytující prekancerózy, které vznikají v důsledku dlouhodobé expozice ultrafialovému záření (UV). Pozorování ukazují na její možný vývoj do invazivního dlaždicobuněčného karcinomu kůže (cSCC). Kolem 60–70 % invazivních cSCC vzniká na podkladě preexistující AK. Morbus Bowen, bowenoidní papulóza společně s intraepiteliálními neoplaziemi (erythroplasia Queyrat), zahrnujícími penilní vulvární a anální intraepiteliální neoplazie, jsou řazeny do skupiny dlaždicobuněčného carcinoma in situ (Cis). Na etiologii Cis se přitom podílí celá řada rizikových faktorů, především UV záření, chronický zánět a infekce vysoce rizikovými onkogenními HPV typ 16 a 18. V diagnostice AK hraje důležitou roli dermatoskopie, která představuje vysoce senzitivní, spolehlivou, rychlou a neinvazivní diagnostickou metodu. Terapii AK a Cis můžeme rozdělit na léčbu zaměřenou na jednotlivé léze (tzv. „lesion-directed therapy“ – např. kryoterapie, kyretáž a elektrodesikace, tangenciální „shave“ excize) anebo na léčbu zaměřenou na plošné ošetření „chorobného pole“ (tzv. „field-directed therapy“ – např. 5 fluorouracil, imiquimod, ingenol mebutát, diklofenak sodný, fotodynamická terapie).
Klíčová slova:
dermatoskopie – aktinická keratóza – morbus Bowen – carcinoma in situ – erythroplasia Queyrat – bowenoidní papulóza – penilní intraepiteliální neoplazie – vulvární intraepiteliální neoplazie – „high-grade“ skvamózní intraepiteliální léze – chemoprevence – „lesion directed therapy“ – „field directed therapy“
ÚVOD
Aktinické keratózy (AK) a dlaždicobuněčný carcinoma in situ (Cis) patří mezi velice časté klinické jednotky každodenní praxe, jejichž histologické známky se nachází přibližně u 60–70 % invazivních dlaždicobuněčných karcinomů kůže [20]. Je proto nutné AK a Cis v klinické praxi nepodceňovat, včasně diagnostikovat a léčit. V případě Cis se setkáváme s různými klinickými variantami v závislosti na anatomické lokalitě: morbus Bowen postihuje oblast na hlavě, krku, trupu a končetinách, bowenoidní papulóza a erytroplazie Queyrat oblast anogenitální. U Cis byl prokázán postupný přechod do invazivního dlaždicobuněčného karcinomu kůže (cSCC). V případě AK může rovněž dojít ke vzniku invazivního cSCC anebo naopak ke spontánní regresi, avšak s vysokou mírou lokální recidivy.
AKTINICKÁ KERATÓZA
Aktinická keratóza (AK) je definována jako proliferace atypických keratinocytů epidermis vznikající na podkladě dlouhodobé expozice ultrafialovému (UV) záření. Klinicky se manifestuje jako světle růžová makula, nebo plochá papula až plak různé velikosti (většinou 2–5 mm) na povrchu s šupinami, případně lpějící hyperkeratózou. V těchto případech je klinicky obtížné odlišení AK od invazivního cSCC. Je proto vhodné odstranění hyperkeratózy pomocí keratolytik, která umožní lepší vyšetření léze, usnadní výběr vhodného místa pro biopsii a odběr reprezentativního vzorku. AK představuje jednu z nejčastějších diagnóz a je příčinou přibližně až 14 % všech návštěv u dermatologů [18].
Někdy bývají rozlišovány tři stupně postižení u AK. AK I. stupně jsou ploché a snadno přehlédnutelné, někdy spíše hmatné s drsným povrchem. AK II. stupně představují více prominující léze, které jsou snadno detekovatelné pouhým zrakem a palpací. AK III. stupně bývají jasně elevované, klinicky zjevné léze, zaměnitelné za invazivní cSCC [33].
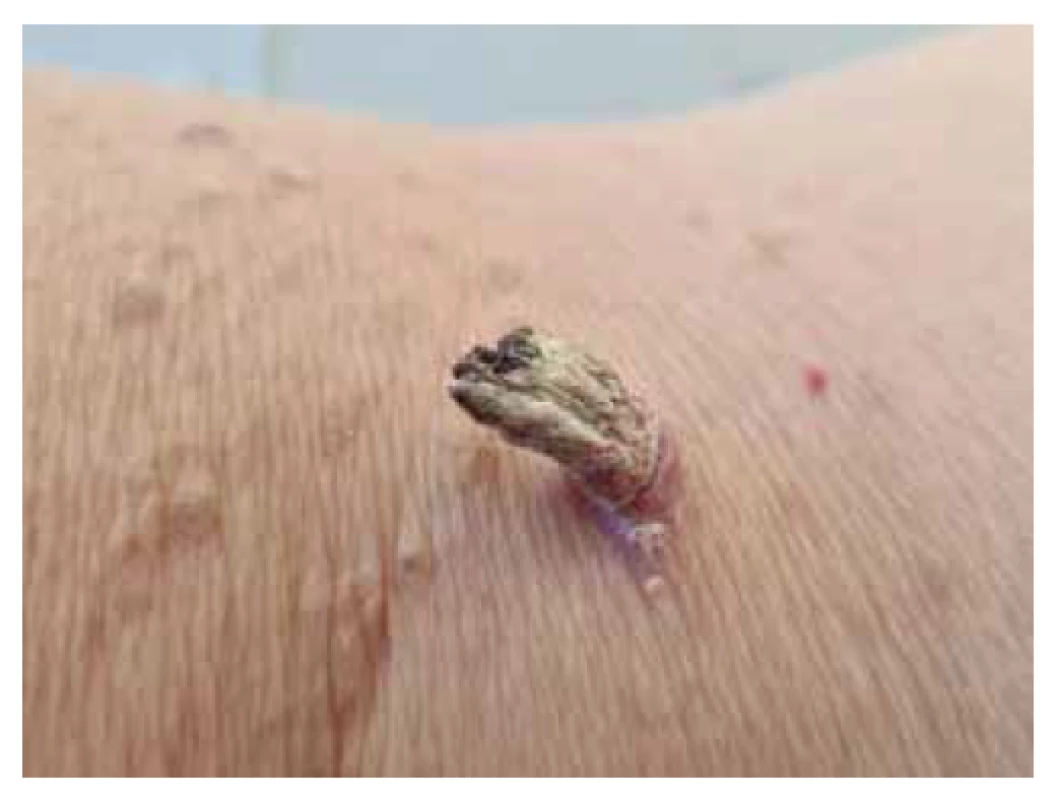
Podle klinického obrazu jsou rozlišovány různé formy AK. Erytematózní nebo atrofická varianta aktinické keratózy je definována jako časné stadium AK I. stupně charakterizované růžovým až světle červeným zbarvením, pravděpodobně na podkladě u probíhající zánětlivé reakce. Velikost se obvykle pohybuje v rozmezí několika milimetrů, vzácněji centimetrů. Keratotická varianta aktinické keratózy zahrnuje AK II. a III. stupně, a představuje tak nejčastější variantu AK, kdy na povrchu těchto lézí dochází ke vzniku hyperkeratóz. Rovněž dochází ke změně zbarvení AK, které se stávají červené, žluto-bílé nebo světle hnědé. Po mechanickém odstranění povrchové hyperkeratózy (pomocí ostré lžičky) se objevuje jasně červená nepravidelná spodina s krvácejícími malými tečkovitými cévkami a zánětlivým lemem. Extrémně hyperkeratotická forma AK může nabývat až vzhledu cornu cutaneum (obr. 1). Většinou se jedná o solitární léze vyskytující se zejména na tvářích, spáncích, ušních boltcích, ve výstřihu, na horní třetině zad nebo na dorzu rukou, které jsou nejčastěji žluto-bílého či žluto-hnědého zbarvení. Projev roste vertikálně nad niveau kůže, je cylindrického tvaru a může narůstat až do délky 15 cm. Při dosažení výšky několika cm často dochází k zakřivení rohu, který poté nabývá oblého tvaru [61].
Pojem cornu cutaneum je popisný klinický termín, ne patologickoanatomická jednotka, protože může být různé etiologie [33]. Podkladem vzniku cornu cutaneum může být nejen AK, ale rovněž invazivní cSCC, bazocelulární karcinom (BCC), vulgární veruka, nebo např. zánětlivá onemocnění jako diskoidní lupus erythematodes a tinea amiantacea. K určení etiologie cornu cutaneum je proto nutné histopatologické vyšetření. Přibližně 61,1 % případů cornu cutaneum vzniká na podkladě benigní léze, 23,2 % případů na podkladě prekancerózy a 15,7 % případů na podkladě maligní léze [72].
Další variantu AK představuje tzv. lichenoidní aktinická keratóza, která je charakterizována tmavě červeným až lividním zbarvením a svou histologickou strukturou připomíná obraz lichen planus. Tato varianta AK se častěji vyskytuje na extenzorové straně předloktí a na hrudníku. Pigmentovaná aktinická keratóza je variantou AK s pigmentem. Tento typ AK nejčastěji postihuje oblast obličeje, zejména pak tváře a spánky. Pigmentované AK jsou většinou světle hnědě zbarvené (zbarvení je dáno větším množstvím pigmentu melaninu, změny melanocytů nebývají přítomny). Tyto léze jsou klinicky obtížně odlišitelné od lentigo solaris (hyperpigmentace bazální vrstvy epidermis) a lentigo maligna (melanoma in situ). V těchto případech je opět nutná histopatologická konfirmace [61]. AK se nejčastěji nacházejí v místech chronické expozice UV záření (hlava a krk, dorzální strana rukou a předloktí).
Histologicky u AK pozorujeme poruchu zrání keratinocytů s přítomností cytologických atypií. Keratinocyty vykazují v části epidermis ztrátu polarity, nepravidelná hyperchromní jádra s prominujícími jadérky, mitózy. Rovněž mohou být přítomny ojedinělé dyskeratotické keratinocyty. V místě ústí vlasových folikulů a vývodů ekrinních potních žlázek postihují dané změny pouze spodní část epidermis. Ve stratum corneum můžeme také pozorovat parakeratózu. Spodní část epidermis vybíhá do dermis ve formě krátkých prstovitých epidermálních čepů. V oblasti dermis je přítomna bazofilní degenerace vaziva (solární elastóza) s různě intenzivním mononukleárním zánětlivým infiltrátem v horní části dermis. Histologicky rozlišujeme hypertrofický, atrofický, akantolytický, pigmentovaný a lichenoidní typ AK [33].
Prevalence AK v Dánsku ve věkové skupině s průměrným věkem 72 let dosahuje 49 % u mužů a 28 % u žen [15]. Výskyt AK ve věkové skupině 65–74 let, s vysokou mírou expozice UV záření, dosahuje až 55 % u mužů a 37 % u žen, ve srovnání se stejnou věkovou skupinou bez vyšší míry expozice UV záření, kde výskyt klesá na přibližně 19 % u mužů a 12 % u žen (kavkazská bílá populace v USA) [10].
Rizikový faktor pro vznik AK představuje nižší fototyp (podle Fitzpatricka I–II), vyšší věk a androgenní alopecie. Jedná se tedy o projev solárního poškození kůže, který může vést až k obrazu nádorového pole, tzv. „field cancerization“ (obr. 2). Nádorové pole vzniká v místech chronické expozice UV zářením, která je příčinou klonální proliferace oblastí s mutací tumor supresorového genu TP53 (mutace genu TP53 je přítomna u více než 90 % invazivních cSCC a je považována za zcela zásadní při vzniku obrazu nádorového pole) [6, 29]. Tato mutace byla identifikována nejen v aktinicky poškozené kůži, ale také v UV exponované klinicky intaktní kůži, avšak je prakticky nepřítomna v oblastech, které nejsou exponovány UV záření. Pro vznik aktinického poškození a invazivního cSCC je tedy nejdůležitější chronická expozice UV záření, nikoliv krátkodobá a intenzivní expozice. Jasná definice pro pojem nádorového pole však v klinické praxi stále neexistuje. Nádorové pole může být definováno jako oblast s výskytem vícečetných AK a dlaždicobuněčných Cis s anebo bez přítomnosti invazivních cSCC [69]. V daném terénu můžeme běžně detekovat nejen rozsáhlé klinické, ale i subklinické aktinické poškození. Pro zhodnocení rozsahu a závažnosti nádorového pole lze využít skórovacího systému, tzv. „Actinic Keratosis Area and Severity Index“ (AKASI skóre 0-18) [59]. AKASI se zaměřuje na 3 hlavní body:
Obr. 2. Nádorové pole v oblasti kalvy 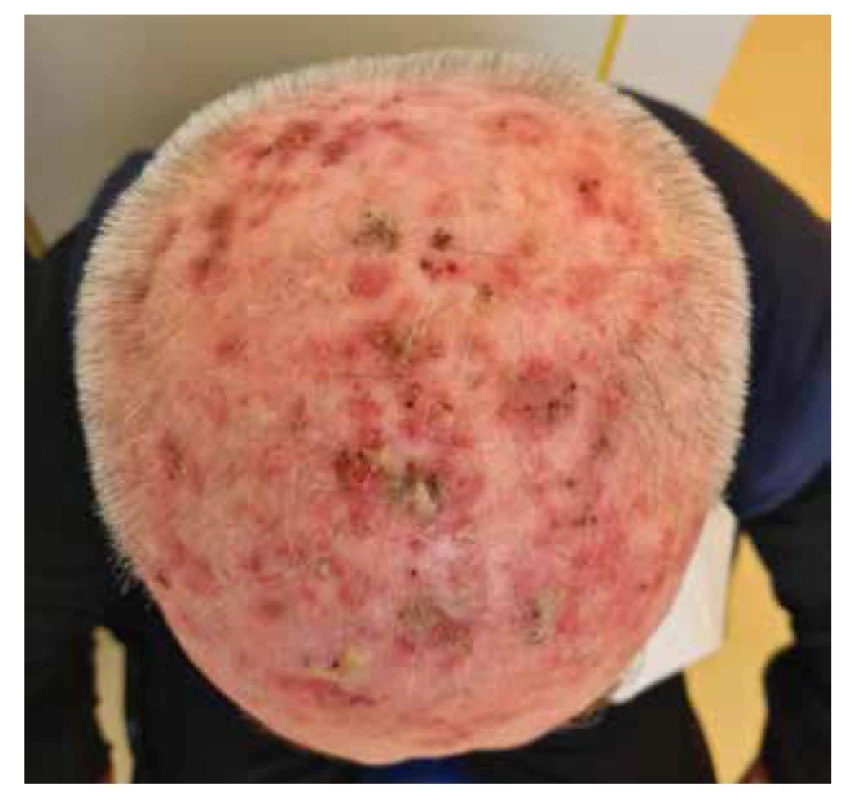
1. postiženou anatomickou oblast (kštice, čelo, pravá a levá tvář),
2. procento aktinicky postiženého kožního povrchu (0–100 %),
3. intenzitu aktinického poškození definovanou erytémem, indurací a distribucí AK (erytém – nepřítomen, mírný, střední, intenzivní, velmi intenzivní, indurace – nepalpovatelné, lehce palpovatelné, jasně palpovatelné, ztluštělé/indurované, velmi ztluštělé/ indurované, distribuce AK – nepřítomna, izolované/ rozptýlené, seskupené, seskupené až splývající, splývající).
Čím je dosažené skóre vyšší, tím pokročilejší je aktinické poškození v dané oblasti. Vyšší hodnoty AKASI skóre jsou asociovány s vyšším rizikem vzniku invazivních cSCC a BCC (AKASI 6.9 pro cSCC vs AKASI 3.3 pro BCC). Mezi hlavní nevýhody tohoto skórovacího systému patří především jeho přílišná zdlouhavost (všechny parametry musí být vyplněny pro každou anatomickou oblast zvlášť, tedy pro kštici, čelo, pravou a levou tvář), rovněž systém nezohledňuje zvýšení rizika v případě přítomnosti carcinoma in situ anebo invazivního cSCC v terénu nádorového pole a dále doposud chybí robustní prospektivní studie hodnotící validitu skórovacího systému. Na druhou stranu je AKASI kalkulátor k dispozici zdarma jako mobilní aplikace, což umožňuje jeho případné rychlejší využití v každodenní praxi.
V patogenezi přechodu AK do invazivního cSCC se dnes uplatňují 2 klíčové hypotézy. „Klasická“ hypotéza je definována histologicky postupným vývojem AK přes I.–III. stupeň (I. stupeň: atypické keratinocyty v dolní 1/3 epidermis, II. stupeň: atypické keratinocyty v dolních 2/3 epidermis, III. stupeň: atypické keratinocyty přítomny v celé tloušťce epidermis bez překročení bazální membrány – odpovídá carcinoma in situ). Tento vývoj se uplatňuje u zhruba 36 % invazivních cSCC, které vykazují vysokou proliferační aktivitu Ki67 [13, 14, 58]. Nová, tzv. „diferencovaná“, hypotéza, podle které AK stupně I s atypickými keratinocyty v bazální a suprabazální vrstvě epidermis mají nejvyšší riziko přímého přechodu do invazivního cSCC, se naopak uplatňuje téměř u 64 % případů invazivního cSCC, které rovněž vykazují ztrátu E-kadherinu a β-kateninu [13, 14, 58]. U aktinických keratóz se velmi často vyskytuje mutace tumor supresorového genu TP53 v asociaci s expozicí UV záření. Podle systematického přehledu z roku 2013, do kterého bylo zařazeno 24 klinických studií (15 randomizovaných kontrolovaných studií, 6 prospektivních kohortových studií a 3 studie srovnávající použití vs. nepoužití fotoprotekce), se pohybovalo riziko transformace jedné AK do invazivního cSCC v rozmezí 0,0–0,075 % za rok (průměrný věk populace byl 60,1–71,2 roku). U pacientů s anamnézou NMSC toto riziko narostlo na 0,53 % za rok (průměrný věk populace byl 68 let) a během pěti let se zvýšilo až na 2,88 %. Výsledky systematického přehledu je však nutné interpretovat z hlediska skutečné rizikovosti progrese AK do invazivního cSCC velmi opatrně, vzhledem ke značné heterogenitě jednotlivých studií, metodologickým limitacím a s tím souvisejícímu vyššímu riziku chybovosti [65]. Riziko transformace jedné AK do invazivního cSCC, se podle 6 klinických studií zabývajících se danou problematikou v letech 1988–1998, pohybovalo v rozmezí 0,025–16,0 % za rok [16]. Výrazná diskrepance mezi jednotlivými studiemi může být interpretována heterogenitou studijní populace mezi studiemi, do které se promítají individuální endogenní a exogenní rizikové faktory pacientů. Mezi které patří například vyšší počet AK, vyšší stupeň aktinického poškození kůže, anamnéza NMSC, radioterapie, fototerapie PUVA, terapie cyklosporinem A, obecně imunosupresivní terapie, HIV infekce, stav po transplantaci solidních orgánů, chronická lymfatická leukemie, nižší fototyp, vyšší věk a anatomická lokalizace. Pacienti, kteří mají průměrně 7,7 aktinických keratóz, mají desetileté kumulativní riziko transformace 1 AK do invazivního cSCC až 10,2 % [8]. Pacienti s AK mají navíc 6krát vyšší riziko pro vznik NMSC nebo maligního melanomu ve srovnání s populací bez AK [22]. U aktinických keratóz se vyskytuje rovněž možnost spontánní regrese, která se po 1 roce od jejich vzniku pohybuje v rozmezí 15–63 %. I přes možnost spontánní regrese existuje riziko následovné recidivy, které dosahuje 15–53 % [65]. Klinicky však nelze spolehlivě rozhodnout, u které z přítomných AK může dojít ke zvratu do invazivního cSCC, a proto je vhodné provádět terapii všech AK, a to buď cestou léčby cílené na léze, „lesion-directed therapy“ (např. kryoterapie, která je jednoduše proveditelná, levná a dostupná), nebo léčby cílené na celou chorobnou oblast „field-directed therapy“ (např. 5 % imiquimod, který má v České republice (ČR) v dané indikaci úhradu z veřejného zdravotního pojištění). Velmi zajímavá data pro klinickou praxi přináší recentní kohortová studie z Kalifornie v USA (data z období mezi roky 2009 a 2020). Tato klinická studie s celkem více než 220 000 pacienty a délkou sledování okolo 10 let prokázala narůstání meziročního rizika vzniku invazivního cSCC u pacientů s AK o 1,92 %. Při srovnání oproti kontrolní skupině pacientů bez AK (zde pouze 0,83 %) se jedná o dvojnásobné navýšení rizika. Rovněž byla prokázána vyšší kumulativní incidence cSCC u pacientů s AK, která dosahovala až 17,1 % (trojnásobné navýšení) ve srovnání s pacienty bez AK, kde se pohybovala pouze okolo 5,7 % [37].
Dermatoskopie představuje neinvazivní diagnostickou metodu hojně využívanou při stanovení diagnózy benigních a maligních nádorů kůže. Pro diagnostiku aktinických keratóz lze využít ručního (standardní zvětšení 10–20krát) anebo digitálního dermatoskopu (zvětšení 10–50krát) [33, 73]. Pomocí dermatoskopie lze na základě korelace mezi klinickými a dermatoskopickými znaky určit aktinické keratózy stupeň I–III (obr. 3).
Obr. 3. Dermatoskopie aktinické keratózy 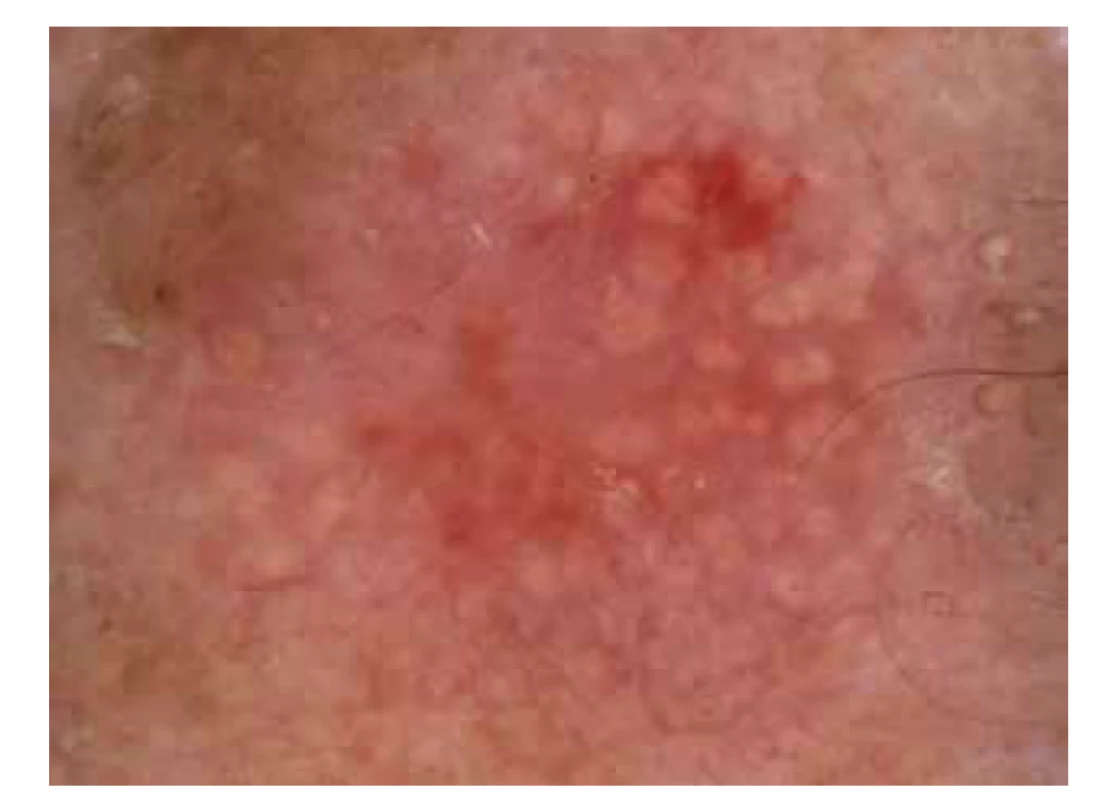
AK stupeň I klinicky představuje AK, která je pouze mírně palpovatelná (přítomnost spíše pocitová než viditelná), zatímco dermatoskopicky je typická přítomnost červené pseudosítě okolo folikulárních ústí s přítomností bílých šupin nebo bez nich.
AK stupeň II se klinicky jeví jako středně indurovaná AK, dermatoskopicky je zde charakteristická přítomnost erytematózního pozadí (tzv. červená pseudosíť) se žlutobílými keratinovými čepy vyplňujícími folikulární ústí, vytváří se tak až obraz tzv. jahodového vzoru („strawberry pattern“).
AK stupně III je klinicky definována jako silně indurovaná hyperkeratotická a/nebo klinicky zřetelná AK, dermatoskopicky je specifikována přítomností žlutobílých keratinových čepů vyplňujících folikulární ústí v kombinaci s bělavými šupinami a žlutobílými bezstrukturními okrsky hyperkeratózy [33, 73].
CARCINOMA IN SITU KŮŽE
Carcinoma in situ kůže (Cis) je definován jako dlaždicobuněčný intraepiteliální karcinom vznikající jako intraepidermální proliferace atypických keratinocytů, které nepřestupují přes bazální membránu epidermis [20, 33]. U Cis byla prokázána jasná souvislost s postupným vývojem do invazivního cSCC. V ČR je hlášen do Národního onkologického registru (NOR) pod MKN-10 kódem D04 (novotvar in situ kůže). Za rok 2017 bylo hlášeno celkem 2 379 nových případů, z toho u mužů bylo 1 130 případů, incidence 21,7 případů na 100 000/ rok. U žen bylo za stejné období nahlášeno až 1 249 případů, incidence 23,2 případu na 100 000/rok [34]. Klinicky jsou rozlišovány tři formy Cis morbus Bowen, bowenoidní papulóza a intraepiteliální neoplazie (erythroplazie Queyrat).
Morbus Bowen (MB) představuje typickou variantu Cis na kůži exponované UV záření (zejména hlava, krk, trup, dorza rukou a DKK). Klinicky se projevuje jako solitární nebo méně často vícečetný erytematózní pozvolna se šířící, ostře ohraničený, mírně elevovaný plak, okrouhlého či nepravidelného tvaru [33] (obr. 4). Zbarvení MB se pohybuje v rozmezí světle růžové až červené barvy. Na povrchu léze může být přítomna deskvamace a hyperkeratózy. Rovněž se mohou objevit povrchové eroze a hemoragické krusty, povrch léze se tak stává zhrubělý. U projevu většinou dochází k pomalému růstu a MB postupně dosáhne velikosti od několika mm až po několik cm (většinou 1–5 cm). MB bývá často mylně považován za zánětlivý plak v rámci chronického ekzému anebo psoriázy. Projevy MB mohou být rovněž provázeny nárazovitým pruritem. Mezi známky transformace MB do invazivního cSCC se řadí vznik ulcerace, indurace, nodulu. V klinické praxi se rovněž můžeme vzácněji setkat s pigmentovanou variantou MB světle hnědé barvy. Riziko transformace morbus Bowen do invazivního cSCC se pohybuje v rozmezí 3–5 % [42, 44].
Obr. 4. Rozsáhlý morbus Bowen na rameni 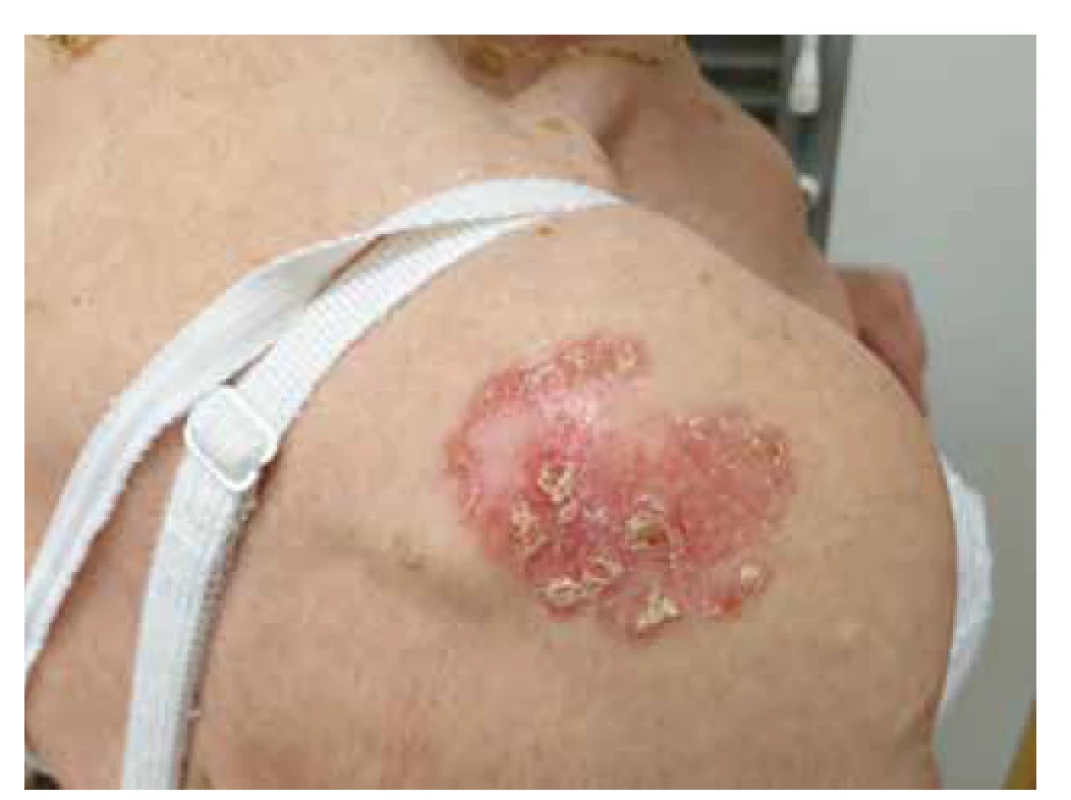
Pro diagnostiku morbus Bowen lze využít ručního (standardní zvětšení 10–20krát) anebo digitálního dermatoskopu (zvětšení 10–50krát) [33, 73]. V dermatoskopii je zásadní cévní vzor, který je tvořen především tečkovitými nebo glomerulárními cévkami, které jsou uspořádané ve skupinkách anebo radiálních liniích. Rovněž může být okolo cévek přítomné bělavé halo. Mezi další znaky, které mohou být u MB přítomny, patří především žlutavé neprůsvitné okrsky nebo šupiny, malé eroze a žluto-červené pozadí [73] (obr. 5).
Obr. 5. Dermatoskopie morbus Bowen 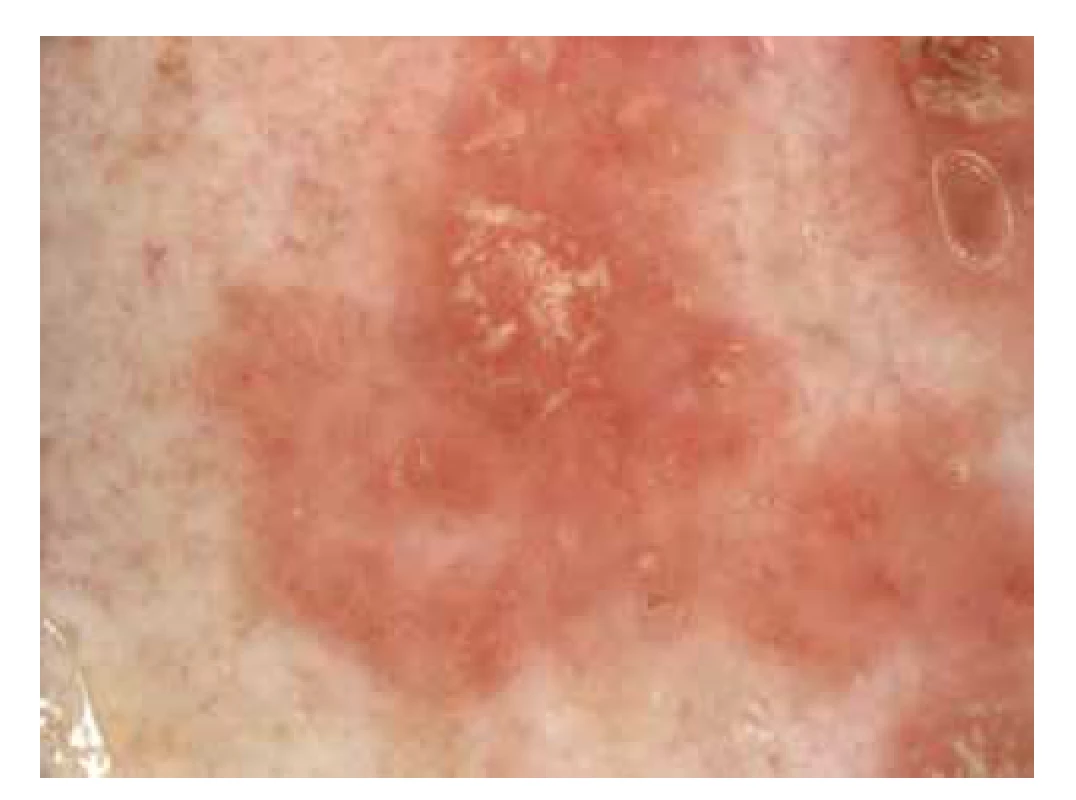
Histologicky u MB pozorujeme dysplastické změny v celé šíři epidermis, akantózu epidermis s parakeratózou stratum corneum. Keratinocyty vykazují buněčnou pleomorfii, jaderné atypie, atypické mitózy, vícejaderné buňky a dyskeratózu. MB bývá v oblasti dermoepidermální junkce přesně ohraničen proti dermis, ve které je přítomen různě intenzivní mononukleární zánětlivý infiltrát s příměsí plazmocytů. Histologicky rozlišujeme psoriaziformní, atrofický, hyperkeratoticky - verukózní, papilomatózní, pigmentovaný a pagetoidní typ [33].
Intraepiteliální neoplazie – erythroplasia Queyrat (EQ) je dlaždicobuněčný Cis v oblasti penisu (glans penis a vnitřní list preputia) a vulvy (labia minora). V současné době pro toto postižení jsou preferovány termíny penilní intraepiteliální neoplazie (PeIN), vulvární intraepiteliální neoplazie (VIN), které byly rozšířeny i na oblast perinea jako perianální/anální intraepiteliální neoplazie (PaIN či AIN). U genitálních forem Cis je riziko transformace do invazivního dlaždicobuněčného karcinomu vyšší a dosahuje 10–33 % [42, 44].
Penilní intraepiteliální neoplaziie (PeIN) je klasifikována do dvou základních typů:
1. nediferencovaný bazaloidní nebo verukózní typ PeIN, u kterého je prokázána souvislost s infekcí vysoce rizikovými onkogenními HPV, nejčastěji typem 16, 18, 31 a 33, imunohistochemickou pozitivitou p16 a negativitou p53. Při průkazu pozitivity p16 je možné, ve specializovaných diagnostických laboratořích, provést doplnění HPV typizace ze získaného histopatologického materiálu pomocí metody PCR (polymerázová řetězová reakce) pro rozdělení na vysoce/ nízce rizikové typy HPV. Metoda PCR rovněž umožňuje průkaz onkogenu E6/E7 u vysoce rizikových typů HPV 16, 18, 31, 33, 35, 45 (průkaz transkripčně aktivního viru). Protein p16 je exprimován vysoce rizikovými HPV uvnitř infikovaných buněk, zatímco protein p53 odráží poškození DNA při maligní transformaci. Tento typ PeIN se vyskytuje spíše u mladších, sexuálně aktivních mužů (< 40 let) a bývá rovněž spojován s lepší prognózou (obr. 6).
Obr. 6. Nediferencovaný typ PeIN, asociace s vysoce rizikovými, onkogenními HPV typ 16 a 18 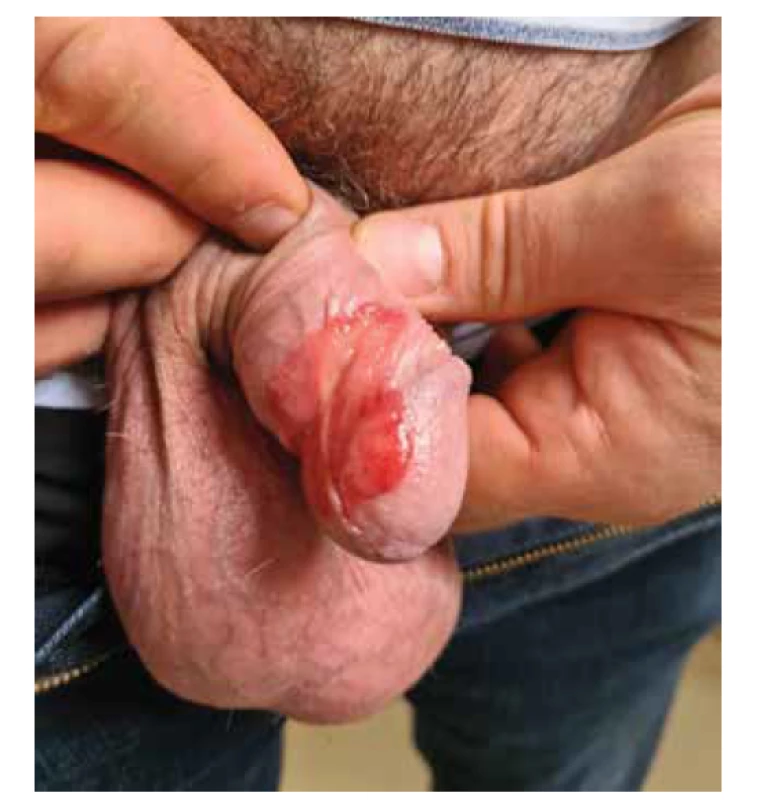
2. diferencovaný typ PeIN nevykazuje souvislost s HPV infekcí, má přítomnou negativitu p16 a pozitivitu p53 a bývá asociován s horší prognózu ve srovnání s typem nediferencovaným. Je pozorován častější výskyt u starších mužů (> 60 let), často v souvislosti s lichen sclerosus (tzv. balanitis xerotica obliterans dosahuje riziko vzniku premaligní nebo maligní léze 8,4 % a invazivního cSCC přibližně 2,0–12,5 %) [7, 33].
V případě vulvární intraepiteliální neoplazie (VIN) je vývoj nomenklatury složitější. Do roku 2004 se používalo tradiční histopatologické dělení na VIN 1, 2 a 3 analogicky s nálezy odpovídající cervikální intraepiteliální neoplazii (CIN 1, 2 a 3). V roce 2004 však provedla ISSVD (International Society for the Study of Vulvovaginal Disease) reklasifikaci VIN. Pro klinickou praxi bylo doporučeno pojem VIN 1 (mírné dysplastické změny v dolní třetině epitelu) přestat zcela používat, jelikož jsou tyto změny asociovány spíše s iritací anebo s infekcí nízce rizikovými HPV (condylomata acuminata/plana, HPV 6 a 11). U těchto lézí je velmi nízké riziko maligní transformace a zároveň možnost spontánní regrese. ISSVD ponechalo pojem VIN pouze pro vysoce rizikové (high-grade) skvamózní (dlaždicobuněčné) léze, tedy pro VIN 2 a VIN 3. Dále se v běžné praxi začalo uplatňovat rozdělení VIN na obvyklý, nediferencovaný, typ (u-VIN) asociovaný s infekcí vysoce rizikovými onkogenními HPV typ 16, 18, 31, 33 a diferencovaný typ (d-VIN) bez asociace s HPV [48, 49]. V roce 2015 pak podle ISSVD proběhla další změna nomenklatury pro VIN. V případě VIN asociovaných s infekcí HPV se začalo používat dělení na nízkorizikové „low-grade“ a vysokorizikové „high-grade“ skvamózní intraepiteliální léze (LSIL a HSIL). LSIL je asociováno s infekcí nízce rizikovými HPV 6, 11 (condylomata plana), přičemž u těchto lézí je přítomno velmi nízké riziko transformace do invazivního dlaždicobuněčného karcinomu (SCC). Zatímco HSIL prokazuje asociaci s vysoce rizikovými onkogenními HPV typ 16, 18, 31 a 33 (dříve označováno jako u-VIN, nebo VIN 2 a 3), zde se naopak riziko maligní transformace výrazně zvyšuje [48, 49]. V oblasti vulvy se častěji, zhruba v 80 % případů, vyskytuje HSIL s pozitivitou infekce vysoce rizikovými onkogenními HPV typ 16, 18, 31 a 33 (častěji u mladších, sexuálně aktivních, premenopauzálních žen s věkovým průměrem 40 let). V případě HSIL dochází bez adekvátní terapie až u 85 % pacientek v průběhu 6–7 let k rozvoji invazivního SCC. U přibližně 50 % pacientek s HSIL dochází bez terapie k rozvoji cervikální, vaginální nebo anální intreaepiteliální neoplazie. Rovněž v těchto případech je možné doplnění typizace HPV (v získaném histopatologickém materiálu) na nízce/vysoce rizikové typy a průkaz onkogenu E6/E7 pomocí metody PCR. Diferencovaný typ (d-VIN), tvoří přibližně 20 % případů vulvárních lézí (bez uplatnění HPV infekce), bývá přítomen zejména u starších, postmenopauzálních (věkového průměru 60 let) žen v terénu lichen sclerosus a erozivního lichen planus (tzv. kraurosis vulvae). Prognóza je v tomto případě horší, jelikož maligní transformace nastává bez adekvátní terapie u většiny žen průměrně během 2–4 let [5, 20, 47, 48].
PeIN se klinicky projevuje v oblasti glans penis nebo na vnitřním listu preputia jako ostře ohraničené neinfiltrované jasně červené matné plaky s tendencí k tvorbě erozí [33]. V případě vzniku PeIN nebo VIN v terénu lichen sclerosus a lichen planus se vytvářejí spíše bělavé, atrofické nebo keratotické plaky. VIN pak tvoří solitární či mnohočetná bělavé až světle červené plaky (u HPV pozitivních projevů nabývající charakter až kondylomatózních lézí). Mezi varovné signály transformace do invazivního cSCC patří ulcerace, výrazná indurace a bolest.
Bowenoidní papulóza (BP) představuje poslední klinickou variantu carcinoma in situ vyskytující se v anogenitální oblasti. BP vzniká nejčastěji u mladších sexuálně aktivních jedinců ve věkové kategorii mezi 20.–40. rokem života. Klinická manifestace BP probíhá ve formě jednotlivých či mnohočetných rychle rostoucích erytematózních či světle hnědočervených makulopapul až plaků, typicky v anogenitální lokalitě (zevní genitál, perineum, perianální kůže), s pozitivitou vysoce rizikového onkogenního HPV typu 16 a 18 (obr. 7). Po určité době může nastat spontánní regrese projevů, přitom riziko transformace do invazivního cSCC dosahuje pouze < 1,0 % [5, 20, 33].
Obr. 7. Bowenoidní papulóza u kořene penisu 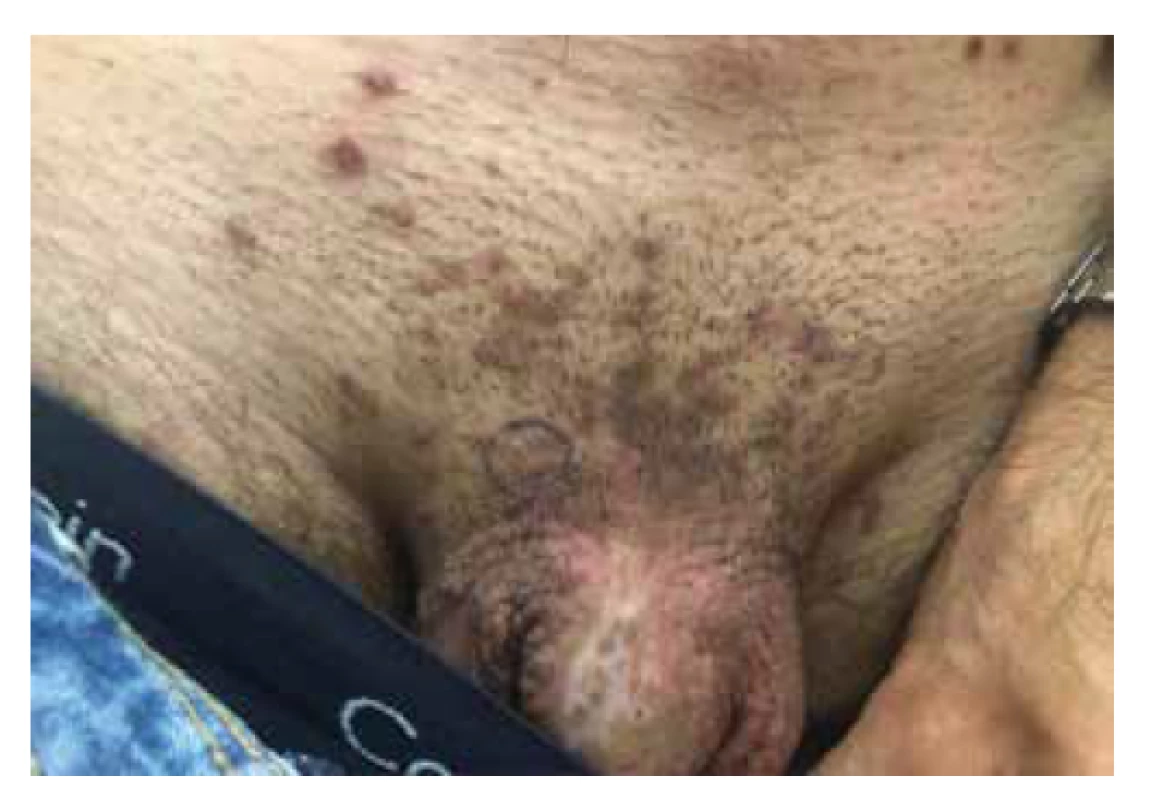
Histologicky je BP neodlišitelná od MB, proto je nutné provedení klinicko-patologické korelace. V případě BP nacházíme častější mitózy v metafázi, hrubější keratohyalinní granula s přítomností koilocytů, které představují atypické keratinocyty s perinukleárním haló a svraštělým jádrem. Nález těchto buněk bývá asociován s HPV infekcí [33].
TERAPIE AKTINICKÝCH KERATÓZ A CARCINOMA IN SITU
Terapie AK a Cis lze rozdělit na terapii cílenou na jednotlivé léze (tzv. „lesion-directed therapy“ – LDT) a terapii cílenou na „chorobné pole“ k ošetření rozsáhlejší plochy (tzv. „field-directed therapy“ – FDT).
Mezi nejvíce používané metody cílené na jednotlivé léze (LDT) patří kryoterapie, kyretáž a elektrodesikace anebo tangenciální, „shave“, excize (v případě carcinoma in situ se rovněž může uplatnit standardní chirurgická excize). Hlavního zástupce LDT však představuje především kryoterapie. Přitom míra léčebné odpovědi u kryoterapie AK dosahuje přibližně 68,0–76,2 % po jednom cyklu kryoléčby. V případě opakovaní 2. cyklu za 3–6 měsíců dochází k navýšení míry léčebné odpovědi až na 86,1–87,0 % [60]. Nevýhody kyretáže a elektrodesikace anebo „shave“ excize spočívají v nutnosti použití lokálního anestetika, riziku krvácení a jizvení. Kryoterapie je na druhou stranu asociována s bolestí, vznikem puchýře a povrchové rány, s vyšším rizikem infekce a posunů pigmentu (hypopigmentace a hyperpigmentace při hojení).
Terapie cílené na „chorobné pole“ (FDT) představují zejména aplikace lokálního 5-fluorouracilu (Efudex, v ČR není registrovaný) [2, 57], 5 % imiquimodu (Aldara, v ČR registrovaný s úhradou) [19, 51], ingenolu mebutátu (Picato, v ČR není dostupný vzhledem k dočasnému pozastavení registrace v ČR na doporučení EMA a SÚKLu) [35], 3% diklofenaku sodného (Solaraze, v ČR není registrovaný) [53], fotodynamické terapie – PDT (Metvix, není dostupný na českém trhu) [57, 66, 67, 68]. FDT dosahuje podle klinických studií (v závislosti na zvolené modalitě) iniciálního odhojení (clearance rate) až v 75 %. Ovšem u 25–75 % imunokompetentních pacientů s obrazem nádorového pole, však dochází během 1 roku po iniciální lokální terapii k opětovnému vzniku AK a Cis [60] (tab. 1).
Tab. 1. Přehled současných možností cílené léčby chorobného pole 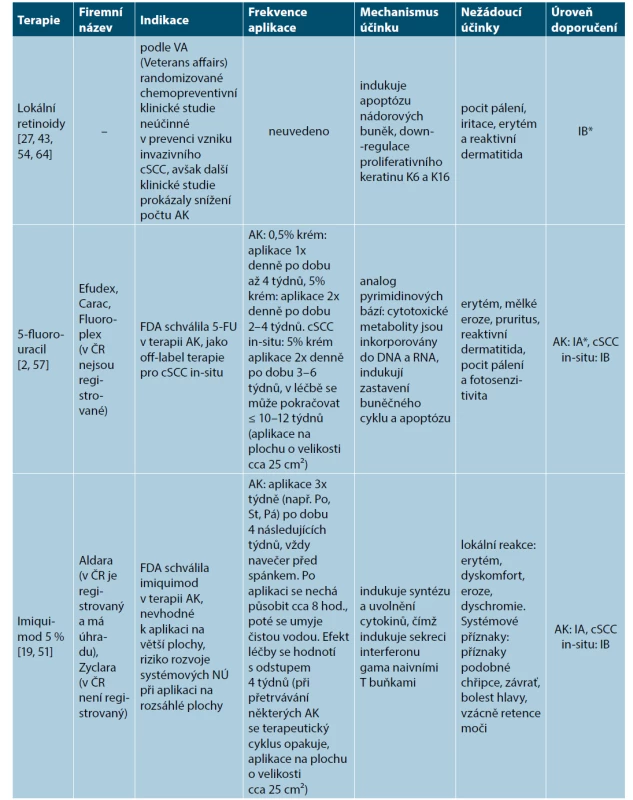
[převzato od Que 2018, 28] Tabulka 1. – pokračování 
*Úroveň doporučení IA se opírá o metaanalýzy z prospektivních, randomizovaných, kontrolovaných klinických studií. Doporučení IB se opírá o data ≥1 prospektivní, randomizované, kontrolované klinické studie. Doporučení IIA se opírá o data ≥1 prospektivní, nerandomizované, kontrolované klinické studie. Doporučení IIB se opírá o data z ≥1 jiné experimentální klinické studie. Doporučení III se opírá o data neexperimentálních popisných studií, jako např. srovnávacích studií, korelačních studií, studie případů a kontrol. Doporučení IV se opírá o doporučení expertních komisí. cSCC – kožní dlaždicobuněčný karcinom, AK – aktinická keratóza. Srovnání účinnosti jednotlivých modalit FDT bylo provedeno v klinické studii z Nizozemska publikované v roce 2020. V této studii bylo zařazeno celkem 624 pacientů, kteří byli rozdělení do 4 terapeutických ramen:
1. rameno 5-fluorouracil crm.,
2. rameno 5% imiquimod crm.,
3. rameno MAL-PDT,
4. rameno ingenol mebutát 0,015% gel.
Jako jeden z hlavních výsledků bylo hodnocení pravděpodobnosti dosažení redukce v počtu AK ≥ 75 % ve 12. měsíci po provedení lokální terapie. Ze studie tedy vyplývá, že 5-fluorouracil crm. dosáhl 74,7 % (95 % CI, 66,8-81,0 %), 5% imiquimod crm. dosáhl 53,9 % (95 % CI, 45,4-61,6 %), MAL-PDT dosáhlo 37,7 % (95 % CI, 30,0 - 45,3 %) a konečně ingenol mebutát 0,015 % gel dosáhl 28,9 % (95 % CI, 21,8-36,3 %) [25].
Aldara 5% crm. je jako jediný preparát hrazený z prostředků veřejného zdravotního pojištění. Aktuální úhradová kritéria podle Státního ústavu pro kontrolu léčiv (SÚKL) v indikaci aktinické keratózy ke dni 22. 7. 2021, splňují: Pacienti se 4–8 viditelnými lézemi nehyperkeratotické nehypertrofické aktinické keratózy na ploše ≤ 25 cm² na obličeji nebo vlasové pokožce, kteří v minulosti prodělali léčbu kryoterapií a dosáhli věku 18 let. Z prostředků veřejného zdravotního pojištění jsou hrazeny maximálně dva cykly.
Systémová chemoprevence pro AK, Cis a invazivní cSCC představuje perorální podávání preparátů, které snižují riziko vzniku nemelanomových nádorů kůže a jejich prekurzorů. U pacientů, kteří mají v osobní anamnéze 5 a více invazivních cSCC nebo alespoň 1 vysoce rizikový cSCC, by mělo být zváženo zahájení systémové chemoprevence. Tito pacienti představují vysoce rizikovou skupinu pro vznik NMSC. Mezi hlavní představitele řadíme především nikotinamid [23, 24, 30, 31, 62, 71], systémové retinoidy (acitretin) [3, 32, 36, 40, 41, 45, 50], nesteroidní antiflogistika [46], capecitabin [9, 26, 70] a v neposlední řadě také sirolimus [1, 12, 21, 28, 39]. Jednu z nejúčinnějších modalit chemoprevence představují systémové retinoidy (acitretin). V ČR se bohužel jedná o indikaci, která není hrazena z prostředků veřejného zdravotního pojištění (tedy buď na předpis v režimu samoplátce, nebo sepsání žádosti na zvýšenou úhradu k reviznímu lékaři dané pojišťovny) (tab. 2).
Tab. 2. Přehled současných možností systémové chemoprevence 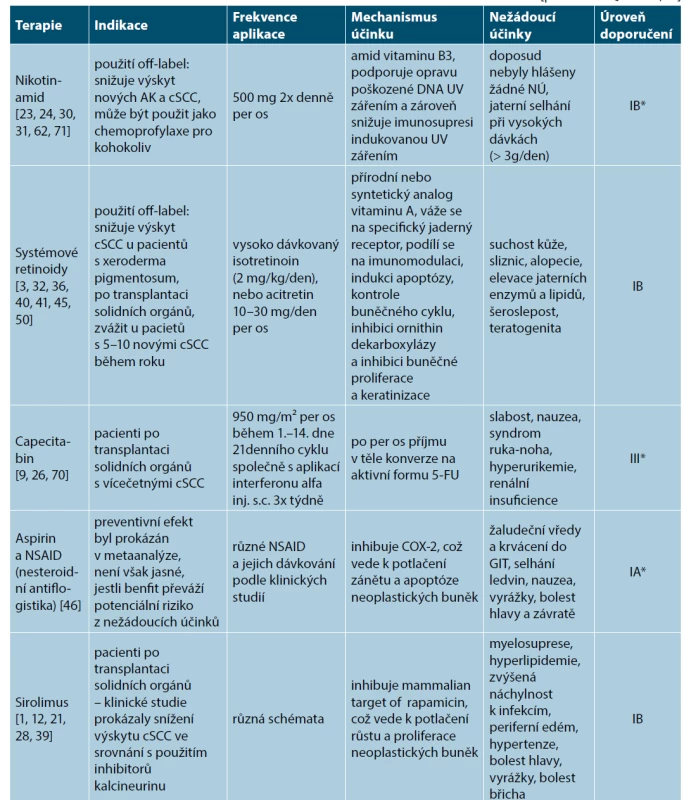
*Úroveň doporučení IA se opírá o metaanalýzy z prospektivních, randomizovaných, kontrolovaných klinických studií. Doporučení IB se opírá o data ≥ 1 prospektivní, randomizované, kontrolované klinické studie. Doporučení IIA se opírá o data ≥ 1 prospektivní, nerandomizované, kontrolované klinické studie. Doporučení IIB se opírá o data z ≥ 1 jiné experimentální klinické studie. Doporučení III se opírá o data neexperimentálních popisných studií, jako např. srovnávacích studií, korelačních studií, studie případů a kontrol. Doporučení IV se opírá o doporučení expertních komisí. Fotoprotekce na druhou stranu představuje dostupnou a účinnou modalitu v rámci primární prevence aktinického poškození kůže a s tím souvisejícím vznikem AK, Cis a invazivních cSCC. V rámci fotoprotekce využíváme především ochrannou pokrývku hlavy, tmavé brýle s UV filtrem, ochranný oděv (UPF – „Ultraviolet Protection Factor“, dostačující je UPF nad 30) a v neposlední řadě sunscreeny (opalovací krémy) [11, 52]. Pro snížení rizika vzniku invazivních cSCC je nutná dlouhodobá (každodenní) aplikace opalovacích krémů/fotoprotektiv s obsahem UVA a UVB filtrů [17, 63]. Důležité je rovněž použití správné galenické formy (sprej, krém, gel, lotio, olej) podle plánované venkovní aktivity, dostatečného SPF („Sun Protection Factor“, v rozmezí 6–50+, poskytuje pouze ochranu proti UVB záření) a UVA ochrany. Ta by měla představovat minimálně 1/3 deklarovaného SPF (označení piktogramem UVA v kroužku na obalu). Pro prevenci aktinického poškození kůže je nutné minimálně SPF vyšší než 15 [11]. Z praktického hlediska je vhodné použití opalovacích krémů s vyšším SPF (50+) vzhledem k nutnosti nižší frekvence dotírání během dne při pobytu venku. Deklarované SPF na obalu předpokládá aplikovanou dávku 2 mg/cm² kůže, v běžné praxi však pacienti aplikují výrazně nižší dávku, než jsou 2 mg/cm². Dostatečné množství opalovacího krému aplikované na obličej se pohybuje kolem 1 g a v případě celého těla pak až 30 g [4]. Rovněž je důležité pacienta poučit o preferenci přípravků s certifikátem „water-resistant“ anebo „very-water-resistant“ v případě pobytu ve vodním prostředí. Tyto certifikáty deklarují odolnost opalovacího krému vůči vodě. V současné době se rovněž moderní fotoprotektivní preparáty zaměřují na ochranu proti tzv. HEVL („High Energy Visible Light“), tedy viditelnému světlu modré a fialové barvy o vysoké energii a vlnové délce 400–500 nm, které vykazuje shodné negativní vlastnosti s UVA zářením [38].
ZÁVĚR
Aktinické keratózy jsou asociovány s významnou epidemiologickou morbiditou, avšak nízkou mortalitou. Tyto léze představují jednu z nejčastějších diagnóz, pro kterou pacient vyhledá odbornou lékařskou pomoc dermatovenerologa. Pro praxi je důležité počítat s rizikem eventuálního maligního zvratu aktinických keratóz a včasně zahájit jejich adekvátní terapii. Pacient přitom musí být vždy poučen o nutnosti pravidelného (každodenního) používání fotoprotekce s UVA a UVB filtry, která snižuje výskyt invazivního cSCC až o 40 % [17, 63]. V případech rozsáhlého aktinického poškození zvážení zavedení systémové chemoprevence, která snižuje riziko vzniku nejen dalších AK, ale také nemelanomových nádorů kůže (např. nikotinamid nebo systémové retinoidy). V případě různých klinických variant Cis byl prokázán jasný vývoj těchto lézí do invazivního cSCC. Pozitivní anamnéza pro Cis je spojena s pětiletým kumulativním rizikem pro vznik invazivního cSCC v rozmezí 7–12 %. U těchto projevů je proto nutná adekvátní terapie a následné pravidelné sledování pacientů. V diagnostice AK a Cis hraje důležitou úlohu dermatoskopie, která prokázala v řadě klinických studií i ve vlastní klinické praxi vysokou míru senzitivity, specificity a rovněž možnost provedení bezbolestné diagnostiky prekanceróz a Cis. Z těchto důvodů je zásadní využití dermatoskopie ještě před provedením lokální terapie k ověření suspektní diagnózy. V případě diagnostických rozpaků je vždy indikováno provedení bioptického ověření projevu.
Do redakce došlo dne 17. 8. 2021.
Adresa pro korespondenci:
MUDr. Marek Pásek
Dermatovenerologická klinika 3.LF UK a FNKV
Šrobárova 1150/50
100 34 Praha 10
e-mail: marek.pasek@fnkv.cz
Zdroje
1. ASGARI, M. M., ARRON, S. T., WEISSHAAR, D. et al. Sirolimus use and risk of cutaneous squamous cell carcinoma (SCC) in solid organ transplant recipients (SOTRs). J Am Acad Dermatol., 2015, 73(3), p. 444–450.
2. ASKEW, D. A., MICKAN, S. M., SOYER, H. P. et al. Effectiveness of 5-fluorouracil treatment for actinic keratosis and systematic review of randomized controlled trials. Int J Dermatol., 2009, 48(5), p. 453 – 463.
3. BAVINCK, J. N., TIEBEN, L. M., VERMEER, B. J. et al. Prevention of skin cancer and reduction of keratotic skin lesions during acitretin therapy in renal recipients: a double blind, placebo-controlled study. J Clin Oncol., 1995, 13(8), p. 1933–1938.
4. BENÁKOVÁ, N. a kol. Moderní farmakoterapie v dermatologii. Praha: Maxdorf s.r.o., 2020. 647 s. ISBN 978-80-7345-653-5.
5. BOLOGNIA, J., SCHAFFER, J., CERRONI, L. et al. Dermatology: 2 Volume Set, 4th Edition. Elsevier. 2017, 2880 p., ISBN 9780702062759.
6. BRASH, D. E., RUDOLPH, J. A., SIMON, J. A. et al. A role for sunlight in skin cancer: UV-induced p53 mutations in squamous cell carcinoma. Proc Natl Acad Sci USA, 1991, 88(22), p. 10124–10128.
7. BUNKER, C. B., SHIM, T. N. Male Genital Lichen Sclerosus. Indian J Dermatol, 2015, 60(2), p. 111–117.
8. DODSON, J. M., DESPAIN, J., HEWETT, J. E. et al. Malignant potential of actinic keratoses and the controversy over treatment. A patient-oriented perspective. Arch Dermatol, 1991, 127(7), p. 1029 – 1031.
9. ENDRIZZI, B., AHMED, R. L., LEE, P. et al. Capecitabine to reduce nonmelanoma skin carcinoma burden in solid organ transplant recipients. Dermatol Surg., 2013, 39(4), p. 634–645.
10. ENGEL, A., JOHNSON, M. L., HAYNES, S. G. et al. Health effects of sunlight exposure in the United States. Results from the first National Health and Nutrition Examination Survey, 1971–1974. Arch Dermatol, 1988, 124(1), p. 72–79.
11. ETTLER, K. Účinky UV záření na kůži a fotoprotekce. Med. Pro Praxi, 2007, 6, s. 273–275.
12. EUVRARD, S., MORELON, E., DANTAL, J. et al. TUMORAPA Study Group. Sirolimus and secondary skin-cancer prevention in kidney transplantation. N Engl J Med., 2012, 367(4), p. 329–339.
13. FERNÁNDÉZ-FIGUERAS, M. T., CARRATO, C., SÁENZ, X. et al. Actinic keratosis with atypical basal cells (AK I) is the most common lesion associated with invasive squamous cell carcinoma of the skin. J Eur Acad Dermatol Venereol, 2015, 29(5), p. 991–997.
14. FERNÁNDÉZ-FIGUERAS, M. T. From actinic keratosis to squamous cell carcinoma pathophysiology revisited. J Eur Acad Dermatol Venereol, 2017, 31(Suppl. 2), p. 5–7.
15. FLOHIL, S. C., VAN DER LEEST, R. J., DOWLATSHAHI, E. A. et al. Prevalence of actinic keratosis and its risk factors in the general population: the Rotterdam Study. J Invest Dermatol, 2013, 133(8), p. 1971–1978.
16. GLOGAU, R. G. The risk of progression to invasive disease. J Am Acad Dermatol, 2000, 42(1 Pt 2), p. 23–24.
17. GREEN, A., WILLIAMS, G., NEALE, R., HART, V. et al. Daily sunscreen application and betacarotene supplementation in prevention of basal-cell and squamous - cell carcinomas of the skin: a randomised controlled trial. Lancet, 1999, 354 (9180), p. 723–729.
18. GUPTA, A. K., COOPER, E. A., FELDMAN, SROV. et al. A survey of office visits for actinic keratosis as reported by NAMCS, 1990–1999. National Ambulatory Medical Care Survey. Cutis, 2002, 70(2 Suppl), p. 8–13.
19. HADLEY, G., DERRY, S., MOORE, R. A. Imiquimod for actinic keratosis: systematic review and meta-analysis. J Invest Dermatol., 2006, 126(6), p. 1251–1255.
20. HERCOGOVÁ, J. a kol. Klinická Dermatoverelogie 1. díl, Praha: Mladá fronta a.s., 2019. 863 s. ISBN 978 - 80-204-5321-1.
21. HOOGENDIJK-VAN DEN AKKER, J. M., HARDEN, P. N., de FIJTER, J. W. et al. Two-year randomized controlled prospective trial converting treatment of stable renal transplant recipients with cutaneous invasive squamous cell carcinomas to sirolimus. J Clin Oncol., 2013, 31(10), p. 1317–1323.
22. CHEN, G. J., FELDMAN, S. R., WILLIFORD, P. M. et al. Clinical diagnosis of actinic keratosis identifies an elderly population at high risk of developing skin cancer. Dermatol Surg, 2005, 31(1), p. 43–47.
23. CHEN, A. C., MARTIN, A. J., DAMIAN, D. L. et al. A phase 3 randomized trial of nicotinamide for skin-cancer prevention. N Engl J Med., 2015, 373(17), p. 1618–1626.
24. CHEN, A. C., MARTIN, A. J., DAMIAN, D. L. et al. A phase II randomized controlled trial of nicotinamide for skin cancer chemoprevention in renal transplant recipients. Br J Dermatol., 2016, 175(5), p. 1073–1075.
25. JANSEN, M. H. E., KESSELS, J., NELEMANS, P. J. et al. Randomized trial of four treatment approaches for actinic keratosis. N Engl J Med., 2019, 380, p. 935–946.
26. JIRAKULAPORN, T., ENDRIZZI, B., DUDEK, AZ. et al. Capecitabine for skin cancer prevention in solid organ transplant recipients. Clin Transpl., 2011, 25(4), p. 541–548.
27. KANG, S., GOLDFARB, M. T., GRIFFITHS, C. E. et al. Assessment of adapalene gel for the treatment of actinic keratoses and lentigines: a randomized trial. J AmAcad Dermatol., 2003, 49(1), p. 83–90.
28. KARIA, P. S., AZZI, J. R., SCHMULTS, C. D. et al. Association of sirolimus use with risk for skin cancer in a mixed-organ cohort of solid-organ transplant recipients with a history of cancer. JAMA Dermatol., 2016, 152(5), p. 533–540.
29. KLEIN, A. M., BRASH, D. E., JONES, P. H. et al. Stochastic fate of p53-mutant epidermal progenitor cells is tilted toward proliferation by UVB during preneoplasia. Proc Natl Acad Sci USA, 2010, 107(1), p. 270–275.
30. KNIP, M., DOUEK, I. F., GALE, E. A. et al. European Nicotinamide Diabetes Intervention Trial Group. Safety of high-dose nicotinamide: a review. Diabetologia, 2000, 43, p. 1337–1345.
31. KOVACH, B. T., SAMS, H. H., STASKO, T. Systemic strategies for chemoprevention of skin cancers in transplant recipients. Clin Transpl., 2005, 19(6), p. 726–734.
32. KRAEMER, K. H., DIGIOVANNA, J. J., PECK, G. L. et al. Prevention of skin cancer in xeroderma pigmentosum with the use of oral isotretinoin. N Engl J Med., 1988, 318(25), p. 1633–1637.
33. KRAJSOVÁ, I. a kol. Maligní kožní nádory. Praha: Mladá fronta a.s., 2017. 287 s. ISBN 978-80-204 - 4186-7.
34. KREJČÍ, D., SVOBODOVÁ, I., PEHALOVÁ, L. a kol. Novotvary 2017 ČR. Praha: ÚZIS. 2020. 350 s. ISSN: 1210 - 857X.
35. LEBWOHL, M., SWANSON, N., BERMAN, B. et al. Ingenol mebutate gel for actinic keratosis. N Engl J Med., 2012, 366(11), p. 1010–1019.
36. LENS, M., MEDENICA, L. Systemic retinoids in chemoprevention of non-melanoma skin cancer. Expert Opin Pharmacother., 2008, 9(8), p. 1363 – 1374.
37. MADANI, S., MARWAHA, S., DUSENDANG, J. R. et al. Ten-Year Follow-up of Persons With Sun-Damaged Skin Associated With Subsequent Development of Cutaneous Squamous Cell Carcinoma. JAMA Dermatol, 2021 [EPub Ahead of Print].
38. MAHMOUD, B. H., HEXSEL, C. L., HAMZAVI, I. H. et al. Effects of Visible Light on the Skin. Photochemistry and Photobiology, 2008, 84, p. 450–462.
39. MATHEW, T., KREIS, H., FRIEND, P. Two-year incidence of malignancy in sirolimus-treated renal transplant recipients: results from five multicenter studies. Clin Transpl., 2004, 18(4), p. 446 – 449.
40. MCKENNA, D. B., MURPHY, G. M. Skin cancer chemoprophylaxis in renal transplant recipients: 5 years of experience using low-dose acitretin. Br J Dermatol., 2001, 140(4), p. 656–660.
41. MCKERROW, K. J., MACKIE, R. M., PEARSON, C. et al. The effect of oral retinoid therapy on the normal human immune system. Br J Dermatol., 1988, 119(3), p. 313–320.
42. MIKHAIL, G. R. Cancers, Precancers, and Pseudocancers on the Male Genitalia A Review of Clinical Appearances, Histopathology, and Management. The Journal of Dermatologic Surgery and Oncology, 1980, 6(12), p. 1027–1035.
43. MISIEWICZ, J., SENDAGORTA, E., GOLEBIOWSKA, A. Topical treatment of multiple actinic keratoses of the face with arotinoid methyl sulfone (Ro 14-9706) cream versus tretinoin cream: a double-blind, comparative study. J Am Acad Dermatol., 1991, 24(3), p. 448–451.
44. MORTON, C. A., BIRNIE, A. J., EEDY, D. J. et al. British Association of Dermatologists’ guidelines for the management of squamous cell carcinoma in situ (Bowen’s disease) 2014. Br J Dermatol, 2014, 170(2), p. 245–260.
45. MOSHELL, A. N. Prevention of skin cancer in xeroderma pigmentosum with oral isotretinoin. Cutis, 1989, 43(5), p. 485–490.
46. MURANUSHI, C., OLSEN, C. M., PANDEYA, N. et al. Aspirin and nonsteroidal anti-inflammatory drugs can prevent cutaneous squamous cell carcinoma: a systematic review and metaanalysis. J Invest Dermatol., 2015, 135(4), p. 975–983.
47. NANCE, F. C., DELOACH, D. H., WELSH, R. A., BECKER, W. F. Paget‘s disease of the breast. Ann Surg, 1970, 171(6), p. 864–874.
48. NGAN, V., OAKLEY, A., ROWAN, D. Vulvar intraepithelial neoplasia. Dostupné na www: https://www. dermnetnz.org/topica/vulval-intraepithelial-neoplasia.
49. OAKLEY, A. Lower anogenital squamous terminology. Dostupné na www: https://www.dermnetnz. org/topics/lower-anogenital-squamous-terminology.
50. OTLEY, C. C., STASKO, T., LEBWOHL, M. et al. Chemoprevention of nonmelanoma skin cancer with systemic retinoids: practical dosing and management of adverse effects. Dermatol Surg., 2006, 32(4), p. 562–568.
51. PATEL, G. K., GOODWIN, R., CHAWLA, M. et al. Imiquimod 5% cream monotherapy for cutaneous squamous cell carcinoma in situ (Bowen’s disease): a randomized, double blind, placebo-controlled trial. J AmAcadDermatol., 2006, 54(6), p. 1025–1032.
52. PINNELL, S. R. Cutaneous photodamage, oxidative stress, and topical antioxidant protection. J Am Acad Dermatol., 2003, 48(1), p. 1–19.
53. PIRARD, D., VEREECKEN, P., HEENEN, M. et al. Three percent diclofenac in 2.5% hyaluronan gel in the treatment of actinic keratoses: a meta-analysis of the recent studies. Arch Dermatol Res., 2005, 297(5), p. 185–189.
54. PRENS, S. P., de VRIES, K., PRENS, E. P. et al. Non-ablative fractional resurfacing in combination with topical tretinoin cream as a field treatment modality for multiple actinic keratosis: a pilot study and a review of other field treatment modalities. J Dermatolog Treat., 2013, 24(3), p. 227–231.
55. QUE, S. K. T., ZWALD, F. O., SCHMULTS, C. D. Cutaneous squamous cell carcinoma: Incidence, risk factors, diagnosis, and staging. J Am Acad Dermatol, 2018, 78(2), p. 237–247.
56. QUE, S. K. T., ZWALD, F. O., SCHMULTS, C. D. Cutaneous squamous cell carcinoma, Management of advanced and high-stage tumors. J Am Acad Dermatol, 2018, 78(2), p. 249–261.
57. SALIM, A., LEMAN, J. A., MORTON, C. A. et al. Randomized comparison of photodynamic therapy with topical 5-fluorouracil in Bowen’s disease. Br J Dermatol., 2003, 148(3), p. 539–543.
58. SEANZ-SARDÁ, X., CARRATO, C., PERÉZ-ROCA, L. et al. Epithelial-to-mesenchymal transition contributes to invasion in squamous cell carcinomas originated from actinic keratosis through the differentiated pathway whereas proliferation plays a more significant role in the classical pathway. J Eur Acad Dermatol Venereol, 2017, 32(4), p. 581–586.
59. SCHMITZ, L., GAMBICHLER, T., GUPTA, G. et al. Actinic keratosis area and severity index (AKASI) is associated with the incidence of squamous cell carcinoma. J Eur Acad Dermatol Venereol., 2018, 32(5), p. 752–756.
60. SCHMULTS, C. D. et al. High-Risk Cutaneous Squamous Cell Carcinoma – A Practical Guide for Patient Management. Berlin: Springer International Publishing, 2016. 261 p. ISBN 978-3-662 - 47080-0.
61. STOCKFLETH, E., SCHMITZ, L. Braun-Falco´s Dermatology, Malignant Epithelial Tumors. Berlin: Springer International Publishing, 2020. 24 p. ISBN 978 - 3-662-58713-3.
62. SURJANA, D., HALLIDAY, G. M., DAMIAN, D. L. Nicotinamide enhances repair of ultraviolet radiation - induced DNA damage in human keratinocytes and ex vivo skin. Carcinogenesis, 2013, 34(5), p. 1144–1149.
63. VAN DER POLS, J. C., WILLIAMS, G. M., PANDEYA, N. et al. Prolonged prevention of squamous cell carcinoma of the skin by regular sunscreen use. Cancer Epidemiol Biomarkers Prev., 2006, 15(12), p. 2546–2548.
64. WEINSTOCK, M. A., BINGHAM, S. F., VERTREES, J. E. et al. Veterans Affairs Topical Tretinoin Chemoprevention Trial Group. Tretinoin and the prevention of keratinocyte carcinoma (basal and squamous cell carcinoma of the skin): a Veterans Affairs randomized chemoprevention trial. J Invest Dermatol., 2012, 132(6), p. 1583–1590.
65. WERNER, R. N., SAMMAIN, A., ERDMANN, R. et al. The natural history of actinic keratosis: a systematic review. Br J Dermatol, 2013, 169(3), p. 502–518.
66. WIEGELL, S. R., HAEDERSHAL M., WULF, H. C. et al. Continuous activation of PpIX by daylight is as effective as and less painful than conventional photodynamic therapy for actinic keratoses; a randomized, controlled, single-blinded study. Br J Dermatol., 2008, 158(4), p. 740–746.
67. WIEGELL, S. R., HAEDERSHAL M., WULF, H. C. et al. Photodynamic therapy of actinic keratoses with 8% and 16% methyl aminolaevulinate and home-based daylight exposure: a double-blinded randomized clinical trial. Br J Dermatol., 2009, 160(6), p. 1308–1314.
68. WIEGELL, S. R., FABRICIUS, S., WULF, H. C. et al. A randomized, multicentre study of directed daylight exposure times of 1½ vs 2½ h in daylight-mediated photodynamic therapy with methyl aminolaevulinate in patients with multiple thin actinic keratoses of the face and scalp. Br J Dermatol., 2011, 164(5), p. 1083–1090.
69. WILLENBRINK, T. J., RUIZ, E. S., CORNEJO, CHM. et al. Field cancerization: Definition, epidemiology, risk factors, and outcomes. J Am Acad Dermatol., 2020, 83(3), p. 709–717.
70. WOLLINA, U., HANSEL, G., KÖSTLER, E. et al. Oral capecitabine plus subcutaneous interferon alpha in advanced squamous cell carcinoma of the skin. J Cancer Res Clin Oncol., 2005, 131(5), p. 300–304.
71. YIASEMIDES, E., SIVAPIRABU, G., DAMIAN, D. L. et al. Oral nicotinamide protects against ultraviolet radiation induced immunosuppression in humans. Carcinogenesis, 2009, 30(1), p. 101–105.
72. YU, R. C., PRYCE, D. W., MACFARLANE, A. W. et al. A histopathological study of 643 cutaneous horns. Br J Dermatol, 1991, 124(5), p. 449–452.
73. ZALAUDEK, I., ARGENZIANO, G., GIACOMEL, J. et al. Dermatoscopy of Non-Pigmented Skin Tumors: Pink – Think – Blink (1st ed.). Boca Raton: CRS Press, 2015. 158 p. ISBN 978-1-4822-3753-5.
Štítky
Dermatologie Dětská dermatologie
Článek KONTROLNÍ TESTČlánek Odborné akce 2021
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2021 Číslo 5- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Význam lokální oxygenoterapie a ozonoterapie pro léčbu nehojivých ran
-
Všechny články tohoto čísla
- Terapeutické možnosti u aktinické keratózy a dlaždicobuněčného carcinoma in situ
- KONTROLNÍ TEST
- Recidivující herpetické paronychium. Popis případu
- Tvrdé noduly na skrotu. Stručný přehled
- Případ kombinovaného névu s pigmentovaným epiteloidním melanocytomem. Popis případu
- Odborné akce 2021
- 16. KONGRES ČESKÝCH A SLOVENSKÝCH DERMATOVENEROLOGŮ
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické možnosti u aktinické keratózy a dlaždicobuněčného carcinoma in situ
- 16. KONGRES ČESKÝCH A SLOVENSKÝCH DERMATOVENEROLOGŮ
- Recidivující herpetické paronychium. Popis případu
- Tvrdé noduly na skrotu. Stručný přehled
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání