-
Články
- Vzdělávání
- Časopisy
Top články
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
A new target in the treatment of psoriatic arthritis. Why interleukin-17?
Interleukin 17 is a pro-inflammatory cytokine that plays an important role in the development of psoriasis, psoriatic arthritis and other autoimmune diseases. It is produced by various cells, especially Th17 lymphocytes. Its inhibition has a pronounced anti-inflammatory effect, manifested, for example, by the suppression of psoriasis skin manifestations and by the reduction of psoriatic arthritis activity. The pathway to achieve inhibition of IL-17 is the use of monoclonal antibodies against IL-17 as well as its receptors, through antibodies against the p40 subunit shared by IL-12 and 23, and preventing their interaction with the receptor, subsequent signalling, differentiation, and cytokine production, including IL-17. IL-17 inhibitors are a new, very effective generation of psoriasis biological therapy, as well as a significant extension of the biological spondyloarthritis therapies to the first drugs with a new, different mechanism of action. Therefore, IL-17 inhibitors represent similar advances as TNF-α inhibitors in rheumatoid arthritis years ago.
Keywords:
Psoriasis – biological therapy – anti-TNF-α – anti-IL-12/23 – IL-17 – anti-IL-17 – Psoriatic arthritis
Autoři: L. Šedová
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 2, p. 78-85.
Kategorie: Přehledový článek
Souhrn
Interleukin 17 je prozánětlivě působící cytokin, který hraje důležitou úlohu při rozvoji psoriázy, psoriatické artritidy a jiných autoimunitních chorob. Je produkován různými buňkami, především Th17-lymfocyty. Jeho inhibice má výrazný protizánětlivý účinek, který se projevuje např. potlačením kožních projevů psoriázy i snížením aktivity psoriatické artritidy. Cesta k dosažení inhibice IL-17 vede přes monoklonální protilátky proti jeho součástem i proti jeho receptorům, přes protilátky proti p40 podjednotce sdílené IL-12 a -23 a zabraňující jejich interakci s receptorem, následnou signalizaci, diferenciaci, a produkci cytokinů, včetně IL-17.
Inhibitory IL-17 představují novou, velmi účinnou generaci biologické léčby psoriázy a také významné rozšíření palety biologické terapie spondyloartritid o léčiva první volby s novým, odlišným mechanismem účinku. Účinnost inhibitorů IL-17 v léčbě psoriázy převyšuje účinnost inhibitorů TNF-α a u psoriatické artritidy je jejich účinnost srovnatelná. Inhibitory IL-17 znamenají proto zde podobný pokrok, jako před lety inhibitory TNF-α u revmatoidní artritidy.
Klíčová slova:
biologická terapie – anti-TNF-α – anti-IL-12/23 – IL-17 – anti-IL-17 – psoriáza – psoriatická artritida
ÚVOD
V posledních dekádách došlo k zásadnímu pochopení patogeneze autoimunitních onemocnění, jako jsou revmatoidní a psoriatická artritida, ankylozující spondylitida, psoriáza a také idiopatické střevní záněty (1).
Pochopení patogenetických mechanismů a technologický rozvoj umožnily rozšířit terapeutické možnosti o protilátky a solubilní receptory cílící na konkrétní úrovně zánětu. Jedním z nich je např. tumor nekrotizující faktor alfa (TNF-α), který hraje v rámci těchto chorob klíčovou roli při poškozující zánětlivé reakci. Nicméně se stále setkáváme s vysokým procentem pacientů, u kterých nedokážeme dosáhnout terapeutického cíle ve smyslu remise, nebo alespoň nízké aktivity choroby. Existují tedy pacienti rezistentní na léčbu, a je proto nutné pokračovat ve výzkumu a objasňování všech patogenetických cest udržujících zánět nebo vedoucích k zánětu.
Vzhledem k nálezu zvýšeného počtu buněk Th17 produkujících interleukin 17 (IL-17) v periferní krvi, synoviální tkáni a psoriatických kožních lezích a korelujících koncentrací tohoto cytokinu s aktivitou onemocnění u pacientů s psoriatickou artritidou (PsA) se otevřela otázka možnosti terapeutického ovlivnění osy Th17.
PŮVOD, STRUKTURA A MÍSTO IL-17 V MECHANISMU ZÁNĚTU
T-lymfocyty se klasicky dělí na dvě populace, CD4+ a CD8+ T-buňky, a to na základě exprese odlišných receptorů – „cluster of differentiation“ (CD). CD8+ T-buňky jsou cytotoxické T-lymfocyty, zatímco CD4+ T-buňky, zvané „helpers“, vydávají pomocné signály imunitnímu systému (2). Mezi CD4+ T-lymfocyty diferencujeme Th1 (pomocné) podporující buněčnou imunitu proti nitrobuněčným patogenům, a to produkcí cytokinů, a Th2 podporující protilátkovou odpověď. Th1-lymfocyty hrají významnou roli v řadě autoimunitních nemocí.
Interleukin-17 je prozánětlivý cytokin s klíčovou rolí v akutní obraně proti extracelulárním bakteriálním a plísňovým infekcím. Byl poprvé popsán v roce 1993 a jeho receptor v roce 1995 na populaci Th-lymfocytů produkujících tento cytokin. Takto byla o 10 let později v roce 2006 definována nová subpopulace Th-lymfocytů – Th17 vyvíjející se diferenciací z CD4+ T-lymfocytů nezávisle na Th1 a Th2 transkripčních programech. Na rozdíl od Th1 - a Th2-lymfocytů, které se zdají být konečně diferenciovanými buňkami, Th17 mají vyšší míru vývojové plasticity (3).
Než se z naivních T-buněk stávají aktivovanými Th17-lymfocyty, musí být stimulované dendritickými buňkami za pomocí cytokinů TGF-β a IL-6, IL-1β a IL-23. Tato stimulace umožňuje expresi receptoru IL-23 na povrchu Th17-lymfocytů a další aktivaci IL-23. Toto vede k maturaci a stabilizaci Th17-lymfocytů a zvýšené produkci prozánětlivých cytokinů, zejména interleukinů 17, 21 a 22. Interleukin 21 působí i jako pozitivní zpětná vazba a proliferaci Th17-lymfocytů dále stimuluje.
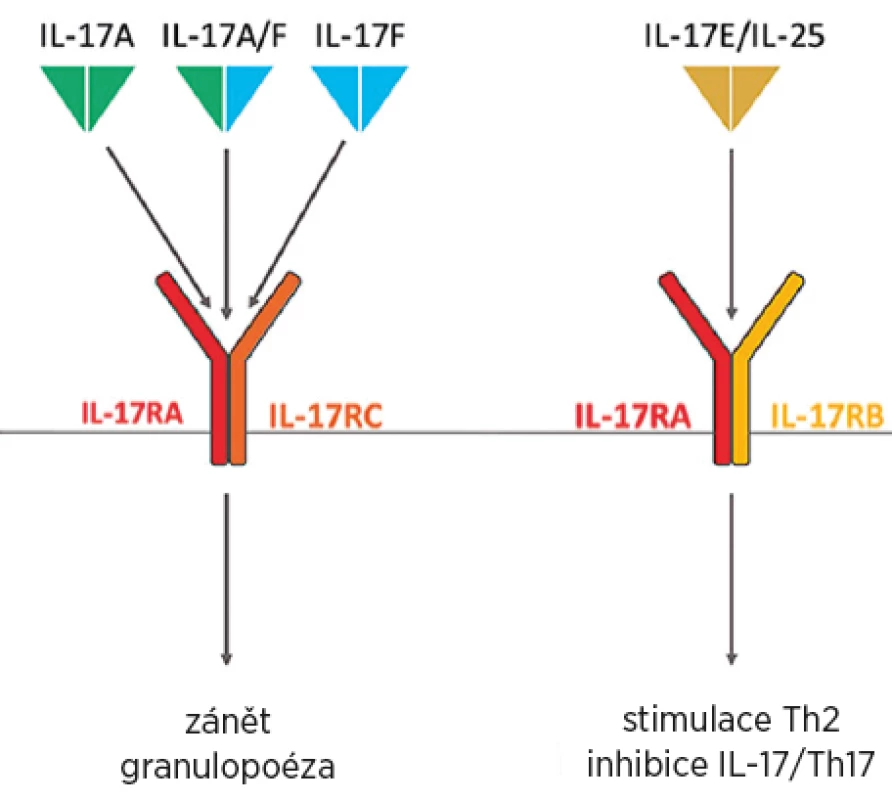
Rodina IL-17 se vyskytuje, stejně jako převážná část ostatních interleukinů, ve formě dimerů. Tyto dimery mohou být tvořeny šesti různými podjednotkami označovanými A–F (4). Nejsilnější prozánětlivý účinek u autoimunitních onemocnění má IL-17A, menší prozánětlivou i destruktivní aktivitu má IL-17F. Role obou při obranyschopnosti proti extracelulárním infekcím je srovnatelná. Funkce ostatních izotypů IL-17 nebyla zatím úplně objasněna (5). IL-17A může být homodimerem A/A nebo heterodimerem A/F (obr. 1) a v obou případech se označuje jako IL-17A (6).
Receptor pro IL-17A v homodimerní i heterodimerní formě je tvořen ze dvou řetězců – IL-17RA a IL-17RC a jejich kombinace je nezbytná pro receptorovou funkci (obr. 1) (7).
Obvyklá obranná reakce organismu na patogeny indukuje sekreci IL-23 a tímto diferenciaci a aktivaci Th17-lymfocytů s následnou produkcí IL-17, který je fyziologicky odpovědný za diferenciaci i aktivaci (přes indukci faktoru stimulujícího granulocytární kolonie – G-CSF) a migraci neutrofilů k místě zánětu (přes IL-8). IL-17A hraje proto důležitou úlohu pro přežívání a homeostázu neutrofilů a v obraně proti extracelulárním patogenům, jako jsou klebsiely, stafylokoky a kandidy (8).
IL-17F je méně aktivní než IL-17A, ale vzhledem k synergii s TNF-α má stejně jako IL-17A prozánětlivou roli.
Na rozdíl od aktivity IL-17A a F má další člen rodiny IL-17E (také zvaný IL-25) naopak protizánětlivou aktivitu tím, že inhibuje prozánětlivý účinekIL-17A i F (9) (obr. 1). Pokud dochází k poruše rovnováhy mezi IL-17A a IL-25 ve prospěch produkce IL-17A proti jeho inhibici, dochází k perpetuaci zánětu (10).
Ve střevě indukuje IL-17 produkci mucinů a defenzinů, dále i sekreci jiných prozánětlivých cytokinů (TNF-α, IL-6), GM-CSF a adhezivních molekul. Th17--buňky produkují také IL-22, který indukuje syntézu dalších chemokinů i antimikrobiálních peptidů, jež mají zásadní úlohu při udržení integrity střevního epitelu (11).
Interleukiny 17 a 23 navíc vyvolávají na prekurzorech osteoklastů expresi receptoru RANK (receptor aktivující nukleární faktor kappa B) (12, 13) a tím podporují osteoklastogenezi přímo, prostřednictvím RANK a faktoru stimulujícího kolonie makrofágů (M-CSF), ale i nepřímou cestou stimulace produkce TNF-α (14–16).
Blokáda osy IL-17 jednak přímou inhibicí a potom omezením diferenciace Th17-lymfocytů je v současnosti předmětem širokého zájmu (17).
PSORIÁZA, PSORIATICKÁ ARTRITIDA A IL-17
Psoriatická artritida se vyskytuje až u 30 % pacientů s psoriázou (Ps) (18).
Prevalence Ps se v závislosti na genetické variaci geograficky liší v rozmezí od 1 % do 3 % populace (19).
Od objevu IL-17 a zejména důležité role IL-23/Th17 signální dráhy v patogenezi Ps se tato oblast stála předmětem zájmu pro ty, kteří se zajímají o patogenezi Ps a psoriatické artritidy.
Předpokládá se, že u geneticky predisponovaných jedinců mohou vnější nebo vnitřní stimuly, jako jsou mikrobiální antigeny, změny ve střevním mikrobiomu, biomechanický stres a/nebo imunologická dysregulace, vést ke zvýšené expresi cytokinů, jako je IL-23. A tento zase stimuluje diferenciaci a aktivaci Th17-lymfocytů a dalších imunitních buněk, které jsou součástí vrozeného imunitního systému spouštějícího adaptivní imunitní procesy, ale i chronické zánětlivé choroby.
U pacientů s Ps a psoriatickou artritidou bylo popsáno signifikantní zvýšení cirkulujících Th - buněk, produkujících interleukiny 17 a 22 v krvi (20, 21).
Inhibice IL-17A podporuje v kůži omezení hyperplazie keratinocytů a potlačení akantózy, dramatické omezení diferenciace kožních Th17-buněk a také produkci IL-17A, IL-17F, IL-21 a IL-22 (22). V synoviální tekutině omezuje množství Th17-lymfocytů, jejichž množství koreluje s aktivitou choroby a progresí kloubního poškození (23). Synoviální hladiny mRNA pro IL-23 také významně korelují se sérovou hladinou C-reaktivního proteinu a počtem oteklých kloubů u psoriatické artritidy (24).
Zvýšená produkce IL-17 byla pozorována také u řady dalších onemocnění autoimunitního původu, jako jsou spondyloartritidy, roztroušená skleróza, revmatoidní artritida a Crohnova choroba (25).
Blokáda osy Th17 buď inhibicí přímo IL-17, nebo omezením diferenciace Th17-lymfocytů se proto jeví jako velmi přínosný přístup k léčbě Ps a psoriatické artritidy zejména tam, kde selhávají inhibitory TNF-α, nebo kde existuje jejich kontraindikace (26).
STRATEGIE BLOKÁDY IL-17
Přesná vazebná afinita, buněčná distribuce a následné působení receptorů IL-17 nebyly dosud plně objasněny. Přesto je evidentní, že dostaneme kvalitativně i kvantitativně odlišnou odpověď při blokádě vlastního interleukinu nebo jeho receptoru.
Blokáda IL-17
Vzhledem k tomu, že IL-17A může být homodimer A/A nebo A/F, byly vytvořeny protilátky blokující obě formy tohoto interleukinu.
IL-17A/A blokuje humánní monoklonální protilátka zvaná secukinumab (SCK). Je to lidská monoklonální protilátka typu IgG1 proti IL-17A (27). Byl schválen FDA i EMA pro léčbu dospělých pacientů se středně těžkou až těžkou Ps i pro léčbu psoriatické artritidy a ankylozující spondylitidy. Schválení pro Ps proběhlo na základě výsledků tří randomizovaných studií (28–30), v nichž byl prokázán lepší efekt SCK oproti etanerceptu, ustekinumabu (USK) a placebu. Další studie prokázaly větší účinnost SCK hodnocenou jako PASI 90 (psoriasis area and index) (31) ve srovnání s USK po 16 týdnech léčby (32).
Účinnost v PsA prokázal SCK ve dvou rozsáhlých klinických studiích fáze III (FUTURE 1, 2), kde ukázal superioritu ve srovnání s placebem (54 % pacientů na 300 mg SCK dosáhlo 20% zlepšení v týdnu 24 ve srovnání s 1% v placebově skupině) s rychlými a příznivými klinickými účinky včetně počtu oteklých a bolestivých kloubů, daktylitid a entezitid (33). Mezi nejčastější nežádoucí účinky patřily nazofaryngitida, bolesti hlavy, nevolnost, závratě, únava a průjem (28). Ve studii fáze III u ložiskové psoriázy FIXTURE byla incidence nežádoucích účinků u pacientů s SCK a etanerceptem podobná. U SCK a USK byl pozorován nízký výskyt mírných až středně závažných kandidových infekcí a nebyly hlášeny žádné případy TB reaktivace (34).
V extenzi studie FUTURE 1 (102 týdnů) u psoriatické artritidy, kterou dokončilo 476 pacientů (78,5 %), byla účinnost SCK setrvalá po celou dobu studie ve všech sledovaných parametrech, včetně aktivity nemoci, kvality života, fyzické funkce, rozsahu kožního postižení, daktylitid a entezitid. Byla hodnocena i rentgenová progrese, přičemž většina léčených pacientů v průběhu sledování neprogredovala (84,3 % u dávky 150 mg, 83,8 % u dávky 75 mg za měsíc). Dvouleté sledování nepřineslo žádné další neočekávané nežádoucí účinky a imunogenita léku byla nízká (35).
Ixekizumab (IXK) je humanizovaná monoklonální IgG4 protilátka, která se váže na IL-17A s velkou afinitou a tím znemožňuje jeho vazbu na receptor (36). Váže se nejen na homodimerní formu IL-17A/A, ale i na heterodimérní formu 17A/F (37). FDA schválila IXK v březnu 2016 pro léčbu středně závažné a závažné plakové Ps a v současnosti má i schválení EMA. Vycházelo se při tom z výsledků tří studií fáze III UNCOVER 1, 2 a 3 (38–40). Studie s IXK zahrnují více než 3800 pacientů se středně těžkou až těžkou plakovou Ps a v nich byla prokázána jeho superiorita oproti etanerceptu, ustekinumabu a placebu. Ve studii fáze II s otevřeným prodloužením (OLE) bylo navíc prokázáno, že pacienti s dobrou účinností IXK si zachovávají klinickou odpověď po dobu 1 roku bez závažných nežádoucích účinků (39, 41). K ověření jeho účinnosti u PsA byly provedeny dvě studie fáze III v rámci projektu SPIRIT. Studie SPIRIT-P1 a -P2 prokázala účinnost IXK na klinické parametry PsA (počet oteklých a bolestivých kloubů, entezitidy, daktylitidy, pacientské dotazníky, postižení kůže a nehtů), ale také z hlediska progrese rtg poškození. Studie SPIRIT-P1 byla koncipována pro pacienty s PsA selhávající na chemických DMARDs a kromě kontroly placebem měla také větev s adalimumabem jako aktivní referenci v rámci analýzy senzitivity studie. Nejednalo se tedy o „head to head“ studii s účelem srovnat tyto oba biologické léky. Pacientům byl IXK podán v dávce 80 mg buď 1krát za 14 dní, nebo za 4 týdny po úvodní dávce 160 mg v první den terapie. Výsledky studie přináší tabulka 1 (42). Studie SPIRIT-P2 byla placebem kontrolovaná a zkoumala účinnost a bezpečnost IXK u pacientů s aktivní PsA, u kterých v minulosti selhala léčba inhibicí TNF-α (43). Studie prokázala zlepšení symptomů a bezpečnostní profil byl v souladu s předchozími studiemi s IXK. Mezi nejčastější nežádoucí účinky hlášené během klinických studií patří infekce horních dýchacích cest, reakce v místě vpichu a bolest hlavy. U pacientů, kteří dostávali IXK, byla hlášena i mírná neutropenie (44). V současné době je schválen i pro léčbu PsA.
Tab. 1. Výsledky studie SPIRIT-P1 a P2 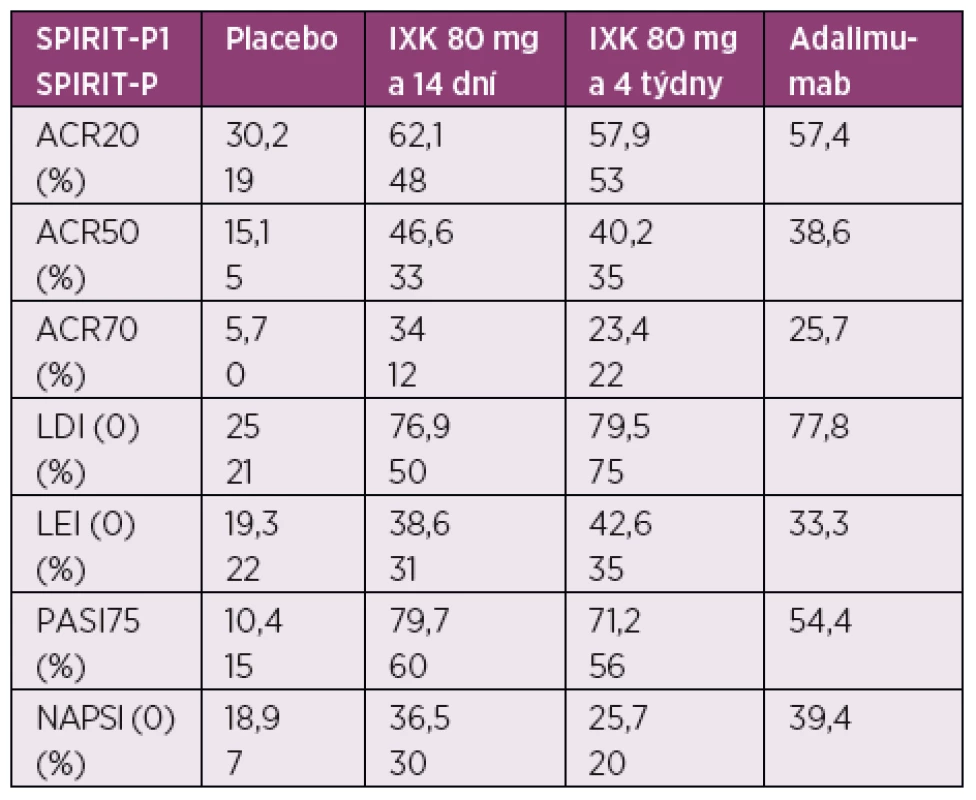
ACR – American College of Rheumatology, LDI (0) – vymizení dactylitidy měřeno Leeds Dactylitis Index, LEI (0) – vymizení entezitidy měřeno Leed Enthesitis Index, PASI75 – Psoriasis Area Severity Index 75 response rate, NAPSI (0) – vymizení postižení nehtů měřeno Nail Psoriasis Severity Index Bimekizumab blokuje IL-17 v obou formách – IL-17A (homodimerní A/A i heterodimerní A/F) i IL-17F (v homodimerní formě F/F), a prokázal účinnost jak u Ps, tak i u PsA. Tento preparát je ve fázi klinických studií.
Blokáda receptoru pro IL-17
Brodalumab je IgG2 monoklonální protilátka, která selektivně cílí na lidský IL-17RA a antagonizuje IL-17 dráhu. Inhibuje reaktivitu nejen IL-17A, ale také IL-17F a IL-17E (45). Účinnost a bezpečnost při léčbě středně těžké až těžké Ps byla prokázána ve studiích fáze II a III, ve kterých byl porovnán s ustekinumabem a placebem (46).
Ve 12. týdnu bylo dosaženo skóre PASI-90 u 70,3 % pacientů ve srovnání s 0,9 % na placebu. Dále bylo dosaženo PASI-100 u 41,9 % pacientů ve srovnání s 0,05 % ve skupině s placebem (46). Nežádoucí účinky byly častější u skupiny s brodalumabem než u skupiny ustekinumabem (47). Nejčastěji se vyskytovali infekce horních cest dýchacích, artralgie, bolesti hlavy a kandidózy. V roce 2015 společnost Amgen ukončila účast na projektu související s brodalumabem z důvodu dvou úmrtí v důsledku sebevraždy. V projektu pokračuje AstraZeneca a Valeant. Kauzalita mezi léčbou brodalumabem a zvýšeným rizikem sebevražedných myšlenek a chování nebyla dosud prokázána. Vzhledem k pozorovanému riziku obsahuje SPC v tomto smyslu varování s nutnosti pečlivě zvážit poměr rizika a přínosu.
Byl schválen v USA a Japonsku v únoru 2017 pro léčbu Ps a v současné době je schválen i v Evropě.
Ovlivnění diferenciace Th17-lymfocytů
Zcela nepostradatelný pro diferenciaci Th17 v zánětlivé efektorové buňky je IL-23 (48). Je členem tzv. super-rodiny heterodimerního IL-12 secernovaného dendritickými buňkami a tkáňově rezidentními makrofágy (48, 49). Jeho receptor je heterodimer složený z podjednotky IL-23 receptoru (IL-23R) vázající se na p19 a podjednotky vázající se na p40 podjednotku (50).
IL-23R je strukturou příbuzný receptoru vázajícímu se na IL-12p35. Je exprimován několika vrozenými a adaptivními imunitními buňkami, včetně buněk Th17 (51).
Signalizace IL-23R zahrnuje Janusovou kinázu 2 (JAK2) a tyrosinkinázu 2 (TYK2), která fosforyluje signální přenos a aktivátor transkripce (STAT) 3. IL-23 je též významný při imunitní odpovědí během infekce a při zachování bariérové imunity (52).
Ovlivnění diferenciace Th17-lymfocytů: blokáda IL-12 i 23
Ustekinumab (USK) je lidská monoklonální IgG1 protilátka, která cílí na p40 podjednotku sdílenou IL-12 a -23 (34) a zabraňuje tak jejich interakci s receptorem, což blokuje následnou signalizaci, diferenciaci a produkci cytokinů včetně IL-17 (53). Jeho klinický vývojový program pro Ps se skládá ze dvou studií fáze I, 1 studie fáze II a tří studií fáze III (54).
Zdá se, že USK může zvýšit riziko závažných bakteriálních, plísňových, virových infekcí a reaktivaci latentních infekcí. V klinických studiích PHOENIX 1, 2 byly nejčastější vedlejší účinky u psoriatických pacientů hlášeny infekce horních dýchacích cest, bolesti hlavy a artralgie (55–57).
USK obdržel v roce 2009 schválení FDA k léčbě Ps, v roce 2013 schválení FDA k léčbě PsA a v roce 2016 FDA schválení pro Crohnovu chorobu u dospělých pacientů. Aktuálně má USK schválení pro Ps i PsA také od EMA. Při terapii USK nebylo dokumentováno zhoršení projevů roztroušené sklerózy, je proto lékem volby u pacientů s anamnézou demyelinizačního onemocnění (58).
Ovlivnění diferenciace Th17-lymfocytů: blokáda Janusových kináz (JAK)
JAK jsou intracelulární tyrosinové kinázy hrající klíčovou roli v signální dráze mnoha cytokinů, které jsou součástí imunitních reakcí a hematopoézy. Při vazbě cytokinu na receptor a následné dimerizaci receptoru se JAK receptory vzájemně fosforylují. Další fosforylace zprostředkovaná JAK vede k vazbě transkripčního faktoru STAT (signal transducer and activator of transcription protein). Tento protein je pak dále fosforylován a tvoří dimer, přičemž v této podobě je schopen putovat do buněčného jádra, kde nasedá na odpovídající části DNA a ovlivňuje tak transkripci genů.
Jsou známy čtyři Janusovy kinázy (JAK1, 2, 3 a Tyk2). JAK1 je přítomná především v lymfoidních buňkách a jiných tkáních, včetně nervového systému. Je spojená s receptory IL-2, interferonu gama a IL-6, -10, -12 a -23. JAK2 byla popsána v řadě buněk. Inhibuje signální dráhy erytropoetinu a růstových hormonů a ovlivňuje hematopoézu. JAK3 je přítomná především v lymfoidních buňkách a je spojená s receptory IL-2, -4, -7, -9, -15 a -21. Tyk2 lze najít v řadě tkání a buněk a je součástí signalizace interferonů alfa a beta i transdukce IL-6, -10, -12 a -23. Stimulace prostřednictvím IL-6, klíčového mediátoru revmatoidní artritidy, má za následek aktivaci JAK1, JAK2 a Tyk2 kináz. Ovlivnění aktivity Ps a PsA touto signální dráhou je ve stadiu klinických studií (59).
ZÁVĚR
Interleukin 17 hraje významnou úlohu při rozvoji psoriázy a psoriatické artritidy.
Jeho inhibice představuje vysoce účinnou terapii psoriázy, ale i první nový směr biologické léčby PsA s jiným mechanismem účinku, než je blokáda TNF-α.
Inhibice IL-17 může být docílena ovlivněním řady cest signálních drah. Tato léčiva představují významnou naději pro pacienty, u kterých TNF-α inhibitory nepřinesly dostatečnou úlevu od symptomů PsA, nebo u kterých jsou kontraindikovány. V případě Ps bylo za pomocí inhibice IL-17 dosaženo ještě lepších výsledků než dosavadními biologickými preparáty s jiným mechanismem účinku. Bezpečnostní profil se jeví jako velmi příznivý.
Konflikt zájmů: žádný.
MUDr. Liliana Šedová
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: sedova@revma.cz
Zdroje
1. Kim BS, Park YJ, Chung Y. Targeting IL-17 in autoimmunity and inflammation. Arch Pharm Res 2016; 39 : 1537–1547.
2. Gao SF, Zhong B, Lin D. Regulation of T helper cell differentiation by E3 ubiquitin ligases and deubiquitinating enzymes. Int Immunopharmacol. 2017; 42 : 150–156.
3. Gizinski AM, Fox DA. T cell subsets and their role in the pathogenesis of rheumatic disease. Curr Opin Rheumatol 2014; 26 : 204–210.
4. Gaffen SL. Structure and signalling in the IL-17 receptor family. Nat Rev Immunol 2009; 9 : 556–567.
5. Smith JA. The Bench-to-Bedside Story of IL-17 and the therapeutic efficacy of its targeting in spondyloarthritis. Curr Rheumatol Rep 2016; 18 : 33.
6. Chang SH, Dong C. A novel heterodimeric cytokine consisting of IL-17 and IL-17F regulates inflammatory responses. Cell Res 2007; 17 : 435–440.
7. Wright JF, Guo Y, Quazi A, et al. Identification of an interleukin 17F/17A heterodimer in activated human CD4+ T cells. J Biol Chem 2007; 282 : 13447–13455.
8. Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation. Immunity 2008; 28 : 454–467.
9. Kleinschek MA, Owyang AM, Joyce-Shaikh B, et al. IL-25 regulates Th17 function in autoimmune inflammation. J Exp Med 2007; 204 : 161–170.
10. Miossec P. Update on interleukin-17: a role in the pathogenesis of inflammatory arthritis and implication for clinical practice RMD Open 2017; 3: e000284.
11. McGeachy MJ, Chen Y, Tato CM, et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol 2009; 10 : 314–324.
12. Adamopoulos IE, Chao CC, Geissler R, et al. Interleukin-17A upregulates receptor activator of NF-kappa B on osteoclast precursors. Arthritis Res Ther 2010; 12: R29.
13. Chen L, Wei XQ, Evans B, et al. IL-23 promotes osteoclast formation by up-regulation of receptor activator of NF-kappa B (RANK) expression in myeloid precursor cells. Eur J Immunol 2008; 38 : 2845–2854.
14. Yago T, Nanke Y, Ichikawa N, et al. IL-17 induces osteoclastogenesis from human monocytes alone in the absence of osteoblasts, which is potently inhibited by anti-TNF-alpha antibody: a novel mechanism of osteoclastogenesis by IL-17. J Cell Biochem 2009; 108 : 947–955.
15. Kotake S, Udagawa N, Takahashi N, et al. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis. J Clin Invest 1999; 103 : 1345–1352.
16. Huang H, Kim HJ, Chang EJ, et al. IL-17 stimulates the proliferation and differentiation of human mesenchymal stem cells: implications for bone remodelling. Cell Death Differ 2009; 16 : 1332–1343.
17. Bartlett HS, Million RP. Targeting the IL-17-T(H)17 pathway. Nat Rev Drug Discov 2015; 14 : 11–12.
18. Ogdie A, Weiss P. The epidemiology of psoriatic arthritis. Rheum Dis Clin North Am 2015; 41 : 545–568.
19. Michalek IM, Loring B, John SM. A systematic review of worldwide epidemiology of psoriasis. Eur Acad Dermatol Venereol 2017; 31 : 205–212.
20. Benham H, Norris P, Goodall J, et al. Th17 and Th22 cells in psoriatic arthritis and psoriasis. Arthritis Res Ther 2013; 15: R136.
21. Mashiko S, Bouguermouh S, Rubio M, et al. Human mast cells are major IL-22 producers in patients with psoriasis and atopic dermatitis. J Allergy Clin Immunol 2015; 136 : 351–359.
22. Balato A, Scala E, Balato N, et al. Biologics that inhibit the Th17 pathway and related cytokines to treat inflammatory disorders. Expert Opin Biol Ther 2017; 17 : 1363–1374.
23. Menon B, Gullick NJ, Walter GJ, et al. Interleukin-17+CD8+ T cells are enriched in the joints of patients with psoriatic arthritis and correlate with disease activity and joint damage progression. Arthritis Rheum 2014; 66 : 1272–1281.
24. Celis R, Planell N, Fernandez-Sueiro JL, et al. Synovial cytokine expression in psoriatic arthritis and associations with lymphoid neogenesis and clinical features. Arthritis Res Ther 2012; 14: R93.
25. Patel DD, Kuchroo VK. Th17 cell pathway in human immunity: lessons from genetics and therapeutic interventions. Immunity 2015; 43 : 1040–1051.
26. Mease P. Inhibition of interleukin-17, interleukin-23 and the TH17 cell pathway in the treatment of psoriatic arthritis and psoriasis. Curr Opin Rheumatol 2015; 27 : 127–133.
27. Koenders MI, van den Berg WB. Secukinumab for rheumatology: development and its potential place in therapy. Drug Des Devel Ther 2016; 10 : 2069–2080.
28. Papp KA, Langley RG, Sigurgeirsson B, et al. Efficacy and safety of secukinumab in the treatment of moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled phase II dose-ranging study. Br J Dermatol 2013; 168 : 412–421.
29. Rich P, Sigurgeirsson B, Thaci D, et al. Secukinumab induction and maintenance therapy in moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled, phase II regimen-finding study. Br J Dermatol 2013; 168 : 402–411.
30. Langley RG, Elewski BE, Lebwohl M, et al. ERASURE Study Group. FIXTURE Study Group. Secukinumab in plaque psoriasis – results of two phase 3 trials. N Engl J Med 2014; 371 : 326–338.
31. Langley RG, Ellis CN. Evaluating psoriasis with psoriasis area and severity index, psoriasis global assessment, and lattice system physician’s global assessment. J Am Acad Dermatol 2004; 51 : 563–569.
32. Thaçi D, Blauvelt A, Reich K, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomized controlled trial. J Am Acad Dermatol 2015; 73 : 400–409.
33. Mease P, McInnes IB. Secukinumab: a new treatment option for psoriatic arthritis. Rheumatol Ther 2016; 3 : 5–29.
34. Cingoz O, Langley RG, Elewski BE, et al. Ustekinumab. Mabs 2009; 1 : 216–221.
35. Kavanaugh A, Mease PJ, Reimold AM, et al. Secukinumab for long-term treatment of psoriatic arthritis: a two-year follow up from a phase III, randomized, double-blind placebo-controlled study. Arthritis Care Res (Hoboken) 2017; 69 : 347–355.
36. Liu L, Lu J, Allan BW, et al. Generation and characterization of ixekizumab, a humanized monoclonal antibody that neutralizes interleukin-17A. J Inflamm Res 2016; 9 : 39–50.
37. Toussirot E. Ixekizumab: an anti-IL17A monoclonal antibody for the treatment of psoriatic arthritis. Expert Opin Biol Ther 2018; 1 : 101–107.
38. Leonardi C, Matheson R, Zachariae C, et al. Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis. N Engl J Med 2012; 366(13): 1190–1199.
39. Gordon KB, Blauvelt A, Papp KA, et al. Phase 3 Trials of Ixekizumab in Moderate-to-Severe Plaque Psoriasis. N Engl J Med 2016; 375 : 345–356.
40. Griffiths CEM, Reich K, Lebwohl M, et al. Comparison of ixekizumab with etanercept or placebo in moderate-to-severe psoriasis (UNCOVER-2 and UNCOVER-3): results from two phase 3 randomised trials. Lancet 2015; 386(9993): 541–551.
41. Gordon KB, Leonardi CL, Lebwohl M, et al. A 52-week, open-label study of the efficacy and safety of ixekizumab, an anti-interleukin-17A monoclonal antibody, in patients with chronic plaque psoriasis. J Am Acad Dermatol 2014; 71 : 1176–1182.
42. Mease PJ, van der Heijde D, Ritchlin CT, et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo – controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017; 76 : 79–87.
43. Nash P, Kirkham B, Okada M, et al. SPIRIT-P2 Study Group. Ixekizumab for the treatment of patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors: results from the 24-week randomised, double-blind, placebo-controlled period of the SPIRIT-P2 phase 3 trial. Lancet 2017; 389(10086): 2317–2327.
44. Leonardi C, Matheson R, Zachariae C, et al. Anti-interleukin-17monoclonal antibody ixekizumab in chronic plaque psoriasis. N Engl J Med 2012; 366(13): 1190–1199.
45. Bauer E, Lucier J, Furst DE. Brodalumab – an IL-17RA monoclonal antibody for psoriasis and psoriatic arthritis. Expert Opin Biol Ther 2015; 15 : 883–893.
46. Papp KA, Reich K, Paul C, et al. A prospective phase 3, randomised, double-blind, placebo-controlled study of brodalumab in patients with moderate-to-severe plaque psoriasis. Br J Dermatol 2016; 175(2): 273–286.
47. Lebwohl M, Strober B, Menter A, et al. Phase 3 studies comparing brodalumab with Ustekinumab in psoriasis. N Engl J Med 2015; 373 : 1318–1328.
48. Ghoreschi K, Laurence A, Yang XP, et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature 2010; 467 : 967–971.
49. Oppmann B, Lesley R, Blom B, et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar aswell as distinct from IL-12. Immunity 2000; 13(5): 715–725.
50. Lyakh L, Trinchieri G, Provezza L, et al. Regulation of interleukin-12/interleukin-23 production and the T-helper 17 response in humans. Immunol Rev 2008; 226 : 112–131.
51. Devos SA, Van Den Bossche N, De Vos M, et al. Adverse skin reactions to anti-TNF-alpha monoclonal antibody therapy. Dermatology 2003; 206 : 388–390.
52. Cua DJ, Tato CM. Innate IL-17-producing cells: the sentinels of the immune system. Nat Rev 2010; 10 : 479–489.
53. Khader SA, Gopal R. IL-17 in protective immunity to intracellular pathogens. Virulence 2010; 1 : 423–427.
54. Murphy CA, Langrish CL, Chen Y, et al. Divergent pro - and anti-inflammatory roles for IL-23 and IL-12 in joint autoimmune inflammation. J Exp Med 2003; 198 : 1951–1957.
55. van de Kerkhof PC. Novel biologic therapies in development targeting IL-12/IL-23. J Eur Acad Dermatol Venereol 2010; 24(Suppl 6): 5–9.
56. Yeilding N, Szapary P, Brodmerkel C, et al. Development of the IL-12/23 antagonist ustekinumab in psoriasis: past, present, and future perspectives. Ann NY Sci 2011; 1222 : 30–39.
57. Scherl EJ, Kumar S, Warren RU. Review of the safety and efficacy of ustekinumab. Ther Adv Gastroenterol 2010; 3 : 321–328.
58. Kaushik SB, Lebwohl MG. Psoriasis: Which therapy for which patient: Psoriasis comorbidities and preferred systemic agents. J Am Acad Dermatol 2019; 80 : 27–40.
59. Baker KF, Isaacs JD. Novel therapies for immune-mediated inflammatory diseases: what can we learn from their use in rheumatoid arthritis, spondyloarthritis, systemic lupus erythematosus, psoriasis, Crohn’s disease and ulcerative colitis? Ann Rheum Dis 2018; 77 : 175–187.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2019 Číslo 2- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- INFOGRAFIKA: Vzácná diagnóza včas
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Abstrakta XVI. semináře mladých revmatologů 16.–18. května 2019, XVI. seminář mladých revmatologů
- „In viridi“ aneb Ve šlépějích Karla
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání