-
Medical journals
- Career
Karcinom ledviny: nové přístu py při vyšetřování a léčbě
Authors: M. L. Blute; P. R. Russo; R. Bukowski
Authors‘ workplace: Cancer Center of Excellence University of Massachusetts Medical School
Published in: Urol List 2010; 8(2): 6-10
Overview
Více než 57 000 Američanů každoročně onemocní karcinomem ledviny a odhaduje se, že letos více než 13 000 z nich na toto onemocnění zemře. Roční přírůstek incidence činí 2,5 % – podle American Cancer Society představuje v současné době karcinom ledviny jedno z deseti nejčastějších maligních onemocnění. Takto vysoký přírůstek není pozorován u žádného dalšího onemocnění postihujícího urogenitální systém. Je známo, že existuje celá řada různých podtypů karcinomu ledviny, z nichž každý má specifický genetický defekt (podmiňující fenotyp karcinomu). V terapii žádného jiného maligního močopohlavního onemocnění nedošlo v uplynulých deseti letech k tak významnému posunu jako při léčbě lokalizovaného nebo metastazujícího karcinomu ledviny. Nové koncepty porozumění významu parciální resekce vs radikální nefrekto mie při léčbě malých renálních tumorů (s ohledem na kontrolu karcinomu a dlouhodobé zachování renální funkce) způsobily odklon od provádění radikální nefrektomie k upřednostňování nefrony šetřící operace. Porozumění genetické podstatě karcinomu ledviny umožnilo vyvinout cílené terapie pro léčbu pokročilého karcinomu. Začlenění těchto nových preparátů do terapie pokročilého karcinomu prostaty vedlo k zahájením studií, které testují jejich účinnost v neoadjuvantním i adjuvantním režimu. Sekvenční aplikace cílených terapií v kombinaci s cytoredukční operací a metastasektomií je v současnosti předmětem klinického výzkumu.
Klíčová slova:
karcinom ledviny, malé renální tumory, cytoredukční nefrektomie, cílené terapieOdhaduje se, že v roce 2008 bude v USA diagnostikováno 54 390 nových případů renálního karcinomu a přibližně 13 000 pacientů na toto onemocnění zemře. Od roku 1970 bylo zaznamenáno pětinásobné zvýšení incidence a dvojnásobné zvýšení mortality na karcinom ledviny. Při léčbě žádného klinicky lokalizovaného a pokročilého karcinomu nedošlo v uplynulých deseti letech k tolika změnám jako při léčbě karcinomu ledviny.
NOVÉ PŘÍSTUPY KE STAGINGU A STANOVENÍ PROGNÓZY
Ačkoli v současné době užívaný TNM klasifikační systém je všeobecně přijímán, prakticky o všech kategoriích se vedou ve vědeckých publikacích diskuze. Od poslední verze AJCC, kdy bylo stadium T1 rozděleno do dvou substadií – T1a (< 4cm) vs T1b (4–7 cm), se pozornost soustřeďuje na velikost nádoru a vztah jeho hranice k indikaci léčby. Různé publikace navrhují zlepšení klasifikačního systému na základě předpokladu, že tumory v kategorii T2 (zejména tumory o velikosti 7–10 cm) mají nižší riziko mortality specifické pro onemocnění než tumory o velikosti > 10 cm.
Nejnovější údaje nasvědčují tomu, že revizi vyžaduje rovněž klasifikace T3 lézí. Bylo například prokázáno, že ipsilaterální invaze nadledviny představuje významný predikátor špatné prognózy (s charakteristikou podobnou lézi T4). Dále bylo zjištěno, že invaze tukové tkáně renálního sinu může být významnějším predikátorem špatné prognózy než invaze perinefrické tukové tkáně. Předtím, než bude možné tuto klasifikaci doporučit pro běžnou praxi, je třeba podrobit karcinomy ohraničené na orgán dalšímu výzkumu. Modifikace klasifikace tumor trombu na základě jeho rozsahu (tj. renální žíla vs IVC a přítomnost invaze tukové tkáně) vyvolaly další návrhy pro revizi klasifikace i těchto lézí.
Další diskuze se týkají otázky, zda je, či není nutná lymfadenektomie u pacientů s karcinomem v pokročilém stadiu. Nej novější údaje nasvědčují tomu, že pacienty s nejvyšším rizikem vzniku šíření do lymfatických uzlin lze identifikovat před operací na základě zobrazovacího vyšetření nebo pomocí analýzy patologických znaků vzorku biopsie „nazmrzlo“ během výkonu.
Vytvoření integrovaných klasifikačních systémů nebo nomogramů, které využívají klinické i anatomické proměnné, vedlo ke zlepšení predikce prognózy onemocnění. Tyto multifaktoriální predikční modely se využívají při sledování, výběru pacientů do klinických studií a rovněž usnadňují adjuvantní terapii. Pro stanovení rizika progrese lokalizovaného a metastazujícího one mocnění a tvorbu sledovacích protokolů po resekci ledviny se v současné době užívá UCLA integrovaný klasifikační systém (UISS), velikost tumoru podle „Mayo“, grade tumoru, klasifikační systém SSIGN, před - a pooperační nomogramy vyvi nuté v Memorial Sloan-Kettering Cancer Institute. Integrované klasifikační systémy hrají rovněž významnou roli při stratifikaci onemocnění podle rizika, což může u pacientů s pokročilým a metastazujícím karcinomem ovlivnit volbu zahájení cílené léčby.
Integrované klasifikační systémy jsou rovněž výbornou pomůckou při realizaci studií testujících adjuvantní terapii u pacientů s nejvyšším rizikem progrese onemocnění a úmrtí, kdy umožní okamžité zařazení pacientů s nejvyšším rizikem progrese. Takto asistovaný výběr může teoreticky přispět ke zkrácení trvání klinických studií. V brzké budoucnosti budou integro -
vané systémy pravděpodobně zahrnovat rovněž molekulární faktory umožňující ještě přesnější stanovení prognózy.Skupina z UCLA prokázala, že anhydráza kyseliny uhličité (CA9), Ki-67, Vimentin, gelsolin, a p-53 zvyšují schopnost UISS
predikovat recidivu onemocnění u pa cientů s lokalizovaným karcinomem ledviny. Rovněž u dalších markerů byla prokázána jejich role jako nezávislých rizikových faktorů: B7-H1, B7-H4, PD-1, IGF-1, survivin, VEGF a jejich receptory. Mayo „Bioskóre“ pomocí kombinace exprese hladiny B7-H1survivin a Ki-67 zvyšuje schopnost již zavedených algoritmů predikovat výsledný stav u pacientů s RCC. V dalších studiích je nutné posoudit, zda je cena spojená se zařazením těchto markerů do běžné klinické praxe oprávněná. Pomocí multivarietní analýzy je dále nutné zhodnotit, zda jednotlivé markery nejsou pouhými zástupci markerů jiných, nebo nepříznivými patologicko-histologickými znaky.LÉČBA MALÝCH TUMORŮ LEDVINNÉ KŮRY
Přibližně 70 % tumorů lokalizovaných v kůře ledviny lze považovat za „malé“ (střední velikost tumoru < 4 cm, T1a) karcinomy. Tyto tumory jsou obvykle detekovány náhodně u asymptomatických pacientů během zobrazovacího vyšetření indikovaného z jiné příčiny. Při léčbě onemocnění pomocí parciální resekce ledviny nebo radikální nefrektomie lze očekávat (v závislosti na histologické charakteristice tumoru) minimálně 90% míru přežití. Přibližně u 20 % pacientů bude detekována benigní léze, např. angiomyolipom, onkocytom, metanefrický adenom nebo krvácející cysta. Ačkoli lze ve většině případů provést perkutánní renální biopsii naváděnou pomocí CT, rozlišení mezi benigním a maligním tumorem a stanovení histologického podtypu je za použití současných radiologických metod a technik biopsie poměrně náročné (70% míra přesnosti). Vývoj imunohistochemických a cytogenetických technik umožnil významné zvýšení míry přesnosti (až na 90 %).
Trend zachování orgánu během onkologické operace (např. karcinom prsu, sarkomy měkkých tkání), kdy i omezená resekce je onkologicky účinná, byl inspirací pro zavedení podobného přístupu při léčbě karcinomu ledviny. Kvalitní studie prokázaly, že elektivní parciální resekce ledviny (PN) dosahuje s ohledem na lokální kontrolu tumoru a přežití bez metastáz stejného výsledku jako radikální nefrektomie (RN). Tento efekt byl prokázán nejprve u tumorů o velikosti ≤ 4 cm a později rovněž u tumorů o velikosti ≤ 7 cm.
Studie srovnávající stav renální funkce u pacientů s malými renálními tumory, kteří podstoupili PN nebo RN, prokázaly, že pacienti podstupující RN měli vyšší pravděpodobnost výskytu proteinurie a vyšší hladiny kreatininu (> 2 mg/dl). Nejnovější studie užívající výpočet odhadované rychlosti glomerulární filtrace (eGFR) na základě MDRD vzorce prokázaly negativní dopad RN na renální funkci. Jedna z velkých studií uvádí, že pravděpodobnost absence eGFR < 60 ml/min per 1,73 m2 po dobu tří let je 80 % po PN, ale pouze 35 % po RN. Odpovídající hodnoty pravděpodobnosti absence eGFR < 45 ml/min per 1,73 m2 po dobu tří let byly 95 % po PN a pouze 64 % po RN. Multivariátní analýza nasvědčuje tomu, že RN představuje nezávislý rizikový faktor pro opakovaný nástup chronického onemocnění ledvin (CKD). U 26 % jinak zdravých pacientů s normální kontralaterální ledvinou byla navíc před resekcí tumoru zaznamenána již existující CKD, o čemž svědčila hodnota eGFR < 60 ml/min per 1,73 m2. Nejnovější analýza údajů z databáze SEER zahrnující téměř 3 000 pacientů prokazuje, že PN nabízí (ve srovnání s RN) benefit celkové doby přežití (schéma 1). Studium částí ledviny, které nejsou zasaženy tumorem, umožnilo v nedávné době objasnit patologickou podstatu CKD u pacientů s karcinomem ledviny. Pouze v 10 % případů byla tumorem nezasažená část ledviny normální. U ostatních pacientů byly zjištěny vaskulární sklerotické změny a další abnormality zahrnující diabetickou nefropatii, glomerulární hypertrofii, rozšiřování mesangia a difuzní glomerulosklerózu.
Schéma 1. Databáze SEER (n = 2 991). 
Odhaduje se, že v současné době trpí CKD v USA 19 milionů dospělých. Na rozdíl od pečlivě vybíraných a mnohem mladších dárců ledviny je střední věk pacientů s tumorem ledviny > 60 let. Tito pacienti často trpí stavy, jako jsou např. diabetes, hypertenze nebo periferní vaskulární onemocnění, které mohou mít dopad na počáteční funkci ledviny. Podrobné prospektivní studie zahrnující pacienty s tumorem ledvin, kteří nepodstoupili operační léčbu, a meta-analýza publikované litera - tury nasvědčují tomu, že roční přírůstek renálního karcinomu je velmi malý (přibližně 0,3 cm/rok). U značného procenta malých renálních lézí odhalí histologické vyšetření benigní nebo indolentní charakter. U pacientů s běžným karcinomem z jas ných buněk o velikosti ≤ 4 cm se pravděpodobnost metastazujícího šíření tumoru odhaduje na 5–7 %.
Klinický přístup spočívající v aktivním sledování vybraných pacientů s malými renálními lézemi (prokázanými pomocí biopsie, nebo nikoli), zejména u starších jedinců a jedinců s dalšími komorbiditami, si získává na popularitě, zvláště vzhledem ke skutečnosti, že příliš agresivní RN může zhoršit nebo dokonce vyvolat CKD. Prostřednictvím vzdělávacích programů a rozšířeného tréninku otevřené/laparoskopické ledviny zachovávající operace je nutné ošetřit otázku přehnané indikace RN jako záruky kvalitní péče. Kliničtí vědci (nejenom v USA) aktivně doporučují nové přístupy k léčbě malých renálních lézí, jako například aktivní sledování, laparoskopickou a robotickou PN, termální ablační proce dury, radiofrekvenční terapii nebo kryoablaci.
Pečlivá volba pacientů a zvyšující se zkušenost s laparoskopickými technikami činí z PN (v rukou zručného operatéra) přijatelnou alternativu k otevřenému přístupu. Obavy týkající se dopadu teplé ischemie na dlouhodobou renální funkci a vyšší míra výskytu interoperačních urologických i neurologických komplikací (ve srovnání s otevřenou PN) mohou bránit většímu rozšíření tohoto výkonu i mimo specializovaná centra, která se zabývají výhradně minimálně invazivními technikami.
Před větším rozšířením ablačních technik je nutné vyřešit otázku patologické úplnosti ablace, posoudit nejlepší metodu pro sledování lézí po ablaci a rovněž posoudit její proveditelnost a obtíže při dosažení záchranné operace bez nutnosti provedení úplné nefrektomie u pacientů s recidivou.
NOVÉ PŘÍSTUPY K LÉČBĚ METASTAZUJÍCÍHO ONEMOCNĚNÍ
Léčba metastazujícího karcinomu ledviny (mRCC) prodělala v uplynulých pěti letech významné změny. Tento druh tumoru je v současné době považován za model pro vývoj nových preparátů. U > 75 % případů sporadického karcinomu z jasných buněk byly zjištěny mutace na chromozomu 3p genu VHL, které pravděpodobně podmiňují vaskulární fenotyp tohoto neoplazmatu. Lepší porozumění biologické povaze tumoru a závislosti VEGF vedlo k objevu řady cílených terapií na molekulární úrovni, jež inhibují vaskularizaci tumoru. Klasická léčba mRCC v minulosti spočívala v apli kaci cytokinů interleukinu-2 a interferonu-α. Tento přístup však dosahoval chabých výsledků a byl spojen s vysokou toxicitou. V uplynulých pěti až šesti letech se testování nových preparátů zaměřilo na agens inhibující VEGF, VEGFR a dráhy mTOR s využitím poznatků o biologické povaze karcinomu z jasných buněk, což vedlo k objevu řady preparátů, a tedy významnému zlepšení výsledků léčby tohoto onemocnění.
Současné přístupy k léčbě tohoto one - mocnění vycházejí z výsledků studií II./III. fáze testující účinnost inhibitorů tyrozin kinázy (TKI), sunitinibu a sorafenibu, mTOR inhibitorů temsirolimu a everolimu a monoklonální protilátky VEGF bevacizumabu. Pro návrh terapie pro individuální léčbu jednotlivých pacientů lze zhodnotit stav, histologický podtyp a hodnocení prognostických faktorů pomocí MSKCC (tab. 1).
Table 1. Nové standardy pro léčbu karcinomu ledviny z jasných buněk: doporučení. 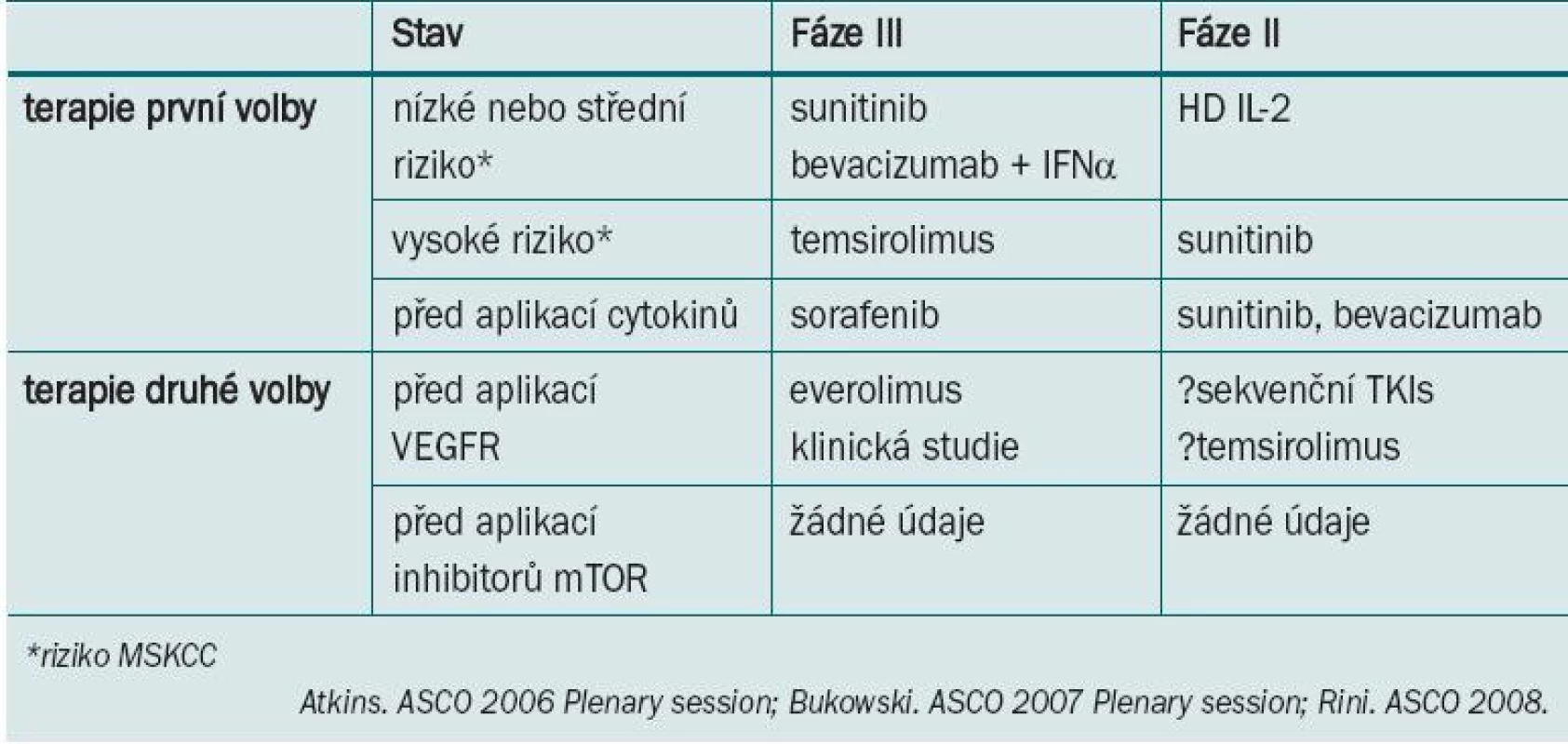
Vhodnou léčbu metastazujícího karcinomu z jasných buněk u pacientů refrakterních na léčbu je nutné teprve posoudit. Aplikace sunitinibu nebo bevacizumabu + IFN-α představuje alternativu pro léčbu pacientů s nízkým nebo středním rizikem. Bylo zaznamenáno zlepšení objektivní míry doby přežití bez progrese i celkové doby přežití. Studie III. fáze srovnávající apli kaci temsirolimu s IFN-α u pacientů s vysokým rizikem prokázala zlepšení PFS a celkové doby přežití navzdory < 10% odpovědi. U onemocnění refrakterních na léčbu je při volbě vhodné léčby užitečné zhodnotit celkový stav pacienta před jejím zahájením.
U pacientů refrakterních na cytokinovou terapii lze indikovat TKI terapii ve formě sorafenibu a sunitinibu. U pacientů refrakterních na TKI může být užitečná aplikace inhibitoru mTOR everolimu, která ve srovnání s BSC zvyšuje PFS. Léčba pacientů s RCC refrakterních na aplikaci inhibitorů mTOR nebyla doposud definována.
Užívání cílové terapie v rámci neoadjuvantního a pooperačního adjuvantního protokolu je stále ve fázi výzkumu.
Nová generace preparátů pro léčbu mRCC, která je doposud ve fázi výzkumu, za hrnuje TKIs, axitinib, pazopanib a AV-951.
CYTOREDUKČNÍ NEFREKTOMIE A METASTASEKTOMIE
Role radikální nefrektomie u pacientů s metastazujícím karcinomem ledviny je delší dobu předmětem diskuze. Výsledky dvou randomizovaných prospektivních klinických studií se shodnými vstupními kritérii publikované v uplynulých deseti letech vedly k přehodnocení role cytoredukční nefrektomie. Randomizovaná kontrolní studie SWOG (Southwest Oncology Group) a EORTC (European Organization Research and Treatment of Cancer) srovnávající aplikaci interferonu alfa-2b vs cytoredukční nefrektomie s aplikací interferonu alfa-2b prokázaly zlepšení střední doby přežití z 27 % na 42 %. Kritéria při indikaci cytoredukční RN zahrnují odstranění > 75 % objemu nádoru, absenci metastáz do CNS, mnohočetných metastáz do jater nebo skeletu ECOG 0-1. Cytoredukční nefrektomie představuje v USA standardní terapeutickou modalitu. Nejnovější metody pro stanovení stadia onemocnění a užívání integrovaných staging systémů mohou usnadnit stratifikaci pacientů na základě rizika a potenciálně zlepšit dobu přežití specifickou pro dané onemocnění díky kombinované indikaci cytoredukční nefrektomie a novějších preparátů.
V současné době probíhají klinické studie testující účinnost neadjuvantní a adjuvantní terapie s cílem posoudit roli tohoto přístupu u pacientů refrakterních na cytokinovou a TKI terapii.
Nejnovější studie MD Andersen Cancer Center uvádějí, že předoperační medikamentózní léčba kandidátů pro cytoredukční nefrektomii a resekci nezpůsobuje významné zvýšení operační morbidity. Skutečnost, že 30–45% snížení primární odpovědi nebylo nikdy u terapie cytosiny zaznamenáno, vedla ke koncepci předoperační léčby s využitím primárního efektu na nádor před operační léčbou. Tato léčba byla využita u speciálních případů, jako jsou nádory solitární ledviny, nádory bilaterální a multifokální.
Díky zlepšení doby přežití bez progrese při cílených terapiích byl obnoven rovněž zájem o cytoredukční terapii a metastasektomii. Spolu s novými poznatky v oblasti tachyfylaxe a selhání cílené léčby může konzolidace operační léčby nabídnout ve vybraných případech trvalou odpověď. Výsledky dosažené v Memorial Sloan-Kettering, Cleveland Clinic a Mayo Clinic by nasvědčovaly tomu, že cytoredukční nefrektomie a samotná resekce solitárních metastáz může dosahovat u 30–50 % pacientů trvalé odpovědi po dobu pěti let.
Nejnovější údaje publikované v Memorial Sloan-Kettering Cancer Center a Mayo Clinic nasvědčují tomu, že nejvýznamnějším aspektem tohoto přístupu je možnost resekce celého onemocnění u vybrané populace pacientů s nízkým až středním rizikem (schéma 2).
Schéma 2. Úplná metastasektomie při léčbě pacientů s karcinomem z renálních buněk s četnými metastázami. 
Michael L. Blute, MD
Professor of Surgery Director,
Cancer Center of Excellence University
of Massachusetts Medical School
Michael.Blute@umassmemorial.org
Sources
1. Lau WK, Blute ML, Weaver AL et al. Matched comparison of radical nephrectomy vs nerve-sparing surgery in patients with unilateral renal cell carcinoma and a normal contralateral kidney. Mayo Clinic Proc 2000; 75 : 1236–1242.
2. Leibovich BC, Blute ML, Cheville JC et al. Nephron sparing surgery for appropriately selected renal cell carcinoma between 4 and 7 cm results in outcome similar to radical nephrectomy. J Urol 2004; 171(3): 1066–1070.
3. Thompson RH, Leibovich BC, Lohse CM et al. Complications of contemporary open nephron sparing surgery: A single institution experience. J Urol 2005; 174(3): 855–858.
4. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351(13): 1296–1305.
5. Huang WC, Levey AS, Serio AM et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumors: A retrospective cohort study. Lancet Oncol 2006; 7(9): 735–740.
6. Guinan P, Sobin LH, Algaba F et al. TNM staging of renal cell carcinoma: Workgroup No 3 Union Int’l Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997; 80 : 992–993.
7. Zisman A, Pantuck AJ, Dorey F et al. Improved prognostication of renal cell carcinoma using an integrated staging system. J Clin Oncol 2001; 19(6): 1649–1657.
8. Motzer RJ, Bacik J, Murphy BA et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced RCC. J Clin Oncol 2002; 20(1): 289–296.
9. Thompson RH, Leibovich BC, Lohse CM et al. Dynamic outcome prediction in patients with clear cell re - nal cell carcinoma treated with radical nephrectomy. The D-SSIGN Score. J Urol 2007; 177(2): 477–480.
10. Thompson RH, Kuntz SM, Leibovich BC, et al. Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up. Cancer Res 2006; 66(7): 3381–3385.
11. Kattan MW, Reuterr V, Motzer RJ et al. A postoperative prognostic nomogram for RCC. J Urol 2001; 166 : 63.
12. Motzer RJ, Mazumdar M, Bacik J et al. Survival and prognostic stratification of 670 patients with advanced RCC. J Clin Oncol 1999; 17(8): 2530.
13. Pantuck AJ, Zisman A, Bellegrun AS. The changing natural history of RCC. J Urol 2001; 166 : 1611.
14. Frank I, Blute ML, Cheville JC et al. An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on tumor stage, size, grade, and necrosis: The SSIGN score. J Urol 2002; 168(6): 2395-2400.
15. Eggener SE, Yossepowitch O, Pettus JA et al. Renal cell carcinoma recurrence after nephrectomy for localized disease: Predicting survival from time of recurrence. J Clin Oncol 2006; 24(19): 3101–3106.
16. Leibovich BC, Cheville JC, Lohse CM et al. A scoring algorithm to predict survival for patients with metastatic clear cell renal cell carcinoma: A stratification tool for prospective clinical trials. J Urol 2006; 174(5): 1759–1763.
17. Blute ML, Leibovich BC, Cheville JC et al. A protocol for performing extended lymph node dissection using primary tumor pathological features for patients treated with radical nephrectomy for clear cell renal cell carcinoma. J Urol 2004; 172(2): 465–469.
18. Pantuck AJ, Zisman A, Dorey F et al. Renal cell carcinoma with retroperitoneal lymph nodes. Impact on survival and benefits of immunotherapy. Cancer 2003; 97(12): 2995–3002.
19. Ljunberg B, Landberg G, Alamdari FI. Factors of importance for prediction of survival in patients with metastatic renal cell carcinoma, treated with or without nephrectomy. Scand J Urol Nephrol 2000, 34(4): 246–251.
20. Flanigan RC, Salmon SE, Blumenstein BA et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal cell cancer. New Engl J Med 2001; 345(23): 1655–1659.
21. Flanigan RC, Mickisch G, Sylvester R et al. Cyto reductive nephrectomy in patients with metastatic renal cancer: A combined analysis. J Urol 2004; 171(3): 1071–1076.
22. Mosharafa A, Koch M, Shalhav A et al. Nephrectomy for metastatic renal cell carcinoma: Indiana Uni - versity experience. Urology 2003; 62(4): 636–640.
23. Rackley R, Novick A, Klein E et al. The impact of adjuvant nephrectomy on multimodality treatment of metastatic renal cell carcinoma. J Urol 1994; 152 : 1399–1403.
24. Figlin RA, Pierce WC, Kaboo R et al. Treatment of meta static RCC with nephrectomy, interleukin -2 and cyto kine primed or CD8 (+) selected tumor infiltrating lymphocytes from primary tumor. J Urol 1997; 158 : 740–745.
25. Levy DA, Swanson DA, Slaton JW et al. Timely delivery of biological therapy after cytoreductive nephrectomy in carefully selected patients with metastatic renal cell carcinoma. J Urol 1998; 159(4): 1168–1173.
26. Linehan, WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003; 170 : 2163–2172.
27. Russo P, Snyder M, Vickers A et al. Cytoreductive nephrectomy and nephrectomy/complete metastasec tomy for renal cancer. ScientificWorldJournal 2007; 7 : 768–778.
28. Russo P. Renal cell carcinoma: presentation, staging, and surgical treatment. Semin Oncol 2000; 27(2): 160–176.
29. Russo P, Goetzl M, Simmons R et al. Partial nephrectomy: The rationale for expanding the indications. Ann Surg Oncol 2002; 9(7): 680–687.
30. Lau WK, Blute ML, Weaver AL et al. Matched comparison of radical nephrectomy vs nephron-sparing surgery in patients with unilateral renal cell carcinoma and a normal contralateral kidney. Mayo Clinic Proc 2000; 75 : 1236–1242.
31. Miller DC, Hollingsworth JM, Hafez KS et al. Partial nephrectomy for small renal masses. An emerging quality of care concern? J Urol 2006; 175 : 853–857.
32. Dechet CB, Zincke H, Sebo TJ et al. Prospective analysis of computerized tomography and needle biopsy with permanent sectioning to determine the nature of solid renal masses in adults. J Urol 2003; 169(1): 71–74.
33. Motzer RJ, Hutson TE, Tomczak P et al: Sunitinib versus interferon alfa in metastatic renal-cell carcinoma.
N Engl J Med 2007; 356(2): 115–124.
34. Escudier B, Eisen T, Stadler WM et al: Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356(2): 125–134.
35. Hudes G, Carducci M, Tomczak P et al: Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356(22): 2271–2281.
36. Motzer RJ, Escudier B, Oudard S et al: Efficacy of everolimus in advanced renal cell carcinoma: a double - blind, randomized, placebo-controlled phase III trial. Lancet 2008; 372(9637): 449–456.
37. Escudier B, Pluzanska A, Koralewski P et al: Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: A randomized double-blind phase III trial. Lancet 2007; 370(9605): 2103–2111.
38. Rini BI, Halabi S, Rosenberg JE et al. Bevacizumab plus interferon alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma: CALGB 90206. J Clin Oncol 2008; 26(33): 5422–5428.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2010 Issue 2-
All articles in this issue
- Karcinom ledviny: nové přístu py při vyšetřování a léčbě
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
- Léčba nádorů ledvin
- Ablační terapie při léčbě malých renálních tumorů: jak daleko se nalézá tato léčebná modalita od standardní péče?
- Nové trendy v systémové léčbě karcinomu ledviny
- Ultrazvukové vyšetření skrota: principy a praktické využití
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ultrazvukové vyšetření skrota: principy a praktické využití
- Léčba nádorů ledvin
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

