-
Medical journals
- Career
Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Authors: D. Belada
Authors‘ workplace: IV. interní hematologická klinika, FN a LF UK v Hradci Králové
Published in: Transfuze Hematol. dnes,26, 2020, No. 3, p. 177-185.
Category: Review/Educational Papers
Overview
Periferní T-lymfomy (PTCL) jsou vzácným nádorovým onemocněním se špatnou prognózou s výjimkou nemocných s ALK (anaplastická lymfomová kináza) pozitivním anaplastickým velkobuněčným lymfomem (ALCL) nízkého rizika. Za standardní terapii 1. linie byl mnoho let považován režim CHOP (cyklofosfamid, doxorubicin, vinkristin a prednison). Přidání etoposidu k režimu CHOP (CHOEP) vedlo u mladších nemocných k prodloužení doby do progrese, ale neprokázalo vliv na celkové přežití. Význam konsolidační terapie autologní transplantací po 1. linii léčby je stále nejasný z důvodu chybějící prospektivní randomizované studie fáze 3. Osud nemocných po selhání terapie 1. linie je extrémně nepříznivý. S výjimkou malé části mladších nemocných, kteří mohou profitovat ze záchranné terapie a provedení alogenní transplantace, neexistuje žádná standardní terapie, která by prokazatelně dosahovala uspokojivých dlouhodobých výsledků u relabujících nebo refrakterních pacientů. Nedávno byly publikovány výsledky randomizované, dvojitě zaslepené, dvojitě maskované studie fáze 3 (ECHELON-2), které prokazují, že u nemocných s nově diagnostikovaným CD30 pozitivním PTCL podání brentuximab vedotinu (chimérické monoklonální protilátky anti-CD30 s monometyl auristatinem E) s režimem CHP vedlo nejen k významně delší době do progrese oproti standardnímu režimu CHOP, ale i k delšímu celkovému přežití, a to zejména u nemocných s ALCL. U ostatních histologických subtypů nebyl přínos BV tak dobře hodnotitelný díky menšímu zastoupení a vyžaduje další studium. V současné době tak lze režim BV-CHP považovat za velmi účinnou terapii 1. linie u pacientů s CD30+ PTCL. V České republice má BV nově úhradu od 1. 8. 2020 v 1. linii léčby dospělých pacientů s CD30-pozitivním periferním T-lymfomem v kombinaci s cyklofosfamidem, doxorubicinem a prednisonem.
Klíčová slova:
T-lymfom – prognóza – brentuximab vedotin – transplantace
ÚVOD
Periferní T-lymfomy (PTCL) představují poměrně vzácný typ lymfoproliferací – zaujímají jen cca 10 % všech nehodgkinských lymfomů (NHL) v naší populaci [1]. Odlišná je incidence v Asii, kde PTCL tvoří až 24 % všech NHL [2]. Jedná se o poměrně heterogenní skupinu onemocnění, která se liší svojí biologií, klinickým průběhem a prognózou. S výjimkou několika forem kožních lymfomů se jedná vesměs o klinicky agresivní nádorová onemocnění s nepříznivou prognózou.
Podle aktuálně platné WHO klasifikace jsou v našich podmínkách nejčastějšími podtypy:
- periferní T-lymfom, blíže nespecifikovaný (PTCL-NOS),
- angioimunoblastický lymfom (AITL),
- anaplastický velkobuněčný lymfom (ALCL) – ALK pozitivní nebo ALK negativní.
Ostatní podtypy, jako například hepatosplenický T-lymfom, enteropatický T-lymfom (EATL), podkožní panikulitidě podobný T-lymfom a další, jsou extrémně raritní onemocnění, která se ročně v České republice vyskytují v řádu jednotek případů. I proto léčebná doporučení pro terapii těchto vzácných jednotek se buď extrapolují z výsledků klinických hodnocení léčby ostatních, častějších podtypů, nebo se doporučení odkazují na retrospektivní analýzy z registrů či jen malé sestavy nebo jednotlivé kazuistické případy.
Prognóza nemocných s PTCL byla dosud velmi neuspokojivá. S výjimkou nemocných s ALK pozitivním ALCL nízkého rizika podle mezinárodního prognostického indexu (IPI 0–1), kde je prognóza dokonce o něco lepší než u B-lymfomů, ve všech ostatních případech se jedná o onemocnění se špatnou prognózou, s pravděpodobností přežití v 5 letech mezi 10–30 % – záleží na subtypu lymfomu [3].
Standardem léčby 1. linie u PTCL je po několik desítek let režim CHOP (cyklofosfamid, doxorubicin, vinkristin, prednison). Přidáním etoposidu k režimu CHOP (režim CHOEP) bylo dosaženo lepších výsledků u mladších nemocných, bohužel jen z hlediska delší doby do progrese (progression free survival – PFS), nikoliv ale celkového přežití (overal survival – OS), kde nebyl shledán signifikantní rozdíl [4, 5]. Starší nemocní navíc nejsou schopni režim CHOEP tolerovat z důvodu vysoké hematologické toxicity. Přidání alemtuzumabu (monoklonální protilátky anti-CD52) k režimu CHOP vedlo ke zvýšení celkové léčebné odpovědi, ale za cenu neakceptovatelně vysoké hematologické toxicity, proto výzkum tímto směrem byl ukončen [6]. Romidepsin (histon deacetylázový inhibitor) v kombinaci s režimem CHOP byl také testován v 1. linii v rámci studie fáze 1b/2 – problémem byla také poměrně významná hematologická toxicita [7].
Snaha zlepšit osud nemocných s PTCL v 1. linii použitím některé konsolidační terapie přinesla rovněž rozporuplné výsledky. Radioterapie je smysluplná jen v případě iniciální léčby extranodálního NK/T lymfomu, nazálního typu – tam je nezbytnou součástí léčby 1. linie s velmi dobrými výsledky díky lokální kontrole onemocnění ozářením. V ostatních případech je její význam velmi omezený. Role konsolidační terapie vysokodávkovanou chemoterapií s autologní transplantací (ASCT) je v současné době také nejasná. Data ze studie fáze 2 ukazují na velmi dobré výsledky tohoto postupu, některé další práce ale význam ASCT nepotvrdily, včetně analýzy z dat registru NIHiL české Kooperativní lymfomové skupiny [8–10]. Zásadním problémem je, že neexistuje žádná prospektivní randomizovaná studie fáze 3 studující význam autologní transplantace jako konsolidační terapie 1. linie. Malá část mladších nemocných může být léčena alogenní transplantací – buď jako konsolidační terapie 1. linie při nedosažení kompletní remise, nebo v relapsu onemocnění.
IMUNOTERAPIE U PTCL
Antigen CD30 je univerzálně exprimován na povrchu nádorových T-lymfocytů u všech nemocných s ALCL. U ostatních subtypů PTCL je jeho exprese variabilní, cca mezi 58–64 % u PTCL-NOS, u 43–63 % nemocných s AITL, u cca 55 % pacientů s T-buněčnou leukemií/lymfomem a velmi variabilní u EATL [11, 12]. Snaha o terapii PTCL pomocí monoklonální protilátky proti antigenu CD30 byla zpočátku neúspěšná. Podání samotné anti-CD30 protilátky vedlo ke zcela minimální léčebné odpovědi u nemocných s relabujícími/refrakterními PTCL [13]. Z klinického pohledu jako průlomový krok nutno vnímat vytvoření molekuly brentuximab vedotinu (BV) – konjugátu monoklonální protilátky anti-CD30 a toxinu – monometyl auristatinu E, který je kovalentně na ni navázán. Po vazbě BV na nádorovou buňku dochází k uvolnění toxinu (silný inhibitor mikrotubulů), který vede k usmrcení nádorové buňky. Po průkazu významné klinické efektivity tohoto léku u nemocných s relabujícím/refrakterním ALCL se klinický vývoj přesunul do oblasti léčby 1. linie PTCL [14]. Vývoj byl zahájen standardně studií fáze 1 a byl vytvořen režim BV-CHP, tedy kombinací BV a režimu CHP – záměrně bez vinkristinu, aby nedocházelo k potenciaci neurotoxického efektu BV [15]. Na základě velmi dobrých výsledků studie fáze 1 byla následně iniciována studie fáze 3 s označením ECHELON-2.
ECHELON-2 STUDIE
Charakteristika studie
ECHELON-2 je mezinárodní, dvojitě zaslepená, dvojitě maskovaná, randomizovaná, placebem kontrolovaná studie fáze 3 srovnávající standardní terapii CHOP s režimem BV-CHP, a to na 132 centrech v 17 zemích celého světa. Studie se zúčastnilo i několik center a pacientů z České republiky.
Do studie byli zařazeni dospělí nemocní s nově diagnostikovanými CD30 pozitivními PTCL. Podmínkou byla minimálně 10% pozitivita CD30 podle imunohistochemického (IHCH) vyšetření vzorku nádorové tkáně. Z histologických subtypů PTCL byli vhodní nemocní s ALCL (v případě pacientů s ALK pozitivním ALCL jen vyššího rizika s IPI 2 a více), PTCL-NOS, AITL, T-buněčnou leukemií/lymfomem dospělých, EATL a hepatosplenickým T-lymfomem. Podmínkou regulatorních úřadů bylo zařazení minimálně 75 % (± 5 %) případů nemocných s ALCL k ověření efektivity a bezpečnosti BV u tohoto typu PTCL. Všechny histologické vzorky byly následně podrobeny centrálnímu čtení. Nemocní byli randomizováni 1 : 1 mezi CHOP a BV-CHP, stratifikace probíhala podle histologického subtypu (ALK pozitivní ALCL vs. ostatní histologie) a IPI (0–1 vs. 2–3 vs. 4–5).
Léčba se skládala z 6–8 cyklů (podle rozhodnutí řešitele) a byla složena z cyklofosfamidu 750 mg/m2 v den 1 (D1), doxorubicinu 50 mg/m2 D1, prednisonu 100 mg D1–5 a vinkristinu 1,4 mg/m2 (maximum 2 mg) D1 nebo brentuximab vedotinu 1,8 mg/kg D1. Rozhodnutí o podání konsolidační radioterapie nebo vysokodávkované terapie s autologní transplantací muselo být provedeno před zahájením léčby u každého nemocného. Primárním cílem studie byla doba do progrese podle nezávislé hodnotící komise, která byla definována jako doba od randomizace do selhání terapie, relapsu/progrese, úmrtí nebo zahájení další protilymfomové léčby, která nebyla v úvodu definována. Použití předem definované radioterapie nebo autologní transplantace v případě, že nebyla přítomna progrese lymfomu, nebylo považováno za událost. Sekundárními cíli byly zejména celkové přežití, procento dosažených kompletních remisí a PFS u skupiny pacientů s ALCL. Léčebná odpověď byla hodnocena podle standardních kritérií Lugano 2007.
Výsledky studie
V období mezi roky 2013 a 2016 bylo do studie zařazeno celkem 601 nemocných, z toho 452 bylo následně randomizováno 1 : 1 mezi CHOP (n = 226) a BV-CHP (n = 226). Medián věku nemocných byl 58 let (45–67 let). Obě skupiny byly srovnatelné stran základních prognostických charakteristik (věk, IPI, stadium, performance status, histologické subtypy). Nejpočetněji zastoupenou skupinou byli nemocní s ALCL (48 % ALK negativních, 22 % ALK pozitivních). Přehledně jsou základní charakteristiky obou skupin uvedeny v tabulce 1.
Table 1. Základní charakteristiky pacientů ve studii Echelon-2 (adaptováno podle Horwitz S et al., Lancet, 2019) 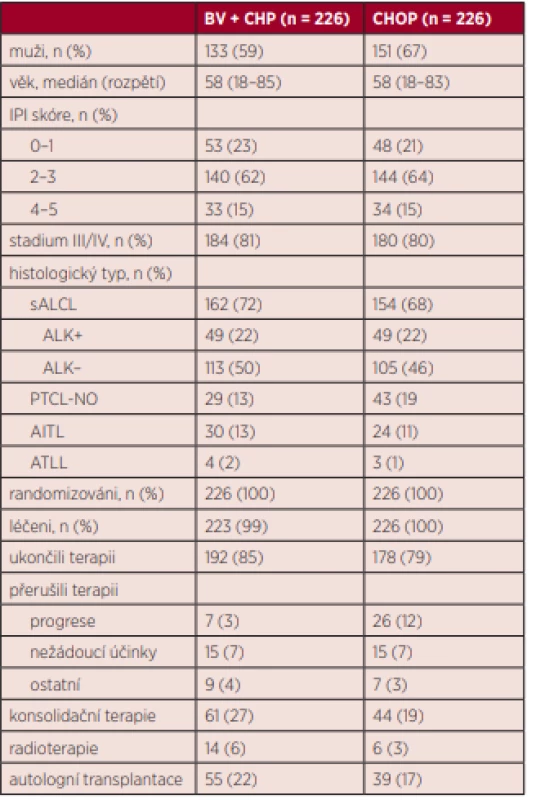
Podání režimu BV-CHP vedlo k 29% redukci rizika progrese oproti CHOP (HR 0,71; 95 % CI 0,54–0,93). Při mediánu sledování 36,2 měsíce byl medián doby do progrese u skupiny BV-CHP 48,2 měsíce vs. 20,8 měsíce u CHOP (p = 0,011) (obr. 1). Primární cíl studie byl tedy naplněn. Subanalýzou podle jednotlivých histologických podtypů byl zjištěn největší benefit u ALCL (ALK+ i ALK–) a PTCL-NOS. U nemocných s AITL byl přínos BV v následné subanalýze statisticky nevýznamný, což mohlo být způsobeno malým počtem nemocných s tímto histologickým typem. Nutno konstatovat, že studie nebyla primárně designována na tento typ subanalýzy podle histologických typů.
Image 1. Studie Echelon-2: Graf doby do progrese podle nezávislé hodnotící komise 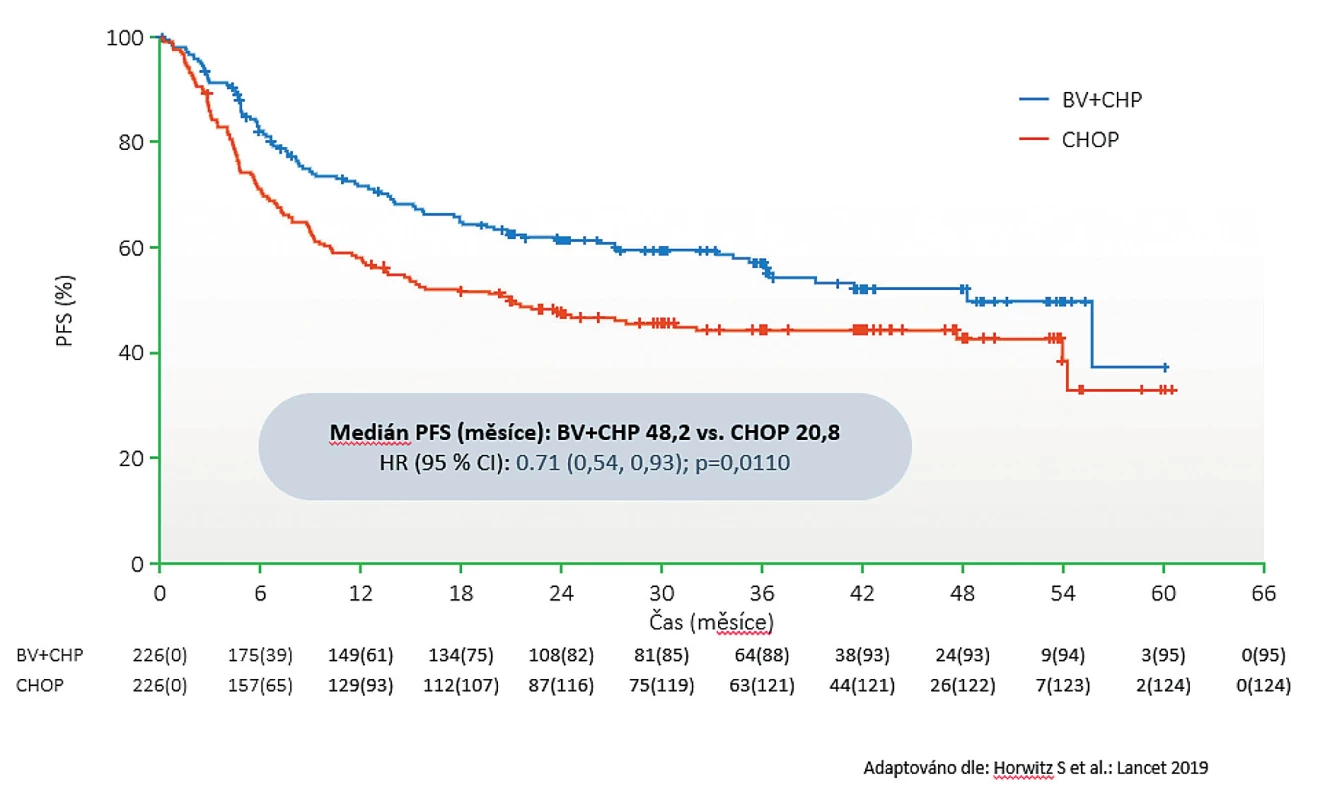
Z hlediska celkového přežití podání režimu BV - -CHP vedlo k 34% redukci rizika úmrtí oproti režimu CHOP (HR 0,66; 95 % CI 0,46–0,95), p = 0,0244. Medián celkového přežití nebyl dosažen u obou ramen (obr. 2). Benefit BV-CHP byl z hlediska histologických subtypů srovnatelný jako při analýze PFS. Relativně největší benefit byl zaznamenán u nejpočetněji zastoupené podskupiny nemocných s ALCL, kde redukce rizika progrese byla celkově 41 % (HR 0,59; 95 % CI 0,42–0,84), p = 0,0031. Vyšší efektivita z hlediska základních parametrů účinnosti (PFS a OS) byla provázena i významně vyšším procentem dosažených kompletních remisí v rameni BV-CHP vs. CHOP (68 % vs. 56 %, p = 0,0066) i vyššího procenta celkových léčebných odpovědí (overall response rate – ORR) ve prospěch režimu BV-CHP oproti CHOP (83 % vs. 72 %, p = 0,0032) (obr. 3). Celkem 59 nemocných v rameni BV-CHP (26 %) a 94 nemocných v rameni CHOP (42 %) vyžadovalo následnou terapii pro relaps, progresi nebo zbytkovou aktivitu lymfomu [16].
Image 2. Studie Echelon-2: Graf celkového přežití podle nezávislé hodnotící komise 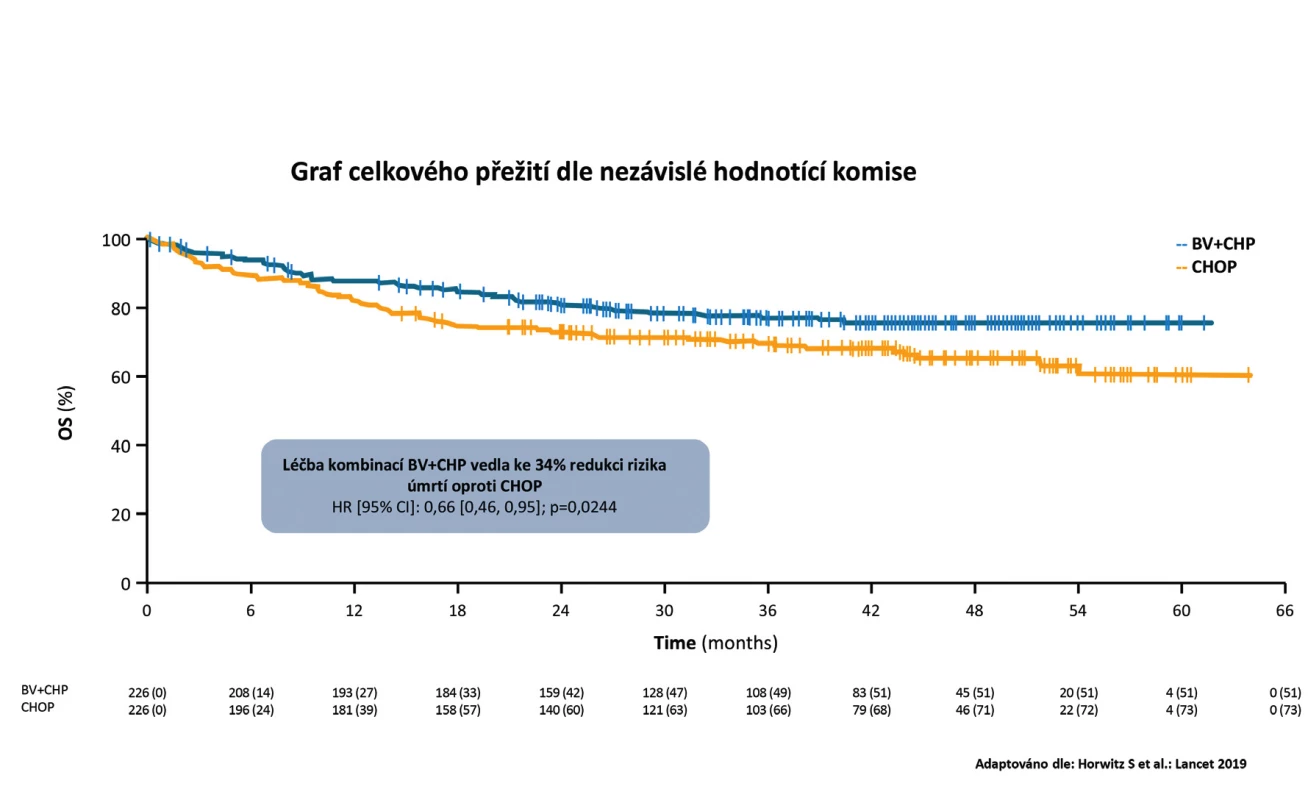
Image 3. Studie Echelon-2: Souhrn celkové léčebné odpovědi na konci léčby podle nezávislé hodnotící komise 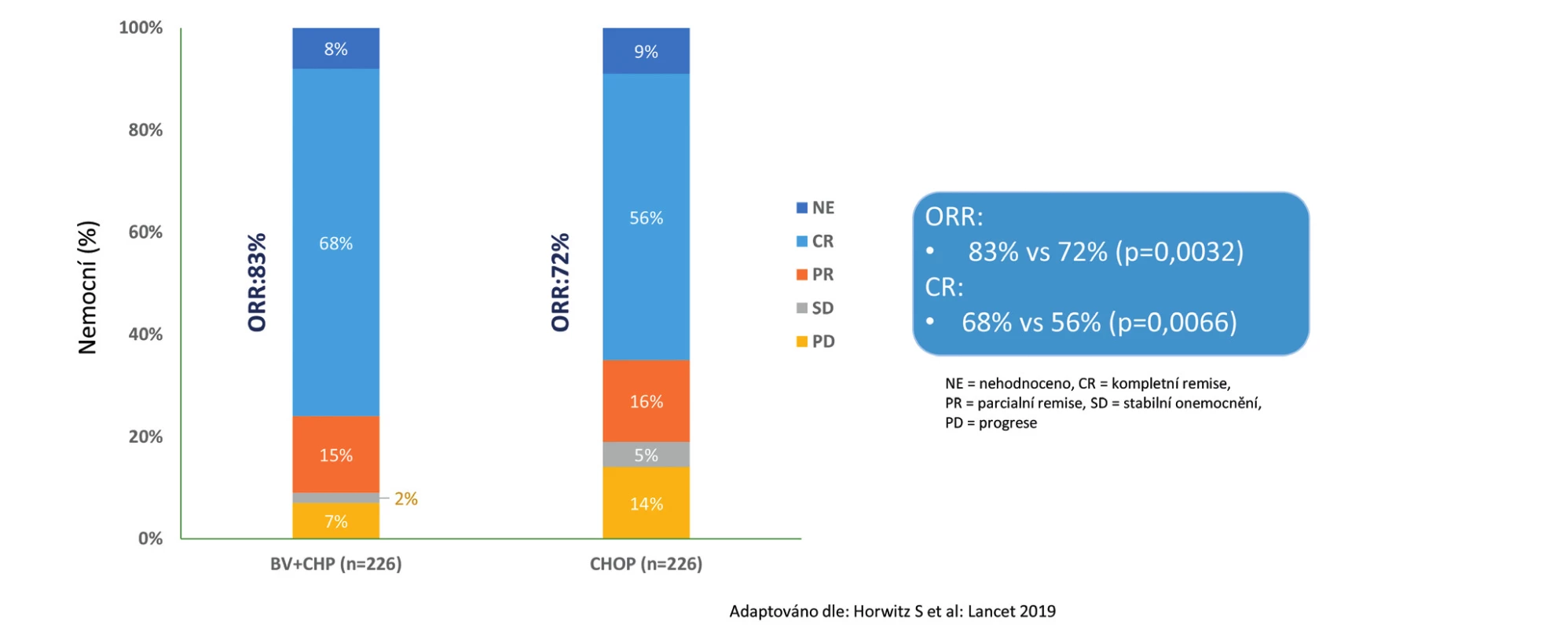
Zajímavé výsledky byly prezentovány stran korelace mezi expresí CD30 a efektivitou léčby. Ze závěrů této subanalýzy vyplývá, že neexistuje žádná korelace mezi stupněm exprese CD30 a účinností režimu BV-CHP [17]. Druhá subanalýza se týká významu autologní transplantace (ASCT) na základě výsledků studie ECHELON-2 u pacientů léčených BV. Z výsledků vyplývá, že vysokodávkovaná terapie s ASCT je výhodnější z hlediska PFS, na druhou stranu nejednalo se o prospektivní, randomizované sledování, ale až následnou post-hoc subanalýzu, která je tak zatížena jistě selekčním bias při volbě daného postupu [18]. Ani z této práce tedy nelze udělat jednoznačný závěr ohledně významu ASCT jako konsolidační terapie 1. linie léčby nemocných s PTCL.
Nežádoucí účinky
Výskyt a závažnost sledovaných nežádoucích účinků byly celkově srovnatelné mezi oběma rameny. O něco vyšší výskyt průjmů (většinou stupně 1) byl zaznamenán v rameni BV-CHP. Procento zaznamenané hematologické toxicity terapie, stejně jako očekávané neuropatie, bylo srovnatelné mezi oběma režimy (obr. 4).
Image 4. Studie Echelon-2: Přehled hlavních nežádoucích účinků 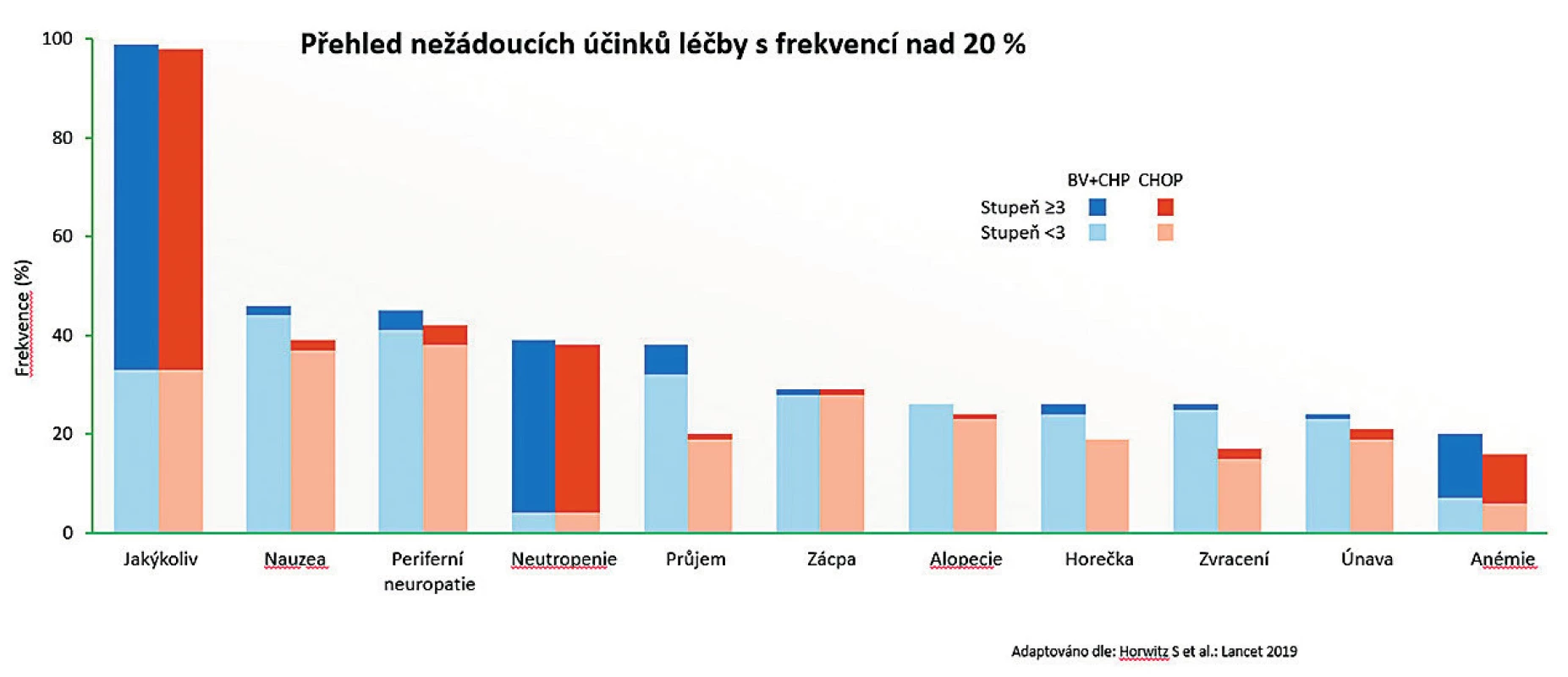
Periferní neuropatie byla velmi pečlivě sledovaným ukazatelem během studie, protože podání vinkristinu i BV je spojeno s tímto nežádoucím účinkem. Celkově byla zaznamenána u 52 % nemocných léčených BV-CHP a u 55 % nemocných léčených CHOP. Zajímavé bylo i sledování dynamiky následné úpravy této neuropatie po ukončení léčby. K úpravě neuropatie na vstupní úroveň před léčbou došlo u 50 % nemocných léčených BV-CHP při mediánu 17 týdnů; u režimu CHOP k tomu došlo u 64 % nemocných s mediánem úpravy 11,4 týdne. Pouze u 2 nemocných léčených BV-CHP došlo ke vzniku neuropatie stupně 3 (u CHOP jen v jednom případě). Nežádoucí účinky vedly k ukončení léčby pouze v 6 % případů v rameni BV-CHP, resp. v 7 % v rameni CHOP [16].
Diskuse k výsledkům studie
Studie ECHELON-2 představuje první prospektivní, randomizovanou studii fáze 3, která prokazuje benefit režimu BV-CHP oproti dosud standardnímu režimu CHOP, a to jak z hlediska redukce rizika progrese (o 29 %), tak zejména prodloužení celkového přežití (redukce rizika úmrtí o 34 %). Nutno poznamenat, že největší benefit této terapie byl zaznamenán u nemocných s ALCL. Důležitým zjištěním bylo, že toxicita (a zejména periferní neuropatie) je srovnatelná mezi oběma režimy. Předchozí pokusy zlepšit výsledky léčby 1. line nemocných s PTCL byly vesměs neúspěšné. Kombinace režimu CHOP s novými léky, jako například romidepsin, alemtuzumab nebo pralatrexate, nevedla ke zlepšení výsledků, a to většinou z důvodu nepřijatelné toxicity [6, 7, 19]. Ani přidání etoposidu v rámci režimu CHOEP v první linii nevedlo k průkazu statisticky významného prodloužení OS v žádné z randomizovaných studií. Největší význam byl shledán u skupiny mladších nemocných do 60 let věku, ale jen z hlediska PFS [5]. Následně byla publikována data z retrospektivních analýz některých registrů (například z českého registru Kooperativní lymfomové skupiny NIHiL), které poukazují na možný benefit přidání etoposidu stran PFS i OS. Bohužel, tyto výsledky jsou zatíženy rizikem selekčního bias – nejedná se o prospektivní randomizované srovnání [10]. Ani v rámci analýzy ze švédského lymfomového registru nebyl v rámci multivariantní analýzy prokázán význam etoposidu na zlepšení celkového přežití v rámci režimu CHOEP [21]. Přehledně jsou srovnány výsledky studie ECHELON-2 s daty z českého a švédského registru v tabulce 2.
Table 2. Srovnání výsledků studie Echelon-2 s retrospektivními analýzami z národních registrů. 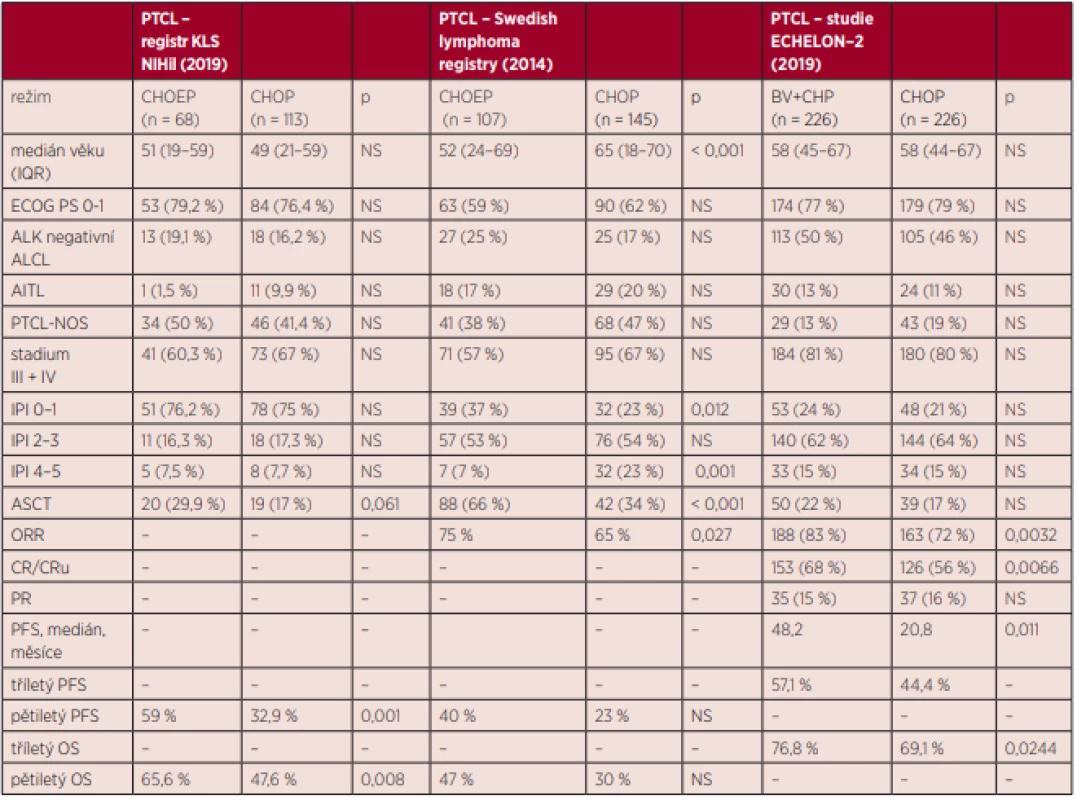
PTCL – periferní T-lymfomy, KLS – Kooperativní lymfomová skupina, IQR – interkvartilové rozdělení, ECOG PS – Eastern Cooperative Oncology Group pefrormance status, ALK – anaplastická lymfomová kináza, ALCL – anaplastický velkobuněčný lymfom, PTCL-NOS – periferní T-lymfom blíže nespecifikovaný, AITL – angioimunoblastický lymfom, IPI – mezinárodní prognostický index, CR – kompletní remise, CRu – nepotvrzená kompletní remise, PR – parciální remise, PFS – období do progrese, OS – celkové přežití, ASCT – autologní transplantace, ORR – celková léčebná odpověď, NS - nesignifikantní Konsolidační léčba 1. linie pomocí ASCT také neprokázala jednoznačný benefit OS. V rámci analýzy švédského registru byl sice shledán PFS i OS benefit ASCT, bohužel se jednalo o retrospektivní analýzu a nikoliv randomizované srovnání, a analýza je tím pádem zatížena rizikem selekčního bias. Navíc mezi oběma skupinami (ASCT a no-ASCT) byly poměrně významné rozdíly z hlediska vstupních charakteristik: věku (nemocní s ASCT byli významně mladší – 57 let vs. 65 let), použité indukční terapie (režim CHOEP byl použit u 66 % skupiny s ASCT vs. 20 % u skupiny no-ASCT) a vstupního IPI – nízké riziko bylo shledáno u 35 % transplantovaných oproti jen 22 % ve skupině no-ASCT [21]. Otázkou významu ASCT se zabývala i analýza z dat registru NIHiL české Kooperativní lymfomové skupiny. V rámci retrospektivní analýzy bohužel nelze jednoznačně význam ASCT zhodnotit z důvodu malého počtu nemocných, kteří byli k této terapii indikováni [10]. V současné době neexistuje žádná randomizovaná studie zkoumající význam ASCT jako konsolidační terapie 1. linie. I přes absenci této studie některé výše uvedené práce ukazují na její benefit, proto je tato terapie považována za možnost konsolidační léčby 1. linie a takto je uvedena v doporučeních pro léčbu nemocných do 65 let s PTCL v České republice [21].
V léčbě nemocných s relapsem PTCL jsou k dispozici data o velmi dobré efektivitě BV v terapii nemocných s relabujícím nebo refrakterním ALCL, kde léčebnou odpověď dosáhlo celkem 86 % nemocných, z toho u 57 % bylo dosaženo CR [14]. Tyto výsledky byly potvrzeny i při dlouhodobém sledování [22]. Účinnost BV v léčbě ostatních podtypů PTCL v relapsu onemocnění je výrazně nižší – léčebná odpověď byla zaznamenána u 41 % s mediánem doby do progrese 6,7 měsíce [23].
Kromě naplnění primárního cíle studie, kterým bylo prodloužení PFS pro celou studijní populaci, se podařilo splnit i klíčový sekundární cíl studie, kterým bylo zlepšení PFS v nejvíce zastoupené populaci, a to u nemocných s ALCL. Požadavek regulatorních autorit na zařazení minimálně 70 % (± 5 %) nemocných s touto diagnózou ale současně způsobil, že zastoupení ostatních histologických subtypů bylo výrazně nižší. Z tohoto důvodu je interpretace výsledků u nemocných s PTCL-NOS a AITL obtížná. Hlavní limitací bylo, že studie nebyla designována na porovnání účinnosti mezi jednotlivými histologickými subtypy. Zatímco u nemocných s PTCL-NOS se v rámci multivariantní analýzy intervaly spolehlivosti stran benefitu PFS i OS pohybovaly na straně BV-CHP, u AITL jsou výsledky léčby z důvodu malého počtu nemocných nejednoznačné a přínos BV je sporný. Dalším důležitým aspektem z hlediska správné interpretace výsledků této studie je pozitivní skutečnost, že medián PFS u kontrolního ramene (20,8 měsíce) je v porovnání s některými jinými kohortami historicky lepším výsledkem. To ale může být způsobeno relativně vysokým zastoupením skupiny nemocných s ALCL (přestože podmínkou pro ALK pozitivní nemocné bylo IPI 2 a více).
I přes pozitivní výsledky studie v této oblasti zůstává celá řada otazníků. Prvním je benefit BV u méně zastoupených histologických podskupin – PTCL-NOS a AITL. Z důvodu malého počtu zařazených nemocných s těmito histologickými subtypy nebyl eventuální přínos BV tak dobře hodnotitelný jako u nemocných s ALCL a vyžaduje další studium. Druhým otazníkem je absence korelace mezi expresí CD30 a účinností léčby BV [17]. Podmínkou zařazení do studie ECHELON-2 byla minimálně 10% exprese antigenu CD30 pomocí IHCH vyšetření. Nelze vyloučit, že efektivita BV může být přítomna i u nemocných s nižší expresí CD30 – toto bude předmětem dalšího výzkumu. Nadále nejasný je bohužel význam konsolidace autologní transplantací. Z výsledků post hoc analýzy vyplývá, že nemocní, kteří byli konsolidováni v rámci studie ECHELON-2 pomocí ASCT po léčbě 1. linie, dosáhli lepších výsledků z hlediska PFS. Nutno ale upozornit, že rozhodnutí o provedení ASCT muselo být provedeno před zahájením léčby. Nejednalo se tedy o randomizované srovnání, proto výsledky mohou být zatíženy významným selekčním bias a těžko z nich lze stanovit nějaké jednoznačné závěry. Další oblastí je otázka přidání etoposidu k režimu CHOP a kombinace s BV, a to zejména u mladších nemocných. Je možné, že tato kombinace by dosahovala ještě lepších výsledků, studie ale nebyla takto designována a pro eventuální průkaz je nutno vyčkat na výsledky dalších klinických studií. I přes zlepšení výsledků léčby nemocných s PTCL vstupem BV do léčby 1. linie jsou výsledky nemocných (zejména při selhání indukční léčby) neuspokojivé. V současné době probíhá celá řada klinických hodnocení testujících nové léky v léčbě PTCL, a to jak v první linii léčby, tak zejména v relapsu onemocnění. Jedná se například o monoklonální protilátku mogamulizumab proti chemokinovému receptoru CCR4, inhibitory histondeacetylázy belinostat a romidepsin, imunitu modulující lék lenalidomid, inhibitor kontrolních bodů nivolumab a další. Významná výzkumná aktivita je zaměřena i na testování léčby pomocí CAR-T (geneticky modifikované T-lymfocyty a chimérickým antigenním receptorem [23].
ZÁVĚR
Studie ECHELON-2 představuje po delší době průlomovou studii v terapii 1. linie nemocných s CD30 pozitivními PTCL. Největší benefit přidání BV byl pozorován u nemocných s ALCL, u ostatních subtypů nebyl benefit BV tak přesvědčivý, což mohlo být způsobeno malým zastoupením v rámci studie – zde nutno vyčkat výsledků dalšího výzkumu v této oblasti. BV v kombinaci s režimem CHP byl 16. listopadu 2018 schválen FDA (US Food and Drug Administration) pro léčbu první linie u ALCL a ostatních CD30 pozitivních PTCL. V rámci EMA (European Medicines Agency) je indikační omezení na ALCL nemocné. V České republice má BV nově od 1. 8. 2020 úhradu v 1. linii léčby dospělých pacientů s CD30-pozitivním periferním T-lymfomem v kombinaci s cyklofosfamidem, doxorubicinem a prednisonem. Jedná se o pacienty o stavu výkonnosti 0–1 podle ECOG. Brentuximab je hrazen do progrese onemocnění, projevů nepřijatelné toxicity nebo do vyčerpání maximálního počtu 8 cyklů kombinační chemoterapie podle toho, co nastane dříve.
Čestné prohlášení
Autor deklaruje tento potenciální konflikt zájmů: Takeda – konzultační činnost, podpora výzkumu, podpora vzdělávání.
Autor práce prohlašuje, že vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Tato práce byla podpořena projektem PROGRES Q40/08.
Do redakce doručeno dne 21. 3. 2020.
Přijato po recenzi dne 16. 4. 2020.
MUDr. David Belada, Ph.D.
4. interní hematologická klinika
Fakultní nemocnice Hradec Králové a Univerzita Karlova,
Lékařská fakulta v Hradci Králové
Sokolská 581
500 05 Hradec Králové 5
e-mail: david.belada@seznam.cz
Sources
1. Trněný M. Non-Hodgkinův lymfom v České republice. Transfuze Hematol Dnes. 2019;25(1):81–86.
2. Anderson JR, Armitage JO, Weisenburger DD. Epidemiology of the non-Hodgkin‘s lymphomas: distributions of the major subtypes differ by geographic locations. Non-Hodgkin‘s Lymphoma Classification Project. Ann Oncol. 1998;9(7):717–720.
3. Foss FM, Zinzani PL, Vose JM. Peripheral T-cell lymphoma. Blood. 2011;117(25):6756–6767.
4. Schmitz N, Trümper L, Ziepert M, et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: an analysis of patients with T-cell lymphoma treated in studies of the German High-Grade NonHodgkin Lymphoma Study Group. Blood. 2010;116(18):3418–3425.
5. Pfreundschuh M, Trümper L, Kloess M, et al. Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of elderly patients with aggressive lymphomas: results of the NHL-B2 trial of the DSHNHL. Blood. 2004;104(3):634–641.
6. Trumper H, Wuff G, Ziepert M, et al. Alemtuzumab added to CHOP for treatment of peripheral T-cell lymphoma (pTNHL) of the elderly: Final results of 116 patients treated in the international ACT-2 phase III trial. J Clin Oncol. 2016;34(15suppl):7500.
7. Dupuis J, Morschhauser F, Ghesquières H, et al. Combination of romidepsin with cyclophosphamide, doxorubicin, vincristine, and prednisone in previously untreated patients with peripheral T-cell lymphoma: a non-randomised, phase 1b/2 study. Lancet Haematol. 2015;2(4):e160–165.
8. Válková V, Trněný M. Současné postavení transplantace krvetvorných buněk v léčbě lymfomů – přehled. Klin Onkol. 2010;23(3):155–164.
9. d’Amore F, Relander T, Lauritzsen GF, et al. Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01. J Clin Oncol. 2012;30(25):3093–3099.
10. Janikova A, Chloupkova R, Campr V, et al. First-line therapy for T cell lymphomas: a retrospective population-based analysis of 906 T cell lymphoma patients. Ann Hematol. 2019;98(8):1961–1972.
11. Bossard C, Dobay MP, Parrens M, et al. Immunohistochemistry as a valuable tool to assess CD30 expression in peripheral T-cell lymphomas: high correlation with mRNA levels. Blood. 2014;124(19):2983–2986.
12. Sabattini E, Pizzi M, Tabanelli V, et al. CD30 expression in peripheral T-cell lymphomas. Haematologica. 2013;98(8):e81–e82.
13. Forero-Torres A, Leonard JP, Younes A, et al. A Phase II study of SGN-30 (anti-CD30 mAb) in Hodgkin lymphoma or systemic anaplastic large cell lymphoma. Br J Haematol. 2009;146(2):171–179.
14. Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol. 2012;30(18):2190–2196.
15. Fanale MA, Horwitz SM, Forero-Torres A, et al. Brentuximab vedotin in the front-line treatment of patients with CD30+ peripheral T-cell lymphomas: results of a phase I study. J Clin Oncol. 2014;32(28):3137–3143.
16. Horwitz S, O’Connor OA, Pro B, et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet. 2019;393(10168):229–240.
17. Illidge T, Horwitz S, Iver S, et al. Response to A+CHP by CD30 expression in the ECHELON-2 trial. Hematol Oncol. 2019;37(S2):abstract 228.
18. Savage K, Radvani A, Horwitz S, et al. An exploratory analysis of brentuximab vedotin plus CHP (A+CHP) in the frontline treatment of patients with CD30+ peripheral T-cell lymphomas (ECHELON-2): impact of consolidative stem cell transplant. Blood. 2019;134(Supplement 1):464.
19. Advani RH, Ansell SM, Lechowicz MJ, et al. A phase II study of cyclophosphamide, etoposide, vincristine and prednisone (CEOP) alternating with pralatrexate (P) as front line therapy for patients with peripheral T-cell lymphoma (PTCL): final results from the T-cell consortium trial. Br J Haematol. 2016;172(4):535–544.
20. Ellin F, Landström J, Jerkeman M, et al. Real-world data on prognostic factors and treatment in peripheral T-cell lymphomas: a study from the Swedish Lymphoma Registry. Blood. 2014;124(10):1570–1577.
21. Belada D, Trněný M a kol. Diagnostické a léčebné postupy u nemocných s maligními lymfomy. X. vydání [on-line]. Praha: Czech Lymproma Study group, Kooperativní lymfomová skupian, Česká hematologická společnost ČLS JEP, 2018 Dostupné na: https://www.lymphoma.cz/_uploads/attachments/KLS_guidelines_10_2018.pdf
22. Pro B, Advani R, Brice P, et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma. Blood. 2017;130(25):2709–2717.
23. Horwitz SM, Advani RH, Bartlett NL, et al. Objective responses in relapsed T-cell lymphomas with single-agent brentuximab vedotin. Blood. 2014;123(20):3095–3100.
24. https://www.clinicaltrials.gov.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2020 Issue 3-
All articles in this issue
- COVID-19 a transfuzní služba v ČR
- Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
- Léčba multicentrické a unicentrické formy Castlemanovy nemoci
- Tematizace problémů komplexní péče z perspektivy osob s hemofilií
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Vzácné kožní změny asociované s monoklonální gamapatií: skleredém, skleromyxedém a IgA pemfigus – popis pěti případů a přehled léčebných možností
- Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
- Hodnocení znalosti transfuzního lékařství u lékařů po promoci v Turecku
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

