-
Medical journals
- Career
AL amyloidóza v obrazech
Authors: P. Látalová 1; T. Pika 2; P. Flodr 1
Authors‘ workplace: Ústav klinické a molekulární patologie LF UP v Olomouci 1; Hemato-onkologická klinika FN Olomouc a LF UP v Olomouci 2
Published in: Transfuze Hematol. dnes,20, 2014, No. 3, p. 76-80.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Nemocní se systémovou AL amyloidózou jsou diagnostikováni převážně v pozdějších až pokročilých stadiích nemoci, ačkoliv možnosti rozpoznání onemocnění i stratifikace pacientů se stále rozšiřují a stávají se dostupnými i mimo specializovaná diagnostická a léčebná centra. Tímto kazuistickým sdělením, jehož cílem je upozornit na danou problematiku, předkládáme nevšedním pohledem patologa spolu s obrazovou dokumentací případ pacienta se značně pokročilým onemocněním, které bylo diagnostikováno až krátce před smrtí ve stadiu velmi významných orgánových změn, tři měsíce po prvním vyšetření lékařem.
Klíčová slova:
AL amyloidóza, volné lehké řetězce imunoglobulinu, renální postižení, srdeční postiženíÚvod
Muž ve věku 49 let byl od srpna 2013 vyšetřován pro několik měsíců progredující únavu a nechutenství. Hmotnostní úbytek činil 4 kg za čtyři měsíce. Gastroskopické vyšetření provedené v srpnu 2013 zjistilo gastritidu a bulbitidu, kolonoskopicky (09/2013) byla patrná pouze divertikulóza sigmoidea. Následně bylo indikováno vyšetření počítačovou tomografií (09/2013), které zobrazilo ascites, oboustranný fluidothorax a zvětšení lymfatických uzlin v mezenteriu. V laboratorním obraze v tomto období dominovala hepatopatie a známky nefrotického syndromu. Vyšetření krevního séra nepotvrdilo podezření na infekční hepatitidu. Pacient byl v říjnu 2013 přijat k hospitalizaci k došetření příčiny poškození ledvin.
Výsledky vyšetření a klinický průběh během hospitalizace
Nápadné perimaleolární otoky a hypotenze (100/70 mmHg) byly hlavní symptomy pacienta při příjmovém vyšetření a stav během krátké doby několika hodin progredoval v oběhové selhání s nutností překladu na jednotku intenzivní péče. Periorbitální purpura ani makroglosie, které patří mezi typické příznaky pacientů s AL amyloidózou, nebyly vyjádřeny. Proteinurie dosahovala 9 g/den, hladina kreatininu 240 μmol/l, urey 24,2 mmol/l. Echokardiografické vyšetření s abnormálním nálezem vyslovilo podezření na infiltrativní postižení myokardu charakteru amyloidózy, sérové ukazatele kardiálního postižení byly zvýšené: troponin T 0,253 μg/l (patologická hodnota je nad 0,014 μg/l), NT-proBNP 10177 ng/l (patologická hodnota je nad 125 ng/l). Vysoké sérové hladiny volných lehkých řetězců lambda (495 mg/l, index κ/λ 0,046) v korelaci s orgánovým postižením (nefropatie, kardiomyopatie a hepatopatie) vedly k podezření na systémovou AL amyloidózu. Vyšetření kostní dřeně (aspirace a průtoková cytometrie) prokázalo přítomnost monoklonálních plazmocytů, avšak kritéria pro diagnózu mnohočetného myelomu nebyla splněna. Pro přetrvávající podezření na amyloidózu byla druhý den hospitalizace provedena biopsie rekta vyšetřená ve statim režimu, která diagnózu AL amyloidózy potvrdila nálezem amyloidových lambda-pozitivních depozit (obr. 1a, 1b, 1c). Bezprostředně poté byla zahájena terapie dexametazonem, avšak přes maximální podpůrnou péči třetí den hospitalizace dospěl stav pacienta do těžké laktátové acidózy a šoku se srdeční zástavou, která vyústila v exitus letalis.
Obr. 1a Rektum – biopsie, Kongo červeň. Zvětšení 200x. Kongo pozitivní depozita ve stěnách cév a fokálně v intersticiu lamina propria mucosae. 
Obr. 1b Rektum – biopsie, Kongo červeň – vyšetření v polarizovaném světle. Zvětšení 200x. Kongo pozitivní depozita vykazují charakteristickou birefringenci s dichroismem. 
Obr. 1c Rektum – biopsie, imunohistochemické vyšetření lehkých řetězců Ig lambda. Zvětšení 200x. Pozitivita krevních cév a intersticia v lamina propria mucosae. 
Autoptický nález
Autoptické vyšetření bylo překvapující, protože prokázalo pokročilé orgánové nálezy. Nejvýraznější změny byly patrné na játrech, slezině, ledvinách a lymfatických uzlinách, méně nápadné změny byly zjištěny na srdci. Základní struktura jater byla setřelá (obr. 2a), konzistence jaterního parenchymu byla extrémně tuhá a zároveň křehká, což vedlo k podezření na depozici amyloidu. Shodný nález byl i ve slezině (obr. 3a). Ledviny byly symetricky zvětšené, jejich povrch zvýšeně lesklý, nažloutlé barvy. Kůra byla nepravidelně žlutě zabarvena a měla proto „žíhaný“ vzhled (obr. 4a). Na srdci byla patrná mírná hypertrofie obou komor s nepravidelným střídáním světlejších a tmavších okrsků srdeční svaloviny (obr. 5a). Lymfatické uzliny byly zvětšeny zejména v oblasti mezenteria, kde vytvářely místy až splývající pakety tmavě šedorůžové barvy a budily podezření z nádorového postižení.
Obr. 2a Setřelá struktura jater na řezu. 
Obr. 2b Játra – histologický nález, Kongo červeň. Zvětšení 100x. Kongo pozitivní depozita ve stěnách cév a rozsáhle v intersticiu s atrofií trámců hepatocytů. 
Obr. 3a Setřelá struktura sleziny na řezu. 
Obr. 3b Slezina – histologický nález, Kongo červeň. Zvětšení 100x. Kongo pozitivní depozita rozsáhle v oblasti červené i bílé pulpy. 
Obr. 4a Nepravidelné žluté zbarvení kůry ledvin. 
Obr. 4b Ledvina – histologický nález, Saturnová červeň. Zvětšení 200x. Sytě růžová depozita v intersticiu glomerulů ledviny. 
Následné histologické vyšetření vnitřních orgánů potvrdilo rozsah postižení, které bylo zřejmé již z makroskopického nálezu. Nádorové změny lymfatických uzlin nebyly prokázány, jejich vzhled byl podmíněn pouze difuzní depozicí amyloidu, který setřel základní strukturu a způsobil atrofii parenchymu (obr. 6). Amyloid byl v některých tkáních dobře patrný již v základním barvení hematoxylinem-eozinem, avšak jeho skutečné množství a lokalizace se znázornily až metodami speciálního barvení, zejména Kongo červení s vyšetřením v polarizovaném světle. Ve všech vyšetřených vnitřních orgánech a tkáních byl amyloid v různém množství prokázán. Zatímco v játrech a slezině byla patrná difuzní infiltrace způsobující atrofii parenchymu (obr. 2b, 3b), v ledvinách byly nejvíce postiženy glomeruly a stěny cév (obr. 4b, 4c). Změny myokardu odpovídaly ložiskovému postižení intersticia a stěn cév (obr. 5b). Četná depozita amyloidu byla přítomna také v kostní dřeni (obr. 7).
Obr. 4c Ledvina – imunohistochemické vyšetření lehkých řetězců Ig lambda. Zvětšení 100x. Pozitivita intersticia glomerulů. 
Obr. 5a Mírná hypertrofie obou srdečních komor s nepravidelným střídáním světlejších a tmavších okrsků srdeční svaloviny. 
Obr. 5b Myokard – histologický nález, Kongo červeň. Zvětšení 200x. Kongo pozitivní depozita ve stěně cévy a v drobných okrscích v intersticiu 
Image 1. Lymfatická uzlina – histologický nález, Kongo červeň. Zvětšení 100x. Základní struktura lymfatické uzliny je zcela setřena Kongo pozitivními depozity. 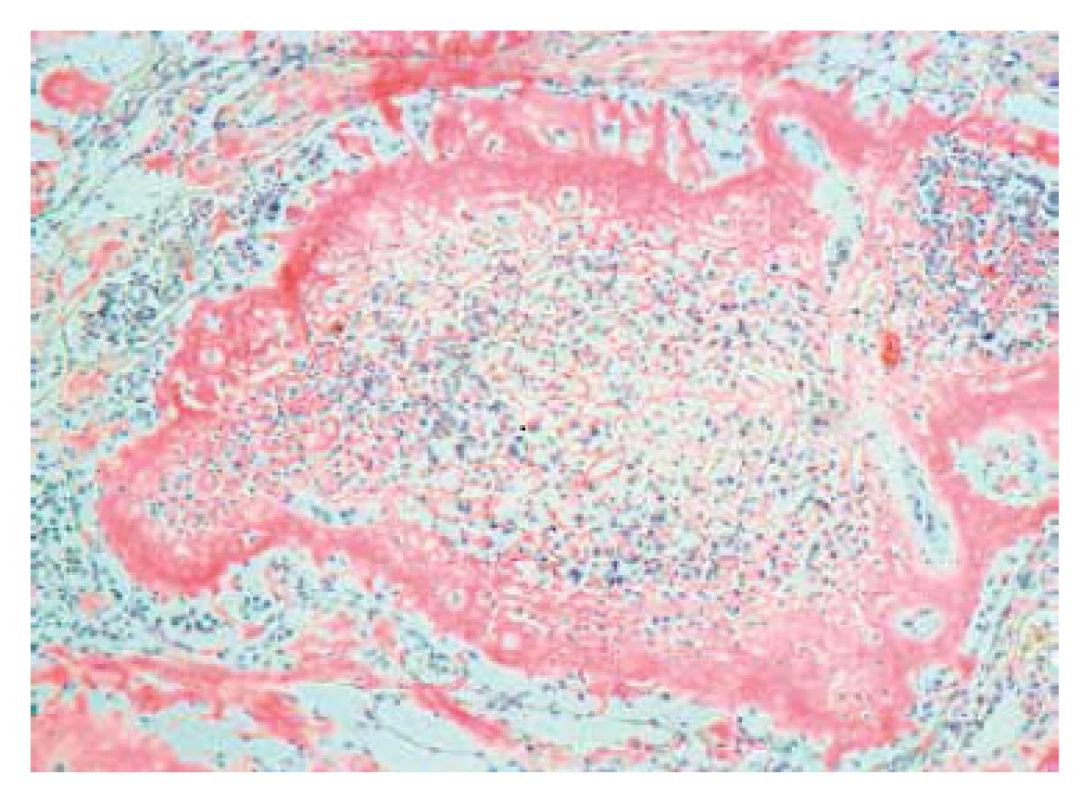
Image 2. Kostní dřeň – histologický nález, Kongo červeň. Zvětšení 200x. Splývající Kongo pozitivní depozita intertrabekulárně v intersticiu. 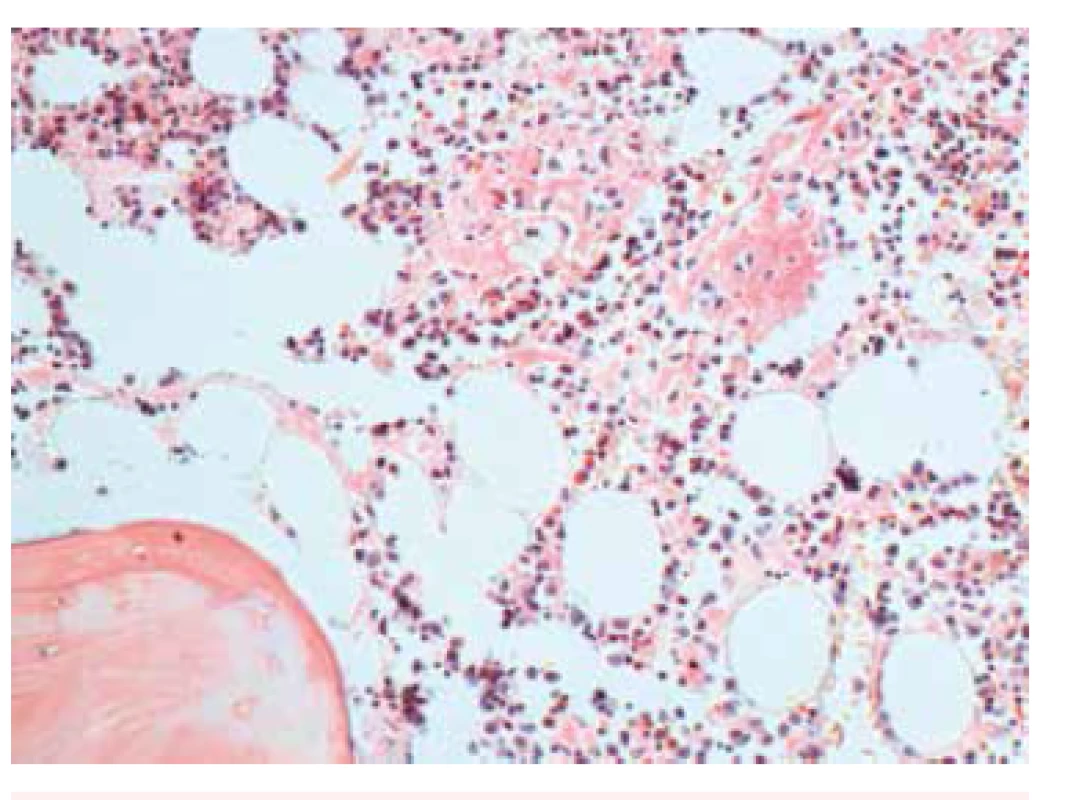
Závěr a diskuse
Prezentovaný případ pokročilé systémové AL amyloidózy nás upozorňuje na nutnost časné diagnostiky tohoto vzácného onemocnění. Incidence AL amyloidózy v České republice není přesně známa, ale přibližný odhad lze učinit při znalosti incidence v jiných oblastech, např. v USA je uváděna 5,1 až 12,8/1 mil. obyvatel za rok, v západní Evropě 0,8/100 000 obyvatel za rok (1, 6). V naší populaci lze proto odhadnout přibližně sto nových pacientů za rok. Nízká incidence je jeden z důvodů problematického záchytu nemocných. Diagnostiku dále ztěžuje velká různorodost projevů, které u systémové AL amyloidózy mohou zahrnovat postižení všech hlavních orgánových systémů. V rámci prvních vyšetření u pacientů se suspektní amyloidózou se kromě standardní anamnézy a fyzikálního vyšetření provádí základní biochemický rozbor krve a krevní obraz, speciální vyšetření krve k průkazu mnohočetného myelomu či AL amyloidózy (elektroforéza a imunofixace séra a moči, stanovení hladin imunoglobulinů a volných lehkých řetězců v séru) (3). Následuje cílené komplexní vyšetření kostní dřeně (průtoková cytometrie, cytologické vyšetření aspirátu, histologické vyšetření trepanobiopsie, genetické vyšetření aspirátu kostní dřeně) a orgánový screening nejčastěji postižených systémů (srdce, ledviny, játra) zahrnující laboratorní a zobrazovací vyšetření. Při přetrvávajícím podezření je indikován necílený odběr tkáně pro průkaz depozice amyloidu (rektum, malá slinná žláza dutiny ústní, jazyk, podkožní tuk), následovaný cíleným odběrem postiženého orgánů při negativitě necílené biopsie (nejčastěji biopsie ledviny). Jedním z nejvýznamnějších přínosů v diagnostice i stratifikaci pacientů je posun od pátrání po tradičních symptomech k detekci citlivých biomarkerů. Tyto biomarkery umožňují odhalit již presymptomatické orgánové postižení (2) a pro pacienty přinášejí možnost brzkého zahájení léčby. Ze spektra dostupných vysoce citlivých ukazatelů je třeba vyzdvihnout markery srdečního postižení (troponin T, NT-proBNP), které tvoří jeden ze základních pilířů pro prognostickou stratifikaci nemocných (1, 2, 3, 4, 5).
Systémová amyloidóza patří v České republice k poddiagnostikovaným onemocněním. Lze jen souhlasit s tvrzením prof. Merliniho, že časná diagnóza je dosud stále unikajícím klíčem ke zlepšení péče o pacienty s touto diagnózou (2).
Podíl autorů na rukopisu
Pavla Látalová: vypracování rukopisu, zpracování bioptického i nekroptického materiálu se stanovením diagnózy, vytvoření fotodokumentace
Tomáš Pika: zpracování klinických dat o pacientovi, zpracovaní souhrnu diagnostických metod při vyšetřování pacientů s amyloidózou, kontrola rukopisu
Patrik Flodr: supervize při zpracování bioptického materiálu a stanovení diagnózy, kontrola rukopisu
Seznam použitých zkratek
NT-proBNP – N-terminal pro-Brain Natriuretic Peptide; AL amyloidóza – light chain amyloidóza
Doručeno do redakce: 14. 7. 2014
Přijato po recenzích: 15. 9. 2014
MUDr. Pavla Látalová
Ústav klinické a molekulární patologie LF UP a FN Olomouc
Hněvotínská 3
779 00 Olomouc
Sources
1. Bird J, Cavenagh J, Hawkins P, et al. Guidelines on the diagnosis and management of AL amyloidosis. Brit J Haematol 2004; 125 : 681-700.
2. Merlini G, Wechalekar AD, Palladini G. Systemic light chain amyloidosis: an update for treating physicians. Blood 2013; 121 : 5124-5130.
3. Gertz MA. Immunoglobulin light chain amyloidosis: 2013 update on diagnosis, prognosis, and treatment. Am J Hematol 2013; 88(5): 416-425.
4. Pika T, Lochman P, Flodr P, et al. Význam stanovení vybraných laboratorních parametrů v diagnostice, stratifikaci a sledování nemocných s AL amyloidózou. Klin Biochem Metab 2013; 21(42): 79-82.
5. Fikrle M, Paleček T, Kuchynka P, et al. Cardiac amyloidosis: A comprehensive review. Cor Vasa 2013; 55: E60-E75.
6. Ščudla V, Pika T. Současné možnosti diagnostiky a léčby systémové AL-amyloidózy. Vnitř Lék 2009; 55 : 77-87.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2014 Issue 3-
All articles in this issue
- Molecular analysis of Fanconi anemia: the experience of the Bone Marrow Failure Study Group of the Italian Association of Pediatric Onco-Hematology
- Outcome and management of pregnancies in severe chronic neutropenia patients by the European Branch of the Severe Chronic Neutropenia International Registry
- Outcome of patients with abnl(17p) acute myeloid leukemia after allogeneic hematopoietic stem cell transplantation
- Allogeneic hematopoietic stem cell transplantation in patients with polycythemia vera or essential thrombocythemia transformed to myelofibrosis or acute myeloid leukemia: a report from the MPN Subcommittee of the Chronic Malignancies Working Party of the European Group for Blood and Marrow Transplantation
- Postthrombotic syndrome following upper extremity deep vein thrombosis in children
- Platelet diameters in inherited thrombocytopenias: analysis of 376 patients with all known disorders
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
- Případ diferenciální diagnostiky pancytopenie
- Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Effect of body mass in children with hematologic malignancies undergoing allogeneic bone marrow transplantation
- D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study
- Dexamethasone (6 mg/m2/day) and prednisolone (60 mg/m2/day) were equally effective as induction therapy for childhood acute lymphoblastic leukemia in the EORTC CLG 58951 randomized trial
- Diagnostic and risk criteria for HSCT-associated thrombotic microangiopathy: a study in children and young adults
- Validation and refinement of the Disease Risk Index for allogeneic stem cell transplantation
- Erythropoietin therapy after allogeneic hematopoietic cell transplantation: a prospective, randomized trial
- Immunodeficiency scoring index to predict poor outcomes in hematopoietic cell transplant recipients with RSV infections
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Případ diferenciální diagnostiky pancytopenie
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

