-
Medical journals
- Career
Stanovování funkční zdatnosti jater a jejich rezidua po velkých resekčních výkonech
Authors: M. Havel 1,2; A. Vašura 3; V. Dedek 1,2; P. Širůček 1,2; O. Kraft 1,2; G. Havlová 1; P. Vávra 4; M. Vávrová 5; S. Bobková 1; K. Trulíková 1
Authors‘ workplace: Klinika nukleární medicíny, Fakultní nemocnice Ostrava 1; Katedra zobrazovacích metod, Lékařská fakulta Ostravské univerzity 2; Interní a kardiologická klinika, Fakultní nemocnice Ostrava 3; Chirurgická klinika, Fakultní nemocnice Ostrava a Lékařská fakulta Ostravské univerzity 4; Radiodiagnostický ústav, Fakultní nemocnice Ostrava, ČR 5
Published in: NuklMed 2023;12:2-8
Category: Review Article
Overview
Úvod: Rozsáhlé resekční výkony na játrech jsou spojeny s rizikem vývoje jaterního selhání. V rámci indikace k operačnímu výkonu je využívána řada přímých i nepřímých metod k hodnocení funkce jaterního parenchymu i předpokládaného poresekčního rezidua.
Řešená problematika: Morfologické metody odhadují funkci zejména na základě informace o objemu budoucího rezidua, laboratorní testy posuzují spíše globální funkci a nemusejí vždy korelovat s prognózou pacientů. Ze scintigrafické diagnostiky mají potenciál postupy založené na sledování akumulace derivátů iminodioctové kyseliny (IDA), zejména se jedná o stanovení hepatální extrakční frakce a výpočet rychlosti nárůstu aktivity v jaterním parenchymu. Druhý uvedený postup umožňuje identifikovat pacienty v potenciálním riziku jaterního selhání po resekčním výkonu i díky literárně definovaným hraničním hodnotám.
Závěr: Scintigrafické metody mohou být využity v odhadu funkčního stavu budoucího rezidua jater, a tím i sloužit v algoritmu indikace pacientů k rozsáhlým resekčním výkonům. Z možných vyšetření umožňuje identifikovat pacienty v riziku jaterního selhání po operačním výkonu zejména výpočet rychlosti akumulace derivátu IDA v jaterním parenchymu.
Klíčová slova:
funkce – resekce – scintigrafie – játra – IDA
Úvod
Posouzení funkčního stavu jater je důležitou součástí zvažování léčebné strategie u pacientů s plánovanou resekcí části jejich parenchymu, také u pacientů před augmentační operací jater. Pacienti podstupující rozsáhlý operační zákrok s odstraněním části funkčního parenchymu jater jsou v riziku vývoje jaterního selhání, jehož výskyt je udáván v rozsahu 0,7 % až 9,1 %, přičemž má tento stav vysokou mortalitu, až 80 %. 1
K posouzení funkční zdatnosti jater, resp. k predikci funkce budoucího rezidua, je možno použít řadu přímých i nepřímých metod. Zaměřili jsme se na výčet některých z nich s dalším rozvedením metod nukleární medicíny, které mají potenciál zasahovat do diagnosticko-terapeutického postupu u pacientů plánovaných k velkým resekčním výkonům na játrech.
Řešená problematika
Posouzení funkční zdatnosti rezidua – anatomické metody
Morfologické zobrazovací metody, jako CT nebo MRI, přináší informaci o objemu předpokládaného funkčního rezidua. Pacienti podstupující rozsáhlý operační výkon bývají ovlivněni předchozí léčbou, často se jedná o nemocné s anamnézou onkologického onemocnění po prodělané protinádorové terapii, která sama o sobě může vést k postižení jater, a tak izolovaná informace o objemu rezidua nemusí přinést validní informaci. Potřebná velikost funkčního jaterního rezidua se u zdravých jater udává nad 25 %, u jater postižených, např. po chemoterapii, pak minimálně 40 %. 2 CT volumetrie představuje nepřímou metodu hodnocení jaterní funkce, resp. budoucího pooperačního rezidua. Problematické může být ne zcela explicitní stanovení hraničních parametrů, které jsou však závislé na funkční zdatnosti jaterního parenchymu, přičemž může být tato nadhodnocena. 3 Stran posouzení přítomnosti steatózy jaterního parenchymu je možno využít postprocesingovou metodu stanovení zastoupení lipidů ve tkáni, proton density fat fraction (PDFF). 4
Sonografické metody představují obecně pro pacienta méně zatěžující vyšetření, byly vyvinuty specializované postupy, které k hodnocení vlastností jaterního parenchymu využívají rozdílné technologie, ať už metody hodnotící atenuaci ultrazvuku v jaterní tkáni pro kvantifikaci akumulace tuku při jaterní steatóze či metody měřící rychlost šíření vln v játrech pro hodnocení jaterní fibrózy. 4
Laboratorní testy
Mezi testy, které jsou běžně dostupné, patří laboratorní metody stanovení hladin aminotransferáz, které korelují s mírou nekrózy jaterní buňky, nevypovídají ale přímo
o funkci jater. Aspartát aminotransferáza (AST) není specifický jaterní enzym, vyskytuje se i ve svalech a v srdci, má relativně kratší poločas. Alanin aminotransferáza (ALT) je naproti tomu specifická pro jaterní buňku, s delším poločasem. V případě akutního postižení jater dochází k výraznému zvýšení právě ALT, což bývá navázáno na nekrózu nebo odpovídá zvýšené permeabilitě po narušení buněčné membrány. Při ischemickém postižení mohou hladiny ALT a AST odpovídat rozsahu postižení. Laktátdehydrogenáza (LDH) je nespecifickým markerem ischemického postižení jater. 5 Hladina bilirubinu, která souvisí s vychytáváním, konjugací a exkrecí játry, není sensitivním markerem jaterního postižení, jelikož nemusí být více ovlivněna v časných fázích postižení jater. 5,6 Ač je bilirubin také přímo spojen s funkčními procesy v játrech, může být jeho plazmatická hladina ovlivněna i extrahepatálními procesy.
Albumin a koagulační faktory jsou syntetizovány v játrech, a tak jejich hladina je nepřímo obrazem globální jaterní funkce, jsou tak součástí i běžně používané klinické klasifikace Child-Pugh.
Jedním z laboratorních ukazatelů z poslední doby je kyselina hyaluronová, jejíž clearance souvisí s funkcí buněk jaterních sinusoidů. Mezi další markery patří cirkulující inhibitor matrixové metaloproteinázy (TIMP-1) a N-terminální peptid prokolagenu III (PIIINP), které svou hladinou korelují s obratem proteinů vaziva v játrech. Po složitém přepočtu jsou tyto tři výše jmenované ukazatele v běžné praxi užívané v tzv. ELF (Enhance Liver Fibrosis) skóre, hodnotícím významnost jaterní fibrózy či přítomnost cirhózy. 7–9
Z přímých funkčních testů bývá v některých zemích zavedena clearance indocyaninové zeleně (ICG). ICG je selektivně vychytávána hepatocyty, není metabolizována a nezměněná je vylučována do žluči. Normální hodnoty poklesu ICG v plasmě se pohybují v rozmezí 18–25 %/min. Diagnostiku lze provádět odběrem krevních vzorků po intravenózní aplikaci látky, dostupné jsou i neinvazivní monitory. Ale i tato metoda nemusí jednoznačně identifikovat pacienty se špatnou prognózou. 5,8,10
Klinické klasifikace
V klinické praxi je používána Child-Pugh klasifikace založená na posouzení sérové hladiny bilirubinu, albuminu, hladiny INR (international normalized ratio) a přítomnosti ascitu a encefalopatie. Klasifikace byla v průběhu let modifikována a slouží k odhadu prognózy u pacientů s cirhózou a chronickým onemocněním jater. 11 (Tab. 1) Přesné stanovení funkční rezervy parenchymu je důležité zejména u pacientů s Child-Pugh A, jelikož u této skupiny, pokud je zvažován rozsáhlý resekční výkon, nemusí tato klasifikace predikovat riziko jaterního selhání. Složitějším, ale aktuálnějším systémem klinického hodnocení je MELD (Model for End-Stage Liver Disease) skóre, původně určené k predikci 3měsíčního přežití u pacientů s konečným selháváním jater podstupujících zavedení portosystémové anastomózy. Složitá rovnice integruje hodnotu sérového bilirubinu, INR a kreatininu a také informaci, zda byl pacient v posledním týdnu dialyzován. 12
Table 1. Child-Pugh skóre a sledované parametry. 5–6 bodů = Child-Pugh A, přežití 1 rok 100 %, přežití 2 roky 85 %; 7–9 bodů = Child-Pugh B, přežití 1 rok 81 %, přežití 2 roky 57 %; 10–15 bodů = Child-Pugh C, přežití 1 rok 45 %, 2 roky 35 %. 11 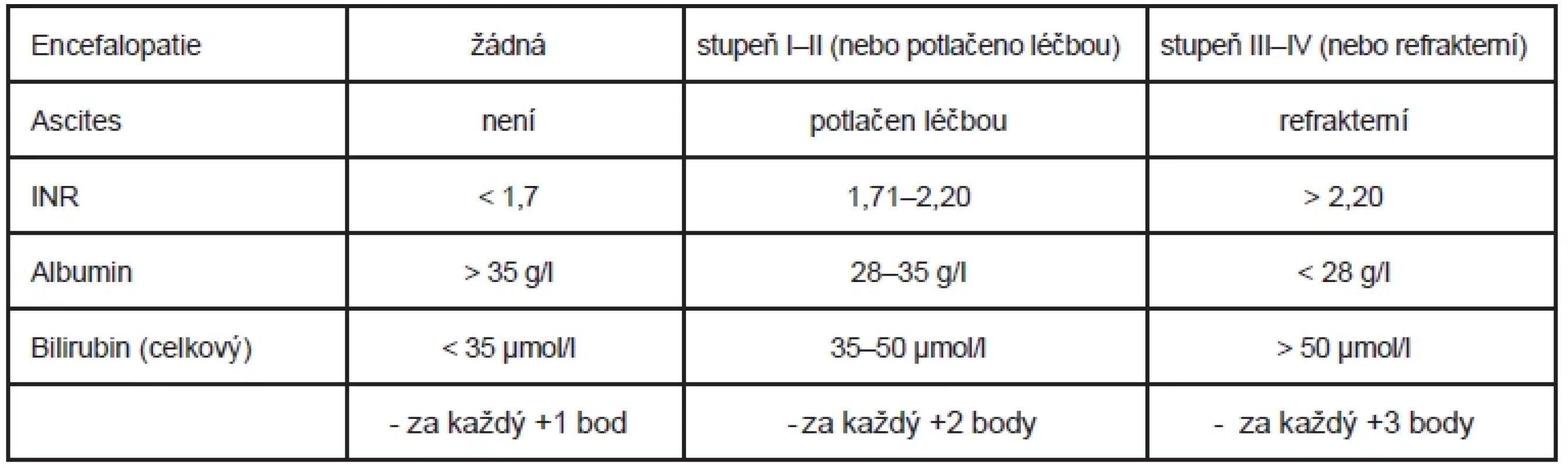
Scintigrafické metody
Z hlediska scintigrafické diagnostiky je možné se setkat s vícero přístupy, mezi které patří zejména scintigrafie se značeným sulfur koloidem, galaktosyl sérovým albuminem (GSA) nebo deriváty imonodioctové kyseliny (IDA).
Akumulace značeného sulfur koloidu v játrech je založena na jeho vychytávání retikuloendoteliálním systémem ve funkčním parenchymu jater. Chan et al. prezentoval případ efektivního využití metody v hodnocení funkce předpokládaného budoucího rezidua jater před plánovaným velkým resekčním výkonem. 13 Bowen et al. sledoval korelaci akumulace koloidu v játrech vzhledem k funkci, posuzoval funkci celkovou i předpokládaného rezidua u pacientů s hepatocelulárním karcinomem před resekcí. 14 Metoda je postavena na sledování radioaktivity nad játry a nad slezinou v 15. minutě studie a vymezení oblastí zájmu na provedeném SPECT/CT. Vztah radioaktivity parenchymu jater a sleziny sledoval i Zuckerman et al., který poukázal na možnost sledování funkce jater u pacientů s cirhózou s výsledky korelujícími s Child-Pugh skóre. 15
Scintigrafie se značeným galaktosyl sérovým albuminem (GSA) využívá vazby na asialoglykoproteinové receptory na cytoplazmatické membráně hepatocytů. V předchozích studiích byla sledována využitelnost GSA scintigrafie v rámci hepatální chirurgie k odhadu funkce pooperačního rezidua či sledování funkce u hepatálního selhání. Jedna z metodik zahrnuje provedení studie s 20minutovou dynamickou studií s hodnocením poměru radioaktivity oblasti zájmu (ROI) nad játry vůči sumě radioaktivity ROI nad játry a nad srdcem v 15. minutě, index clearance pak odpovídá poměru radioaktivity nad srdcem ve 3. k 15. minutě. 16
Scintigrafie s deriváty IDA je dostupnou metodou i v ČR, tradiční indikací je zhodnocení funkce žlučových cest a jejich drenáže, ale i charakterizace lézí jaterního parenchymu stran jejich funkce. IDA se po intravenózní aplikaci váže na plazmatický albumin, je transportována do jater, kde je vylučována bez biotransformace do žlučového systému. Do jaterní buňky prochází analogickou cestou jako bilirubin. K hodnocení funkce jater, resp. predikované funkce budoucího rezidua, je možné použít odhad z akumulace radiofarmaka v jaterním parenchymu.
Využití analogů IDA v posuzování funkce hepatocytů může vycházet jednak ze stanovení extrakční frakce farmaka hepatocyty při prvním průchodu játry, výpočtem tzv. hepatální extrakční frakce (HEF), nebo sledováním rychlosti akumulace IDA v játrech. Tato metoda koreluje s clearance indocyaninové zeleně. Protože je radiofarmakum vylučováno do žluči, může být v rámci jedné studie vyšetřeno vedle funkce jater i vylučování žlučovými cestami. 17
Výpočet hepatální extrakční frakce
Parametr HEF má možnost odlišit postižení hepatocytu od patologie na žlučových cestách. Pokud není funkce hepatocytu narušena, probíhá rychlá clearance farmaka z krve. K získání křivky radioaktivity jaterního parenchymu, která by odpovídala hypotetickému stavu vývoje radoaktivity nad játry při aplikaci radiofarmaka přímo do krevního zásobení jater, je provedena dekonvoluční analýza. Výstupní funkcí je radioaktivita ROI nad játry a vstupní funkcí radioaktivita ROI bloodpoolu, tj. nad srdcem či slezinou. Na získanou křivku po dekonvoluční analýze je fitována monoexponenciální funkce. Model fitace se provádí od bodu, kde křivka protíná osu „x“, či zpětně od 30. minuty trvání studie, jak uvádějí některé metodiky, až do místa, kde již není kopírován exponenciální průběh křivky po dekonvoluci. Podílem hodnoty průsečíku fitované exponenciály s osou „y“ a maxima křivky po dekonvoluci získáme hodnotu tzv. hepatální extrakční frakce. 18–20 Normální rozmezí hodnot HEF pro 99mTc-mebrofenin je 92 % až 100 %. 21 Standardní oblastí pro výstupní funkci se volí parenchym horní části pravého laloku jater. 18,20
Metodika je odvozena z již tradiční práce Ekmana et al., kde je popsáno hodnocení akumulační schopnosti jater na základě výpočtu clearance 99mTc-IODIDA. 22 Adaptovaný postup jsme si ověřili i u některých pacientů před velkým resekčním výkonem. (Obr. 1, Obr. 2) Hodnoty HEF jsme stanovili dekonvoluční analýzou křivek aktivity z ROI vykresleného nad srdcem (vstupní funkce) a nad játry (výstupní funkce) při dynamické studii s mebrofeninem značeným 99mTc (99mTc-HIBIDA). Hodnotu HEF jsme dopočetli v grafu fitací monoexponenciální funkce na dekonvolucí získanou křivku.
Image 1. 1 Vyhodnocení studie dynamické scintigrafie jater v programu OstNucline u pacienta s ložiskovým postižením jater – velké defekty funkčního parenchymu v pravém laloku, drobné defekty v kontuře laloku levého, prodloužený poločas clearance radioindikátoru. 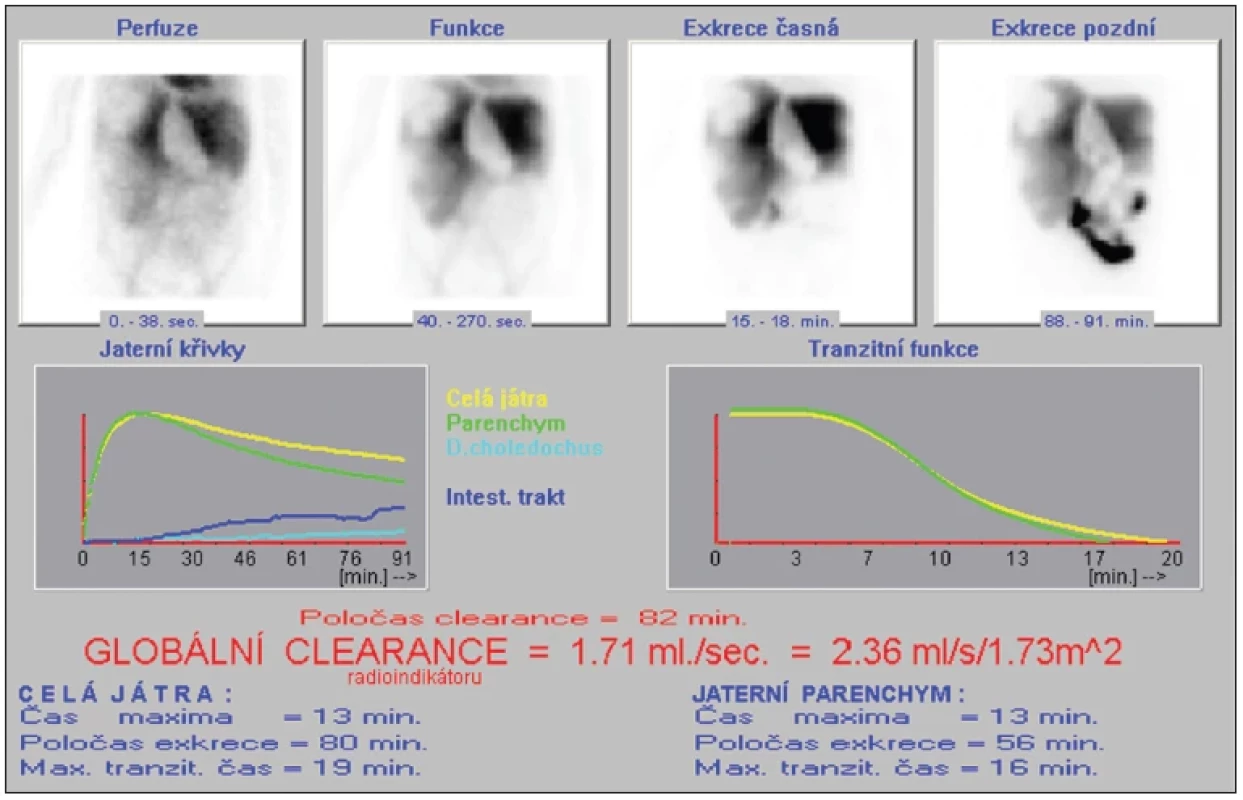
Image 2. Jednotlivé křivky po dekonvoluční analýze a fitované exponenciální funkce. a) Oblast pravého laloku laterálně – ložisko (HEF cca 25 %). b) Oblast pravého laloku mediálně (HEF cca 50 %). c) Oblast levého laloku (HEF nad 85 %). 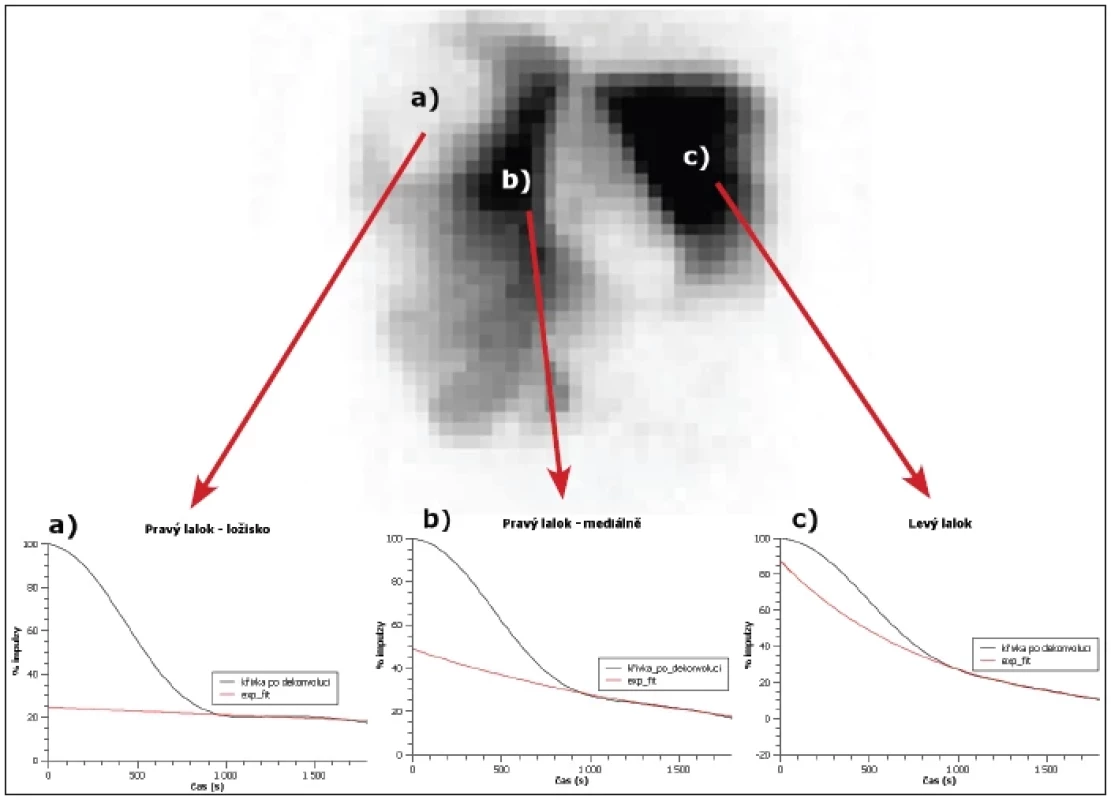
Stanovení rychlosti akumulace radiofarmaka v parenchymu
V poslední době relativně propagovanou metodou je stanovení rychlosti akumulace HIDA v jaterním parenchymu na základě posouzení gradientu nárůstu radioaktivity v prvních minutách dynamické studie. I tento způsob jsme si na pracovišti ověřili. Postup zahrnuje provedení dynamické studie po aplikaci 99mTc-mebrofeninu, ROI jsou vykresleny kolem jater, srdce a velkých cév, a kolem celé vyšetřované oblasti. Počítá se s hodnotami ROI v období 150. a 350. sekundy studie při předpokladu již homogenní distribuce radiofarmaka v krevním poolu v období 150. sekundy. (Obr. 3) Rozvedený vzorec dle práce Ekmana et al. je uveden níže:
Ač se zápis vzorce může zdát na první pohled složitý, všechny vstupní veličiny je možné získat z odečtu aktivit ROI, integrál Cnorm je fakticky suma normalizovaných aktivit krevního poolu v každém framu dynamické studie v daném časovém rozmezí t1 až t2. V praxi jsou pak používány výsledné hodnoty korigované na povrch těla (%/min/m2). K výpočtu predikované funkční zdatnosti budoucího rezidua se určí jeho podíl aktivity na celkové aktivitě jater, a to ze sumovaného planárního scintigramu nebo lépe z tomografických dat provedených v 10. minutě studie; tímto podílem se pak přepočte dříve vypočtená celková rychlost jaterní clearance. Mezní hodnota je nejčastěji udávána 2,69 %/min/m2. 23
Image 3. Křivky aktivita-čas k hodnocení gradientu nárůstu aktivity radiofarmaka v jaterním parenchymu, výpočet v časovém intervalu 150–350 s. Výsledek vztažený na celá játra 3,75 %/min/m2. 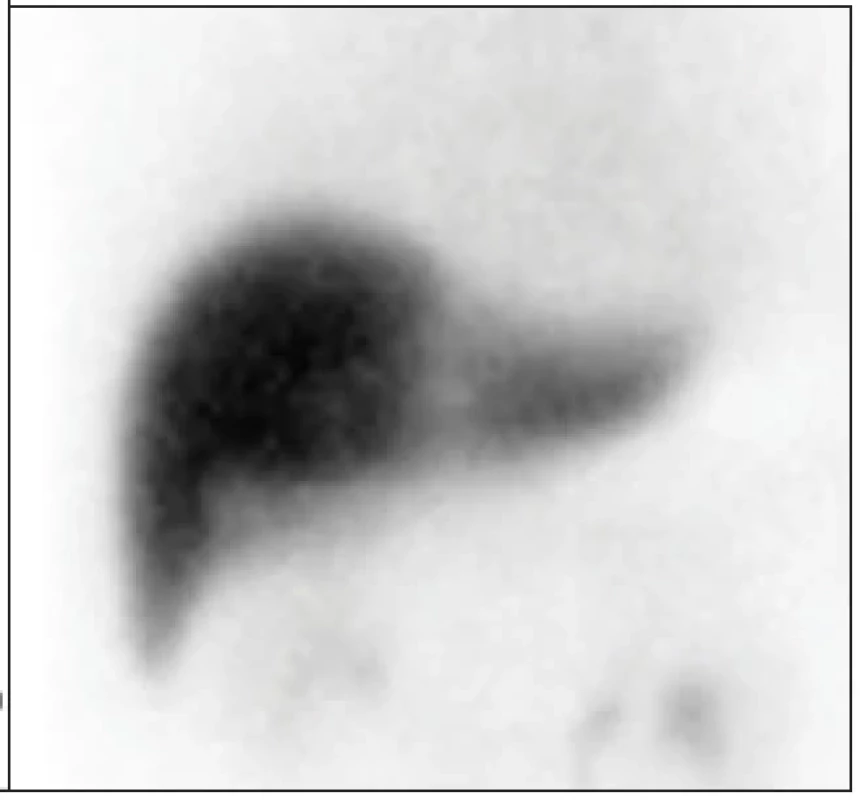
Diskuze
Pečlivá indikace pacientů k rozsáhlému resekčnímu výkonu na játrech je důležitá pro jejich prognózu. Zásadní pooperační komplikací je možný vývoj jaterního selhání resultujícího z nedostatečné velikosti či funkční zdatnosti poresekčního rezidua jater. U pacientů, kteří podstoupili chemoterapii či mají jiné onemocnění jater, je udávána mortalita spojená s pooperačním jaterním selháním až 32 %. Potřebná velikost funkčního jaterního rezidua se u zdravých jater udává nad 25 %, u jater postižených, např. po chemoterapii, pak minimálně 40 %. 2
Hepatocelulární karcinom (HCC) je nejčastější formou primárního jaterního karcinomu. Vzniká nejčastěji v terénu chronického onemocnění jater, především v důsledku jaterní cirhózy, která je brána jako prekancerózní stav vzniku HCC, navíc bývá nejčastější příčinou úmrtí při cirhóze. Etiologicky jsou významnými rizikovými faktory hepatitida B nebo C, i když vliv hepatitidy C v čase relativně klesá vzhledem k zavedené antivirotické léčbě. Riziko představuje i konzumace alkoholu, stoupá význam nealkoholické steatohepatitidy nebo cukrovky. Vzhledem k tomu, že až 90 % výskytu HCC je asociováno s cirhózou, může být výběr léčebné modality tímto komplikován. Obecně jsou pacienti v časných stádiích indikováni k resekci nebo transplantaci nebo k ablaci, přičemž pacienti s pokročilejšími stádii jsou spíše kandidáty k provedení chemoembolizace nebo k systémové léčbě. 24 U nemocných v pokročilých stádiích a s metastatickým postižením se v posledním období nabízí v terapii možnost medikace multikinázovými inhibitory. 25 Vzhledem k průvodní alteraci jaterního parenchymu cirhózou se stává zhodnocení funkčního stavu parenchymu velmi důležité. U pacientů s HCC v terénu cirhózy je důležité hodnocení přítomnosti významné portální hypertenze, kdy se v takovém případě zvažuje spíše transplantace jater. 26
Játra jsou jedním z nejčastějších míst metastatického postižení. U pacientů s kolorektálním karcinomem bývají játra postižena ve více než 25 % případů. 27,28 Chirurgické odstranění jaterních ložisek je jediným potenciálním terapeutickým řešením zvyšujícím 5leté přežití. 28,29 V době stanovení diagnózy je však chirurgická resekce ložisek jater možná jen u malé části pacientů (10–20 %). 30 U pacientů, kteří podstoupili chemoterapii či mají jiné onemocnění jater, je udávána mortalita spojená s poresekčním jaterním selháním až 32 % i na podkladě vývoje následného jaterního selhání z nedostatečně velkého funkčního rezidua. 2
Limitací dostupnosti nukleárně medicínské metody je dostupnost použitelných radiofarmak. U scintigrafie jater není v současné době registrován v ČR žádný preparát na bázi koloidu s indikací scintigrafie jaterního parenchymu. V posledních měsících je i problematická dostupnost značených derivátů IDA.
Používaná radiofarmaka k dynamické scintigrafii jater, deriváty IDA, se navíc liší různou extrakční frakcí jater a také rozdílnou extrakcí ledvinami. Jejich farmakokinetika je ovlivňována hladinou bilirubinu v krvi. Bilirubin se váže na transportní proteiny, a tak při vyšší koncentraci interferuje s přenosem radiofarmaka, zvyšuje jeho vylučování alternativní cestou ledvinami. Mebrofenin se vyznačuje nejvyšší rezistencí proti tomuto ději, a tak je nejvhodnějším farmakem pro scintigrafickou diagnostiku u pacientů s vysokými hladinami bilirubinu a pro hodnocení funkce. Při hladinách bilirubinu 170 μmol/l je totiž uptake disofeninu játry jen 36 %, kdežto u mebrofeninu dosahuje hodnot nad 70 % i při hladině bilirubinu 340 μmol/l. 31 Posuzování rychlosti jaterní clearance a stanovení mezní hodnoty budoucího funkčního rezidua predikujícího možné jaterní selhání bylo prováděno a standardizováno s mebrofeninem. Radiofarmaka s rozdílnou extrakční frakcí v játrech a jiným podílem dalších cest jejich eliminace z organizmu mohou výsledky takto hodnocené jaterní clearance potenciálně podhodnocovat. 22 Nejčastěji udávaná hodnota vychází z práce Graafa et al., 2.69 %/min/m2. Postupem času se vývojem metodik objevily i mezní hodnoty nižší, až 1,59 %/min/m2. Rozdíly vycházejí z využití geometrického průměru v rámci dynamické studie, začlenění výstupů ze SPECT a rozdílně definované výstupy sledovaných souborů pacientů. 23,32,33
Zajímavé je stanovování regionální HEF z tomografických studií. 34,35 Tomografické stanovení lze principiálně použít i ke stanovení podílu budoucího funkčního rezidua při výpočtu založeném na gradientu nárůstu radioaktivity v parenchymu.
Použití funkčních metod může mít i potenciální význam v indikaci pacientů k dalším dostupným terapeutickým výkonům na játrech, vedle chirurgických metod kupříkladu i při indikaci pacientů před selektivní vnitřní radioterapií (SIRT).
Z neizotopových metod umožňuje analýzu regionálního hodnocení hepatální funkce na podobném farmakokinetickém modelu magnetická rezonance, a to díky využití kontrastní látky Gd-EOB-DTPA (Gadolinium ethoxybenzyl diethylenetriaminepentaacetát). 36
Ke zhodnocení jaterní fibrózy je zlatým standardem biopsie, i když její pozice může být při dostupnosti metod neinvazivních diskutabilní. Pokrok zaznamenává sonografie s určováním elasticity tkáně jater (elastografie), rozšiřuje se i spektrum speciálních laboratorních metod. 37
Závěr
Ke zhodnocení jaterní funkce slouží řada přímých i nepřímých metod. Scintigrafické metody mohou být využity v odhadu funkčního stavu budoucího rezidua jater, a tím i sloužit v algoritmu indikace pacientů k rozsáhlým resekčním výkonům. Potenciál k tomuto hodnocení mají zejména radiofarmaka deriváty IDA a specifické provedení dynamické studie. Především výpočet rychlosti akumulace radiofarmaka v jaterním parenchymu umožňuje identifikovat pacienty v riziku jaterního selhání po operačním výkonu i díky definovaným mezním hodnotám. Nutná však bude další standardizace provedení i odvozených sledovaných mezních hodnot, i vzhledem k začleňování tomografických metod nebo použití různých derivátů IDA.
NuklMed 2023;12 : 2–8
Sources
- Van Den Broek MAJ, Olde Damink SWM, Dejong CHC, et al. Liver failure after partial hepatic resection: definition, pathophysiology, risk factors and treatment. Liver Int. 2008;28 : 767-780
- de Santibañes E, Alvarez FA, Ardiles V. How to Avoid Postoperative Liver Failure: A Novel Method. World J Surg. 2012;36 : 125-128
- Olthof PB, Tomassini F, Huespe PE, et al. Hepatobiliary scintigraphy to evaluate liver function in associating liver partition and portal vein ligation for staged hepatectomy: Liver volume overestimates liver function. Surgery. 2017;162 : 775-783
- Bozic D, Podrug K, Mikolasevic I, et al. Ultrasound Methods for the Assessment of Liver Steatosis: A Critical Appraisal. Diagnostics. 2022;12 : 2287
- Gasperi A De, Mazza E, Prosperi M. Indocyanine green kinetics to assess liver function: Ready for a clinical dynamic assessment in major liver surgery? World J Hepatol. 2016;8 : 355
- Guerra Ruiz AR, Crespo J, López Martínez RM, et al. Measurement and clinical usefulness of bilirubin in liver disease. Adv Lab Med/Av en Med Lab. 2021;2 : 352-361
- Šmíd V. Liver fibrosis. Vnitr Lek. 2020;66 : 61-66
- Rassam F, Olthof PB, Bennink RJ, et al. Current Modalities for the Assessment of Future Remnant Liver Function. Visc Med. 2017;33 : 442-448
- Lichtinghagen R, Pietsch D, Bantel H, et al. The Enhanced Liver Fibrosis (ELF) score: Normal values, influence factors and proposed cut-off values. J Hepatol. 2013;59 : 236-242
- Faybik P, Hetz H. Plasma Disappearance Rate of Indocyanine Green in Liver Dysfunction. Transplant Proc. 2006;38 : 801-802
- Hines RL, Jones SB. Stoelting’s Anesthesia and Co-Existing Disease E-Book. Elsevier Health Sciences; 2021
- Moraes ACO de, Oliveira PC de, Fonseca-Neto OCL da. The impact of the meld score on liver transplant allocation and results: an integrative review. ABCD Arq Bras Cir Dig (São Paulo). 2017; 30 : 65-68
- Chan Y, Luk W, Cheng L, et al. Tc-99m sulfur colloid SPECT-CT and assessment of functional liver reserve after Y90 radioembolization: A case report. Int J Surg Case Rep. 2019;62 : 89-93
- Bowen SR, Chapman TR, Borgman J, et al. Measuring total liver function on sulfur colloid SPECT/CT for improved risk stratification and outcome prediction of hepatocellular carcinoma patients. EJNMMI Res. 2016;6 : 57
- Zuckerman E, Slobodin G, Sabo E, et al. Quantitative liver-spleen scan using single photon emission computerized tomography (SPECT) for assessment of hepatic function in cirrhotic patients. J Hepatol. 2003;39 : 326-332
- Suzuki Y, Kakisaka K, Sato T, et al. Tc-99m GSA scintigraphy within the first 3 days after admission as an early predictor of outcome in severe acute liver injury. Sci Rep. 2021;11 : 12518
- Bennink RJ, Dinant S, Erdogan D, et al. Preoperative assessment of postoperative remnant liver function using hepatobiliary scintigraphy. J Nucl Med. 2004;45 : 965-971
- Howman-Giles R, Moase A, Gaskin K, et al. Hepatobiliary scintigraphy in a pediatric population: determination of hepatic extraction fraction by deconvolution analysis. J Nucl Med. 1993;34 : 214-221
- Lieberman DA, Brown PH, Krishnamurthy GT. Improved scintigraphic assessment of severe cholestasis with the hepatic extraction fraction. Dig Dis Sci. 1990;35 : 1385-1390
- Brown PH, Juni JE, Lieberman DA, et al. Hepatocyte versus biliary disease: a distinction by deconvolutional analysis of technetium-99m IDA time-activity curves. J Nucl Med. 1988;29 : 623-630
- Prášek J. Atlas Dynamické Cholescintigrafie. 1. vyd. Praha: Agentura Pankrác; 2004, 72 p
- Ekman M, Fjälling M, Friman S, et al. Liver uptake function measured by IODIDA clearance rate in liver transplant patients and healthy volunteers. Nucl Med Commun. 1996;17 : 235-242
- de Graaf W, van Lienden KP, Dinant S, et al. Assessment of future remnant liver function using hepatobiliary scintigraphy in patients undergoing major liver resection. J Gastrointest Surg. 2010;14 : 369-378
- Llovet JM, Kelley RK, Villanueva A, et al. Hepatocellular carcinoma. Nat Rev Dis Prim. 2021;7 : 6
- Tomášek J, Tuček Š, Andrašina T. Hepatocelulární karcinom–diagnostika a terapie z pohledu klinického onkologa. Gastroenterol a Hepatol Gastroenterol a Hepatol. 2011;3 : 149-153 [online] [cit. 2022-12-10]. Dostupné na: https://www.prolekare.cz/casopisy/ceska-slovenska-gastro/2011-3-5/hepatocelularni-karcinom-diagnostika-a-terapie-z-pohledu-klinickeho-onkologa-35372
- Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 2022;76 : 681-693
- Martin J, Petrillo A, Smyth EC, et al. Colorectal liver metastases: Current management and future perspectives. World J Clin Oncol. 2020;11 : 761-808
- Rocha FG, Helton WS. Resectability of colorectal liver metastases: an evolving definition. HPB (Oxford). 2012;14 : 283-284
- Robinson SM, Wilson CH, Burt AD, et al. Chemotherapy-associated liver injury in patients with colorectal liver metastases: a systematic review and meta-analysis. Ann Surg Oncol. 2012;19 : 4287-4299
- Alvarez FA, Ardiles V, de Santibañes E. The ALPPS Approach for the Management of Colorectal Carcinoma Liver Metastases. Curr Colorectal Cancer Rep. 2013;9 : 168-177
- Markowicz-Piasecka M, Dębski P, Mikiciuk-Olasik E, et al. Synthesis and Biocompatibility Studies of New Iminodiacetic Acid Derivatives. Molecules. 2017;22 : 2265
- Chapelle T, Op de Beeck B, Roeyen G, et al. Measuring future liver remnant function prior to hepatectomy may guide the indication for portal vein occlusion and avoid posthepatectomy liver failure: a prospective interventional study. HPB. 2017;19 : 108-117
- Serenari M, Bonatti C, Zanoni L, et al. The role of hepatobiliary scintigraphy combined with spect/ct in predicting severity of liver failure before major hepatectomy: a single-center pilot study. Updates Surg. 2021;73 : 197-208
- Wang H, Feng M, Frey KA, et al. Predictive models for regional hepatic function based on 99mTc-IDA SPECT and local radiation dose for physiologic adaptive radiation therapy. Int J Radiat Oncol Biol Phys. 2013;86 : 1000-1006
- Wang H, Cao Y. Spatially resolved assessment of hepatic function using 99mTc-IDA SPECT. Med Phys. 2013;40 : 092501
- Nilsson H, Nordell A, Vargas R, et al. Assessment of hepatic extraction fraction and input relative blood flow using dynamic hepatocyte-specific contrast-enhanced MRI. J Magn Reson Imaging. 2009;29 : 1323-1331
- Papastergiou V, Tsochatzis E, Burroughs AK. Non-invasive assessment of liver fibrosis. Ann Gastroenterol. 2012;25 : 218-231
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine
2023 Issue 1-
All articles in this issue
- Editorial
- Stanovování funkční zdatnosti jater a jejich rezidua po velkých resekčních výkonech
- Přehled nejzajímavějších novinek a trendů 35. kongresu Evropské Asociace Nukleární Medicíny (EANM)
- Nukleární medicína a MUDr. Ladislav Šabata České Budějovice
- Annual Congress of the European Association of Nuclear Medicine, Barcelona, Španělsko
- Historický kvíz
- Sonda do historie
- Nuclear Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stanovování funkční zdatnosti jater a jejich rezidua po velkých resekčních výkonech
- Přehled nejzajímavějších novinek a trendů 35. kongresu Evropské Asociace Nukleární Medicíny (EANM)
- Nukleární medicína a MUDr. Ladislav Šabata České Budějovice
- Annual Congress of the European Association of Nuclear Medicine, Barcelona, Španělsko
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



