-
Medical journals
- Career
Miesto agonistov GLP1 receptorov a ich fixná kombinácia s inzulínom v liečbe diabetes mellitus 2. typu
Authors: Zbynek Schroner 1; Vladimír Uličiansky 2
Authors‘ workplace: SchronerMED, s. r. o., interná a diabetologická ambulancia Košice, Slovenská republika 1; Via medica, s. r. o., Košice, Slovenská republika 2
Published in: Vnitř Lék 2019; 65(4): 284-288
Category:
Overview
Liečba agonistami GLP1 receptorov vykazuje viaceré multiorgánové benefity. Medzi možné dôvody uprednostnenia tejto skupiny farmák možno zaradiť: účinnosť (celkové ovplyvnenie glukózovej triády), vplyv na hmotnosť (zníženie), kardiovaskulárna (KV) protektivita, spomalenie progresie nefropatie, ochrana funkcie B-buniek, bezpečnosť (nízke riziko hypoglykémie, nízky výskyt závažných nežiaducich účinkov), zníženie krvného tlaku, lipidov, biomarkerov KV rizika, markerov chronického subklinického zápalu. V rámci individualizovaného prístupu liečba agonistami GLP1 receptorov by mala byť preferovaná už vo včasných štádiách diabetes mellitus 2. typu, ako liek druhej voľby po metformíne, hlavne u obéznejších pacientov so subklinickými až klinickými prejavmi aterosklerózy, ale zatiaľ bez prejavov srdcového zlyhávania.
Klíčová slova:
agonisty GLP1 receptorov – fixná kombinácia – terapeutické miesto
Základná charakteristika, diferenciácia a účinky agonistov GLP1 receptorov
Agonisty GLP1 (Glucagon-Like Peptid/glukagonu podobného peptidu) receptorov nie sú degradované enzýmom dipeptidyl-peptidáza 4 (DPP4), viažu sa na receptory GLP1 a spôsobujú ich aktiváciu. Po ich podaní dochádza až k 5-násobnému zvýšeniu cirkulujúcich hladín aktívneho GLP1, ktorý sa produkuje v endokrinných L-bunkách tenkého a hrubého čreva v rámci odpovede na perorálne prijatie potravy. GLP1 má 2 bioaktívne formy: GLP1 (7–37) a GLP1 (7–36) amid. Obe formy majú podobnú biologickú aktivitu, hlavná cirkulujúca forma je GLP1 (7–36) amid.
V tab. 1 je diferenciácia agonistov GLP1 receptorov podľa chemickej štruktúry, farmakokinetického profilu a podľa vplyvu na evakuáciu žalúdka, glykémiu nalačno (Fasting Postprandial Glucose – FPG) a postprandiálnu glykémiu (PPG) [1,2].
Table 1. Diferenciácia agonistov GLP1 receptorov. Upravené podľa [23–25] ![Diferenciácia agonistov GLP1 receptorov.
Upravené podľa [23–25]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b690f742f268468d0b0e752775c6ae7f.jpeg)
Ako prvý agonista GLP1 receptorov, ktorý prišiel do klinickej praxe najprv v USA a potom postupne v iných aj európskych krajinách (medzi nimi aj na Slovensku) bol exenatid. Exenatid je syntetická verzia exendinu 4, ktorý bol izolovaný zo slín kôrnatca jedovatého (Heloderma suspectum). Exenatid sa skladá z 39 aminokyselín, je z 53 % homológny s natívnym GLP1. Biologický polčas exenatidu je 2,4 hod. Podľa farmakokinetického profilu sa zaraďuje medzi krátkodobo pôsobiace agonisty GLP1 receptorov, podľa účinku na evakuáciu žalúdka, glykémiu nalačno (GNL) a PPG medzi prandiálne agonisty GLP1 receptorov (výrazné spomalenie vyprázdňovania žalúdka, zníženie prevažne PPG a zníženie exkurzií postprandiálnej glykémie. Podáva sa 2-krát denne.
Lixisenatid, ktorý prišiel na slovenský trh v júni roku 2014, je podobne ako exenatid na exendíne 4 založený, krátkodobo pôsobiaci, prandiálny agonista GLP1 receptorov. Lixisenatid je zložený z 44 aminokyselín s amidáciou na C konci, je na asi 50 % homológny s natívnym GLP1. Po subkutánnom podaní biologický polčas je medzi 2,7–4,3 hod. Podáva sa 1-krát denne pred jedlom s najväčšou kalorickou hodnotou.
Medzi dlhodobo pôsobiace, non-prandiálne agonisty GLP1 receptorov, ktoré môžeme používať aj na Slovensku, zaraďujeme liraglutid (podáva sa s.c.1-krát denne), exenatid QW a dulaglutid (podávajú s.c. 1-krát týždenne). Tieto preparáty pôsobia viac na glykémiu nalačno, sú o niečo účinnejšie na zníženie HbA1c, majú relatívne malý vplyv na vyprázdňovanie žalúdka (ich anorektický účinok je sprostredkovaný prevažne pôsobením v centrálnom nervovom systéme). Pri ich podávaní je pozorovaný menší výskyt gastrointestinálnych nežiaducich účinkov v porovnaní s krátkodobo pôsobiacimi agonistami GLP1 receptorov. Zaznamenaný však bol pri nich určitý, aj keď veľmi malý vzostup srdcovej frekvencie.
Výskum v oblasti agonistov GLP1 receptorov však neustále pokračuje a vo vývoji je viacero liekov z tejto skupiny (napr. efpeglenatid – podávanie 1-krát týždenne, ITCA-650 – podávanie 1-krát mesačne) a iné [3,4].
Agonisty GLP1 receptorov účinkujú vo viacerých orgánoch. Na schéme 1 sú uvedené multiorgánové účinky agonistov GLP1 receptorov. Najdôležitejším fyziologickým účinkom GLP1 je regulácia postprandiálnej glukózovej homeostázy (pankreatické účinky). Tento účinok je sprostredkovaný receptorom pre GLP1, ktorý je exprimovaný najmä na povrchu A-buniek a B-buniek Langerhansových ostrovčekov pankreasu. GLP1 stimuluje glukózou navodenú sekréciu inzulínu. Naviazanie GLP1 na receptor, ktorý je umiestnený na bunkovej membráne B-buniek, vedie k následnej aktivácii adenylátcyklázy, čoho dôsledkom je akumulácia cyklického adenozínmonofosfátu (cAMP) v bunke, aktivácia proteínkinázy A, zvýšenie cytoplazmatickej koncentrácie Ca2+ a transport inzulínových sekrečných granúl smerom k bunkovej membráne. Táto opísaná kaskáda je prísne glukózodependentná, a preto nenastáva behom normálnych alebo nízkych koncentrácií glukózy. GLP1 tiež inhibuje postprandiálnu sekréciu glukagónu pri diabetes mellitus 2. typu (DM2T), výsledkom je strata fyziologickej supresie postprandiálnej sekrécie glukagónu s následnou zvýšenou glukoneogenézou v pečeni, ktorá ovplyvňuje bazálnu aj prandiálnu glykémiu a aj spomaľuje vyprázdňovanie žalúdka (hepatálne, gastrointestinálne účinky). Reguluje tiež príjem potravy zvýšením pocitu sýtosti (centrálne účinky) [5]. Stimulujú natriurézu, čím prispievajú k normalizácii tubuloglomerulárnej spätnej väzby, čo má za následok spomalenie progresie nefropatie (renálne účinky). Intenzívne sa študuje aj otázka kardiovaskulárnych efektov GLP1. Podávanie GLP1 agonistov vedie k celému spektru pozitívnych vplyvov na cievnu a srdcovú funkciu [6]. Účinky sú veľmi podobné efektom exogénneho GLP1. Podanie exenatidu pred experimentálnym vyvolaním ischémie u prasacieho modelu viedlo k zmenšeniu veľkosti infarktového ložiska a k prevencii zhoršenia systolickej a diastolickej funkcie [7]. Podobné účinky malo aj podanie liraglutidu [8]. Prvou klinickou štúdiou, ktorá preukázala zmenšenie infarktového ložiska po podaní GLP1 agonistu u ľudí, bola Lonborgova štúdia, v ktorej bol pacientom so STEMI infarktom myokardu podávaný intravenózne exenatid [9].
Schéma 1. Multiorgánové účinky agonistov GLP1 receptorov. Upravené podľa [26] ![Schéma 1. Multiorgánové účinky agonistov GLP1 receptorov. Upravené podľa [26]](https://pl-master.mdcdn.cz/media/image/c7138f00a1e782cd8284c0a23cad9c8f.jpeg?version=1557831687)
V súčasnosti máme k dispozícii výsledky 2 veľkých randomizovaných štúdií s agonistami GLP1 receptorov s preukázaným kardiovaskulárne protektívnym účinkom (LEADER s liraglutidom, SUSTAIN-6 so semaglutidom) [10,11]. V štúdii EXSCEL (v ktorej bol testovaný efekt exenatidu QW v dávke 2 mg podávanej raz týždenne ako prídavnej liečby k predchádzajúcej antidiabetickej liečbe v porovnaní s placebom) bolo pozorované zníženie primárneho kompozitného výsledku o 9 %, čo bolo na hranici štatistickej významnosti (p = 0,06) [12].
Napriek hraničnému efektu liečby na primárny kompozitný výsledok, celková mortalita bola znížená o 14 % (p = 0,02). Mechanizmus KV protektivity agonistov GLP1 receptorov nie je známy, ale dáva sa do súvislosti hlavne s ovplyvnením patogenetických mechanizmov aterosklerózy. Aktivácia GLP1 o receptorov v endotelových bunkách, bunkách hladkých svalov cievnej steny, makrofágoch a trombocytoch pravdepodobne priaznivo ovplyvňuje priamo proces aterogenézy na rôznych úrovniach [13,14]. Dokázaný bol tiež nefroprotektívny efekt liraglutidu a semaglutidu v oboch štúdiách.
Zistené boli tiež viaceré neuroprotektívne účinky GLP1 pri degeneratívnych neurologických ochoreniach ako je Parkinsonova alebo Alzheimerova choroba, aj keď zatiaľ len v animálnych štúdiách. Experimenty na zvieratách ukázali, že GLP1 zvyšuje počet B-buniek, a to znížením apoptózy, ale aj stimuláciou neoproliferácie B-buniek z buniek pankreatických duktov [15].
Miesto agonistov GLP1 receptorov v liečbe DM2T
V tab. 2 a tab. 3 sú uvedené možné dôvody na uprednostnenie liečby agonistami GLP1 receptorov. Možné nevýhody liečby týmito preparátmi sú zhrnuté v tab. 4.
Table 2. Možné dôvody na uprednostnenie liečby agonistami GLP1 receptorov. Upravené podľa [1] ![Možné dôvody na uprednostnenie liečby agonistami
GLP1 receptorov. Upravené podľa [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4754ba4dba00e4fdf603315df3d42dbd.jpeg)
Table 3. Možné dôvody na uprednostnenie liečby agonistami GLP1 receptorov. Upravené podľa [2] ![Možné dôvody na uprednostnenie liečby agonistami
GLP1 receptorov. Upravené podľa [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/363122e30be0ae2210a1ebb8560e760d.jpeg)
Table 4. Možné nevýhody liečby agonistami GLP1 receptorov 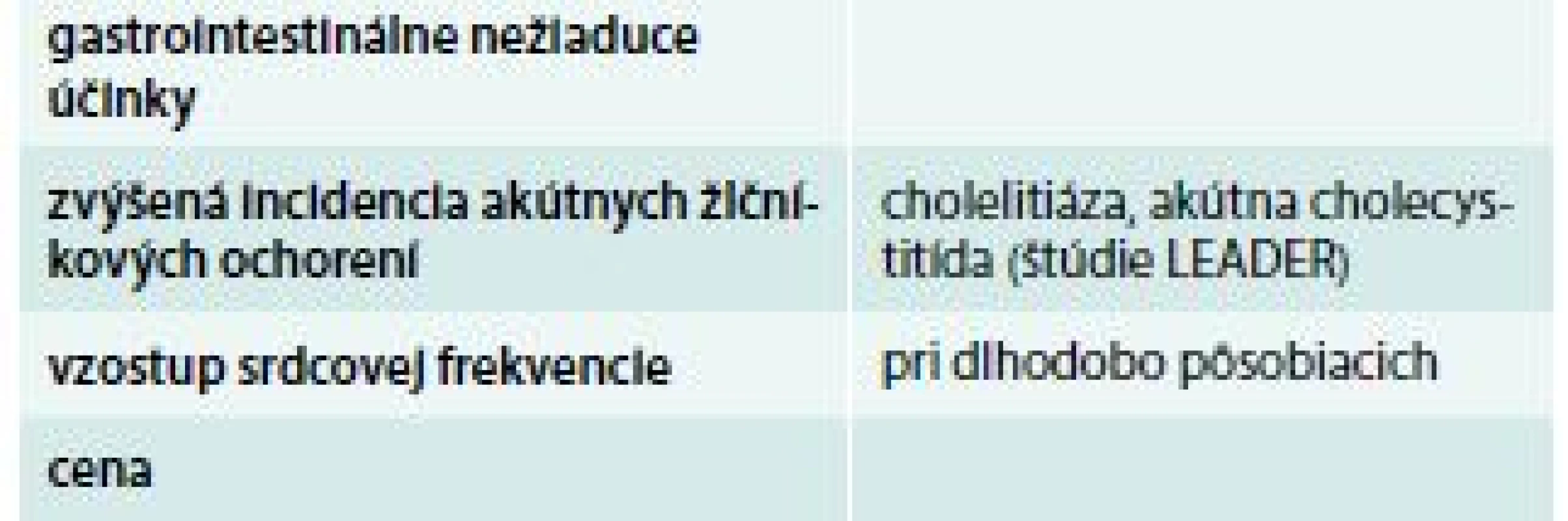
Podľa Európskej liekovej agentúry (European Medicines Agency – EMA) sú agonisty GLP1 receptorov určené na liečbu dospelých pacientov s DM2T na dosiahnutie glykemickej kontroly v kombinácii s perorálnymi liekmi znižujúcimi glykémiu a/alebo bazálnym inzulínom, keď tieto spolu s diétou a cvičením, neposkytujú adekvátnu glykemickú kontrolu. Ak je metformín kontraindikovaný alebo sú prítomné jeho nežiaduce účinky, možno použiť agonistov GLP1 receptorov aj ako monoterapiu.
Podľa v súčasnosti platných indikačných obmedzení v Slovenskej republike pre agonistov GLP1 receptorov hradená liečba sa môže indikovať u obéznych pacientov (BMI > 30 kg/m2, resp. BMI > 35 kg/m2 pri dulaglutide) s DM2T v kombinácií s metformínom alebo v kombinácií s metformínom a sulfonylmočovinou, ak predchádzajúca minimálne polročná liečba maximálnymi tolerovanými dávkami perorálnych antidiabetík neviedla k uspokojivej metabolickej kompenzácii (HbA1c > 7 % DCCT) [16].
Aktuálne odporúčania v liečbe DM2T sú charakterizované odklonom od „glukocentrického“ prístupu k liečbe, k prístupu, ktorý preferuje výber farmák podľa klinických charakteristík pacienta a dokázaných benefitov/rizík jednotlivých farmák.
V porovnaní so štúdiou UKPDS, v ktorej išlo o novodiagnostikovaných diabetikov 2. typu bez kardiovaskulárneho ochorenia (KVO), v štúdiách LEADER, SUSTAIN-6 boli zaradení pacienti s DM2T buď už s prítomným KVO, alebo s vysokým KV rizikom so súčasne veľmi dobrou antihypertenzívnou, hypolipidemickou a antiagregačnou liečbou. Presvedčivé výsledky štúdií LEADER, SUSTAIN-6 už viedli k úprave viacerých národných aj medzinárodných odporúčaní na liečbu DM2T. Dochádza k rozšíreniu indikácií liečby liraglutidom ako antidiabetika na prevenciu KV príhod aj progresiu nefropatie. Odporúčané je používanie agonistov GLP1 receptorov aj vo včasných štádiách DM2T, hneď po metformíne, hlavne u obéznejších pacientov so subklinickými až klinickými prejavmi aterosklerózy, ale zatiaľ bez prejavov srdcového zlyhávania [13,14].
Najnovší konsenzuálny terapeutický algoritmus Slovenskej diabetologickej spoločnosti (SDS) pre DM2T zdôrazňuje, že u pacientov s prítomným KVO alebo prekonanou KV príhodou, prejavmi srdcového zlyhávania či nefropatiou, by mal byť v liečbe zvažovaný liraglutid alebo empagliflozín (schéma 2 a schéma 3) [17].
Schéma 2. Klinické kategórie pre výber vhodnej farmakologickej liečby DM2T v zmysle EBM dôkazov (prítomné kardiovaskulárne ochorenia). Upravené podľa [17] ![Schéma 2. Klinické kategórie pre výber vhodnej farmakologickej liečby DM2T v zmysle EBM dôkazov
(prítomné kardiovaskulárne ochorenia). Upravené podľa [17]](https://pl-master.mdcdn.cz/media/image/d84540f3efb9f0011e056e469c62a76c.jpeg?version=1557831753)
Schéma 3. Možnosť a benefit použitia antidiabetík podľa eGF (redukcia progresie nefropatie). Upravené podľa [17] ![Schéma
3. Možnosť a benefit použitia antidiabetík podľa eGF (redukcia progresie nefropatie).
Upravené podľa [17]](https://pl-master.mdcdn.cz/media/image/b01ce98a493239e84f852219f671b666.jpeg?version=1557831765)
Najnovšie štandardy Americkej diabetologickej asociácie (American Diabetes Association – ADA) z roku 2018 uvádzajú, že u pacientov s prekonanou KV príhodou, resp. preukázaným aterosklerotickým KVO sa odporúča použitie liraglutidu, (alebo empagliflozínu), keďže preukázali zníženie KV mortality a celkovej mortality, ak sa použili ako prídavná liečba k bežnej starostlivosti [18]. Z patofyziologického, ale aj z klinického hľadiska sa zdá byť výhodná aj kombinácia agonistov GLP1 receptorov s inhibítormi SGLT2 (na Slovensku zatiaľ nie je možná) [19,20].
Fixná kombinácia agonistov GLP1 receptorov s inzulínom v liečbe DM2T
Kombinácia GLP1 agonistov s bazálnym inzulínom má aditívny účinok na zníženie glykemických parametrov (bazálny inzulín ovplyvňuje hlavne glykémie nalačno a GLP1 agonista postprandiálne glykémie), pri nižšej dávke inzulínu, bez zvýšeného rizika hypoglykémie. Minimalizovaný je tiež vzostup hmotnosti pri tejto kombinácii [21,22]. Európska lieková agentúra (EMA) ako prvú fixnú kombináciu agonistu GLP1 receptorov s bazálnym inzulínom schválila fixnú kombináciu inzulínu degludek s liraglutidom. Na klinickom trhu (zatiaľ nie na Slovensku) je aj fixná kombinácia inzulínu glargín s lixisenatidom. Podľa EMA sú fixné kombinácie inzulínu degludek s liraglutidom, resp. inzulínu glargín s lixisenatidom určené k liečbe dospelých diabetikov 2. typu s cieľom zlepšiť glykemickú kontrolu v kombinácii s perorálne podávanými liekmi na zníženie hladiny glukózy, keď tieto lieky samotné alebo v kombinácii s bazálnym inzulínom neposkytujú dostatočnú glykemickú kontrolu [17].
doc. MUDr. Zbynek Schroner, PhD.
SchronerMED, s.r.o., interná a diabetologická ambulancia Košice, Slovenská republika
Doručeno do redakce 12. 9. 2018
Přijato po recenzi 31. 1. 2019
Sources
-
Meier JJ. Differentiation of GLP-1 receptor agonist. Nat Rev Endocrinol 2012; 8(12): 728–742. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2012.140>.
-
Horowitz M, Rayner CK, Jones KL. Mechanisms and clinical efficacy of lixisenatide for the management of type 2 diabetes. Adv Ther. 2013; 30(2): 81–101. Dostupné z DOI: <http://doi: 10.1007/s12325–013–0009–4>.
-
Uličiansky V, Schroner Z, Némethyová Z et al. Personalizovaná medicína v kontexte odporúčaní ADA/EASD 2015. Forum Diab 2015; 4(2): 102–118.
-
Schroner Z, Uličiansky V. Multiorgánové benefity agonistov GLP-1 analógov. Interná Med 2015; 15(4): 175–177.
-
Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 2006; 368(9548): 1696–1705. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(06)69705–5>.
-
Ban K, Kim KH, Kelbaek H et al. Glucagon-like peptide -1 (9–36) amide-mediated cytoprotection is blocked by exendin (9–39) yet does not require the known GLP-1 receptor. Endocrinology 2010; 151(4): 1520–1531. Dostupné z DOI: <http://dx.doi.org/10.1210/en.2009–1197>.
-
Timmers L, Henriques JP, deKleijn DP et al. Exenatide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury. J Am Col Card 2009; 53(6): 501–510. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.10.033>.
-
Noyan-Ashraf MH, Momen MA, Ban K et al. GLP-1R agonist liraglutide activates cytoprotective pathways and improves outcomes after experimental myocardial infarction in mice. Diabetes 2009; 58(4): 975–983.Dostupné z DOI: <http://dx.doi.org/10.2337/db08–1193>.
-
Lonborg J, Vejlstup N, Kelbaek H et al. Exenatide reduces reperfusion injury in patients with ST-segment elevation myocardial infarction. Eur Heart J 2012; 33(12): 1491–1499. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr309>.
-
Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(4): 311–322. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1603827>.
-
Marso SP, Bain SC, Consoli A et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(19); 1834–1844. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1607141>.
-
Holman RR et al. [EXSCEL Study Group]. Effect of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2017; 377(13): 1228–1239. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1612917>.
-
Haluzík M, Schroner Z. Liečba založená na účinku inkretínov a kardiovaskulárne riziko. In: Haluzík M, Schroner Z, Mráz, M et al. Antidiabetiká a kardiovaskuslárne riziko. SchronerMed: Košice 2017. ISBN: 978–80–8129–073–2.
-
Tkáč I. Miesto agonistov GLP-1 receptorov a inhibítorov SGLT2 v modernej liečbe diabetu 2. typu. Diabetes a obezita 2017; 17(34): 17–24.
-
Gallwitz B. Extra-pancreatic effects of incretin-based therapies. Endocrine 2014; 47(2): 360–371. Dostupné z DOI: <http://dx.doi.org/10.1007/s12020–014–0223–0>.
-
Schroner Z. GLP1 analógy – vhodná terapeutická voľba u obéznych pacientov s DM 2. typu. Forum Diab 2016; 5(1): 25–28.
-
Martinka E, Uličiansky V, Mokáň M et al. Konsenzuálne terapeutické odporúčanie Slovenskej diabetologickej spoločnosti pre diabetes mellitus 2. typu (2018). Diabetes a obezita 2018; 18(35): 9–42.
-
[American Diabetes Association]. Standards of Medical Care in Diabetes 2018. Diabetes Care 2018; 41(Suppl 1): S73-S85. https://doi.org/10.2337/dc18-S008.
-
Garber AJ, Abrahamson MJ, Barzilay JI et al. Consensus Statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the Comprehensive Type 2 Diabetes Management Algorithm – 2017 Executive Summary. Endocr Pract 2017; 23(2): 207–238. Dostupné z DOI: <http://dx.doi.org/10.4158/EP161682.CS>.
-
DeFronzo RA. Combination therapy with GLP-1 receptor agonist and SGLT2 inhibitor. Diabetes Obes Metab 2017; 19(10): 1353–1362. Dostupné z DOI: <http://dx.doi.org/10.1111/dom.12982>.
-
Kapitza CH, Bode B, Ingwersen SH et al. Preserved pharmacokinetic exposure and distinct glycemic effects of insulin degludec and liraglutide in IDegLira, a fixed-ratio combination therapy. J Clin Pharm 2015; 55(12): 1369–1377. Dostupné z DOI: <http://dx.doi.org/10.1002/jcph.549>.
-
Schroner Z, Uličiansky V. Nová fixná kombinácia inzulínu degludek s GLP-1 analógom liraglutidom – klinické skúsenosti a ich implikácia do klinickej praxe. Diabetes a obezita 2015; 15(30): 39–42.
-
Fineman MS, Cirincione BB, Maggs D et al. GLP-1 based therapies: differential effects on fasting and postprandial glucose. Diabetes Obes Metab 2012; 14(8): 675–688. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2012.01560.x>.
-
Meier JJ. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus.Nat Rev Endocrinol 2012; 8(12): 728–742. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2012.140>.
-
Horowitz M, Rayner CK, Jones KL. Mechanisms and clinical efficacy of lixisenatide for the management of type 2 diabetes. Adv Ther 2013; 30(2): 81–101. Dostupné z DOI: <http://dx.doi.org/10.1007/s12325–013–0009–4>.
-
Baggio LL, Drucker DJ. Biology of incretins: GLP-1 and GIP. Gastroenterology 2007; 132(6): 2131–2157. Dostupné z DOI: <10.1053/j.gastro.2007.03.054>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 4-
All articles in this issue
- Léčba inzulinovou pumpou: edukace a její cíle
- Diabetické těhotenství: současné možnosti léčby
- Primárna a sekundárna inzulínová rezistencia
- Strategie a taktika léčby diabetes mellitus 2. typu
- Jak dobře léčíme inzulinem v České republice a ve Slovenské republice Shrnutí výsledků a komentář originální česko-slovenské studie DIAINFORM
- Miesto agonistov GLP1 receptorov a ich fixná kombinácia s inzulínom v liečbe diabetes mellitus 2. typu
- Rámcový pohled na epidemiologii hypoglykemie u diabetes mellitus 1. a 2. typu
- Současný pohled na léčbu hypoglykemie
- Hypoglykemie jako symptom adrenální dysfunkce u pacientů s diabetes mellitus: vzácná, ale reálná situace
- Etanol a riziko hypoglykemie u pacientů s diabetes mellitus 1. typu: stručný přehled pro klinickou praxi
- Onemocnění dutiny ústní u pacientů s diabetem
- Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus: legislativní změny v roce 2018 a souhrn zdravotních aspektů
- Diabetes mellitus 1. typu: etiologie a epidemiologie
- Diabetes mellitus a chronické srdeční selhání
- Pavel Dostál et al. Základy umělé plicní ventilace
- Manažment diabetikov s končatinovocievnou artériovou chorobou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primárna a sekundárna inzulínová rezistencia
- Současný pohled na léčbu hypoglykemie
- Diabetes mellitus 1. typu: etiologie a epidemiologie
- Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus: legislativní změny v roce 2018 a souhrn zdravotních aspektů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

