-
Medical journals
- Career
Onemocnění štítné žlázy v seniorském věku
Authors: Zdeňka Límanová
Authors‘ workplace: III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Published in: Vnitř Lék 2018; 64(11): 993-1002
Category:
Overview
Nemoci štítné žlázy se většinou týkají žen v poměru 8 : 1 k mužům. Výskyt hypotyreózy se s věkem zvyšuje. Nepoznané poruchy funkce štítné žlázy vedou ke zvýšeným rizikům: kardiovaskulárním, zlomeninám, kognitivním postižením, depresím a zvýšené úmrtnosti. Symptomy onemocnění štítné žlázy (ŠŽ) mohou být nespecifické, u seniorů jsou běžné a doprovázejí problémy známkami stárnutí. Při interpretaci tyreoidálních testů musí být zváženy fyziologické změny v sekreci a metabolizmu tyreotropinu (TSH), vliv komorbidit, určitých léků a v neposlední řadě i individuální „set point“ hypofýzy. Na základě mnoha studií víme, že koncentrace TSH, tyroxinu (T4) závisí i na věku, komorbiditách a léčbě; tyto okolnosti často komplikují diagnózu u starší populace. V úvahu musíme brát i možnost snížené citlivosti hypofýzy vůči T4. Mnohé studie dokládají závislost koncentrace TSH na věku; horní limit TSH u starších > 70 let by mohl být 5,28–5,9 mIU/l. Terapie poruch funkce ŠŽ se u starších lidí liší od terapie mladší populace; hypotyreóza by měla být léčena obezřetně, protože vysoké dávky tyroxinu mohou vést k srdeční arytmii a zvýšenému kostnímu obratu. Definitivním řešením hypertyreózy je operace nebo – přednostně léčba radiojodem. Interpretace testů funkce ŠŽ může být u seniorů náročnější a zejména diagnóza subklinické hypotyreózy by měla být stanovena po zvážení všech důležitých okolností. Nicméně jsou dané jasné indikace, ve kterých je léčba subklinické hypotyreózy i u seniorů jednoznačná.
Klíčová slova:
hypertyreóza – hypotyreóza – onemocnění štítné žlázy – stárnutí
Úvod
Činnost endokrinních orgánů je ovlivněna genetikou, imunologickou výbavou, pohlavím, věkem, zevním prostředím, u štítné žlázy (ŠŽ) dodávkou či chyběním esenciálních prvků – jodu a selenu. Endokrinní systém také ovlivňují dnes široce diskutované endokrinní disruptory. Ve 20. století díky jodaci jedlé soli v mnoha zemích pozvolna došlo k eradikaci deficitu jodu, a tím se zásadně změnil charakter onemocnění ŠŽ, a likvidací kretenizmu se do určité míry ovlivnily psychické změny (IQ) populací, akcentace významu jodu v graviditě se příznivě uplatňuje při vývoji plodu v psychomotorické oblasti. Snížil se výskyt i charakter strumy, nicméně u populace narozené před rokem 1950 (zahájena jodace jedlé soli) nemusí být překvapením. Setkáváme se i s jedinci s kongenitální hypotyreózou, dnes staršími 40 let, kteří nebyli zavčas podchyceni a léčeni – screening byl zaveden v roce 1986. Dnes je takový novorozenec ihned po narození léčen a je zachráněn před negativními dopady na IQ, v ČR jde zhruba o 20–25 dětí ročně. I my sami lékaři působíme na ŠŽ iatrogenně operačními zásahy, zevním zářením, běžnými léky a v posledních letech léky, indikovanými při rozvíjející se protizánětlivé a onkologické léčbě. S rozšiřujícím se využitím nejen laboratorních, ale i zobrazovacích metod jsou podchyceny asymptomatické patologické nálezy (subklinické poruchy funkce), jejichž řešení se liší dle věku, komorbidity a stavu pacienta. Vyskytují se častěji u žen než u mužů zhruba v poměru 8 : 1. V dospělosti u normální – zdravé ŠŽ věk ani pohlaví nehrají významnější roli za předpokladu přiměřeného příjmu jodu. Zato subklinické poruchy – subklinická hypotyreóza (na podkladě chronické lymfocytární tyreoiditidy – CLT) a subklinická hypertyreóza (obvykle na podkladě uzlové přestavby) mají u starší populace tendenci progredovat do plně rozvinutých forem. Proto zamyšlení nad tyreopatiemi a vztahem ke stáří je stále aktuální.
Epidemiologie
Struma, která byla hrozbou ještě v minulém století, je v současné době v ČR spíše výjimkou. Tyreoidea se v oblastech s přiměřeným zásobením jodem spíše zmenšuje. Za strumu je považována u žen ŠŽ větší než 18 ml a 22 ml u mužů. Retrosternální zasahování ŠŽ u starší populace nemusí být při běžném RTG vyšetření patrné a je překvapením při vyšetření výpočetní tomografií (CT). Přestavby v retrosternální části jsou běžné – degenerativní cystické změny, hromadění koloidu, tvorba nodozit, adenomů, v diferenciální diagnóze vždy musíme uvážit i malignitu.
Poruchy funkce pozorujeme v celém věkovém spektru [1]. Hypertyreóza postihuje asi 1,5–1,8 % dospělých, při konzervativní léčbě lze asi u 20–30 % dosáhnout dlouhotrvající až celoživotní remise, ale vždy je riziko relapsu onemocnění. Část těchto osob přechází v průběhu let spontánně do hypotyreózy, a část se stává hypotyreózní po radikální léčbě (operace, radiojod). Subklinická forma zvláště u seniorů je uváděna u dalších asi 2 %.
Prevalence hypotyreózy v dospělé populaci se uvádí 4–5 %, ale toto číslo je zavádějící, protože existují značné rozdíly dle pohlaví, věku a geografických podmínek. Při aktivním vyhledávání, zaměřeném na osoby se zvýšeným rizikem, tj. na ženy a na osoby s autoimunitními chorobami, je záchyt vyšší. Perspektiva spontánního vyléčení prakticky není, vyjma iatrogenně vyvolané případy a stavy po subakutním zánětu. Nemocní jsou odkázáni na celoživotní substituci. Subklinická forma je u dalších 8–15 %, např. u selektované populace starších žen.
Obecné poznámky a přehled základních vyšetřovacích metod (postupů)
Hormony ŠŽ zasahují do činnosti většiny orgánů, jejich nedostatek či nadbytek má nepochybně negativní dopad na kvalitu života jedince. U seniorů ovlivňují hormony ŠŽ zvláště činnost kardiovaskulárního systému a neléčená rozvinutá hypotyreóza i hypertyreóza jsou spojeny s významnými kardiovaskulárními riziky. Při dlouhotrvající poruše ovlivňují hormony ŠŽ metabolizmus – hladinu glukózy, lipidů, zažívací trakt, skelet, svaly, psychiku, činnost dalších orgánů. Klinické obtíže u hypertyreózy bývají nápadné a onemocnění je odhalené spíše brzy, pacienta k lékaři přivedou. U hypotyreózy, zvláště u seniorů, jsou příznaky natolik nenápadné, že zůstávají dlouho nepovšimnuté. Při cíleném vyšetření je záchyt obou funkčních poruch využitím laboratorních a ev. zobrazovacích metod poměrně snadný. Diagnostika onemocnění ŠŽ je dobře propracovaná, snadno dosažitelná a levná. S tím ale souvisí riziko nadbytečné diagnostiky a nadbytečné léčby (overdiagnosis a overtreatment) [2], proto je potřebná správná indikace vyšetření, znalost okolností ovlivňujících laboratorní výsledy a schopnost interpretace nálezů z ultrasonografie (USG) a aspirační biopsie tenkou jehlou (Fine Needle Aspiration Biopsy – FNAB).
Diagnostika laboratorní, zobrazovací metody
Základním laboratorním vyšetřením je stanovení tyreostimulačního hormonu (TSH). Krev je možné odebírat kdykoliv v průběhu dne, TSH sice minimálně kolísá, je vyšší v noci, ale pro klinické potřeby jsou tyto změny nevýznamné. Hladina TSH je ale ovlivněna řadou okolností, nejen biochemickými postupy [3], ale vlivem fyziologických i patologických okolností: především stresem, syndromem nízkého T3 (viz dále), léky, v neposlední řadě „set point“ jedince, nicméně jasně patologické hodnoty jsou důsledkem onemocnění ŠŽ. Normy TSH jsou závislé na metodice a pro starší populaci by měla být horní hranice o něco vyšší (tab. 1). TSH je regulováno zpětnou vazbou a reaguje na změny periferních hormonů tyroxinu (T4) a triodotyroninu (T3). Reakce je pomalá – až po dosažení rovnováhy v organizmu, takže změny TSH zachytíme v průběhu více dnů až týdnů. Tyroxin (T4) i trijodotyronin (T3) cirkulují v krvi vázány na vazebné bílkoviny, které mají vliv na laboratorní výsledek. Výsledek je ovlivněn i některými léky, estrogeny (gravidita, hormonální antikoncepce a hormonální postmenopauzální léčba), proto vyšetřujeme raději jejich volnou frakci (fT4, fT3). fT4 i fT3 se zvýší bezprostředně po požití substituce, proto má být poslední substituční dávka užita 24 hod před odběrem. Pokud je užita ráno, může být hodnota falešně vyšší o 1–2 pmol/l. Hladinu T3 (fT3) vyšetřujeme pouze cíleně, do screeningového souboru nepatří a výsledek naopak někdy komplikuje interpretaci, např. u syndromu nízkého T3 u netyreoidálních onemocnění – viz dále. Nedílnou součástí je vyšetření protilátek TPOab (Thyroid Peroxidase Antibody – TPO, pozitivita provází tyreoidální autoimunitu – jejich titr může při atrofii ŠŽ ve stáří klesat až vymizet.
Table 1. Rozmezí laboratorních tyreodálních testů – pro běžnou populaci a návrh pro seniory. Upraveno podle [39] ![Rozmezí laboratorních tyreodálních testů
– pro běžnou populaci a návrh pro seniory.
Upraveno podle [39]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/abf29ac1a8c63bb0d3dc265e6716394f.png)
Ze zobrazovacích metod plně vyhovuje ultrasonografie (USG), zkušenému sonografistovi umožňuje popsat velikost ŠŽ, strukturu, echogenitu, nodozity a jejich charakter, kalcifikace, cysty, vztah k okolí, případné lymfatické uzliny. Retrosternální šíření tyreoidey hodnotit nelze. Dříve hojně využívaná scintigrafie má své místo především v onkologii tyreoidey a při pátrání po toxickém – independentním adenomu či charakteru polynodózní přestavby. Tenkojehlová aspirační biopsie je metodou cytologickou a stala se již běžně dostupným vyšetřením. S výhodou je využita jako léčebná metoda při odsávání obsahu objemnějších cyst, nyní umožňuje i likvidaci cyst či adenomu sklerotizací. Náročnější zobrazovací metody (MR, PET, PET-CT, speciální metody v onkologii) využíváme výjimečně, na druhé straně tyto metody často upozorňují na patologický proces v oblasti ŠŽ (PET) či horní hrudní apertury anebo horního mediastina.
Onemocnění
Struma může působit obtíže svojí velikostí, zvláště při retrosternálním růstu. Tkáň se v průběhu let může stát autonomní a být příčinou subklinické až plně rozvinuté hypertyreózy. Vždy je nutné tuto příčinu zvážit při kardiálních obtížích anebo při změnách skeletu ve smyslu osteoporózy, především fraktur obratů. Více v části subklinická hypertyreóza. Šetrnou léčbou je podání radiojodu, dopad je nejen na zklidnění subklinické hypertyreózy a psychiku, ale má i efekt zmenšovací [4]. Recentní práce informují o možnosti zmenšení či likvidace hyperfunkčních oblastí radiofrekvenční ablací [5].
Poruchy funkce
S rozvojem a zpřesněním laboratorních metod se vydělila skupina subklinických poruch. Diskuse o dopadu těchto nálezů na zdraví jedince trvají 30–40 let, sice bez jednoznačného závěru, ale s ohledem na stovky studií, přibývajících každoročně, je možné se k nějakému závěru přiklonit bez ambice na definitivní doporučení. Osoby se subklinickou hypotyreózou, zvláště starší ročníky, lze v určitých případech pouze sledovat, zatímco osoby se subklinickou hyperfunkcí mají spíše být léčeny. Řešení má být vždy individuální [6].
Hypotyreóza se zaměřením na seniory
Nejčastější příčinou periferní hypotyreózy v našich podmínkách je chronická lymfocytární tyreoiditida (CLT), známá též pod názvem Hashimotova tyreoiditida (HT), ta byla původně spojována se strumou [7]. CLT může být konečnou fází HT se strumou, která spontánně nebo při léčbě atrofovala, nebo je CLT již primárně provázena atrofií. Jde o typické orgánově specifické autoimunitní onemocnění. Další příčiny hypotyreózy po operaci, spontánní přechod Gravesovy-Basedowovy tyreotoxikózy (GB tx) do hypofunkce, po ozáření, kongenitální defekty tvoří skupinu méně početnou. Centrální hypotyreóza je vzácná. Rozvinutá hypotyreóza je provázena TSH > 10 mIU/l a současně poklesem T4 (fT4) pod normu. T3 (fT3) může být v normě nebo nižší (tab. 2). Příznaky hypotyreózy jsou většinou přítomny. Protilátky proti TPOab prokazujeme u asi 90 % osob s CLT, jejich přítomnost potvrzuje autoimunitní etiologii a může být i prognostickým ukazatelem rozvoje funkční poruchy, i upozorněním na onemocnění ŠŽ jako součásti polyendokrinopatie [8]. Studie kohorty 6 434 osob bez známého tyreoidálního onemocnění z Nizozemí prokázala TPOab pozitivitu u 8,6 % mužů a 18,5 % žen. Jejich přítomnost byla asociována s TSH mimo normu [9]. Eufuknční ženy s pozitivním titrem protilátek mají 8násobně vyšší riziko rozvoje hypotyreózy v průběhu 20 let než ženy bez protilátek [1,10]. Prohloubení subklinické hypotyreózy do plné nastane ročně asi u 4 % těchto osob. Hypotyreóza se vyvíjí pomalu a je typickým onemocněním, které může být zaměněno za projevy stáří.
Table 2. Přehled laboratorních nálezů a základní léčba poruch funkce ŠŽ 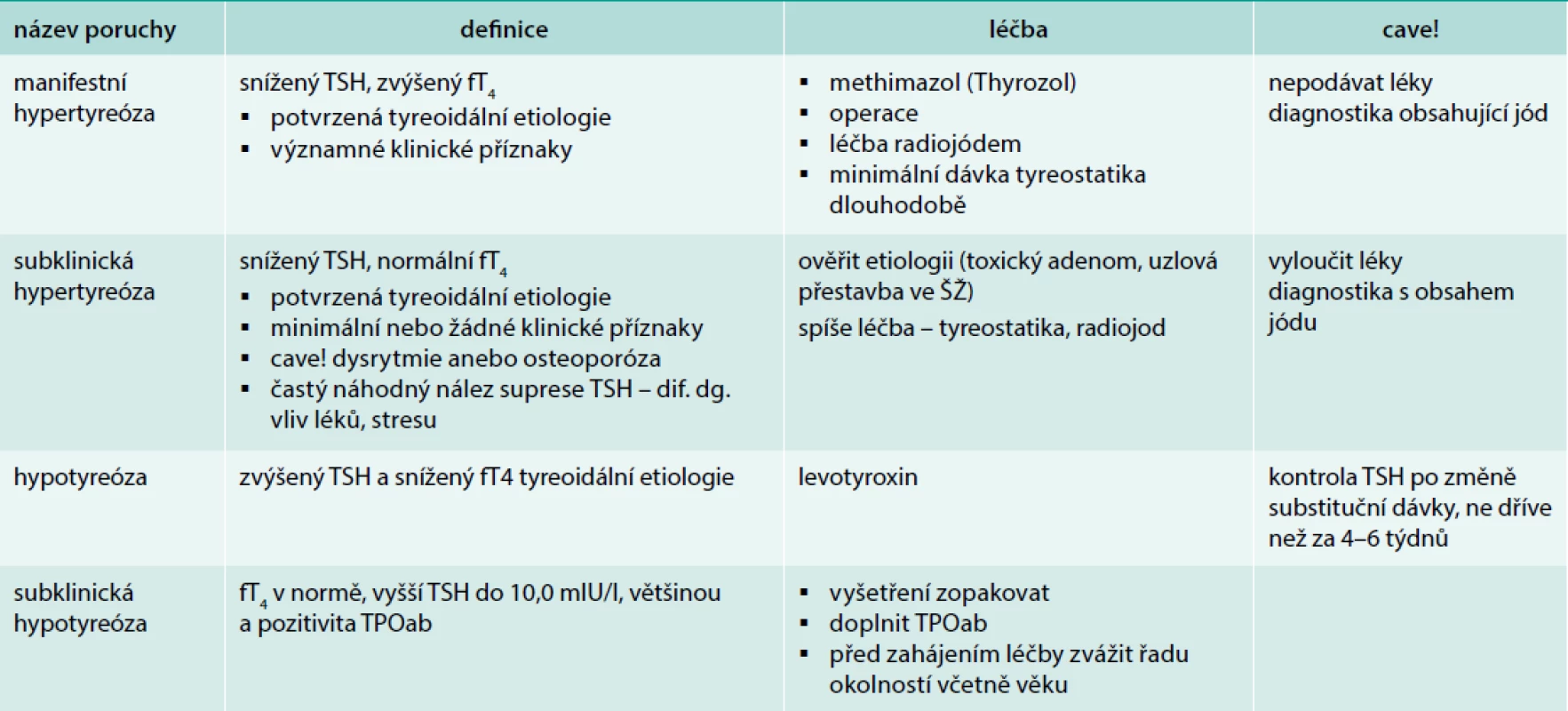
Většina příznaků je nespecifických: obstipace, zimomřivost, celková zpomalenost, zapomínání, nedostatek elánu, otoky rukou a nohou. Nápadnější jsou následující příznaky: ruce – suchá pokožka, připomínající kůži krokodýla, drsné – plechové předloktí (Charvátův příznak), hypomimie a otoky víček – připomínají ospalého eskymáka. Onemocnění je často skryté po léta, pacient si obtíže neuvědomuje. Diagnóza hypotyreózy sice vychází z klinických příznaků, ale jejich senzitivita je nízká (2,9–24,5 %), s nespecifickými příznaky se setkáváme i u eutyreoidních osob nejméně ve 20 %. Bývá horší kontrola hmotnosti – ne však obezita. Přes nespecifičnost příznaků při přítomnosti alespoň 4 z nich je hypotyreóza pravděpodobná: únava, zimomřivost, obstipace, zhoršení paměti, zpomalené psychické tempo, chrapot, sklon k depresím, svalová slabost, bolesti svalů, z kardiovaskulárních příznaků bradykardie, diastolická hypertenze, otoky periorbitální i bércové, retence tekutin. Některé příznaky však mohou být zakryty současnou např. antihypertenzní léčbou. Nepřítomnost zvětšené tyreoidey diagnózu nevylučuje. Obdobně máme posuzovat klinickou symptomatologii – jejich nepřítomnost diagnózu nevylučuje, existují i jedinci s hlubokou hypotyreózou a minimální symptomatologií, jiní přiznávají obtíže až při cíleném dotazu. Plně rozvinutá a déletrvající hypotyreóza je provázena negativními dopady na řadu orgánů a některé laboratorní nálezy jsou typické: na hypotyreózu bychom měli pomyslet při laboratorním nálezu hypercholesterolemie, hyponatremie, mírné hyperprolaktinemie, anémie, vyšším homocysteinu, zvýšení kreatinkinázy, změnami na EKG, zvláště při perikardiálním výpotku (tzv. myxedémové srdce). U těžké hypotyreózy je snížená renální clearence, je možná koagulopatie – získaný von Willebrandův syndrom typ I, snížení faktorů, V, VII VIII, IX a X. Pacienti s hypotyreózou jsou zvýšeně citliví k sedativům a analgetikům. U těžké hypotyreózy je nutné vyloučit současnou adrenální insuficienci v rámci možné polyendokrinopatie a před zahájením substituční léčby máme nabrat krev na vyšetření adrenokortikotropního hormonu (ACTH) a kortizolu. Potvrzení diagnózy je před zahájením léčby hypotyreózy naprosto nezbytné, výchozí hodnota TSH by měla být uvedena na parere. Jakmile je pacient léčen, jeho laboratorní nálezy (TSH, fT4) se normalizují, a při pochybnosti o správné indikaci k léčbě by bylo nutné léčbu přerušit na 5–6 týdnů. Sám pacient mnohdy důvod své léčby nezná, ale revize diagnózy je někdy potřebná. Se záměnou diagnózy při léčbě supresní (léčba strumy) za substituční se stále setkáváme. Je nutné také varovat před nadměrnou substitucí především u seniorů, optimální je dosažení TSH 3–4,0 mIU/l [8].
Subklinická hypotyreóza
Subklinická hypotyreóza (SH) – latentní, subklinická, chemická, kompenzovaná – je označením pro minimální snížení tyreoidální funkce, klinické obtíže nebývají zřejmé [11]. Diagnóza vychází z laboratorních nálezů a bývá často náhodná, proto by se vyšší hladina TSH měla ověřit ještě v odstupu několika týdnů. Pro subklinickou hypotyreózu svědčí pouze elevace TSH do hodnoty 10,0 mIU/l a hladina periferních tyreoidálních hormonů (T4 i T3) v normě. Příčinou je obvykle CLT, proto prokazujeme často protilátky TPOab (tab. 2). Subklinická hypotyreóza je častým nálezem u osob starších 65 let. Pitevní nálezy z let 1964 a 1996 v USA ukázaly, že 5–15 % žen a 1–5 % mužů má známky chronické tyreoiditidy, stavu, který v průběhu let často vyústí ve sníženou tyreoidální funkci. Ve studiích z USA a UK má SH 8–17 % osob starších 55–60 let, subklinická hypotyreóza je 7krát častější u žen než u mužů a 2krát častější u bílé než černé populace. Neléčená SH má možný dopad na kardiovaskulární aparát a na kognitivní poruchy, ale patrně jde o určité skupiny s ohledem na věk a pohlaví. Studie zaměřené na tuto problematiku se často v hodnocení následků liší [13]. V každém případě by pacient se subklinickou hypotyreózou měl být o svém nemocnění informován a měly by být probrány možnosti léčby či sledování. Vyšetření ŠŽ pomocí USG u subklinických stavů je přínosné při rozvaze o terapii, na druhé straně někteří varují před nadbytečnou diagnostikou a léčbou.
Léčba hypotyreózy
Léčba a dispenzarizace a je ve většině případů celoživotní, lékem volby je levotyroxin. Velmi obecně lze akceptovat doporučení denních dávek v rozmezí 1,4–2,2 μg/kg váhy, je závislost na schopnosti lék resorbovat (cave onemocnění žaludeční sliznice) a určitá závislost na hmotnosti. Při její významnější změně (asi 10 kg) je někdy nutné substituční dávku upravit. U starých polymorbidních nemocných při zahajování léčby podáme 0,5 μg T4/1 kg váhy a zvolna po 3–6 týdnech zvyšujeme do úpravy klinického stavu a normalizace TSH. Levotyroxin se výborně toleruje, ale výjimečně mohou mít pacienti pocit nesnášenlivosti, v tom případě je vyzkoušení výrobku jiné farmaceutické společnosti na místě, ale zásadně léky nemáme zaměňovat. U osob s deficitem laktázy je vhodné doporučit variantu tbl., u níž není použita laktóza jako stabilizační medium.
Praktické rady
Dodržení správné aplikace je nutné: tabletu je nutné užívat nalačno, nejlépe tedy ráno, vždy odděleně od ostatní medikace, zapít pouze čistou vodou, různé čaje, káva, minerálky resorpci léku snižují. Jídlo či další léky je možné požít za 20–30 min. Nedodržení tohoto postupu resorpci snižují a následně kolísá TSH. Zvláště starší pacienti mají někdy po ranním požití tablety pocit palpitací, pak je možné zkusit užít lék na noc, ale v odstupu nejméně 2 hod od posledního jídla. Běžně se však tento postup nedoporučuje. U dlouhodobě léčených jedinců je vhodné zásady správné aplikace léku opětovně připomínat. Při dosažení vyššího věku je obvykle nutné substituci snižovat, řídíme se hodnotami TSH. Některé léky ovlivňují resorpci, jiné interferují s další medikací, jiné působí dalšími mechanizmy, často se efekt kombinuje (tab. 3).
Table 3. Léky, které mohou ovlivnit účinek levotyroxinu nebo jeho resorpci, hladinu TSH, funkci ŠŽ. Seznam není vyčerpávající ani konečný, mechanizmy se někdy kombinují 
Indikace k substituční léčbě u osob se subklinickou hypotyreózou je stále předmětem diskuse, léčba má své odpůrce i příznivce [14], některé studie uvažují o tom, že substituovaní jednici mají lepší pocit well-being [13]. Dalším argumentem pro léčbu je porucha lipidového spektra, zvláště zvýšení hladiny triglyceridů [15], jiní posuzují kardiovaskulární postižení [16]. Dlouhodobější studie navíc dokládají, že jedinci s hraničně vyšším TSH či se supresí TSH mají vyšší mortalitu [17]. Odlišný postup je doporučen pro osoby starší 85 let. K rozhodnutí musí lékař přistupovat individuálně, se znalostí schopnosti spolupráce pacienta, zvážením přínosu a na druhé straně rizik léčby ve vztahu k řadě zdravotních, a někdy i sociálních okolností u osamělých seniorů (tab. 4). Nebezpečím u starších a starých osob je možnost předávkování, ze kterého plynou rovněž rizika, především dysrytmie a negativní dopad na skelet (osteopenie – osteoporóza), ale i poddávkování. Starší studie z USA mj. upozornila, že pouze 67 % léčených s poruchou funkce mělo TSH v normě [18]. Substituce je určitě doporučena u osob se strumou na podkladě CLT – o vyšším riziku vzniku rozvoje karcinomu v terénu CLT se diskuse vedou sice bez jasného závěru, ale požadavek normálního TSH je v těchto případech nutné respektovat. Zajímavé výsledky přinesla recentní tuzemská studie [19]. Léčba je určitě indikována u osob se strumou na podkladě CLT, po resekci štítné žlázy (riziko růstu zbytků žlázy i riziko vzniku karcinomu), v terénu předchozího záření (tab. 5). Při obtížích, které mohou předstírat hypotyreózu, je možné léčbu zkusit a po 6 měsících vyhodnotit efekt. Není-li patrný efekt nebo předpokládáme efekt placebový, je možné léčbu ukončit. Pokud je léčba zahájena, jsou nutné z počátku častější kontroly stavu (po 3–6 měsících). Subklinickou hypotyreózu léčíme především u mladších pacientů (< 65 let), u starších osob po zvážení řady okolností. Pokud neléčíme, je nutné sledování stavu a TSH po 6–12 měsících (viz výše).
Table 4. Možné negativní dopady subklinické hypotyreózy 
Table 5. Indikace k léčbě osob se subklinickou hypotyreózou – po opakovaném potvrzení elevace TSH 
Myxedémové kóma
V současné době jde o vzácný stav, nejčastěji je důsledkem dlouhodobějšího ukončení substituce nejspíše pacientem. Léčba kómatu musí probíhat na jednotce intenzivní péče, tbl. T4 se podávají p.o. sondou, předem rozdrcené a rozpuštěné v mírně okyseleném prostředí. Přidání menší dávky T3 (Cynomel) je při zahájení léčby doporučeno, protože obvykle v játrech chybí aktivita dejodázy D2 nutná k přeměně T4 na T3. Celková komplexní péče při tomto metabolickém rozvratu je nezbytná, perspektiva záchrany je nejistá.
Zvláštní situace
Hypotyreóza a ICHS
U osoby s ICHS a prokázanou hypotyreózou i u osob po AIM je léčba nutná, protože nedostatek tyroxinu snižuje činnost myokardu, a tím je zhoršená jeho systolická i diastolická funkce [19]. Dlouhodobá suboptimální léčba může akcelerovat či zhoršovat koronární aterosklerózu. Zahajujeme nízkými dávkami 12,5–25–50 μg T4 denně a zvyšujeme pozvolna po 3–6 týdnech. Kombinace s betablokátory na začátku léčby může být přínosná.
Osoby starší 85 let se subklinickou hypotyreózou
Observační studie z roku 2004 i další [20,21,42] dokládají, že osoby velmi staré (nad 80–85 let) se subklinickou hypotyreózou mohou být ponechány bez substituce, ale musejí být sledovány včetně TSH. Léčba má být zahájena při prohloubení do plné hypotyreózy.
Hypertyreóza
Rozvinutá hypertyreóza je provázena TSH < 0,1 IU/l (0,45) a současně zvýšením T4 (fT4) nad normu. T3 (fT3) je rovněž zvýšené (tab. 2). U starší populace se projevuje nejčastěji klasickými příznaky, tj. kardiálními: dysrytmiemi anebo dušností a pocením. Hypertenze a tachykardie bývají někdy překryty terapií. Další příznaky – svalová slabost – např. typická šplhavá chůze do schodů s pomocí rukou, nemožnost se postavit ze sedu v důsledku slabosti kvadricepsů (taburetový příznak), častý úbytek hmotnosti či třes mohou být připisovány projevům stáří, zatímco intolerance tepla, agitovanost či průjmy pacienta obtěžují a oni na tyto obtíže upozorňují [22].
Mohou se objevit i psychické změny – vnitřní tenze a deprese – příznaky, u seniorů nikoliv vzácné i z jiné příčiny. Struma může a nemusí být. Příčinou hyperfunkce je nejčastěji autoimunitní – GB choroba, asi u 60 % provázená endokrinní oftalmopatií (EO). Vzácně existují i formy EO bez současné hyperfunkce. GB choroba sice postihuje nejčastěji osoby mezi 30.–50. rokem života, nicméně ji diagnostikujeme ve všech věkových skupinách. U dětí a u osob nad 85 let je vzácná, ne však vyloučená. Jedinci se mohou léčit i na jiná autoimunitní onemocnění – diabetes mellitus 1. typu, na celiakii, perniciózní anémii, vitiligo nebo na další autoimunitní choroby. Další příčinou je toxický adenom nebo polynodózní struma – tuto diagnózu stanovujeme spíše u seniorů. Pro hypertyreózu svědčí suprese TSH a elevace fT4, pro autoimunitní etiologii vyšší protilátky proti TSH receptoru (TRAK) a protilátky TPOab, na rozdíl od etiologie autonomní při toxickém adenomu nebo polynodózní strumě, u kterých protilátky neprokazujeme. U GB tyreotoxikózy je na USG obraz imunogenního postižení, tj. snížená echogenita a zvýšená perfuze, při dlouhodobém podávání tyreostatik nastávají ve žláze změny – tvorba uzlů a ne vzácně rozvoj karcinomu. Z nespecifických nálezů může být mírná elevace jaterních enzymů, nižší cholesterol. Léčba je u jasné tyreotoxikózy bez ohledu na etiologii (vyjma tyreotoxikózu z destrukce folikulů) jednoznačná. Lékem volby je Thyrozol (methimazol), tbl. po 10 mg. Plná dávka činí 30 mg denně, postupně se snižuje po 4–6 týdnech a po dosažení remise je udržovací dávka 2,5–5 mg. Tachykardie a hypertenze dobře reagují na betablokátory, anxiolytiky zpočátku nešetříme, vhodná jsou i hypnotika při psychických obtížích. Vyšetření hemogramu a jaterních enzymů před zahájením léčby umožní sledování v průběhu léčby. Vedlejší účinky se objevují při zahajování léčby spíše asi do 3–4 měsíců a jsou do určité míry závislé na dávce. Leukopenie, agranulocytóza či elevace jaterních testů jsou vzácné. Nejasné teploty, nejasná angina či ikterus vyžadují okamžité vyšetření a úvahu o spojení s podáváním tyreostatika. Méně závažné je svědění pokožky a artralgie. Změna na Propycil je v případě intolerance možná, ale existuje riziko vedlejších dopadů, především hepatotoxicity. Dlouhodobá léčba minimální dávkou je dobře tolerována a u seniorů, kteří odmítají operaci či léčbu radiojodem, je možné ji akceptovat za předpokladu pravidelných kontrol. Při předávkování je nebezpečí růstu žlázy. Endokrinní oftalmopatie může být u seniorů torpidní až invalidizující, vyžaduje spolupráci oftalmologa a endokrinologa, indikovány jsou kortikoidy v nárazech v infuzích, ve stadiu zkoušení je biologická léčba [23]. Definitivním řešením tyreotoxikózy je operace nebo léčba radiojodem. Operace má v českých zemích letitou tradici, z komplikací lze vyjmenovat parézu zvratného nervu a hypoparatyreózu, na výsledek operace má nepochybně vliv zkušenost operatéra i operační terén. U velmi objemné strumy (hlavně dříve), při peristrumitidě či pokročilém karcinomu bude riziko komplikací větší. Elegantním řešením je léčba radiojodem, dnes lze podat ambulantně, rizika léčby prakticky nejsou, riziko vzniku následného karcinomu v organizmu je početnými studiemi vyloučeno. S opatrností se rozhodujeme u osob s EO, riziko komplikací je minimalizováno podáváním kortikoidů. Jak po operaci (ihned), tak většinou po radiojodu (do 3–6 měsíců) se vyvíjí hypotyreóza, včasný záchyt a léčba jsou samozřejmostí obdobně jako důsledná dispenzarizace, která umožní kontrolovat substituční léčbu.
Subklinická tyreotoxikóza je definována laboratorním nálezem, tj. supresí TSH, hladina fT4 je v normálním pásmu, TRAK může být negativní nebo hraniční, pacienti by měli být asymptomatičtí. Suprese je odhalena při cíleném vyšetření při pátrání po příčině osteoporózy a jejích následcích (komprese obratlů), dysrytmiích, do té doby považovaných za důsledek ICHS. Po vyloučení netyreoidálních příčin suprese TSH doplníme USG vyšetření. To obvykle odhalí uzlovou přestavbu, následná scintigrafie přítomnost independentního adenomu nebo uzlovou přestavbu s oblastmi zvýšené aktivity. Zjištění těchto změn ve ŠŽ je podporou při rozhodování o léčbě, zvláště při fibrilaci či jiném typu dysrytmie nebo při průkazu zvýšeného kostního obratu [24]. Subklinická hypertyreóza by měla být léčena především u starších osob [25,26], podáváme tyreostatika v dávce, která normalizuje TSH, ev. volíme radiojod a pak léčíme vzniklou hypotyreózu.
Souhrnně a stručně indikace k léčbě funkčních poruch ŠŽ v tab. 5.
Karcinom štítné žlázy
Karcinom štítné žlázy tvoří asi 1–2 % ze všech nádorů, postihuje více ženy než muže a je nejčastějším endokrinním nádorem [27]. V ČR bylo v roce 2015 diagnostikováno 1 143 karcinomů ŠŽ [28]. S rozvojem diagnostických postupů, tj. USG a FNAB, je zachycován stále u většího počtu asymptomatických osob, např. časté vyšetření karotid náhodně zachytí i několikamilimetrové uzly ve štítné žláze. Na rozvoj karcinomu v terénu CLT může mít vliv i hraničně vyšší TSH [19]. Problematice nadbytečné diagnostiky (overdiagnosis) a následné nadbytečné léčby (overtreatment) je již věnována četná literatura. Vzhledem k charakteru papilárního karcinomu se dnes hovoří o možnosti rezervovaného postupu, tj. u vybraných jedinců pouze sledování [29]. Studie týkající se výhod genetického vyšetření ze vzorku, získaného z FNAB, dokazují částečný přínos při hodnocení biologické povahy tumoru. Jde ale o nákladnější postup, zatím se rozvíjející, v běžné klinické medicíně není zaveden, ale studie probíhají [30]. Karcinom ŠŽ je diagnostikován nejčastěji mezi 35.–65. rokem, ale postihuje osoby jak v dětském věku, tak v seniu; častější je u žen.
Na karcinom ŠŽ pomyslíme při růstu či změně existujícího uzlu, nálezu zvětšených uzlin v nadklíčku, nejasných metastázách v plicích. Při rychlém růstu tumoru v diferenciální diagnóze zvažujeme lymfom – a to u osob s CLT, zvláště pak u těch s vyšším TSH. Další spíše výjimečnou příčinou tumoru ve ŠŽ u onkologických nemocných může být metastáza karcinomu prsu, plic, ledvin. Na USG je podezřelý každý neohraničený uzel, endokrinologické vyšetření s doplněním FNAB je nezbytné. Pokud je jasná indikace k operaci, není rozhodující věk, ale biologický stav pacienta. U diferencovaného karcinomu ŠŽ obvykle následuje léčba radiojodem, ve většině případů pak následuje suprese, která se překvapivě dobře toleruje i v seniu. Dle současných názorů supresní léčba u nerizikových osob postačí maximálně 5 let. Dlouhodobá suprese je rizikem pro rozvoj osteoporózy [24].
Využíváním USG se daří zachytit malé karcinomy – mikrokarcinomy. Pokud je velikost tumoru do 1,5 (2 cm), dle doporučení postačí odstranění postiženého laloku ŠŽ. U mikrokarcinomů u nerizikových osob přistupují v některých zemích pouze ke sledování, vycházejí jednak z příznivé prognózy papilárního karcinomu a jednak z výrazného zvýšení počtu operací ŠŽ [31]. K tomuto postupu se zatím Česká endokrinologická společnost České lékařské společnosti J. E. Purkyně nevyslovila. Vždy je nutné na specializovaném pracovišti komplexní posouzení charakteru nádoru a rizika recidivy.
Zvláštní situace
Syndrom nízkého T3 (Non Thyroid Illnes – NTI). Tento syndrom je adaptací na onemocnění organizmu, a to bud při energetické karenci, nebo při akutních stavech. Syndromu NTI je věnována řada studií a je zajímavou ukázkou autoregulačních mechanizmů, které promptně reagují na chorobu jedince ve snaze organizmus ochránit před metabolickými nároky. V katabolickém stavu je dejodace usměrněna tak, aby byl organizmus chráněn před metabolickými nároky, a tedy produkce T3 klesá, často hluboce pod normální hranici, a zvyšuje se reverzní T3, který je metabolicky neúčinný. Vzhledem k tomu, že metabolicky účinným hormonem je T3 vznikající převážně dejodací z T4, je pro trpící organizmus výhodné produkci T3 omezit, zapojí se tedy jiná dejodáza. Aktivita dejodáz je ovlivněna fyziologickými i patologickými okolnostmi (glykemie, pH krve, katabolické stavy, cytokiny, hormony a řada dalších okolností). Běžně se s tímto syndromem setkáváme u mentální anorexie, provází nemocné přijímané pro akutní stav do nemocnice (infarkt myokardu, šokové a septické stavy, po transplantacích apod) [32]. Stav je definován sníženou hladinou T3, hodnoty TSH a fT4 mohou být v normě, TSH může být suprimované a fT4 je v normě nebo na dolní hranici. Po vyléčení či realimentaci se nálezy normalizují. Syndrom nízkého T3 v naprosté většině případů není indikován k léčbě.
Vliv léků na činnost štítné žlázy a na laboratorní nálezy
Hladina TSH může být mírně ovlivněna akutním či kritickým stavem, rekonvalescencí. Proto je vhodné hraniční nálezy zopakovat především po rekonvalescenci. Dále je hodnota TSH ovlivněna některými léky, které mohou působit centrálně přímo na TRH-TSH systém, jiné snižují resorpci levotyroxinu, další mohou působit na ŠŽ toxicky, při nadbytku jodu, imunomodulačně, a některé kombinací uvedených i dalších vlivů [33]. Výsledek laboratorního testu může též ovlivnit interference látek v séru, nebo při laboratorním zpracování [3]. Podrobnosti jsou uvedeny v tab. 3, zde zmiňujeme nejčastější běžně užívané léky. Resorpci levotyroxinu v GIT snižují: železo, vápník (uhličitan vápenatý), sloučeniny hliníku, selen, hořčík, zinek, iontoměniče – cholestyramin, vláknina, antagonisté H2-receptorů, antacida, ve větším množství sója. Nejasným mechanizmem mohou působit ve vysokých dávkách statiny. Působení warfarinu může být ovlivněno podáváním T4.
Speciální a významnou problematikou, ve které se setkávají internisté, kardiologové a endokrinologové, jsou tyreoidální dysfunkce při léčbě amiodaronem. Amiodaron je podáván s dobrým kardiálním efektem více než 50 let a asi u 10 % takto léčených je nutné počítat s vlivem na štítnou žlázu, ať již s rozvojem hyperfunkce, nebo hypofunkce. Porucha se častěji vyvine u osob s prodělanou tyreotoxikózou GB typu, s preexistující CLT, či jen s pozitivním titrem protilátek nebo u osob s uzlovou strumou, do té doby eufunkční. Vzniklá hypotyreóza se léčí dle zvyklostí, bývá spíše lehčího charakteru a podávání amiodaronu není nutné ukončovat. Pokud jeho podávání ukončíme, je někdy možné ukončit i léčbu hypotyreózy. Rozvoj tyreotoxikózy může být závažnou komplikací, pro další postup je nutné rozlišit 1. a 2. typ. Typ první je vyvolán nadbytkem jodu v již dříve změněné ŠŽ (uzlově změněné nebo u osob po GB toxikóze), druhý typ je vyvolán destrukcí dříve zdravé ŠŽ. Diferenciální diagnóza není vždy snadná, opírá se o anamnézu, přítomnost protilátek a o obraz na USG. Někdy jde o smíšení typu 1. a 2. Dříve bylo imperativem ukončit léčbu amiodaronem. Podle recentního doporučení [33] je u prvního typu možné léčbu amiodaronem ponechat či pozvolna ukončit, současně doplnit o podávání metimazolu, případně perchlorátu, ale odpověď na terapii bývá opožděná. Definitivním řešením je – pokud to stav umožní – totální tyreoidektomie nebo léčba radiojodem. Ta je šetrná, je však možná až po ukončení léčby amiodaronem, který má poločas kolem 50 dní, tedy zhruba za 3 měsíce. Druhý typ se léčí glukokortikoidy, reaguje na terapii poměrně rychle (1–2 týdny), častěji přechází do trvalé remise nebo do hypotyreózy, a amiodaron (pokud není jasná kardiologická indikace) lze vysadit už po několika týdnech. U složitých případů má léčbu vést zkušený endokrinolog vždy ve spolupráci s kardiologem.
Cytokiny, využívané v imunomodulační léčbě především u některých typů hepatitid, hematologických onemocnění a u některých onkologických nemocných, vyvolávají hypotyreózu především u osob s CLT. Většinou jde o osoby s pozitivním titrem protilátek TPOab. Vzniklou poruchu funkce – častěji hypotyreózu – léčíme standardním postupem, po ukončení podávání cytokinů je vhodná revize stavu, často je možné tyreoidální substituci ukončit, protože hypotyreóza může být lehčí a reverzibilní. Při rozvoji hyperfunkce opět léčíme standardním postupem. Jde-li o diagnózu CLT, má být pacient dlouhodobě kontrolován i po zklidnění tyreoidální odchylky, i po ukončení podávání cytokinů. Některé studie dokládají, že nemocní s tyreoidální reakcí mívají lepší prognózu základního onemocnění, vysvětlením by mohla být příznivá aktivace imunitního systému.
Do imunologického profilu pacienta výrazně zasahuje biologická léčba. Tato léčba se stala slibným postupem při léčbě rakoviny a u některých vybraných především autoimunitních chorob. Je indikována častěji u seniorů, proto je nutné věnovat pozornost jejím negativním dopadům. Léky cíleně blokují určitá místa imunologických procesů. Ovlivněním cytotoxického T lymfocytárního antigenu 4 (CTLA4), programované buněčné smrti 1 (programmed cell death 1 – PD1) nebo jeho ligandu (PD-L1) zvyšují imunitu proti tumoru. Počet těchto léků se nadále zvyšuje a některé se vedlejšími dopady liší. Negativním dopadem je vznik nebo rozvoj některých onemocnění endokrinních žláz, nejčastěji ŠŽ, ale i hypofýzy a nadledvin, postiženy mohou být i další orgány [35]. Role cytokinů může být při podávání těchto léků přídatná. Jde především o léky: ipilimumab, působící na CTLA4 a vyvolávající hypofyzitidu, nivolumab a pembrolizumab ovlivňující PD1 a vyvolávající tyreoiditidu, atezolizumab, avelumab, durvalumab – ovlivňují PD-L1. Tyreoiditida vznikne častěji u osob, u kterých byly již před léčbou prokázány protilátky proti ŠŽ. Spíše vzniká hypotyreóza, té však může předcházet období hyperfunkce, vznikající rozpadem tyreocytů. Onkologickou terapii není nutné přerušit, hyperfunkční fáze se léčí betabokátorem a spontánně odezní a většinou přejde do hypotyreózy. Ta se léčí jako běžná hypotyreóza, která přetrvává i po ukončení biologické léčby, ojediněle může být reverzibilní. Vznik hyperfunkce typu GB je patrně vzácný. Postižení hypofýzy a nadledvin je sice vzácné, ale je zapotřebí na ně také pomýšlet a funkce všech endokrinních orgánů sledovat. Biologická léčba se zkouší i u karcinomů ŠŽ [36].
Jaké jsou normy tyreoidálních testů pro seniory?
Úvaha o tom, jaké je pro starší populaci normální rozmezí hladin TSH a fT4 a jsou-li dopady na morbiditu či mortalitu populace při hraničních nálezech, se opakovaně vracejí. Závěry krátkodobých a dlouhodobých studií se mohou lišit. Z početných studií, založených na dlouhodobých studiích, vycházejí zajímavé úvahy. Na vztah laboratorních nálezů TSH a mortality se soustředili Inoue et al [37]. Prospektivní robustní soubor dospělých eufunkčních osob s normálním TSH starších ≥ 20 let a zahrnující 12 584 sledovali v letech 1988–1994. Osoby byly dle hodnot TSH rozděleny do 3 kvartil (hraničně vyšší – vysoké, střední a hraničně nižší). Studie pokračovala ještě v letech 2001–2002, 2007–2008, a 2009–2010, v té době byla doplněna o vyšetření fT4. Osoby byly rozděleny dle pohlaví a věku < 60 let a starší ≥ 60 let. Byly zkoumány všechny příčiny úmrtí (n = 3 395) a zvláště vydělili úmrtí v důsledku kardiovaskulárního onemocnění a malignity. Medián sledování byl 19,1 let. U skupiny s hraničně vyšším TSH ve srovnání se střední normální hodnotou bylo signifikantně vyšší riziko všech příčin úmrtí HR 1,27; u kardiovaskulárního úmrtí bylo HR 1,30 a u úmrtí na karcinom HR 1,43. Uzavírají, že hraničně vyšší TSH ve srovnání se středním normálním kvartilem TSH byl při dlouhodobém sledování asociován se zvýšeným rizikem úmrtí ze všech příčin (malignity, kardiovaskulární choroby). Upozorňují ale, že by normy TSH a fT4 měly být reevaluovány. Obdobné závěry přinesla observační studie 17 440 osob s průměrným věkem 83 let zahrnující osoby se subklinickou hypotyreózou, subklinickou hypertyreózou a kontrolní kohortu, sledovaných po 10 let. Závěry jsou podobné – jak subklinická hypotyreóza, tak subklinická hypertyreóza jsou asociovány se signifikantně vyšší mortalitou (subklinická hypotyreóza HR 1,75, subklinická hypertyreóza 2,33) [15]. Další studie s menším počtem probandů (493) se soustředila na osoby starší 80 let s normálním, ale opět hraničním laboratorním nálezem: autoři dokládají, že hraničně vyšší fT4 (18,5–22 pmol/l) bylo asociováno s vyšší mortalitou ve srovnání s nižší hladinou (11,5–15,0) – HR 1,7. Vztah mezi mortalitou a ŠŽ se patrně liší dle věku [38]. Razvi et al [37] navázali a reanalyzovali Wickhamskou studii, hodnotili vývoj osob s TSH 6–15 mIU: mortalita osob na ICHS byla vyšší u osob se subklinickou hypotyreózou než u osob kontrolních (HR 1,76). Léčba subklinické hypotyreózy zmírnila morbiditu i mortalitu. Doporučují, aby se „normální“ TSH pohybovalo spíše v rozmezí TSH 1,0–2,0 mIU/l oproti TSH 3,0–4,0 mIU/l. Dále upozorňují, že vztah mezi funkcí ŠŽ a mortalitou se patrně liší dle věku.
Jaké jsou tedy optimální hodnoty TSH pro starší populaci?
Ke konkrétním hodnotám s ohledem na věk se vyjádřila nedávná studie. Vyšetřením zdravých starších téměř 4 000 osob (z toho zcela zdravých 411) stanovili normu TSH 0,64–5,9 mIU/l a fT4 12,1–20,6 pmol/l. Doporučují pro starší populaci tyto revidované normy respektovat. Tím se zachytí více subklinických hyperfunkcí a méně subklinických hypotyreóz. Zatímco hraničně vyšší TSH nebylo asociováno s mortalitou, hraničně vyšší fT4 ano [38]. V souladu s touto publikací vyznívají i data zpracovaná autory Chaekr et al [39]. Dokládají, že hladina fT4 > 90. percentil byla asociována s rizikem úmrtí na kardiovaskulární příčiny do 10 let > 7,5 % (P = 0,005), osoby s fT4 hladinou > 97. percentil měly toto riziko dokonce 10,8 % (P < 0,001). Shodně s předchozími autory doporučují, aby rozpětí norem bylo definováno s ohledem a věk a pohlaví, a navíc k riziku chorob (tab. 1).
Závěr
Uvedené studie jsou do určité míry v rozporu se všeobecně přijímaným postupem, že subklinické hypotyreózy, jsou-li skutečně asymptomatické, je možné pouze sledovat. Zjištění, že výsledky dlouhodobých studií svědčí pro vyšší morbiditu i mortalitu osob se subklinickou hypotyreózou oproti kontrolnímu souboru a že zahájení substituce zlepší prognózu, je nutné brát v úvahu. Ve studiu celé složité otázky je nutné pokračovat, jednoznačně uplatnit individuální přístup k terapii. Existuje shoda, že by se normy TSH pro starší populaci měly změnit – horní do oblasti 5,9 MIU/1, dolní 0,64 mIU/l. Zachytilo by se méně subklinických hypotyreóz, ale více subklinických hypertyreóz. Ze závěrů řady publikací lze uzavřít, že subklinická hypertyreóza by měla být častěji léčena i u starších osob. Subklinickou hypotyreózu máme léčit především u mladších pacientů (< 65 let), zatímco u starších osob po zvážení řady okolností často stačí jen sledování. Nicméně indikace k léčbě určitých stavů jsou jasně dané (tab. 5). Senioři starší 85 tvoří zcela zvláštní skupinu, u nich je subklinická hypotyreóza asi spojena s nižší mortalitou [19] a nemáme se do substituce nutit. Byl nastolen návrh, aby se s každým desetiletím horní hranice TSH zvýšila o 0,1 mIU/l, a další [40], aby pro osoby nad 65 let byla norma pro TSH 0,64–5,9 mIU/l. Současně je doporučováno, aby byla přísnější kontrola horní hranice fT4 (absolutní číslo je dáno ovšem s ohledem na použitou metodiku). Stanovení normálního rozpětí laboratorních ukazatelů s ohledem na věk i morbiditu je výzvou pro odborníky.
doc. MUDr. Zdeňka Límanová, CSc.
liman@vfn.cz; jan.liman@volny.cz
III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Doručeno do redakce 30. 5. 2018
Přijato po recenzi 14. 9. 2018
Sources
- Vanderpump MPJ, Tunbridge WMG, French JM et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol 1995; 43(1): 55–68.
- Peeters RP. Subclinical hypothyroidism. N Engl J Med 2017; 377(14): 1404. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1709853>.
- Kumar S, Hermsen D, Distelmaier F. Biotin treatment mimicking Graves´disease. N Engl J Med 2016; 375(7): 704–765. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1602096>.
- Kaniuka-Jakubowska S, Lewczuk A, Majkowicz M et al. Nontoxic Goiter (NTG) and Radioiodine: What Do Patients Think About It? Quality of Life in Patients with NTG Before and After 131-I Therapy. Front Endocrinol (Lausanne) 2018; 9 : 114. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2018.00114>.
- Dobning H, Amrein K. Monopolar radiofrequency ablation of thyroid nobles. A prospective Austrian single-center study. Thyroid 2018; 28(4): 472–480. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2017.0547>.
- Toplis DJ, Eastman CJ. 5. Diagnosis and management of hyperthyroidism and hypothyroidism. Med J Aust 2004; 180(4): 186–193.
- Laurberg P, Andersen S, Bülow Pedersen I et al. Hypothyroidism in the elderly: pathophysiology, diagnosis and treatment. Drugs Aging 2005; 22(1): 23–38. Dostupné z DOI: <http://dx.doi.org/10.2165/00002512–200522010–00002>.
- Husebye ES, Anderson MS, Kampe O. Autoimmune polyendocrine syndromes. N Engl J Med 2018; 378(12): 1132–1141. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1713301>.
- Hoogendoorn EH, Hermus AR, de Vegt F et al. Thyroid function and prevalence of anti-thyroperoxidase antibodies in a population with borderline sufficient iodine intake: influences of age and sex. Clin Chem 2006; 52(1): 104–111. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2005.055194>.
- Tunbridge WM, Evered DC, Hall R et al. The spectrum of thyroid disease in a community: the Whickham survey. Clin Endocrinol (Oxf) 1977; 7(6): 481–493.
- Peeters RP. Subclinical hypothyroidism. N Engl J Med 2017; 376(26): 2556–2565. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMcp1611144>.
- Somwaru LL, Rariy CM, Arnold AM et al. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012; 97(6): 1962–1969. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–3047>.
- Parle J, Roberts L, Wilson S et al. A randomized controlled trial of the effect of thyroxine replacement on cognitive function in community-living elderly subjects with subclinical hypothyroidism: the Birmingham Elderly Thyroid study. J Clin Endocrinol Metab 2010; 95(8): 3623–3631. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2009–2571>.
- Stott DJ, Rodondi N, Kearney PM et al. Thyroid hormone therapy for older adults with subclinical hypothyroidism. N Engl J Med 2017; 376(26): 2534–2544. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1603825>.
- Zhao M, Tang X, Yang T et al. Lipotoxicity, a potential risk factor for the increasing prevalence of subclinical hypotyhroidism? J Clin Endocrinol Metab 2015; 100(5): 1887–1894. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–3987>.
- Hyland KA, Arnold AM, Lee JS et al. Persistent subclinical hypothyroidism and cardiovascular risk in elderly. Cardiovascular health study. J Clin Endocrinol Metab 2013; 98(2): 533–540. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–2180>.
- Grossman A, Weiss A, Koren-Morag N et al. Subclinical thyroid disease and mortality in the elderly: a retrospective cohort study. Examination Survey. Am J Med 2016; 129(4): 423–430. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2015.11.027>.
- Holowell JG, Staehling NW, Flanders WD et al. Serum TSH.T(4) and thyroid antibodies in the United States population 1988–1994 (NHANES III). J Clin Endocrinol Metab 2002; 87(2): 489–499. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.87.2.8182>.
- Krátký J, Ježková J, Vítková H et al: Positive anti-thyroid antibodies and non-sppressed TSH are associated with thyroid cancer: A retrospective cross-sectional study. Int J Endocrinol 2018; online. <http://dx.doi.org/10.1155/2018/9793850>.
- Jiskra J. Hypotyreóza u pacientů se srdečním onemocněním. Vnitř Lék 2017; 63(9): 566–571.
- Singer RB. Mortality in a complete 4 year follow up of 85 year old residents of Leiden, classified by serum level of thyrotropin and thyroxine J Insur med 2006; 38(1): 14–19.
- Kahaly GJ, Bartalena L, Hegedus L. The American Thyroid Association/American Association of Clinical Endocrinologists guidelines for hyperthyroidism and other causes of thyrotoxicosis: a European perspective. Thyroid 2011; 21(6): 585–591. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2011.2106.ed3>.
- Smith T, Hegedus L. Graves‘ disease. NEJM 2016; 375(16): 1552–1565. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1510030>.
- Lee SJ, Kim KM, Lee E et al. Low Normal TSH levels are Associated with Impaired BMD and Hip Geometry in the Elderly. Aging Dis 2016; 7(6): Dostupné z DOI: <http://dx.doi.org/734–743.10.14336/AD.2016.0325>.
- Biondi B, Bartalena L, Cooper DS et al. The 2015 European Thyroid Association guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism. Eur Thyroid J 2015; 4(3): 149–163. Dostupné z DOI: <http://dx.doi.org/10.1159/000438750>.
- Donangelo I, Young S. Subclinical hyperthyroidism: when to consider treatment. Am Fam Physician 2017; 95(11): 710–716.
- Parker WA, Edafe O, Balasubramanian SP. Long term treatment related morbidity in differentiated thyroid cancer: a systematic review of the literature. Pragmat Obs Res 2017; 8 : 57–67. Dostupné z DOI: <http://dx.doi.org/.2147/POR.S130510>.
- Vlček P, Nováková D, Katra R. Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu. Vnitř Lék 2017; 63(9): 572–579.
- Ahn HS, Kim HJ, Welch HG. Korea´s thyroid cancer „epidemic“ – screening and overdiagnosis. N Engl J Med 2014; 371(19): 1765–1767. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMp1409841>.
- Ito Y, Miyauchi A. Prognostic factors and therapeutic strategies for differentiated carcinomas of the thyroid. Prognostic factors and therapeutic strategies for differentiated carcinomas of the thyroid. Endocr J 2009; 56(2): 177–192.
- Ito Y, Miyauchi A, Kudo T et al. Trends in the implementation of active surveillance for low risk papillary thyroid microcarcinomasat Kuma hospital: gradual increase and heterogenity in the acceptance of this new management option. Thyroid 2018; 28(4): 488–495. Dostupné z DOI: <http://doi: 10.1089/thy.2017.0448>.
- Wang L, Liu S, Li L, at al. Non-thyroidal illness syndrome in patients with cardiovascular diseases: A systematic review and meta-analysis. Int J Cardiol 2017; 226 : 1–10. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2016.10.039>.
- Tajtáková M. Lieky a štítná žlaza. Vnitř Lék 2012; 58(2): 140–144.
- Bartalena L, Bogazzi F, Chiovato L et al. 2018 European Thyroid Association (ETA) Guidelines for the management of amiodarone-associated thyroid dysfunction. Eur Thyroid J 2018; 7(2): 55–66. Dostupné z DOI: <http://dx.doi.org/10.1159/000486957>.
- Postow MA, Sidlow R, Hellman MD. Immune related adverse events associated with immune checkpoint blocade. N Engl J Med 2018; 378(2): 158–168. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1703481>.
- Latteyer S, Tiedje V, Schilling B et al. Perspective immunotherapy in endocrine cancers. Endocr Relat Cancer 2016; 23(10): 469–484. <http://dx.doi.org/10.1530/ERC-16–0169>.
- Inoue K, Tsujimoto T, Saito J et al. Association Between Serum Thyrotropin Levels and Mortality Among Euthyroid Adults in the United States. Thyroid 2016; 26(10): 1457–1465. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2016.0156>.
- van de Ven AC, Netea-Maier RT, de Vegt F et al. Associations between thyroid function and mortality: the influence of age. Eur J Endocrinol 2014; 171(2): 183–191. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-13–1070>.
- Razvi S, Weaver JU, Vanderpump H et al. The incidence of ischemic heart diseases and mortality in people with DH. Reanalysis of the Wickham survey cohort. J Clin Endocrinolmetab 2010; 95(4): 1734–1740. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2009–1749>.
- Yeap BB, Manning L, Chubb SA et al. Reference Ranges for Thyroid-Stimulating Hormone and Free Thyroxine in Older Men: Results From the Health In Men Study. J Gerontol A Biol Sci Med Sci 2017; 72(3): 444–449. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/glw132>.
- Chaker L, Korevaar T, Rizopoulos D. Defining Optimal Health Range for Thyroid Function Based on the Risk of Cardiovascular Disease. J Clin Endocrinol Metab 2017; 102(8): 2853–2861. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2017–00410>.
- Gussekloo J, van Exel E, de Craen AJ et al. Thyroid status, disability and cognitive function, and survival in old age. JAMA 2004; 292(21): 2591–2599. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.292.21.2591>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 11-
All articles in this issue
- Arteriální hypertenze ve stáří
- Onemocnění štítné žlázy v seniorském věku
- Diabetes mellitus u staršího komplikovaného pacienta
- Antikoagulační léčba u seniorů
- Léčba statiny u osob vyššího věku
- Specifické rysy racionální geriatrické farmakoterapie: role klinických farmaceutů v individualizované léčbě ve stáří
- Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby
- Nutriční podpora u geriatrických nemocných: nové doporučené postupy ESPEN
- Poruchy vodní a iontové rovnováhy ve stáří
- Geriatrický pacient a chirurgický výkon
- Rizika hospitalizace seniorů
- Pády: významná příčina morbidity a mortality seniorů
- Hyperaktivní močový měchýř u starších pacientek: zvláštnosti léčby a lékové interakce
- Poruchy termoregulace a jejich význam ve vyšším věku
- Chronické nehojící se rány v geriatrii
- Souvisí stav zásobení organizmu vitaminem D s výsledky testování kognitivních funkcí a aktivit denního života u seniorů?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy termoregulace a jejich význam ve vyšším věku
- Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby
- Poruchy vodní a iontové rovnováhy ve stáří
- Pády: významná příčina morbidity a mortality seniorů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

