-
Medical journals
- Career
Úskalia stanovenia vitamínu D
Authors: Anton Vaňuga 1,2; Peter Huba 1; Ivana Ságová 3; Pavel Blažíček 1; Jarmila Melegová 5; Juraj Payer 4; Peter; Vaňuga 2
Authors‘ workplace: Alphamedical s. r. o., Slovenská republika 1; Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa, Slovenská republika 2; I. interná klinika JLF UK a UNM, Martin, Slovenská republika 3; V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika 4; Klinická biochémia, s. r. o, Žilina, Slovenská republika 5
Published in: Vnitř Lék 2017; 63(6): 403-408
Category: Original Contributions
Overview
Cieľ:
Cieľom štúdie bolo porovnať 3 rutinné imunochemické metódy stanovenia celkového 25-hydroxy-vitamínu D [25-(OH) D] s vysokoúčinnou kvapalinovou chromatografiou s UV detekciou.Materiál a metódy:
Sérové hladiny 25-(OH) D boli stanovované u 109 pacientov rôznymi imunochemickými metódami (ABBOTT, ROCHE, SIEMENS) a metódou HPLC, ktorá bola v predkladanej práci považovaná za referenčnú. V prvom kroku boli vybrané imunochemické metódy porovnané s ohľadom na metódu HPLC. V druhom kroku boli tieto metódy porovnané navzájom medzi sebou. Na porovnanie metód bola použitá regresná analýza (Passing-Bablok) a Bland-Altmanova analýza diferencií. Za maximálne akceptovateľné diferencie v jednotlivých výsledkoch boli považované hodnoty v rozmedzí ± 21,5 %. Toto kritérium bolo zvolené na základe CDC Vitamin D Standardization-Certification Program (VDSCP). V poslednom kroku bola vyhodnotená miera zhody v interpretácii nameraných výsledkov 25-(OH) D.Výsledky:
Žiadna zo skúmaných imunochemických metód stanovenia 25-(OH) D nebola porovnateľná s metódou HPLC a takisto neboli porovnateľné navzájom medzi sebou. Bland-Atlmanova analýza odhalila, v porovnaní s HPLC, že metóda ROCHE vykazuje bias +28,0 %, metóda ABBOTT +0,2 % a metóda Siemens -23,4 %. Priemerný bias u metódy ABBOTT je síce nevýznamný, avšak jednotlivé výsledky vykazovali bias v rozmedzí -89,4 % až 89,0 %. V porovnaní s metódou HPLC bola miera zhody v klinickej interpretácii výsledkov u metódy ABBOTT 65,21 %, ROCHE 59,63 % a SIEMENS 47,79 %.Záver:
Výsledky predkladanej práce poukazujú na slabú úroveň štandardizácie metód stanovenia 25-(OH) D, ako aj na možnosť zvážiť používanie na metóde závislých rozhodovacích limitov.Kľúčové slová:
25-hydroxy-vitamín D – interpretácia – porovnanie metód – štandardizáciaÚvod
Celosvetový nárast hypovitaminózy D má za následok prudký vzostup záujmu o jeho laboratórne stanovenie [1,2]. Deficit vitamínu D je spájaný s incidenciou mnohých ochorení. Známy je vzájomný vzťah hypovitaminózy D so vznikom osteoporózy a osteomalácie [3–5]. V súčasnosti sa pozornosť sústreďuje na koincidenciu hypovitaminózy D s ochoreniami ako diabetes mellitus [6], kardiovaskulárne ochorenia [7], imunologické a onkologické ochorenia [8,9]. Receptory pre vitamín D boli zistené na niekoľkých tkanivách vrátane čreva, žalúdka, pečene, tukového tkaniva, srdcového a kostrového svalstva, obličiek, imunitného systému, centrálneho nervového systému, štítnej žľazy, prištítnych teliesok, nadobličiek a B buniek pankreasu. Vitamín D sa stáva potenciálnym kľúčovým hráčom v rozvoji týchto ochorení. Pod označením vitamín D sa skrýva niekoľko v tukoch rozpustných kalciferolov, pričom 2 hlavné formy – cholekalciferol (vitamín D3) a ergokalciferol (vitamín D2) sú vlastne prohormóny, z ktorých v pečeni vzniká hydroxyláciou 25-hydroxycholekalciferol (kalcidiol), resp. 25-hydroxyergokalciferol, a následne v obličkách definitívna biologicky aktívna forma 1,25-dihydroxycholekalciferol (kalcitriol), resp. 1,25-dihydroxyergkokalciferol [11].
Ukázalo sa, že meranie 25-hydroxy-vitamínu D [25-(OH) D] je optimálny ukazovateľ stavu saturácie vitamínu D v organizme [12,13]. Na stanovenie 25-(OH) D sa v súčasnosti využívajú najmä 2 typy metód: imunochemické (rádioimunoanalýza, chemiluminiscenčná imunoanalýza, elektro-chemiluminiscenčná imunoanalýza, enzýmová imunoanalýza) a separačné (vysokoúčinná kvapalinová chromatografia, kvapalinová chromatografia – tandemová hmotnostná spektrometria) [14,15]. Široké spektrum dodávateľov ponúka automatizované imunochemické stanovenie, ktoré jednoznačne urýchlilo stanovenie 25-(OH) D [16,17]. Rozdiely medzi imunochemickými stanoveniami môžu byť markantné, čo môže viesť k sťaženej interpretácii výsledkov [18–20]. Naša práca informuje o výsledkoch porovnania troch automatizovaných imunochemických metód stanovenia 25-(OH) D s metódou HPLC.
Súbor pacientov a metodika
Vzorky
Pre účel tejto štúdie bolo vybratých celkovo 109 probandov s vekom 17–86 rokov (priemer 56,89). Z toho bolo 13 mužov s vekom 31–77 rokov (priemer 56,3) a 96 žien s vekom 17–86 rokov (priemer 56,9). Žiadne bližšie kritériá okrem rutinne stanovenej hladiny 25-(OH) D neboli pri výbere aplikované. Na analýzu boli použité pacientske vzorky venóznej krvi, ktoré boli odobraté za štandardných podmienok a u ktorých bolo indikované vyšetrenie 25-(OH) D lekármi Národného endokrinologického a diabetologického ústavu v Ľubochni. Vzorky boli po doručení do laboratória štandardne odstredené a po vykonaní analýz indikovaných lekármi boli zvyšné séra odpipetované do alikvotačných skúmaviek (pre každú metódu osobitne), označené a uskladnené pri -30 °C v laboratóriu klinickej biochémie a hematológie v Ľubochni (Alphamedical, s.r.o.). Po nazbieraní dostatočného počtu vzoriek boli, v zamrazenom stave, transportované do cieľových pracovísk: oddelenie klinickej biochémie firmy Klinická biochémia, s.r.o. v Žiline, laboratórium špeciálnych metód v Bratislave firmy Alphamedical, s.r.o. Každá analýza bola vykonaná z čerstvo rozmrazenej alikvotnej časti.
Metódy stanovenia 25-(OH) D
Na stanovenie celkového 25-(OH) D vo vzorkách boli použité komerčné chemiluminiscenčné imunochemické metódy od firmy Diagnostic/Architect, Siemens/Centaur a Roche Diagnostic/Cobas. Zo separačných metód bola použitá HPLC s UV detekciou od firmy Immundiagnostik AG (Bensheim, Germany) – set na stanovenie 25-(OH) D3/D2 RP – HPLC Kit (Article Nr. KC3000). Metóda HPLC-UV bola považovaná v našej práci za referenčnú. Meranie bolo vykonané na niekoľkých pracoviskách. Pracovisko Alphamedical, s.r.o. v Ľubochni analyzovalo vzorky na analyzátoroch Centaur XP (Siemens) a Cobas e411 (Roche). Na oddelení klinickej biochémie v Žiline firmy Klinická biochémia, s.r.o. boli vzorky vyšetrené na analyzátore Architect i2000 (Abbott) a laboratórium špeciálnych metód v Bratislave firmy Alphamedical, s.r.o. zabezpečilo analýzu separačnou metódou HPLC.
AdviaCentaur celkový vitamín D
Jedná sa o 18-minútovú protilátkovú kompetitívnu imunoanalýzu, ktorá využíva monoklonálnu myšiu protilátku proti fluoresceínu kovalentne spojenú s paramagnetickými časticami, monoklonálnu myšiu protilátku proti 25-(OH) D označenú esterom akridínu a analóg vitamínu D označený fluoresceínom. Existuje recipročný vzťah medzi množstvom vitamínu D prítomným vo vzorke pacienta a množstvom relatívnych svetelných jednotiek (RLU) zistených systémom [21]. Výrobca udáva skríženú reaktivitu s inými metabolitmi (3-epi-25(OH) vitamínu D3, parikalcitol, vitamín D2, vitamín D3, 1,25(OH)2 D2, 1,25(OH)2 D3, ktorá však podľa jeho vyhlásenia je minimálna.
Architect 25-OH Vitamín D
Metóda je oneskorená jednokroková chemiluminiscenčná imunoanalýza na mikročasticiach (CMIA – Chemiluminscent Microparticle Immunoassay) k kvantitatívnemu stanoveniu 25-(OH) D v ľudskom sére a plazme. Táto metóda využíva ovčiu polyklonálnu protilátku proti ľudskému vitamínu D triedy IgG v TRIS pufry. Množstvo vitamínu D vo vzorke je nepriamo úmerné signálu v jednotkách RLU detegovaného optikou systému ARCHITECT iSystem [22]. Aj tu výrobca deklaruje krížovú reaktivitu už spomínaných metabolitov, ktorá je podľa jeho vyhlásenia minimálna.
Elecsys Vitamin D total
Jedná sa o kompetitívny elektrochemiluminiscenčný väzobný test. Súprava Elecsys vitamin D total využíva proteín viažuci vitamín D (VDBP) ako vychytávajúci proteín, na ktorý sa viaže 25-(OH) D3 a 25-(OH) D2. Stanoveniu predchádza denaturácia a uvoľnenie 25-(OH) D z väzby na VDBP. Metóda je založená na väzbe 25-(OH) D s rutheniom značeným VDBP. Následne je pridaný biotínom značený 25-(OH) D, dôjde ku kompetícii o väzobné miesta na rutheinilovanom VDBP. Po pridaní streptavidínom potiahnutých mikročastíc prebehne interakcia biotín-streptavidín. Nenaviazané zložky sú odstránené. Privedené napätie na elektróde vyvolá chemiluminscenčnú emisiu fotónov. Emitované fotóny sú zmerané fotonásobičom a množstvo 25-(OH) D vo vzorke je nepriamo úmerné s množstvom emitovaných fotónov [23]. Výrobca udáva značnú skríženú reaktivitu s C3-epimérom-25 hydroxivitamínu D3 a 24,25-dihydroxy vitamínom D3. Ostatné metabolity vykazujú minimálnu skríženú reaktivitu.
25-OH Vitamin D3/D2 RP – HPLC
Separačná metóda HPLC s obrátenou fázou je určená pre kvantitatívne stanovenie 25-(OH) D3 a 25-(OH) D2 v sére a plazme. Ide o test, v ktorom vlastnú analýzu vzorky predchádza jednoduchá príprava vzorky pozostávajúca z kombinácie precipitácie a extrakcie. Separácia HPLC prebieha v izokratickom režime pri 30 °C na kolóne s „reverznou fázou“. Rozmer kolóny je 125 × 4 mm, prietoková rýchlosť 1 ml/min. Formy 25-(OH) D sú detegované pomocou UV detektora pri 264 nm. Limit detekcie pre 25-(OH) D3 je 7 nmol/l a pre 25-(OH) D2 9,4 nmol/l. Linearita 25-(OH) D3/D2 je do 1 250 nmol/l. Výťažnosť pre 25-(OH) D3 je 109,8 % a pre 25-(OH) D2 102,8 %. Špecificita metódy bola testovaná porovnaním retenčných časov zmesí štandardných roztokov 25-(OH) D3/D2 s kalibrátorom. Minimálne rozdiely medzi retenčnými časmi (< 3 %) umožňujú spoľahlivú identifikáciu píkov. Pridaním metabolitov [1,25-(OH)2 D3/D2, 24,25-(OH)2 D3] nebola pozorovaná interferencia. Separácia trvá 15 minút pre každý beh. Výsledky sa kvantifikujú podľa kalibrátora a vypočítavajú sa externým štandardným spôsobom stanovením výšky píku. Systém využíva jednobodovú kalibráciu a má 2 hladiny kontrol [24]. Pri analýze pacientskych vzoriek, pre účely predkladanej práce, boli použité kalibrátory výrobcu s cieľovými koncentráciami pre 25-(OH) D3 =142 nmol/l a pre 25-(OH) D2 =185 nmol/l. Pre kontrolu kvality boli použité lyofilizované kontrolné materiály výrobcu s cieľovými hodnotami pre 25-(OH) D3, L1 = 51,8, resp. L2 = 89,9 nmol/l, a pre 25-(OH) D2, L1 = 116,7, reps. L2 = 209,1 nmol/l. Celkovo bolo vykonaných 24 kontrolných meraní, 6 kontrolných meraní pre každý analyt a kontrolnú hladinu. Priemerná nameraná koncentrácia pre 25-(OH) D3 bola L1 = 47,1 nmol/l (bias = -9,14 %) a L2 = 87,5 nmol/l (bias = -2,69 %). Priemerná nameraná koncentrácia pre 25-(OH) D2 bola: L1 = 119,7 nmol/l (bias = -1,30 %) a L2 = 209,1 nmol/l (bias = -3.83 %). Žiadne z kontrolných meraní neprekročilo definovaný limit ± 21,5 %.
Štatistická analýza
Na porovnanie metód bola použitá regresná analýza podľa Passing-Babloka a Bland-Altmanova analýza diferencií. Za maximálne akceptovateľné diferencie v jednotlivých výsledkoch boli považované hodnoty v rozmedzí ± 21,5 %. Toto kritérium bolo zvolené na základe CDC Vitamin D Standardization-Certification Program (VDSCP). Kritérium tak bolo vypočítané, z podmienok pre bias = 5 % a pre precíznosť = 10 %, podľa vzťahu TEA = 1,65 * CV + bias. Pre účely korelačnej analýzy boli, vzhľadom na negaussovské rozdelenie dát, použité Spearmanove korelačné koeficienty. Za štatisticky významné boli považované hodnoty P ≤ 0,05. Hodnoty 25-(OH) D2 a 25-(OH) D3 namerané pomocou HPLC boli sčítané a uvedené ako 25-(OH) D. Stredné koncentrácie 25-(OH) D, D2 a D3 boli vyjadrené formou mediánu spolu s interkvartilovým rozsahom (IQR). Miera zhody v interpretácii nameraných výsledkov celkového vitamínu D bola vyhodnotená jednak na základe odporúčaných kritérií pre centrálnu Európu [26] a následne na základe metódo-špecifických rozhodovacích limitov, ktoré boli získané prepočtom odporúčaných kritérií pomocou regresných rovníc. Na vyhodnotenie dát bol použitý MedCalcStatistical Software version 13.1.2 (MedCalc Software bvba, Ostend, Belgium; http://www.medcalc.org; 2014) a Microsoft Excel (2013).
Výsledky
Najväčšia stredná koncentrácia 25-(OH) D bola zaznamenaná u metódy ROCHE (medián = 91,02 nmol/l, IQR = 42,58–123,1 nmol/l), potom u metódy HPLC (medián = 71,8 nmol/l, IQR = 38,55–100,4 nmol/l), následne u metódy ABBOTT (medián = 67,93 nmol/l, IQR = 32,28–91,35 nmol/l) a nakoniec u metódy SIEMENS (medián = 51,73 nmol/l, IQR = 18,01–70,12 nmol/l). Koncentrácia 25-(OH) D bola determinovaná takmer výlučne 25-(OH) D3. Metóda HPLC poukázala na strednú koncentráciu 25-(OH) D3 = 71,9 nmol/l (IQR = 44,08–100,0 nmol/l). Medián 25-(OH) D2 z celého súboru výsledkov nebol kvantifikovateľný. Merateľná koncentrácia 25-(OH) D2 bola zaznamenaná iba v 7 prípadoch. Medián 25-(OH) D2 z tohto súboru výsledkov bol 30,4 nmol/l (IQR = 23,45–115,8 nmol/).
Namerané výsledky 25-(OH) D pomocou 3 imunochemických metód boli porovnané s metódou HPLC ako aj navzájom medzi sebou pomocou regresnej analýzy podľa Passing-Babloka. Výsledky tejto analýzy sú zhrnuté v tab. 1 a graficky je znázorňuje graf 1. Spomedzi porovnávaných metód bola korelácia medzi HPLC a ABBOTT najlepšia (R = 0,873, P < 0,0001), potom medzi HPLC a ROCHE (R = 0,849, P < 0,0001) a nakoniec medzi HPLC a SIEMENS (R = 0,842, P < 0,0001). Pri porovnaní imunochemických metód navzájom bola zistená najlepšia korelácia medzi SIEMENS a ABBOTT (R = 0,972, P < 0,0001), potom medzi ROCHE a ABBOTT (R = 0,923, P < 0,0001) a nakoniec medzi SIEMENS a ROCHE (R = 0,904, P < 0,0001).
Table 1. Porovnanie metód stanovenia 25-(OH) D pomocou regresnej analýzy podľa Passing-Babloka 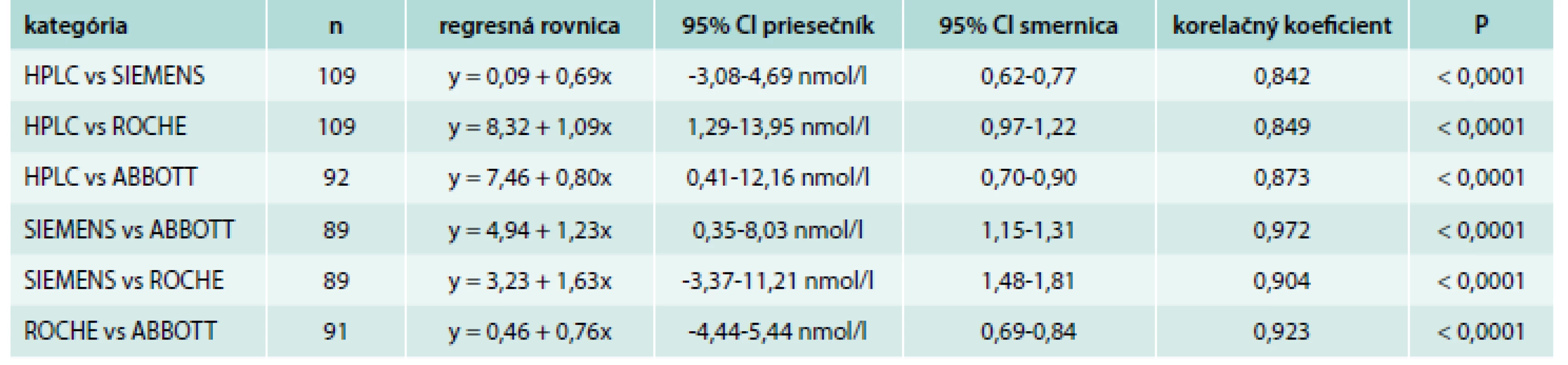
Hodnota P predstavuje štatistickú významnosť korelácie. 95% CI znamená 95% interval spoľahlivosti. Graph 1. Sumárny regresný graf z porovnania vybraných imunochemických metód s HPLC 
Bias medzi imunochemickými metódami a metódou HPLC bol vyhodnotený pomocou Bland-Altmanovej analýzy. Výsledky tejto analýzy graficky znázorňuje graf 2. Spomedzi porovnávaných metód bol zaznamenaný najmenší priemerný bias medzi metódou HPLC a ABBOTT (-0,2 %), potom medzi HPLC a SIEMENS (23,4 %) a nakoniec medzi HPLC a ROCHE (-28,0 %).
Graph 2. Bland-Altmanove grafy porovnania rutinných imunochemických metód stanovenia 25-(OH) D vyjadrujúce priemerný relatívny bias. 
(A) HPLC-UV vs SIEMENS, (B) HPLC-UV vs ABBOTT, (C) HPLC-UV vs ROCHE. Neprerušovaná línia reprezentuje priemerný relatívny bias, prerušovaná línia s bodkou regresnú priamku diferencií a prerušované línie limity zhody (bias ± 1,96 SD) Pri vzájomnom porovnaní imunochemických metód bol zaznamenaný najmenší priemerný bias medzi metódou ROCHE a ABBOTT (22,8 %), potom medzi SIEMENS a ABBOTT (-32,1 %) a nakoniec medzi SIEMENS a ROCHE (-53,6 %).
V tab. 2 je znázornená miera zhody v klasifikácii výsledkov 25-(OH) D s ohľadom na odporúčané ako aj metódo-špecifické rozhodovacie limity. Na základe odporúčaných kritérií bola medzi metódou HPLC a ABBOTT zhoda v 65,22 %, medzi metódami HPLC a ROCHE v 59,63 % a medzi metódou HPLC a SIEMENS 46,79 % prípadov. Miera falošnej negativity výsledkov bola najväčšia u metódy SIEMENS (50,46 %), potom u metódy ABBOTT (30,43 %) a nakoniec u metódy ROCHE (11,93 %). Miera falošnej pozitivity bola naopak najvyššia u metódy ROCHE (28,44 %), potom u metódy ABBOTT (4,35 %) a nakoniec u metódy SIEMENS (2,75 %). Pri interpretácii výsledkov na základe metódo-špecifických rozhodovacích limitov bola medzi metódou HPLC a ABBOTT zhoda v 67,39 %, medzi metódami HPLC a ROCHE v 66,06 % a medzi metódou HPLC a SIEMENS v 65,14 % prípadov. Z tohto jednoduchého experimentu je zrejmé, že miera zhody sa vylepšila u všetkých troch imunochemických metód s najvýraznejším zlepšením u metódy SIEMENS (46,79 % vs 65,14 %) a je porovnateľná u všetkých 3 metód. Podobne došlo aj k rovnomernejšiemu rozloženiu falošne negatívnych a pozitívnych výsledkov.
Table 2. Zhoda v klasifikácii nameraných výsledkov 25-(OH) D s ohľadom na odporúčania pre centrálnu Európu, resp. na metódo-špecifické rozhodovacie limity 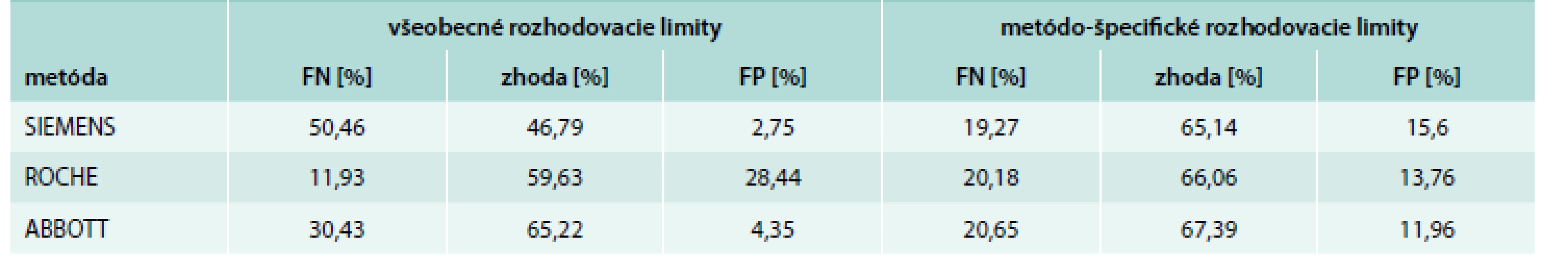
FN – falošná negativita FP – falošná pozitivita Diskusia
Stanovenie hladiny 25-(OH) D sa stáva predmetom záujmu mnohých medicínskych špecializácií. Klinické laboratóriá sa musia vysporiadať s narastajúcim počtom indikácií stanovenia hladiny 25-(OH) D. I keď sa za referenčnú metódu považuje metóda LC-MS/MS, tá je pre svoju prístrojovú, ekonomickú náročnosť a náročnosť na obsluhu v rutinných podmienkach laboratórií nahradzovaná imunochemickými metódami, ktoré v súčasnosti poskytujú viacerí výrobcovia IVD prostriedkov [26]. Výber metódy je na rozhodnutí laboratórií, pričom neexistuje jednoznačný návod, ktorý by pomohol pri výbere najvhodnejšej metódy. Situáciu výrazne komplikuje nízka úroveň štandardizácie metód, ktorá spolu so všeobecnými cut-off hodnotami pre hodnotenie statusu 25-(OH) D môže v konečnom dôsledku skomplikovať klinické rozhodovanie. Už niekoľko autorov zaoberajúcich sa touto problematikou poukazuje na riešenie situácie, pričom poukazujú na nutnosť štandardizácie metód s vhodným referenčným materiálom [15], prípadne vytvorením metódo-špecifických referenčných intervalov[16,26,27]. V tejto štúdii sme sa zamerali na porovnanie 3 imunochemických metód stanovenia 25-(OH) D s HPLC, ktoré sa podľa nášho názoru a skúseností, využívajú v rutinnej praxi najčastejšie. Počas trvania tejto štúdie mali všetky použité imunochemické metódy vydaný certifikát VDSCP (Vitamin D Standardization-Certification Program). Tento certifikát sa vydáva pre metódy, ktoré splnia certifikačné podmienky, bias ≤ 5 % a precíznosť ≤ 10 %, od CDC a University of Ghent Vitamin D2 and D3 referenčných metód v rozsahu 22,5–275 nmol/l. Výsledky regresnej analýzy ako aj analýzy diferencií v tejto práci poukázali na významné rozdiely medzi skúmanými metódami. K podobným záverom sa dopracovali viaceré publikované štúdie [28–34].
Namerané výsledky 25-(OH) D sme podrobili aj interpretácii s ohľadom na všeobecné rozhodovacie limity platné pre centrálnu Európu [26]. Tieto odporúčania rozoznávajú 6 pásiem koncentrácie 25-(OH) D: < 50 nmol/l (deficit), 50–75 nmol/l (suboptimum), 75–125 nmol/l (adekvátny status), 125–250 nmol/l (nadmerná zásoba), 250–500 nmol/l (riziková koncentrácia), > 500 nmol/l (toxicita). Na základe týchto kritérií bola medzi metódami značná diverzita v miere zhody ako aj v miere falošne negatívnych a pozitívnych výsledkov. Po prepočte rozhodovacích limitov pomocou regresných rovníc pre každú metódu sa miera zhody ako aj miera falošne negatívnych a pozitívnych výsledkov ustálila na približne rovnakej úrovni naprieč všetkými metódami, pričom vo všetkých prípadoch došlo k zlepšeniu týchto ukazovateľov.
I keď štandardizácia je najčastejšie skloňovaným problémom, je nutné zmieniť aj iné potencionálne zdroje príčin diskrepancií medzi výsledkami 25-(OH) D. Viacerí autori v literatúre poukazujú na ďalšie príčiny, ktoré môžu spôsobiť značné rozdiely medzi metódami stanovenia 25-(OH) D. Podľa nich sa javia ako problematické metabolity vitamínu D, napr. 3-epi-25 hydroxivitamín D, 24,25-dihydroxyvitamin D, rozdielna imunoreaktivita 25-(OH) D2 a 25-(OH) D3, heterofilné protilátky, VDBP (Vitamin D Binding Protein) [35–37].
Záver
Úroveň štandardizácie metód stanovenia 25-(OH) D je i doposiaľ nedostatočná a spolu s ďalšími faktormi môže skresľovať klinické rozhodovanie, čo môže viesť k neadekvátnym terapeutickým postupom. Nedá sa očakávať, že sa situácia v blízkej budúcnosti významne zmení, a preto je vhodné uvažovať aspoň o používaní na metóde závislých rozhodovacích limitov, ktoré môžu pri najmenšom zlepšiť interpretáciu výsledkov 25-(OH) D naprieč rôznymi rutinne používanými metódami.
Mgr. Anton Vaňuga
vvanuga@nedu.sk
Národný endokrinologický a diabetologický ústav, n.o.,
Ľubochňa,
Slovenská republika
www.nedu.sk
Doručeno do redakce 9. 3. 2017
Přijato po recenzi 27. 6. 2017
Sources
1. Cannell JJ, Hollis BW, Zasloff M et al. Diagnosis and treatment of vitamin D deficiency. Expert Opin Pharmacother 2008; 9(1): 107–118.
2. Huibers MH, Visser DH, Deckers MM et al. Vitamin D deficiency among native Dutch and first – and second generationnon – Westernimmigrants. Eur J Pediatr 2014; 173(5): 583–588. Dostupné z DOI: <http://dx.doi.org/10.1007/s00431–013–2198-x>.
3. Bischoff-Ferrari HA, Dietrich T, Orav EJ et al.l Positive association between 25-hydroxy vitamin D levels and bone mineral density: a population-based study of younger and older adults. Am J Med 2004; 116(9): 634–639.
4. Murad MH, Elamin KB, Abu Elnour NO et al. Clinical review: The effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab 2011; 96 : 2997–3006. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–1193>.
5. Bentley J. The role of vitamin D in infants, children and young people. Nurs Child Young People 2015; 27(1): 28–35; quiz 36. Dostupné z DOI: <http://dx.doi.org/10.7748/ncyp.27.1.28.e508>.
6. Pittas AG, Lau J, Hu FB et al. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J Clin Endocrinol Metab 2007; 92(6): 2017–2029.
7. Forman JP, Bischoff-Ferrari HA, Willett WC et al. Vitamin D intake and risk of incident hypertension: results from three large prospective cohort studies. Hypertension 2005; 46 : 676–682.
8. Grant WB. How strong is the evidence that solar ultraviolet B and vitamin D reduce the risk of cancer? An examination using Hill’s criteria for causality. Dermatoendocrinol 2009; 1(1): 17–24.
9. Melamed ML, Michos ED, Post W et al. 25-hydroxyvitamin D levels and the risk of mortality in the general population. Arch Intern Med 2008; 168(15): 1629–1637. Dostupné z DOI: <http://dx.doi.org/10.1001/archinte.168.15.1629>.
10. Garland CF, Gorham ED, Mohr SB et al. Vitamin D for cancer prevention: global perspective. Ann Epidemiol 2009; 19(7): 468–483. Dostupné z DOI: <http://dx.doi.org/10.1016/j.annepidem.2009.03.021>.
11. Saenger AK, Laha TJ, Bremner DE et al. Quantification of serum 25-hydroxyvitamin D(2) and D(3) using HPLC-tandem mass spectrometry and examination of reference intervals of or diagnosis of vitamin D deficiency. Am J Clin Pathol 2006; 125(6): 914–920.
12. Ross AC, Taylor CL, Yaktine AL et al (eds). [Institute of Medicine (IOM)]. Dietary Reference Intakes for Calcium and Vitamin D. The National Academic Press: Washington (DC) 2011. ISBN 978–0-309–16394–1.
13. Seamans KM, Cashman KD. Existing and potentially novel functional Markers of vitamin D status: a systematic review. Am J Clin Nutr 2009; 89(6): 1997S-2008S. Dostupné z DOI: <http://dx.doi.org/10.3945/ajcn.2009.27230D>.
14. Kwak HS, Chung HJ, Cho DH et al. Efficacy of the measurement of 25-hydroxyvitamin D2 and D3 levels by using Perkin Elmer liquid chromatography-tandem mass spectrometry vitamin D kit compared with Dia Sorinradio immunoassay kit and Elecsys vitamin D total assay. Ann Lab Med 2015; 35(2): 263–265. Dostupné z DOI: <http://dx.doi.org/10.3343/alm.2015.35.2.263>.
15. Tsugawa N, Suhara Y, Kamao M et al. Determination of 25-hydroxyvitamin D in human plasma using high-performance liquid chromatography – tandem mass spectrometry. Anal Chem 2005; 77(9): 3001–3007.
16. Wallace AM, Gibson S, de la Hunty A et al. Measurement of 25-hydroxyvitamin D in the clinical laboratory: current procedures, performance characteristics and limitations. Steroids 2010; 75(7): 477–488. Dostupné z DOI: <http://dx.doi.org/10.1016/j.steroids.2010.02.012>.
17. Janssen MJ, Wielders JP, Bekker CC et al. Multicenter comparison study of current methods to measure 25-hydroxyvitamin D in serum. Steroids 2012; 77(13): 1366–1372. Dostupné z DOI: <http://dx.doi.org/10.1016/j.steroids.2012.07.013>.
18. Carter GD. 25-Hydroxyvitamin D assays: the quest for accuracy. Clin Chem 2009; 55(7): 1300–1302. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2009.125906>.
19. Binkley N, Krueger D, Cowgill CS et al. Assay variation confounds the diagnosis of hypovitaminosis D: a call for standardization. J Clin Endocrinol Metab 2005; 89(7): 3152–3157.
20. Binkley N, Krueger D, Gemar D et al. Correlation among 25-hydroxy-vitamin D assays. J Clin Endocrinol Metab 2008; 93(5): 1804–1808. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2007–2340>.
21. Siemens Advia Centaur® XP. Celkový vitamín (Vit D) [direction. insert 0699279_SK Rev D]. Siemens Healthcare Diagnostics: Tarrytown (NY) 2016–04.
22. Architect® 25-OH Vitamin D [directional insert 3L52, G2–4021/R03]. Abbott Laboratories. Wiesbaden 2012. Dostupné z WWW: <http://www.ilexmedical.com/files/download/1306390706e06Sh.pdf>.
23. Roche ELECSYS®. Vitamin D total [directional insert 05894913 190, V 7.0 Slovenskz]. Roche Diagnostics GmbH: Mannheim 2016–08.
24. Immunodiagnostik 25-OH-Vitamin D3/D2 RP-HPLC Kit [directional insert KC3000], Immundiagnostik AG: Bensheim 2015–06. Dostupné z WWW: http://www.immundiagnostik.com/fileadmin/pdf/KC3000%20Vitamin%20D3%20D2_RP.pdf
25. Pludowski P, Karczmarewicz E, Bayer M et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe – recommended vitamin D intakes in the general population and group sat risk of vitamin D deficiency. Endokrynol Pol 2013; 64(4): 319–327.
26. Holick MF, Binkley NC, Bischoff-Ferrari HA et al. Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96(7): 1911–1930. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–0385>. Erratum in J Clin Endocrinol Metab 2011; 96(12): 3908.
27. Ross AC, Taylor CL, Yaktine AL et al. (eds). [Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium]. Dietary Reference Intakes for Calcium and Vitamin D. National Academies Press: Washington (DC): 2011. ISBN 978–0-309–16394–1.
28. Cavalier E, Dozet E, Gadisseur R et al. Measurement uncertainty of 25-OH vitamin D determination with different commercially available kits: impact on the clinical cutoffs. Osteoporosis Int 2010; 21(6): 1047–1051. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–009–1052–5>.
29. Cavalier E, Carlisi A, Beckert A et al. Analytical evaluation of the new Abbott Architect 25-OH vitamin D assay. Clin Biochem 2012; 45(6): 505–508. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clinbiochem.2012.01.021>.
30. Lei JK, Lucas RM, Clements MS et al. Assessing vitamin D status: pit falls for the un way. Mol Nutr Food Res 2010; 54(8): 1062–1071. Dostupné z DOI: <http://dx.doi.org/10.1002/mnfr.200900468>.
31. Roth HJ, Schmidt-Gayk H, Weber H et al. Accuracy and clinical implications of seven 25-hydroxyvitamin D compared with liquid chromatography – tandem mass spectrometry as reference. Ann Clin Biochem 2008; 45(Pt 2): 153–159. Dostupné z DOI: <http://dx.doi.org/10.1258/acb.2007.007091>.
32. Farrell CJ L, Martin S, Mc Whinney B et al. State of Art vitamin D assays: A comparison of Automated Immunoassays with Liquid chromatography-Tandem Mass Spectrometry Methods. Clin Chem 2012; 58(3): 531–542. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2011.172155>.
33. Ong L, Saw S, Schabdeen NB et al. Current 25-hydroxyvitamin D assays: Do the ypass the test? Clin Chim Acta 2012; 413(13–14): 1127–1134. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cca.2012.03.009>.
34. Snellman G, Melkus H, Godeborg R et al. Determining vitamin D status, a comparison between commercially available assays. Plos One 2010; 5(7): e11555. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0011555>.
35. Friedecký B, Vávrová J. Současný stav stanovení vitaminu D v séru. Klin Biochem Metab 2012; 20[41](3): 174–178 .Dostupné z WWW: <http://www.cskb.cz/res/file/KBM-pdf/2012/2012–3/KBM12–3-Fr-vitD-174.pdf>.
36. Carter GD. 25-hydroxyvitamin D: A difficult analyte. Clin Chem 2012; 58(3): 486–488. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2011.180562>.
37. Kricka LJ. Human anti-animal antibody interferences in immunological assays. Clin Chem 1999; 45(7): 942–956.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 6-
All articles in this issue
- Rizikové faktory kardiovaskulárních onemocnění u potomků nemocných po časném infarktu myokardu
- Úskalia stanovenia vitamínu D
- Klinická štúdia FOURIER
- Primární testikulární lymfomy
- Rivaroxaban u rizikových pacientů
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Prediktory kvality života u českých pacientek po léčbě karcinomu prsu se zaměřením na dovednosti zvládání zátěže
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primární testikulární lymfomy
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Úskalia stanovenia vitamínu D
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

