-
Medical journals
- Career
Časný pohybový režim snižuje asymetrický dimetylarginin po transplantaci ledviny
Authors: V. Teplan 1,2; A. Mahrová 3; K. Švagrová 3; J. Racek 4; R. Gürlich 5; V. Teplan Jr 5; L. Šenolt 6; M. Štollová 1
Authors‘ workplace: Klinika nefrologie Transplantcentra IKEM Praha, přednosta prof. MUDr. Ondřej Viklický, CSc. 1; Subkatedra nefrologie IPVZ Praha, vedoucí prof. MUDr. Vladimír Teplan, DrSc. 2; Laboratoř sportovní motoriky Fakulty tělesné výchovy a sportu UK Praha, přednosta prof. Ing. Václav Bunc, CSc. 3; Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Jaroslav Racek, DrSc. 4; Chirurgická klinika 3. lékařské fakulty UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Robert Gürlich, CSc. 5; Revmatologický ústav Praha, ředitel prof. MUDr. Karel Pavelka, DrSc. 6
Published in: Vnitř Lék 2012; 58(9): 640-646
Category: Original Contributions
Overview
Úvod a cíl studie:
Hladiny endogenního inhibitoru NO syntázy asymetrického dimetylargininu jsou zvýšeny u pacientů po transplantaci ledvin a mohou významně přispět k cévním komplikacím. V této studii jsme testovali hypotézu, zda pravidelné fyzické cvičení započaté po transplantaci ledviny může snížit zvýšené hladiny asymetrického dimetylargininu. Současně jsme vyšetřili vybrané cytokiny a metabolické parametry.Metody:
Plazmatické vzorky pro analýzu asymetrického dimetylargininu, adiponektinu, leptinu, rozpustného receptoru pro leptin, rezistinu, visfatinu, CRP, TNFα a další vybrané parametry lipidového a sacharidového metabolizmu byly vyšetřeny v prospektivní randomizované studii u 68 pacientů po 1. kadaverózní transplantaci ledviny, kteří souhlasili s účastí v kontrolovaném aerobním cvičebním programu po dobu 6 měsíců (skupina I). Vzorky byly odebrány před zahájením cvičení v 1. měsíci po transplantaci při již stabilní funkci transplantované ledviny a kontrolní odběry za 6 měsíců od zahájení. Kontrolní skupinu tvořilo 60 transplantovaných pacientů srovnatelných dle věku, pohlaví, HLA typizace, délky předchozí dialýzy, anamnézy kardiovaskulárních onemocnění a imunosupresivního režimu, kteří nepodstoupili pravidelný cvičební režim (skupina II).Výsledky:
Na začátku sledovaného údobí nebyly mezi oběma skupinami zjištěny signifikantní rozdíly v hladinách asymetrického dimetylargininu. Po 6měsíčním pravidelném cvičebním programu hladiny asymetrického dimetylargininu ve skupině I významně poklesly (z 3,5 ± 0,45 na 2,11 ± 0,35 µmol/l, p < 0,01) a byly také signifikantně nižší ve srovnání s kontrolní skupinou II (2,11 ± 0,23 vs 3,25 ± 0,34 µmol/l,p < 0,01). Byly zjištěny i další signifikantní změny ve skupině I v následujících sledovaných parametrech: adiponektin (z 14,6 ± 6,6 na 22,3 ± 6,2 mg/ml, p < 0,01), leptin (z 51,3 ± 11,2 na 20,3 ± ± 9,2 ng/l, p < 0,01), rozpustný/solubilní receptor pro leptin (z 24,6 ± 8,4 na 46,1 ± 11,4 U/ml, p < 0,01), rezistin (z 20,8 ± 10,1 na 14,6 ± ± 6,4 mg/ml, p < 0,025) a visfatin (z 1,8 ± 0,2 na 1,2 ± 0,01 ng/ml, p < 0,05). Současně byly ovlivněny i parametry lipidového a sacharidového metabolizmu (celkový a LDL-cholesterol, triacylglyceroly, HbA1c, hladina inzulinu), jakož i hladiny prozánětlivých cytokinů (CRP a TNFα).Závěr:
Zvýšená hladina asymetrického dimetylargininu a vybrané adipocytokiny byly u pacientů po transplantaci ledviny signifikantně ovlivněny časným pravidelným pohybovým režimem. Cvičební režim může významně snížit i riziko kardiovaskulárních onemocnění po transplantaci ledviny.Klíčová slova:
transplantace ledviny – tělesné cvičení – ADMA – adiponektin – leptin – rezistin – visfatinÚvod
Pacienti po transplantaci ledvin mají zvýšené riziko kardiovaskulárních onemocnění a úmrtí. Cévní změny mohou být spojeny s omezenou biologickou aktivitou oxidu dusnatého (NO) a zvýšením koncentrací cirkulujícího endogenního inhibitoru NO syntázy asymetrického dimetylargininu (ADMA), markeru endoteliální dysfunkce u onemocnění ledvin [1].
Zvýšení hladiny ADMA souvisí se sníženou funkcí ledvin. Z přibližně 300 mmol (60 mg) ADMA za den je kolem 50 mmol vylučováno močí, a proto se hladina ADMA zvyšuje u pacientů se selháním ledvin [2]. Transplantace ledvin normalizuje hladinu symetrického dimetylargininu (SDMA), zatímco hodnota ADMA zůstává zvýšena. Důvodem může být snížené odbourávání ADMA v ledvinách [alterovaná činnost enzymu dimetylarginin dimetylaminohydrolázy (DDAH)] a/nebo jeho zvýšená tvorba. Zatím je málo dokladů o dalším ovlivnění ADMA farmakoterapií. Údaje o účinku inhibitorů angiotenzin-konvertujícího enzymu či blokátorů receptorů pro angiotenzin II jsou protichůdné, nicméně o perorálních antidiabetikách (např. metforminu či glitazonu) se předpokládá, že by prostřednictvím zlepšení inzulinové rezistence mohly snížit hladiny ADMA. Tento účinek pravděpodobně vyplývá ze zvýšení DDAH [3].
U netransplantovaných pacientů jsou plazmatické koncentrace ADMA vyšší u obézních inzulin-rezistentních jedinců a hubnutí bylo spojeno se snížením plazmatických koncentrací ADMA. Vysoce zvýšené koncentrace ADMA u morbidně obézních pacientů [body mass index (BMI) > 35 kg/m2] se významně snížily po bariatrické gastroplastice, jež vedla ke snížení tělesné hmotnosti [4].
Vyšší koncentrace ADMA byly opakovaně popsány v situacích zvýšeného kardiovaskulárního rizika [5,6]. Dle zvýšení hladiny ADMA lze předpovědět riziko kardiovaskulárních příhod u pacientů se selháním ledvin, především u mužů s již přítomnou ischemickou chorobou srdeční [7]. Pacienti po transplantaci ledviny mají známky významné endoteliální dysfunkce [8] a také významně vyšší hladiny ADMA, než je tomu u zdravých osob se srovnatelnou renální funkcí [9]. Tento nález by mohl výrazně přispět k vysoké kardiovaskulární morbiditě a mortalitě [10]. Po úspěšné transplantaci ledviny s rozvojem renální funkce sice ADMA klesá ve srovnání s hodnotami u dialyzovaných nemocných, ale zůstává trvale významně vyšší. Na tom se mohou podílet i další faktory, z nichž velmi důležitou roli hraje přírůstek tukové tkáně – především viscerálního tuku – po transplantaci. Tuková tkáň vylučuje řadu hormonů a cytokinů, které jsou považovány za klíčové při vzniku inzulinové rezistence a endoteliální dysfunkce [11,12]. Mění se i hladina adiponektinu (ADPN), jenž má naopak předpokládané účinky antiaterosklerotické a protizánětlivé [13,14]. U neobézních pacientů po úspěšné transplantaci ledviny jeho zvýšená hladina může částečně snížit riziko endoteliální dysfunkce [15].
Bylo prokázáno, že pravidelné aerobní cvičení významně zlepšuje vazodilataci závislou na funkci endotelu u kardiologických nemocných [16].
Pravidelná tělesná aktivita ovlivňuje pozitivně endoteliální dysfunkci i u nemocných s chronickým onemocněním ledvin a u pacientů na dialýze se zvýšeným kardiovaskulárním rizikem [17]. Lze proto předpokládat pozitivní vliv i u transplantovaných pacientů. Dosud však nebyly publikovány žádné relevantní údaje podporující tuto hypotézu.
Cílem naší práce bylo proto charakterizovat a zhodnotit plazmatické hladiny ADMA ve vztahu k ostatním rizikovým faktorům u příjemců transplantované ledviny před pravidelným fyzickým cvičením a po jeho ukončení. Současně jsme vyšetřili vybrané adipocytokiny (ADPN, leptin, rezistin a visfatin), cytokiny tumor nekrotizujícího faktoru α (TNFα) a C-reaktivní protein (CRP), které by mohly být cvičením ovlivněny. Dále vybrané parametry metabolizmu lipidů a sacharidů spolu s hodnocením renální funkce clearancovými metodami.
Materiál a metody
Studie byla schválena etickou komisí Institutu klinické a experimentální medicíny Praha a je v souladu s Helsinskou deklarací, včetně aktuální verze správné klinické praxe. Postupy respektují institucionální předpisy. Všichni nemocní byli podrobně informování a dali písemný informovaný souhlas před zařazením do studie.
Soubor nemocných
Do prospektivní randomizované studie bylo zařazeno celkem 128 nemocných po 1. transplantaci kadaverózní ledviny, která byla provedena v Transplantcentru Institutu klinické a experimentální medicíny Praha od 1. 9. 2009, z toho 68 randomizovaně vybraných pacientů (skupina I, 36 mužů a 32 žen, průměrný věk 58 ± 7,2 let, rozmezí 25 až 71 let, střední věk 54,0 let) souhlasilo s účastí v kontrolovaném aerobním cvičebním programu s nutriční edukací po dobu 6 měsíců od transplantace ledviny. Randomizace byla provedena standardní metodou výběru dle data narození.
Kontrolní skupinu tvořilo 60 nemocných (skupina II, 30 mužů a 30 žen) po transplantaci ledviny, srovnatelných z hlediska věku, pohlaví, HLA typizace, délky předchozí dialýzy, anamnézy kardiovaskulárních onemocnění a imunosupresivního režimu, kteří nepodstoupili pravidelný cvičební režim spojený s nutriční edukací. Sběr dat pacientů byl dokončen 31. 10. 2011. Pacienti byli vyšetřeni a sledováni na metabolickém oddělení a v clearancové laboratoři Kliniky nefrologie IKEM Praha se zahájením v 1. měsících po transplantaci při stabilizaci funkce transplantované ledviny po dobu 6 měsíců. Vzorky krve a moči byly vyšetřeny při zahájení studie a za 6 měsíců sledování. Funkce ledvin byla hodnocena clearancí inulinu a kreatininu.
Dlouhodobý imunosupresivní protokol zahrnoval podávání cyklosporinu (Sandimmun Neoral, Novartis, Basilej, Švýcarsko) nebo takrolimu (Prograf, Astellas, Praha, Česká republika) v dávkách odpovídajících doporučeným léčebným hladinám, dále mykofenolát mofetilu (Cellcept, Hoffmann-La Roche, Basilej, Švýcarsko), 1–2 g/den a steroidů 5–10 mg/den (Prednison, Zentiva, Praha, Česká republika). Nemocní s epizodami rejekce štěpu byli vyřazeni ze studie.
Z hlediska komplikujících onemocnění 4 z 68 cvičících pacientů a 3 z 60 necvičících pacientů měli již před transplantací cukrovku a byli léčeni inzulinem. V době 4 týdnů před odběrem krevních a močových vzorků žádný pacient neměl projevy akutní infekce.
Všichni zařazení nemocní měli hodnotu funkce transplantované ledviny měřenou korigovanou clearancí kreatinu větší než 60 ml/min (1 ml/s). Pacienti s pozitivní anamnézou již proběhlých závažných kardiovaskulárních příhod (IM, MCP) byli z této studie vyřazeni a všichni sledovaní nemocní byli nekuřáci. Přítomná hypertenze byla léčena dle standardních postupů u nemocných po transplantaci ledviny včetně podávání ACE inhibitorů a blokátorů receptoru pro angiotenzin II. Při prokázané hyperlipidemii byly použity ve standardním postupu statiny. Nutriční a dietologickou intervenci provedla zkušená nutriční terapeutka standardním dotazníkem a opakovaným nutričním pohovorem u všech intervenovaných nemocných s užitím počítačového programu DIETA (IKEM Praha). Pacienti byli poučeni o doporučeném složení diety během své první návštěvy tak, aby příjem proteinů nepřesáhl hodnotu 1,2 g/kg/den a energie 30 kcal/kg/den během sledovaného údobí. Kontroly byly prováděny měsíčně v prvních 3 měsících po transplantaci a na konci sledování za 6 měsíců.
Hodnocení tělesné kondice a pravidelného cvičebního programu
Fyzická kondice byla hodnocena pomocí baterie motorických testů „Senior Fitness Tests – SFT“ (Rikli, Jones) spolu s kvalitou života hodnocenou standardizovaným dotazníkem HRQOL SF36-Bref. Výsledky na začátku a konci sledování byly srovnávány jak se zdravou populací (populační normy), tak v obou časových periodách v intervenovaném souboru a kontrolní skupině (pre-post testy). Výkonnostní cvičení sestávalo z fáze kontrolní a testové (1. měsíc), kontrolně edukační (kontrolované cvičení po dobu 3 měsíců) a pokračující individuální pohybové aktivitě (další 3 měsíce), a to převážně formou cyklických opakovaných cviků (stationary cycling). Každá cvičební aktivita trvala 1 hod a zátěž byla postupně individuálně zvyšována k dosažení požadovaného rozmezí cvičební zátěže. Po 3–5 min úvodního rozcvičení (warm-up) byla tak cvičební zátěž zvýšena až do srdeční frekvence 60–70 % dříve zjištěné hodnoty rozdílu mezi klidovým režimem a maximální individuální tolerovanou srdeční frekvencí. Tato zátěž trvala minimálně 40 min s následujícím 5minutovým uvolněním (cool-down). Frekvence cvičebního režimu s edukací byla během prvních 2 týdnů od zahájení cvičebně-edukačního programu 2krát týdně, v následujícím údobí 3krát týdně. Celý výcvik byl veden zkušenou fyzioterapeutkou pod dohledem lékaře. Pacienti byli po poučení a kontrole oprávněni provádět další tréninkový program doma, ale dodržování garantovaných školení muselo mít při kontrole více než 60% complianci.
Antropometrické vyšetření, odběry vzorků a clearancové metody
Antropometrické vyšetření pacientů byla provedena za bazálního stavu na začátku a na konci studie. Všichni pacienti byli standardně změřeni a zváženi s výpočtem BMI. Krevní vzorky pro stanovená měření byly odebrány v 1. měsíci po transplantaci při obnově funkce transplantované ledviny a za 6 měsíců po transplantaci. Funkce ledvin byla vyšetřena v clearancové laboratoři metabolického oddělení Kliniky nefrologie IKEM Praha za použití metodiky clearance inulinu/polyfruktosanu (Cin) a současně i korigované clearance kreatininu (Ckr) technikou se sběrem moči. Přesné měření Cin vyžaduje stabilní plazmatickou koncentraci inulinu pro odběry vzorků krve a moči během vyšetření. K zajištění adekvátní diurézy je nutné předchozí zavodnění 0,5–1,0 l vody 1 hod před začátkem vyšetření. Renální clearance inulinu byla měřena s plazmatickou hladinou inulinu mezi 20–30 mg/100 ml. Té bylo dosaženo počátečním podáním inulinu/polyfruktosanu i.v. v dávce vypočítané dle hmotnosti nemocného a jeho renální korigované clearance kreatininu s následující udržovací infuzí inulinu/polyfruktosanu. Po ekvilibrační periodě 60 min se vzorky krve a moči odebírají nai začátku, uprostřed a na konci dalšího 60minutového údobí. Korigovaná clearance kreatininu vyžaduje přesný sběr moči za 24 hod a 2 vzorky žilní krve na začátku a na konci sběrného období.
Biochemické analýzy
Pro stanovení ADMA byly krevní vzorky odebrány do vakuet s etylendiamintetraoctovou kyselinou a krev byla okamžitě centrifugována při 3 600 otáčkách a 3 G po dobu 5 min při 20 °C. Všichni pacienti byli na lačno po dobu nejméně 10 hod před odběrem vzorků, aby se zabránilo vlivu metioninu z potravy na koncentraci ADMA. ADMA byla stanovena metodou ELISA (Kit ADMA, ELISA, DLD Diagnostika GmbH, Hamburk, Německo) a AUTO--EIA II readeru (Labsystems Oy, Espoo, Finsko). Tato kompetitivní metoda používá mikrotitrační desky. ADMA je vázána na pevnou fázi a acetylovaná ADMA ve vzorcích kompetuje s navázanou ADMA s užitím králičího antiséra proti ADMA. Poté je vázaná protilátka detekována anti-králičí peroxidázou. Výsledný produkt této reakce je sledován při 450 nm. Množství protilátek je nepřímo úměrné koncentraci ADMA vzorku.
Stanovení adiponektinu (ADPN) bylo provedeno radioimunoesejí ze 2 vzorků krve po předchozím 12hodinovém lačnění (Human adiponektin RIA Kit, Dinco Research, Inc, St. Charles, MO, USA). Pro zhodnocení výsledků u obou skupin (cvičící a necvičící) bylo nutné měřit vzorky ve stejnou dobu. Sérový leptin a rozpustný/solubilní leptinový receptor (ObRe) byly měřeny komerční imunoesejí (Bio-Vendor, Praha, Česká republika).
Sérové koncentrace TNFα byly stanoveny s užitím adipokine LINCOplex kitu s Luminexem 200 (Linco Research). Sérová koncentrace C reaktivního proteinu (CRP) byla měřena vysoce senzitivním CRP ELISA kit (DSL, Oxon, UK). Sérový visfatin metodou ELISA (Bio Vision Research Products, Mountain View, USA).
Inulin (polyfruktosan S) byl analyzován metodou s antronem na spektrofotometru při vlnové délce 580 nm (Antelie Light Secoman, Domond Cedex, Francie). Celkový cholesterol, HDL-cholesterol a triglyceridy byly stanoveny pomocí enzymatické kolorimetrické metody na přístroji Olympus AU 600 (Olympus Diagnostics, GmbH, Hamburk, Německo). Hladina LDL-cholesterolu byla vypočtena z Friedewaldova vzorce. Sérové koncentrace inzulinu byly měřeny pomocí RIA (CisBio International, Lyon, Francie), glykovaného hemoglobinu (HbA1c) byly analyzovány pomocí kapalinové chromatografie na Tosoh HLC-723 G7 (Shiba, Minato-ku, Tokio, Japonsko) a proteinurie na 24 hod fotometricky s pyrogallolovou červení pomocí systému Olympus 800 (Hamburk, Německo).
Statistická analýza
Pro statistickou analýzu byl použit software SigmaStat (SPSS Inc, Chicago, IL, USA). Párový t-test a dvouvýběrový t-test byly použity pro porovnání výsledků u obou skupin pacientů. Výsledky byly považovány za statisticky významné při p < 0,05.
Výsledky
Základní klinické charakteristiky obou skupin pacientů po transplantaci ledviny jsou uvedeny v tab. 1.
Table 1. Klinické a laboratorní parametry v souboru transplantovaných nemocných. Skupina IA – cvičící pacienti před zahájením cvičebního programu, skupina IB – cvičící pacienti po 6 měsících cvičebního programu, skupina II – kontrolní skupina necvičících pacientů na konci sledování za 6 měsíců. 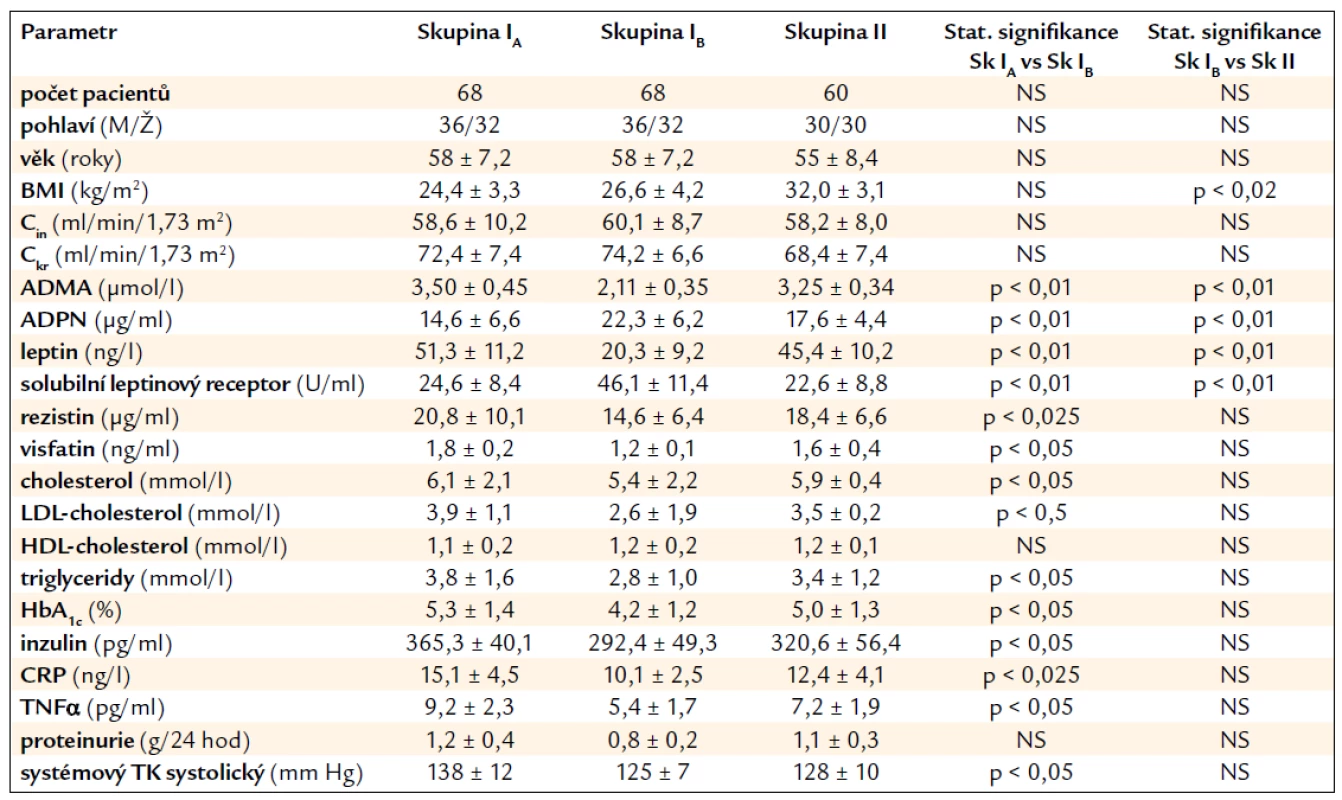
BMI – body mass index, ADPN – adiponektin, Cin – inulinová clearance, TNFα – tumor necrosis faktor α, Ckr – kreatininová clearance, CRP – C reaktivní protein, ADMA – asymetrický dimetylarginin, NS – nesignifikantní závislost. Výsledky vyjádřeny v hodnotách průměrů ± SD. Statistické hodnocení pomocí párového a dvou výběrového t-testu. Statistická signifikance p < 0,05. Skupiny se významně nelišily s ohledem na věk, pohlaví, HLA typizaci či imunosupresivní léčbu. V porovnání s kontrolní skupinou II měli pacienti ve skupině I po 6 měsících pravidelného cvičebního tréninku významně nižší sérové hladiny ADMA a leptinu. Naopak hladiny ADPN a rozpustného/solubilního leptinového receptoru byly zvýšeny (vše p < 0,01). Cvičební režim byl spojen s mírným, leč signifikantním snížením sérové hladiny rezistinu (p < 0,025) a visfatinu (p < 0,05). Snížily se i parametry prozánětlivých cytokinů (CRP p < 0,025 a TNFα p < 0,05). Současně bylo zaznamenáno i snížení některých parametrů lipidového a sacharidového metabolizmu (celkový cholesterol, LDL-cholesterol, triacylglyceroly, HbA1c a inzulinu, p < 0,05), zatímco hladiny HDL-cholesterolu zůstaly nezměněny. Cvičební režim neovlivnil proteinurii, ale systémový TK se mírně snížil (p < 0,05). Pohybový režim ovlivnil též snížení BMI (p < 0,02). Během 6 měsíců sledování se funkce ledvin měřená inulinovou a kreatininovou clearancí signifikantně nezměnila.
Obr. 1 zachycuje významné rozdíly v hladinách markerů endoteliální dysfunkce ve skupině I před (IA) a po 6 měsících (IB) pravidelného cvičení: pokles ADMA (p < 0,01), CRP (p < 0,025) a TNFα (p < 0,05) a zvýšení ADPN (p < 0,01).
Image 1. Plazmatické koncentrace ADMA, ADPN, CPR a TNFα ve skupině I na začátku (skupina I<sub>A</sub>) a na konci (skupina I<sub>B</sub>) 6měsíčního cvičebního programu. 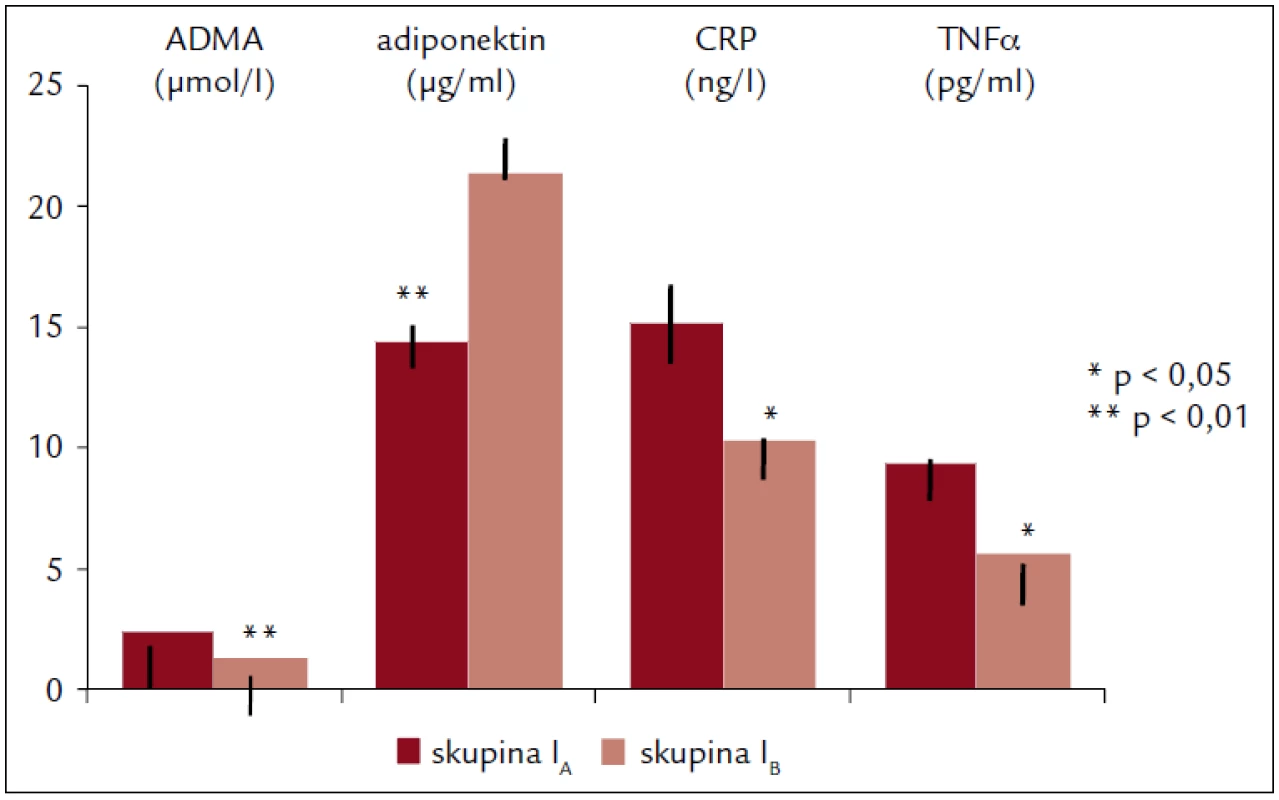
Diskuze
V předchozích studiích bylo prokázáno, že pravidelná aerobní fyzická aktivita vede u nemocných s ICHS a diabetem ke zlepšení na endotelu dependentní vazodilataci, a tím ke snížení kardiovaskulárního rizika nemocných. Vliv programu aerobního cvičení ale může být přechodný a jeho účinek zmizí s ukončením pravidelné fyzické aktivity [17]. Pravidelná tělesná aktivita pozitivně ovlivňuje přítomnou endoteliální dysfunkci i u nemocných s chronickým onemocněním ledvin a v dialyzačním programu [18–20]. Zvýšené kardiovaskulární riziko spojené se zvýšenou koncentrací ADMA zůstává i po úspěšné transplantaci ledviny. Nejčastější příčinou úmrtí po transplantaci ledviny jsou kardiovaskulární příhody a jejich riziko je mnohonásobně vyšší ve srovnání se zdravými osobami. Časná pohybová rehabilitace však toto riziko významně snižuje [21–24]. Bazální produkce NO je snížena u těchto pacientů stejně jako u nemocných s diabetem a na endotelu závislá vazodilatace v reakci na acetylcholin je podobná jako u zdravých kontrol [25]. Nedávná studie u nemocných s chronickou renální insuficiencí (CHRI) ukázala, že ADMA souvisí s bazální produkcí NO, ale není závislá na acetylcholinem indukované vazodilataci. Zvýšené hladiny ADMA v naší studii představují marker či mediátor snížené bazální produkce NO, kterou lze zlepšit aerobním cvičením. Zvýšení ADMA souvisí s vyšším rizikem vzniku akutních koronárních příhod u pacientů s ischemickou chorobou srdeční [26] a kardiovaskulárních příhod po perkutánní koronární intervenci [27]. U pacientů s diabetickou nefropatií je zvýšená ADMA spojena se zvýšenou prevalencí kardiovaskulárních příhod [28]. Naopak snížení ADMA pravidelným aerobním cvičením tak může přispět ke snižování kardiovaskulárního rizika u pacientů po transplantaci ledvin. Je zajímavé, že snížení hladiny ADMA bylo spojeno i se změnami v klasických rizikových faktorech metabolizmu lipidů a sacharidů. Navíc opětné zvýšení hladiny ADMA po ukončení cvičebního programu naznačuje, že je třeba dlouhodobé fyzické aktivity pro udržení nižšího kardiovaskulárního rizikového profilu [17]. Potvrzení předpokladu, že snížená koncentrace ADMA je spojena se sníženou kardiovaskulární morbiditou, vyžaduje proto delší sledování s klinickou kontrolou.
Na rozdíl od našich nálezů studie u pacientů s chronickým srdečním selháním ukazují, že hladina ADMA u těchto nemocných nemusí být vždy ovlivněna aerobním cvičením [29]. V této studii ale hladiny ADMA u pacientů i kontrol byly podobné před zahájením cvičebního programu, a tedy normální koncentrace ADMA již nebyla cvičením dále snižována. V lidském těle ADMA vzniká především metylací L-argininu metyltransferázami. Celková degradace ADMA dimetylaminohydrolázou (DDAH) významně determinuje zvýšení koncentrace ADMA, zatímco podíl degradace ledvinami je považován za méně důležitou cestu eliminace [30]. SDMA není metabolizován DDAH a je vylučován pouze ledvinami [31,32].
Mechanizmy účinku cvičení vedoucí ke snížení ADMA však nelze přímo uzavřít z výsledků naší studie. Není pravděpodobné, že změny ve funkci ledvin, které se rovněž týkaly ovlivnění endoteliální funkce [33], rozhodujícím způsobem vedly ke snížení ADMA v plazmě, protože inulinová a kreatininová clearance zůstaly v normálním rozmezí u pacientů po transplantaci a nelišily se na konci sledovaného údobí. Je pravděpodobné, že pravidelné aerobní cvičení může mít vliv i na antioxidační stav organizmu prostřednictvím zvýšené exprese superoxid dismutázy [34] a zlepšení antioxidačního statusu souvisí s redukcí ADMA. Studie in vitro prokázala, že glukóza může snížit činnost DDAH [35]. Nicméně, změny v metabolizmu sacharidů v naší studii byly jen na hranici statistické signifikance.
Pouze mírné zlepšení kompenzace diabetu je v souladu s předchozími výsledky ukazujícími, že tělesná aktivita neznamená automaticky zlepšení kompenzace diabetu u pacientů po transplantaci ledvin bez upravené diety [36]. Krevní lipidy se mírně zlepšily po 6měsíčním tréninku a také jejich spojení se změnami ADMA nelze vyloučit. Změny v ADMA však mohou být zcela nezávislé, jak bylo zjištěno v několika dalších studiích [36,37].
Studie u nemocných po transplantaci ledviny prokázaly, že s rozvojem funkce ledvin se původně vysoká koncentrace ADMA snižuje, ale tyto hodnoty zůstávají 2–3krát vyšší ve srovnání se netransplantovanými jedinci se stejnou úrovní glomerulární filtrace. U pacientů po transplantaci užívajících dlouhodobě imunosupresi můžeme uvažovat o vlivu těchto léků především s ohledem na jejich vedlejší metabolický účinek (inzulinová rezistence se sníženou aktivitou DDAH po podání steroidů) [38].
Protokol studie nedovolil srovnat účinky cyklosporinu A a takrolimu. Dřívější údaje naznačují, že inhibitory kalcineurinu mohou vyvolat endoteliální dysfunkce u pacientů po transplantaci ledvin, pravděpodobně potlačením syntézy NO [38]. Podle našich výsledků hladiny ADMA byly signifikantně vyšší u obézních pacientů po transplantaci ledvin, ačkoli imunosupresivní režimy byly srovnatelné v obou skupinách. Pravděpodobné vysvětlení souvisí s významnými rozdíly v tukové hmotě spojené se zvýšenou tvorbou adipocytokinů [39]. Vývoj proteinurie po transplantaci ledvin také částečně souvisí s endoteliální dysfunkcí pří zvýšené úrovni ADMA. Obezita a redukce hmotnosti byly spojeny se změnami funkce endotelu [40]. Klinické studie prokázaly snížení NO-dependentní vazodilatace u obézních osob ve srovnání s osobami neobézními. Je proto možné, že zvýšené koncentrace ADMA by mohly přispět k rozvoji endoteliální dysfunkce u obezity [38]. Vliv předepsané diety nelze zcela vyloučit jako důvod pro zvýšení ADMA. Nicméně zvýšený příjem sacharidů je spojen se snížením koncentrace ADMA, zatímco vliv příjmu bílkovin a tuků na ADMA nebyl prokázán [41].
Vliv antihypertenzivní léčby na hladiny ADMA není dosud zcela objasněn. Dlouhodobá léčba s užitím ACE inhibitorů vedla ke snížení plazmatické koncentrace ADMA. Vyloučení pacientů s antihypertenzní léčbou ze statistického hodnocení však nezměnilo výsledky, a nemělo tak významný vliv na ovlivnění hladiny ADMA [42]. Vliv na zvýšené riziko kardiovaskulárního onemocnění u nemocných v CHRI a po transplantaci ledviny mohou mít i další faktory. CHRI je často spojeno s vyšší plazmatickou hladiny adiponektinu. Důvody pro toto zvýšení nejsou zcela jasné, lze však předpokládat roli porušené metabolické degradace. Po úspěšné transplantaci ledvin hladina adiponektinu může mírně klesat, což podporuje představu o podílu ledvin na jeho biodegradaci a eliminaci [15,43]. Jasná korelace mezi změnou funkce ledviny a snížení plazmatického adiponektinu nebyla v naší studii prokázána. Tyto údaje podporují názor, že hladinu adiponektinu ovlivňují další faktory, především obsah tukové tkáně a přítomnost chronického zánětu [44]. Snížení zánětlivých parametrů po transplantaci i v souvislosti s cvičebním režimem by tak mohlo ovlivnit hladinu ADPN [45].
U leptinu jsme zjistili jeho pokles po cvičebním režimu se současným zvýšením hladin solubilního leptinového receptoru.
Rezistin byl původně objeven v tukových buňkách a jeho hladina byla zvýšena při obezitě. Jeho významná role však může být v jeho prozánětlivých účincích [46]. Jeho pokles v naší studii mohl souviset s poklesem prozánětlivých markerů po pravidelném cvičení.
Visfatin je novým adipocytokinem, který je zvýšen ve viscerálních tukových buňkách. Visfatin má kromě energetického metabolizmu svoji roli v přirozené imunitě a zánětu. V poslední několika letech byl objeven jeho prozánětlivý až tkáň destruktivní účinek [47]. Jeho pokles by mohl souviset se snížením celkové prozánětlivé aktivity po pravidelném cvičení.
Limitem naší studie je nemožnost srovnání výsledků cvičení u nemocných s CHRI a u transplantovaných nemocných bez imunosupresivní léčby. Také role obezity ve skupině necvičících nemocných nebyla podrobněji analyzována. Soubor nemocných po transplantaci ledviny byl heterogenní z hlediska základní diagnózy ledvinového selhání (diabetes mellitus v 7 případech). Naši pacienti neměli klinické projevy závažné aterosklerózy a vztahy mezi ADMA a kardiovaskulární morbiditou byly popsány především u pacientů s manifestním cévním onemocněním. Je tedy zřejmé, že cvičení může snížit ADMA po transplantaci ledvin především u kardiovaskulárních pacientů. Kromě toho není v současné době známo, zda ADMA může být dále snížena u jinak zdravých osob nebo je-li snížení pod normální hodnoty výhodné pro endoteliální funkci.
Závěr
Závěry studie lze shrnout tak, že u pacientů po transplantaci ledviny pravidelná fyzická aktivita po dobu 6 měsíců snížila zvýšené koncentrace ADMA a dalších rizikových faktorů pro rozvoj kardiovaskulárního onemocnění. Snížení hladiny ADMA by tak mohlo snížit kardiovaskulární riziko těchto pacientů. Získané výsledky však musí být ještě potvrzeny v dlouhodobých studiích kardiovaskulárních komplikací po transplantaci ledviny.
Studie byla podpořena grantem NS/10518-3//2009 uděleným Interní grantovou agenturou České republiky.
Autoři jsou zavázáni paní V. Kuncové za technickou pomoc.
prof. MUDr. Vladimír Teplan, DrSc.
www.ikem.cz
e-mail: vladimir.teplan@ikem.cz
Doručeno do redakce: 30. 3. 2012
Přijato po recenzi: 9. 5. 2012
Sources
1. Kielstein JT, Böger RH, Bode-Böger SM et al. Marked increase of asymmetric dimethylarginine in patients with incipient primary chronic renal disease. J Am Soc Nephrol 2002; 13 : 170–176.
2. Cooke JP. Asymmetrical dimethylarginine: the Uber marker? Circulation 2004; 109 : 1813–1818.
3. Zoccali C, Kielstein J. Asymmetric dimethylarginine: a new player in the pathogenesis of renal disease? Curr Opin Nephrol Hypertens 2006; 15 : 314–320.
4. Krzyzanowska K, Mittermayer F, Kopp HP et al. Weight loss reduces circulating asymmetrical dimethylarginine concentrations in morbidity obese women. J Clin Endocrinol Metab 2004; 89 : 6277–6281.
5. Meier-Kriesche HV, Arndorfer JA, Kaplan B. The impact of body mass index on renal transplant outcomes: a significant independent risk factor for graft failure and patient death. Transplantation 2002; 73 : 70–74.
6. Boots JM, Christiaans MH, van Hooff JP. Effect of immunosuppressive agents on long-term survival of renal transplant recipients: focus on the cardiovascular risk. Drugs 2004; 64 : 2047–2073.
7. Axelsson J, Heimbürger O, Lindholm B et al. Adipose tissue and its relation to inflammation: the role of adipokines. J Ren Nutr 2005; 15 : 131–136.
8. Zoccali C, Mallamaci F, Tripepi G. Adipose tissue as a source of inflammatory cytokines in health and disease: focus on end-stage renal disease. Kidney Int 2003; 63 (Suppl 84): S65–S68.
9. de Mattos AM, Prather J, Olyaei AJ et al. Cardiovascular events following renal transplantation: role of traditional and transplant-specific risk factors. Kidney Int 2006; 70 : 757–764.
10. Fazelzadeh A, Mehdizadeh A, Ostovan MA et al. Incidence of cardiovascular risk factors and complications before and after kidney transplantation. Transplant Proc 2006; 38 : 506–508.
11. Yilmaz MI, Saglam M, Caglar K et al. Endothelial functions improve with decrease in asymmetric dimethylarginine (ADMA) levels after renal transplantation. Transplantation 2005; 80 : 1660–1666.
12. el-Agroudy AE, Wafa EW, Gheith OE et al. Weight gain after renal transplantation is a risk factor for patients and graft outcome. Transplantation 2004; 77 : 1381–1385.
13. Weisberg SP, McCann D, Desai M et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003; 112 : 1796–1808.
14. Haluzik M, Parizkova J, Haluzik MM. Adiponectin and its role in the obesity-induced insulin resistance and related complications. Physiol Res 2004; 53 : 123–129.
15. Chudek J, Adamczak M, Karkoszka H et al. Plasma adiponectin concentration before and after successful kidney transplantation. Transplant Proc 2003; 35 : 2186–2189.
16. Armstrong KA, Campbell SB, Hawley CM et al. Obesity is associated with worsening cardiovascular risk factor profiles and proteinuria progression in renal transplant recipients. Am J Transplant 2005; 5 : 2710–2718.
17. Mittermayer F, Pleiner J, Krzyzanowska K et al. Regular physical exercise normalizes elevated asymmetrical dimethylarginine concentrations in patients with type 1 diabetes mellitus. Wien Klin Wochenschr 2005; 117 : 816–820.
18. Fuhrmann I, Krause R. Principles of exercising in patients with chronic kidney disease, on dialysis and for kidney transplant recipients. Clin Nephrol 2004; 61 (Suppl 1): S14–S25.
19. Painter P, Carlson L, Carey S et al. Physical functioning and health-related quality of life changes with exercise training in hemodialysis patients. Am J Kidney Dis 2000; 35 : 482–492.
20. Mahrova A, Švagrová K, Bunc V et al. Fyzická a psychická kondice u jedinců po transplantaci ledviny – význam časné pohybové intervence. Aktual Nefrol 2011; 17 : 30–40.
21. Painter PL, Tomlanovich SL, Hector LA et al. A randomized trial of exercise training after renal transplantation. Transplantation 2002; 74 : 42–48.
22. Korabiewska L, Lewandowska M, Juskowa J et al. Need for rehabilitation in renal replacement therapy involving allogenetic kidney transplantation. Transplant Proc 2007; 39 : 2776–2777.
23. Mahrová A, Bunc V, Panáček V et al. Exercise rehabilitation during haemodialysis – clinical experience. Aktual Nefrol 2009; 15 : 16–24.
24. McLaughlin T, Stühlinger M, Lamendola C et al. Plasma asymmetric dimethylarginine concentrations are elevated in obese insulin-resistant women and fall with weight loss. J Clin Endocrinol Metab 2006; 91 : 1896–1900.
25. Wiecek A, Kokot F, Chudek J et al. The adipose tissue: a novel endocrine organ of interest to the nephrologist. Nephrol Dial Transplant 2002; 17 : 191–195.
26. Valkonen VP, Päivä H, Salonen JT et al. Risk of acute coronary events and serum concentration of asymmetrical dimethylarginine. Lancet 2001; 358 : 2127–2128.
27. Lu TM, Ding YA, Lin SJ et al. Plasma levels of asymmetrical dimethylarginine and adverse cardiovascular events after percutaneous coronary intervention. Eur Heart J 2003; 24 : 1912–1919.
28. Tarnow L, Hovind P, Teerlink T et al. Elevated plasma asymmetric dimethylarginine as a marker of cardiovascular morbidity in early diabetic nephropathy in type 1 diabetes. Diabetes Care 2004; 27 : 765–769.
29. Niebauer J, Clark AL, Webb-Peploe KM et al. Home-based exercise training modulates pro--oxidant substrates in patients with chronic heart failure. Eur J Heart Fail 2005; 7 : 183–188.
30. Achan V, Broadhead M, Malaki M et al. Asymmetric dimethylarginine causes hypertension and cardiac dysfunction in humus and is actively metabolized by dimethylarginine dimethylaminohydrolase. Arterioscler Thromb Vasc Biol 2003; 23 : 1455–1459.
31. Ogawa T, Kimoto M, Sasaoka K. Purification and properties of a new enzyme, NG, NG-dimethylarginine dimethylaminohydrolase, from rat kidney. J Biol Chem 1989; 264 : 10205–10209.
32. Kimoto M, Tsuji H, Ogawa T et al. Detection of NG, NG-dimethylarginine dimethylaminohydrolase in the nitric oxide-generating systems of rats using monoclonal antibody. Arch Biochem Biophys 1993; 300 : 657–662.
33. Zaletel J, Cerne D, Lenart K et al. Renal functional reserve in patients with Type 1 diabetes mellitus. Wien Klin Wochenschr 2004; 116 : 246–251.
34. Fukai T, Siegfried MR, Ushio-Fukai M et al. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. J Clin Invest 2000; 105 : 1631–1639.
35. Lin KY, Ito A, Asagami T et al. Impaired nitric oxide synthase pathway in diabetes mellitus: role of asymmetric dimethylarginine and dimethylarginine dimethylaminohydrolase. Circulation 2002; 106 : 987–992.
36. Mittermayer F, Mayer BX, Meyer A et al. Circulating concentrations of asymmetrical dimethyl-L-arginine are increased in women with previous gestational diabetes. Diabetologia 2002; 45 : 1372–1378.
37. Päivä H, Lehtimäki T, Laakso J et al. Plasma concentrations of asymmetric-dimethyl-arginine in type 2 diabetes associate with glycemic control and glomerular filtration rate but not with risk factors of vasculopathy. Metabolism 2003; 52 : 303–307.
38. Valkonen VP, Laakso J, Päivä H et al. Asymmetrical dimethylarginine (ADMA) and risk of acute coronary events. Does statin treatment influence plasma ADMA levels? Atheroscler 2003; 4 : 19–22.
39. Teplan V, Malý J, Gürlich R et al. Muscle and fat metabolism in obesity after kidney transplantation: no effect of peritoneal dialysis or hemodialysis. J Ren Nutr 2012; 22 : 166–170.
40. Oflaz H, Turkmen A, Kazancioglu R et al. The effects of calcineurin inhibitors on endothelial function in renal transplant recipients. Clin Transplant 2003; 17 : 212–216.
41. Sciacqua A, Candigliota M, Ceravolo R et al. Weight loss in combination with physical activity improves endothelial dysfunction in human obesity. Diabetes Care 2003; 26 : 1673–1678.
42. Päivä H, Lehtimäki T, Laakso J et al. Dietary composition as a determinant of plasma asymmetric dimethylarginine in subject with mild hypercholesterolemia. Metabolism 2004; 53 : 1072–1075.
43. Ito A, Egashira K, Narishige T et al. Renin--angiotensin system is involved in the mechanism of increased serum asymmetric dimethylarginine in essential hypertension. Jpn Circ J 2001; 65 : 775–778.
44. Havel PJ. Control of energy homeostasis and insulin action by adipocyte hormones: leptin, acylation stimulating protein and adiponectin. Curr Opin Lipidol 2002; 13 : 51–59.
45. Stenvienkel P, Marchlewska A, Pecoits-Filho R et al. Adiponectin in renal disease: relationship to phenotype and genetic variation of the gene encoding adiponectin. Kidney Int 2004; 65 : 274–281.
46. Sharma AM, Chettey VT. Obesity, hypertension and insulin resistance. Acta Diabetol 2005; 42 (Suppl 1): S3–S8.
47. Senolt L, Krystufkova O, Hulejova H. The level of serum visfatin (PBEF) is associated with total number of B cells in patients with rheumatoid arthritis and decreases following B cell depletion therapy. Cytokine 2011; 55 : 116–121.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 9-
All articles in this issue
- Srovnání dvou metod dlouhodobého externího telemonitorování EKG po ablaci fibrilace síní
- Časný pohybový režim snižuje asymetrický dimetylarginin po transplantaci ledviny
- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Léková compliance – úskalí terapie revmatoidní artritidy?
- Peripartální život ohrožující krvácení – mezioborové konsenzuální stanovisko
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Nádor srdce manifestující se náhlou srdeční smrtí
- Naše zkušenosti s léčbou multicentrické plazmocelulární Castlemanovy choroby s projevy vaskulitidy – popis případu a přehled literatury
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

