-
Medical journals
- Career
Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
Authors: K. Gazdíková 1; †f. Gazdík 2; I. Kajaba 1; D. Hučková 3; D. Daniš 4; Ľ. Okruhlica 5
Authors‘ workplace: Fakulta ošetrovateľstva a zdravotníckych odborných štúdií Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 1; Oddelenie imunológie a imunotoxikológie Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 2; HPL spol. s r. o., Bratislava, Slovenská republika, riaditeľ MUDr. Juraj Hanzen 3; Ústav patológie Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 4; Inštitút drogových závislostí, Centrum pre liečbu drogových závislostí Bratislava, Slovenská republika, riaditeľ MUDr. Ľubomír Okruhlica, PhD. 5
Published in: Vnitř Lék 2012; 58(2): 104-109
Category: Original Contributions
Overview
Úvod:
Drogovo závislí jedinci (IDUs) predstavujú najrizikovejšiu skupinu pacientov z hľadiska hepatitídy C. Cieľom sledovania bolo vyhodnotiť trvalú virologickú odpoveď (SVR) na štandardnú liečbu pegylovaným interferónom-α a ribavirínom u bývalých IDUs s chronickou vírusovou hepatitídou C (CHC).Pacienti a metódy:
Z 293 doteraz neliečených (naivných) bývalých IDUs s CHC, u ktorých sme zahájili liečbu, sme vyhodnotili 239 (69 žien, 170 mužov) s priemerným vekom 27 rokov, ktorí ukončili liečbu a absolvovali aj follow-up vyšetrenie po 24 týždňoch liečby (kritérium SVR). Kritériom CHC bolo trvanie infekcie ≥ 6 mesiacov, potvrdené intermitentne/trvale zvýšenými hodnotami aminotransferáz (ALT), virologickým nálezom (protilátky anti-HCV, HCV RNA pozitivita, genotyp) a histologickým nálezom, ak biopsia pečene nebola kontraindikovaná. Do liečby boli zaradení pacienti s minimálne 6-mesačnou abstinenciou užívania drog. Na virologickú diagnostiku sa použili štandardné diagnostické metódy. Pacienti boli liečení kombinovanou imunomodulačnou liečbou v štandardnej dľžke a v štandardnom dávkovacom režime. Kritériom posúdenia SVR bol negatívny nález HCV RNA 24 týždňov od ukončenia liečby.Výsledky:
Na konci liečby odpovedalo 224 pacientov (94 %). SVR sme zaznamenali u 227/95 % pacientov. Pacienti s genotypom 3 odpovedali v 98 % (147 pacientov) a s genotypom 1 v 90 % (80 pacientov). Počas liečby došlo k štatisticky signifikantnému poklesu ALT. Liečba bola sprevádzaná očakávanými vedľajšími účinkami.Záver:
Faktory podieľajúce sa na účinnosti liečby boli: včasný záchyt infekcie u mladej populácie bývalých IDUs; prevaha genotypu 3; nízky stupeň fibrózy a optimálna adherencia k terapii.Kľúčové slová:
chronická hepatitída C – pegylovaný interferón-α – ribavirín – drogovo závislí jedinciÚvod
Celosvetovo je približne 170–200 miliónov jedincov infikovaných vírusom hepatitídy C (HCV), čo predstavuje asi 3 % celosvetovej populácie. Vysoká prevalencia od 40–70 % sa vyskytuje v industrializovaných krajinách sveta, predovšetkým v rizikovej skupine drogovo závislých jedincov (IDUs). Podobná situácia je aj na Slovensku s výskytom HCV infekcie v tejto rizikovej skupine v 25–40 % [1–3]. Riziko infekcie spočíva v progresii akútnej hepatitídy do chronickej v 50–85 %, s rizikom vývoja ireverzibilného poškodenia pečene – cirhózy a rakoviny pečene v priebehu niekoľkých desiatok rokov [4,5]. V USA chronická HCV infekcia a jej komplikácie sú najčastejšiu indikáciou transplantácie pečene [6].
Od roku 1989, kedy bol po prvýkrát identifikovaný HCV, vývoj antivírusovej liečby zaznamenal 3 významné etapy. Poslednou je zavedenie pegylovaného interferónu-α (PEG-IFN-α) 2a a 2b v kombinácii s ribavirínom (R), ktorá doposiaľ predstavuje najefektívnejší spôsob a „zlatý“ štandard liečby chronickej hepatitídy C (CHC).
Ciele klinického sledovania
Cieľom klinického sledovania bolo vyhodnotiť biochemickú a trvalú virologickú odpoveď (sustained virological response – SVR) u bývalých IDUs s CHC, liečených na našej ambulancii PEG-IFN-α-2a a 2b s R.
Pacienti a metódy
Na Oddelení imunológie a imunotoxikológie Slovenskej zdravotníckej univerzity sme v rokoch 2002–2008 zahájili u 293 bývalých IDUs s CHC kombinovanú imunomodulačnú liečbu PEG-IFN-α a R. Päťdesiati štyria pacienti neabsolvovali kompletné vyšetrenia na vyhodnotenie SVR. Dvaja pacienti (1 %) museli predčasne ukončiť liečbu z dôvodu nežiaducich účinkov – u jedného sa jednalo o ťažkú trombocytopéniu s prejavmi krvácania a u jednej došlo k manifestácii reumatoidnej artritídy s nutnosťou terapie. Osemnásti (6 %) pacienti neukončili liečbu pre nespoluprácu a 34 (11 %) sa nedostavilo na vyšetrenie po 1/2 roku od ukončenia liečby, čím nebolo možné vyhodnotiť SVR.
Indikačnými kritériami pre zaradenie do liečby boli abstinencia od drog minimálne 6 mesiacov, potvrdená psychiatrom a opakovanými negatívnymi vyšetreniami moču, pozitívny virologický nález ribonukleovej kyseliny vírusu hepatitídy C (HCV RNA) v sére, stanovený genotyp, pozitivita protilátok proti vírusu hepatitídy C (anti-HCV) pred zahájením liečby, intermitentne alebo trvale zvýšená aktivita aminotransferáz v sére (ALT) počas posledných 6 mesiacov, absencia závažných onkologických, kardiovaskulárnych, neurologických a psychiatrických (ťažké depresívne syndrómy) chorôb. Ďalšou podmienkou bolo, u pacientov bez kontraindikácií, vykonanie biopsie pečene s histologickým vyhodnotením.
Celkovo sme vyhodnotili efektivitu liečby u 239 naivných bývalých IDUs [69 žien (Ž), 170 mužov (M)] s CHC s priemerným vekom 27 rokov (od 17 do 50 rokov), ktorí kompletne ukončili štandardnú kombinovanú imunomodulačnú liečbu a absolvovali aj follow-up vyšetrenie na vyhodnotenie SVR po 24 týždňoch od ukončenia liečby. Genotyp 3 bol stanovený u 150/63 % (43 Ž, 107 M) a genotyp 1 u 89/37 % (26 Ž, 63 M) (tab. 1). Zo 182 (76 %) pacientov (127/70 % M; 55/30 % Ž) liečených PEG-IFN-α-2a s R bol genotyp 1 stanovený u 69 (38 %) a genotyp 3 u 113 (62 %), pričom u jednej pacientky s genotypom 3 sa jednalo o koinfekciu s vírusom hepatitídy B. Z 57 (24 %) pacientov liečených PEG-IFN-α-2b s R bolo 43 mužov (75 %) a 14 žien (25 %), u 20 (35 %) bol stanovený genotyp 1 a u 37 (65 %) genotyp 3.
Table 1. Charakteristika súboru. 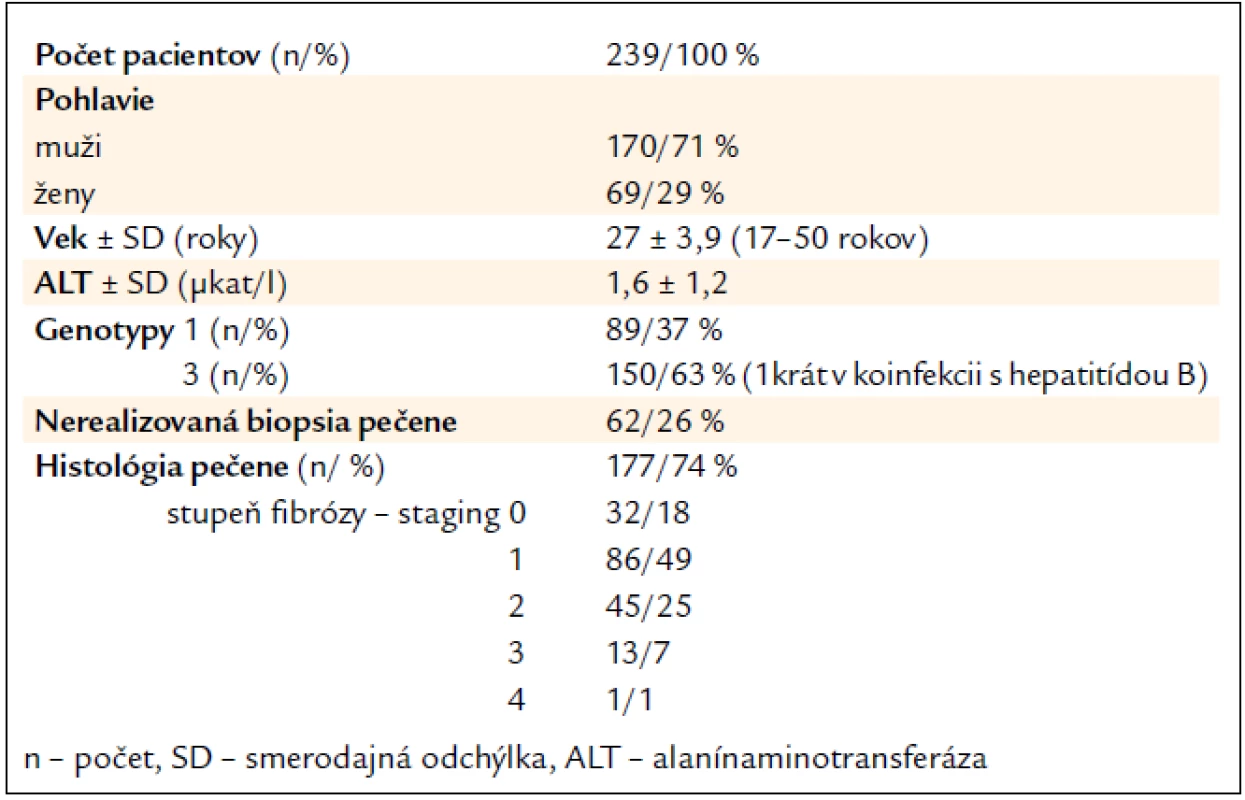
Biopsia pečene bola po vylúčení kontraindikácií realizovaná u 177 pacientov (74 %), z čoho stupeň fibrózy (Staging – S), hodnotený podľa systému Ishaka et al, S0 bol u 32 (18 %), S1 u 86 (49 %), S2 u 45 (25 %), S3 u 13 (7 %) a S4 iba u 1 (1 %) pacienta (tab. 1) [7]. Vo vyhodnotenom súbore nebola zistená pokročilá septálna fibróza (S5) ani cirhóza (S6). U 60 (25 %) bola biopsia pečene kontraindikovaná a u 2 (1 %) sa aj napriek opakovaným pokusom nepodarilo získať reprezentatívnu vzorku pečene. Počas biopsií pečene, ani po nich, neboli zaznamenané žiadne komplikácie.
Najviac liečených pacientov bolo vo veku 26–30 rokov (117/49 %), nasledovali 21–25-roční (70/29 %). Na druhej strane iba do 1 % boli pacienti vyšších vekových skupín 46–50-roční (1/0,5 %) a 41–45-roční (2/1 %) (tab. 2).
Table 2. Charakteristika pacientov podľa vekového rozloženia. 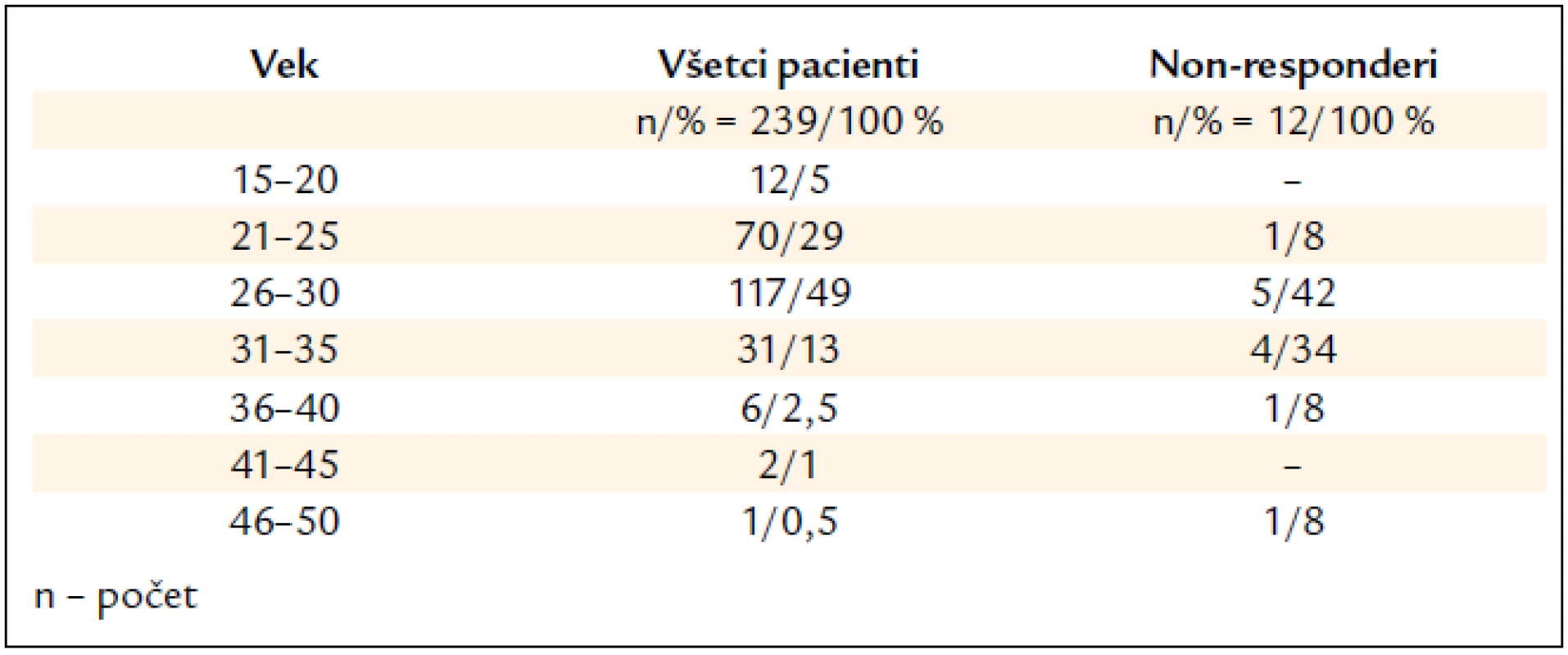
Liečba a sledované parametre
Pred začiatkom liečby boli pacienti písomne, ako aj ústne informovaní o dĺžke liečby, dávkovacom režime, nežiaducich účinkoch liečby a o spôsobe monitorovania bezpečnosti liečby. Každý zo zaradených pacientov podpísal „Informovaný súhlas“.
Pacienti s genotypom 3 absolvovali 24-týždňovú liečbu PEG-IFN-α + R a pacienti s genotypom 1 48-týždňovú liečbu. Dávkovanie PEG-IFN-α 2a a 2b (prípravky Pegasys inj. à 180 μg, Hoffmann-La Roche, Švajčiarsko, PegIntron inj. od 80–150 μg, 1,5 μg/kg//týždeň, Schering Plough, USA) bolo 1-krát týždenne subkutánne a R v dennej dávke od 800–1 200 mg v závislosti od hmotnosti pacienta (Copegus tbl. à 200 mg, Hoffmann-La Roche, Rebetol tbl. à 200 mg, Schering Plough, USA). Za SVR sa považoval negatívny virologický nález v sére (nedetegovateľná HCV RNA PCR metódou) 24 týždňov od ukončenia liečby. Aktivita ALT (μkat/l) sa stanovovala pred začiatkom liečby, v 12. týždni, na konci liečby a 24 týždňov od ukončenia liečby.
Virologický nález (kvalitatívne testy na dôkaz HCV RNA) sme sledovali pred začiatkom liečby, po 12. týždni (EVR – early virological response), na konci (ETVR – end-of-treatment virological response) a 24 týždňov od ukončenia liečby (SVR). Bezpečnosť liečby sme zabezpečovali pravidelným podrobným monitorovaním klinického a laboratórneho nálezu (krvný obraz, diferenciálny rozpočet leukocytov).
Virologické metódy
Protilátky anti-HCV boli vyšetrené ELISA metódou (anti-HCV – Innotest HCV Ab IV, Innogenetics, Belgicko). Kvalitatívny dôkaz HCV bol vykonaný metódou polymerázovej reťazovej reakcie (PCR metódou; Cobas, Hoffmann La Roche, Švajčiarsko), genotyp bol stanovený metódou Versant HCV genotype Assay (LiPA), Bayer HealthCare, USA probova hybridizácia alebo Linear Array HCV genotyping test, Roche, Nemecko.
Biochemické a hematologické metódy
Aktivita ALT a parametre krvného obrazu (erytrocyty, hemoglobín, leukocyty, trombocyty, diferenciálny rozpočet leukocytov) boli stanovené štandardnými metódami v laboratóriách Slovenskej zdravotníckej univerzity.
Biopsia pečene
Pred vykonaním biopsie pečene pacienti absolvovali podrobné interné predoperačné vyšetrenie na zistenie prípadných kontraindikácií k výkonu. Vzorky boli vyhodnotené v Ústave patológie Slovenskej zdravotníckej univerzity s histologickým vyhodnotením podľa skórovacieho systému vypracovaného Ishakom et al [7].
Štatistické spracovanie
Výsledky boli spracované párovým t-Studentovým testom.
Výsledky
Virologická odpoveď
Po 12. týždni a na konci liečby odpovedalo negatívnym HCV RNA nálezom 206/86 %, respektíve 224/94 % pacientov (graf 1). Celková SVR bola zaznamenaná u 227/95 % pacientov, pričom pacienti s genotypom 3 odpovedali v 98 % (147 pacientov) a s genotypom 1 v 90 % (80 pacientov) (graf 1).
Graph 1. Stanovenie HCV RNA počas kombinovanej imunomodulačnej liečby PEG-IFN-α + R (n = 239). EVR (early virological response) – počet pacientov HCV RNA negatívnych po 12. týždni liečby, ETVR (end-of-treatment virological response) – počet pacientov HCV RNA negatívnych na konci liečby, SVR (sustained virological response) – počet pacientov HCV RNA negatívnych po 24 týždňoch od skončenia liečby 
Stopäťdesiatsedem (86 %) pacientov liečených PEG-IFN-α-2a s R dosiahlo EVR, 170 (93 %) ETVR a 173 (95 %) SVR. Porovnateľné výsledky boli zistené aj u pacientov liečených PEG-IFN-α-2b s R EVR dosiahlo 49 pacientov (86 %), ETVR a SVR 54 (95 %) pacientov.
Napriek tomu, že v súčasnosti patrí k štandardu diagnostiky pri genotype 1 aj kvantitatívne vyšetrenie vírusu pred liečbou a následne po 12 týždňoch liečby, ako podklad pre ďalšie rozhodovanie sa o terapeutickom postupe, v našom súbore máme tieto údaje len u časti pacientov, nakoľko v prvých rokoch sledovania nepatrili tieto vyšetrenia k štandardom. Kvantitatívne vyšetrenie bolo stanovené u 1/3 pacientov s genotypom 1 (26 pacientov). Priemerná vírusová nálož bola 2 867 946 IU/ml (102 000–12 530 000 IU/ml). U ďalších 10 pacientov bola semikvantitatívne vyhodnotená vysoká HCV RNA pozitivita. U non-responderov bola stanovená vírusová nálož iba u 2 (120 000 IU/ml; 663 000 IU/ml).
Aktivita ALT (μkat/l)
Po 12. týždni liečby signifikantne poklesla sérová aktivita ALT (1,60 μkat/l vs 0,64 μkat/l, p < 0,05) a na konci liečby sa upravila do referenčného rozmedzia (1,60 μkat/l vs 0,52 μkat/l, p < 0,05) (tab. 3).
Table 3. Vplyv kombinovanej imunomodulačnej liečby PEG-IFN-α + R na aktivitu ALT a parametre krvného obrazu (n = 239). 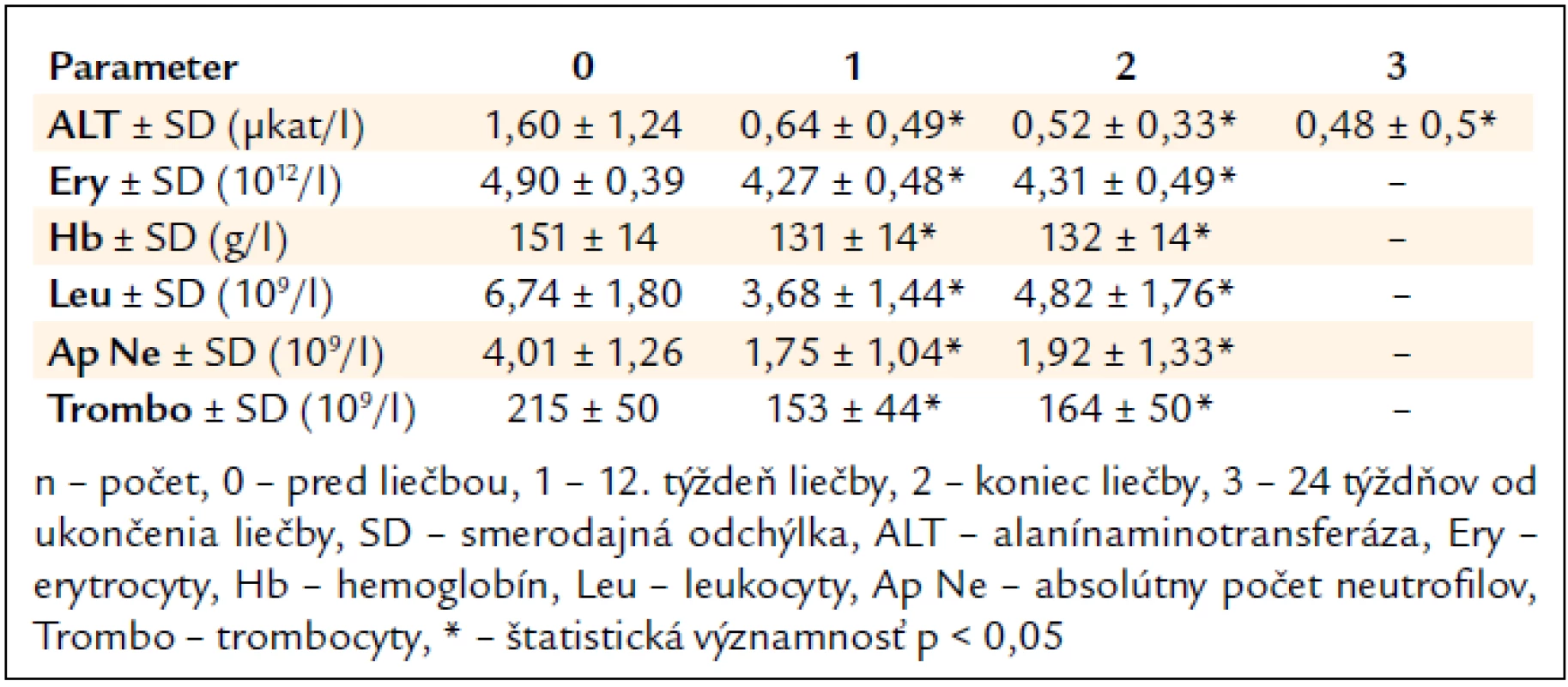
Vedľajšie účinky
Najčastejšími očakávanými vedľajšími účinkami liečby boli flu-like syndróm u 203 pacientov (85 %), gastrointestinálne ťažkosti (nechutenstvo, hnačky, dyspepsia, úbytok hmotnosti) u 191 (80 %), neuropsychiatrické ťažkosti (nervozita, depresie, agresivita) u 88 (37 %) a kožné prejavy (suchá koža, ekzém) u 43 pacientov (18 %). V laboratórnom náleze sme zaznamenali signifikantný pokles parametrov krvného obrazu (tab. 3).
Tab. 4 sumarizuje hlavné pozitívne prediktívne faktory SVR, ktoré sme zaznamenali v analyzovanom súbore pacientov (tab. 4).
Table 4. Prediktívne faktory ovplyvňujúce trvalú virologickú odpoveď na kombinovanú imunomodulačnú liečbu PEG-IFN-α + R u 239 bývalých IDUs. 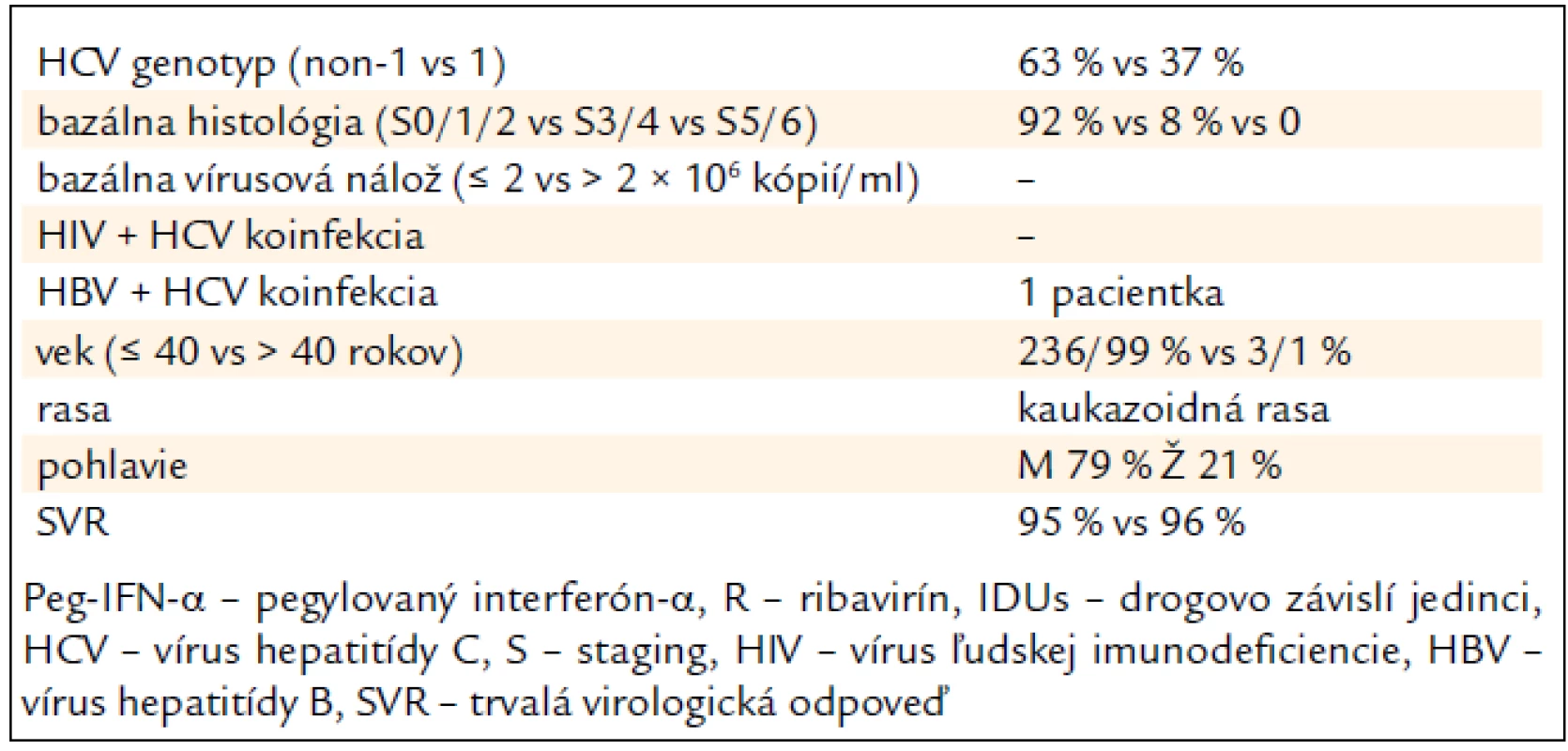
Non-responderi
V skupine 12 non-responderov (5 %) boli 3 ženy a 9 mužov, u 3 bol stanovený genotyp 3, u ostatných 1. Piati pacienti (42 %) boli vo veku 26–30 rokov (4/42 %) a štyria (34 %) 31–35 rokov, najmladší mal 25 rokov a na liečbu neodpovedala aj najstaršia 50-ročná pacientka (tab. 2). U non-responderov bola biopsia pečene realizovaná u 10 (83 %) a z toho po 1 pacientovi (10 %) bola zistená S0, S3, S4; S1 u 3 (30 %), S2 u 4 (40 %) pacientov. U non-respoderov, rovnako ako v celom našom súbore, prevažovali pacienti (7/80 %) s nízkym stupňom fibrózy S0–S2.
Pokles biochemickej aktivity ALT bol zaznamenaný štatisticky významný iba po 12 týždňoch liečby (2,3 μkat/l vs 0,78 μkat/l, p < 0,5), na konci liečby, rovnako ako 6 mesiacov od ukončenia liečby, sa hodnoty ALT štatisticky významne nelíšili (0,81 μkat/l, resp. 1,99 μkat/l).
EVR bola v tejto skupine zaznamenaná u 4 (34 %), ETVR u 7 (58 %) pacientov. Z 9 pacientov s genotypom 1 iba u jedného (1 %) bola dosiahnutá EVR a u 5 (56 %) ETVR.
Diskusia
Už niekoľko rokov sa intenzívne študujú prediktívne faktory, ovplyvňujúce efektivitu liečby HCV infekcie. Je nepochybné, že na účinnosti liečby sa podieľajú ako faktory vírusu, tak aj faktory hostiteľského organizmu [8].
V USA a v krajinách západnej Európy v najrizikovejšej skupine IDUs dominuje genotyp 1 nad genotypom 3, avšak v zhode s našimi výsledkami v Európe pribúdajú práce dokladujúce prevahu genotypu 3 v tejto rizikovej skupine [9–12]. Genotyp 3 priaznivejšie odpovedá na kombinovanú liečbu (70–80 % SVR) v porovnaní s genotypom 1 (40–53 % SVR) [13–16]. Urbánek et al zistili u malého súboru 7 naivných pacientov s genotypom 3, resp. 2 až 100 % SVR [17]. V našej štúdií bola SVR vyhodnocovaná iba u pacientov, ktorí ukončili celú liečbu a absolvovali aj vyšetrenie po 24 týždňoch od ukončenia liečby. Neodpovedali 9 pacienti (9 %) s genotypom 1 a iba 3 (2 %) s genotypom 3, čo potvrdzuje vyššiu úspešnosť liečby pacientov s genotypom 3.
Vek pacientov a dĺžka trvania infekcie sú známe prediktívne faktory odpovede na liečbu [18]. Analyzovaný súbor pacientov z tohto hľadiska predstavoval homogénny súbor (iba bývalí IDUs) s nízkym vekovým priemerom v porovnaní s inými, doposiaľ publikovanými, štúdiami. Vek nad 40 rokov sa považuje za nepriaznivý prediktívny faktor, najpravdepodobnejšie súvisiaci s kapacitou a funkčnosťou imunitného systému, podobne ako pri onkologických ochoreniach [19]. V našom súbore boli iba 5 pacienti starší ako 40 rokov, z toho 2 neodpovedali na liečbu. Priemerný vek pacientov neodpovedajúcich na liečbu bol vyšší (32 rokov) v porovnaní s celkovým priemerným vekom (27 rokov). Najmladší non-responder bol 25-ročný a na liečbu neodpovedala aj najstaršia vyhodnotená 50-ročná pacientka, čo dokladuje význam veku ako faktora SVR.
Krátke trvanie infekcie u mladých jedincov (predpokladáme rádovo niekoľko rokov), bývalých IDUs, je v súlade s histologickými nálezmi biopsie pečene, ktoré dokladujú u väčšiny pacientov nízky stupeň fibrózy pečene S0–S2 163/92 %. Naopak, pokročilá fibróza pečene s prechodom do cirhózy pečene je nepriaznivým prediktívnym faktorom a v našom súbore sa štádia S5 (pokročilá septálna fibróza) ani S6 (cirhóza) nevyskytovali, čo mohlo prispieť k vysokej SVR [19].
Nízka vírusovú nálož pred začiatkom liečby je akceptovaným prediktívnym faktorom úspešnosti liečby [20]. V našej klinickej štúdii sa kvantitatívne testy HCV RNA nevykonávali u všetkých pacientov, nakoľko v prvých rokoch sledovania nepatrili k štandardnej diagnostike. K dispozícií máme vyšetrenia iba pacientov zaradených do liečby po štandardizácii tohto vyšetrenia v rámci diagnostiky a liečby HCV infekcie. Kvantitatívne vyšetrenie máme vyhodnotené iba u 1/3 pacientov s genotypom 1 s priemernou hodnotou 2 867 946 IU/ml. Kvantitatívne vyšetrenie vírusovej nálože pred zahájením liečbu u všetkých pacientov s genotypom 1 by pomohlo sofistikovanejšie vyhodnotiť vplyv tohto faktora na SVR, aj keď dostupné výsledky nenaznačujú, že by sa jednalo o najrelevantnejší faktor úspešnosti liečby nášho súboru. Na druhej strane zaznamenanie EVR iba u jedného z 12 non-responderov potvrdzuje význam EVR pri dosiahnutí SVR.
K úspešnosti liečby prispela aj optimálna adherencia pacientov k liečbe, ktorá bola podmienená úzkou spoluprácou pacientov s ošetrujúcim personálom. McHutchison et al opisujú signifikantne vyššiu terapeutickú účinnosť, ak liečba trvá viac ako 80 % náležitej dĺžky a pacient prijal viac ako 80 % náležitej dávky IFN-α a R. Autori považujú adherenciu k terapii za dôležitý faktor, napomáhajúci k vysokej terapeutickej účinnosti [21]. V našom súbore z pôvodne liečených 293 pacientov 54 (18 %) neukončilo liečbu, z čoho u 2 (necelé 1 %) sa jednalo o zdravotné dôvody, 34 (11 %) neabsolvovali vyšetrenie po 6 mesiacoch od ukončenia liečby, čím nemohla byť vyhodnotená SVR, aj keď liečba bola u nich kompletne ukončená a iba 18 (6 %) pacientov neukončilo liečbu pre nespoluprácu. Všetci pacienti, ktorí ukončili liečbu, spĺňali minimálne kritérium 3 × 80.
Vysoká úspešnosť liečby zistená v našom súbore evokuje možnosť liečby akútnej hepatitídy C so známou vysokou efektivitou liečby. Zaradenie pacientov s pozitivitou anti-HCV, eleváciou hepatálnych testov staršou ako 1/2 roka a minimálne 6 mesačnou abstinenciou od drog (zhodné s kritériom chronicity HCV infekcie) minimalizuje, resp. eliminuje túto možnosť. Ďalším podporným faktom je, že S0 bola iba u 18 % pacientov, kým stupeň fibrózy S1–S4 boli zistené u ostávajúcich 82 % pacientov, ktorí absolvovali biopsiu pečene. V našom súbore neboli pacienti so štádiami S5 a S6, čo na druhej strane podporuje krátke trvanie infekcie u liečených IDUs a môže sa podieľať sa úspešnosti liečby.
Zvýšenia SVR oproti ETR u 3 pacientov – u 2 s genotypom 3 a u jednej s genotypom 1, bude najpravdepodobnejšie spôsobené chybným zberom dát alebo laboratórnou nepresnosťou. U uvedených pacientov boli vykonané kontrolné vyšetrenia aj po roku od ukončenia liečby, ktoré potvrdili negatívne výsledky HCV RNA.
Výsledky uvedenej štúdie otvárajú viaceré otázky, ktoré by v budúcnosti mohli objasniť ďalšie faktory ovplyvňujúce SVR. Nepochybne významnú úlohu budú zohrávať faktory imunitného systému infikovaného jedinca. V súčasnosti prebiehajú sledovania vplyvu variácii lokusu IL-28B na úspešnosť liečby [22]. Ďalším faktorom ovplyvňujúcim odpoveď na kombinovanú imunomodulačnú liečbu podľa Furusyo et al sa javí koncentrácia ribavirínu [23].
Záver
Výsledky predloženej štúdie bývalých drogovo závislých pacientov s chronickou hepatitídou C, liečených PEG-IFN-α 2a a 2b a R, potvrdili vysokú SVR. Nepochybne najdôležitejšími faktormi úspešnosti liečby boli: mladý vek pacientov, krátke trvanie choroby po infikovaní, nízky stupeň fibrózy pečene, prevaha genotypu 3 oproti 1 a veľmi dobrá adherencia pacientov k terapii. Výsledky klinickej štúdie dokladujú význam vyhľadávacieho programu, uskutočňovaného v spolupráci s psychiatrami, adiktológmi a psychológmi; ako aj skoré zahájenie liečby s jej vyššou úspešnosťou.
Klinická štúdia bola realizovaná za podpory grantu MZ SR 2005/28-SZU-06.
doc. MUDr. Katarína Gazdíková, PhD.
www. szu.sk
e-mail: katarina.gazdikova@szu.sk
Doručeno do redakce: 17. 3. 2011
Přijato po recenzi: 30. 8. 2011
Sources
1. Gazdik F, Bednarova A, Kazar J et al. Hepatitis C virus genotypes distribution among risk groups in the Slovak Republic. Hepatology 2001; 34 : 559.
2. Gazdík F, Gazdíková K, Kajaba I et al. Séroprevalencia HCV infekcie a distribúcia genotypov u intravenóznych drogovo závislých jedincov v regióne západného Slovenska. Slov Lekár 2006; 16 : 275–278.
3. Gazdik F, Pijak M, Kazar J et al. Hepatitis C virus prevalence among general population and risk groups in the Slovak Republic. Hepatology 2001; 34 : 559.
4. Di Bisceglie AM. Natural history of hepatitis C: its impact on clinical management. Hepatology 2000; 31 : 1014–1018.
5. Seef LB. Natural history of chronic hepatitis C. Hepatology 2002; 36: S35–S46.
6. Biggins SW, Terrault NA. Treatment of recurrent hepatitis C after liver transplantation. Clin Liver Dis 2005; 9 : 505–523.
7. Ishak K, Baptista A, Bianchi L et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22 : 696–699.
8. Oltman M, Kužela L. Vírus hepatitídy C a imunitný systém. Trendy HEPA 2010; 1 : 18–22.
9. Matheï C, Wollants E, Verbeck J et al. Molecular epidemiology of hepatitis C among drug users in Flanders, Belgium: Association of genotype with clinical parameters and with sex - and drug-related risk behaviours. Eur J Clin Microbial Infect Dis 2005; 24 : 514–522.
10. Thomson BJ, Finch RG. Hepatitis C virus infection. Clin Microbiol Infect 2005; 11 : 86–94.
11. Koncova-Fejdiova K, Gazdik F, Hruzikova H. Comparison of the HCV genotypes between active drug users and patients in therapeutic process in the Slovak Republic in the years 2004––2005. J Clin Virology 2006; 26 : 108.
12. Krekulová L, Rehák V, Strunecký O et al. Current situation and trends in the hepatitis C genotype distribution among injecting drug users in the Czech Republic. Epidemiol Mikrobiol Imunol 2009; 58 : 84–89.
13. Fried MW, Siffman ML, Reddy KR et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347 : 975–982.
14. Hadziyannis SJ, Cheinquer H, Morgan T et al. Peginterferon alfa-2A (40KD) (Pegasys) in combination with ribavirin (RBV): efficacy and safety results from a phase III, randomized, double--blind, multicentre study examining effect of duration of treatment and RBV dose. J Hepatol 2002; 36 : 3.
15. Manns MP, McHutchison JG, Gordon SC et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358 : 958–965.
16. Zeuzem S, Hultcrantz R, Bourliere M et al. Peginterferon alfa-2b plus ribavirin for treatment of chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3. J Hepatol 2004; 40 : 993–999.
17. Urbánek P, Subhanová I, Janoušková E et al. Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí. Vnitř Lék 2009; 55 : 474–479.
18. He LL, Chen Z, Chen Y et al. Association between influential factors and the effectiveness of pegylated interferon alpha-2a plus ribavirin as a combination treatment for chronic hepatitis C patients. Zhonghua Gan Zang Bing Za Zhi 2011 : 19 : 34–37.
19. Schuppan D, Krebs A, Bauer M et al. Hepatitis C and liver fibrosis. Cell Death Differ 2003; 10: S59–S67.
20. Husa P, Šlesinger P, Štroblová H et al. Ovlivnění úspešnosti léčby chronické hepatitdy C hmotností a pohlavím pacienta a výši vstupní viremie. Vnitř Lék 2006; 52 : 590–595.
21. McHutchison JG, Manns M, Patel K et al. International Hepatitis Interventional Therapy Group. Adherence to combination therapy enhances sustained response in genotype-1-infected patients with chronic hepatitis C. Gastroenterology 2002; 123 : 1061–1069.
22. Ochi H, Maekawa T, Abe H et al. IL-28B predicts response to chronic hepatitis C therapy – fine-mapping and replication study in Asian populations. J Gen Virol 2011; 92 : 1071–1081.
23. Furusyo N, Murata M, Ogawa E et al. Ribavirin concentration in the later stages of 48 week pegylated interferon-α-2b plus ribavirin therapy for chronic hepatitis C is useful for predicting virological response. J Antimicrob Chemother 2011; 66 : 1127–1139.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 2-
All articles in this issue
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

