-
Medical journals
- Career
Karcinoid
Authors: V. Cempírková; P. Havránek
Authors‘ workplace: Interní oddělení Nemocnice České Budějovice, prim. MUDr. Pavel Havránek
Published in: Vnitř Lék 2005; 51(9): 1011-1018
Category: Case Report
Overview
Autoři referují o 2 případech karcinoidních tumorů, které reprezentují šíři problémů u těchto malignit. Diskutují podrobněji o některých typických, ale i problémových symptomech postižených pacientů. První kazuistika je trochu neobvyklý případ trombózy lienální a portální žíly, na ní demonstrují autoři někdy zdlouhavou a obtížnou cestu ke správné diagnóze. Druhý diskutovaný nemocný představuje typický problém kardiologa - včas rozpoznat srdeční příznaky generalizovaného onemocnění a zahájit správnou terapii.
Klíčová slova:
karcinoid - ovariální tumor - pozdní diagnóza - postižení srdceÚvod
Autoři prezentují dva případy karcinoidu, z nichž první je zajímavý nejen jako kazuistika z oblasti gastroenterologie, ale také jako problém pro angiologa. Druhá nemocná demonstruje problém pro kardiologa v diferenciální diagnostice postižení pravého srdce.
Karcinoidy (incidence 2 : 100 000) [25] jsou neobvyklé, neuroendokrinní nádory obsahující sekretagoga, která nejčastěji produkují serotonin a jeho metabolity. Mohou však produkovat i jiné biologicky aktivní látky (chromogranin A, neurokinin A, histamin, kalikrein, inzulin, bradykinin, tachykinin, thyroidální a parathyroidální hormony, gastrin, motilin, VIP, glukagon, prostaglandiny) [15]. To ve svém důsledku může působit pestrý klinický obraz označovaný jako karcinoidní syndrom. Ten se však vyvine pouze u omezeného počtu nemocných s karcinoidem, u nichž se působky dostanou do velkého krevního oběhu, udává se že u 20-30 %. U ostatních, kde jsou aktivní látky při prvním průchodu játry metabolizovány, jsou příznaky nevýrazné, chudé.
Karcinoidní syndrom sestává z flushe (94 %), kožních změn, průjmů (78 %), kardiálního postižení (50-60 %), bolestí břicha (50 %), bronchospazmů (6 %) a hypotenze. Kardiální postižení spočívá v tvorbě endokardiální fibrózy, která postihuje jak chlopenní aparát, tak nástěnný endokard v pravém srdci. Typickými vadami jsou trikuspidální insuficience a pulmonální stenóza a regurgitace. Přítomnost degradačních enzymů v plicním epitelu může vysvětlit, proč postižení levostranných srdečních oddílů je u nádorů produkujících serotonin neobvyklé s výjimkou přítomnosti pravolevého zkratu, bronchiálního tumoru nebo plicních metastáz [10].
Diagnostický význam má stanovení 5-HIAA (5 - hydroxyindoleacetic acid) a serotoninu v moči. Téměř 90 % karcinoidů má receptory pro somatostatin, toho se také využívá jak v diagnostice (oktreotidová scintigrafie), tak i v léčbě těchto nádorů [6,27].
Růst karcinoidů je většinou pomalý. Nacházejí se nejčastěji v apendixu, terminálním ileu a zbytku tenkého střeva, méně často v tlustém střevě, rektu, žaludku, pankreatu, bronších, ev. pohlavních žlázách [1,3,5]. Extraintestinální karcinoidy tvoří až 33 % [28]. Pomalý je i vznik metastáz, většinou do jater. Jsou popsány i primární karcinoidové nádory kůže, někdy sdružené s lichen ruber planus [16].
Tyto nádory mají bimodální distribuci co do věku nemocných, první maximum je mezi 3. a 5. dekádou života pacienta a druhé po 60. roku věku.
Karcinoid je vlastně anglický překlad původního termínu německých patologů, kteří tak označovali tumory, které vypadaly jako karcinomy, chovaly se ale méně agresivně [12,20]. Staří patologové také popsali, že tyto tumory vycházejí z enterochromafinních buněk střeva, které vychytávají a redukují stříbro. Jsou příbuzné ostatním neuroendokrinním tumorům, které vycházejí z buněk APUD systému, jako jsou medulární karcinom štítnice, feochromocytom a endokrinní tumory pankreatu. Patologičtí anatomové dělí karcinoidy podle místa původu na „foregut, midgut, hindgut“ nádory, jsou zatím vzácně popsány některé molekulárně genetické odchylky jako delece na chromozomech 11 a 18. Karcinoidový syndrom je nejvíce, v 70 %, vyjádřen u „midgut“ nádorů, tedy těch, které pochází z tenkého střeva, apendixu a proximálního tračníku.
Jaké jsou možnosti terapie?
Chirurgická léčba - je indikována v případech, kdy je možné nádor nebo nádory radikálně odstranit, popř. když nádor dosáhne větších rozměrů a působí obstrukci trávicí trubice, nebo ke zmenšení rozsahu jaterních metastáz. Toho je možné docílit také chemoembolizací přívodných tepen [7].
Radioterapie - téměř se nepoužívá, karcinoidy jsou k záření rezistentní.
Chemoterapie - v minulosti se používal streptozotocin v kombinaci s 5-fluorouracilem nebo cyklofosfamidem, případně kombinace cisplatiny a etopozidu. Léčba měla ale řadu nežádoucích účinků, pro které byla špatně snášena [8].
Regrese karcinoidů byla popsána po aplikaci interferonu alfa v dávce 3-6 mil. j./den, v některých menších studiích byla pozorována hormonální odpověď a inhibice růstu tumoru až u 70-80 % pacientů takto léčených [24]. Znamená to, že po této látce se snižuje produkce 5-HIAA a dochází k úlevě. Léčba interferonem alfa indukuje fibrózu uvnitř tumoru [27], při ultrazvukovém vyšetření nebo na CT se velikost nádoru často nemění, snižuje se ale jeho endokrinní aktivita. Vedlejším účinkem této terapie ale může být vznik autoimunních chorob jako tyreotoxikózy a hypotyreózy, perniciózní anémie a vaskulitidy, častý je únavový syndrom, anémie, trombocytopenie a leukopenie.
V poslední době se dává přednost spíše antihormonální léčbě, používá se analog somatostatinu oktreotid jako účinný prostředek k tlumení příznaků karcinoidu, inhibuje somatostatinové receptory subtypu II a V. V depotní formě je k dispozici další analog somatostatinu lanreotid, který umožňuje méně časté podávání než u oktreotidu, kde jsou nutné injekce 2krát denně. Léčba somatostatinovými analogy utlumí flush skoro u všech a průjmy u 75 % nemocných. Je dobře tolerována, občas se pozoruje steatorea, hyperglykemie a vznik cholecystolitázy [12,23].
Periferní účinky kininů lze také tlumit podáním fenotiazinů nebo cyproheptadinu a lysuridu (interference s periferními účinky serotoninu). Vyskytuje-li se flush, je možné zkusit H2-blokátory a při bronchiálním astmatu glukokortikoidy [8].
Popis kazuistik
První kazuistika
Nemocná narozená roku 1963 byla odeslána na interní oddělení Nemocnice České Budějovice ambulantním gastroenterologem v červenci roku 2002. Předtím byla půl roku sledována a vyšetřována pro intermitentní průjmy. Na počátku sledování bylo zhotoveno CT-vyšetření slinivky s negativním nálezem, později gastroenterolog provedl pankoloskopii, při které pro difuzně výraznější cévní kresbu odebral 4 vzorky sliznice, ale kromě nespecifické lymfocytární infiltrace nebyla zjištěna patologie. Po 2 měsících pro přetrvávající obtíže (intermitentní průjmy) provedl kontrolní ultrazvukové vyšetření epigastria s nálezem necharakteristické změny na rozhraní těla a kaudy pankreatu, patrně jen sumace struktur (když předtím CT bylo v normě). Místo přechodu těla a kaudy pankreatu bylo lehce pozměněné, mohlo se jednat o stav po fokální pankreatitidě. Nemocné doporučil sledovat potravinové alergie a objednal ji na kontrolu. V dalším průběhu ambulantního vyšetřování byla zjištěna alergie na jablka a stav byl prozatím uzavřen jako kombinovaný problém: fokální pankreatitida a potravinová alergie. Nemocné byla také doporučena gastroskopie, na tu se dostavila v dubnu roku 2002 a nalezena byla jen lehká chronická antrumgastritis, což potvrdila i histologie žaludeční sliznice.
Po 2 měsících nemocná opět navštívila ordinaci pro tendenci k průjmům, v závislosti na psychických problémech byly stolice 1-6krát denně, gastroenterolog znovu provedl ultrazvukové vyšetření epigastria. Pro trvající nejasný nález na přechodu těla a kaudy pankreatu objednal kontrolní CT-slinivky. To proběhlo koncem května a nález zněl - fokální pankreatitida s parciální, dobře obtékanou trombózou v. portae. Ke zvážení MRI-vyšetření a zavedení léčby (antikoagulace) nemocnou objednal k hospitalizaci na interní oddělení.
Při přijetí na naše pracoviště v červenci roku 2002 byla nemocná silně anxiózní, jinak normálního habitu, váha 52 kg, výška 163 cm. Objektivní nález kromě nevýrazné palpační citlivosti v epigastriu byl zcela v normě, stolice měla světlou barvu, intermitentně se zbytky potravy.
Bylo doplněno MRI-vyšetření s nálezem: ložiskové lehké prosáknutí střední části těla a kaudy pankreatu, trombus v iniciální části portální žíly, postkontrastní sycení nesvědčilo pro ložiskový tumor slinivky, bylo patrné téměř homogenní sycení pankreatu kontrastem a doporučeno UZ sledování. Během hospitalizace u nás bylo také provedeno ultrazvukové vyšetření s nálezem trombu v lienální žíle dosahující k soutoku s v. mesenterica superior, velikost trombu 2,6 cm v průměru (obr. 1). Oblast těla a kaudy pankreatu byla prostoupena ložiskem smíšené echogenity velikosti 3,4 cm v průměru, celkově oproti ostatní tkáni pankreatu hypoechogenním, nález dělal dojem zánětlivých změn, i když ložisko bylo poněkud ohraničené (obr. 2).
Image 1. Nevelký trombus v iniciální části v. portae (VII 2002). 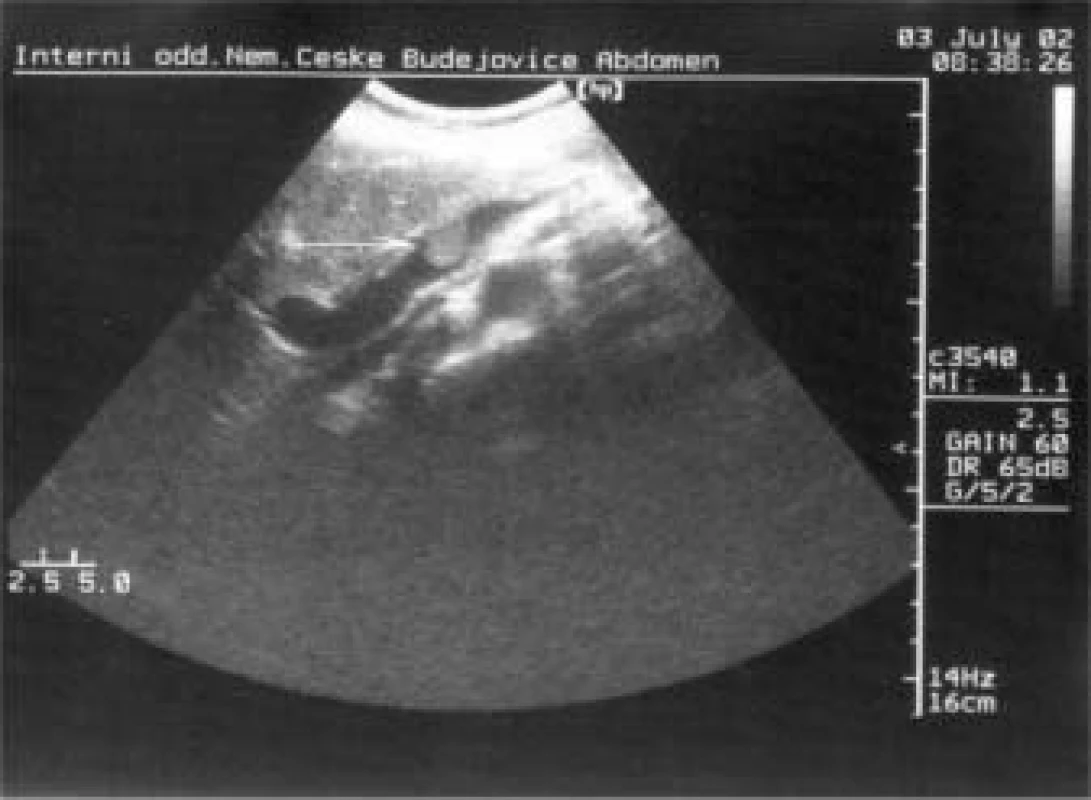
Image 2. Ložiskové změny pankreatu (ložisko snížené echogenity na přechodu těla a kaudy). 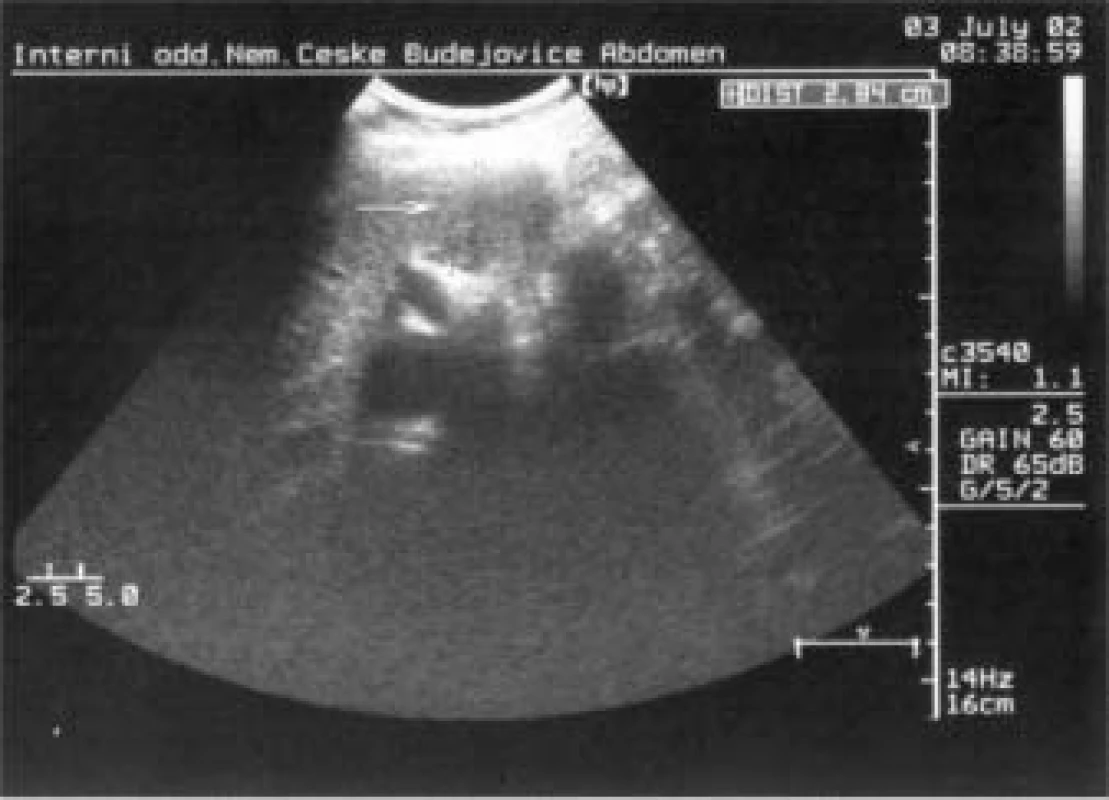
Laboratorní ukazatele kromě mírně zvýšené FW (20/30) byly zcela normální (biochemie séra včetně amyláz, krevní obraz, koagulace, rovněž tak moč a sediment, markery tumoru CA 19-9, CEA a TPS).
Subjektivní obtíže nemocné se po nasazení kombinace léků Pangrol 400 mg tbl., Combizym tbl. comp. a Lexaurin 3 mg tbl. zmírnily, stolice byla jen 1krát denně, anxieta rovněž ustupovala. K antikoagulační léčbě nebylo přistoupeno.
Bylo domluveno ambulantní ultrazvukové (UZ) sledování.
Během následujícího půl roku byla nemocná sledována a léčena ambulantně. Nemocná opakovaně navrhovala punkci slinivky a operaci, ale punkce ani probatorní laparotomie nebyly považovány za indikované. Subjektivní obtíže byly v zásadě stejné, intermitentní průjmy, pobolívání v epigastriu, nemocná přibrala na váze, vážila nyní 55 kg.
Později bylo přistoupeno k léčbě LMWH a antikoagulancii, na velikost trombu v portální a lienální žíle ale léčba neměla žádný vliv. Naopak, během půl roku došlo ke zvětšení trombu ze 2,6 cm téměř na 5 cm, ložisko v pankreatu bylo stále stejné, kolem 4 cm (obr. 3).
Image 3. Trombus již prakticky obturuje lumen lienální a portální žíly. 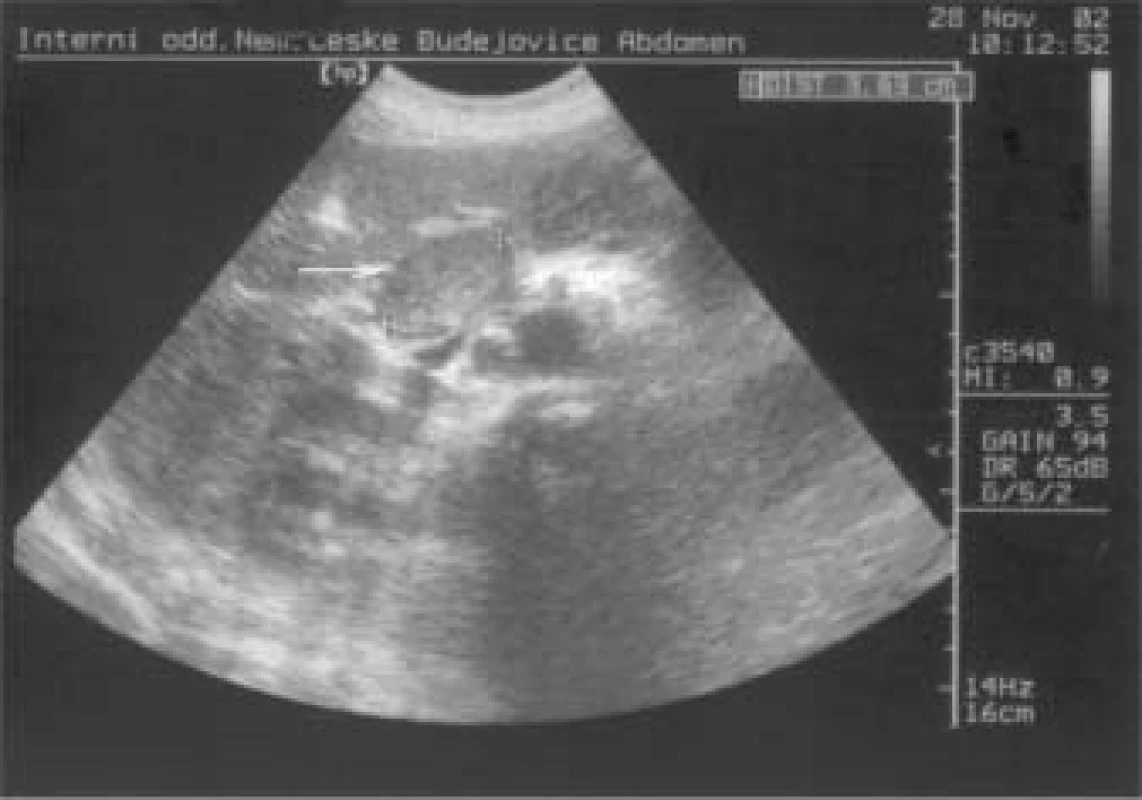
Nález byl konzultován na gastroenterologických a radiologických pracovištích v Hradci Králové a v IKEM Praha, ale s obdobným případem nebyly zkušenosti. Koncem roku 2002 již byly patrné dilatované žíly mediálně od sleziny (vytvářející se spojky) a zvětšující se slezina. Navíc byl trombus nyní podstatně echogennější než dříve, dělal dojem měkkotkáňového útvaru.
Proto byla nemocné počátkem roku 2003 doporučena operace, ke které se nakonec v únoru roku 2003 rozhodla. Mezitím bylo znovu zopakováno CT-vyšetření - progrese trombu v portální žíle, odtok ze sleziny přes dilatovanou gastroepiploickou žílu do horní mezenterické žíly, došlo k dalšímu zvětšení těla pankreatu, zvětšení uzlin v retroperitoneu nebylo patrné.
Po telefonické konzultaci s prof. MUDr. Pafkem byla nemocná odeslána k operaci do FN Motol Praha s diagnózou portální hypertenze při pre - a intrahepatální blokádě (trombóza portální a lienální žíly, progredující tvorba kolaterál), nejasný nález na slinivce, pravděpodobně fokální zánětlivé změny. Předběžně bylo domluveno, že bude provedena levostranná pankreatektomie, splenektomie a pokus o odstranění trombu z portální žíly. První zprávy z FN Motol byly nepříznivé - peroperační diagnóza zněla adenokarcinom pankreatu s metastázou do uzliny. Trombus v portální žíle byl nádorový trombus. Nemocné tedy byla provedena výše zmíněná operace plus levostranná parciální ooforektomie pro makroskopický nález cysty. Trombus ve v. portae byl pevný a celistvý, takže byl odstraněn celý.
Později bylo z operačního materiálu stanoveno, že nejde o adenokarcinom, ale o karcinoid. Ukázalo se, že v ovariu byl také nádor a buňky měly stejný charakter jako v pankreatu, a tak šlo pravděpodobně o metastázu do levého ovaria.
Pooperační průběh byl poznamenán „pouze“ psychickými problémy nemocné, jiné komplikace nenastaly.
Během dalšího ambulantního sledování byla nemocná bez obtíží, průjmy vymizely. Bylo doplněno kontrolní vyšetření tlustého střeva včetně terminálního ilea (bez patologie), vyšetření tenkého střeva enteroskopií nemocná odmítla. Asi po půl roce si začala stěžovat na nepravidelnost menstruace. Při UZ vyšetření a následném CT byla zjištěna expanze velikosti 3 cm v oblasti levého ovaria. Pro podezření na recidivu byla na gynekologickém oddělení v Českých Budějovicích provedena laparoskopie. Při ní byla na levém ovariu nalezena pouze hemoragická cysta, byl odebrán vzorek z její stěny a vyšetření na zdejším patologickém oddělení recidivu karcinoidu vyloučilo.
18 měsíců od operace, do podzimu roku 2004, byla nemocná v celkově dobrém stavu, bez známek recidivy v dutině břišní a bez kardiálního postižení. Dosud neužívá žádné léky. Sledování odpadů 5-HIAA v moči má v tomto případě, kdy ložiska byla lokalizována „před játry“, v portálním řečišti, omezený význam, resp. i v případě, že nebudou zvýšeny, neznamená to, že recidiva nemůže být přítomna. Pouze v případě, že recidiva by byla v ovariu, by mohly být odpady 5-HIAA zvýšeny. V poslední době si nemocná začala opět stěžovat na občasné průjmy, proto je tč. objednána k izotopovému vyšetření (octreoscanu).
Druhá kazuistika
V tomto bylo stanovení diagnózy podstatně snazší, nemocná se dostavila v pokročilém stadiu onemocnění.
Nemocná narozená roku 1949 byla na Interní oddělení Nemocnice České Budějovice přijata počátkem listopadu roku 2004 a v této době již byl patrný rozvoj řady příznaků syndromu karcinoidu. Byla přijata překladem z infekčního oddělení, tam byla přechodně hospitalizována pro průjmy, infekční etiologie nebyla prokázána.
Váha byla 49 kg při výšce 167 cm, v prekordiu bylo slyšet hlučný systolický šelest IV/VI, játra přesahovala 3 cm přes oblouk, v obličeji a horní polovině těla již byly vyvinuty teleangiektazie, ostatní somatický nález byl vcelku v normě, DK bez otoků (obr. 4).
Image 4. Kožní změny při syndromu karcinoidu – teleangiektazie v obličeji. 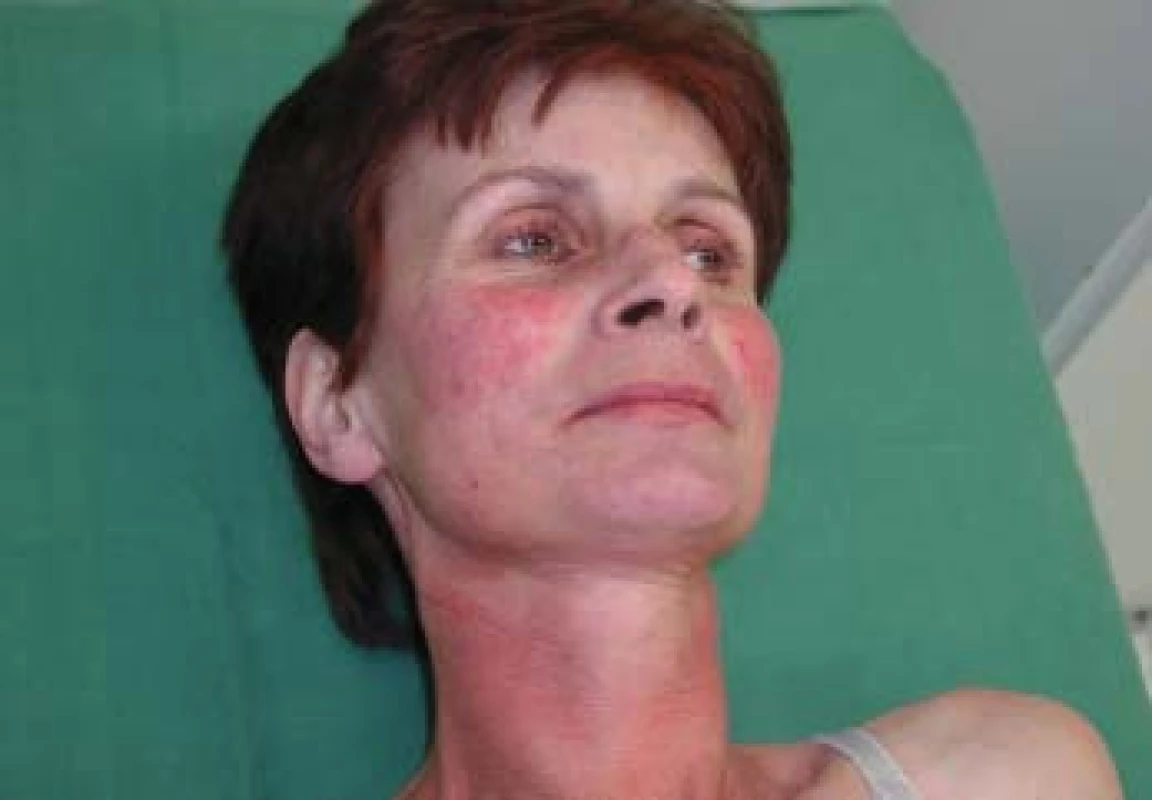
Ze subjektivních potíží byly v popředí průjmy, zhoršující se poslední 3 měsíce. Nemocná trpěla typickým záchvatovitým flushem horní poloviny těla, záchvatovitou dušností, hubla (11 kg za poslední 3 týdny) a celkově progredovala slabost, nevýkonnost. Z léků užívala Lokren 20 mg, Lozap 25 mg, Loradur mitte. K dispozici byl také anamnestický údaj o ložisku v játrech, pozorovaném již před 2 lety na UZ u ambulantního gastroenterologa, shodou okolností stejného lékaře, u kterého byla původně sledována i první nemocná. Tehdy byly změny omezeny na levý lalok jaterní, který byl prostoupen ložiskem zvýšené echogenity s cystickými projasněními. Nemocná byla stejně jako žena z první kazuistiky u ambulantního gastroenterologa vyšetřována pro průjmy. I u ní byla provedena gastroskopie a koloskopie s negativním nálezem, histologie ze stěny rekta (mírná nespecifická lymfocytární infiltrace). Ambulantně pak také během 2 let bylo opakovaně provedeno CT jater, nálezy víceméně korespondovaly s UZ vyšetřeními, k etiologii ložisek se nebylo možné spolehlivě vyjádřit, nebyla typická pro metastázy, proto nemocné byla opakovaně doporučena punkce ložiska, což odmítla. Také kompliance nemocné s vyšetřeními byla omezená, nechtěla dojíždět asi 30 km do Českých Budějovic apod.
Po přijetí na interní oddělení byla diagnóza stanovena s velkou pravděpodobností již při prvním UZ-vyšetření. Zde byla po provedení kardioechografického vyšetření a zároveň UZ epigastria vyslovena suspekce na generalizovaný karcinoid (metastatické postižení jater a významná trikuspidální regurgitace).
Následně bylo toto podezření potvrzeno stanovením hladiny 5-HIAA v moči (810 µmol/den, norma do 47,1 µmol/den) a serotoninu v moči (3,17 µmol/den, norma do 1,4 µmol/den). Z dalších laboratorních výsledků byla zjištěna již závažnější hypoproteinemie (celková bílkovina 56,0 g/l, albumin 34,0 g/l), Quick 63 %, jaterní testy včetně bilirubinu lehce zvýšeny, kreatinin v normě, FW byla 2/4. V krevním obraze byla opakovaně zastižena polyglobulie (6,0 tera/l) s malým objemem erytrocytů (70 fl), hladina Fe v séru byla normální (16,4 µmol/l). Hladina erytropoetinu byla také v normě.
Jaký byl nález při TTE? (obr. 5 a 6). Především byla patrná dilatace pravostranných srdečních oddílů (PK 33 mm) s těžkou trikuspidální regurgitací, masivně až dutých a jaterních žil. Baze trikuspidální chlopně byla nápadně ztluštělá s významnou inkompetencí cípů, endokard v PS byl také nepravidelně ztluštělý. Na pulmonální chlopni byla malá regurgitace, patologické ztluštění cípů zjevné nebylo. Naměřena byla lehká plicní hypertenze. Levá komora měla pouze plochý pohyb septa, kontrakce ostatních segmentů byly v normě, EF LK 75 %. Transmitrální tok byl normální, rovněž zkrat na úrovni síní ani komor nebyl patrný.
Image 5. Trikuspidální ústí – CW Doppler: dagger shaped waves – známka těžké regurgitace. 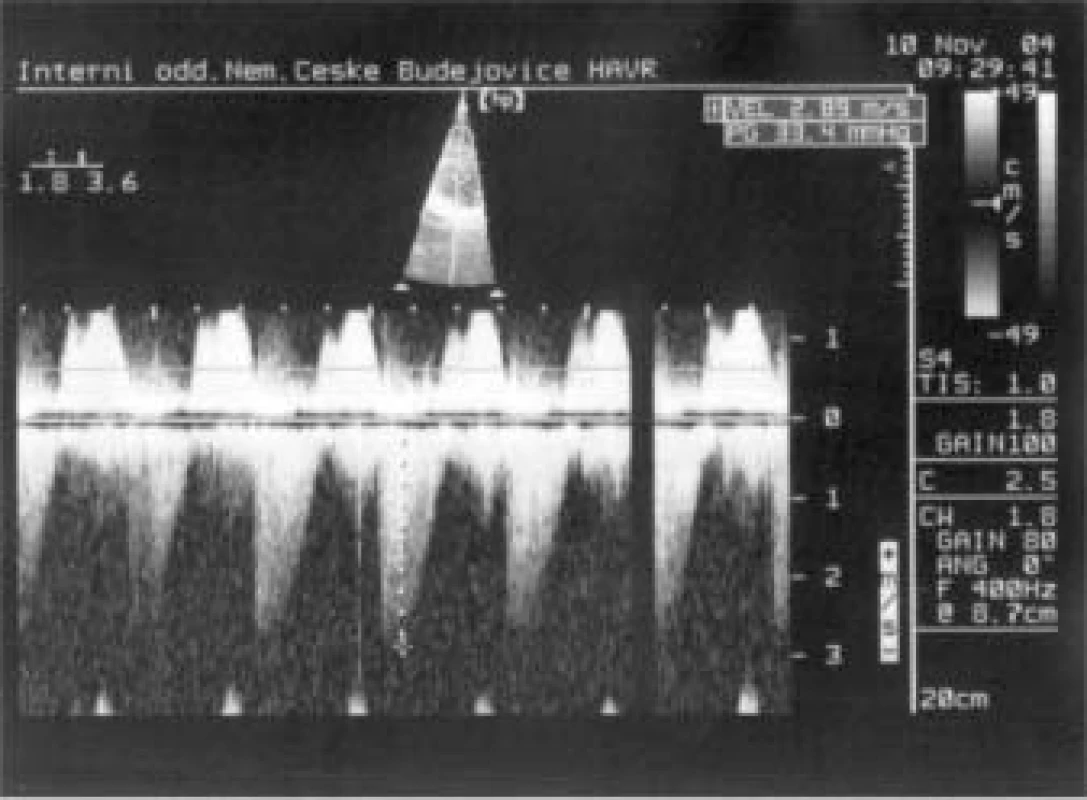
Image 6. Ztluštění baze cípů trikuspidální chlopně, jet regurgitace. 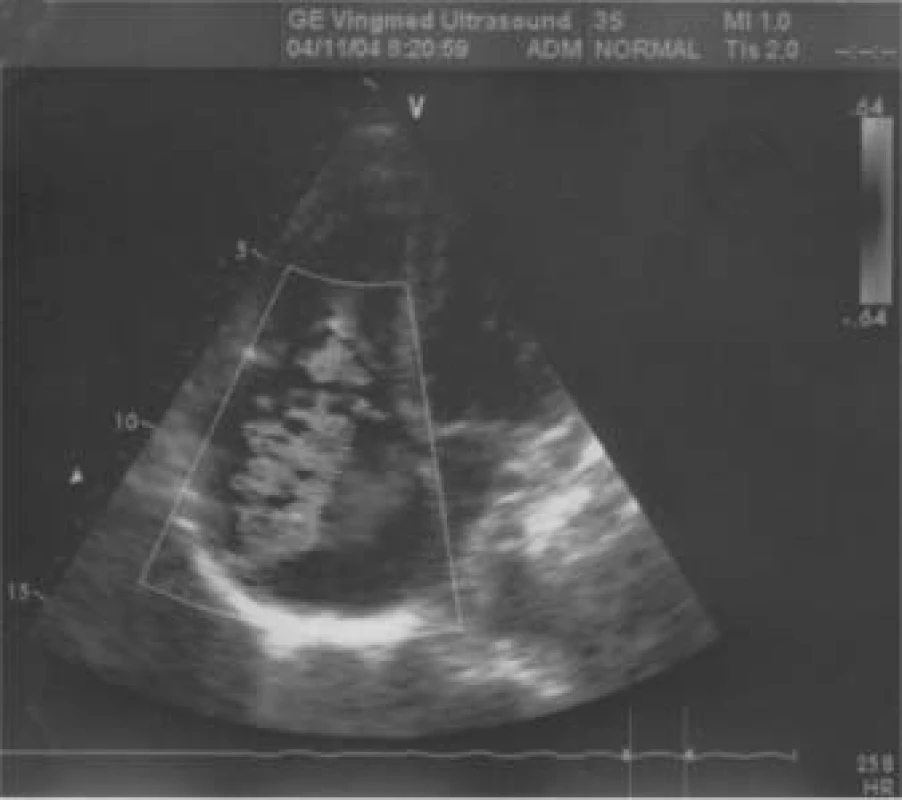
Při UZ vyšetření břicha (obr. 7) byla zjištěna mnohočetná ložiska v obou lalocích jater, většinou hypoechogenní s cystickými dutinami, velikosti od 2 do 10 cm v průměru, DDŽ žíla nejevila dechové variace průsvitu a byla dilatovaná na 28 mm. Pankreas bez patologie, slezina mírně celkově zvětšená, podélně 13 mm, bez ložisek, obě ledviny hraniční velikosti, bez významné redukce parenchymu. V malé pánvi byl nevelký ascites. Stejný nález byl i při následně provedeném CT-vyšetření břicha, CT-vyšetření plic a mediastina nezjistilo žádné postižení.
Image 7. Metastastická ložiska karcinoidu v játrech. 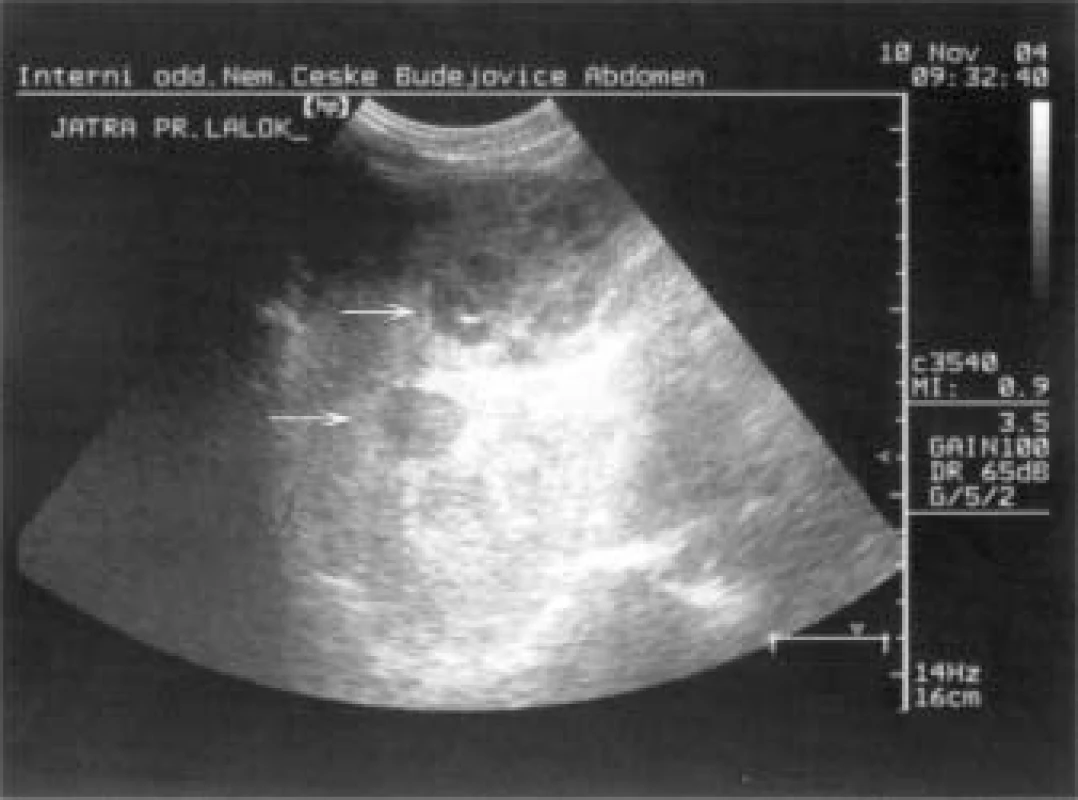
Ke zjištění rozsahu postižení, ev. nalezení primárního ložiska byla provedena kontrolní koloskopie. Do terminálního ilea nebyl tumor nalezen.
TEE a ev. pravostranná srdeční katetrizace nebyly indikovány, pro stanovení léčby a prognózu nemocné by nebyly již dalším přínosem. Naopak bylo provedeno izotopové vyšetření Octreoscan (obr. 8), které může stanovit nejen rozsah postižení, ale v horizontu měsíců při jeho opakování posoudit i měnící se aktivitu ložisek v závislosti na aplikované terapii. Toto vyšetření kromě výše popsaných ložisek v játrech odhalilo další 2 ložiska patologické aktivity v pravé polovině dutiny břišní, větší v pravé jámě kyčelní a druhé proximálně od něj v pravém mezogastriu. Po zvážení situace jsme dále po primárním ložisku nepátrali, bylo by to obtížné a podle našeho mínění málo přínosné.
U této nemocné bylo nakonec přistoupeno k léčbě analogem somatostatinu lanreotidem (SOMATULIN AUTOGEL 60 mg inj.) v dávce 60 mg 1krát za 28 dní. Dávka bude přizpůsobena stupni dosažené symptomatické úlevy. Dispenzarizována po stránce základního onemocnění bude na onkologii, na interním oddělení bude sledována po stránce kardiální. Z ostatní medikace byly nemocné vysazeny Lokren tbl. a Lozap tbl., které u ní vedly k symptomatické hypotenzi, z diuretik ponechán Loradur mitte v dávce 1 tbl/den, který zatím postačuje ke kontrole pravostranné srdeční insuficience.
V případě nedostatečného efektu této léčby je možné ještě zvážit parciální resekci jater s cílem zmenšit velikost hormonálně aktivních metastáz či okluzi přívodných tepen metastáz nejspíše radiologicky chemoembolizací [7]. Rovněž tak v úvahu připadá radikální léčba trikuspidální insuficience, pokud by situace progredovala k farmakologicky nezvladatelnému městanavému syndromu.
Diskuse
Při vyjádřených příznacích, většinou již v pokročilém stadiu onemocnění, je stanovení diagnózy relativně snadné. Tak tomu bylo u naší 2. nemocné. Karcinoidový syndrom je relativně vzácná příčina získané chlopňové vady, výjimečný je i mechanizmus - plošné ztluštění endokardu komor i chlopní a kolem DDŽ [26]. Může vést ke stenóze i insuficienci, regurgitace na trikuspidálním ústí je nejčastější. Zmnožení kolagenu pod endokardem je téměř patognomické pro karcinoid, na trikuspidální chlopni je predilekčně postižena komorová strana a na pulmonální chlopni naopak strana arteriální. Dochází ke ztluštění cípů, srůstům komisur, šlašinky jsou také ztluštělé a zkrácené (absorbované šlašinky). Vazoaktivní látky uvolňované tumorem aktivují transforming growth factor beta, který stimuluje tvorbu matrix a kolagenu [10]. Pro kardiologa je důležitá diferenciální diagnóza čisté trikuspidální regurgitace, musí vyloučit Ebsteinovu anomálii, prolaps, jinou kongenitální malformaci, infekční endokarditidu, vzácně i revmatickou vadu, trauma, postižení při Marfanově syndromu, po iradiaci, u systémových chorob pojiva. Endomyokardiální fibróza s restrikcí trikuspidálních cípů je častou a důležitou příčinou trikuspidální regurgitace v tropické Africe.
Postižení chlopní s omezením rozsahu pohybu cípů bez kalcifikací při normální kinetice obou komor vede tedy v první řadě k podezření na postižení u karcinoidu [20]. Nesmíme ale zapomínat i na iatrogenní případy, po lécích obsahujících námelové deriváty při léčbě migrény, nebo po anorekticích - typická byla v 80. letech 20. století postižení pravého srdce po fenfluraminu a fenterminu, jsou známá i postižení po obdobných čínských bylinách.
Byly popsány dokonce i případy trikuspidální těžké regurgitace po bromokriptinu a dalších agonistech dopaminu jako po pergolidu.
Postižení chlopní pravého srdce patří typicky do karcinoidového syndromu. Popsaná jsou i jiná postižení srdce, např. intraperikardiální metastázy. Tuto komplikaci jsme u naší nemocné nezaznamenali [4,22].
V diferenciální diagnostice musíme vyloučit jiná onemocnění vedoucí k flushi, jako je např. VIP produkující tumor (Verner-Morrisonův syndrom) nebo systémová mastocytóza. Klinicky se rozeznávají 4 typy flushe. První je náhlé zčervenání obličeje, krku a horní hrudi (běžná oblast flushe), trvá 1-5 minut, bývá provázen palpitacemi. Je součástí časné generalizace tumoru. U 2. typu bývá naznačena fialová barva, trvá déle, bývají přítomny teleangiektazie. Ten provází pokročilejší stadia karcinoidu. Třetí typ postihuje celé tělo, trvá hodiny, provází ho profuzní slzení, otok slinných žláz i obličeje, často hypotenze. Bývá u maligních bronchiálních karcinoidů. Čtvrtý typ se manifestuje jako živě červená políčka při hypersekreci histaminu.
Kromě flushe byla popsána i mohutná žaludeční hypersekrece, sonda často odvede až 5 litrů tekutiny za den. Tuto komplikaci jsme u nemocné také nezaznamenali. Pravidlem bývají i různě vyjádřené mentální změny, které jsou interpretovány jako hyperserotonergní stav. Atypické chování jsme viděli u obou našich pacientek. 5-HT1A receptory jsou v mozku i míše, lze tak někdy bohatou neurologickou a psychiatrickou symptomatologii vysvětlit. Tito nemocní často špatně snášejí celkovou anestezii, je třeba se připravit na možné komplikace. Takovou život ohrožující komplikací je karcinoidová krize s hypotenzí, hypertermií a tachykardií, nemocný může v krizi zemřít. Život zachraňující je pak podání analogu somatostatinu i.v. [9].
Obdobou flushe u některých pacientů může být svědivá dermatóza, při diferenciální diagnostice svědivky je nutno vzpomenout i na karcinoid [13]. Jako některé další endokrinní tumory může i karcinoid způsobit nevysvětlitelné noční pocení.
Naopak karcinoid bez vyjádřeného karcinoidního syndromu je onemocnění na příznaky chudé a stanovení diagnózy může být problematické. Při zpětném hodnocení je vidět, že naše 1. nemocná mohla mít přínos z punkce slinivky pro dřívější stanovení diagnózy. Přesná diagnóza u ní byla stanovena až po operačním odstranění nádoru. Ani tehdy ale nebyla jistota o primárním tumoru - obě možnosti platí. Jsou popsány metastazující karcinoidy ovaria a samozřejmě také primární tumory slinivky s metastázami do dutiny břišní a pánve. Je třeba ovšem říct, že trombóza byla opakovaně popsána jako součást obrazu karcinoidu, dokonce i Peyronova choroba, postihující penis. Gastroenterologovi může komplikovat situaci i častá intraabdominální a retroperitoneální fibróza. Žilní nádorová trombóza naší nemocné byla život ohrožující komplikací, popsány byly i smrtící trombózy a uzávěry mezenteriálních žil a tepen.
Pátrat po primárním ložisku je ale nutné, jakož i po ev. recidivě či metastázách, protože jejich odstranění může významně přispět k přežití nemocných a lepší kvalitě jejich života.
Primární nádor lze někdy zjistit i akutně peroperačně při náhodném operačním zjištění podezřelého nálezu, pomocí značeného analoga somatostatinu, 111In-pentreotidu gama kamerou, v ruce drženou operatérem, takto bylo příkladně kompletně odstraněno nádorové ložisko z plic u primárně bronchiálního tumoru [18]. Je známo, že i při vzniku jaterních metastáz je procento přežití relativně vysoké. Pro pacienty s dlouhodobými a třeba i nepříliš intenzivními průjmy, pro které není jiné dostatečné vysvětlení, by mohlo být přínosem pokusit se o screening karcinoidu.
Je-li nádor lokalizovaný, 5 let přežije 94 %, při postižení regionálních uzlin toto číslo klesá na 64 % a na 18 % se vzdálenými metastázami, jiné zdroje zase uvádějí medián přežití v závislosti na první epizodě flushe či hladině 5-HIAA v moči [19].
Závěr
Autoři popisují 2 případy karcinoidu, které dobře dokumentují šíři problematiky u tohoto tumoru a diskutují o diagnostických známkách a rozpacích. V 1. případě šlo o neobvyklý případ trombózy lienální a portální žíly s komplikovaným a vleklým dokazováním nádorové etiologie i povahy nádoru.
Druhý případ dokumentuje karcinoidový syndrom jako primární problematiku kardiologa, autoři diskutují možnosti léčby u generalizovaného onemocnění.
MUDr. Věra Cempírková
www.nemcb.cz
e-mail: veracem@seznam.cz
Doručeno do redakce: 29. 11. 2004
Přijato po recenzi: 11. 2. 2005
Sources
1. Schettler G et al. Repetitorium praktického lékaře. Praha: Galén 1995 : 815-816.
2. Kiňová S, Ďuriš I, Kratochvílová E et al. Carcinoid tumors - somatostatine in diagnosis and therapy. Bratisl Lek Listy 2002; 103 : 108-112.
3. Chatterjee K, Heather JC. Carcinoid heart disease from primary ovarian carcinoid tumorous. A case report a review of literature. Am J Med 1968; 45 : 643-681.
4. Modlin IM, Lye KD, Kidd M. Decade Analysis of 13,715 Carcinoid Tumors. Cancer 2003; 97 : 934-959.
5. Davis KP, Hartmann LK, Keeney GL et al. Primary ovarian carcinoid tumoros. Gynecol Oncol 1996; 61 : 259-265.
6. Lamberts SW, Krenning EP, Klijn JG et al. The clinical use of somatostatin analoques in the treatment of cancer. Baillieres Clin Endocrinol Metab 1990; 4 : 29-49.
7. Nobin A, Mansson B, Lunderquist A. Evaluation of temporary liver dearterialization and embolization in patients with metastatic carcinoid tumour. Acta Oncol 1989; 28 : 419-424.
8. Klener P. Protinádorová chemoterapie. Praha: Galén 1996 : 555-556.
9. Lawrence JP, Ashizuka J, Haber B. The effect of somatostatin on 5-hydroxytryptamin release from carcinoid tumor. Surgery 1990; 108 : 1131-1135.
10. Crawford MH, Di Marco JP. Cardiology. 1st ed. London: Mosby 2001 : 11-12.
11. Ferri F. Practical Guide to the Care of the Medical Patient. 6th ed. St. Louis: Mosby 2004 : 345-347.
12. Abeloff MD. Clinical Oncology. 3rd ed. Philadelphia: Elsevier/Churchill Livingstone 2002 : 1631-1636.
13. Charlesworth NE, Vincent SB Sr. Pruritic Dermatoses: Overview of Etiology and Therapy. Am J Med 2002; 113 : 25S-33S.
14. Bouros D, Hatzakis K, Labrakis H et al. Association of Malignancy With Diaseases Causing Interstitial Pulmonary Changes, Reviews. Chest 2002; 121(4): 1278-1289.
15. Calhoun K, Toth-Fejel S, Cheek J et al. Serum peptid profiles in patients with carcinoid tumors. Am J Surg 2003; 186 : 28-31.
16. Cokonis CD, Green JJ, Manders SM. Primary carcinoid tumor of the skin. J Am Acad Dermatol 2004; 51: S74-S76.
17. Bhattacharya R, Rao S, Kowdley KV. Liver involvement in patients with solid tumors of non-hepatic origin. Clin Liver Dis 2002; 6 : 1033-1043.
18. Pandharipande PP, Reichard PS, Vallee MF. High gastric output as a perioperative sign of carcinoid syndrom. Anesthesiology 2002; 96 : 755-756.
19. Toth-Fejel S, Pommier RF. Relationships among delay of diagnosis, extent of disease, and survival in patients with abdominal carcinoid tumors. Am J Surg 2004; 187 : 575-579.
20. Braunwald E. Heart Diasease: A Textbook of Cardiovascular Medicine. 6th ed. Philadelphia: Saunders 2001 : 1692-1694.
21. Kiňová S, Kováčová E, Bulas J et al. Výskyt karcinoidného syndromu u pacientov s karcinoidom. Vnitř Lék 2004; 50(2): 126-133.
22. Collins N, Bellamy G, Hayes P. Intrapericardial carcinoid metastasis. J Am Soc Echocardiogr 2004; 17 : 675-676.
23. Ruszniewski P, Ducreux M, Chayvialle JA et al. Treatment of the carcinoid syndrom with the longacting somatostatin analogue lanreotide: a prospective study in 39 patients. Gut 1996; 39 : 279-283.
24. Botero M, Fuchs R, Paulus DA et al. Carcinoid heart disease: a case report and literature review. J Clin Anesth 2002; 14 : 57-63.
25. Chaowalit N, Connolly HM, Schaff HV et al. Carcinoid heart disease associated with primary ovarian carcinoid tumor. Am J Cardiol 2004; 93 : 1314-1315.
26. Šteiner I. Postižení srdce při karcinoidu. Čes Slov Patol 2003; 39 : 55-58.
27. Kiňová S, Ďuriš I. Carcinoid tumor. Bratisl Lek Listy 2001; 102 : 495-504.
28. Pellikka PA, Tajik AJ, Khandheria BK et al. Carcinoid heart disease: Clinical and echocardiographic spectrum in 74 patients. Circulation 1993; 87 : 1188-1196.
29. Larsen PR, Williams RH. Williams Textbook of Endocrinology. 10th ed. Philadelphia: Saunders 2002 : 1857-1870.
30. Rodriguez JA, Meyers MO, Jacome TH et al. Intraoperative Detection of a Bronchial Carcinoid with a Radiolabeled Somatostatin Analog. Chest 2002; 121 : 985-988.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 9-
All articles in this issue
- Esenciální hypertenze a Arg16Gly polymorfizmus genu pro β2-adrenergní receptor
- Význam vyšetření kontraktilní rezervy levé komory dobutaminovou echokardiografií u nemocných s pokročilým chronickým srdečním selháním
- Význam kombinovaného rehabilitačního programu u nemocných s chronickou ischemickou chorobou srdeční
- Big endotelin, interleukin 6 a funkce pravé komory
- Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni. Bezprostřední a dlouhodobé výsledky u 150 pacientů
- Migraeflux v akutní léčbě migrény
- Účinnost a komplikace léčby snímatelnými kontaktními fixacemi u pacientů s neuropatickými ulceracemi, akutní Charcotovou osteoartropatií a neuropatickými frakturami
- Poruchy metabolizmu železa II.
- Nekomplikovaný priebeh“ hypertenzie, paroxyzmálnej atriálnej fibrilácie a esenciálnej trombocytémie
- Karcinoid
- Lack of Efficacy of Ticlopidine Pre-Treatment in the Reduction of Troponin I Release Following Percutaneous Intervention in Stable Angina Patients
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinoid
- Poruchy metabolizmu železa II.
- Migraeflux v akutní léčbě migrény
- Význam vyšetření kontraktilní rezervy levé komory dobutaminovou echokardiografií u nemocných s pokročilým chronickým srdečním selháním
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

