-
Medical journals
- Career
Patofyziologie diabetické retinopatie
Authors: T. Sosna
Authors‘ workplace: Primář: MUDr. Karel Sedláček ; Oční oddělení Fakultní Thomayerovy nemocnice, Praha
Published in: Prakt. Lék. 2009; 89(2): 89-92
Category: Of different specialties
Overview
Základním patogenetickým podkladem vzniku diabetické retinopatie je hyperglykémie. Poškození kapilár sítnice diabetika může být vysvětleno mnoha mechanismy. Příčinou může být sorbitolové přetížení, vliv hromadění pokročilých produktů neenzymatické glykace, oxidační stres i buněčná apoptóza, způsobená paradoxním glukózovým hladověním. V článku je dále rozebrán mechanismus poruchy kapilár sítnice na podkladu hemorheologických, hemodynamických a histopatologických změn. Je zde zdůrazněn specifický vliv retinálního pigmentového epitelu sítnice. Jsou popsány histopatologické změny vedoucí k základním mikrocirkulačním změnám vzniklým zánikem pericytů, poruchou endotelových buněk a bazální membrány. Tyto změny se projeví kapilární dilatací, vaskulární okluzí a formací novotvořených cév.
Klíčová slova:
patofyziologie diabetická retinopatie, hyperglykémie, pericyty, endotelové buňky.Přestože se diabetická retinopatie (DR) studuje již mnoho desetiletí, zůstává biochemický a molekulární mechanismus jejího vzniku nejistý. Patogenetickým podkladem DR je totiž množství známých, ale velmi pravděpodobně i dosud zcela neznámých mechanismů. Etiopatogeneticky se diabetes mellitus (DM) 1. a 2. typu zřetelně liší. Přesto je zřejmé, že oba typy musí mít společný faktor, který je zodpovědný za vznik a rozvoj DR. Tím společným a nepochybným patologickým agens DR je kolísání hladiny cukru, ale především hyperglykémie.
Vliv hyperglykémie na cévní endotel
Zvýšení koncentrace hexózy v krvi diabetika podporuje biochemickou teorii o hyperglykémii jako základním článku vzniku DR (4, 5). Biochemické hypotézy již dlouho hovoří o polyolové-sorbitolové cestě. Teorií sorbitolové akumulace, respektive přetížení (sorbitol overload) se vysvětluje hyperosmotický efekt na čočce diabetika. Dochází k bobtnání a následné akumulaci sorbitolu (glucitolu) a fruktózy v čočce. Tím vznikají známé akomodační obtíže diabetiků a později snad i diabetická katarakta. Teorie sorbitolové akumulace je založena na předpokladu, že glukóza se při hyperglykémii metabolizuje na sorbitol aldózo-reduktázovým enzymatickým mechanismem. Některé práce dokládají přítomnost aldózo-reduktázových enzymů především v pericytech sítnice. To by mohlo být jedním z vysvětlení prvotního a velmi izolovaného zániku pericytů sítnicových kapilár (10).
Buněčná membrána je pro sorbitol prakticky neprostupná, což vede k jeho tkáňové akumulaci. Na rozdíl od nervové tkáně je vytvoření dostatečného osmotického gradientu, který by primárně poškodil endotelové buňky sítnicových kapilár, jen málo pravděpodobné (9, 33).
V současné době se zkoumá in vivo a in vitro vliv inhibitorů aldózo-reduktázy na zpomalení rozvoje DR. Je dobře znám pozitivní efekt sorbinilu na hematookulární barieru diabetiků s počínající DR. Dobře fluorofotometricky dokumentované studie podporují teorii aldózo-reduktázové inhibice, jako stabilizujícího faktoru DR (4, 5, 10, 13, 16, 35).
Nepochybný vliv na vznik chronických komplikací u diabetiků mají pokročilé produkty neenzymatické glykace. Excesivní hromadění pokročilých produktů glykace (AGE – advanced glycation endproducts) přispívá také k mikrovaskulárním změnám sítnicových cév. Tyto produkty mohou svým přímým působením měnit cévní rigiditu, ale i poškodit pojivovou tkáň. In vitro byla prokázána jejich toxicita na pericyty a mitogenní působení na endotelové buňky (24).
Oxidační stres, který provází hyperglykémii, má za následek nerovnováhu mezi volnými radikály a buněčným antioxidačním obranným mechanismem. Vznikající pseudohypoxie může porušit buněčnou membránu denaturací proteinů, poškozením DNA přeměnou glukózy na toxický peroxid a oxoaldehyd (20, 21).
Další zajímavá hypotéza se týká pericytů, které jsou na rozdíl od buněk endotelu zvláště citlivé na nedostatek glukózy. Takzvané paradoxní glukózové hladovění (starvation) velmi pravděpodobně vede k jejich apoptóze (24). Tento zdánlivě nelogický jev je způsoben dlouhodobou hyperglykémií vedoucí ke snížení množství glukózového transportéru 1 (GLUT 1), který obsahují především pericyty. Jeho nedostatek v pericytech způsobí tak sekundárně snížený přísun glukózy do buňky (15, 17).
Podobný apoptotický mechanismus by mohl vysvětlit i progresi DR při prudkém poklesu hladiny glukózy u rychle kompenzovaných diabetiků, kteří měli delší čas vysoké hladiny cukru v krvi (EW syndrom). Apoptóza následkem dlouhodobé hyperglykémie je však také popisována některými autory u endotelových buněk. Jisté je, že popisované změny nemohou plně vysvětlit okluzívní procesy v kapilárách.
Jsou zkoumány i vlivy vysokých hladin glukózy na myo-inositolový a inositolfosfátový metabolismus. Diacylglycerol (DG) spolu s Ca2+a dalšími látkami tvoří komplex aktivující proteinkinázu C (PKC). Navíc je DG prekurzorem při syntéze prostaglandinů. Enzymová aktivita PKC a DG je zřetelně vyšší u právě diabetiků. Je zjištěno, že PKC významně ovlivňuje nejen cévní permeabilitu, ale i kontraktilitu (zřejmě opět specifickým působením na pericyty), krevní průtok i angiogenezi. Ovlivňuje též intracelulární adhesivní molekuly a cytokiny jako transforming growth factor β (transformační růstový faktor – PKC-ß). Podávání perorálních inhibitorů PKC ve studiích na zvířecích modelech prokázalo jejich schopnost potlačit vznik i rozvoj DR. Vascular endothelial growth factor (cévní endotelový růstový faktor – VEGF) je aktivován také PKC u těžké hypoxie (1, 23, 37).
Hemorheologické změny
Dlouhodobá hyperglykémie vede různými mechanismy k poruše mikrocirkulace. Ta je sledována kapilární hyperpermeabilitou. Hyperglykémie zvyšuje krevní viskozitu a mění koncentraci plazmatických proteinů. Současně se zvyšuje agregace trombocytů. Změny rigidity a flexibility erytrocytů vedou k mikrotraumatizaci endotelu kapilár, při které se zároveň zvyšuje množství uvolněného von Willebrandova faktoru, který má přímý agregační vliv. Mechanické poškození je zřejmě výraznější při zrychleném průtoku krve kapilárami, který provází hyperglykémii. Současně výrazně ale klesá oxygenace. Je snížena schopnost přenosu kyslíku erytrocyty (6, 11).
Také leukocyty hrají důležitou roli v patogenezi DR. Velikost leukocytů téměř dosahuje průměru kapilár. Díky své pozoruhodné schopnosti deformace jimi procházejí. U diabetiků se ale zvyšuje jejich adherence k endotelu a mohou tak uvolňovat proteolytické enzymy. Zároveň s narůstající průtokovou rezistencí se uvolňují i kyslíkové radikály. Tyto změny také mohou mít za následek kapilární okluzi. Někteří autoři je dávají do přímé souvislosti s tak zvaným capillary drop out, rychlým zánikem perimakulární kapilární sítě. Na zvýšenou adhezivitu má zřejmě také vliv Golgiho glykosylovaný enzym (31).
Hemodynamické změny
V počátcích nekontrolovaného diabetu dochází ke změnám průtoku krve kapilárami. Například experimentálně vyvolaná glykémie kolem 25 mmol/l jej signifikantně zvyšuje. Některé práce za použití LDV (laser doppler velocimetry), označují jako kritickou hladinu již 17 mmol/l. Podobný, ale méně významný jev je však zaznamenán i při hypoglykémii. Změny průtoku bezprostředně snižují vaskulární reaktivitu. Na zvířatech bylo prokázáno, že i tyto změny poškozují endotel cév (2, 10). Jistě se na tomto poškození podílí mechanicky změnou své rigidity i krevní elementy. Jak již bylo řečeno předpokládá se mikrotraumatizace endotelu kapilár.
Ve chvíli kdy se diabetická retinopatie vyvinula, snižuje se průtok krve ve střední periferii sítnice. Je to ochranný mechanismus, jímž se zachová normální průtok ve funkčně důležitější centrální oblasti. Teprve následkem dalšího poklesu průtoku krve sítnicí a vznikem rozsáhlejších ischemických oblastí je poškozena perifoveolární oblast, v níž dramaticky klesá průtoku krve (32).
Retinální pigmentový epitel sítnice
V patogenezi vzniku DR hraje velmi významnou roli retinální pigmentový epitel (RPE). U diabetika dochází k nárůstu koncentrace sorbitolu v RPE, a tím k primárním změnám osmotického gradientu a Na+ - K+ - ATP aktivity. Tímto mechanismem se vysvětluje především porucha metabolismu buněk nervové tkáně, ganglionární i nukleární vrstvy sítnice. Larson s Paulsonem v roce 1962 publikovali práci, ve které prokázali, že hyperglykémie u diabetiků vede k poklesu nitrooční tenze (22).
Podobný jev byl pozorován i u hypoglykémie. Noční hypoglykémie zřejmě na podobném principu vedou u proliferativní DR ke vzniku hemoftalmu. Tato relativní hypotenze může morfologicky a i funkčně měnit strukturu RPE. Hovoří se o vchlípení plazmatické membrány (infolding) na bazální ploše RPE buněk přilehajících k choriokapilaris. Funkční alterace RPE může být jednou z příčin zhroucení zevní, ale i vnitřní hematookulární bariery. Abnormální transport přes porušený RPE umožňuje tak některým proliferačním faktorům snadno pronikat do sklivce a zvyšovat proliferační potenciál oka (14).
Perfuzní tlak sítnicových cév je definován rozdílem mezi intravaskulárním a intraokulárním tlakem. Snížení intraokulární tenze vede k relativnímu zvýšení perfuzního tlaku. Důsledkem je progrese venózní dilatace a později zhroucení autoregulačních systémů. Relativní nárůst perfuzního tlaku také vede k výraznější exsudaci a zeslabení stěn kapilár a spolupůsobí při vzniku mikroaneurysmat. Tento mechanismus by také konečně i vysvětloval vyšší zánik fragilnějších pericytů v sítnici, než jaký je v ostatních orgánech s výjimkou srdce, kde jsou též rozdílné perfúzní tlaky.
Histopatologické změny
Primární histopatologické změny nacházíme v kapilárním řečišti. Tyto změny se týkají především pericytů, buněk endotelu a bazální membrány. Pro pochopení jednotlivých histopatologických procesů v cévním řečišti sítnice je třeba si uvědomit některé jeho zvláštnosti.
Ve většině tkáňových kapilár je poměr endotelových buněk k pericytům 2 : 1 jen v kapilárách sítnice je tento poměr 1 : 1. Navíc mají endotelové buňky sítnice velmi těsná junkční spojení mezi sebou tzv. zonulae occludentaes, což za normálních okolností velmi dobře zabraňuje extravazálnímu prosakování. Jsou poslední anatomickou hradbou vnitřní hematookulární bariery.
Endotelové buňky cév sítnice plní četné funkce, např. antikoagulační, fibrinolytické, antiagregační, imunologické, sekreční, včetně produkce růstových a vazogenních faktorů (19).
Funkce pericytů zatím není zcela jasná. Pravděpodobně nejdůležitější a bezpečně známou vlastností pericytů je kontraktilita.V podstatě se všeobecně uznává, že pericyty, stejně jako jiné mesangiální buňky, jsou schopny vlastní kontrakce, přestože neobsahují myofibrily. V cytoskeletu pericytů, tak jako u ostatních amoebocytů, je přítomen alfa-aktin, který dovoluje buňkám vytvářet a stahovat výběžky. Na chemické inotropní signály (endotelin), stahují pericyty své výběžky, jež jsou v kontaktu s endotelovými buňkami, a nabývají vřetenovitého tvaru. Uvolněním kontaktu se tak zvětšuje volná plocha endotelu, a tím i povrch, kterým dochází k difúzi (hovoří se o takzvaných paradoxních fenestrech). Tímto mechanismem zřejmě kontrolují pericyty transport tekutin, hormonů a jiných molekul, které se pohybují oběma směry kapilární stěnou. Distálně od pericytu se tím může měnit i lumen kapiláry. V souhlase s tím je i pozorování, že pericyty nejsou nacházeny přímo v místě kontrakce, ale i dedukce, že za dynamiku kapilární stěny mohou být po mechanické stránce odpovědny převážně endotelie. Dalším důležitým známým faktem je, že kontrakce pericytů je inhibována ve tkáňových kulturách vysokým obsahem glukózy v mediu.
Ztráta pericytů u dekompenzovaných diabetiků vede tak k poruše funkcí kapilár sítnice (25). Jak již bylo řečeno, jde zpočátku o do značné míry selektivní ztrátu převážně pericytů a jen minimální ztrátu endotelových buněk. Zároveň však dochází i k poruše a zeslabení bazální membrány. Zánik pericytů je natolik izolovaný, že se týká především sítnicových kapilár a ne ostatních kapilár v těle stejného kalibru s výjimkou myokardu. Zde zřejmě vstupují do hry výše zmíněné další vlivy a specifiky oka, retinální pigmentový epitel, nitrooční tenze i perfúzní tlaky.
Histologické změny při počínající diabetické retinopatii jsou nejprve omezeny na kapiláry. Projevují se endoteliální proliferací a vznikem mikroaneurysmat na venózní straně kapiláry (2, 29). Arteriální strana jeví známky spíše degenerativního postižení buněk endotelu. S postupujícím onemocněním v arteriální části kapiláry se objevují známky další degenerace buněk, zatímco na její venózní straně přibývá počet mikroaneurysmat. Tento jev je částečně způsoben anatomickou strukturou arteriální a venózní části kapilár.
Tyto histopatologické změny nejsou však v oku specifické pro DR. Je známo, že sítnice má velmi omezenou schopnost rozdílně reagovat na odlišné patologické podněty. V případě rozličných vaskulárních retinopatií se jednotlivé nálezy od DR histologicky příliš neliší. Jediný podstatnější rozdíl může být v distribuci a počtu změn na sítnici. Mikroaneurysmata nalezneme u hypertenze, ischemických syndromů a žilních okluzí, HIV mikrovaskulopatií, SLE, polyarteritis nodóza, Wegenerovy granulopatózy, leukémie, Waldenstromovy makroglobulinémie, myeloma multiplex, toxické talkové retinopatie, Ealsovy choroby.
Image 1. Středně pokročilá forma neproliferativní diabetické retinopatie 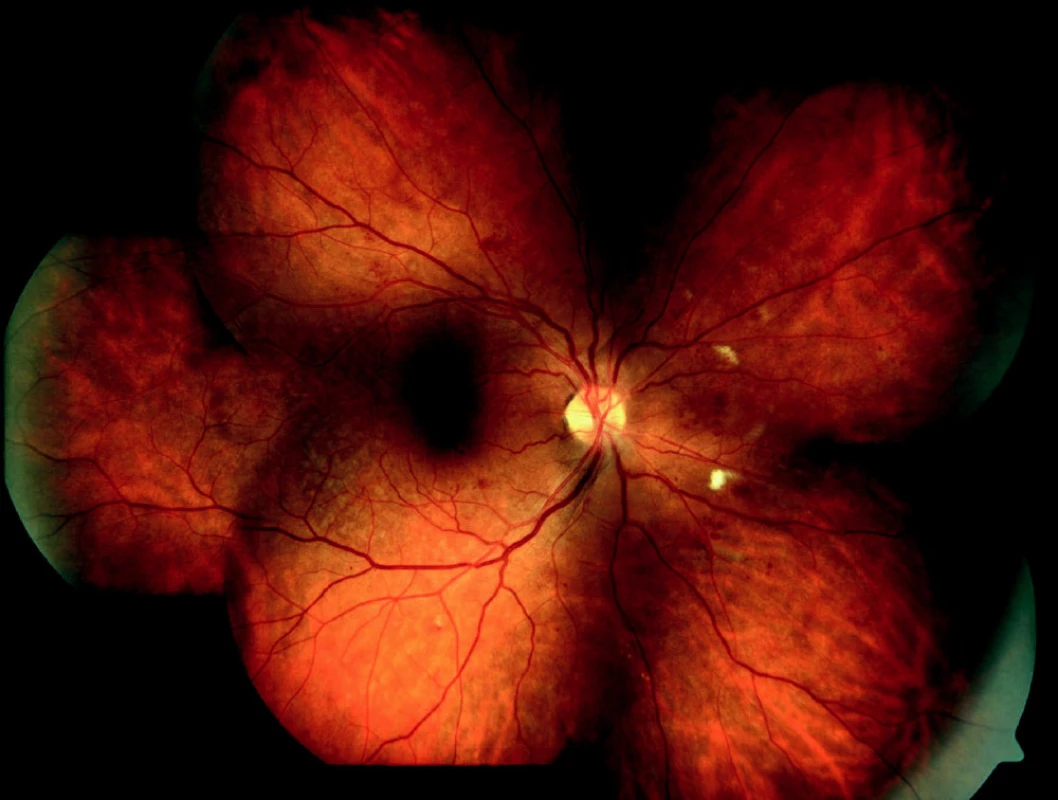
Dynamika patogenetických změn
Dlouhodobá hyperglykémie tedy vede k dalším mikrocirkulačním změnám. Projevují se kapilární dilatací a kapilární hyperpermeabilitou.
Kapilární dilatace a kapilární hyperpermeabilita
Kapilární dilatace je prvou klinicky významnou, časnou manifestací DR. Je dobře patrna při fluorescenční angiografii i v době, kdy ještě nejsou jasné histoanatomické změny na endotelových buňkách a bazální membráně (2). Pokračující proces se projevuje na kapilárách vymizením pericytů. Rozvolňuje se kontakt mezi buňkami endotelu a pericyty, které přestanou ovlivňovat průtok krve v kapilárách, a tím dochází i k postupné involuci cévního řečiště. Kapilární hyperpermeabilita je další změnou, která vzniká patrně následkem změn předchozích. Jedná se o histoanatomické změny bazální membrány kapilár (1). Následné prosakování séra vede ke vzniku edému sítnice a k jejímu závažnému funkčnímu poškození.
Vaskulární okluze
Dalším projevem poškození sítnice u diabetika je vaskulární okluze. Ani příčina tohoto procesu není úplně vysvětlena. Předpokládá se, že podstatou tohoto jevu je aktivní hemostáza a zvýšená agregace trombocytů v krvi diabetických pacientů s retinopatií (6, 31, 34). Vliv leukocytů na kapilární okluzi byl již popsán. Tvorba mikrotrombů je usnadněna změněnou fibrinolytickou a antitrombotickou aktivitou poškozených buněk endotelu. Podílí se na tom i zrychlený průtok krve a zvýšená krevní viskozita a další hemorheologické změny (zvýšená koncentrace fibrinogenu, změny plazmatických proteinů, apod.). Tyto abnormality byly prokázány jak in vivo, tak in vitro.
Přímý vliv na kapilární okluzi mají zřejmě i lipoproteiny nízké denzity, inzulín, histamin a uvolněné katecholaminy v průběhu reaktivních hypoglykémií (3, 21, 34). Okluzívní procesy již přímo vedou ke vzniku ischemických oblastí v sítnici a k následné hypoxii až úplné anoxii přilehlých tkání.
Formace novotvořených cév
Poslední z triády diabetických sítnicových abnormalit je formace novotvořených cév. Opět to není to specifický projev DR. Formaci novotvořených cév nacházíme na sítnici u pacientů s venózní okluzí, u vaskulitid, ale i u srpkovité anemie. U všech těchto případů je primární změnou, předcházející vznik novotvořených cév, arteriolární a kapilární okluze. Za jeden z hlavních patofyziologických podkladů tvorby neovaskularizací je považována hypoxie. Prvním krokem směřujícím k tvorbě novotvořených cév je rozpad extracelulární matrix. Příčinou tohoto rozpadu je sekrece proteoglykanů, hypoxií poškozenými endotelovými buňkami. Po ní následuje buněčná migrace a proliferace. Konečnou fází je formace cévního lumina (7, 11).
Endokrinní a růstové faktory mohou hrát významnou roli v patogenezi diabetické retinopatie. K nejvýznamnějším patří růstový hormon (GH) (3, 12, 30). Hladiny růstových hormonů jsou u diabetiků zvýšené. GH působí prostřednictvím insulin (like) growth faktoru-1, (IGF-1).
IGF-1 je produkován především endotelovými buňkami a jeho hladiny u inzulín dependentních pacientů jsou obecně nízké (8). Hladina tohoto hormonu se významně zvyšuje u progresivních forem DR, ale také při náhlé kompenzaci dlouhodobě dekompenzovaného diabetu (18). Jeho zvýšenou koncentraci nacházíme ve sklivci u diabetiků s proliferativní DR (1).
Podle experimentálních studií i podle toho, jaké jsou hladiny IGF-1 po laserové panretinální fotokoagulaci sítnice (PRFK), se předpokládá, že IGF-1 je vytvářen nejenom buňkami endotelu a pericyty, ale i retinálním pigmentovým epitelem (RPE) sítnice.
Již od roku 1948 je předpokládána existence těchto angiogenních faktorů, které umožňují růst novotvořených cév. Jejich existence byla potvrzena v roce 1956. Tyto faktory jsou za fyziologických podmínek v rovnováze s antagonisticky působícími, inhibičními faktory.
Mezi dalšími proliferačními faktory je vascular endothelial growth factor – VEGF, velmi úzce spjat vazoobliterující hypoxickou sítnici s PKC a AGE (38). Basic FGF (fibroblast growth factor) je produkován endotelovými buňkami a při jejich zániku se uvolňuje a ukládá do extracelulární matrix. Poškozený pigmentový epitel sítnice podporuje také specifickým způsobem proliferaci RDGF (retina derivated growth factor). Do tohoto procesu současně vstupuje i mitogenní efekt růstového hormonu, který je opět zprostředkován IGF l (26).
Dalšími růstovými faktory, které mohou výrazně ovlivnit proliferaci, jsou basic a acidic fibroblast growth factor (bFGF, aFGF), dále platelet derivated growth factor (PDGF) a transforming growth factor ß (TGF ß). Je známa existence angiogenezi inhibujících faktorů, (somatostatin, oktreotid, polypeptid hypotalamu) které inhibuji uvolňování GH.
Jak již bylo řečeno u zdravého jedince se tedy předpokládá rovnováha mezi angiogenezi stimulujícími a inhibujícími faktory. Tyto inhibující faktory jsou také obsaženy v endotelových buňkách, v pigmentovém epitelu sítnice a pravděpodobně i v pericytech. Při poruše této rovnováhy, následkem poškození endotelu, či RPE, cévy mohou proliferovat.
V roce 1953 byla popsána regrese proliferativní diabetické retinopatie po postpartuální nekróze hypofýzy. V krátkém období byla pak hypofyzektomie a implantace ytriového zářiče léčebnou metodou u pacientů s proliferativní DR (27, 36). Hladina růstového faktoru zřejmě ovlivňuje průběh DR u dětí a dospívajících. Formování novotvořených cév je zcela specifická, izolovaná vlastnost sítnice, která nemá obdobu v jiných orgánech.
Závěr
Diabetická retinopatie představuje nejčastější příčinu slepoty ve vyspělých zemích. Přes všechny pokroky v léčbě i prevenci DR je nárůst slepých pacientů stálý a dramatický. Pochopení všech mechanismů, vedoucích ke vzniku a vývoji DR jistě povede k novým strategiím prevence a léčby tohoto onemocnění (28).
doc. MUDr. Tomáš Sosna, CSc.
Oční oddělení FTN
Vídeňská 800
140 59 Praha 4
E-mail: tomas.sosna@ftn.cz
Sources
1. Adamis, A.P, Miller, J.W., Bernal, M.T. et al. Elevated vascular permeability factor, vascular endothelial growth factor levels in the vitreous of eyes with proliferative diabetic retinopathy. Am. J. Ophthalmol. 1994, 118, p. 445-450.
2. Ashton, N.A. Vascular basement membrane changes in diabetic retinopathy. Br. J. Ophthalmol. 1974, 58, p. 344-366.
3. Barnes, A.J., Kohner, E.M., Johnston, D.G., Alberti, K.G. Severe retinopathy and mild carbohydrate intolerance: possible role of insulin deficiency and elevated circulating growth hormone. Lancet 1985, 1(8444), p. 1465-1468.
4. Cagliero, E. Characteristics and mechanisms of high – glucose inducted overexpression of basement membrane components in cultured human endothelial cells. Diabetes 1991, 40, p. 102-109.
5. Cohen, R.A., Hennekens, C.H., Christen, W.G. et al. Determinants of retinopathy progression in type 1 diabetes mellitus. Am. J. Med. 1999, 107, p. 145-151.
6. Collier, A., Tymkewycz, P., Armstrong, R. et al. Increased platelet thromboxane receptors sensitivity in diabetic patients with proliferative retinopathy. Diabetologia 1986, 29, p. 471-474.
7. D’Amore, P. Mechanisms of retinal and chorioidal neovascularisation. Invest. Ophthalmol. Vis. Sci. 1994, 35, p. 3974-3979.
8. Danias, J., Stilianopoulou, F. Expression of IGE-l and IGF-2 genes in the adult rat eye. Curr. Eye Res. 1990, 9, p. 379-386.
9. Dorovini-Zis, K., Bowman, P.D., Betz, A.L., Goldstein, G.W. Hyperosmotic arabinose solutions open the tight junctions between brain capillary endothelial cells in cell culture. Brain Res. 1984, 302, p. 383-386.
10. Engerman, R.L., Kern, T.S. Aldoso reductase inhibitors fail to prevent retinopathy in diabetic and galactosaemic dogs. Diabetes 1993, 42, p. 820-825.
11. Faumenhaft, R., Abe, M., Mignatti, P., Rifkin, D.B. Basic fibroblast growth factor-induced activation of latent transforming growth factor - beta in endothelial cells: regulation of plasminogen activator activity. J. Cell Biol. 1992, 118, p. 901-909.
12. Forrester, J.V., Shafiee, A.F., Schroder, S. et al. The role of growth factors in proliferative diabetic retinopathy. Eye 1993, 7, p. 276-287.
13. Frank, R.N. The aldose reductase controversy. Diabetes 1994, 43, p. 169-172.
14. Glaser, B.M., Campochiaro, P.A., Davis, J.L., Jerdan, J.A. Retinal pigment epithelial cells release inhibitors of neovascularization. Ophthalmology 1987, 94, p. 780-784.
15. Gould, G., Bell, G.I. Facilitative glucose transporters: an expanding family. TIBS 1990, 15, p. 18-23.
16. Group, S.T.R. A randomised trial of sorbinil an aldoso reductase inhibitor, in diabetic retinopathy. Arch. Ophthalmol. 1990, 108, p. 1234-1244.
17. Harik, S.I., Kalaria, R.N., Whitney, P.M. Glucoso transporter are abundant in cells with occluding junction at blood retinal barrier. Proc. Natl. Acad. Sci. 1990, 87, p. 4261-4264.
18. Chantelau, E. Evidence that upregulation of serum IGF - 1 concentration can trigger acceleration of diabetic retinopathy. Br. J. Ophthalmol.1996, 82, p. 725-730.
19. Jaffe, A. Cell biology of endothelial cells. Human. Pathol. 1987, 18, p. 234-239.
20. Kubes, P., Granger, D.N. Nitric oxide modulates microvascular permeability. Am. J. Physiol. 1992, 262, p. 611-615.
21. Kwamura, M., Heineke, J.W., Chait, A. Pathophysiological concentrations of glucose promote oxidative modification of LDL by a superoxide dependent pathway. J. Clin. Invest. 1994, 94, p. 771-778.
22. Larson, H.W., Poulsen, J.E. Intra-ocular tension and blood sugar fluctuations in diabetes. Acta Ophtalmol. 1962, 40, p. 580-589.
23. Lee, T.S., Saltsman, K.A., Ohashi, H., King, G.L. Activation of protein kinase C by elevation of glucose concentration. Proc. Natl. Acad. Sci. 1990, 86, p. 5141-5145.
24. Li, W., Liu, X., Yanoff, M., Cohen, S., Ye, X. Cultured retinal capillary pericytes die by apoptosis after an abrupt fluctuation from high to low levels: a comparative study with retinal capillary endothelial cells. Diabetologia 1996, 39, p. 537-557.
25. Lyons, T.J., Li, W., Wells-Knect, M.C., Jokl, R. Toxicity of mildly modified LDL to cultured retinal capillary endothelial cells and pericytes. Diabetes 1994, 43, p. 1090-1095.
26. Moriarty, P., Bouton, M., Dickson, A., McLeod. D. Production of IGF-1 and IGF binding proteins by retinal cells in vitro. Br. J. Ophtalmol. 1994, 78, p. 638-642.
27. Poulsen, J.E. Recovery from retinopathy in the case of diabetes in Simmod‘s disease. Diabetes 1953, 2, p. 7-12.
28. Saudek, F., Bartoš, V., Vaněk, I. et al. Dlouhodobá léčba diabetu transplantací pankreatu. Čas. Lék. čes. 1996, 135, s. 348-653.
29. Schwieki, D., Itin, A., Soffer, D., Kesht, E. Vascular endothelial cell growth factor may mediate hypoxia – initiated angiogenesis. Nature 1992, 359, p. 843-845.
30. Sönksen, P.H., Russell-Jones, D., Jones, R.H. Growth hormone and diabetes mellitus. A review of sixty - three years of medicinal research and a glimpse into the future? Horm. Res. 1993, 40, p. 68-79.
31. Tarboletti, G., Roberts, D., Liotta, L., Giavezzi, R. Platelet thrombostatin modulates endothelial cell adhesion motility and growth: a potential angiogenesis regulatory factor. J. Cell. Biol. 1990, 111, p. 765-772.
32. Tooke, J.E. Microvascular haemodynamics in diabetics. Eye 1993, 7, p. 227-229.
33. Vondrová, H., Bartoš, V., Bouček, P. a kol. Vztah diabetické polyneuropatie k cévním a orgánovým komplikacím u diabetu mellitu I. typu. Čas. Lék. čes. 1990, 129, s. 1161-1165.
34. Watanabe, J., Wohtmann, H.J., Klein, R.L. et al. Enhancement of platelet aggregation by low density lipoprotein in patients with diabetes mellitus. Diabetes 1988, 37, p. 1652-1657.
35. Wilson, D.K., Bohren, K.M., Gababy, K.H., Quicho, F.A. An unlikely sugar substrate site in the 1.65 A Structure of the human aldoso reductase holoenzyme implicated in diabetic complications. Science 1992, 257, p. 81-84.
36. Wright, A., Kohner, E.M., Oakley, N.W. et al. Serum growth hormone levels and the response of diabetic retinopathy to pituitary ablation. BMJ 1969, 2(5653), p. 346–348.
37. Xia, P., Aiello, L.P., Ishii, H. et al. Characterisation of vascular endothelial growth factors effect of the activation of protein kinase C, its isoforms and endothelial cell growth. J. Clin. Invest. 1996, 98, p. 2018-2026.
38. Yasuda, Y., Clermont, A., Takahara, N. et al. Characterization of retinal abnormalities in vascular targeted overexpression of PKC beta2 isoform transgenic mice. Program and abstracts of the 63rd Scientific Sessions of the American Diabetes Association; June 13-17, 2003; New Orleans, Louisiana. Abstract 879-P.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2009 Issue 2-
All articles in this issue
- Posttraumatická stresová porucha u zneužívaných dětí
- Kouření a kardiovaskulární nemoci
- Zdravotní aspekty redukční mammaplastiky
- Prevence onemocnění klíšťovou encefalitidou z pohledu zdravotní pojišťovny
- Transplantace ruky
- Neurostimulace v léčbě refrakterní anginy pectoris
- Patofyziologie diabetické retinopatie
- Alergická rinitida jako nemoc z povolání
- Spokojenost pacientů s poskytovanou péčí: teoretické přístupy a modely
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Transplantace ruky
- Posttraumatická stresová porucha u zneužívaných dětí
- Alergická rinitida jako nemoc z povolání
- Spokojenost pacientů s poskytovanou péčí: teoretické přístupy a modely
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

