-
Medical journals
- Career
Primární adenokarcinom žaludku s yolk sac diferenciací
Authors: Z. Diviš 1; O. Lukáš 1; J. Laco 2; M. Kopáčová 3
Authors‘ workplace: Interní oddělení, Nemocnice Pardubického kraje, a. s., Chrudim 1; Fingerlandův ústav patologie, LF UK a FN Hradec Králové 2; II. interní gastroenterologická klinika LF UK a FN Hradec Králové 3
Published in: Gastroent Hepatol 2016; 70(4): 319-324
Category: Gastrointestinal Oncology: Case Report
doi: https://doi.org/10.14735/amgh2016319Overview
Prezentujeme kazuistiku 41letého pacienta, který byl přivezen do našeho zdravotnického zařízení pro podezření na krvácení do horní části gastrointestinálního traktu. Gastroskopicky byla nalezena exulcerovaná infiltrace na zadní stěně subkardiální části žaludku. Histologicky byl prokázán vzácný adenokarcinom žaludku s yolk sac diferenciací. Tento typ nádoru patří mezi malignity se špatnou prognózou. V době diagnózy bývá již přítomna generalizace s jaterním metastatickým postižením.
Klíčová slova:
žaludek – adenokarcinom – yolk sac tumorÚvod
Karcinom žaludku v současné době zaujímá celosvětově páté místo mezi zhoubnými nádory (po zhoubných nádorech plic, prsu, tlustého střeva, prostaty) a představuje ve stejném měřítku třetí nejčastější příčinu úmrtí na rakovinu u obou pohlaví [1]. Výskyt zhoubných novotvarů žaludku i jejich mortalita v ČR setrvale klesá dle dat z ÚZIS ČR [2]. Přesto, dle registru GLOBOCAN, byl v roce 2012 zjištěn celosvětově téměř milion nových případů zhoubných nádorů žaludku (952 000 případů; 6,8 % z celkového počtu onkologických onemocnění).
Adenokarcinom žaludku je onemocnění staršího věku, medián věku u mužů je 69 let, u žen pak 74 let [3]. V posledních letech je však zaznamenán vzestup incidence i u osob mladších 40 let. Nepříznivá prognóza tohoto onemocnění je způsobena především jeho pozdním záchytem.
Obecně pro tyto karcinomy žaludku platí, že pětileté přežití, udávané pro časný karcinom, je více než 90 %, pro pokročilý méně než 20 % [4]. Z 90 – 95 % se histologicky jedná o adenokarcinom, avšak existují vzácné typy žaludečního adenokarcinomu produkující α-fetoprotein (AFP). Tyto AFP produkující žaludeční karcinomy zaujímají 2–6 % ze všech žaludečních karcinomů [5]. Žaludeční tumory ze žloutkového váčku jsou extrémně vzácné a jejich prognóza velmi nepříznivá. Mnoho pacientů má v době diagnózy rozsáhlé metastatické postižení [6]. Většina nemocných s takto pokročilým onemocněním umírá do šesti měsíců od stanovení diagnózy (tab. 1).
Table 1. Stručný přehled případů yolk sac tumorů v literatuře. Upraveno dle [9]. Tab. 1. Brief re-view of yolk sac tumour cases in literature. Modified according to [9]. ![Stručný přehled případů yolk sac tumorů v literatuře. Upraveno dle [9].
Tab. 1. Brief re-view of yolk sac tumour cases in literature. Modified according to [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/74c70dc844e6a050f6a5e110fa395fb2.jpg)
YST – yolk sac tumor, AC – adenokarcinom, CC – choriokarcinom, VP-16 – etoposid, TS-1 – titanium silikát, CHT – chemoterapie, MLE – mediastinální lymfadenectomie, BEP – bleomycin, etoposid, cisplatina, RFA – radiofrekvenční ablace, MOF – multiorgánové selhání, dg – diagnóza,GE – gastroesofageální Popis případu
Představujeme 41letého pacienta s nevýznamnou osobní anamnézou (pouze operace tříselné kýly ve 20 letech a v dětství podstoupená apendektomie). Rodinná anamnéza byla pozitivní ve smyslu generalizovaného onkologického onemocnění – otec matky pacienta zemřel v 63 letech na onkologické onemocnění (bez možnosti bližšího určení). Matka otce pacienta zemřela v 60 letech na karcinom hrtanu. Rodiče pacienta byli zdrávi, sourozence neměl. Pacient pracoval jako řidič kamionu. Z rizikových faktorů udával od 15 let trvající nikotinizmus a alkohol konzumoval zcela výjimečně.
Pacient byl přivezen rychlou záchrannou službou na příjmovou ambulanci Interního oddělení Chrudimské nemocnice pro dyspeptický syndrom horního typu se suspekcí na krvácení do horní části gastrointestinálního traktu (GIT). Popisoval přibližně měsíc trvající dyspepsie horního typu (pocit plnosti, plynatosti a nechutenství) a dva měsíce trvající námahovou dušnost v posledním týdnu progredující do dušnosti klidové. Dále udával, že před přijetím opakovaně zvracel žaludeční obsah charakteru kávové sedliny, které se rozvinulo v časové korelaci s klidovou dušností. Stejně tak zaznamenal v posledním týdnu melénu, která však nebyla při přijetí verifikována. V laboratorních hodnotách byla zjištěna sideropenická (normocytární, normochromní) anémie s hemoglobinem (Hb) 69 g/l (laboratorní norma 135–180 g/l), MCV 82,40 fl (75–95 fl), MCHC 335,0 g/l (300–350 g/l), nízká plazmatická koncentrace železa 2,9 µmol/l (7,2–29 µmol/l) s normální hodnotou feritinu 221 µg/l (30–400 µg/l), elevace C-reaktivního proteinu (CRP) 102 g/l (> 5 mg/ l), s přítomnou hypoproteinemií 56 g/l (66–87 g/l) a hypoalbuminemií 33g/l (39–49 g/l). Z výše popsaných informací a laboratorních hodnot jsme získali podezření na krvácení do horní části GIT a pacienta jsme hospitalizovali na metabolické jednotce intenzivní péče. Byla zahájena hemosubstituce s podáváním inhibitorů protonové pumpy v parenterálním režimu a zajištěno gastroskopické vyšetření.
Při endoskopii jsme nalezli v subkardiální oblasti žaludku na zadní stěně exulcerovanou infiltraci (obr. 1). Pro absenci známek akutního krvácení nebyla nutná akutní endoskopická intervence. Byly odebrány vícečetné bioptické vzorky k histologickému vyšetření. Při následném ultrazvukovém vyšetření (UZ) břicha byla zjištěna vícečetná ložiska v obou jaterních lalocích při suspektním metastatickém jaterním procesu. UZ bylo doplněno CT vyšetřením břicha, kde byl verifikován tumor žaludku postihující zadní stěnu od úrovně kardie až téměř po angulární řasu se suspektní infiltrací do okolí s výraznou spádovou lymfadenopatií a známkami generalizace ve smyslu nálezu vícečetných ložisek v jaterním parenchymu velikosti 40–85 mm při metastatickém postižení (obr. 2). Dalším nálezem v laboratorních parametrech byla elevace transamináz AST 1,26 µkat/l (0,17–0,85 µkat/l), GGT 2,84 µkat/l (0,17–1,19 µkat/l), ALP 2,75 µkat/l (0,67–2,15 µkat/l) bez elevace ALT 0,22 µkat/l (0,17–0,83 µkat/l). V panelu onkomarkerů dominovala elevace AFP nad 1 210 µg/l (> 7 µg/l), ostatní onkomarkery (CEA, Ca 19-9 a HCG-β) byly v mezích normy. Rychlý ureázový test (CLO – Campylobacter-like organism) byl negativní. Elevace CRP byla bez známek aktivního infektu, vč. negativních základních kultivačních vyšetření. Při histologickém vyšetření odebraných vzorků z gastroskopie byl prokázán maligní nádor, kde jsme diferenciálně diagnosticky zvažovali metastázu nádoru z germinálních buněk či primární adenokarcinom žaludku s diferenciací směrem k zárodečným buňkám jako vzácně se vyskytující variantu karcinomu žaludku (obr. 3). Proliferační aktivita Ki-67 byla více než 90 %, imunohistochemicky s difuzní expresí cytokeratinů (AE1/AE/3) a SALL4, s fokální expresí cytokeratinu 7, AFP (obr. 4A) a glypicanu-3 (obr. 4B), ojediněle byla zjištěna i exprese CDX2. CK 20, CEA, OCT3/4 a CD30 byly však negativní. Toto imunohistochemické vyšetření svědčilo pro možný germinální nádor, proto jsme provedli UZ varlat, které však vykazovalo normální strukturu tkání, bez ložiskové a vaskulární patologie. Ze stejného důvodu jsme provedli CT vyšetření hrudníku, které nevykazovalo patologické změny vč. oblasti mediastina. Na základě výše popsaných výsledků vyšetření byla indikována cílená biopsie jater s verifikací metastáz adenokarcinomu žaludku s diferenciací směrem k zárodečným buňkám. Vzhledem k anatomickým poměrům jaterních metastáz a zvyklostí pracoviště byla radiologem doporučena biopsie jater pod CT kontrolou.
Image 1. V subkardiální oblasti na zadní stěně žaludku rozsáhlá exulcerovaná infiltrace. Fig. 1. Large ulcerated infiltration on the posterior wall of the stomach body in the subcardial area. 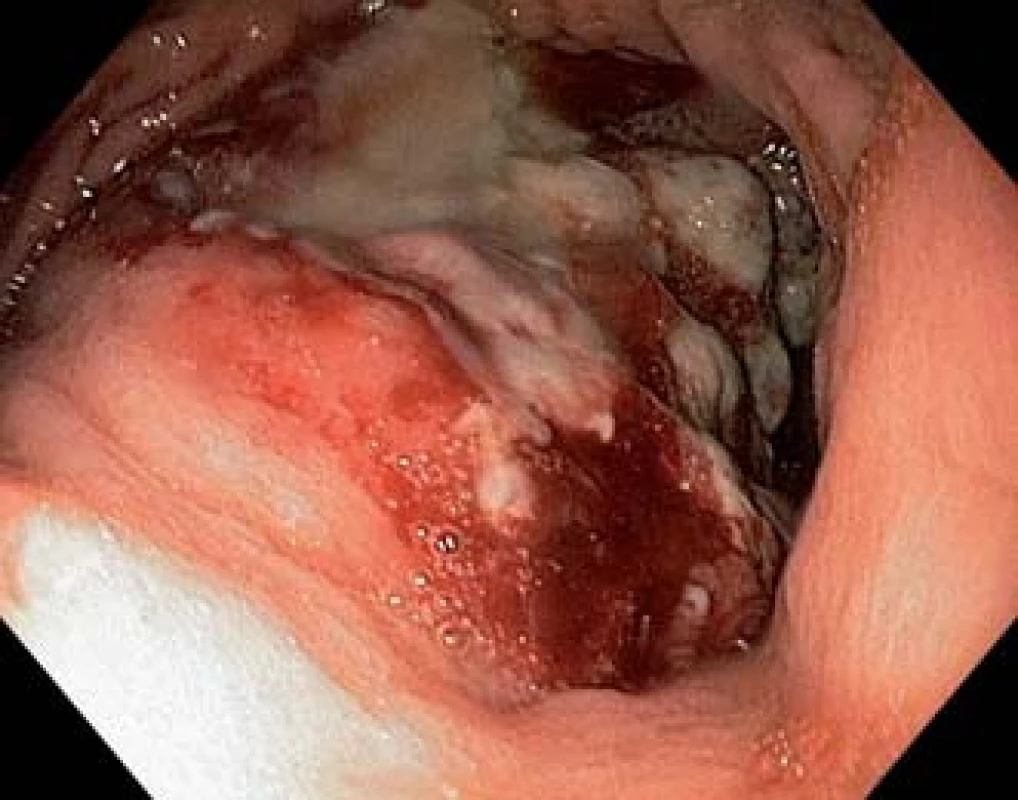
Image 2. Tumor postihující zadní stěnu žaludku od úrovně kardie téměř po angulus, stěna rozšířená nepravidelně až na 30 mm, výrazná spádová lymfadenopatie – perigastricky zmnožené uzliny 8–17 mm. Vícečetná metastatická ložiska jater veli-kosti 40–85 mm. Fig. 2. A tumour affecting the posterior wall of the stomach from the level of cardia almost up to the angulus, the wall is irre-gularly extended to up to 30 mm, distinct catchment lymphadenopathy – next to the stomach multiplied nodules of 8–17 mm. Multiple metastatic foci sized 40–85 mm in the liver. 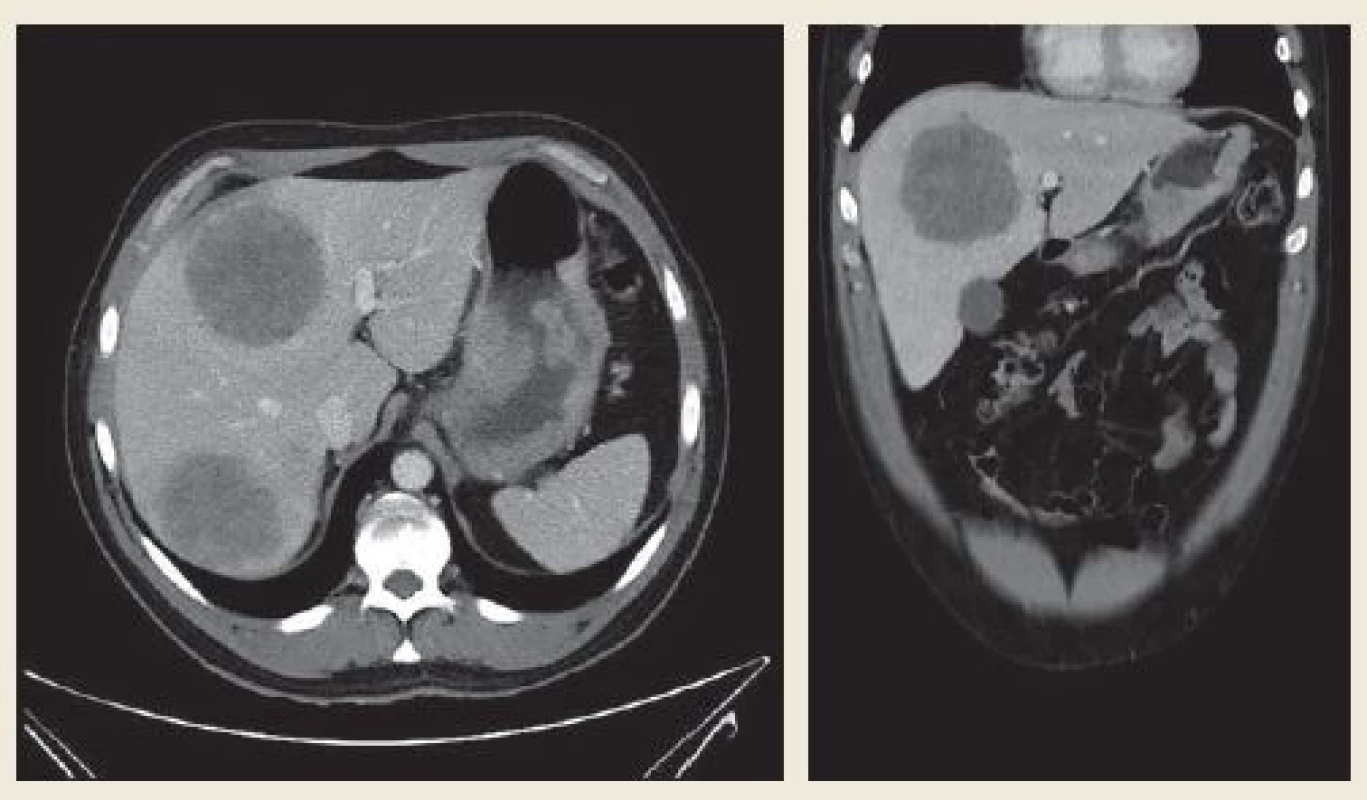
Image 3. Solidně rostoucí adenokarcinom ve sliznici žaludku (hematoxylin-eozin, původní zvětšení 200×). Fig. 3. Solid adenocarcinoma in gastric mucosa (haematoxylin-eosin, original magnification ×200). 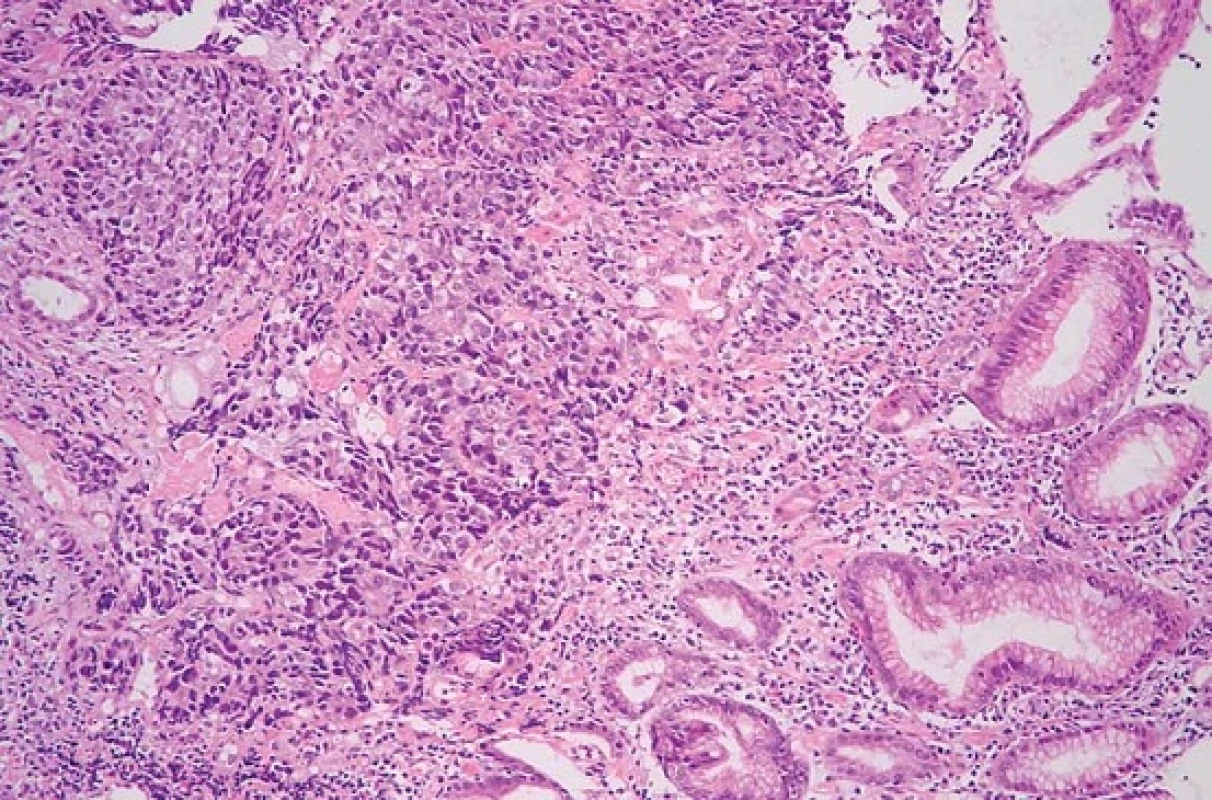
Image 4. A. Silná exprese α-fetoproteinu v nádorových buňkách (imunohistochemie, původní zvětšení 400×), B. Fokální silná exprese glypicanu-3 (imunohistochemie, původní zvětšení 400×). Fig. 4. A. Strong expression of α-fetoprotein in tumour cells (immunohistochemistry, original magnification ×400), B. Focal strong expression of glypican-3 (immunohistochemistry, original magnification ×400). 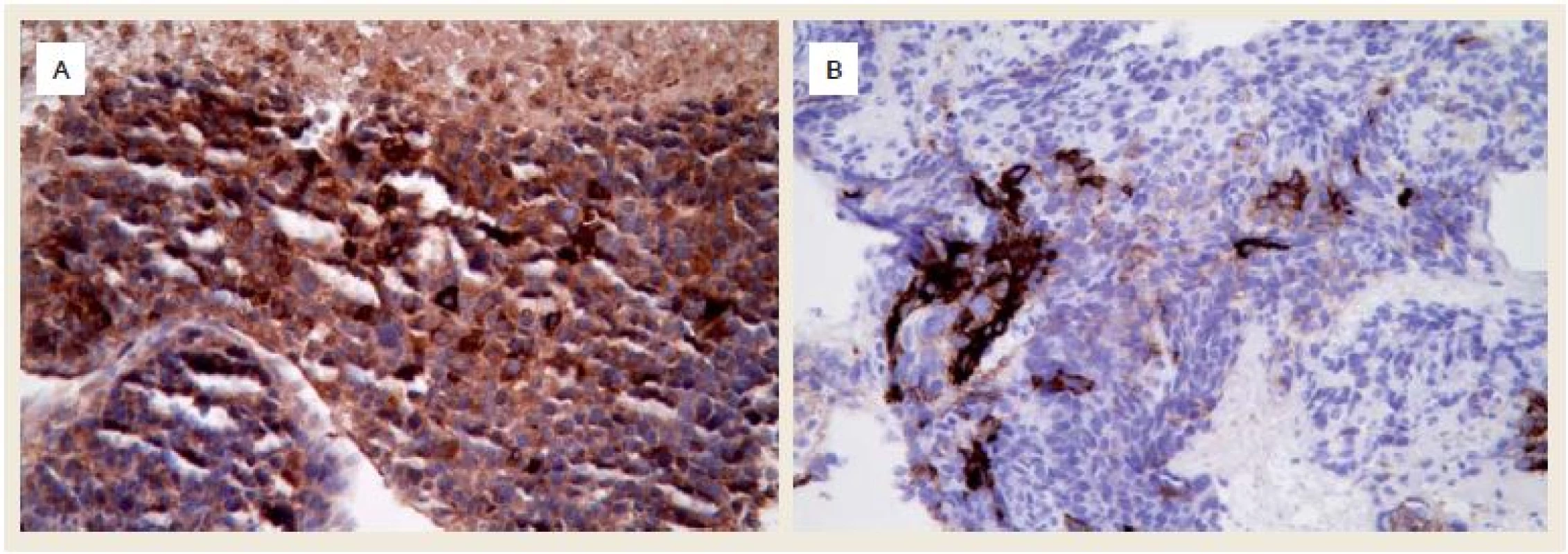
Dle rozhodnutí onkologa byla zahájena první série chemoterapie v režimu BEP (bleomycin, etoposid, cisplatina) v dávce cisplatina 40 mg D1 – D5, etoposid 200 mg D1 + D5, bleomycin 30 mg D1 + D8. Bleomycin 30 mg D15 nebyl podán pro febrilní stav s pancytopenií (leukopenie 0,3 × 109/l, anémie Hb 90 g/l, trombocytopenie 29 × 109/l) s nutností opakované hemosubstituce a podávání trombocytárních náplavů, filgrastimu a aplikací cefalosporinu III. generace. Po zlepšení stavu byly podány celkem tři série BEP. V dalším průběhu docházelo ke zhoršení základního onkologického onemocnění, proto bylo přistoupeno k druhé linii chemoterapie, resp. režimu vinblastin, ifosfamid, mesna, cisplatina (VeIP) v dávkách cisplatina 35 mg D1 – D5, vinblastin 5 mg D1 – D2, mesna 800 mg D1 – D5 a ifosfamid 1 800 mg D1–D5. Přes intenzivní léčbu nemocný zemřel na komplikace charakteru akutního krvácení z horní části GIT šest měsíců po stanovení diagnózy. Pitva nebyla provedena.
Diskuze
Představili jsme vzácný typ žaludečního adenokarcinomu s tzv. diferenciací směrem k zárodečným buňkám. Tento histologický typ nádoru byl do současnosti popsán v necelých 20 případech na celém světě (tab. 1) a dostupné informace pocházejí pouze z popisů jednotlivých případů. Poprvé žaludeční nádor se schopností uvolňovat AFP popsal v roce 1970 Boureille, jak uvádí Lunghi et al [7]. Extragonadální tumory ze zárodečných buněk jsou vzácné, představují 1–4 % všech nádorů ze zárodečných buněk [8].
Jasný mechanizmus vzniku žaludečních yolk sac tumorů (YST), jakož i dalších extragonadálních tumorů, není zcela objasněn. Předpokládají se dvě cesty vzniku. První teorií vysvětlující jejich vznik je migrace germinálních buněk během zárodečného vývoje nebo úloha multipotentní neoplastické protoepiteliální buňky žaludeční sliznice [9]. Většina autorů však zdůrazňuje teorii tzv. retrodiferenciace a vysvětluje tím vznik tumorů obsahujících germinální buňky v žaludku. Tato teorie předpokládá fakt, že žaludek vznikající z prvostřeva obsahuje všechny buňky s kompletním genetickým materiálem, a tudíž se nádorové buňky mohou diferencovat do yolk sac fenotypu [9].
AFP produkující žaludeční nádory se mohou rozdělovat na tři podtypy – hepatoidní, YST-like a fetální gastrointestinální [10].
V diferenciální diagnostice je třeba vyloučit tzv. hepatoidní adenokarcinom žaludku, který rovněž produkuje AFP. Hepatoidní adenokarcinom je zvláštní typ karcinomu, který se histologicky podobá hepatocelulárnímu karcinomu (HCC) a který se vyznačuje vysokou hladinou AFP v séru. Má stejný vysoce maligní potenciál jako YST s časnou lymfatickou invazí a časnými jaterními metastázami, což má rovněž za následek jeho špatnou prognózu i v případě časné diagnózy [11].
Dále byl zvažován metastatický proces v žaludku u HCC. Gastrointestinální metastázy HCC jsou však vzácné [12]. Ostatní stavy, jako je jaterní cirhóza, cholestáza a virové hepatitidy, mohou způsobovat elevaci AFP. Avšak hodnoty vyšší než 500 ng/ml jsou pro tyto stavy neobvyklé [10].
Na základě provedeného endoskopického vyšetření v korelaci s provedeným CT vyšetřením břicha s nálezem metastatického procesu jater bylo vysloveno podezření na žaludeční karcinom ve stadiu IV. Upřesnění diagnózy přineslo histologické a imunohistochemické vyšetření, které je pro přesné stanovení diagnózy YST nenahraditelné. Pouze AFP a glypican-3 jsou charakteristickými imunohistochemickými markery pro YST. Ostatní protilátky (SALL-4, Lin28, IMP-3) pomáhají v diferenciální diagnostice a některé další markery (CDX-2, TTF-1, HepPar1) slouží k verifikaci vzácnějších variant YST [13].
Obecně jsou tyto nádory spojovány s vyšší proliferační aktivitou, narušenou apoptózou a bohatou neovaskularizací [14], což předurčuje jejich špatnou prognózu. Pacienti již v době diagnózy mají často metastatické postižení jater. Odpověď na chemoterapii a radioterapii je všeobecně neuspokojivá, s krátkou počáteční odpovědí následovanou vznikem rezistence na chemoterapii. Přes různé modality chemoterapie, využití radioterapie a chirurgie se nedaří zlepšit prognózu tohoto agresivního onemocnění [5].
Muži jsou postiženi častěji [10], což potvrzuje i uvedený přehled kazuistik (tab. 1) [5,6,9,15–29]. Nejčastějším místem metastazování jsou játra. Většina případů se vyskytuje u starších pacientů. V porovnání s naším případem je shoda stran charakteristiky onemocnění vč. prognózy. Pacienti v pokročilém stadiu i přes adekvátní terapii umírají do šesti měsíců.
Závěr
Přestože v ČR lineárně klesá incidence i mortalita na zhoubná onemocnění žaludku, jedná se stále o poměrně časté a závažné onemocnění s nejistou prognózou. V případě tumorů s diferenciací k zárodečným buňkám je prognóza špatná i při časném záchytu onemocnění a intenzivní terapii. Přežívání se pohybuje kolem půl roku od stanovení diagnózy.
Podpořeno programem PRVOUK P37/ 08 a P37/ 11.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 13. 3. 2016
Přijato: 18. 5. 2016
MU Dr. Zdeněk Diviš
Interní oddělení
Nemocnice Pardubického kraje, a. s.
Chrudimská nemocnice
Václavská 570
537 27 Chrudim
divis.zdenek@email.cz
Sources
1. International Agency for Research on Cancer. World Health Organization. GLOBOCAN 2012: Estimated cancer incidence, mortality and prevalence worldwide in 2012. [online]. Available from: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx?cancer=stomach.
2. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www.svod.cz.
3. Obermannová R, Novák J, Novotný Iet al. Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku. Gastroent Hepatol 2013; 67(5): 390 – 395.
4. Rejchrt S. Endoskopická léčba premalignit a časných malignit GIT. Česká společnost HPB chirurgie 2002; 2(4): 19 – 21.
5. Hong R, Hong Suh C, Lee MJ. Adenocarcinoma with yolk sac tumor of the stomach: case report with review of the literature and an immunohistochemical study. Korean J Pathol 2007; 41(5): 352 – 357.
6. Kim YS, Kim SH, Seong JK et al. Gastric yolk sac tumor: a case report and review of the literature. Korean J Intern Med 2009; 24(2): 143 – 146. doi: 10.3904/ kjim.2009.24.2.143.
7. Lunghi A, Petreni P, Romanelli RG et al. Aggresive gastric carcinoma producing alpha-fetoprotein: a case report and review of the literature. Case Rep Oncol 2014; 7(1): 92 – 96. doi: 10.1159/ 000358509.
8. Singh M, Arya M, Anand S et al. Gastric adenocarcinoma with features of endodermal sinus tumor. World J Gastroenterol 2007; 13(35): 4781 – 4783.
9. Magni E, Sonzogni A, Zampino MG. Primary pure gastric yolk sac tumor. Rare Tumours 2010; 2(1): e10. doi: 10.4081/ rt.2010.e10.
10. Vivekanandarajah A, Atallah JP, Gupta S. Alpha-fetoprotein-producing nonmetastatic gastric adenocarcinoma: a rare entity. J Gastrointest Cancer 2014; 45(2): 225 – 227. doi: 10.1007/ s12029-013-9498-2.
11. Yang J, Wang R, Zhang W et al. Clinicopathological and prognosis characteristic of hepatoid adenocarcinoma of the stomach. Gastroenterol Res Pract 2014; 2014 : 140587. doi: 10.1155/ 2014/ 140587.
12. Li L, Zhang WH, Meng FP et al. Gastric metastasis of hepatocellular carcinoma with gastrointestinal bleeding after liver transplant: a case report. Transplant Proc 2015; 47(8): 2544 – 2547. doi: 10.1016/ j.transproceed.2015.09.012.
13. Nogales FF, Preda O, Nicolae A. Yolk sac tumours revised. A review of their many faces and names. Histopatology 2012; 60(7): 1023 – 1033. doi: 10.1111/ j.1365-2559.2011.03889.x.
14. Chun H, Kwon SJ. Clinicopathological characteristic of alpha-fetoprotein-producing gastric cancer. J Gastric Cancer 2011; 11(1): 23 – 30. doi: 10.5230/ jgc. 2011.11.1.23.
15. Garcia RL, Ghali VS. Gastric choriocarcinoma and yolk sac tumor in a man: observations about its possible origin. Hum Pathol 1985; 16(9): 955 – 958.
16. Matoyama T, Saito K, Iwafuchi M et al. Endodermal sinus tumor of the stomach. Acta Pathol Jpn 1985; 35(2): 497 – 505.
17. Zámečník M, Patriková J, Gomolčák P. Yolk sac carcinoma of the stomach with gastrin positivity. Hum Pathol 1993; 24(8): 927 – 928.
18. Suzuki T, Kimura N, Shizawa S et al. Yolk sac tumor of the stomach with an adenocarcinomatous component: a case report with immunohistochemical analysis. Pathol Int 1999; 49(6): 557 – 562.
19. Wang L, Tabbarah HJ, Gulati P et al. Gastric adenocarcinoma with a yolk sac component: a case report and review of the literature. J Clin Gastroenterol 2000; 31(1): 85 – 88.
20. Puglisi F,Damante G, Pizzolitto S et al. Combined yolk sac tumor and adenocarcinoma in a gastric stump: molecular evidence of clonality. Cancer 1999; 85(9): 1910 – 1906.
21. Napaki S. Combined yolk sac tumour and adenocarcinoma of the oesophago-gastric junction. Pathology 2004; 36(6): 589 – 592.
22. Kanai M, Torii A, Hamada A et al. Pure gastric yolk sac tumor that was diagnosed after curative resection: case report and review of literature. Int J Gastrointest Cancer 2005; 35(1): 77 – 81.
23. Ukiyama E, Endo M, Yoshida F et al. Recurrent yolk sac tumor following resection of a neonatal immature gastric teratoma. Pediatr Surg Int 2005; 21(7): 585 – 588.
24. Singh M, Arya M, Anand S et al. Gastric adenocarcinoma with features of endodermal sinus tumor. World J Gastroenterol 2007; 13(35): 4781–4783.
25. Tahara H, Hirokawa T, Oyama T et al. Gastric yolk sac tumor complicated with betahuman chorionic gonadotropin-producing me-tastases. Intern Med 2008; 47(24): 2145 – 2149.
26. Kunin N, Ferrand L, Morreau L et al. Gastric yolk sac tumor. Gastroenterol Clin Biol 2010; 34(8 – 9): e11 – e13. doi: 10.1016/ j.gcb.2010.04.004.
27. Chen CJ, Hsu HT, Yen HH. Anunusual cause of upper gastrointestinal bleeding. Gastric yolk sac tumor with a large retroperitoneal metastasis. Gastroenterology 2010; 139(4): 1098, 1427. doi: 10.1053/j.gastro.2009.10.060.
28. Satake N, Chikakiyo M, Yagi T et al. Gastric cancer with choriocarcinoma and yolk sac tumor components: case report. Pathol Int 2011; 61(3): 156–160. doi: 10.1111/j.1440-1827.2010.02635.x.
29. Bihari C, Rastogi A, Chandan KN et al. Gastric adenocarcinoma with yolk sac tumor differentiation and liver metastasis of yolk sac tumor component. Case Rep Oncol Med 2013; 2013 : 923596. doi: 10.1155/2013/ 923596.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Noví členové redakční rady časopisu
- Výběr z mezinárodních časopisů
- Olysio® (simeprevir)
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

