-
Medical journals
- Career
Pankreatické cystické léze u pacientů po transplantaci jater
Authors: P. Mačinga 1; D. Cupalová 2; D. Kautznerová 2; J. Froněk 3; P. Trunečka 4; J. Špičák 1; T. Hucl 1
Authors‘ workplace: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 2; Klinika transplantační chirurgie, Transplantcentrum, IKEM, Praha 3; Transplantcentrum, IKEM, Praha 4
Published in: Gastroent Hepatol 2016; 70(4): 295-299
Category: Clinical and Experimental Gastroenterology: Original Article
doi: https://doi.org/10.14735/amgh2016295Overview
Úvod:
Pankreatické cystické léze (PCL) jsou častým nálezem v obecné populaci s narůstající prevalencí s věkem. Pankreatické cystické neoplazie reprezentují více než 50 % všech diagnostikovaných PCL. Pacienti po transplantaci solidních orgánů mají vyšší riziko nádorových onemocnění v důsledku expozice dlouhodobé imunosupresivní léčby. Přirozený vývoj PCL u pacientů po transplantaci solidních orgánů je neznámý.Cíl a metody:
Cílem studie bylo posoudit prevalenci a chování incidentálních PCL u pacientů po transplantaci jater. Provedli jsme retrospektivní analýzu nálezů zobrazovacích metod a anamnestických údajů u všech dospělých pacientů, kteří podstoupili v Institutu klinické a experimentální medicíny transplantaci jater v období od září 1996 do listopadu 2014.Výsledky:
Celkem bylo ve sledovaném období provedeno 967 transplantací u 578 mužů a 389 žen (průměrný věk 51 ± 11,7 let). PCL byly nalezeny u 60 pacientů (6,2 %; 26 mužů, 34 žen; průměrný věk 61 ± 8,9), z nichž u 29 byly diagnostikovány v předtransplantačním období. Medián velikosti detekovaných PCL byl 10 mm (5–85). PCL byly lokalizovány v hlavě pankreatu v 35 %, v těle v 33 % a v kaudě v 15 %, multifokální PCL mělo 17 % pacientů. Dvě a více PCL mělo 20 pacientů (33 %). Medián doby sledování byl 37,5 měsíců (6–194). U 10 pacientů (17 %) došlo ke zvětšení PCL (medián + 4 mm), u žádného z nich ale nebyla progrese klinicky relevantní. Pacienti s PCL byli signifikantně starší (p < 0,001), častěji byli ženského pohlaví (p < 0,05) a byli častěji transplantováni pro primární biliární cirhózu (p < 0,05) a deficit α-1-antitrypsinu (p < 0,05). Žádný z pacientů nezemřel v průběhu sledování v souvislosti s PCL, přežívání pacientů s PCL a bez PCL se signifikantně nelišilo.Závěr:
Prevalence PCL u pacientů po transplantaci jater je podobná jako v obecné populaci. Jejich přítomnost byla spojena s vyšším věkem, ženským pohlavím, primárním jaterním onemocněním a neovlivňovala přežívání pacientů.Klíčová slova:
pankreatická cysta – jaterní transplantace – imunosupreseÚvod
Pankreatické cystické léze (PCL) jsou v dnešní populaci v důsledku širšího využití a zdokonalení zobrazovacích metod relativně častým a obvykle náhodným nálezem. Jejich prevalence roste s věkem a v závislosti na použité zobrazovací metodě se dle recentních studií pohybuje mezi 2,6 % u multidetektorové počítačové tomografie (MDCT – multidetector computer tomography) a 20 % u magnetické rezonance (MR) [1,2]. PCL tak jsou nezanedbatelnou klinickou entitou.
PCL lze rozdělit na non-neoplastické a neoplastické. Nejčastější non-neoplastické PCL jsou pankreatické pseudocysty, často vznikající v terénu zánětlivého onemocnění pankreatu (akutní či chronická pankreatitida), či jako důsledek abdominálního traumatu. Nejvíce zastoupené pankreatické cystické neoplazie jsou intraduktální papilární mucinózní neoplazie (IPMN), mucinózní cystické neoplazie (MCN) a serózní cystadenomy (SCA). Ostatní PCL, jako např. solidní pseudopapilární neoplazie, cystický adenokarcinom pankreatu, cystické pankreatické neuroendokrinní neoplazie, degenerativní cysty a další, jsou vzácné a spolu odpovídají méně než 10 % všech případů [3]. Zatímco pseudocysty a SCA jsou považovány za benigní, MCN a IPMN jsou premaligní léze, jejichž maligní potenciál se liší v závislosti od histologického typu. MCN a IPMN hlavního pankreatického vývodu mají výrazně vyšší riziko maligní transformace než IPMN vedlejších vývodů [4]. Pacienti s neoplastickými PCL jsou proto indikováni k pravidelnému sledování dle mezinárodních doporučených postupů [4–7]. Recentní studie prokazují, že neoplastické cysty představují více než 50 % PCL, a to i u pacientů s anamnézou pankreatitidy [8,9].
Pacienti po transplantaci solidních orgánů exponovaní dlouhodobé imunosupresivní léčbě mají zvýšené riziko nádorových onemocnění, vč. nádorů gastrointestinálního traktu [10]. Recentní velké populační studie odhadly standardizovanou incidenci de novo karcinomu pankreatu u pacientů po transplantaci jater na 2,31 – 3,6 [11,12]. Ztráta imunologického dozoru při chronické imunosupresivní léčbě napomáhá proliferaci a přežívání atypických buněk. Zůstává otázkou, zda není chování neoplastických PCL u transplantované populace odlišné ve smyslu akcelerace maligní transformace. Na toto téma bylo prozatím publikováno pouze několik málo prací, a není tedy známo, zda lze doporučené postupy pro sledování pacientů s PCL v obecné populaci aplikovat také u pacientů po transplantaci [13–17].
Cílem naší studie bylo stanovit prevalenci a klinický průběh PCL u pacientů po transplantaci jater.
Metody
Provedli jsme retrospektivní analýzu klinických údajů a nálezů zobrazovacích metod u všech dospělých pacientů, kteří podstoupili transplantaci jater v Institutu klinické a experimentální medicíny v období mezi zářím 1996 a listopadem 2014. Do studie byli zařazeni všichni pacienti s nálezem PCL na jakékoli zobrazovací metodě (abdominální sonografie, MDCT, MR, magnetická cholangiopankreatografie (MRCP)) jak před transplantací jater, tak po výkonu. Všichni pacienti měli v rámci předtransplantačního vyšetření provedenou sonografii a CT dutiny břišní. Podmínkou zařazení byla minimální doba follow-up šest měsíců od stanovení diagnózy PCL.
V potransplantačním období byli všichni pacienti standardně léčeni trojkombinací inhibitorů kalcineurinu (takrolimus, cyklosporin), mykofenolátu a kortikosteroidů s postupnou detrakcí kortikoidů.
Ke statistické analýze kvantitativních údajů byl použit dvouvýběrový t-test, k posouzení nezávislostí kvalitativních znaků Fisherův exaktní test s hladinou významnosti p = 0,05. Kumulativní křivka přežívání byla generována Kaplan-Meierovou metodou, přežívání mezi skupinami bylo porovnáno log-rank testem.
Výsledky
Ve sledovaném období byla provedena transplantace jater u 967 pacientů starších 18 let, z toho bylo 578 mužů (60 %) a 389 žen (40 %) průměrného věku 51 ± 11,7 let. PCL byly detekovány u 60 pacientů (6,2 %) – 26 mužů (43 %) a 34 žen (57 %) průměrného věku 61 ± 8,9 let. U 29 pacientů byla přítomnost PCL zjištěna v předtransplantačním období, u 31 byly PCL diagnostikovány po transplantaci jater. Nejčastější metodou detekce byla CT (67 %), následovaná MR (18 %) a ultrasonografií (USG) (16 %).
Pacienti s PCL byli signifikantně starší (p < 0,001) a prevalence PCL byla signifikantně vyšší u žen (8,7 vs. 4,5 %; p < 0,05). Prevalence PCL byla signifikantně vyšší u pacientů s primární biliární cirhózou (PBC) (p < 0,05) a deficitem α-1-antitrypsinu (A1AT) (p < 0,05). Tyto výsledky jsou shrnuty v tab. 1.
Table 1. Charakteristika pacientů po transplantaci jater v závislosti na přítomnosti PCL. Tab. 1. Characteristics of liver transplant recipients in relation to the presence of a PCL. 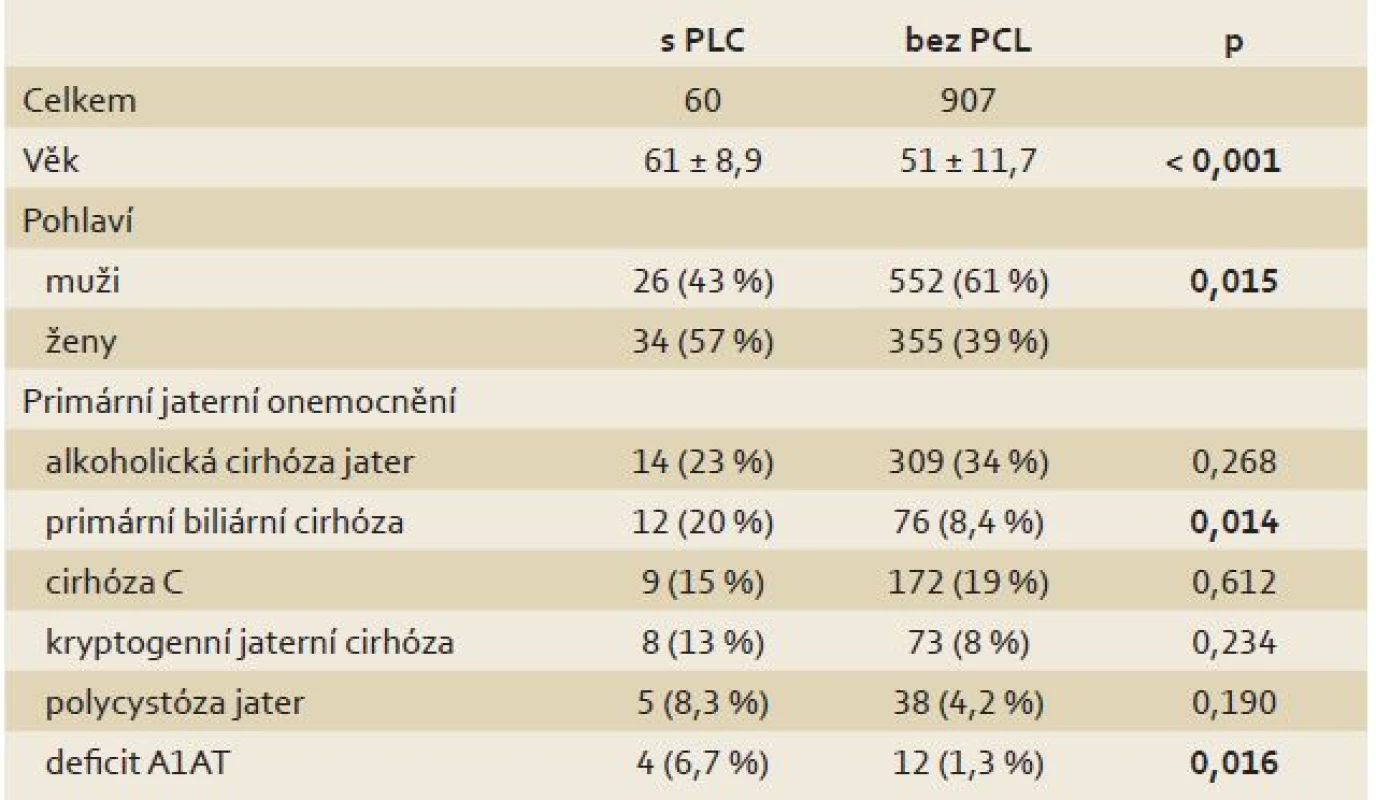
PCL – pankreatické cystické léze, A1AT – α-1-antitrypsin PCL byly nejčastěji lokalizovány v hlavě (35 %) a těle pankreatu (33 %), méně v kaudě (15 %), 17 % pacientů mělo multifokální PCL. Dvě a více lézí bylo nalezeno u 20 pacientů (33 %), tři a více PCL mělo 12 pacientů (20 %).
Průměrná velikost největší přítomné cystické léze byla 15,6 ± 13,4 mm, medián byl 10,5 mm (5–85). V průběhu střední doby sledování 37,5 měsíce (6 – 194) došlo u 10 pacientů (17 %) k progresi velikosti léze, medián 4 mm (2–9), u žádného z nich ale nebyla změna klinicky relevantní. U zbylých 50 pacientů byla velikost cystoidů stacionární nebo v regresi. U dvou pacientů byla provedena transgastrická drenáž infikované pseudocysty, která vedla k úplné rezoluci cystoidu. Vývoj nálezů u ostatních pacientů si nevyžádal žádnou intervenci.
Celkem zemřelo devět pacientů s PCL, čtyři z nich na maligní onemocnění (bronchogenní karcinom, karcinom ovaria, posttransplantační lymfoproliferativní nemoc a karcinom pankreatu). Karcinom pankreatu vyvstal v kaudě pankreatu u pacienta, který byl sledován s cystickými lézemi hlavy a těla, které na zobrazovacích metodách opakovaně neměly známky malignity. Další z pacientů zemřel na selhání jater při cirhóze štěpu, další na GVHD (graft vs. host disease), jeden pacient na pneumonii, jeden na komplikace v souvislosti s urologickou operací. U jednoho z pacientů není příčina úmrtí známa.
Nebyl nalezen statisticky významnýrozdíl v přežívání pacientů po transplantaci jater v závislosti na přítomnosti PCL (log-rank p = 0,245; graf 1).
Graph 1. Přežívání pacientů po transplantaci jater v závislosti na přítomnosti PCL. Graph 1. Survival of liver transplant recipients in relation to the presence of a PCL. 
Diskuze
Cílem naší studie bylo posoudit prevalenci a chování PCL u pacientů po transplantaci jater. Vzhledem k významnému riziku vzniku malignity u PCL v obecné populaci a dlouhodobému užívání imunosupresivní léčby u transplantovaných pacientů, v jejímž důsledku mají tito pacienti zvýšené riziko maligního onemocnění, zůstává otázkou, zda je výskyt a chování těchto lézí v transplantované populaci odlišný. Populaci příjemců jater jsme vybrali z důvodu existence protokolárního MDCT vyšetření břicha u všech kandidátů transplantace jater. Studovat tento fenomén u pacientů po transplantaci ledvin by se mohlo jevit s ohledem na obecně vyšší dávkování udržovací imunosupresivní léčby vhodnější, tito pacienti ale v našem centru obvykle neabsolvují v rámci předtransplantačního vyšetření CT. Navíc jsou příjemci jater v potransplantačním období častěji vyšetřováni zobrazovacími metodami vzhledem k výskytu biliárních a cévních komplikací.
V důsledku širšího využití radiologických metod bylo možné u pacientů po transplantaci jater očekávat vyšší prevalenci PCL oproti obecné populaci. Prevalence PCL v naší studii byla 6,4 %, což je vzhledem k diverzitě zobrazovacích metod (kombinace MDCT, MR a USG) srovnatelné s obecnou populací. V předchozích publikovaných pracích se prevalence PCL u pacientů po transplantaci jater výrazně lišila s hodnotami od 3,2 % až k téměř 60 % [14,16]. Extrémní nález italských autorů je možné z části vysvětlit využitím MRCP jako zobrazovací metody a rovněž selekčním biasem – do studie byli zahrnuti pouze pacienti, kteří absolvovali vyšetření z důvodu biliárních komplikací.
Vyšší výskyt PCL u starších pacientů je obecně známý [2,18]. Neočekávaným výsledkem byl téměř dvojnásobný výskyt PCL u žen ve srovnání s muži. Pohlavní predominance nebyla u obecné populace popsána [18,19], 1,5× vyšší prevalence PCL u žen po transplantaci solidních orgánů byla ale pozorována i v recentní studii autorů z Mayo Clinic [17]. Příčina tohoto rozdílu není známá. Výskyt některých cystických neoplazií je sice vyšší v ženské populaci (MCN 9 : 1, SCN 3 : 1), výskyt IPMN je ale lehce vyšší u mužů (3 : 2) [20].
Prevalence PCL v námi studované populaci byla ovlivněna i primárním jaterním onemocněním. Až pětina pacientů s PCL byla transplantována pro PBC v porovnání s 8,4 % u transplantovaných pacientů bez PCL. Pro vyšší výskyt PCL u pacientů s PBC není jasné vysvětlení, jelikož toto onemocnění není obecně spojeno s onemocněním pankreatu. Na druhou stranu bývá PBC často sdružena se Sjögrenovým syndromem, který může vzácně doprovázet autoimunitní pankreatitidu [21]. Abnormální wirsungogram byl v jedné studii popsán u 43 % studovaných pacientů s PBC, u stejné skupiny pak byla prokázána sekretinovým testem pankreatická hyposekrece [22]. Zastoupení pacientů s deficitem A1AT bylo 4× vyšší ve skupině pacientů s PCL (6,7 vs. 1,3 %). Asociace deficitu A1AT s chronickou pankreatitidou byla postulována několika pracemi [23], recentní genetická studie ale neprokázala vyšší frekvenci Z nebo S alely genu pro A1AT u pacientů s idiopatickou či hereditární chronickou pankreatitidou [24]. Polycystóza jater byla 2× častěji indikací k transplantaci jater u pacientů s PCL než u pacientů bez PCL (8,3 vs. 4,2 %), rozdíl ale nedosáhl statistické významnosti. Toto pozorování není překvapivé, cysty pankreatu se vyskytují až u 9 % pacientů s polycystickým onemocněním jater [25]. Nejčastější indikací k transplantaci jater u pacientů s PCL byla alkoholická cirhóza jater, nicméně relativní zastoupení této indikace bylo u pacientů s PCL nižší než u pacientů bez PCL (23,3 vs. 34 %). Chronický abúzus alkoholu je rizikovým faktorem rozvoje chronické pankreatitidy, nicméně koincidence alkoholické jaterní cirhózy a chronické pankreatitidy je popisována vzácně, patofyziologický mechanizmus tohoto fenoménu je nejasný [26,27].
Odlišení non-neoplastických a neoplastických lézí a přesná specifikace jednotlivých neoplastických lézí je v klinické praxi velmi obtížné. Vyžadují většinou užití kombinace zobrazovacích metod, v řadě případů i jejich opakování v čase, 100% v určení typu léze je pouze histologické hodnocení resekátu. Svízelnost přesné diagnostiky je v našem souboru ještě umocněna jejím retrospektivním charakterem, kdy u části pacientů nebyl diagnostický algoritmus kompletní. Pouze šest pacientů s PCL mělo v anamnéze chronickou či akutní pankreatitidu, pět pacientů bylo transplantováno pro polycystózu jater, 12 pacientů mělo na zobrazovacích metodách nález slučitelný s diagnózou IPMN vedlejších vývodů. Zbylí pacienti byli vzhledem k necharakteristickému nálezu na zobrazovacích metodách sledováni bez definitivní diagnózy, u mnoha z nich ale bylo pomýšleno na neoplastickou cystickou lézi, nejčastěji IPMN z vedlejších vývodů. Tento nález je kompatibilní s názorem některých expertů, že IPMN vedlejších vývodů reprezentují většinu malých incidentálních cystických lézí [28].
Toho času je dostupných pouze velice málo informací o přirozeném průběhu PCL u pacientů po transplantaci solidních orgánů. V našem souboru, který je druhý největší z doposud publikovaných, došlo k mírné progresi velikosti (medián + 4 mm, 2–9 mm) největšího cystoidu pouze u 10 pacientů (17 %), u žádného z nich ale nebyla progrese nálezu klinicky relevantní. U žádného z pacientů nevzniklo v průběhu sledování podezření na maligní proces, které by vedlo ke změně sledovacího algoritmu či k operačnímu řešení. Naše pozorování je tak v souladu s předchozími studiemi [13,17]. Z těchto výsledků tedy nelze zatím doporučit odlišný přístup k pacientům s PCL po transplantaci. K definitivnímu potvrzení tohoto závěru budou nutné prospektivní kontrolované studie s vyšším počtem pacientů a delší dobou sledování.
Shrnutí
Prevalence PCL po transplantaci jater je obdobná jako ve všeobecné populaci. Pacienti s PCL byli signifikantně starší a prevalence PCL byla signifikantně vyšší u žen, pacientů s PBC a deficitem A1AT. V průběhu sledování došlo u menšiny pacientů k progresi velikosti cysty, která nebyla klinicky relevantní a nevyžádala si změnu sledování či intervenci. Přítomnost PCL nekompromitovala přežívání pacientů po transplantaci jater.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 8. 7. 2016
Přijato: 1. 8. 2016
doc. MU Dr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/ 9
140 21 Praha 4
tomas.hucl@ikem.cz
Sources
1. Lee HJ, Kim MJ, Choi JY et al. Relative accuracy of CT and MRI in the differentiation of benign from malignant pancreatic cystic lesions. Clin Radiol 2011; 66(4): 315 – 321. doi: 10.1016/ j.crad.2010.06.019.
2. Laffan TA, Horton KM, Klein AP et al. Prevalence of unsuspected pancreatic cysts on MDCT. AJR Am J Roentgenol 2008; 191(3): 802 – 807. doi: 10.2214/ AJR.07.3340.
3. Sahani DV, Kambadakone A, Macari M et al. Diagnosis and management of cystic pancreatic lesions. AJR Am J Roentgenol 2013; 200(2): 343 – 354. doi: 10.2214/ AJR.12.8862.
4. Del Chiaro M, Verbeke C, Salvia R et al. European experts consensus statement on cystic tumours of the pancreas. Dig Liver Dis 2013; 45(9): 703 – 711. doi: 10.1016/ j.dld.2013.01.010.
5. Tanaka M, Chari S, Adsay V et al. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6(1 – 2): 17 – 32.
6. Tanaka M, Fernández-del Castillo C, Adsay V et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 2012; 12(3): 183 – 197. doi: 10.1016/ j.pan.2012.04.004.
7. Italian Association of Hospital Gastroenterologists and Endoscopists, Italian Association for the Study of the Pancreas, Buscarini E et al. Italian consensus guidelines for the diagnostic work-up and follow-up of cystic pancreatic neoplasms. Dig Liver Dis 2014; 46(6): 479 – 493. doi: 10.1016/ j.dld.2013.12.019.
8. Spinelli KS, Fromwiller TE, Daniel RA et al. Cystic pancreatic neoplasms: observe or operate. Ann Surg 2004; 239(5): 651 – 657.
9. Fernández-del Castillo C, Targarona J, Thayer SP et al. Incidental pancreatic cysts: clinicopathologic characteristics and comparison with symptomatic patients. Arch Surg 2003; 138(4): 427 – 433.
10. Herrero JI, Lorenzo M, Quiroga J et al. De novo neoplasia after liver transplantation: an analysis of risk factors and influence on survival. Liver Transpl 2005; 11(1): 89 – 97.
11. Aberg F, Pukkala E, Höckerstedt K et al. Risk of malignant neoplasms after liver transplantation: a population-based study. Liver Transpl 2008; 14(10): 1428 – 1436. doi: 10.1002/ lt.21475.
12. Krynitz B, Edgren G, Lindelöf B et al. Risk of skin cancer and other malignancies in kidney, liver, heart and lung transplant recipients 1970 to 2008 – a Swedish population-based study. Int J Cancer 2013; 132(6): 1429 – 1438. doi: 10.1002/ ijc.27765.
13. Gill KR, Pelaez-Luna M, Keaveny A et al. Branch duct intraductal papillary mucinous neoplasm of the pancreas in solid organ transplant recipients. Am J Gastroenterol 2009; 104(5): 1256 – 1261. doi: 10.1038/ ajg.2009.62.
14. Girometti R, Intini SG, Cereser L et al. Incidental pancreatic cysts: a frequent finding in liver-transplanted patients as assessed by 3D T2-weighted turbo spin echo magnetic resonance cholangiopancreatography. JOP 2009; 10(5): 507 – 514.
15. Lennon AM, Victor D, Zaheer A et al. Liver transplant patients have a risk of progression similar to that of sporadic patients with branch duct intraductal papillary mucinous neoplasms. Liver Transpl 2014; 20(12): 1462 – 1467. doi: 10.1002/ lt.23983.
16. Darstein F, König C, Hoppe-Lotichius Met al. Impact of pancreatic comorbidities in patients with end-stage liver disease on outcome after liver transplantation. Eur J Intern Med 2014; 25(3): 281 – 285. doi: 10.1016/ j.ejim.2014.01.005.
17. Ngamruengphong S, Seeger KM, McCrone LM et al. Prevalence and outcomes of cystic lesion of the pancreas in immunosuppressed patients with solid organ transplantation. Dig Liver Dis 2015; 47(5): 417 – 422. doi: 10.1016/ j.dld.2015.02.011.
18. Lee KS, Sekhar A, Rofsky NM et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010; 105(9): 2079 – 2084. doi: 10.1038/ ajg.2010.122.
19. Zhang XM, Mitchell DG, Dohke M et al. Pancreatic cysts: depiction on single-shot fast spin-echo MR images. Radiology 2002; 223(2): 547 – 553.
20. Matthaei H, Schulick RD, Hruban RH et al. Cystic precursors to invasive pancreatic cancer. Nat Rev Gastroenterol Hepatol 2011; 8(3): 141 – 150. doi: 10.1038/ nrgastro.2011.2.
21. Li A, Wang Y, Deng Z. Concurrent autoimmune pancreatitis and primary biliary cirrhosis: a rare case report and literature review. BMC Gastroenterol 2014; 14 : 10. doi: 10.1186/ 1471-230X-14-10.
22. Epstein O, Chapman RW, Lake-Bakaar G et al. The pancreas in primary biliary cirrhosis and primary sclerosing cholangitis. Gastroenterology 1982; 83(6): 1177 – 1182.
23. Rabassa AA, Schwartz MR, Ertan A. Alpha 1-antitrypsin deficiency and chronic pancreatitis. Dig Dis Sci 1995; 40(9): 1997 – 2001.
24. Witt H, Kage A, Luck W et al. Alpha1-antitrypsin genotypes in patients with chronic pancreatitis. Scand J Gastroenterol 2002; 37(3): 356 – 359.
25. Torra R, Nicolau C, Badenas C et al. Ultrasonographic study of pancreatic cysts in autosomal dominant polycystic kidney disease. Clin Nephrol 1997; 47(1): 19 – 22.
26. Veena AB, Rajesh G, Varghese J et al. Alcoholic chronic pancreatitis and alcoholic liver cirrhosis: differences in alcohol use habits and patterns in Indian subjects. Pancreas 2012; 41(5): 703 – 706. doi: 10.1097/ MPA.0b013e31823b62ca.
27. Spicak J, Pulkertova A, Kralova-Lesna Iet al. Alcoholic chronic pancreatitis and liver cirrhosis: coincidence and differences in lifestyle. Pancreatology 2012; 12(4): 311 – 316. doi: 10.1016/ j.pan.2012.05.008.
28. Farrell JJ, Fernández-del Castillo C. Pancreatic cystic neoplasms: management and unanswered questions. Gastroenterology 2013; 144(6): 1303 – 1315. doi: 10.1053/ j.gastro.2013.01.073.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Noví členové redakční rady časopisu
- Výběr z mezinárodních časopisů
- Olysio® (simeprevir)
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

