-
Medical journals
- Career
Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
Authors: H. Naeem
Authors‘ workplace: Gastroenterologické oddělení, Nemocnice Tábor, a. s.
Published in: Gastroent Hepatol 2016; 70(4): 340-345
Category: Digestive Endoscopy: Case Report
doi: https://doi.org/10.14735/amgh2016340Overview
Primární non-Hodgkinův lymfom duodena je relativně vzácným primárním nádorem gastrointestinálního traktu. Difuzní velkobuněčný B lymfom je v současné době považován za dominantní histologický typ primárních extranodálních lymfomů vycházejících z gastrointestinálního traktu. V odborné literatuře je popsáno jen velmi málo případů primárního lymfomu duodena prezentujících se obstrukčním ikterem a obstrukcí duodena. Uvádíme kazuistiku dosud zdravého 59letého muže, který byl hospitalizován na našem oddělení pro zvracení, anorexii a obstrukční ikterus. Příčinou biliární obstrukce a obstrukce duodena byl právě primární lymfom duodena diagnostikovaný na základě endoskopického vyšetření s odběrem biopsie. Histologický rozbor následně prokázal difuzní velkobuněčný B lymfom. Tento případ ukazuje, že i přes svoji vzácnost může být prvním symptomem duodenálního lymfomu obstrukce duodena s obstrukčním ikterem.
Klíčová slova:
dvanáctník – difuzní velkobuněčný B lymfom – obstrukce duodena – obstrukční ikterusPopis případu
Uvádíme případ dosud zdravého pacienta, 59letého muže, který byl hospitalizován na našem oddělení v červnu 2015 pro dva měsíce trvající stavy nevolnosti, zvracení, anorexii a obstrukční ikterus.
Pacient při přijetí nevykazoval významnější známky malnutrice. Při fyzikálním vyšetření nebyla přítomna lymfadenopatie v palpačně přístupných lokalizacích. Jednalo se o pacienta s nevýznamnou rodinnou anamnézou. Rodinná anamnéza pro nádorové onemocnění zažívacího traktu byla negativní. Přítomnost celiakie v rodině nebyla zjištěna. V osobní anamnéze měl léčbou korigovanou arteriální hypertenzi. Fyzikální nález a vstupní laboratorní výsledky – vzestup jaterních testů s dominující ikterickou cholestázou vzbuzoval podezření na obstrukci žlučových cest (S-bilirubin celkový 83 µmol/l, S-bilirubin přímý 76 µmol/l, S-ALT 4,45 µkat/l, S-AST 3,69 µkat/l, S-GGT 17,92 µkat/l, S-ALP 8,75 µkat/l, CRP 39 mg/l). Ve vstupním laboratorním nálezu byla hladina sérové amylázy negativní. Pacient neměl klinické projevy či laboratorní známky akutní biliární pankreatitidy.
Abdominální ultrasonografií byla zobrazena dilatace choledochu a intrahepatických žlučovodů, nepřehledný pankreas, drobná cysta v pravé ledvině. Vzhledem k výše uvedeným nálezům byla provedena endoskopická retrográdní cholangiopankreatografie (ERCP), která odhalila tumorózní léze s nekrotickými hmotami, které infiltrovaly bulbus duodena a D2 části. Při ERCP se nepodařilo proniknout do D2 k papile (obr. 1).
Image 1. Gastroskopie – antegrádní gastroskopický pohled do pyloru a proximálního úseku duodena. Tumorózní infiltrace s nekrotickými hmotami při postižení sliznice duodena a D2 difuzním velkobunečným B lymfomem. Fig. 1. Antegrade endoscopic view of the pylorus and proximal part of the duodenum. Tumour lesion with necrotic masses of diffuse B-cell lymphoma infiltrating in the proximal part of the duodenum. 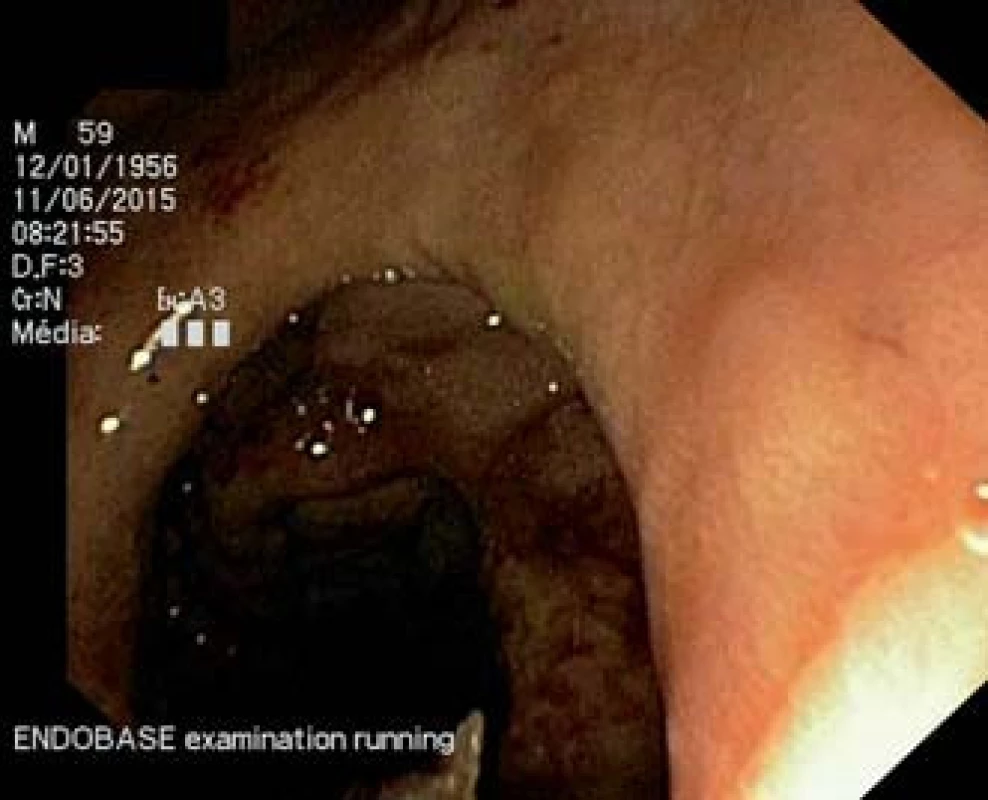
U nemocného byla zavedena nazogastrická sonda k odvádění stagnačního obsahu a podána parenterální výživa. Nález diferenciálně diagnosticky vzbuzoval podezření na prorůstající tumor pankreatu, primární tumor duodena (adenokarcinom, lymfom, leiomyosarkom či stromální tumor), karcinom vycházející z distálních žlučovodů, event. metastatické postižení duodena melanomem. V dalším diagnostickém algoritmu bylo doplněno CT břicha s podáním kontrastní látky i.v., které prokázalo rozsáhlý stenozující tumor duodena o velikosti 10 × 13 × 11 cm s infiltrací okolí (obr. 2). Vzdálené metastatické postižení nebylo prokázáno. Bylo vysloveno podezření na primární tumor duodena. CT hrudníku bylo bez významnějších změn. Při CT vyšetření nebyly nalezeny zvětšené lymfatické uzliny v dutině břišní ani hrudníku. Byla provedena gastroskopie s odběrem mnohočetných bioptických vzorků z D2 duodena. Stenóza byla obtížně prostupná i pro endoskop menšího kalibru 9,8 mm v průměru (obr. 3). Nález byl konzultován s chirurgem a onkologem. Uvažovali jsme o přechodném řešení obstrukčního ikteru transhepatickou drenáží nebo o definitivním řešení stenózy Whippleovou operací či endoskopickou stentáží duodena SEMS (samoexpandabilní metalický stent). Nakonec bylo na základě multioborového konsenzu rozhodnuto vyčkat na výsledek histologie.
Image 2. Axiální a koronární řez – CT břicha demonstrující objemnou tumorózní masu v oblasti D1 a D2 (šipka). Fig. 2. Axial and coronal view – computer tomography of scan of abdomen demonstrating a large mass in the first and second part of the duodenum (arrow). 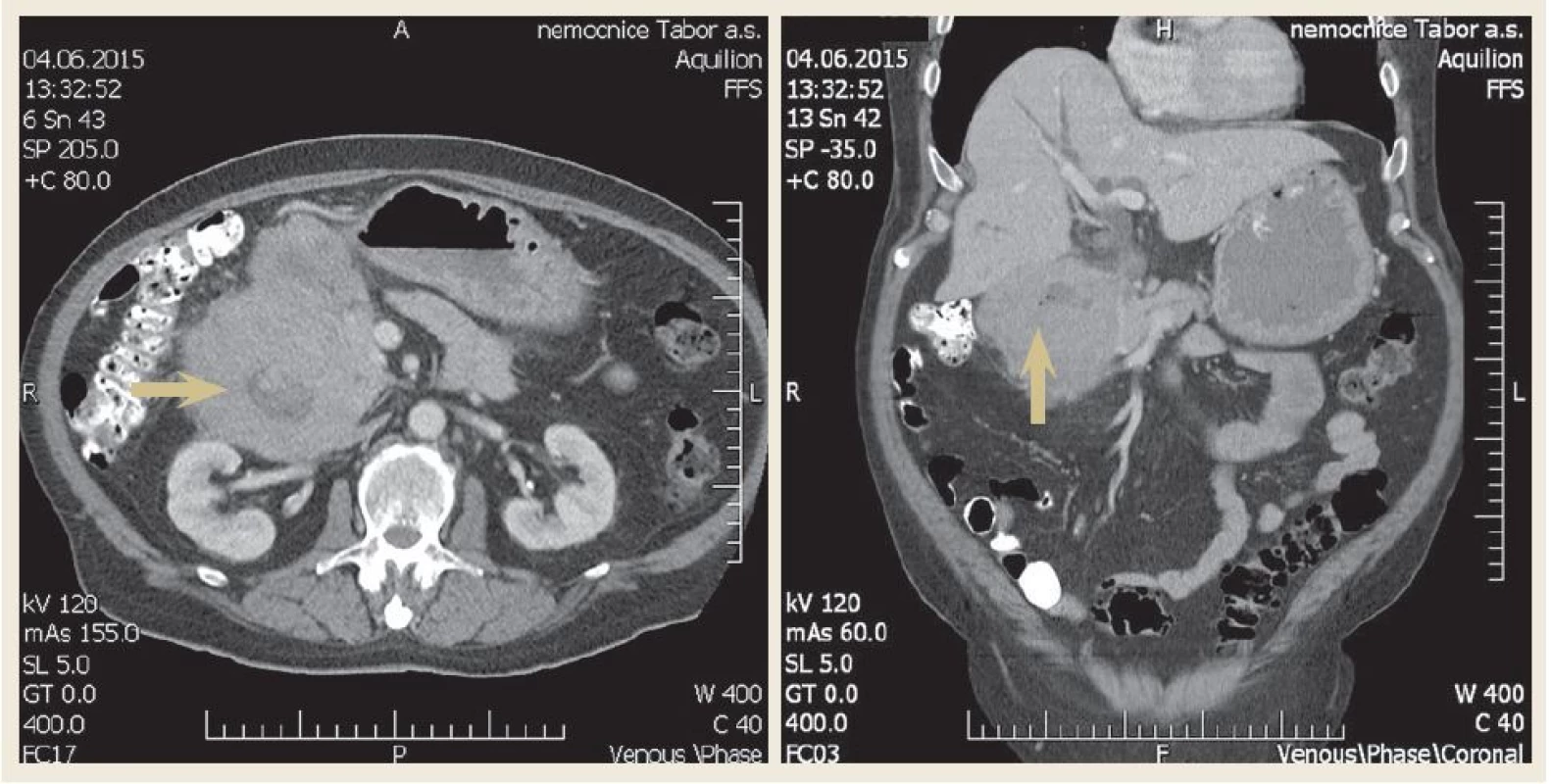
Image 3. Horní endoskopie našeho pacienta ukazující objemné květákovité masy při postižení D2 difuzním velkobunečným B lymfomem. Fig. 3. Upper gastrointestinal endoscopy of our patient showing large fungating masses of diffuse B-cell lymphomas in the second part of the duodenum. 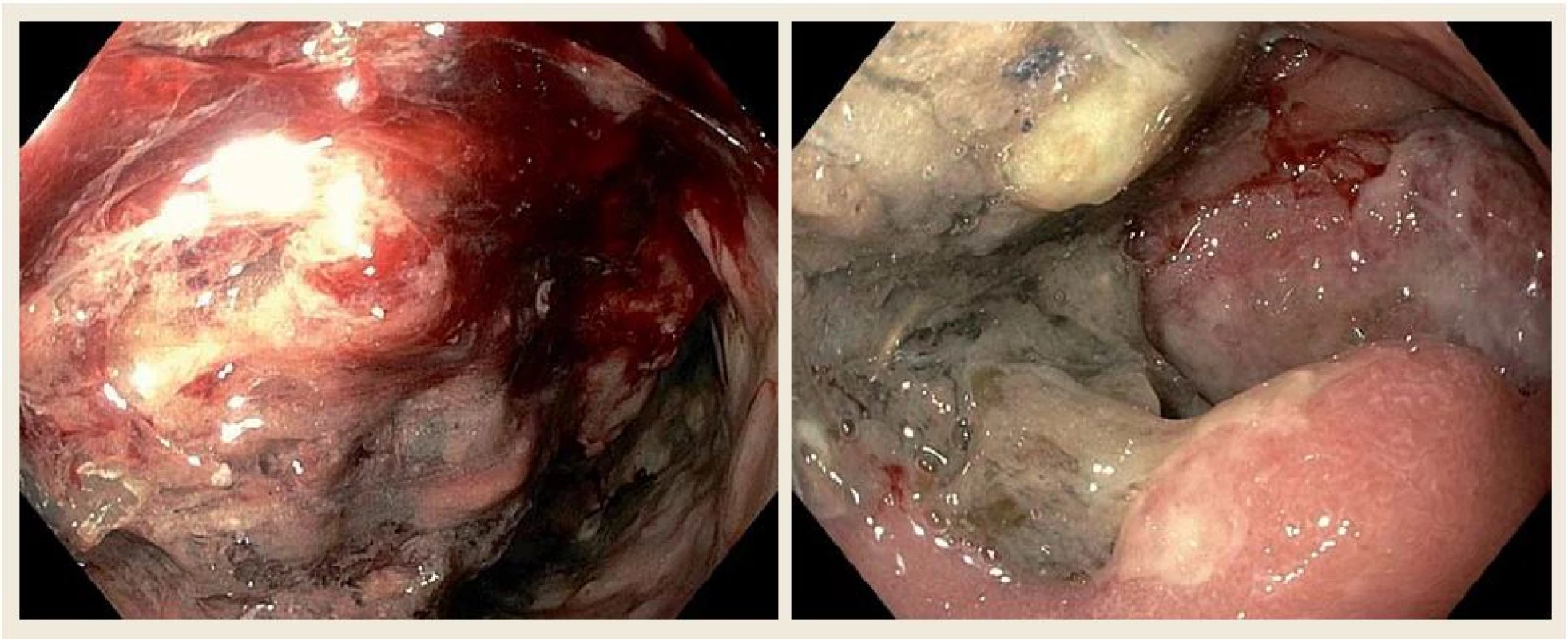
Histologicky byla v prvním čtení zjištěna infiltrace duodenální mukózy malými a většími lymfoidními elementy, ojedinělé centroblasty a imunoblasty s vysokým proliferačním indexem charakteru lymfomu a suspektní okrsky plísně. Vzhledem k omezenému množství materiálu nebylo provedeno další imunohistochemické vyšetření a materiál byl zaslán na pracoviště vyššího typu k dalšímu čtení. Pro narůstání zánětlivých parametrů byla nasazena antibiotická a antimykotická terapie. V rámci diferenciální diagnózy byla doplněna další vyšetření. Vyšetření na Helicobacter pylori bylo negativní, trepanobiopsie neprokázala žádnou abnormalitu svědčící o postižení kostní dřeně, sérologický screening nepotvrzoval infekční hepatitidy typu A, B, C, virus Epstein-Barrové (EBV) ani cytomegalovirus. Hodnoty celkových imunoglobulinů IgA, IgG, IgM a IgE nebyly zvýšené. Sérologický panel celiakie byl negativní.
Pacienta jsme předali do péče hematoonkologického pracoviště vyššího typu pro případnou léčbu. Jelikož se dle prvního čtení jednalo suspektně o agresivní fenotyp lymfomu, předpokládala se citlivost na léčbu s možnou spontánní desobstrukcí biliárního traktu i duodena. Pacientovi byla podána chemoterapie podle protokolu R-CHOP (bez Mabthery, výsledek druhého čtení nebyl k dispozici). Odpověď na léčbu po první sérii chemoterapie byla promptní, klinický stav pacienta se výrazně zlepšil jeden týden po podání první dávky chemoterapie, ikterus ustoupil, pacient postupně začal přijímat stravu, pasáž gastrointestinálního traktu (GIT) se obnovila. První sérii chemoterapie pacient snášel dobře. Laboratorně došlo k poklesu jaterních testů (S-bilirubin celkový 45 µmol/l, S-bilirubin přímý 38 µmol/l, S-ALT 1,73 µkat/l, S-AST 0,44 µkat/l, S-GGT 7,9 µkat/l, S-ALP 12,27 µkat/l), leukocyty 11 × 109/l, S-CRP 9,5 mg/l).
Druhé histologické čtení prokázalo, že prakticky všechny buňky tumoru byly imunohistochemicky hodnoceny jako CD20, CD45 a CD79 pozitivní a prakticky všechny buňky vykázaly proliferační index MIBI (Ki-67) pozitivitu, což potvrdilo výrazný proliferační potenciál tumoru. Jednalo se tudíž nejspíše o difuzní velkobuněčný non-Hodgkinův lymfom B typu dle WHO klasifikace. Další sledování a podání onkologické léčby pacienta proběhlo pod dohledem hematoonkologa jiného pracoviště. Po obdržení výsledku histologie druhého čtení do chemoterapie byla přidána Mabthera. Po II. cyklu chemoterapie byl pacient asymptomatický. V prosinci 2015 bylo provedeno PET/CT bez průkazu patologické akumulace, byla dosažena kompletní remise.
Překvapivě, 12. srpna 2015 byl pacient opět přivezen na naše pracoviště pro opakované zvracení. Po vyloučení náhlé příhody břišní, vzhledem k podezření na recidivu lymfomu duodena, jsme provedli gastroskopii, kde endoskopický nález ukázal kompletní vymizení tumorózní infiltrace v oblasti duodena. V místě původní tumorózní léze byla nalezena vředová léze s mírnou stenózou duodena prostupnou pro endoskop (obr. 4). Opět byl proveden odběr mnohočetných bioptických vzorků z vředové léze a sliznice duodena. Histologie neprokázala přítomnost lymfomu. Jako příčina zvracení byla zjištěna infekce vyvolaná Campylobacter jejuni. Pacienta jsme opět předali do péče hematoonkologického pracoviště, kde byl předtím sledován.
Image 4. Horní endoskopický nález ukázal kompletní vymizení tumorózní infiltrace v oblasti duodena po třech měsících chemoterapie. V místě původní tumorózní léze byla nalezena vředová léze s mírnou stenózou duodena prostupnou pro endoskop (šipka). Fig. 4. Upper gastrointestinal endoscopy of our patient after three months of chemotherapy showing no mass in the duodenum. In place of the mass, endoscope revealed chronic peptic ulceration with mild stenosis (arrow). 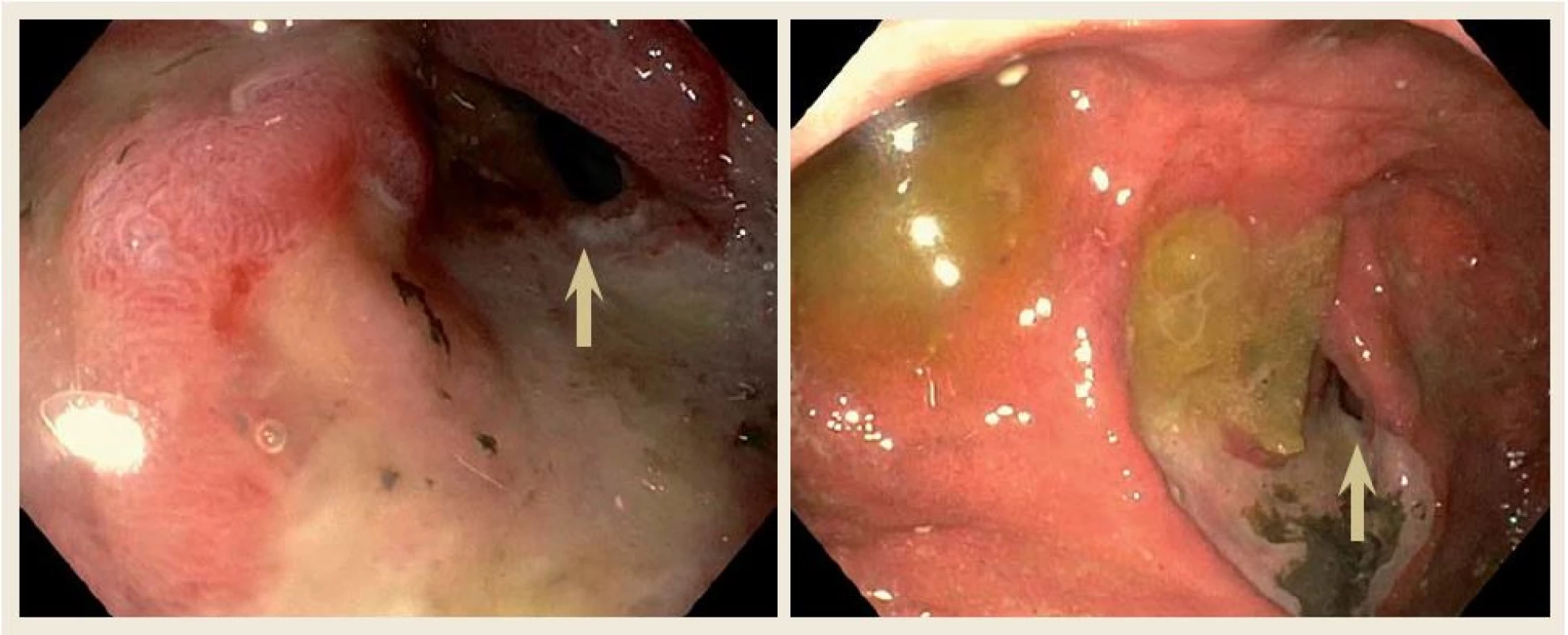
Diskuze
Maligní non-Hodgkinův lymfom se může vyskytovat v různých anatomických lokalizacích [1]. Nejčastějším místem výskytu extranodálních lymfomů je zažívací trakt. Primární lymfomy zažívacího traktu jsou vzácné, představují 4–11 % všech lymfomů, naopak sekundární postižení je relativně časté [2]. U primárních lymfomů je postižení žaludku až 50–60 %, postižení tenkého střeva tvoří méně než 30 % [3]. Nejčastějším místem výskytu primárních lymfomů tenkého střeva je ileum (60–65 %), následuje jejunum (20–25 %), duodenum (6 – 8 %) a tzv. multiple sites – mnohočetná místa (8–9 %) [4]. Lymfomy tvoří jen 12 % všech malignit duodena [5]. Incidence lymfomů GIT je závislá na množství lymfatické tkáně přítomné v daném segmentu.
Většina lymfomů zažívacího traktu vzniká z B a T buněk. Primární lymfomy tenkého střeva tvoří heterogenní skupinu zahrnující MALT lymfom (mucosa-associated lymphoid tissue), difuzní velkobuněčný B lymfom (DLBCL – diffuse large B-cell lymphoma), T buněčný lymfom enteropatického typu, lymfom z plášťových buněk, folikulární lymfom a imunoproliferativní onemocnění tenkého střeva také známé jako nemoc řetězců α a raritní lymfocytický lymfom (chronická lymfocytární leukemie) [6]. DLBCL je v současnosti považován za převažující histologický typ primárních extranodálních lymfomů postihujících GIT. T buněčné lymfomy tenkého střeva představují 10 – 25 % primárních střevních lymfomů, nejčastěji se manifestují jako enteropatický T buněčný lymfom. Výskyt těchto lymfomů je nejčastěji asociován především s dlouhodobě neléčenou celiakií [7]. V našem případě byl pacient postižen DLBCL.
V patogenezi gastrointestinálních lymfomů hrají roli určité rizikové faktory jako infekce Helicobacter pylori, HIV, Campylobacter jejuni, EBV, virus hepatitidy B, lidský T lymfotropní virus, dále celiakie, nespecifické střevní záněty a imunosuprese [8].
Typické příznaky lymfomu tenkého střeva jsou bolest břicha (křečovitá nebo kolikovitá), zvracení, hubnutí a teploty. Také mohou být přítomny příznaky žaludečního vředu, krvácení ve formě hematemézy, melény či anémie nebo nespecifické příznaky jako nechutenství a nevolnost. Jako krvácející duodenální vřed se primární lymfom duodena prezentuje zřídka [9]. Nauzea a zvracení provázejí lymfomové postižení proximálního jejuna a duodena, kdežto abdominální distenze je obvyklá pro distální lézi. Primární střevní lymfom, obzvlášť duodenální, se vzácně projeví obstrukčním ikterem. Našeho pacienta přivedlo k vyšetření nechutenství, váhový úbytek, zvracení a ikterus.
K diagnóze primárního střevního lymfomu je nutné splnit následná kritéria dle Dawsona [10]: 1. absence hmatné povrchní lymfadenopatie, 2. absence zvětšených uzlin mediastina na snímku hrudníku, 3. normální hodnoty leukocytů a diferenciálního rozpočtu, 4. převaha postižení trávicího traktu s účastí jenom regionálních lymfatických uzlin, 5. absence tumorózní infiltrace jater a sleziny. Náš pacient splňoval všechna uvedená kritéria.
Primární lymfom duodena se vyskytuje velmi vzácně [11–16]. Je známo jen relativně málo údajů o jeho klinické manifestaci, průběhu nemoci či léčbě [11]. Není mnoho případů, kdy se duodenální lymfom prezentuje obstrukčním ikterem [17–19]. Přesná incidence a prevalence obstrukčního ikteru u duodenálního lymfomu není známá, ale extrahepatální biliární obstrukcí se projevuje 43 % všech malignit duodena [20]. Jako příčina rozvoje obstrukčního ikteru u maligního lymfomu při postižení GIT se popisují různé mechanizmy. Zahrnují infiltraci jater granulomatózní hepatitidou, intrahepatickou cholestázou nebo primárním lymfomem jater, obstrukci extrahepatálních žlučových cest při postižení portálních uzlin nebo toxickou polékovou hepatitidu. V našem případě byl obstrukční ikterus způsoben útlakem ductus choledochus lymfomovou infiltrací oblasti Vaterské papily a duodena. Makroskopicky může mít tumor vzhled ulcerací s navalitými okraji nebo tvoří mnohočetné noduly či plaky, difuzní ztluštění střevní stěny, zbytnění slizničních řas, polypy nebo objemné květákovité masy. Nemoci jako celiakie, primární či sekundární imunodeficit, infekce EBV, nespecifické střevní záněty a infekce Helicobacter pylori mohou také indukovat vznik gastrointestinálních lymfomů, proto je potřeba tyto stavy vyloučit [21].
Pro histologickou diagnostiku je nutný vzorek z klínovité biopsie, nikoli aspirace tenkou jehlou. Validní imunohistologický rozbor je podmíněný správnou technikou odběru a následnou manipulací s bioptovaným materiálem. Vhodnou modalitou k získání biopsie je gastroskopie.
Pro primární lymfom tenkého střeva je charakteristický výskyt v mladších věkových skupinách, méně lokalizované postižení a agresivnější histologické typy, hlavně DLBCL. V našem případě se jednalo o non-Hodgkinův DLBCL dle WHO klasifikace, kde prakticky všechny buňky tumoru byly imunohistochemicky CD20, CD45 a CD79 pozitivní a prakticky všechny buňky vykázaly MIBI (Ki-67) pozitivitu.
V literatuře se jako nejúčinnější léčba primárních střevních lymfomů udává chemoterapie [17]. Léčba primárního lymfomu tenkého střeva ale zůstává kontroverzní [22]. Fascinující je zejména účinek antibiotické léčby infekce Helicobacter pylori, který může u lokalizovaného stadia primárního lymfomu žaludku typu MALT vést k úplné regresi onemocnění bez jakékoli protinádorové terapie. Neobvykle dobrých výsledků dosahují lokoregionální léčebné postupy. Radikální chirurgický výkon může vést k dlouholetým remisím nádorové choroby, pokud je onemocnění lokalizováno a neprorůstá do okolí [23]. Někteří odbornicí doporučují chirurgickou léčbu jako nejlepší postup k eradikaci lokalizovaných a stenozujících procesů [24]. Chirurgická léčba má významnou roli v léčbě lokalizované nemoci a souvisejících komplikací jako střevní obstrukce, krvácení či perforace. Nicméně resekce je v eradikaci lymfomu málokdy úspěšná a mnoho pacientů vyžaduje další léčbu chemoterapií nebo radioterapií. Chirurgická redukce nádorové masy předcházející chemo - nebo radioterapii dle dostupných zdrojů zlepšuje přežití i ve III. a IV. stadiu nemoci. Výborných výsledků dosahuje moderní radioterapie, zejména u primárních gastrointestinálních lymfomů nízké malignity. Chemoterapie je účinná především u lymfomů vysoké malignity [2]. Kombinace rituximabu a chemoterapie je v léčbě non-Hodgkinova lymfomu hodnocená jako bezpečná a efektivní [25]. V některých případech je možno u téhož typu onemocnění volit z několika různých léčebných postupů, které literárně poskytují srovnatelně dobré výsledky léčby.
V literatuře lze nalézt popsané případy primárního lymfomu duodena způsobujícího ikterus [19,26]. Ve většině těchto popsaných případů byla léčbou volby onkologická léčba, následně chirurgické či kombinované léčebné postupy [17,27].
Vzhledem ke klinickému průběhu a expresi agresivních markerů na povrchu B buněk byla u našeho pacienta zvolena R-CHOP chemoterapie (rituximab, cytoxan, hydroxydaunorubicin (adriamycin), oncovin (vinkristin), prednisolon) i s vědomím, že se jedná o zatěžující léčbu.
Závěr
Přestože je primární non-Hodgkinův lymfom duodena považován za relativně vzácný, je nutné na toto onemocnění myslet. Ve většině případů jsou příznaky lymfomu tenkého střeva zcela nespecifické. Prvním příznakem může být obstrukční ikterus a obstrukce duodena, přesná incidence a prevalence těchto příznaků ale není známá. Pacienti prezentující se obstrukčním ikterem, zejména je-li spojený s poruchou evakuace žaludku, musí být důkladně vyšetřeni mimo jiné i k vyloučení vzácných lézí této lokality, např. primárního lymfomu duodena. Při podezření na primární tumor duodena s obstrukčním ikterem je vhodné vyčkat výsledků histologického vyšetření, než bude učiněno rozhodnutí o invazivním řešení obstrukce žlučových cest, dovolí-li to klinický stav pacienta. Jak prezentujeme v naší kazuistice, důkladná diagnostika a mezioborová spolupráce u tohoto pacienta vedla k zahájení maximálně efektivní léčby, čímž se zabránilo předčasnému radikálnímu chirurgickému výkonu.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 12. 2015
Přijato: 27. 2. 2016
MU Dr. Hassan Naeem
Gastroenterologické oddělení
Nemocnice Tábor, a. s.
Kpt. Jaroše 2000
390 03 Tábor
naeem@seznam.cz
Sources
1. Isaacson P, Wright DH. Malignant lymphoma of mucosa-associated lymphoid tissue. A distinctive type of B-cell lymphoma. Cancer 1983; 52(8): 1410 – 1406.
2. Bozdag AD, Nazli O, Tansug T et al. Primary tumors of the small bowel: diagnosis, treatment and prognostic factors. Hepatogastroenterology 2003; 50 (Suppl 2): 216 – 218.
3. Woo KH, Kim JH, Yoon SB et al. Duodenal mucosa associated lymphoid tissue lymphoma: a case report. Korean J Intern Med 2007; 22(4): 296 – 299.
4. Schottenfeld D, Beebe-Dimmer JL, Vigneau FD. The epidemiology and pathogenesis of neoplasia in the small intestine. Ann Epidemiol 2009; 19(1): 58 – 69. doi: 10.1016/ j.annepidem.2008.10.004.
5. Rosas Marcos E, Frisnacho Velarde O, Yábar Berrocal A. Malignant duodenal neoplasia: clinical-pathologic profile. Rev Gastroenterol Peru 2003; 23(2): 99 – 106.
6. Jaffe ES, Harris NL, Stein H et al. Classification of lymphoid neoplasms: the microscope as a tool for disease discovery. Blood 2008; 112(12): 4384–4399. doi: 10.1182/blood-2008-07-077982.
7. Garrido A, Luque A, Vázquez A et al. Primary small bowel neoplasms as a complication of celiac disease. Gastroenterol Hepatol 2009; 32(9): 618 – 621. doi: 10.1016/ j.gastrohep.2009.05.003.
8. Marsh MN. Studies of intestinal lymphoid tissue. XI – The immunopathology of cell-mediated reactions in gluten sensitivity and other enteropathies. Scanning Microsc 1988; 2(3): 1663 – 1684.
9. Mundasad B, Hawe M. Lymphoma presenting as a bleeding duodenal ulcer: a case report. The Internet Journal of Tropical Medicine 2005; 3(1): 1 – 3.
10. Gumaste VV, Bhutani MS, Dunphy RC et al. Esophageal Lymphoma. [online]. Available from: http://emedicine.medscape.com/article/174662-overview.
11. Wang HH, Lin JT, Chiu CC et al. Endoscopic features of mucosa-associated lymphoid tissue lymphoma of the duodenum. Gastrointest Endosc 1995; 41(3): 258 – 261.
12. Isaacson P, Wright DH. Malignant lymphoma of mucosa-associated lymphoid tissue. A distinctive type of B-cell lymphoma. Cancer 1983; 52(8): 1410 – 1406.
13. Nagashima R, Takeda H, Maeda K et al. Regression of duodenal mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori. Gastroenterology 1996; 111(6): 1674 – 1678.
14. Tsuji K, Katanuma A, Mori M et al. Clinical study of MALT lymphomas and related diseases of the duodenum representing characteristic findings. Gastroenterol Endosc 1996; 38 : 1931.
15. Yoshida T, Lesato Y, Yokomori T et al. A case of primary MALT lymphoma of the duodenum. Jpn J Gastroenterol Surg 1966; 29 : 452.
16. Leone N, Brunello F, Baronio M et al. High grade B-cell lymphoma arising in mucosa-associated lymphoid tissue of the duodenum. Eur J Gastroenterol Hepatol 2002; 14(8): 893 – 896.
17. Rahman S, Reyes E, Mehta A et al. Primary duodenal lymphoma presenting as obstructive jaundice. Internet J Gastroenterol 2009; 7(2): 1 – 4.
18. Bandyopadhyay SK, Moulick A, Dutta A.Primary duodenal lymphoma producing obstructive jaundice. J Assoc Physicians India 2007; 55 : 76 – 77.
19. Peter U, Honegger H, Koelz HR. Obstructive jaundice caused by primary duodenal lymphoma case report and review of the literature. Digestion 2007; 75(2 – 3): 124 – 125. doi: 10.1159/ 000104828.
20. Hoffart HE. Duodenal malignancies differential diagnosis and therapeutic aspects. Langenbecks Arch Chir 1985; 366 : 539 – 543.
21. Marsh MN. Studies of intestinal lymphoid tissue. XI – The immunopathology of cell-mediated reactions in gluten sensitivity and other enteropathies. Scanning Microsc 1988; 2(3): 1663 – 1684.
22. Beaton C, Davies M, Beynon J. The management of primary small bowel and colon lymphoma – a review. Int J Colorectal Dis 2012; 27(5): 555 – 563. doi: 10.1007/ s00384-011-1309-2.
23. Tomíška M, Vášová I. Současná terapie primárního lymfomu gastrointestinálního traktu. Klin Farmakol Farm 2004; 18 : 153 – 159.
24. Ruskoné-Fourmestraux A, Aegerter P, Delmer A et al. Primary digestive tract lymphoma: a prospective multicentric study of 91 patients. Groupe d’Etude des Lymphomes Digestifs. Gastroenterology 1993; 105(6): 1662 – 1671.
25. Dotan E, Aggarwal C, Smith MR. Impact of rituximab (rituxan) on the treatment of b-cell non-Hodgkin’s lymphoma. P T 2010; 35(3): 148 – 157.
26. Kondo N, Furuya H, Yamamoto S et al. Diffuse large B-cell lymphoma in the ampulla of vater causing obstructive jaundice: report of a case. Surg Today 2008; 38(1): 76 – 80.
27. Najem AZ, Porcaro JL, Rush BF Jr. Primary non-Hodgkin’s lymphoma of the duodenum. Case report and literature review. Cancer 1984; 54(5): 895 – 898.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Noví členové redakční rady časopisu
- Výběr z mezinárodních časopisů
- Olysio® (simeprevir)
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

