-
Medical journals
- Career
První hodnocená zkušenost s testem Septin 9 v České republice
Authors: Pavel Sychra 1; V. Procházka 1; L. Roubalová 2; J. Zapletalová 3; M. Konečný 1
Authors‘ workplace: II. interní klinika – gatroenterologická a hepatologická LF UP a FN Olomouc 1; Oddělení klinické biochemie, FN Olomouc 2; Ústav lékařské biofyziky, LF UP Olomouc 3
Published in: Gastroent Hepatol 2016; 70(4): 300-304
Category: Clinical and Experimental Gastroenterology: Original Article
doi: https://doi.org/10.14735/amgh2016300Overview
Rakovina tlustého střeva a konečníku zůstává přes pokrok v diagnostice i terapii nadále celospolečenským problémem. Některá nenaplněná očekávání screeningových programů vedou ke zkoumání možností využití stávajících poznatků molekulární biologie k časné diagnostice. Zprávy o možnostech testování epigenetických známek nositelů rakoviny tlustého střeva nás vedly ke studii proveditelnosti testu Septin 9 pomocí Epi proColon Plasma Quick kit na skupině 108 pacientů podstupujících kolonoskopii, která byla referenční metodou. Zajímala nás senzitivita a specificita testu v našich klinických podmínkách. V souboru 108 osob byl kolonoskopicky zjištěn u 41 osob adenom, u 21 osob karcinom a 46 osob mělo negativní kolonoskopický nález. V kategorii osob s negativním kolonoskopickým nálezem byl Septin 9 u 34 negativní a u dvou pozitivní, u 10 osob byl test hodnocen pro nízkou koncentraci DNA v izobátu jako nezjištěno (ND – non detected). V kategorii pacientů s prokázaným adenomem byl Septin 9 ve 26 případech negativní a v jednom pozitivní a u 14 osob byl výsledek ND. Ve skupině pacientů s karcinomem byl Septin 9 negativní u sedmi osob, pozitivní u sedmi osob, u dalších sedmi osob byl test hodnocen jako ND. Senzitivita testu Septin 9 pro predikci karcinomu nebo adenomu byla 19,5 % a specificita 94,4 %. Pozitivita testu Septin 9 byla zjištěna signifikantně častěji u osob s karcinomem než u osob s adenomem nebo s negativním nálezem při kolonoskopii (p = 0,003). Septin 9 jako test prokázal vysokou specificitu (94,4 %). Zklamáním byla velmi nízká senzitivita u osob s adenomem v testovaném souboru (jen 3,7 %). Celkové výsledky studie jsou ve velké míře ovlivněny testy, ve kterých byla koncentrace DNA v izolátu vyhodnocena jako nedostatečná a výsledek byl stanoven jako ND.
Klíčová slova:
septiny – Septin 9 – senzitivita – specifita – kolorektální nádoryÚvod
Kolorektální karcinom (CRC – colorectal carcinoma) je jedna z nejčastějších onkologických diagnóz. V ČR je tento nádor druhý nejčastěji diagnostikovaný novotvar u mužů i u žen. V mezinárodním srovnání ČR zaujímá páté místo. Z tohoto důvodu stoupá význam screeningu CRC. V současné době je využíván imunochemický test na okultní krvácení ve stolici (FIT – faecal immunochemical test) a dále screeningová kolonoskopie.
Novou možností v diagnostice CRC je stanovení hypermetylace genu pro Septin 9 z periferní krve. Cílem naší studie bylo posoudit senzitivitu a specificitu tohoto testu v diagnostice CRC v našich klinických podmínkách a z tohoto pohledu zvážit jeho možnosti ve screeningovém programu. Screeningem rozumíme organizované, kontinuální a vyhodnocované úsilí o časný záchyt zhoubných nádorů tlustého střeva a konečníku u bezpříznakových osob.
Již v asymptomatické fázi onemocnění dochází k intermitentnímu krvácení. Tato skutečnost je využívána v základním pilíři screeningového vyšetření – testu na okultní krvácení. Screening má v ČR dlouhou tradici. Prvotní pilotní studie byly v ČR provedeny v letech 1979–1984 a národní program screeningu byl zahájen 1. 7. 2000 [1–4].
Screeningové vyšetření je v ČR dvoustupňové. Provádí se pomocí testu na okultní krvácení do stolice (TOKS) u asymptomatické populace nad 50 let věku, a pokud je test pozitivní, následuje kolonoskopické vyšetření. Vyšetření TOKS se ve věku 50 – 55 let provádí 1× ročně. Od 55 let se test provádí pravidelně ve dvouletém intervalu nebo je jeho alternativou provedení screeningové kolonoskopie. Pokud je kolonoskopie negativní a jsou splněny všechny kvalitativní parametry vyšetření (personální, technické, optimální příprava střeva, kompletní vyšetření tlustého střeva, vytahovací čas), pak je interval následné screeningové kolonoskopie 10 let. V lednu 2014 bylo spuštěno adresné zvaní cílové populace k preventivnímu vyšetření.
Mezi další screeningové postupy užívané ve světě patří také detekce genetických markerů a některé zobrazovací metody – sigmoideoskopie, kolonoskopie, irigografie a CT virtuální kolonografie s použitím CT či MR [5].
V současné době nejsou žádná doporučení pro použití testu Septin 9 pro diagnostiku a screening CRC. Test stanovuje metylovaný tumor supresorový gen mSEPT9 v plazmě. Gen SEPT9 kóduje protein Septin 9. Septiny jsou multifunkční proteiny, které jsou zapojeny do buněčné přestavby, apoptózy, neurodegenerace a karcinogeneze. Test Septin 9 je založen na detekci aberantně metylované DNA v sekvenci v2 pro gen SEPT9. Cytozinové zbytky v oblasti v2 pro gen SEPT9 jsou specificky metylovány ve tkáni CRC oproti zdravé sliznici tlustého střeva a konečníku. Tato specifická metylace může být zjišťována z volné DNA v plazmě, která je uvolňována nádorovými buňkami. Pro běžnou populaci v běžném riziku má test podle předchozích studií senzitivitu 48 % a specificitu 92 % při stanovení v dubletu. Specificita pro pokročilé adenomy byla jen 11,2 %. Studie ukázaly, že CRC může být u asymptomatické populace testem detekován, ale není vhodný pro běžný screening, protože senzitivita pro adenomy je velice nízká [6–8].
Design, cíle a metody
Do pilotní studie Septin 9 na II. interní klinice FN Olomouc bylo zařazeno 108 pacientů indikovaných ke kolonoskopii. Téměř v 80 % byla kolonoskopie provedena pro symptomy. U všech osob byla odebrána krev na test Septin 9 a provedena totální kolonoskopie. Pacienti byli rozděleni do tří kategorií dle kolonoskopického nálezu – negativní nález, nález adenomu, nález karcinomu. Cílem studie bylo posouzení proveditelnosti, senzitivity a specifity testu. Základní charakteristiky studovaného souboru (pohlaví, věk, BMI, kuřáctví, alkohol – příležitostná konzumace, diabetes mellitus 2. typu, rodinná anamnéza – adenom nebo CRC) jsou uvedeny v tab. 1.
Table 1. Studovaný soubor a jeho základní charakteristiky (n = 108). Tab. 1. The series and its basic characteristics (n = 108). 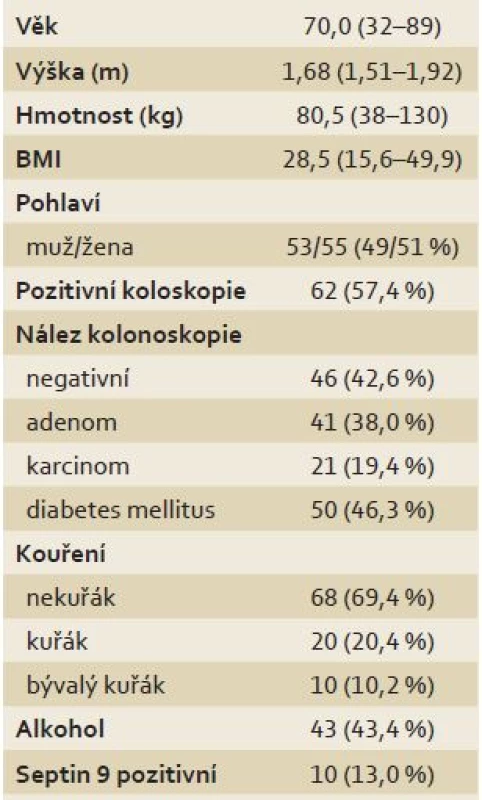
Data v tabulce jsou prezentována jako počet (%), resp. medián (min.–max.). Pacientům bylo odebíráno 9 ml krve do zkumavek Vacuette® Greiner s přídavkem K3EDTA. Po odběru byly vzorky ihned dopraveny do laboratoře. Každá zkumavka byla centrifugována 12 min při 1 350 ± 150 rcf. Do alikvotační zkumavky byly přeneseny min. 4 ml plazmy a následně byly vzorky uchovávány při – 20 °C až do analýzy.
Laboratorní metody
Pro stanovení byly použity kity druhé generace, které vykazují vyšší senzitivitu (81 % při 95% CI 91 – 99 %) a specificitu (97 % při 95% CI 72–87 %). Mez detekce je 14 pg/ ml.
Izolace DNA a bisulfitická konverze vzorků plazmy
Pro izolaci genomové DNA bylo použito 3,5 ml plazmy. Izolace byla provedena ručně, na magnetických partikulích, kitem Epi proColon Plasma Quick kit (kat. číslo M5-02-001, firma Epigenomics AG, Germany) dle protokolu výrobce. V izolátu DNA byla ihned uskutečněna bisulfitická konverze reagencií Epi proColon Bisulfite Solution, která je součástí kitu Epi proColon Plasma Quick kit. Konverze byla opět realizována dle protokolu. Elucí bylo získáno 60 ml bisulfiticky konvertované DNA (bisDNA). S každou sérií vzorků byla zpracovávána i pozitivní kontrola Epi proColon Positive Control z kitu Epi proColon Control kit (kat. číslo M5-02-003, firma Epigenomics AG, Germany). BisDNA byla okamžitě použita pro analýzu polymerázové řetězové reakce (PCR – polymerase chain reaction) a po analýze byla ihned zlikvidována.
Real-time PCR
Pro Real-time PCR analýzu byl použit kit Epi proColon Sensitive PCR kit (kat. číslo M5-02-002, firma Epigenomics AG, Germany). V jedné analýze byla detekována současně cílová metylovaná Septin 9 DNA a interní kontrola (DNA genu pro β-actin). Všechny vzorky i kontroly byly stanoveny v triplikátu. PCR master mix byl připraven z Epi proColon PCR mixu a Epi proColon polymerázy dle protokolu. Objemy byly závislé na aktuálním počtu vzorků. Do PCR reakční směsi bylo použito 15 µl PCR master mixu a 15 µl vzorku bisDNA. Celkový objem reakční PCR směsi byl 30 µl.
Real-time PCR analýza byla provedena na přístroji Bio-Rad CFX 96 s termálním cyklerem C1000 dle následujícího protokolu – denaturace 20 min při 94 °C, 45 cyklů 5 s při 62 °C, 35 s při 55,5 °C, 30 s při 93 °C a finální zchlazení 5 s při 40 °C. Průměrný přírůstek teploty byl 3,3 °C/s. Data byla získávána na konci každého kroku při 55,5 °C. Výsledky byly vyhodnoceny programem Bio-Rad CFX Manager. Celá analýza byla provedena dle optimalizovaného Epi proColon Real-time PCR protokolu pro analyzátory Applied Biosystems® 7500 Fast, nebo 7500 Fast Dx uvedeném v protokolu.
PCR analýza dat
Jako „pozitivní test“ Septin 9 byly vyhodnoceny výsledky, kde nejméně dva ze tří vzorků triplikátu byly pozitivní. Pozitivita byla stanovena na základě cyklu, ve kterém narůstající fluorescence proťala stanovenou mez detekce, tzv. crossing point (CP). Ve všech případech pozitivity pacientských vzorků byly naměřené CP menší než CP pozitivní kontroly v dané analýze. Jako „negativní test“ byly vyhodnoceny výsledky, v nichž nejméně dva ze tří vzorků triplikátu byly negativní.
V případě, že CP interní kontroly pro gen β-actin byl detekován po 36,5 cyklu, byla koncentrace DNA v izolátu vyhodnocena jako nedostatečná a výsledek byl dán jako „nezjištěno (ND – not detected).
Statistická analýza dat
Ke statistické analýze dat byl použit software IBM SPSS Statistics v. 22. K porovnání pozitivity testu Septin 9 u jednotlivých nálezů byl použit Fisherův přesný test s Bonferroniho korekcí signifikance.
Výsledky
V souboru 108 pacientů bylo 41 pacientů s adenomem, 21 pacientů s karcinomem a 46 pacientů s negativním nálezem. V kategorii pacientů s negativním kolonoskopickým nálezem byl Septin 9 u 34 osob negativní a u 2 osob pozitivní a u 10 osob nebyl nález hodnocen pro nízkou koncentraci DNA v izolátu (ND). V kategorii pacientů se zjištěným adenomem byl Septin 9 ve 26 případech negativní a v 1 pozitivní, ve 14 případech byl vyhodnocen jako ND. Ve skupině pacientů s karcinomem byl Septin 9 u sedmi osob negativní a u sedmi osob pozitivní, u zbývajících sedmi byl vyhodnocen jako ND. V naší studii byla zjištěna senzitivita testu Septin 9 pro predikci přítomnosti karcinomu nebo adenomu 19,5 % a specificita 94,4 %. Výsledky zpracování poukazují na jistou míru falešné pozitivity (5,6 %) a také falešné negativity (80,5 %). Senzitivita testu Septin 9 pro predikci karcinomu byla 50,0 %, specificita 94,4 %. Senzitivita testu Septin 9 pro predikci adenomu byla pouze 3,7 %, specificita 94,4 %. Výsledky vč. 95% CI shrnuje tab. 2.
Table 2. Test Septin 9 pro predikci pozitivního nálezu (adenom, karcinom, adenom nebo karcinom). Tab. 2. Septin 9 test to predict a positive finding (adenoma, carcinoma, adenoma or carcinoma). 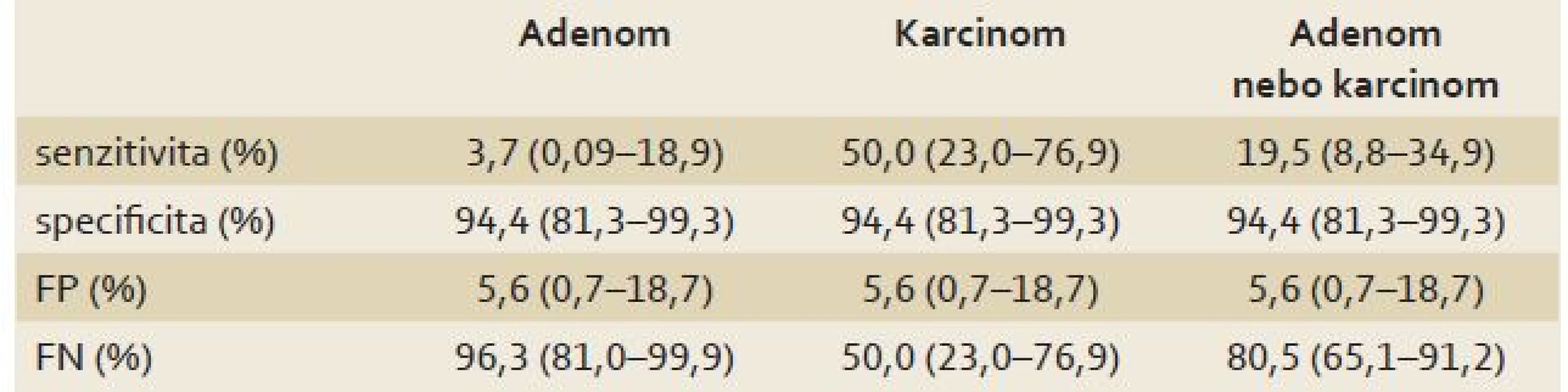
FP – falešná pozitivita, FN – falešná negativita Pozitivita testu Septin 9 byla zjištěna signifikantně častěji u karcinomů (50,0 %) než u adenomů (3,7 %) nebo negativních nálezů (5,6 %), hladina signifikance Fisherova přesného testu byla p = 0,003.
Souhrn výsledků studie Septin 9
Septin 9 jako test prokázal vysokou míru specificity (94,4 %). Největším zklamáním v testovaném souboru byla velmi nízká senzitivita testu Septin 9 u osob s adenomem – jen 3,7 %. Velkou měrou se na celkových výsledcích naší studie podílejí testy, ve kterých byla koncentrace DNA v izolátu vyhodnocena jako nedostatečná a výsledek byl stanoven jako ND. V naší studii se jedná celkem o 31 případů (v sedmi případech u osob s karcinomem, ve 14 u osob s adenomem a v 10 u osob s negativním nálezem).
Diskuze
Rakovina tlustého střeva a konečníku svými biologickými vlastnostmi dovoluje odhalení časných stadií, a tím možnost onemocnění zcela vyléčit. Většinu negativních důsledků tohoto nádorového onemocnění lze významně omezit depistáží [1–4]. Metod využívaných ve screeningu CRC je řada. Ve světě jsou nejčastěji používány metody opírající se o medicínu založenou na důkazech. Mezi ověřené patří TOKS a kolonoskopie. Přes jisté limity vede stávající screening k pozvolnému snižování nemocnosti i úmrtnosti na rakovinu kolorekta. Optimistické výsledky se po letech postupné kultivace screeningu ukazují i v naší populaci. Organizace depistáže, mediální kampaň, edukace laické i odborné části populace a v poslední době i adresné zvaní zvýšily zájem o český národní depistážní program, který má pozitivní odezvu v populaci. Přesto část cílové populace váhá podrobit se zavedeným metodám screeningu. Poznatky molekulární biologie o epigenetických faktorech v karcinogenezi vedly k odhalení významu metylace úseků DNA s následným nevhodným umlčením genů, které, mimo jiné, plní úlohu nádorového supresoru. Tkáň nádorů rakoviny kolorekta obsahuje hypermetylaci v úseku v2 genu pro Septin 9 prakticky ve všech testovaných vzorcích a v plazmě nositelů rakoviny kolorekta lze z cirkulující frakce DNA hypermetylaci detekovat. V celé řadě studií bylo prokázáno, že hypermetylace v úseku v2 genu pro Septin 9 může být použita jako biomarker pro detekci všech stadií CRC. Takový biomarker lze používat pro diagnostiku malignity, monitorování léčebného efektu nebo identifikaci recidivy tumoru [7,8]. Práce Grützman na et al představila v roce 2008 analýzu Septin 9 metylace DNA v plazmě jako jednoduchou, minimálně invazivní metodu detekce všech stadií CRC s možným potenciálem doplnit nenaplněná očekávání a potřeby stávajících depistáží [7]. Postupný pokrok v metodice vyšetřování tohoto biomarkeru vedl podle některých studiích až k 90% senzitivitě a 88% specificitě pro všechna stadia onemocnění, falešná pozitivita testu byla 12 %. Pro časná, léčitelná stadia (I a II) test prokázal 87% senzitivitu [8]. Na rozdíl od těchto optimistických výsledků skupina z Mayo clinic v roce 2012 uveřejnila výsledky malé klinické studie, které poukazují na významně nižší senzitivitu testu na metylovaný Septin 9 v porovnání s testem stolice na markery poškozené DNA při vyhledávání adenomů i CRC [9]. Ve stejném roce publikovala maďarská skupina studii, jejíž výsledky ukazují na významně vyšší senzitivitu i specificitu testu Septin 9 v porovnání s gFOBT (guajakový test na okultní krvácení) a CEA. Výsledky byly lepší bez ohledu na lokalizaci CRC [10]. V americké modelové studii použití testu Septin 9 snížilo incidenci o 35 – 41 % a úmrtnost na CRC o 53–61 % proti populaci bez screeningu. Náklady na dosažení cíle byly vyšší v porovnání s TOKS, FIT, sigmoideoskopií a kolonoskopií. FIT dosáhl nejnižších nákladů a byl považován za preferovanou alternativu v porovnání se všemi ostatními strategiemi. Analýza uvádí, že na úrovni populace může být test Septin 9 přínosem v případě přijatelné ceny a významného zvýšení podílu vyšetřované populace o tu část, která neakceptuje ostatní depistážní strategie [11]. K podobným závěrům dospěla modelová analýza stávajících screeningových postupů v porovnání s testem Septin 9 v Německu [12]. Dalším impulzem pro studium klinického využití testu na metylovanou DNA pro Septin 9 z krve mohou být výsledky multicentrické, prospektivní studie srovnávající test FIT s novým testem na Septin 9 – Epi proColon. V tomto srovnání z pohledu senzitivity (72 %) test Epi proColon nebyl horší než FIT, i když specificita 81,5 % byla nižší než u FIT (97,4 %). Negativní prediktivní hodnota obou testů byla stejná (99,8 %) [13]. Rozsáhlá studie na amerických a německých pracovištích s použitím testu na bázi Septin 9 ukázala, že signál rakoviny tlustého střeva a konečníku v krvi může být detekován u asymptomatických osob s průměrným rizikem, podstupujících screening. Autořisoučasně uvádějí, že využitelnost testu na populační úrovni screeningu bude vyžadovat zvýšení citlivosti metody pro detekci časných nádorů a pokročilých adenomů [14]. Další zprávy dokumentují vývoj nových testů, u kterých je uváděna vyšší citlivost (až 92 %) a specificita (až 90 %) pro komerčně připravené testy druhé generace Epi proColon 2.0 (výrobce Epigenomics AG) [15]. Tento test jsme použili v naší studii. Výzkumníci z Číny aplikovali stejný test na téměř 500 pacientů. Referenční ověřovací metodou byla ve všech případech, podobně jako v naší práci, kolonoskopie. Výsledky studie z Číny jsou až překvapivé – v případě testu Epi pro Colon 2.0 byla senzitivita pro karcinom 74,8 % při specificitě 87,4 % oproti 58,0 % senzitivity u testu FIT při specificitě 82,4 %. Test nové generace Septin 9 ukázal lepší výsledky při detekci rakoviny než FIT, v případě detekce pokročilého adenomu byly výsledky podobné [16]. Naše závěry potvrzují ve shodě s čínskou studií vysokou specificitu, avšak na rozdíl od čínských autorů naše první zkušenosti ukazují zhruba na poloviční senzitivitu pro karcinom a nedostatečnou senzitivitu pro adenom. Z metaanalýzy a systematického přehledu dosud publikovaných prací vyplývá, že zjišťování metylovaného genu pro Septin 9 lze považovat za velmi perspektivní biomarker, vysoce citlivý a specifický pro detekci CRC [17]. Námi uváděné výsledky vlastní studie nejsou překvapením, ale jsou do jisté míry skeptické, neboť testy byly prováděny komerčním setem Epi proColon druhé generace pro Septin 9. Jistě jsou z pohledu již uvedených zpráv marginální, nicméně jsou první klinickou zkušeností s tímto testem na malé kohortě české populace, kde je dobře zavedený a na bázi výsledků medicíny založené na důkazech dobře organizovaný populační screening CRC. Nejcennější v naší studii je zjištění, že výsledky nebyly rozdílné oproti publikovaným v některých předchozích zprávách z jiných zemí a navíc ukazují na jistý problém s relativně vysokým podílem testů, kdy koncentrace DNA v izolátu byla vyhodnocena jako nedostatečná (ve 31 testech ze 108) a výsledek byl shledán jako ND. Využití testu Septin 9 je v ČR v rámci screeningu CRC v současné době velice problematické, jak stran výsledků testů, tak také z ekonomického hlediska. Imunochemický test na skryté krvácení i kolonoskopie jsou efektivní, levnější a dobře zavedené metody v organizovaném populačním screeningu opírajícím se o medicínu založenou na důkazech. Přestože pro použití tohoto testu není dostatek důkazů, některé zdravotní pojišťovny v ČR tento test nabízejí jako součást nadstandardního preventivního balíčku, zřejmě ve snaze zachytit tu část cílové populace, která nereaguje na standardní varianty metod vyšetření regulérního a legislativně zakotveného populačního screeningu.
Závěr
V pilotní studii jsme na vlastní kohortě poprvé v české populaci ověřovali možnosti vyšetření testu Septin 9 provedeného komerčním kitem Epi proColon 2.0. Naše výsledky potvrdily proveditelnost testu a jeho vysokou specificitu pro CRC, ale nepotvrzují vysokou senzitivitu uváděnou v předchozích studiích. V podobě, v jaké je test k dispozici, není podle našich výsledků vhodnou metodou pro populační screening a záchyt adenomů. Nicméně považujeme jej za možný perspektivní biomarker, jenž si zasluhuje další pozornost, vývoj, kultivaci senzitivity a specificity testu a klinický výzkum.
Touto cestou bych rád poděkoval doc. MU Dr. V. Procházkovi za záštitu a výpomoc s celým projektem SEPTIN 9.
Článek vznikl za podpory vnitřního grantu LF-IGA-2015-028.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 7. 2016
Přijato: 8. 8. 2016
MU Dr. Pavel Sychra
II. interní klinika – gastroenterologická a hepatologická
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
sychra.pavel@centrum.cz
Sources
1. Kocna P, Vanickova Z, Zima T. Laboratory screening markers in gastroenerology – state of the art. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 157(2): 91 – 97. doi: 10.5507/ bp.2013.027.
2. Fric P, Zavoral M, Dvorakova H et al. An adapted program of colorectal cancer screening – 7 years experience and cost-benefit analysis. Hepato-gastroenterology 1994; 41(5): 413 – 416.
3. Zavoral M, Suchanek S, Majek O et al. Colorectal cancer screening: 20 years of development and recent progress. World J Gastroenterol 2014; 20(14): 3825 – 3834. doi: 10.3748/ wjg.v20.i14.3825.
4. Suchanek S, Majek O, Vojtechova G et al. Colorectal cancer prevention in the Czech Republic: time trends in performance indicators and current situation after 10 years of screening. Eur J Cancer Prev 2014; 23(1): 18 – 26. doi: 10.1097/ CEJ.0b013e328364f203.
5. Wohl P, Bednařík M, Wohl P et al. Comparison of various strategies for colorectal cancer screening tests. Eur J Gastroenterol Hepatol 2011; 23(12): 1157 – 1164. doi: 10.1097/ MEG.0b013e3283491438.
6. Fukushige S, Horii A. DNA methylation in cancer: a gene silencing mechanism and the clinical potential of its biomarkers. Tohoku J Exp Med 2013; 229(3): 173 – 185.
7. Grützmann R, Molnar B, Pilarsky C et al. Sensitive detection of colorectal cancer in peripheral blood by Septin 9 DNA methylation assay. PLoS One 2008; 3(11): e3759. doi: 10.1371/ journal.pone.0003759.
8. Warren JD, Xiong W, Bunker AM. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer. BMC Med 2011; 9 : 133. doi: 10.1186/ 1741-7015-9-133.
9. Ahlquist DA, Taylor WR, Mahoney DW et al. The stool DNA test is more accurate than the plasma Septin 9 test in detecting colorectal neoplasia. Clin Gastroenterol Hepatol 2012; 10(3): 272 – 277. doi: 10.1016/ j.cgh.2011.10.008.
10. Tóth K, Sipos F, Kalmár A et al. Detection of methylated SEPT9 in plasma is a reliable screening method for both left - and right-sided colon cancers. PLoS One 2012; 7(9): e46000. doi: 10.1371/ journal.pone.0046000.
11. Ladabaum U, Allen J, Wandell M et al. Colorectal cancer screening with blood-based biomarkers: cost-effectiveness of methylated Septin 9 DNA versus current strategies. Cancer Epidemiol Biomarkers Prev 2013; 22(9): 1567 – 1576. doi: 10.1158/ 1055-9965.EPI-13-0204.
12. Ladabaum U, Alvarez-Osorio L, Rosch T et al. Cost-effectiveness of colorectal cancer screening in Germany: current endoscopic and fecal testing strategies versus plasma methylated Septin 9 DNA. Endosc Int Open 2013; 2(2): E96 – E104. doi: 10.1055/ s-0034-1377182.
13. Johnson DA, Barclay RL, Mergener K et al. Plasma Septin9 versus fecal immunochemical testing for colorectal cancer screening: a prospective multicenter study. PLos One 2014; 9(6): e98238. doi: 10.1371/ journal.pone.0098238.
14. Church TR, Wandell M, Lofton-Day C et al. Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer. Gut 2014; 63(2): 317 – 325. doi: 10.1136/ gutjnl-2012-304149.
15. Molnár B, Tóth K, Barták BK et al. Plasma methylated septin 9: a colorectal cancer screening marker. Expert Rev Mol Diagn 2015; 15(2): 171 – 184. doi: 10.1586/ 14737159.2015.975212.
16. Jin P, Kang Q, Wang X et al. Performance of a second-generation methylated SEPT9 test in detecting colorectal neoplasm. J Gastroenterol Hepatol 2015; 30(5): 830 – 833. doi: 10.1111/ jgh.12855.
17. Li B, Gan A, Chen X et al. Performance of DNA hypermethylation markers in peripheral blood for the detection of colorectal cancer: a meta-analysis and systematic review. PLoS One 2016; 11(5): e0155095. doi: 10.1371/ journal.pone.0155095.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Noví členové redakční rady časopisu
- Výběr z mezinárodních časopisů
- Olysio® (simeprevir)
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

