-
Medical journals
- Career
Korelace indikace k resekci pankreatu s následným histopatologickým nálezem
Authors: A. Pulkertová 1; J. Špičák 1; V. Gábriš 2; D. Kautznerová 3; M. Kučera 4; M. Oliverius 4
Authors‘ workplace: Klinika hepatogastroenterologie, IKEM, Praha, 2Pracoviště klinické a transplantační patologie, IKEM, Praha, 3Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha, 4Klinika transplantační chirurgie, IKEM, Praha 1
Published in: Gastroent Hepatol 2012; 66(3): 191-195
Category: Clinical and Experimental Gastroenterology: Original Article
Overview
Diagnostika maligních a benigních onemocnění slinivky břišní je zásadní problém vzhledem k následující odlišné strategii léčby. U adenokarcinomu pankreatu je chirurgická léčba absolutním diktátem, není indikována v případě lokálně pokročilých a metastatických lézí a benigních tumorů. U chronické pankreatitidy je indikována jen v určitých případech. Stále je běžné, že histopatologický nález předchozí diagnózu zásadně koriguje. Cílem studie bylo určit soulad klinické a histopatologické diagnózy.
Metody:
Retrospektivně jsme analyzovali soubor nemocných, kteří absolvovali v Institutu klinické a experimentální medicíny (IKEM) resekci pankreatu bez ohledu na předchozí indikaci, a porovnávali klinickou a histopatologickou diagnózu.Výsledky:
Nejčastější indikací k výkonu bylo podezření na maligní ložiskový proces v parenchymu pankreatu (220 z 362 resekcí; 61 %).Tento nález se potvrdil u 133 z nich (60 %). Zvláště hodnocený tumor Vaterské papily byl indikací k operaci u 48 nemocných, potvrdil se u 33 (69 %) nemocných. Pro komplikaci chronické pankreatitidy bylo indikováno k operaci 59 (16 %) nemocných. Diagnóza byla potvrzena u 44 (74 %), naopak u 12 (20 %) byl zjištěn tumor. Autoimunní pankreatitida byla v sekčním materiálu zjištěna u 14 (4 %) nemocných, z toho u 11 byla předoperačně považována za tumor. Celkově indikace korelovala s histolopatologickým nálezem pouze u 189 pacientů (52 %).Závěr:
Nesoulad předoperačního závěru a definitivní diagnózy byl velmi častý. Autoimunní pankreatitida nebyla výjimečnou (mylnou) indikací k operaci. Předoperační vyšetření je nutné dále systematizovat a zpřesňovat.Klíčová slova:
autoimunní pankreatitida – chronická pankreatitida – malignity pankreatu – resekce pankreatuDiagnostika chronických onemocnění slinivky břišní zůstává přes pokrok v zobrazovacích i dalších diagnostických metodách obtížnou, zejména vzhledem k následnému rozhodnutí o optimálním terapeutickém postupu, které v případě omylu může mít až fatální důsledky. 60–80 % indikací k elektivní chirurgické léčbě chorob pankreatu tvoří karcinom pankreatu [1]. Resekce je jedinou jednoznačně kurabilní metodou léčby, která je ovšem v důsledku pokročilosti procesu možná u maximálně 20 % (ale spíše u podstatně méně) nemocných [2–4]. Menší skupinu tvoří jiné maligní či potenciálně maligní tumory (neuroendokrinní tumory, mucinózní cystadenom a intraduktální papilární mucinózní neoplazie, solidní pseudopapilární tumor) a metastázy např. karcinomu ledviny [5]. Technikou léčby adenokarcinomu je radikální resekce. Jiné méně zhoubné tumory nevyžadují tak extenzivní resekci. Neuroendokrinní tumory jsou operačně řešeny i v případě přítomnosti metastatického postižení [6]. U lymfomů, které tvoří asi 0,7–1 % pankreatických malignit, je metodou volby chemoterapie [7]. Metastázy do pankreatu jsou k resekci indikované jen v případě, je-li radikálně odstraněno primární ložisko [8]. Zhoubné tumory se většinou zobrazují jako expanzivní proces, u adenokarcinomu obvykle unilokulární a bez cystoidní složky. Obraz ostatních malignit je nejednotný s možnou cystoidní složkou.
Nejčastějšími benigními expanzivními procesy pankreatu jsou pseudocysty, zánětlivé pseudotumory a pravé cysty. Chronická pankreatitida bývá nejčastěji alkoholické etiologie. Typicky se jedná o difuzní postižení pankreatu s přítomností kalcifikací, nicméně na zobrazeních se může jevit jako expanze. Ta je častějším projevem u autoimunní pankreatitidy [9,10]. Ampulární adenomyomy, heterotopická slezina, lipomatózní pseudohypertrofie a hamartomy, které nejsou indikací k operaci, mohou být dalším obvykle náhodným matoucím nálezem [11]. Specifickým problémem (přibližně analogickým s jaterní cirhózou) je zvažování malignizace v terénu chronické pankreatitidy, která má uzlovitý charakter.
Strategie léčby u všech zvažovaných onemocnění je zásadně odlišná. U adenokarcinomu je operace jedinou potenciálně kurabilní metodou, takto ovšem musí být formulován operační cíl. Vzhledem k rychlé progresi onemocnění nelze operaci odkládat déle než v intervalu týdnů. Růst jiných druhů malignit a premalignit je pozvolnější a ohrožení není bezprostřední, což dává prostor pro případné ověřování podstaty procesu.
Hlavními indikacemi k chirurgickému řešení chronické pankreatitidy jsou algický syndrom, symptomatická či rozsáhlá pseudocysta, absces, obstrukce žlučových cest, dále pak obstrukce duodena a pankreatická píštěl. Relativní indikací je nemožnost odlišení od pankreatického karcinomu (tab. 1).
Table 1. Nejčastější indikace k chirurgické léčbě pankreatu. Tab. 1. The most frequent indication for pancreas surgery. 
Neoperovat pacienta s adenokarcinomem vhodného k chirurgické léčbě je chybou s nevyhnutelně fatálním důsledkem. Operovat tzv. zbytečně, tj. pro nezhoubné postižení, a tím vystavení nemocného vážným problémům, je taktéž chybou, ale řádově menší. Cílem naší retrospektivní studie bylo zjistit, nakolik závěr učiněný před operací odpovídal konečné diagnóze stanovené perioperačně a patologicko-anatomicky.
Metodika
Retrospektivně jsme analyzovali všechny resekce pankreatu a totální pankreatektomie provedené na Klinice transplantační chirurgie IKEM v letech 2000–2011 (do 30. 6.). Vyhodnotili jsme výsledky předoperačních vyšetření a porovnali závěr učiněný před operací s operačním a histopatologickým nálezem. V hodnocení stadia onemocnění jsme vycházeli z American Joint Committee on Cancer (AJCC). Resekát byl vyšetřen standardními histologickými metodami, v indikovaných případech bylo doplněno i imunohistochemické vyšetření se zaměřením na konkrétní zvažovanou klinickou jednotku.
Výsledky
Pro suspektní adenokarcinom bylo k operaci indikováno 220 nemocných (60,7 % z celého souboru). Následovala algická forma chronické pankreatitidy (59; 16,4 %), dále ampulom (tab. 2).
Table 2. Nejčastější indikace k operačnímu řešení v našem souboru. Tab. 2. The most frequent indication for surgery in our patient cohort. 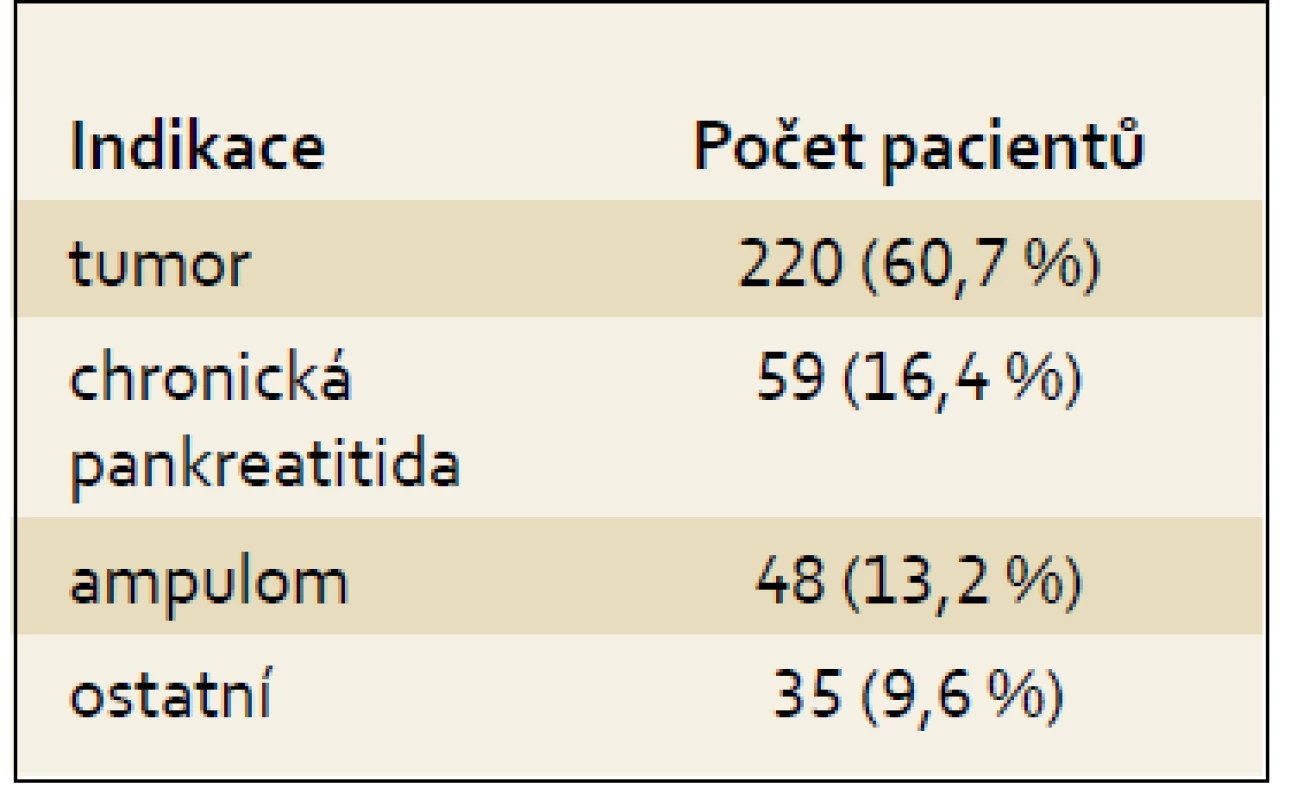
Ložiskové léze byly zjištěny ve 158 případech (43,6 % nemocných). U 133 se jednalo o malignitu, z toho u 110 (82,7 %) o adenokarcinom. U 12 (9 %) byl diagnostikován neuroendokrinní tumor, v jednom resekátu byl přítomen pleomorfní karcinom obrovskobuněčného typu. Metastáza ve slinivce břišní byla nalezena u tří nemocných s primárním karcinomem ledviny a u jednoho s karcinoidem plic. U čtyř pacientek bylo v resekátu tumorózní ložisko hodnoceno jako solidní pseudopapilární tumor, v jednom případě s malignizací a perineurální invazí.
Image 1. Karcinom hlavy pankreatu – makroskopie resekátu. Fig. 1. Pancreatic head carcinoma – resected specimen macroscopy. 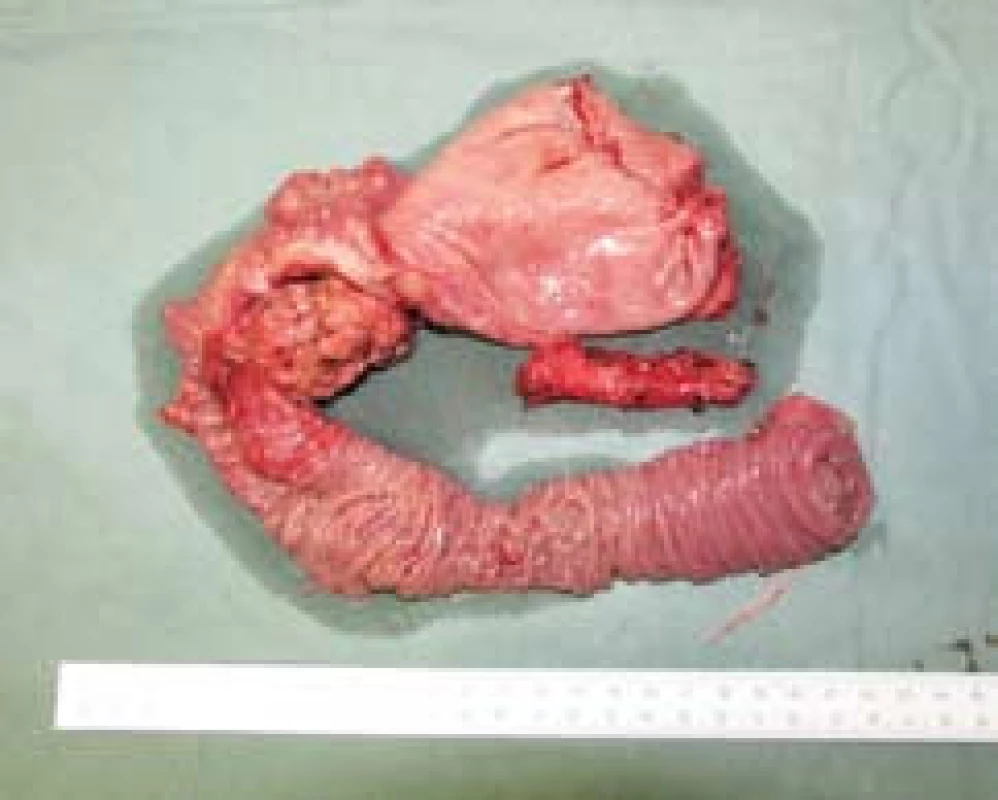
Image 2. Karcinom těla a kaudy pankreatu – CT nález. Fig. 2. Pancreatic body and tail carcinoma – CT finding. 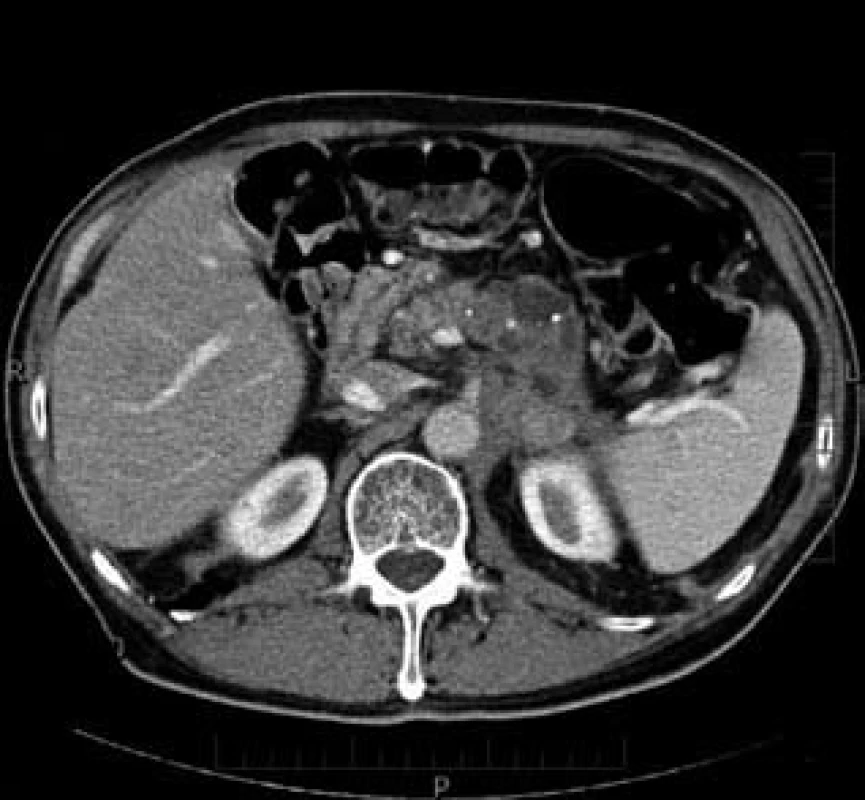
Image 3. Autoimunní pankreatitida – CT nález. Fig. 3. Autoimmune pancreatitis – CT finding. 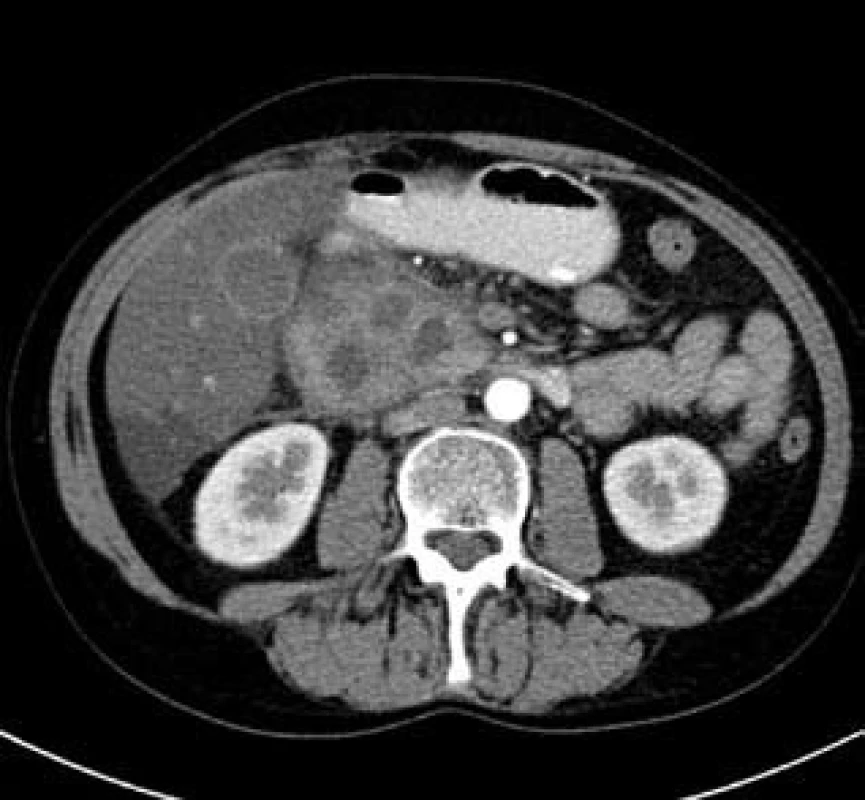
Diferenciaci a stadium primárních maligních tumorů pankreatu ukazuje tab. 3. Převažovaly nádory středně až nízce diferencované. Nejčastěji byly karcinomy ve stadiu IIB dle AJCC (celkem 43; 47,2 %), s pozitivním nálezem v uzlinách a bez vzdálených metastáz.
Table 3. Staging maligních tumorů pankreatu. Tab. 3. Staging of malignant pancreatic tumours. 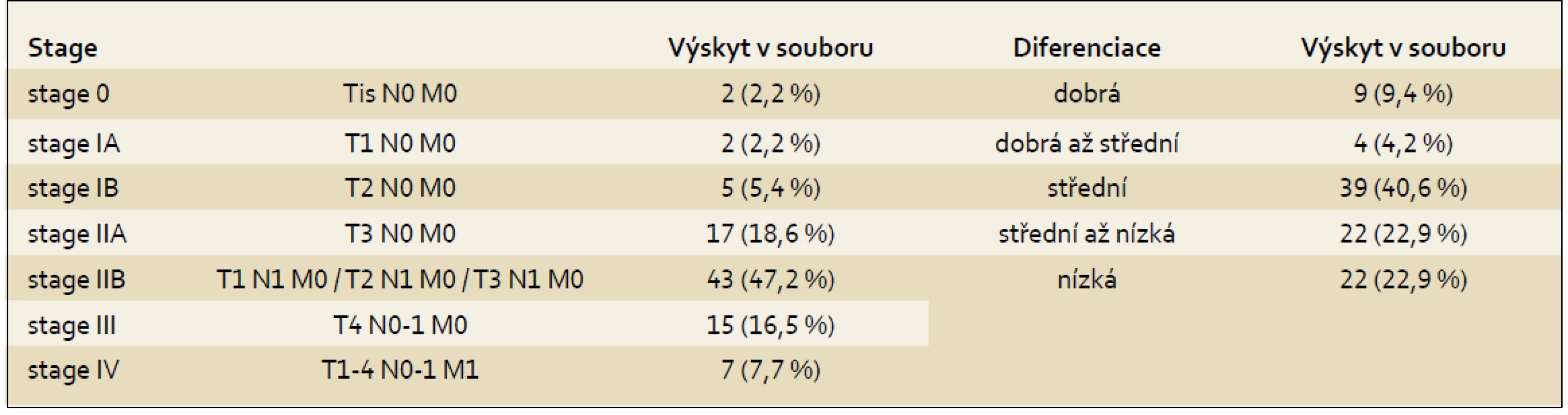
Chronická pankreatitida byla zjištěna histopatologickým vyšetřením u 113 nemocných (31,2 %). Nejčastější indikací k výkonu bylo podezření na tumor (58; 51,3 %), následoval algický syndrom (38; 33,6 %).
Kritéria autoimunní pankreatitidy (AIP) splňovalo celkem 14 resekátů, což je 3,8 % z celkového souboru. Ve všech případech se jednalo o lymfoplazmatickou pankreatitidu (typ I), imunohistochemické vyšetření IgG4 pozitivních plazmatických buněk bylo provedeno u pěti vzorků a u všech byly tyto buňky přítomny. Ve třech resekátech byl v terénu AIP diagnostikován adenokarcinom. Pokud pomineme tyto tři pacienty se současným nálezem AIP a karcinomu, pro suspektní malignitu bylo indikováno celkem 8 (72,7 %) nemocných. Ani u jednoho nebyla předoperačně diagnóza AIP zvažována a všechny zobrazovací metody (CT/EUS) svědčily pro ložiskový proces. U pěti byl současně zvýšený marker CA19-9.
Ampulární tumor byl histopatologicky diagnostikován u 41 (11,3 %) nemocných, z toho u 38 se jednalo o maligní a u tří o benigní proces. Zde byla nejvýraznější shoda s předoperačním závěrem (31; 75,6 % nemocných). Osm nemocných bylo odesláno k operaci pro podezření na karcinom pankreatu. U dvou byla přítomna familiární polypóza. U 25 (60,9 %) byla předem provedena histologická verifikace, 6 (14,6 %) pacientů bylo odesláno vzhledem k pokročilosti nálezu na papile bez ní.
Image 4. Hlavní pankreatický vývod s lymfoplazmocytární zánětlivou celulizací s příměsí eozinofilů při autoimunní pankreatitidě. Fig. 4. Main pancreatic duct with lymphoplasmocytic inflammatory cellulization mixed with eosinophils in autoimmune pancreatitis. 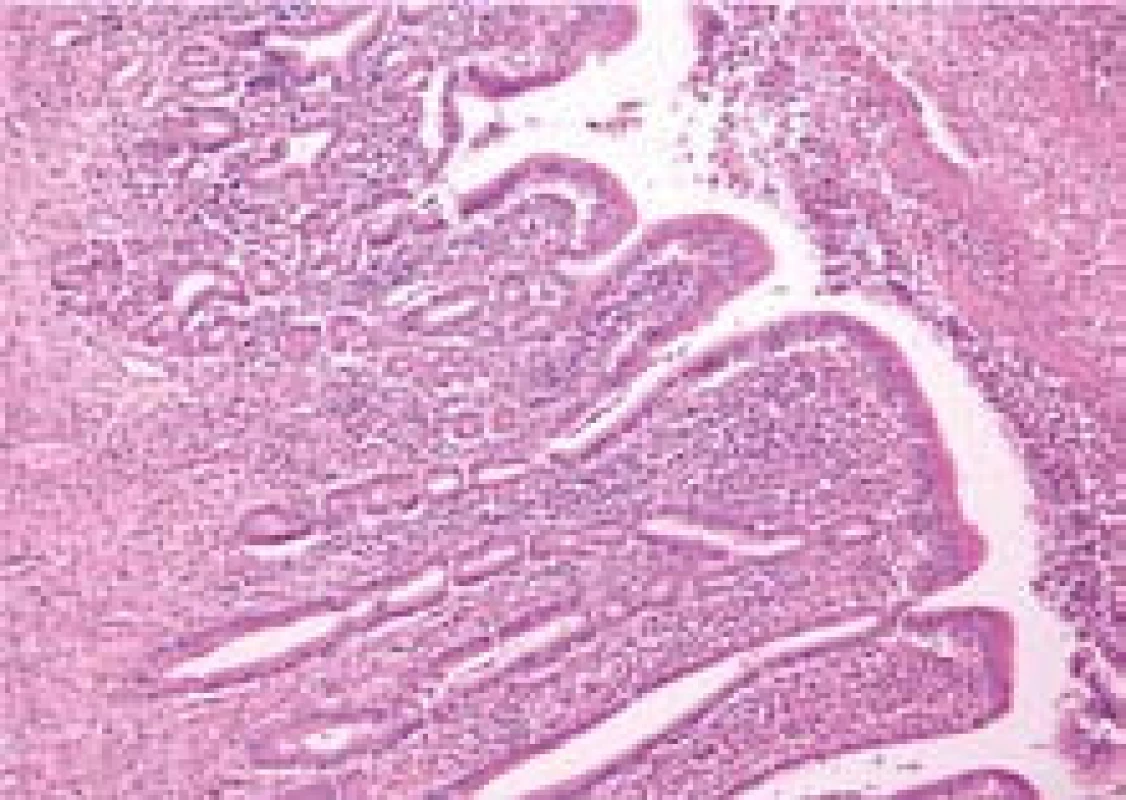
Image 5. Početné imunohistochemicky verifikované IgG4 pozitivní plazmocity u autoimunní pankreatitidy. Fig. 5. Numerous immunohistochemically verified IgG4 positive plasmocytes in autoimmune pancreatitis. 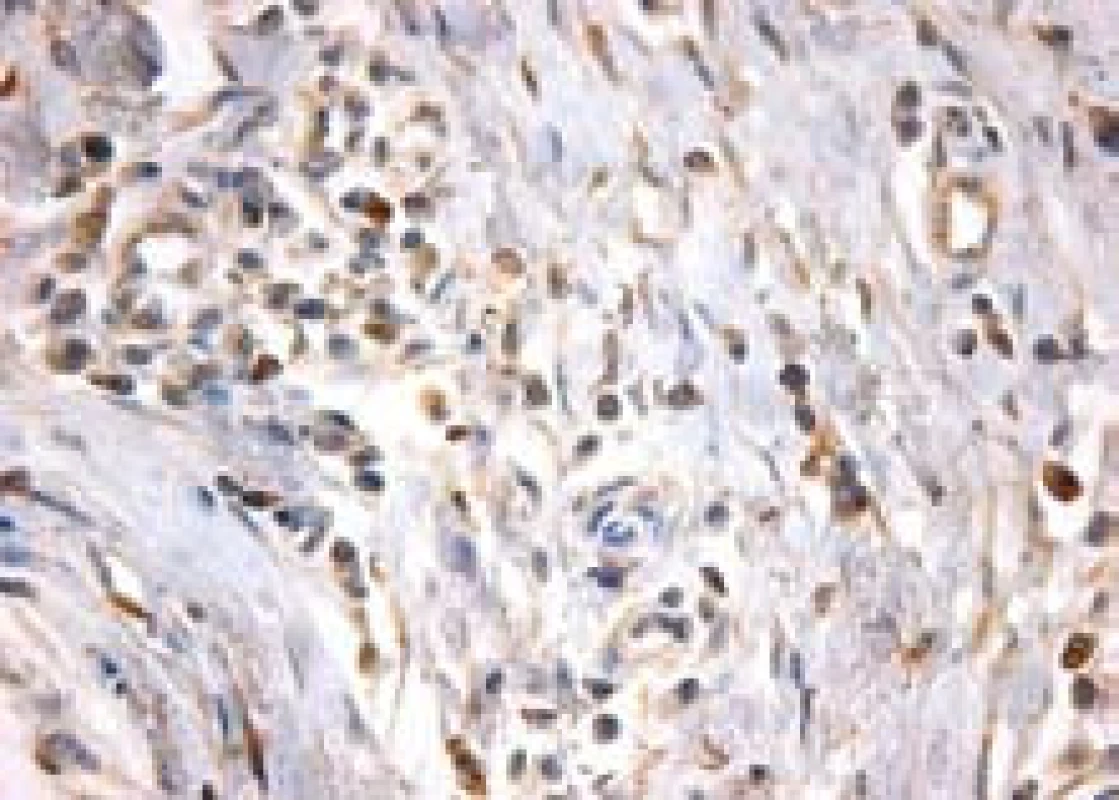
Image 6. Duktální karcinom v terénu autoimunní pankreatitidy. Fig. 6. Ductal carcinoma during the course of autoimmune pancreatitis. 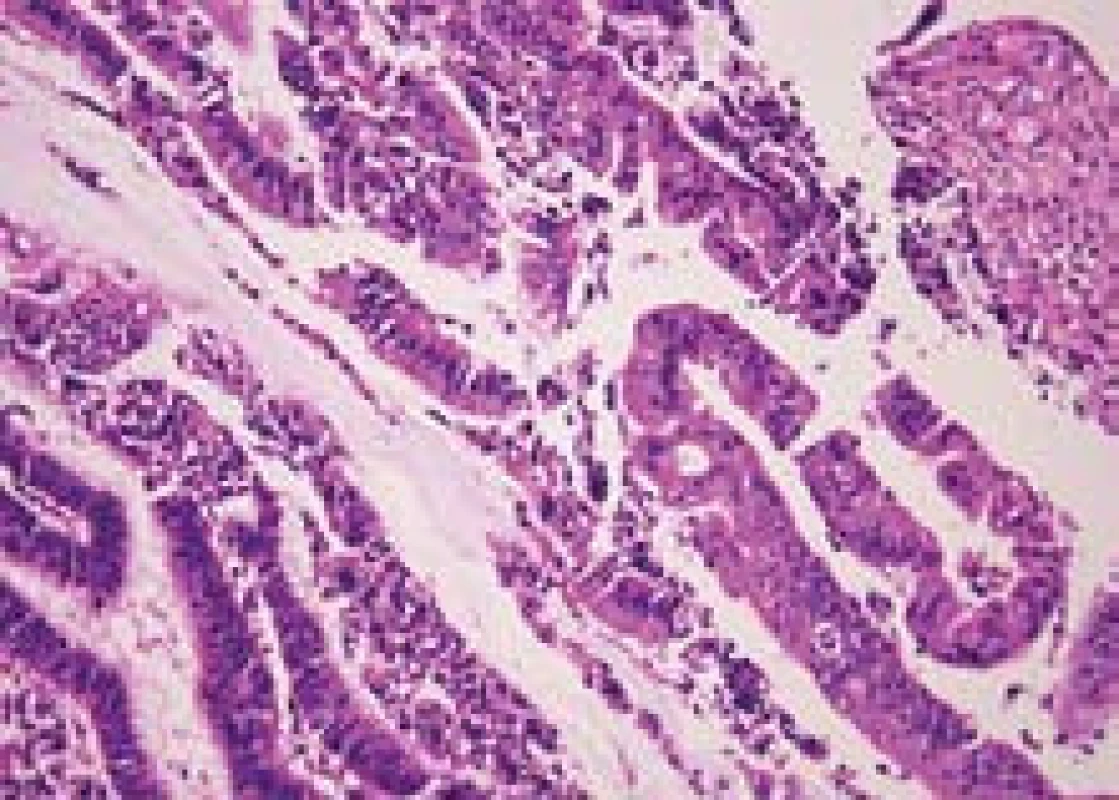
Z celkového počtu 220 pacientů indikovaných k operaci pro suspektní maligní tumor se tento nález potvrdil u 133 (60 %). Naopak, u pacientů indikovaných pro chronickou pankreatitidu byla v resekátu zjištěna neoplazie u 13 (22 % z 59 nemocných). Celkově závěr předoperačního vyšetření koreloval s histopatologickým nálezem u 189 pacientů (52,2 %).
Diskuze
Diagnostika pankreatických onemocnění s ohledem na následný léčebný postup je stále obtížná. Retroperitoneální uložení pankreatu limituje výtěžnost zobrazovacích vyšetření. Kalcifikace vytváří akustický stín, který omezuje posouzení okolního pankreatického parenchymu [11]. Nálezy zobrazovacích metod jsou patognomické pouze do určité míry, naopak jednotlivá onemocnění se poměrně často zobrazují atypicky. Například přestože je chronická alkoholická pankreatitida svou povahou difuzním procesem, u části nemocných (do 30 %) se manifestuje ložiskovou lézí.
Ústřední diagnostickou metodou při podezření na tumor pankreatu je stále počítačová tomografie (CT). Rozlišovací schopnost je vysoká a nejlépe splňuje požadavky na staging. Diagnostická přesnost CT s ohledem na staging a resekabilitu se pohybuje kolem 90 % [12]. Nevýhodou CT je nevýrazná charakteristika struktury tkání a zejména tekutého obsahu a dále expozice záření. Nedostatečná je spolehlivost posuzování metastáz do regionálních lymfatických uzlin, které u nádorů nebývají zvětšené, naopak mohou být mylně považovány za doklad malignity u zánětlivých procesů. V záchytu ložisek vykazuje nejvyšší senzitivitu endoskopická ultrasonografie (EUS), nicméně v terénu chronické pankreatitidy se citlivost EUS snižuje pod 60 %. Přínosem je možnost odběru aspirátu tenkou jehlou, nevýhodou je však omezené zorné pole [13]. Výhodou magnetické rezonance (MR) je absence radiace a posouzení různé tkáňové konzistence, nevýhodou horší prostorová orientace a pohybové artefakty. Přesnost ERCP v rozlišení benigních a maligních lézí se pohybuje mezi 80 a 90 %, včetně rozlišení tumoru a chronické pankreatitidy. Nevýhodou jsou falešně negativní nálezy v případě, že tumor není v kontaktu s hlavním pankreatickým vývodem, míra technické chyby (nezobrazení Wirsungova vývodu), která tvoří 10 %, a nezanedbatelný je i přibližně 5% vznik komplikací [12]. Senzitivita FDG-PET v rozlišení maligních a benigních lézí pankreatu je 85–100 %, specificita 67–99 %. Limitacemi je vysoká incidence poruchy glukózové tolerance či sekundárního diabetu stejně jako vysoká cena a ve většině center se v diagnostice karcinomu pankreatu nevyužívá [12].
Specifickým diagnostickým problémem jsou taktéž cystické léze pankreatu, především rozlišení pseudocysty při chronické pankreatitidě a cystického tumoru. Pomocnou v těchto případech je punkce obsahu cysty s jejím biochemickým (především stanovení amylázy a karcinoembyronálního antigenu) a cytologickým vyšetřením, podrobná analýza přesahuje rámec této studie.
Existuje bezpočet studií posuzujících jednotlivé zobrazovací metody s různými závěry, což vyplývá z nejednotné kvality přístrojového parku i zkušenosti vyšetřujících, ze selekce nemocných a způsobu zaslepení studie.
Specifickým problémem je předoperační tkáňová diagnostika. Odběry je možné provádět pod kontrolou CT a endoskopické ultrasonografie, zejména u prvního však hrozí rozsev metastáz bioptickým traktem. Obecně se má za to, že při výrazném podezření na adenokarcinom se tkáňová diagnostika před operací nepožaduje, naopak vždy je nutná před zahájením onkologické léčby.
Také nádorové markery mají význam omezený. K elevaci nejspecifičtějšího markeru Ca 19-9 dochází i u zánětlivých onemocnění pankreatu. Senzitivita a specificita CA 19-9 pro karcinom pankreatu se pohybují mezi 60 a 70 % v závislosti na velikosti tumoru (selekci nemocných) a u malých tumorů je senzitivita zcela nedostatečná. Výpovědní hodnota u pacientů s karcinomem v terénu chronické pankreatitidy nebyla zkoumána [14]. Dalšími potenciálně využitelnými markery jsou polypeptid--specifický antigen (TPS) a glykoprotein CAM 17-1, u nichž je vyšší senzitivita a specificita v rozlišení chronické pankreatitidy a malignity [15,16].
Problém souladu předoperačních vyšetření a operačních a histopatologických nálezů jistě není vlastní jen našemu pracovišti, důležitá je vůle vlastní výsledky takto analyzovat a prezentovat. Samozřejmě ideální, byť nereálný, by byl soulad předoperačního vyšetření a sekčního nálezu blížící se 100 %, označit námi zjištěný nesoulad za kritický by bylo vytržením jednoho přísně deskriptivního úhlu pohledu z kontextu. Úvodem bylo řečeno, že míra dvou příznačných omylů – neoperovat u operabilního adenokarcinomu a naopak operovat při mylném přesvědčení o malignitě – je nesouměřitelná, a s tímto vědomím přistupují k hodnocení diagnostických metod všichni zúčastnění. Při indikacích zejména u hraničních nálezů je nezbytné zvažovat i celkový stav nemocného hodnocený dle obecně platných kriterií ECOG. Samotný věk nemocných pro indikaci není rozhodující [17]. Zcela specificky je třeba posuzovat situaci, kdy po indikaci k operaci pro domnělou chronickou pankreatitidu byla v pankreatu při výkonu zjištěna malignita. Ano, jednalo se o nesoulad, ale důsledek byl pro nemocného blahodárný. Za velmi relativní omyl je třeba také označit nesoulad při konečné diagnóze jiný tumor. Expanze s podezřením na radikálně operabilní adenokarcinom se totiž běžně nebioptuje. Samostatnou kapitolou je autoimunní pankreatitida. Dosud byla v ČR popsána výjimečně, zde byla mylnou indikací k resekci pro domnělý nádor sice minoritní, nikoli však raritní! Nepochybně je nutné s ní počítat. Nedostatky v péči o nemocné s karcinomem pankreatu jsou běžné i v jiných teritoriích s vyspělým zdravotnictvím. Podle amerického retrospektivního šetření registru všech karcinomů pankreatu se zjistilo, že z potenciálně operabilních jich skutečně podstoupila operaci jen menšina.
Závěr
Nesoulad předoperačního závěru a skutečné diagnózy na základě histopatologického vyšetření byl vysoký, a to přes komisionální multioborové hodnocení u většiny nemocných. Kromě objektivních faktorů – nedokonalosti zobrazovacích metod a nejednoznačné manifestaci onemocnění pankreatu – tato skutečnost reflektuje problémy organizační. Většina pacientů přichází částečně vyšetřena z jiných pracovišť s různou mírou kvality provedených vyšetření, přičemž ne všechny nálezy se znovu hodnotí, případně opakují. Problém vzniká i v rámci jednoho zdravotnického zařízení, kde se zpravidla různí lékaři specializují na různé diagnostické metody a chybí synteticko-analytický prvek. Míra pochybení u jednotlivých nemocných je nesouměřitelná a v některých případech byla pro nemocného blahodárná. Chybou lze označit zbytečnou operaci autoimunní pankreatitidy, zde však byl u tří ze čtrnácti nemocných přítomen karcinom! Tato skutečnost podtrhuje nutnost domácího registru těchto nemocných. Výsledek šetření není zdaleka optimální, je však stimulem proces diagnostiky zlepšit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 1. 2012
Přijato: 20. 3. 2012
MUDr. Adéla Pulkertová
Institut klinické a experimentální medicíny
Klinika hepatogastroenterologie
Vídeňská 1958/9, 140 21 Praha 4
adela.pulkertova@ikem.cz
Sources
1. Ryska M, Bělina F. Chirurgie pankreatu. Postgraduální medicína 2005; 7(4): 249–256.
2. Beger HG, Rau B, Gansauge F et al. Treatment of pancreatic cancer: challenge of the facts. World J Surg 2003; 27(10): 1075–1084.
3. Jemal A, Murray T, Samuels A et al. Cancer Statistics 2003. CA CancerJ Clin 2003; 53(1): 5–26.
4. Bilimoria KY, Bentrem DJ, Ko CY et al. National failure to operate on early stage pancreatic cancer. Ann Surg 2007; 246(2): 173–180.
5. Varga M, Oliverius M, Valsamis A et al. Pancreatic resection for metastatic renal cell carcinoma. Klin Oncol 2009; 22(6): 288–290.
6. Fitzgerald T, Hickner Z, Schmitz M et al. Increasing incidence of nonfunctional neuroendocrine tumors of the pancreas. American Society of Clinical Oncology Gastrointestinal Cancers Symposium. Orlando, FL, 2007.
7. Nayer H, Weir EG, Sheth S et al. Primary pancreatic lymphoma. Cancer 2004; 102(5): 315–321.
8. Hlavsa J, Man M, Kala Z et al. Nádory pankreatu. Med pro praxi 2008; 5(10): 388–392.
9. Mizukami H, Yajima N, Wada R et al. Pancreatic malignant fibrous histiocytoma, inflammatory myofibroblastic tumor, and inflammatory pseudotumor related to autoimmune pancreatitis: characterization and differential diagnosis. Virchows Arch 2006; 448(5): 552–560.
10. Dítě P, Ševčíková A, Novotný I et al. Autoimunní pankreatitida v České republice – region jižní Morava. Čes a Slov Gastroent a Hepatol 2007; 61(2): 82–85.
11. Pauser U, Kosmahl M, Kruslin B et al. Pancreatic solid and cystic hamartoma in adults: characterization of a new tumorous lesion. Am J Surg Pathol 2005; 29(6): 797–800.
12. Delbeke D, Pinson CW. Pancreatic Tumors: Role of Imaging in the Diagnosis, Staging and Treatment. J Hepatobiliary Pancreat Surg 2004; 11(1): 4–10.
13. Noh KW, Wallace MB. EUS-FNA in Diagnosis and Staging of Pancreatic Adenocarcinoma: EUS-FNA in Pancreatic Malignancy. Medscape General Medicine 2005; 7(2): 15.
14. Bedi MM, Gandhi MD, Jacob G et al. CA19-9 to Differentiate Benign and Malignit Masses in Chronic Pancreatitis: Is There Any Benefit? Indian J Gastroenterol 2009; 28(1): 24–27.
15. Slesak B, Harlozinska-Szmyrka A, Knast W et al. Tissue Polypetide Specific Antigen, a Marker for Differentiation between Pancreatic Carcinoma and Chronic Pancreatitis. Cancer 2000; 89(1): 83–88.
16. Gansauge F, Gansauge S, Parker N et al. CAM 17.1 – A New Diagnostic Marker in Pancreatic Cancer. Br J Cancer 1996; 74(12): 1997–2002.
17. Oliverius M, Kala Z, Varga M et al. Radical surgery for pancreatic malignancy in the elderly. Pancreatology 2010; 10(4): 499–502.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2012 Issue 3-
All articles in this issue
- Jak kvalitní je Vaše kolonoskopie?
- Endosonografie v diagnostice choledocholitiázy
- Využití NBI v diagnostice a sledování pacientů s Barrettovým jícnem
- Endoskopický trénink na neživém zvířecím modelu zlepšuje endoskopické dovednosti
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
- Endosonograficky navigovaná alkoholová ablácia cystickej neoplázie pankreasu
- Pozitivita imunoglobulinu IgG4 v krevním séru u osob s karcinomem slinivky břišní
- Korelace indikace k resekci pankreatu s následným histopatologickým nálezem
- Antibiotická profylaxe u akutní pankreatitidy
- Očekávané počty nádorů jater, žlučníku a pankreatu ve světě
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV)
- Highlights of the 34th Czech and Slovak endoscopic days
- Zpráva o DDW 2012
- Ostrava Live Endoscopy
- Prof. MUDr. Julius Špičák, CSc., šedesátníkem
- Prim. MUDr. Karel Lukáš, CSc., sedmdesátiletý
- Moviprep® – moderní příprava střeva před vyšetřením
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Moviprep® – moderní příprava střeva před vyšetřením
- Antibiotická profylaxe u akutní pankreatitidy
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

