-
Medical journals
- Career
Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
Authors: Ester Mejstříková
Authors‘ workplace: Klinika dětské hematologie a onkologie, CLIP-Cytometrie, 2. LF UK a Fakultní nemocnice Motol, Praha
Published in: Čes.-slov. Patol., 59, 2023, No. 4, p. 149-156
Category: Reviews Article
Overview
Průtoková cytometrie je zásadní diagnostickou metodou v imunologii a v hematologii u dětí. Výhodou cytometrie je rychlost, kdy v rámci hodin může tato metoda klinikům pomoci ve volbě terapie a indikaci dalších vyšetření.
Klíčová slova:
akutní leukemie – imunodeficience – minimální reziduální nemoc – Průtoková cytometrie u dětí – Hematologická onemocnění
Průtoková cytometrie je technologie umožňující multiparametrickou analýzu na jednobuněčné úrovni v suspenzi buněk (1). Cytometricky lze hodnotit obecné vlastnosti buněk zejména parametr Fsc (forward scatter velikost) a Side scatter (Ssc granularita). Hodnotíme molekuly jak na povrchu, tak i případně uvnitř buňky, zpravidla pomocí monoklonálních protilátek konjugovaných s fluorescenční značkou. Pomocí barviv schopných vázat stechiometricky DNA lze hodnotit případnou ploidii buněk spolu s buněčným cyklem. V hematologii a imunologii má v současné době nezastupitelné místo a jedná se především o analýzu periferní krve a kostní dřeně, menší podíl vzorků tvoří vyšetření mozkomíšního moku a případných bioptických vzorků. V případě bioptických vzorků tkání je třeba daný materiál nejprve převést do suspenze, což vede ke ztrátě informace o architektuře dané tkáně. Je tedy zřejmé, že cytometrie u těchto vzorků je metodou komplementární k histopatologickému vyšetření. V poslední dekádě jsme svědky nástupu nových technologií umožňující současnou analýzu až desítek parametrů současně. Počet parametrů je závislý na konkrétní klinické aplikaci. V imunologii a zejména v hematologii, tvoří významnou část cytometrického vyšetření interpretace vlastního nálezu, která může být někdy časově náročnější než vlastní laboratorní zpracování vzorku. U vyšetření tkání je velmi důležitá těsná spolupráce s patology. Nadstavbou průtokové cytometrie je případná možnost sortování vybraných populací buněk a jejich případná analýza dalšími metodikami (např. stanovení chimérizmu po transplantaci krvetvorných buněk).
CYTOMETRIE V IMUNOLOGII
Diagnostika primárních a sekundárních imunodeficitů
V analýze imunodeficitů se cytometrie uplatňuje především v hodnocení zastoupení subpopulací lymfocytů (2). Základním vyšetřením je hodnocení počtu B, T (CD4, CD8) a NK buněk. Součet B. T a NK buněk by ideálně měl dávat číslo blízké 100%. Vzácně nacházíme expresi antigenu CD19 na subpopulaci NK buněk (3). Tento fenomén může případně komplikovat i detekci minimální reziduální nemoci u B prekurzorové ALL (4). Absolutní počet CD4 lymfocytů je důležitý, jak pro hodnocení stavu imunity u pacientů s HIV infekcí, tak i u pacientů např. po transplantaci hematopoetickými buňkami a řídí se podle tohoto parametru případná antibiotická profylaxe. Lymfocytární buňky lze dále třídit dle stádia zralosti (paměťové, naivní). Pro interpretaci některých nálezů je třeba znát i klinickou situaci pacienta, případnou léčbu (např. kortikosteroidy, anti-CD20, anti-CD19 léčba).
Těžká kombinovaná imunodeficience
Těžká kombinovaná imunodeficience (severe combined immunodeficiency – SCID) je vzácné genetické onemocnění, kde typicky nacházíme absenci nebo významně snížené zastoupení T lymfocytů (5). Podezření je zpravidla vysloveno u velmi malých dětí do 1 roku věku. Absence T lymfocytů není pravidlem vždy, při tzv. maternofetálním engraftmentu nebo při tzv. Omennově syndromu mohou být počty T lymfocytů absolutně i relativně normální nebo i zvýšené. Klíčovým parametrem je tedy hodnocení nejméně zralých forem T lymfocytů, tzv. recent thymic emigrants, jejichž absence je patognomonická pro SCID. V současnosti probíhá novorozenecký skrínink, kde se testuje přítomnost tzv. T cell excision circles (TREC) a kappa-deleting excision circles (tzv. KREC). Absence TREC je patognomonická pro SCID, některé formy navíc mají i absenci KREC (indikující absenci B lymfocytů). Všichni pacienti s abnormálním výsledkem novorozeneckého skríninku jsou komplexně hodnoceny klinickým imunologem a vyšetřeny i průtokovou cytometrií.
Běžný variabilní imunodeficit
Jedná se o širokou skupinu zpravidla geneticky podmíněných poruch syntézy imunoglobulinů. Cytometrie se uplatňuje doplňkově, klíčovým diagnostickým kritériem je porucha tvorby imunoglobulinů. U části pacientů nacházíme absenci B lymfocytů, u dětí (chlapců) by měla vést k vyloučení mutace v Brutonově tyrozinkináze. V současné době by tyto děti měly být zachyceny novorozeneckým skríninkem. U řady pacientů nacházíme odchylky v kompozici diferenciačních stádií B lymfocytů, typicky nacházíme snížení paměťových forem (6). Vzácnou příčinou CVID jsou mutace v genech CD19, CD81 a CD21, kde typicky nacházíme absenci dotčených molekul (7).
Diagnostika autoimunitního lymfoproliferativního syndromu (ALPS)
ALPS je vzácné onemocnění, zpravidla s časnou manifestací v dětském věku obvykle na podkladě mutace ve Fas apoptotické dráze. U pacientů bývá různě vyjádřená lymfadenopatie, splenomegalie, může být přítomen tzv. Evansův syndrom (autoimunitní pénie postihující alespoň dvě linie). V hodnocení lymfocytárních subpopulaci nacházíme zvýšené zastoupení CD4negCD8neg TCRalfa/beta pozitivních T lymfocytů. Pokud je těchto buněk více než 5 % v rámci lymfocytů je podezření značné, že se jedná o ALPS. Mezi 1 až 5% je jistá šedá zóna. Maccari et al publikovala v roce 2021 práci, kde ukázala, že u pacientů s ALPS na podkladě mutace ve FAS apoptotické dráze v rámci tzv. double negativů převažuje fenotyp CD38+CD45RA+ (8,9) oproti jiným formám ALPS, například na podkladě mutace v genu pro STAT3 GOF nebo CTLA4 deficienci. Příklad pacienta s heterozygotní mutací ve Fas genu je na obrázku číslo 1.
Diagnostika hemofagocytující lymfohistiocytózy
V algoritmu vyšetření pacientů s podezřením na primární hemofagocytující lymfohistiocytózu (FHL) má cytometrie nezastupitelnou roli. Jedná se o často fulminantně probíhající onemocnění a v některých situacích se bohužel jedná o diagnózu stanovenou post mortem. Základním mechanismem u tohoto onemocněni je primární či sekundární porucha cytotoxické funkce T lymfocytů a NK buněk, která vede k deregulované aktivaci imunitního systému. U podtypu FHL2 nacházíme mutaci v genu pro perforin. Molekula perforin je exprimována nativně v NK buňkách a v aktivovaných T lymfocytech a je snadno vyšetřitelná cytometricky pomocí standardního intracelulárního značení. U podtypů FHL3 až 5 (FHL typ 3 – mutace v genu pro hMunc13-4, FHL4 – mutace v genu pro syntaxin, a FHL typu 5 mutace v genu pro Syntaxin binding protein) nacházíme poruchu degranulace NK buněk. In vitro test degranulace NK buněk probíhá pomocí stimulace NK buněk pacienta nádorovou buněčnou linií a následné stanovení exprese molekuly CD107a pomocí průtokové cytometrie (10). Tento test klade vysoké nároky na kvalitu vzorku a zároveň interpretace testu může být velmi obtížná. U primárních forem HLH nacházíme obvykle velmi výraznou aktivaci zejména CD8+ T lymfocytů dle exprese HLA DR, u sekundárních forem to není u všech pacientů. U pacientů s lymfadenopatií je potřeba vyloučit anaplastický velkobuněčný lymfom (ALCL), kde typicky při diagnóze nacházíme různě vyjádřené symptomy hemofagocytózy (11).
Test oxidativního vzplanutí (burst test) při podezření na chronickou granulomatózu
V tomto testu sledujeme oxidativní vzplanutí granulocytů po stimulaci například PMA (phorbol-myristyl-acetátem). Po proniknutí do granulocytů dojde k produkci toxických kyslíkových radikálů a k aktivaci NADPH oxidázy. Tuto reakci lze sledovat podle tvorby fluorescenčního produktu (rhodaminu 123) pomocí průtokové cytometrie. Používá se k diagnostice chronické granulomatózy (CGD), kde je geneticky podmíněná porucha produkce kyslíkových radikálů (12). Převažuje X vázáná forma, u matek přenašeček nacházíme pak zpravidla dvě populace granulocytů. Lze případně použít i pro sledování chimérizmu po alogenní transplantaci krvetvorných buněk.
Selektivní deficience granul
Jedná se o velmi vzácné onemocnění klinicky se překrývající s chronickou granulomatózou (CGD). Podkladem je mutace v genu pro transkripční CEBPe (13). Tento transkripční faktor je zásadní pro diferenciaci monocytů a granulocytů a pro syntézu tzv. sekundárních granul. U pacientů nacházíme významnou hypogranularitu granulocytů, zvýšenou expresi monocytárních znaků (např. CD14) na monocytech a úplnou absenci sekundárnch granul (např, laktoferin) v granulocytech (Obr. 2).
Deficit adhezivních molekul
Jedná se o geneticky podmíněnou deficienci adhezivních molekul, které jsou důležité pro vstup granulocytů do místa zánětu. Rozlišujeme typ I, kde je problém v podjednotce b2 integrinových podjednotek CD11/CD18. Mutovaný CD18 prekurzorový protein je neschopný se připojit s α podjednotkou (14). Cytometricky prokazujeme absenci CD11a,b,c a CD18 molekul zejména na granulocytech v periferní krvi, kde fyziologicky jsou všechny granulocyty pozitivní. Absenci těchto molekul lze případně sledovat v rámci chimérizmu po transplantaci krvetvorných buněk. LAD II je velmi vzácné, autosomálně recesivně dědičné onemocnění, jehož podkladem je porucha fukózového metabolismu. Cytometricky nacházíme absenci antigenu sialyl-LEwis X (CD15) na granulocytech. Kromě imunodeficitu je u těchto pacientů přítomná i mentální retardace (15).
Cytometrie v hematoonkologii
Cytometrie je základní diferenciálně diagnostickou metodou (16). Nejčastějším typem vyšetřovaného materiálu je periferní krev a kostní dřeň. V menší míře se setkáváme s vyšetřením mozkomíšního moku, výpotku, vzorků lymfatických uzlin, případně jiných bioptických vzorků.
Image 1. Příklad pacienta s prokázanou heterozygotní mutací v genu Fas s projevy lymfoproliferace a splenomegaliÍ. U pacienta zřetelně zvýšené TCR alfa/beta dvojitě negativní T lymfocyty a zřetelným tzv. ALPS signature. 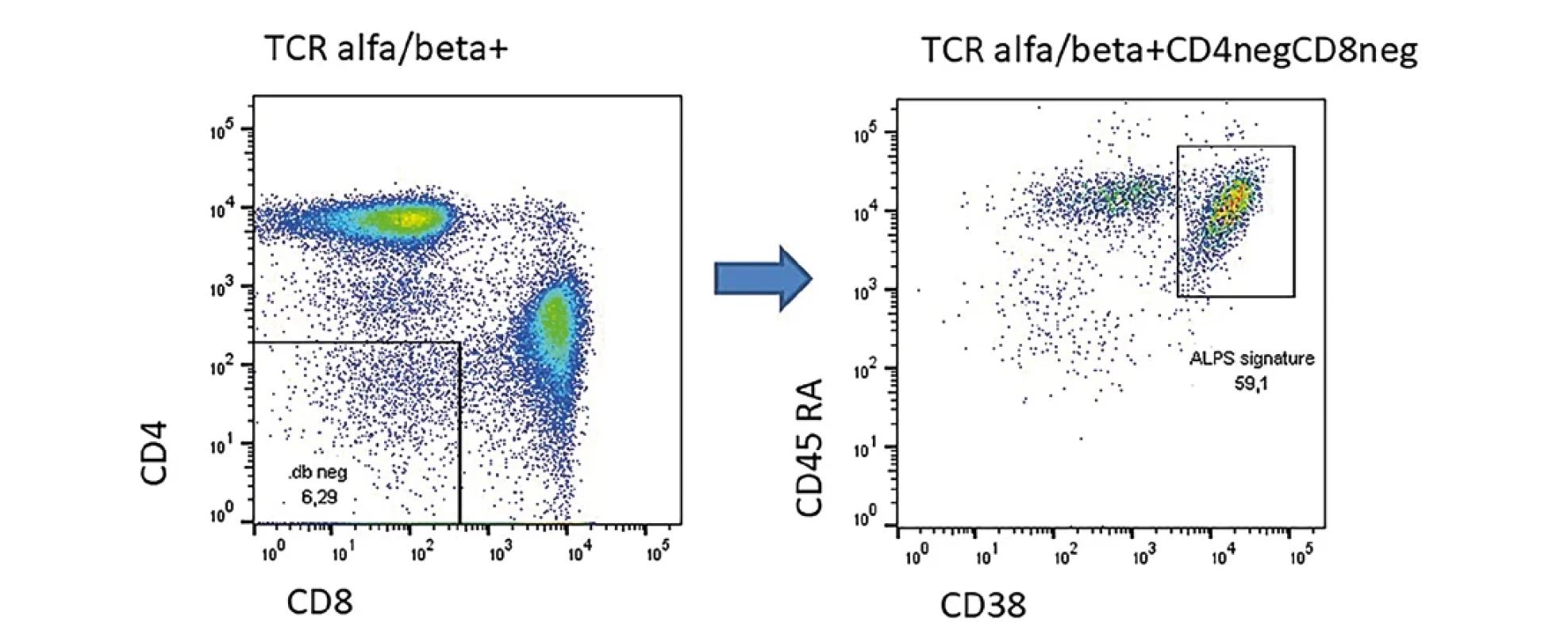
Image 2. Ve sloupci A vlevo je nález u pacientky s prokázanou mutací v genu CEBPe. Je nápadná hypogranularita dle parametru SSc v horním grafu. Nelze dobře opticky podle parametrů Fsc a Ssc oddělit monocyty a granulocyty. V dolním grafu jsou zobrazeny buňky z gatu na horním obrázku. Je zřetelná populace monocytů CD14high CD66c negativní a granulocytů CD14 pozitivních a CD66c vysoce pozitivních. Vpravo zdravá kontrola. 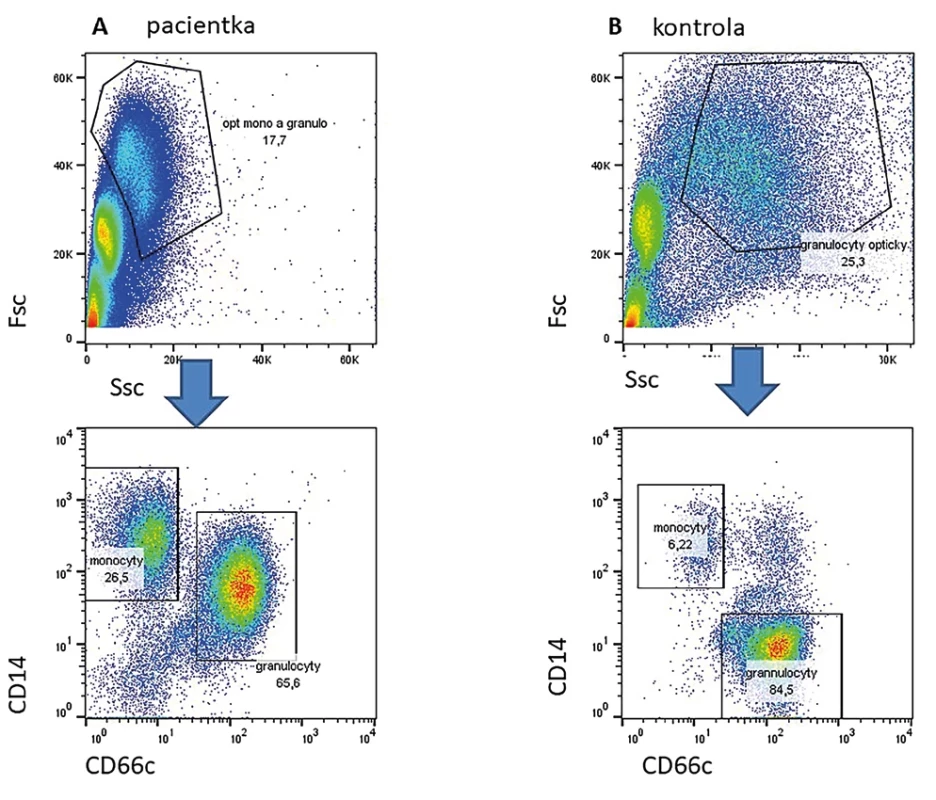
Image 3. A. Malý PNH klon u pacientky po imunosupresivní léčbě pro aplastickou anémii. B. Klinicky významný PNH klon prokázaný u pacientky sledované pro trombocytopenii s nově prokázanou hemoglobinurií a ikterem. 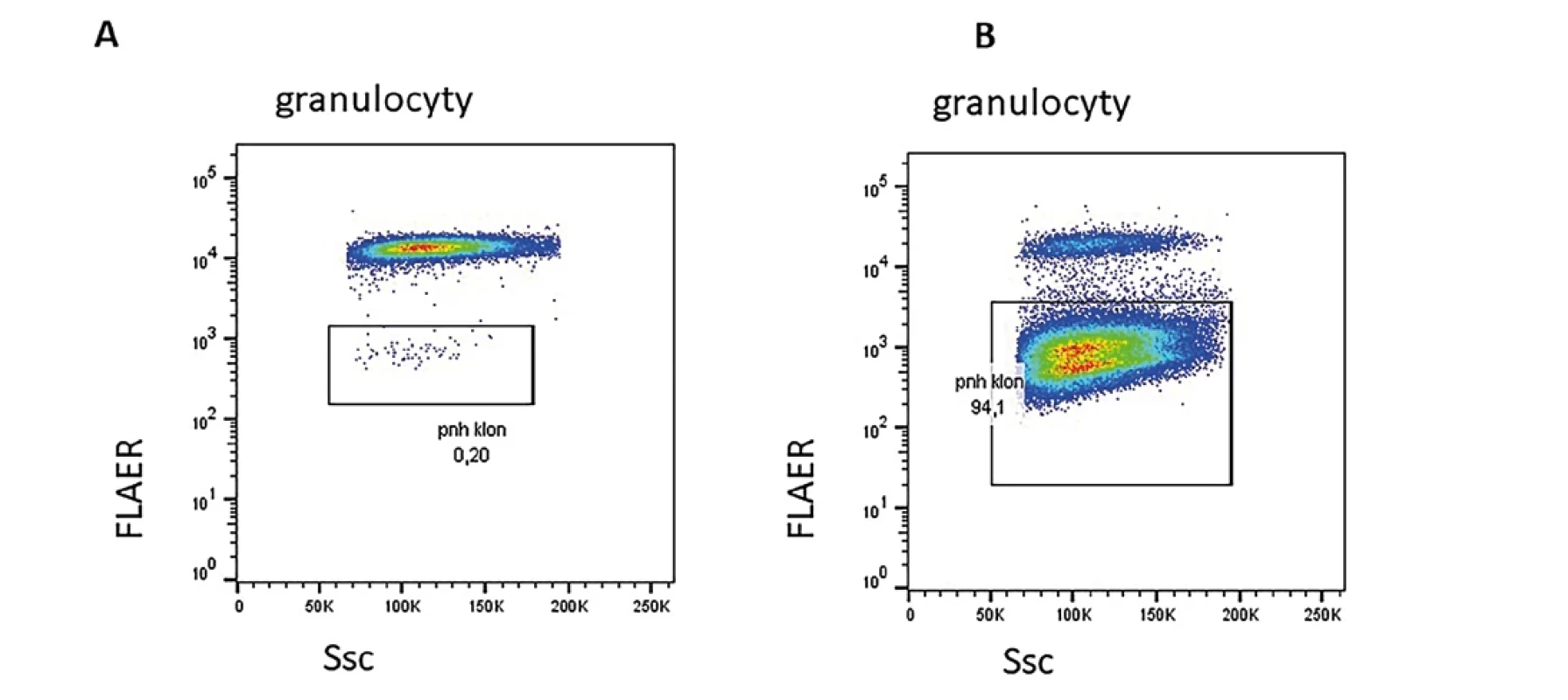
Image 4. Prokazujeme snížení mediánu intenzity EMA fluorescence o 29% u pacienta s hereditární sférocytózou (červená křivka) oproti zdravé kontrole (modrá křivka) na erytrocytech. 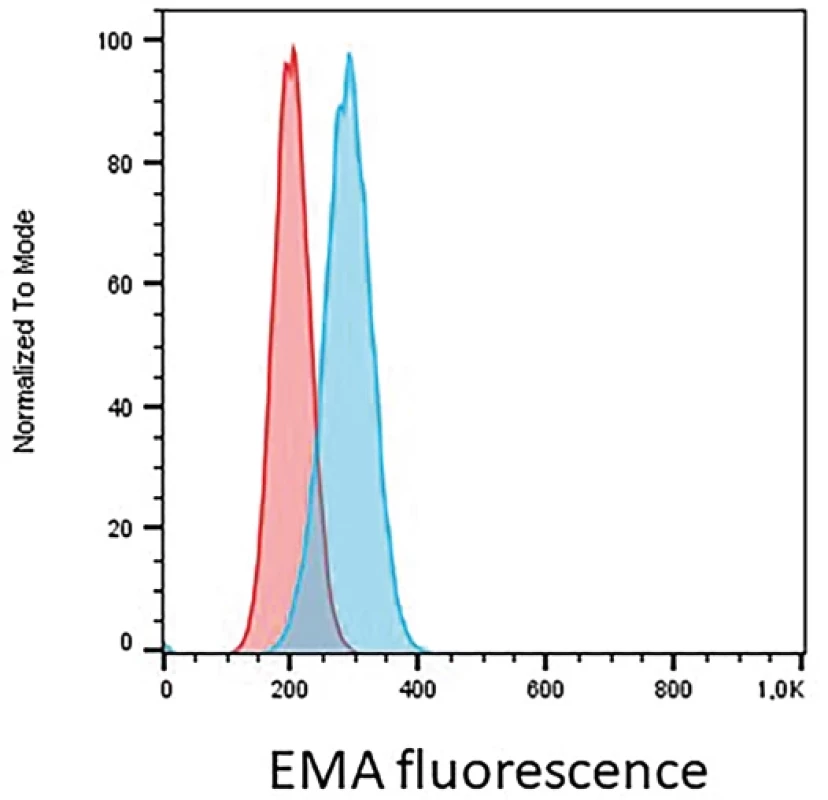
Image 5. Na obrázku A je zobrazen nález u 14 denního novorozence s čilou regenerující nemaligní B řadou. Je zřetelná diferenciace dle antigenu CD10 a CD20. Vpravo na obrázku B je pacient s BCP ALL, u kterého je zřetelná hyperexprese antigenu CD10. 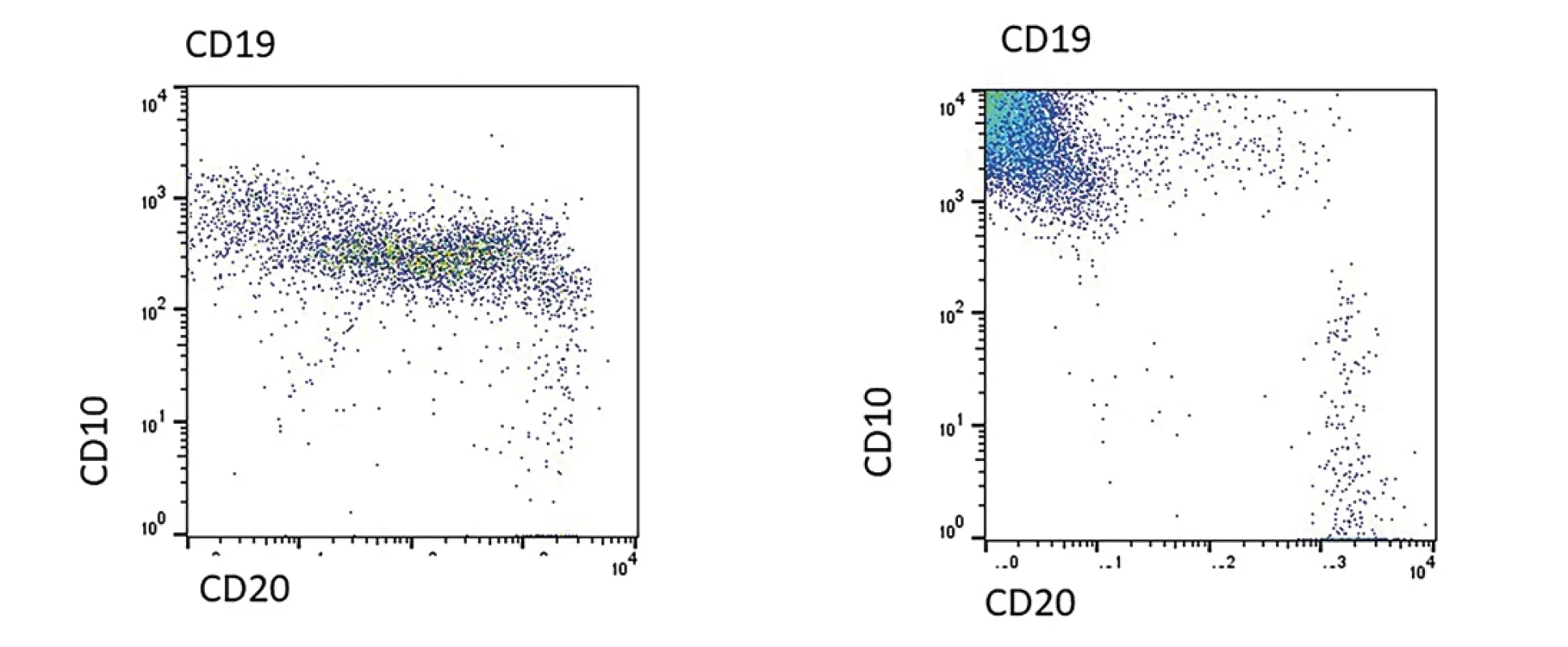
DIAGNOSTIKA NEMALIGNÍCH ONEMOCNĚNÍ
Selhání kostní dřeně na podkladě aplastické anémie
Aplastická anémie je vzácné onemocnění, jak u dětí, tak u dospělých. Etiologie není zřejmá, předpokládá se úloha autoreaktivních T lymfocytů, které poškozují kmenové buňky krvetvorby (17). U dětí pátráme po případném genetickém podkladě (např. Fanconiho anémii, dyskeratosis congenita apod.), ale není vzácností identifikace pacienta např. s dyskeratosis congenita v dospělosti. Typicky nacházíme snížený počet až absenci CD34 a CD117 pozitivních progenitorů. Důležitou diferenciální diagnózou je tzv. váhavě nastupující akutní leukémie, zpravidla B prekurzorová, kde nacházíme projevy selhání kostní dřeně bez zřetelného průkazu zvýšeného počtu blastů morfologicky a s přechodnou spontánní úpravou krevního obrazu. Cytometricky ve fázi selhání krvetvorby často nacházíme variabilní množství atypických buněk (18). V dětském věku ještě v rámci WHO klasifikace rozlišujeme provizorní podjednotku refrakterní cytopenie dětského věku, která se řadí k myelodysplastickému syndromu. Histopatologicky je přítomna dysplázie zejména v erytroidní a megakaryocytární řadě (19), klinicky se ale jedná o jednotku podobnou aplastické anémii.
Paroxysmální noční hemoglobinurie
Průtoková cytometrie je zásadní metodou v identifikaci a monitorování paroxysmální noční hemoglobinurie (PNH) (4,20). PNH je vzácné onemocnění charakterizované intravaskulární hemolýzou, trombofilií a selháním kostní dřeně. Podkladem je somatická mutace v genu kódující glykofosfatidylinositolovou (GPI) kotvu. Na leukocytech i erytrocytech tak mimo jiné chybí molekuly CD55 a CD59. Zejména molekula CD59 je zásadní pro ochranu proti lýze při aktivaci komplementové kaskády u erytrocytů. Nadměrná lýza erytrocytů je základním patofyziologickým mechanismem u PNH. U části pacientů s aplastickou anémií nacházíme při diagnóze, v průběhu, popř. po léčbě klinicky nevýznamný klon, který může i spontánně vymizet. Kvantifikaci PNH klonu provádíme na granulocytech a monocytech, přesněji odpovídá aktuální situaci než kvantifikace na erytrocytech, kde je selektivní výhoda pro erytrocyty nesoucí mimo jiné molekulu CD59. Část pacientů s aplastickou anémií ovšem může dospět i do klinicky plně vyjádřené formy PNH i několik let po úspěšně zaléčené aplastické anémii a je potřeba na tuto komplikaci myslet při sledováni. Příklad dvou různých PNH klonů je na obr. 3.
Diagnostika hereditární sférocytózy
Hereditární sférocytóza je genetické onemocnění zpravidla autosomálně dominantně dědičné, podmíněné defektem genu pro strukturální proteiny cytoskeletu (spektrin, ankyrin, protein III, protein IV.1). Lipidová dvojvrstva je tak nedostatečně zakotvená ke spektrinové vrstvě a při průchodu cévním řečištěm se oddělují jednotlivé části membrány. Snižuje se deformabilita červené krvinky a tvar se postupně mění v kulovitý či elipsoidní. Cytometrie může přispět k diagnostice tohoto onemocnění pomocí barvení eosin-5-maleimidem (EMA) (21). EMA se váže na některé složky plasmatické membrány, zejména proužek 3 membrány. U pacientů s hereditární sférocytózou nacházíme typicky sníženou intenzitou po značení tímto barvivem (obr. 4). Potenciální nevýhodou je vždy potřeba kontrolního vzorku. Pokud je mutací postižen kus membrány, který neváže EMA, fluorescence bude srovnatelná se zdravou kontrolou.
Diagnostika maligních onemocnění
Cytometrie je v současné době zásadní diagnostickou metodou pro hematologická maligní onemocnění. V kombinaci s morfologií a molekulárně genetickými/cytogenetickými metodami se pacienti třídí do jednotlivých kategorií s vlivem na terapii a prognózu.
Akutní leukémie
Cytometrie je zásadní pro správně rozdělení mezi dva základní subtypy, akutní myeloidní leukémii (AML) a lymfoblastickou leukémii (ALL) (22,23). Rozdělení do těchto dvou základních subtypů je zásadní pro typ léčby. U dětí dominujícím subtypem je ALL, četnější je B prekurzorový subtyp, T leukemie tvoří menší část. U některých etnik je podíl T ALL vyšší. S rostoucím věkem stoupá výskyt AML, ve starším věku vlastní AML často předchází myelodysplastický syndrom (MDS). Leukemické buňky jsou částečně imunofenotypově podobné svým nemaligním protějškům, částečně nacházíme v expresi jednotlivých antigenů četné asynchronie a aberace odlišující je od nemaligních buněk. V současné době existuje několik klasifikačních schémat, které slouží i ke kategorizaci pacientů s imunologicky nevyhraněným nálezem na pomezí myeloidní a lymfoidní linie (23,24).
B prekurzorová akutní lymfoblastická leukémie
Typicky nacházíme expresi antigenů CD19, (i)CD22, iCD79a a často s expresí antigenu CD10 a intra-TdT. Atypické blasty napodobují fyziologické B prekurzory, obvykle ale nacházíme řadu odlišností umožňující jejich vzájemnou diferenciaci (např. negativita antigenu CD45, aberantní exprese myeloidního znaku, hyperexprese CD10 a jiné). Příklad hyperexprese antigenu CD10 u BCP ALL a srovnání s fyziologickou nemaligní B řadou je na obr. 5. U malých dětí můžeme v kostní dřeni zachytit desítky procent fyziologických B prekurzorů (tzv. hematogonů) a morfologický obraz může připomínat ALL. Imunofenotyp hemoblastózy může korelovat s genotypem (např. pozitivita CD27 při negativitě CD44 u ETV6/RUNX1, exprese CLL1 u pacientů s přestavbou genu DUX4, exprese CD66c u pacientů s fúzním genem BCR/ABL nebo vysokou hyperdiploidií, exprese CRLF2 u podskupiny pacientů s tzv. BCR/ABL like genotypu, exprese NG2 u pacientů s přestavbou genu KMT2A atd.). Podle zralosti rozlišujeme podskupiny pro B (CD10 negativní), common ALL (cALL) (CD10 pozitivní, intra-IgM negativní) a praeB (CD10 pozitivní, intra-IgM pozitivní). Zralá B ALL (obvykle CD10 pozitivní, CD20 vysoce pozitivní, intra-IgM i povrchové IgM pozitivní s expresí kapa nebo lambda lehkého řetězce) představuje leukemizovanou formu Burkittova lymfomu a je léčená odlišným léčebným protokolem.
T akutní lymfoblastická leukémie
Jak již zmíněno výše, jedná se o vzácnější subtyp lymfoblastické leukémie. Vývoj T lymfocytů z velké částí probíhá v thymu, a proto není překvapivé, že významná část pacientů s T ALL má při diagnóze tumor mediastina. Klíčová je exprese antigenu CD3 buď na povrchu, nebo intracelulárně. WHO klasifikace 2008 zavedla pojem „strong“ CD3 jako definujícící kritérium s cílem vymezit se vůči slabší expresi, která se vzácně nachází u leukémií s koexpresí myeloidních znaků a imunofenotypově stojící na pomezí lymfoidní a myeloidní linie. Metodicky ale toto nebylo zcela jednoznačné ošetřeno. Dále u T ALL obvykle nacházíme expresi antigenu CD7 spolu s intra-Tdt. Podobně jako u BCP ALL odlišujeme stádia dle zralosti: klasifikace EGIL definovala kategorii pro T (CD7, (i)CD3), prae T (CD2 a/nebo CD5 a/nebo CD8), intermediární (CD1a+), zralá T ALL (CD3+, CD1a neg), TCR alfa/beta pozitivní nebo TCR gama/delta pozitivní. Obvykle nacházíme expresi intra-TdT. V roce 2009 publikovala Coustan-Smith kategorii tzv. early T cell precursor T ALL (ETP ALL) částečně se překrývající s kategorií proT a praeT. Je definována primárně jako CD5 negativní (resp. více jak 75% blastů neexprimuje antigen CD5), CD1a a a CD8 negativní spolu s expresí alespoň jednoho myeloidního znaku (25). Původní práce Coustan-Smith prokázala horší léčebnou odpověď a prognózu těchto pacientů. Studie Inukaie et al., která pracovala s upraveným algoritmem pro definici ETP ALL potvrdila horší prognózu (26). V protokolu skupiny AIEOP BFM skupiny, který se používá i v ČR toto nebylo potvrzeno (27). Z pohledu detekce minimální reziduální nemoci (MRN) je důležité zmínit, že u ETP často nejsou nalezeny klonální přestavby Ig/TCR a tudíž často není možná detekce MRN molekulárně geneticky.
Akutní myelodní leukémie (AML)
Podobně jako u lymfoblastické leukémie nacházíme expanzi leukemických buněk nesoucí si určité podobnosti s fyziologickými prekurzory. Cytometrie je zásadní pro identifikaci subtypu M0 (nediferencovaná forma) a M7 (megakaryocytární) (28).
Myelodysplastický syndrom
MDS je heterogenní klonální onemocnění krvetvorby. Výskyt stoupá s věkem, v dětském věku se jedná o velmi vzácně onemocnění. Kromě identifikace počtu nezralých prekurzorů/atypikých buněk se soustředíme cytometricky i na hodnocení vývoje. U dětí bychom vždy měli pátrat pro případné predispozici. Významnou podskupinu tvoří u dětí a mladých dospělých GATA2 deficience (29). Klinické spektrum příznaků je široké od imunodeficience, plicní alveolární proteinózy, primárního lymfedému a hluchoty až po familiární MDS/AML. Často u pacientů s MDS/ AML bývá monozomie 7 nebo trizomie 8. chromozómu. Obvykle nacházíme charakteristické aberace ve složení lymfocytárních subpopulací v periferní krvi: B (NK) lymfopenie, posun B lymfocytů ke zralým formám a snížený počet naivních forem (30). Bývá i monocytopenie, která obvykle koreluje s projevy imunodeficitu, u pacientů v progresi do MDS či AML naopak může být monocytóza (30). Dalším syndromem s predispozicí je syndrom SAMD9/SAMD9 ligand, kde jsme doposud nenalezli konstantní cytometrické odchylky (29).
Myeloproliferace
U myeloproliferativních onemocnění se uplatňuje cytometrie v rámci diferenciální diagnostiky a je snaha identifikovat případnou atypickou populaci. Podobně jako u MDS se uplatňuje hodnocení vzorce diferenciace jednotlivých linií. Diagnostika se samozřejmé dále opírá o molekulární genetiku a morfologická vyšetření. U pacientů s myeloproliferací s eosinofilí je vhodné cíleně pátrat po tzv. lymfocytární variantě hyperesoinfilního syndromu, kdy nacházíme atypické formy T lymfocytů s vysokou expresí CD4 a negativitou CD3 spolu s variabilní expresí CD7 a CD5. U pacientů s primární myelofibrózou jedním z pomocných diagnostických a prognostických kritérií je hladina CD34 pozitivních buněk v periferní krvi. Hladina je obvykle zvýšená. Barosi definoval, že hodnota CD34+ buněk vyšší než 15x106/L v periferní krvi je patognomonická pro primární myelofibrózu a odlišuje ostatní formy myeloproliferativních onemocnění (31).
Transitorní myeloproliferativní onemocnění
Specifickou jednotkou je transitorní myeloproliferativní onemocnění novorozenců spojeného s konstituční trisomií chromozómu 21 u morbus Down a mutací v transkripčním faktoru GATA-1. Obvykle nacházíme kromě zmnožených zralejších forem myeloidních buněk i expanzi blastů s megakaryocytární diferenciací (typicky je přítomná exprese antigenu CD7, CD33, CD56 a obvykle alespoň některý z megakaryocytárních znaků CD41, CD61 a/nebo CD42b (32). Stav se často upraví spontánně bez nutnosti chemoterapie, u části pacientů zhruba do dvou let věku může dojít k rozvoji AML M7.
Lymfomy v dětském věku
Podobně jako u dospělých můžeme lymfomy rozdělit na non Hodgkinské lymfomy (NHL) a Hodgkinův lymfom. Spektrum je částečně odlišné od dospělých pacientů.
Lymfoblastické lymfomy (LBL)
Specifickou kategorii tvoří pacienti s lymfoblastickými lymfomy, kde se jedná o lokalizované formy, imunofenotypově korespondující lymfoblastické leukémii. Současná WHO klasifikace tyto dvě jednotky rozlišuje arbitrárním kritériem 25% blastů
(33). Klíčová je kromě znaků již vyjmenovaná u lymfoblastických leukemií exprese intra-Tdt. Převahu mají T lymfoblastické lymfomy. V případě výpotku lze provést diagnostiku z případného punktátu. Léčí se obdobnými protokoly jako u ALL. Cytometrie se uplatňuje při stanovení tzv. minimální diseminované nemoci, případně pokud je dostupná tkáň s dostatečným zastoupením nádorových buněk, provádíme imunofenotypizaci v rozsahu jako u ALL.
Zralé B lymfoproliferace
Představují velkou skupinu onemocnění dominantně postihující pacienty dospělého věku. U dětí se jedná o vzácnější onemocnění. Již výše je zmíněná zralá B ALL, leukemizovaná forma Burkittova lymfomu (22). Diagnózu je možné stanovit i z případného pleurálního výpotku nebo ascitu. Tento subtyp je typický významnou proliferační frakcí a je často velmi časově omezená viabilita nádorových buněk umožňující cytometrickou analýzu. Často se jedná o velmi agresivní formy s nutností rychlé diagnostiky a urgentního zahájení léčby. Charakteristickou pro tuto kategorii je translokace onkogenu myc. Klíčovým přínosem v diagnostice je cytometrický průkaz případné klonální restrikce dle exprese lehkých řetězců kappa nebo lambda, což platí i pro ostatní formy zralých B NHL.
Zralé T lymfoproliferace
Jedná se o velmi vzácné jednotky. Patří sem již zmíněný ALCL, kde typicky nacházíme vysokou expresi antigenu CD30 s různě vyjádřenými T lymfocytárními znaky (11,34). Diagnosticky svízelnou je tzv. null phenotype varianta, zejména její leukemizovaná forma (35). Ostatní formy jsou extrémně raritní. Za zmínku stojí ještě hepatosplenický lymfom, který může vznikat v terénu imunosuprese či biologické léčby. Imunofenotypově nacházíme zralé TCR gamma/delta pozitivní atypické buňky primárně infiltrující slezinu i játra často rovněž s doprovodnými příznaky HLH (36).
Cytometrie u pacientů s morbus Hodgkin
U Hodgkinova lymfomu dominuje reaktivní infiltrát a vlastní nádorové buňky tvoří minoritu. Zpravidla tvoří agregáty s okolními buňkami a jejich vlastní identifikace cytometricky je stále spíše výzkumnou metodou (37). V reaktivním infiltrátu je zpravidla typická výrazná dominance CD4 pozitivních T lymfocytů.
Cytometrie u histiocytózy z Langerhansových buněk
Klíčovou roli hraje v diagnostice těchto onemocnění histopatologické vyšetření s molekulární genetikou. Cytometrie je metodou komplementární a úspěšná identifikace buněk Langerhansovy histiocytózy je vzácná. Opíráme o znak CD1a spolu s expresí HLA DR a pátráme spíše v granulárních buňkách a netvoří obvykle shluk buněk (38).
Cytometrie u mastocytózy
Obvyklé se opírá o zřetelnou expresi CD117 spolu s expresí CD2 a CD25 a vysokou granularitou (39).
Detekce minimální reziduální nemoci u akutních leukémií
Klíčovou roli hraje průtoková cytometrie ve stanovení hladiny minimální reziduální nemoci (MRN), zejména v časných bodech léčby ALL. Existuje řada metodických přístupů a cytometrie se zdá být použitelná u naprosté většiny pacientů. Zlatým standardem v Evropě u ALL je kvantitativní stanovení pacient-specifických klonálních přestaveb imunoreceptorových genů pomocí PCR. Nicméně, optimalizace vhodných systémů pro detekci pomocí PCR trvá v ideálním případě několik týdnů, proto se cytometrie uplatňuje např. v den 15 léčby ALL. Dále u pacientů bez (vhodných) klonálních přestaveb či fúznich genů je společně s morfologií jedinou metodou umožňující stanovení MRN v průběhu celé léčby. U AML lze u části pacientů s vhodným fúzním genem sledovat MRN rovněž molekulárně geneticky jak na RNA, tak i DNA úrovni. Obecnou nevýhodou cytometrie je, že až na pár výjimek, není žádný antigen zcela leukemicky specifický a nacházíme ho i u normálních krvinek. Dalším problémem je změna fenotypu blastů v průběhu léčby. Hodnotíme komplexní vzorec exprese povrchových znaků, který porovnáme s fyziologickými a reaktivními leukocyty kostní dřeně. U BCP ALL typické známky svědčící pro leukemický původ je negativita CD45, hyperexprese nebo naopak negativita CD10, nízká pozitivita až negativita CD38 u CD10 pozitivních blastů a aberantní exprese myeloidních znaků. U pacientů s přestavbou genu DUX4, ZNF384 a mutací PAX5-P80R po zahájení léčby často blasty mění fenotyp směrem k monocytům (40). Do analýzy MRN v současnosti významně zasahuje cílená léčba, zejména u BCP ALL (anti-CD19, anti-CD22, anti-CD20, anti-CD38). Dochází buď k selekci klonů, kde je daná molekula negativní (např. CD19) (41) nebo dojde k liniovému přesmyku (42) nebo daná protilátka zablokuje danou molekulu, jako jsme pozorovali při léčbě daratumumabem (43). U T ALL jak již zmíněno výše existuje podskupina ETP ALL, kde často chybí klonální přestavby a cytometrie je tak často jedinou metodikou pro sledování MRN (27). U T ALL se při hodnocení MRN opíráme obvykle o znaky CD7, CD99, CD5, CD3, CD4, CD8 spolu s CD34, CD38, exprese TCR alfa/beta nebo TCR gama/delta. U AML zpravidla zohledňujeme stádium diferenciace (myeloidní, monocytární, megakaryocytární apod.).
ZÁVĚR
Rozsah otázek, které můžeme klást na cytometrii je velmi obsáhlý. Dominující aplikacemi je kategorizace hematoonkologických malignit a imunodeficitů a detekce minimální reziduální nemoci. Interpretační část vyšetření může být poněkud zdlouhavá a neobejde se u řady vyšetření bez expertní složky. Snaha je v současné době postupně zapojit i automatizované algoritmy do analýzy dat (44). Postupné, zejména díky aktivitám konsorcia EUROFLOW, je možné i přímé mezilaboratorní srovnání a případné porovnání vzorku s referenční databází. Smysl má i případná centralizace u vzácnějších jednotek.
PODĚKOVÁNÍ
Práce byla podpořena grantem NU23-05-00353. Dále bych ráda poděkovala svým kolegům Ondřejovi Hrušákovi, Tomášovi Kalinovi, Michaela Reiterové, Martině Váškové, Barboře Cabálkové a Daniele Kužílkové za vzájemně se inspirující prostředí.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
MUDr. Ester Mejstříková, Ph.D.
Klinika dětské hematologie a onkologie, CLIP-Cytometrie V úvalu 84, 150 06, Praha 5
tel: 224 436 477
e-mail: Ester.mejstrikova@lfmotol.cuni.cz
Sources
- Cossarizza A, Chang HD, Radbruch A, et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol 2021; 51(12): 2708-3145.
- McCusker C, Upton J, Warrington R. Primary immunodeficiency. Allergy, Asthma Clin Immunol 2018; 14(Suppl 2): 61.
- Korol C, Rossi J, Sanz M, Bernasconi A. NK cells expressing the B cell antigen CD19: Expanding the phenotypical characterization and the potential consequences from misinterpretation of this subset population. Cytom Part B Clin Cytom 2015; 88(6): 358-360.
- Lima M. Laboratory studies for paroxysmal nocturnal hemoglobinuria, with emphasis on flow cytometry. Pract Lab Med 2020; 20: e00158.
- Athni TS, Barmettler S. Hypogammaglobulinemia, late-onset neutropenia, and infections following rituximab. Ann Allergy, Asthma Immunol 2023; 130(6): 699-712.
- Rösel AL, Scheibenbogen C, Schliesser U, et al. Classification of common variable immunodeficiencies using flow cytometry and a memory B-cell functionality assay. J Allergy Clin Immunol 2015; 135(1): 198-208.
- Wentink MWJ, van Zelm MC, van Dongen JJM, Warnatz K, van der Burg M. Deficiencies in the CD19 complex. Clin Immunol 2018; 195 : 82-87.
- Maccari ME, Fuchs S, Kury P, et al. A distinct CD38+CD45RA+ population of CD4+, CD8+, and double-negative T cells is controlled by FAS. J Exp Med 2021; 218(2): e20192191.
- Maccari ME, Schneider P, Smulski CR, et al. Revisiting autoimmune lymphoproliferative syndrome caused by Fas ligand mutations. J Allergy Clin Immunol 2023; 151(5): 1391-1401. e7.
- Bryceson YT, Pende D, Maul-Pavicic A, et al. A prospective evaluation of degranulation assays in the rapid diagnosis of familial hemophagocytic syndromes. Blood 2012; 119(12): 2754-2763.
- Pu Q, Qiao J, Liu Y, et al. Differential diagnosis and identification of prognostic markers for peripheral T-cell lymphoma subtypes based on flow cytometry immunophenotype profiles. Front Immunol 2022; 13 : 1008695.
- Sacco KA, Gazzin A, Notarangelo LD, Delmonte OM. Granulomatous inflammation in inborn errors of immunity. Front Pediatr 2023; 20 : 11 : 1110115.
- Serwas NK, Huemer J, Dieckmann R, et al. CEBPE-Mutant Specific Granule Deficiency Correlates With Aberrant Granule Organization and Substantial Proteome Alterations in Neutrophils. Front Immunol 2018; 9 : 588.
- Fekadu J, Modlich U, Bader P, Bakhtiar S. Understanding the Role of LFA-1 in Leukocyte Adhesion Deficiency Type I (LAD I): Moving towards Inflammation? Int J Mol Sci 2022; 23(7): 3578.
- Hanna S, Etzioni A. Leukocyte adhesion deficiencies. Ann N Y Acad Sci 2012; 1250(1): 50-55.
- Van Dongen JJM, Lhermitte L, Böttcher S, et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia 2012; 26(9): 1908.
- Young NS. Aplastic Anemia. Longo DL, ed. N Engl J Med 2018; 379(17): 1643-1656.
- Zimmermannova O, Zaliova M, Moorman A V., et al. Acute lymphoblastic leukemia with aleukemic prodrome: Preleukemic dynamics and possible mechanisms of immunosurveillance. Haematologica 2017; 102(6): e225-e228.
- Baumann I, Führer M, Behrendt S, et al. Morphological differentiation of severe aplastic anaemia from hypocellular refractory cytopenia of childhood: Reproducibility of histopathological diagnostic criteria. Histopathology 2012; 61(1): 10-17.
- Babushok D V. When does a PNH clone have clinical signifcance? Hematol (United States) 2021; 2021(1): 143-152.
- Wu Y, Liao L, Lin F. The diagnostic protocol for hereditary spherocytosis-2021 update. J Clin Lab Anal 2021; 35(12).
- Dworzak MN, Buldini B, Gaipa G, et al. AIEOP-BFM consensus guidelines 2016 for flow cytometric immunophenotyping of Pediatric acute lymphoblastic leukemia. Cytom Part B Clin Cytom 2018; 94(1): 82-93.
- Hrusak O, De Haas V, Stancikova J, et al. International cooperative study identifies treatment strategy in childhood ambiguous lineage leukemia. Blood 2018; 132(3): 264-276.
- Mejstrikova E, Volejnikova J, Fronkova E, et al. Prognosis of children with mixed phenotype acute leukemia treated on the basis of consistent immunophenotypic criteria. Haematologica 2010; 95(6): 928-935.
- Coustan-Smith E, Mullighan CG, Onciu M, et al. Early T-cell precursor leukaemia: a subtype of very high-risk acute lymphoblastic leukaemia. Lancet Oncol 2009; 10(2): 147-156.
- Inukai T, Kiyokawa N, Campana D, et al. Clinical significance of early T-cell precursor acute lymphoblastic leukaemia: results of the Tokyo Children’s Cancer Study Group Study L99-15. Br J Haematol 2012; 156(3): 358-365.
- Conter V, Valsecchi MG, Buldini B, et al. Early T-cell precursor acute lymphoblastic leukaemia in children treated in AIEOP centres with AIEOP-BFM protocols: a retrospective analysis. Lancet Haematol 2016; 3(2): e80-e86.
- Creutzig U, Van Den Heuvel-Eibrink MM, Gibson B, et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: Recommendations from an international expert panel. Blood 2012; 120(16):3167-3205.
- Sahoo SS, Kozyra EJ, Wlodarski MW. Germline predisposition in myeloid neoplasms: Unique genetic and clinical features of GATA2 deficiency and SAMD9/SAMD9L syndromes. Best Pract Res Clin Haematol 2020; 33(3): 101197.
- Nováková M, Žaliová M, Suková M, et al. Loss of B cells and their precursors is the most constant feature of GATA-2 deficiency in childhood myelodysplastic syndrome. Haematologica 2016; 101(6): 707-716.
- Barosi G, Viarengo G, Pecci A, et al. Diagnostic and clinical relevance of the number of circulating CD34+ cells in myelofibrosis with myeloid metaplasia. Blood 2001; 98(12): 3249-3255.
- Langebrake C, Creutzig U, Dworzak M, et al. Residual disease monitoring in childhood acute myeloid leukemia by multiparameter flow cytometry: The MRD-AML-BFM Study Group. J Clin Oncol 2006; 24(22): 3686-3692.
- Temple WC, Mueller S, Hermiston ML, Burkhardt B. Diagnosis and management of lymphoblastic lymphoma in children, adolescents and young adults. Best Pract Res Clin Haematol 2023; 36(1): 101449.
- Medeiros LJ, Elenitoba-Johnson KSJ. Anaplastic large cell lymphoma. Am J Clin Pathol 2007; 127(5): 707-722.
- Onciu, MD M, Behm, MD FG, Raimondi, PhD SC, et al. ALK-positive anaplastic large cell lymphoma with leukemic peripheral blood involvement is a clinicopathologic entity with an unfavorable prognosis. Report of three cases and review of the literature. Am J Clin Pathol 2003; 120(4): 617-625.
- Bhansali RS, Barta SK. SOHO State of the Art Updates and Next Questions | Challenging Cases in Rare T-Cell Lymphomas. Clin Lymphoma Myeloma Leuk 2023; 23(9): 642-650.
- Martig DS, Fromm JR. A comparison and review of the flow cytometric findings in classic Hodgkin lymphoma, nodular lymphocyte predominant Hodgkin lymphoma, T cell/ histiocyte rich large B cell lymphoma, and primary mediastinal large B cell lymphoma. Cytom Part B Clin Cytom 2022; 102(1): 14-25.
- Minkov M, Pötschger U, Grois N, Gadner H, Dworzak MN. Bone marrow assessment in Langerhans cell histiocytosis. Pediatr Blood Cancer 2007; 49(5): 694-698.
- Teodosio C, Mayado A, Sa´nchez-Mun~oz L, et al. The immunophenotype of mast cells and its utility in the diagnostic work-up of systemic mastocytosis. J Leukoc Biol 2015; 97(1): 49-59.
- Novakova M, Zaliova M, Fiser K, et al. DUX4r, ZNF384r and PAX5-P80R mutated B-cell precursor acute lymphoblastic leukemia frequently undergo monocytic switch. Haematologica 2021; 106(8): 2066-2075.
- Mejstríková E, Hrusak O, Borowitz MJ, et al. CD19-negative relapse of pediatric B-cell precursor acute lymphoblastic leukemia following blinatumomab treatment. Blood Cancer J 2017; 7(12): 659.
- Mo G, Wang HW, Talleur AC, et al. Diagnostic approach to the evaluation of myeloid malignancies following CAR T-cell therapy in B-cell acute lymphoblastic leukemia. J Immunother Cancer 2020; 8(2): e001563.
- Vakrmanová B, Nováková M, Říha P, et al. CD38: A target in relapsed/refractory acute lymphoblastic leukemia—Limitations in treatment and diagnostics. Pediatr Blood Cancer 2022; 69(9): e29779.
- Lhermitte L, Barreau S, Morf D, et al. Automated identification of leukocyte subsets improves standardization of database-guided expert-supervised diagnostic orientation in acute leukemia: a EuroFlow study. Mod Pathol 2021; 34(1): 59-69.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2023 Issue 4-
All articles in this issue
- Lymfom, či nelymfom, toť otázka
- … od svých vrstevníků jsem se lišil při řezání žížal žiletkou - oni příčně, já podélně …
- MONITOR aneb nemělo by vám uniknout, že
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Kompozitní folikulární lymfom a in situ mantle cell neoplázie lymfatické uzliny: identifikace na základě vyšetření průtokovou cytometrií
- Post mortem vyšetření případů náhlé srdeční smrti. Česká zkušenost a možnost zapojení patologů do multidisciplinárního procesu
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

