-
Medical journals
- Career
Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
Authors: Ondřej Souček 1,3; Petra Kašparová 2,3; Vladimíra Řezáčová 1; Jan Krejsek 1,3
Authors‘ workplace: Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové 1; Fingerlandův ústav patologie, Fakultní nemocnice Hradec Králové 2; Lékařská fakulta v Hradci Králové, Univerzita Karlova v Praze 3
Published in: Čes.-slov. Patol., 59, 2023, No. 4, p. 157-167
Category: Reviews Article
Overview
Analýza punktátů kostní dřeně pomocí průtokové cytometrie má zásadní význam pro diagnostiku hematoonkologických onemocnění. Technika poskytuje rychlé určení přítomnosti, liniové příslušnosti a přibližného stádia zralosti patologické populace pomocí analýzy exprese povrchových, cytoplazmatických a jaderných molekul. I přes nesporné výhody má průtoková cytometrie ve svých interpretačních možnostech limity, které však vhodně doplňují další vyšetření, zejména vyšetření morfologické a imunohistochemické. Právě imunohistochemie sdílí s průtokovou cytometrií základní princip detekce patologické populace i skladbu vyšetřovaných molekul. Dále však obě techniky nabízí různé úhly pohledu na daný vzorek a navzájem doplňují diagnosticky hluchá místa. Nezřídkakdy tak až součinnost obou postupů přináší kýžený podrobný obraz o zastoupení a typu patologické populace v kostní dřeni.
Text článku přináší přehled základních postupů při diagnostice hematologických malignit pomocí průtokové cytometrie a zamýšlí se nad přednostmi a slabinami průtokové cytometrie ve vztahu k imunohistochemickému vyšetření.
Klíčová slova:
imunohistochemie – průtoková cytometrie – imunofenotypizace – diagnostika hematologických malignit
Průtoková cytometrie umožňuje určit přítomnost, míru zastoupení, vývojovou linii, stupeň zralosti a v některých případech i klonalitu buněk hematopoetického původu skrze detekci specifických molekul exprimovaných na cytoplazmatické membráně, v cytoplazmě či v jádře buněk. Tento proces, označovaný jako imunofenotypizace, je dnes již zcela nezbytnou součástí diagnostických postupů v imunologii a hematoonkologii. V diagnostice hematoonkologických onemocnění imunofenotypizační vyšetření zpravidla doprovází i vyšetření morfologické, imunohistochemické, genetické, molekulárně-biologické a biochemické. Každý, kdo taková vyšetření indikuje i ten, kdo je provádí a interpretuje, by si měl být vědom předností i slabin daného vyšetření a při utváření diagnózy se pohybovat v jejich mezích. Imunofenotypizační a imunohistochemické vyšetření kostní dřeně se do jisté míry zastupují v oblasti vyšetřovaných molekul, dále nicméně existuje řada odlišností, které za daných okolností činí jednu či druhou metodu vhodnější k posouzení konkrétního stavu či diagnózy. Text článku má za cíl nahlédnout na vzájemné možnosti imunofenotypizačního a imunohistochemického vyšetření vzorků kostní dřeně a přinést přehled základního postupu při diagnostice hematoonkologických onemocnění pomocí průtokové cytometrie.
Průtoková cytometrie versus imunohistochemické vyšetření kostní dřeně
Imunofenotypizační a imunohistochemické vyšetření do nemalé míry sdílí skladbu vyšetřovaných molekul i techniku jejich detekce, která je založena na průkazu daných molekul pomocí značených monoklonálních protilátek. Výhodou na straně průtokové cytometrie je zejména rychlost a šíře vyšetření. Ve statimovém režimu je možné provést kompletní diagnostiku a nahlásit výsledek vyšetření ošetřujícímu lékaři do tří hodin po obdržení vzorku. Další výhodnou vlastností průtokové cytometrie je možnost vyšetření více membránových (i nitrobuněčných) molekul současně v jedné zkumavce (oproti jednomu vyšetřenému znaku na sklíčko u imunohistochemie) a schopnost vyšetřit velké množství buněk (řádově statisíce až jednotky milionů) během velmi krátké chvíle. S tím se pojí i možnost zachytit velmi drobné patologické nálezy, jejichž zastoupení tvoří i pouze setinu či tisícinu z celkového množství analyzovaných buněk. Co průtoková cytometrie oproti imunohistochemickému vyšetření nabídnout nemůže, je velmi komplexní pohled na danou tkáň i v kontextu buněk nehematopoetického původu a mezibuněčné hmoty, míry vaskularizace, fibrotizace, hyperplazie a dalších patofyziologických jevů. Pomocí průtokové cytometrie tedy nelze odhalit, zda je populace v kostní dřeni rozložena fokálně či difuzně, zda se nachází pouze při kostních trámcích atd. a rovněž nelze objektivně posoudit celkovou buněčnost kostní dřeně. Vzorek kostní dřeně odebraný pro imunofenotypizační vyšetření může obsahovat vyšší podíl krve, což výsledný obraz zkresluje. Příprava vzorku pro imunofenotypizační vyšetření navíc zahrnuje proces značení monoklonálními protilátkami, odstranění erytrocytů lýzou a centrifugaci, případně penetraci buněčných membrán a značení molekulárních cílů v cytoplazmě buněk. Tyto procesy mohou mít destruktivní účinek na citlivé buněčné populace (jako jsou např. plazmatické buňky nebo buňky nehematopoetického původu) či ovlivnit jejich množství. Destrukci mohou navíc citlivé elementy podléhat i při samotném měření na průtokovém cytometru. Problémem pro průtokovou cytometrii je suchý punktát, kdy se do suspenze uvolní malý počet buněk například právě z důvodu fibrotizace kostní dřeně, která je naopak dobře patrná při histologickém vyšetření. Typicky komplikovaná je tak pro průtokovou cytometrii z tohoto důvodu například diagnóza mastocytózy, kdy je při aspiraci kostní dřeně získán zpravidla jen hypocelulární punktát. Patologické mastocyty jsou však při histologickém vyšetření nepřehlédnutelné.
Kromě detekce fluorescenčního signálu ze značených monoklonálních protilátek lze detekovat pomocí průtokové cytometrie na základě rozptylu světla i základní morfologické kvality buněk – jejich velikost (parametr v cytometrii označovaný jako „forward scatter“; FSc) a strukturu cytoplazmy (side scatter; SSc). Na grafu, jenž znázorňuje buňky dle těchto vlastností, scattergramu (obr. 1), tak lze u fyziologických vzorků zpravidla rozlišit mezi malými a vnitřně homogenními lymfocyty, většími monocyty s větším objemem cytoplazmy a velkými granulárními neutrofily. Analýza těchto parametrů může dále pomoci rozlišit i zjevné morfologické abnormality, jako např. velké granulární buňky velkobuněčného či Burkittova lymfomu vs. fyziologické malé B lymfocyty, objemné plazmatické buňky vs. plazmablasty lymfocytárního charakteru, promyelocyty vs. myeloidní blasty, živé vs. mrtvé granulocyty, normální vs. dysplastické granulocyty či monocyty atd. (obr. 2). Jedná se však stále o parametry spíše pomocného charakteru, jejichž hodnocení nemůže nahradit morfologickou analýzu zkušeného specialisty patologa či hematologa. Slabou stránkou průtokové cytometrie je omezené časové rozmezí, kdy je možné se vzorkem pracovat. Naměřená data zůstávají, ovšem nativní vzorek podléhá rychlé degradaci a po několika dnech od odběru jsou již případné výsledky imunofenotypizačního vyšetření zavádějící vzhledem k probíhající apoptóze spojené s autofluorescencí a se změnami v morfologii buněk. Fixovaný materiál připravený k imunohistochemickému vyšetření je naopak možné využít opakovaně a nespornou výhodou je i možnost zaslat fixované a obarvené preparáty do jiné laboratoře ke druhému čtení. Cytometrická data je bezpochyby rovněž možné zaslat ke druhému čtení na spřátelené pracoviště, ale vzájemné porovnání je komplikované, neboť má každá laboratoř specifické nastavení přístrojů a byť používá k analýze obdobnou skladbu molekul, jsou diagnostické protilátky proti těmto molekulám často konjugovány s jinými typy fluorochromů a pochází od různých výrobců. Analytická zkušenost je tedy značně individuální. Otázka většího vzájemného sladění vyšetřovacích postupů a protokolů je tak často cytometrickou komunitou na odborných akcích diskutována. Významnou schopností imunohistochemické techniky je rovněž stanovení virových antigenů, jako jsou LMP, EBNA-2, EBER či HHV8, jejichž pozitivita souvisí s určitými klinickými jednotkami.
S ohledem na vše výše zmíněné je však nutné zdůraznit, že i přes všechny rozdíly a podobnosti spolu průtoková cytometrie a imunohistochemie jako metody nesoupeří, ale naopak se mnohdy vzájemně doplňují a nahrazují nedostatky jedné či druhé techniky.
Image 1. Normální nález na scattergramu – lymfocyty (červeně), monocyty (modře), granulocyty (černě). 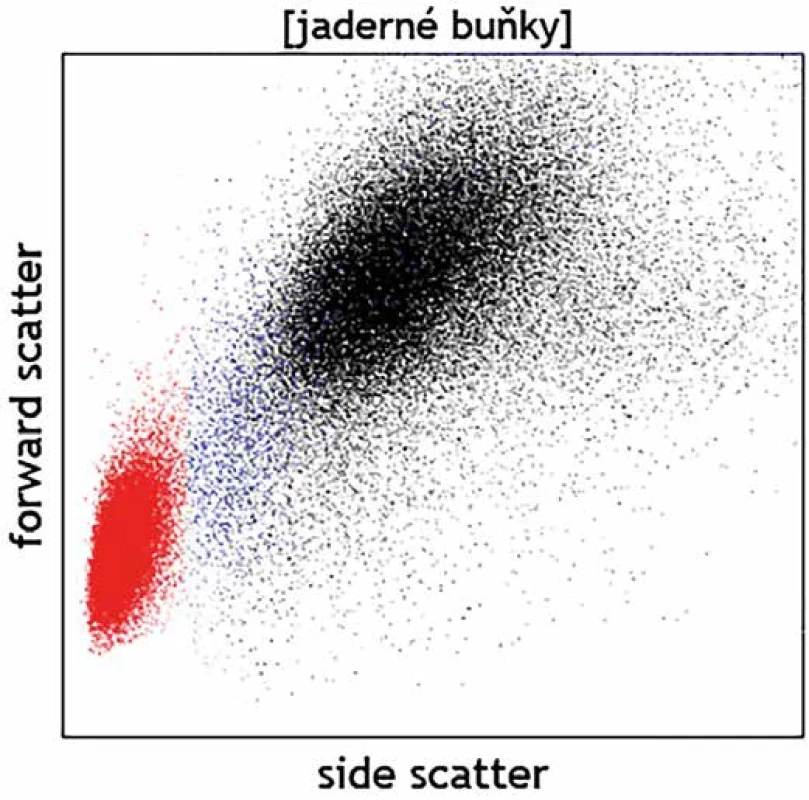
Image 2. Morfologické abnormality patrné při porovnání s fyziologickými lymfocyty (červeně) u buněk (A) DLBCL (zeleně), (B) u zmnožené a morfologicky abnormální populace erytroidních prekurzorů (růžově) a (C) u patologické populace buněk neuroendokrinního nádoru (fialově). 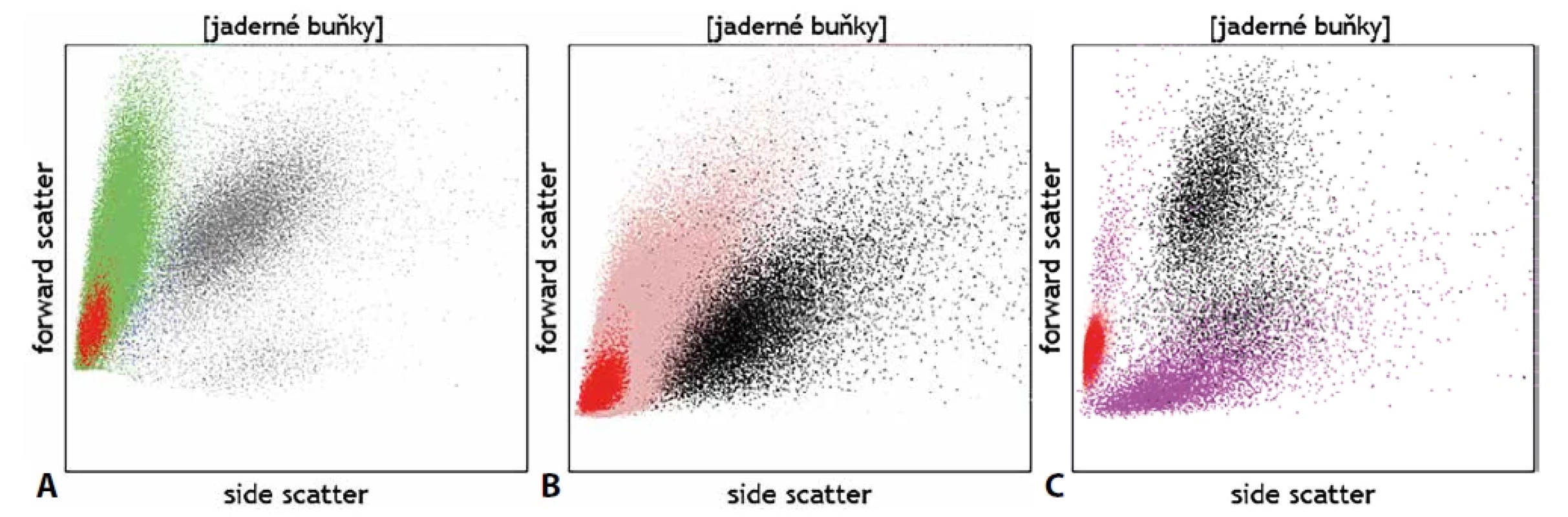
Diagnostika akutních leukémií
Diagnostika akutních leukémií (AL) pomocí průtokové cytometrie se opírá zejména o současné vyšetření znaků (ne)zralosti (CD34, CD38, CD45, CD117, TdT, HLA-DR) a liniově-specifických znaků (myeloperoxidáza, CD3, CD19, CD22, CD79a). Jelikož se jedná o buňky na nízkém stupni zralosti, je vyšetření liniověspecifických znaků nutné provést v cytoplazmě buněk, nikoliv pouze na jejich povrchu. Po stanovení relativního počtu blastů a jejich liniovém zařazení (AML, B-ALL, T-ALL) následuje stanovení dalších znaků typických pro buňky dané vývojové linie pro konkrétnější diagnostiku, detekce potenciálních cílů terapeutických monoklonálních protilátek a stanovení aberantní exprese molekul, které mohou být v budoucnu využity pro stanovení minimální residuální nemoci (MRN), tedy tzv. s leukémií asociovaného imunofenotypu (LAIP). Vhodné je i vyšetření molekul, jejichž exprese souvisí s prognózou choroby či s typickou mutací, jako je exprese molekuly CD25 na myeloidních blastech či exprese znaků NG2, CRLF2, CD25 a CD66c na buňkách B-ALL. V případě nálezu myeloidních blastů je vhodné doplnit výsledky z vyšetření molekul, jejichž exprese souvisí s raritními typy AML (megakaryocytární znaky, molekuly typické pro buňky červené řady, molekuly spjaté s vývojem bazofilních či eosinofilních granulocytů). U lymfoblastických leukémií je dále vhodné doplnit vyšetření o molekuly, jejichž exprese či absence zařazuje danou populaci do klasifikačního systému definovaného Evropskou skupinou pro imunofenotypizaci leukémií (EGIL) pro lepší zacílení terapie a přesnější odhad prognózy (obr. 3). Zcela specifický imunofenotypový obraz je nalézán u buněk akutní promyelocytární leukémie. Jelikož se jedná o klonální promyelocyty, jejich zobrazení na scattergramu spadá do oblasti granulocytů a nikoliv do oblasti, kde se běžně vyskytují myeloidní prekurzory, což může snadno vést i k jejich přehlédnutí. Fenotypový profil spočívá v expresi znaků odrážejících promyelocytární diferenciaci buněk, typická je silná povrchová exprese molekuly CD33 a cytoplazmatická exprese myeloperoxidázy, heterogenní exprese znaků CD13, CD15 a CD117, absence exprese CD34 a HLA-DR. Častá je i pozitivita CD64, exprese CD2 souvisí s FLT3-ITD mutací, pozitivita CD56 je spojena s horší prognózou choroby.
Raritní nálezy leukémií se smíšeným fenotypem se vyznačují současnou expresí molekul typických pro dvě vývojové linie. Jelikož je zcela běžná aberantní koexprese lymfocytárních molekul na buňkách výlučně myeloblastické leukémie a naopak, byla zavedena klasifikační kritéria pro zařazení patologických elementů do vývojové linie dle zjištěného fenotypu. Kritéria dle EGIL i dle WHO se shodují na zařazení blastů do myeloidní linie při cytoplazmatickém průkazu myeloperoxidázy, pro určení T-lymfocytárního původu je u patologické populace nutný průkaz silné exprese molekuly CD3 v cytoplazmě buněk. Pro zařazení blastů do B-lymfocytární linie je nutné, aby expresi znaku CD19 doprovázela i exprese znaku CD79a, CD10 či cytoplazmatická exprese molekul CD22 nebo IgM, přičemž konfirmace pomocí minimálně dvou z uvedených molekul je důležitá zejména při pouze slabé pozitivitě znaku CD19 na blastické populaci. Kromě detekce patologické populace má imunofenotypizační vyšetření přínos i při již zmíněné detekci exprese molekul, které mohou být na patologických buňkách terčem cílené imunoterapie monoklonálními protilátkami. Jedná se zejména o stanovení exprese molekul CD19, CD20 a CD22 na blastech B-lymfocytárního původu a zhodnocení exprese znaku CD33 na myeloidních blastech.
Aby bylo možné posoudit MRN v kostní dřeni po prodělané léčbě, je vhodné definovat na patologické populaci LAIP, tedy specifický, unikátní molekulární profil patologické populace, po kterém je následně pátráno při kontrolním vyšetření. Při detekci LAIPu se využívá faktu, že geneticky aberantní populace vykazuje expresi nejen liniově-specifických molekul, ale i molekul, jejichž exprese je typická pro buňky jiných vývojových linií. Proto kombinace protilátek pro diagnostiku B-ALL zahrnují nejen detekci znaků nezralosti a liniově-specifických znaků buněk B-linie, ale také znaky typické pro buňky myeloidní linie, o nichž je známo, že mohou být na patologické populaci aberantně exprimovány. Při diagnostice AML jsou pak do protilátkového panelu z tohoto důvodu zařazeny i molekuly typické pro buňky lymfocytárního původu (častá je např. exprese znaků CD7 či CD56). U buněk AML je však často detekován fenotyp chudý na aberantní koexprese, což komplikujestanovení dostatečně silného LAIPu a následné spolehlivé zhodnocení hladiny MRN.
V diagnostice AL má imunohistochemie obdobné portfolio vyšetřovaných molekul. Oproti průtokové cytometrii doplňuje i molekulu PAX5 pro detekci B-lymfocytárního původu. Výhodné je i spolehlivé stanovení jaderného enzymu TdT, který je možné stanovit i pomocí průtokové cytometrie. Značení molekuly lokalizované v buněčném jádře je však z pohledu průtokové cytometrie komplikovanější a exprese nemusí vykazovat kýženou sílu. Nespornou výhodou histopatologického vyšetření je celkový morfologický přehled stavu kostní dřeně včetně vyšetření populací, které je možné z hlediska průtokové cytometrie hodnotit pouze omezeně, případně vůbec. Jedná se zejména o buňky červené řady, megakaryocyty, histiocyty, zastoupení adipocytů či o dřeňové infiltráty buněk metastazujících solidních nádorů, které lze cytometricky jen nespecificky popsat, pokud jsou vůbec detekovány. Histologie kostní dřeně je však v diagnostice AL spíše méně využívána pro dostatečnou informační hodnotu ostatních metod, nezbytná je však v situacích, kdy není možné odebrat reprezentativní aspirát (1–8).
Diagnostika lymfoproliferativních onemocnění z B-linie
Diagnostika lymfoproliferativních onemocnění z B-linie (B-LPD) se v rámci průtokové cytometrie opírá o stanovení klonality zralých B lymfocytů, která je určena analýzou povrchové exprese lehkých řetězců κ a λ. Po záchytu klonu B lymfocytů (který se projeví klonální restrikcí jednoho typu lehkého řetězce) následuje vyšetření dalšího panelu molekul, aby bylo možné klon co nejlépe fenotypově popsat. Významné je v tomto ohledu i posouzení morfologických vlastností buněk, tedy relativní velikosti buněk a míry granularity cytoplazmy. Jednotlivé typy B-LPD mají více či méně specifický fenotypový profil. Po stanovení klonálního původu spočívá další fenotypová charakterizace daného klonu v posouzení exprese molekul CD5 a CD10, což může pomoci v základním rozdělení B-LPD do podskupin dle exprese těchto molekul, a následně v posouzení exprese řady molekul, které více či méně specificky odráží konkrétní diagnózu. Buňky chronické lymfocytické leukémie (CLL) a vlasatobuněčné leukémie (HCL) mají specifický imunofenotypový profil, buňky folikulárního lymfomu (FL), Burkittova lymfomu (BL), lymfomu z plášťové zóny (MCL) a variantní formy vlasatobuněčné leukémie (vHCL) vykazují jisté typické fenotypové charakteristiky, pro které je možné vyjádřit suspekci. K ustálenému a chronicky známému fenotypu CLL, který zahrnuje pozitivitu znaků CD5, CD23, CD43 a CD200, slabou expresi či negativitu molekul CD20, CD22, CD79b a povrchových imunoglobulinů a negativitu znaků CD10, CD81 a FMC7 přibyl v posledních letech i enzym ROR1, který je na buňkách CLL pozitivní. Fenotypový profil je dobré doplnit o stanovení molekul CD38 a CD49d, jejichž exprese svědčí o horší prognóze choroby. Buňky HCL vykazují rovněž charakteristický fenotypový profil (CD11c+, CD20++, CD22++, CD24-, CD25+, CD71+, CD103+, CD123+, CD200+), je možné se setkat s méně častou pozitivitou znaku CD10. Fenotypový obraz doplňuje atypická morfologie buněk (jež se projevuje tím, že se klonální lymfocyty nachází i mimo standardní lymfocytární oblast) a minimum detekovaných monocytů ve vzorku. Definitivně diagnózu určí detekce BRAF V600E mutace. Buňky FL často exprimují základní panB-lymfocytární znak CD19 velmi slabě, takže bývá vhodnější buňky identifikovat pomocí molekuly CD20. Typická je i exprese znaku CD10, která však na klonální populaci může být slabá nebo pouze částečná. Buňky BL vykazují zpravidla výrazné morfologické abnormality a sníženou expresi znaku CD45, dále silnou pozitivitu znaku CD10 a povrchového imunoglobulinu IgM. Buňky FL od BL by měly být cytometricky rozeznatelné skrze cytoplazmatickou expresi proteinu Bcl2, imunohistochemie doplňuje i znaky Bcl6 a MYC a další. Populace MCL se často jeví jako klonální populace CD5+ B lymfocytů se silnou expresí znaku CD20, pomáhá i negativita znaku CD200 (pozitivita exprese CD200 však dg. MCL zcela nevylučuje). Rozhodující roli má však imunohistochemické stanovení cyklinu D1. Variantní forma HCL sdílí s klasickou HCL některé fenotypové rysy jako je exprese znaků CD11c či CD103, odlišuje se však zpravidla v absenci exprese molekul CD25, CD123 a CD200, rozdíl může být patrný i v pozitivitě znaku CD27 a v přítomnosti monocytů. Nově by nicméně tato klinická jednotka měla být v angličtině označována jako „splenic B-cell lymphoma/leukemia with prominent nucleoli“ (SBLPN, česky jako: splenický B-lymfom/leukémie s prominujícími jadérky) vzhledem ke vzájemně nesousvisejícím biologickým základům této choroby s dg. HCL. U pacientů s lymfoplazmocytárním lymfomem je typický současný nález klonálních B lymfocytů a klonálních plazmatických buněk se stejným typem výlučně exprimovaného lehkého řetězce. Klonální plazmocyty přitom často nevykazují výrazné fenotypové abnormality, na klonálních B lymfocytech může být naopak patrná překvapivá pozitivita myeloidního znaku CD13. Buňky lymfomů z marginální zóny (MZL), prolymfocytární leukémie (PLL) a velkobuněčného difuzního lymfomu (DLBCL) nevykazují specifické fenotypové rysy, detekována je zpravidla pouze exprese základních B-lymfocytárních znaků, na buňkách MZL může být patrná pozitivita znaku CD5. Klinická jednotka PLL by navíc měla být dle pátého vydání WHO klasifikace lymfoidních neoplázií zrušena a buňky dříve takto označované by měly být zařazeny pod dg. MCL, prolymfocytární progresi CLL či jako SBLPN. Pro odlišení fenotypově nespecifického difuzního splenického lymfomu červené pulpy (SDRPL) od buněk HCL, SBLPN a splenického MZL se jeví jako nadějné stanovení poměru exprese znaků CD200 / CD180, klíčové je však přirozeně histologické vyšetření bioptátu sleziny. Spolu se zmíněnými molekulami CD200 a CD180 bylo navrhnuto k rozlišení mezi populacemi CLL, LPL, MCL a MZL zařadit i stanovení exprese molekuly CD148. U buněk DLBCL lze většinou pozorovat abnormální morfologii buněk, v případě klinického požadavku na vyloučení Richterovy transformace může být právě změna morfologie klonálních B lymfocytů vodítkem k vyjádření podezření na danou transformaci, neboť CLL fenotyp se nemusí při transformaci výrazně změnit.Pro účely lepšího a specifičtějšího rozlišení mezi jednotlivými typy B-LPD byla testována i řada dalších molekul jako např. molekuly z rodiny integrinů a jejich ligandů, molekuly CD31, CD39, CD44, CD71 nebo CD81. I přes řadu slibných nálezů však zatím není široce rozšířené rutinní vyšetřování těchto znaků pro jejich nedostatečnou diagnostickou sílu.
Častým náhodným nálezem zjištěným zejména u starších pacientů, jejichž cytometrické vyšetření bylo indikováno mnohdy ze zcela jiných důvodů než pro suspekci na B-LPD, je nález malého klonu B lymfocytů v řádech desetin či setin procent ze všech analyzovaných buněk. Takový nález může zpravidla svědčit pro tzv. benigní monoklonální lymfocytózu (MBL), pro kterou platí, že u pacienta by v době nálezu neměly být přítomny jiné klinické známky B-LPD. Jedná se o běžný nález, jehož incidence stoupá s věkem vyšetřovaných osob. Buňky MBL často vykazují typický CLL fenotyp, ovšem není to podmínkou. Právě podle fenotypového profilu a absolutního počtu se v rámci MBL rozlišuje low-count MBL s CLL fenotypem a zastoupením klonální populace pod 0,5 x 109 / l, CLL/SLL typ MBL, kdy se absolutní počet klonálních buněk pohybuje pod 0,5 x 109 / l a celkový počet B lymfocytů do 5 x 109 / l, a nonCLL/SLL typ MBL s klonálními B lymfocyty nespecifického fenotypu. Vzhledem k tomu, že původně benigní nález může dále progredovat, či se může jednat o minimální maligní infiltraci B-LPD (specialista na průtokovou cytometrii zpravidla nemá k dispozici detailní informace o klinickém stavu pacienta a nemůže takovou situaci ze svého pohledu vyloučit) je vhodné k výsledku vyšetření doplnit citlivý komentář a doporučit sledování vývoje nálezu v čase.
Podobně jako po léčbě akutních leukémií či mnohočetného myelomu může průtoková cytometrie nabídnout vyšetření MRN. To se u většiny B-LPD omezuje na prostou detekci B lymfocytů (častá je kompletní deplece B lymfocytů po léčbě) a případné posouzení jejich klonality. Odlišná situace je v případě HCL a zejména CLL, kde patologická populace vykazuje specifický fenotyp a protilátkový panel se v těchto případech zaměřuje na konkrétní molekulární cíle. Skladbu takového protilátkového panelu pro vyšetření MRN u CLL se snaží mezi cytometrickými laboratořemi harmonizovat Evropská výzkumná iniciativa pro CLL (ERIC), samozřejmá je snaha o vyšetření co největšího množství buněk a tak o dosažení co nejcitlivější detekce (obr. 4).
Z pohledu imunohistochemie může být komplikované stanovení klonality B lymfocytů vzhledem k vysokému fluorescenčnímu pozadí, jinak má však mnoho nástrojů, jak zpřesnit často poněkud vágní diagnostiku B-LPD z průtokového cytometru. Byť je řada molekulárních cílů identická (CD5, CD10, CD20, CD22, CD23, CD43, CD45, CD79a) doplňuje imunohistochemie řadu dalších markerů, zejména jaderných, jejichž průkaz pomocí průtokové cytometrie je komplikovaný nebo přímo nedostupný. Jedná se zejména o molekuly Bcl6, Annexin-A1, DBA.44, MUM-1, MYC, cyklin D1, BOB1, PAX5, EBER-ISH, GCET1, FOXP1, TRAP či LMO2 a další. Skrze expresi Ki-67 je možné stanovit proliferační aktivitu patologické populace a i když je vyšetření tohoto markeru možné i pomocí průtokové cytometrie, jedná se o poměrně komplikovanou laboratorní proceduru. Cytometrické vyšetření již zmíněného proteinu Bcl2 je rovněž možné, ovšem stejně jako v již uvedeném případu s TdT se jedná o nitrobuněčně lokalizovaný protein, kdy musí protilátka při značení pro potřeby průtokové cytometrie překonat fosfolipidovou membránu a vyšetření nemusí vždy přinést uspokojivě přesvědčivé výsledky. Informačně významné je i histologické posouzení distribuce nádorového infiltrátu. Ve spojení s komplexnější morfologickou analýzou tak často přináší imunohistochemie konkrétnější informace stran diagnózy a prognózy u pacientů s B-LPD (9–21).
Image 3. Typický fenotypový nález u pacienta se záchytem akutní B-lymfoblastické leukémie (fialově); exprese (A) CD19, (B) CD34, (C) CD10 a (D) negativita CD20; zeleně – fyziologické zralé B lymfocyty. 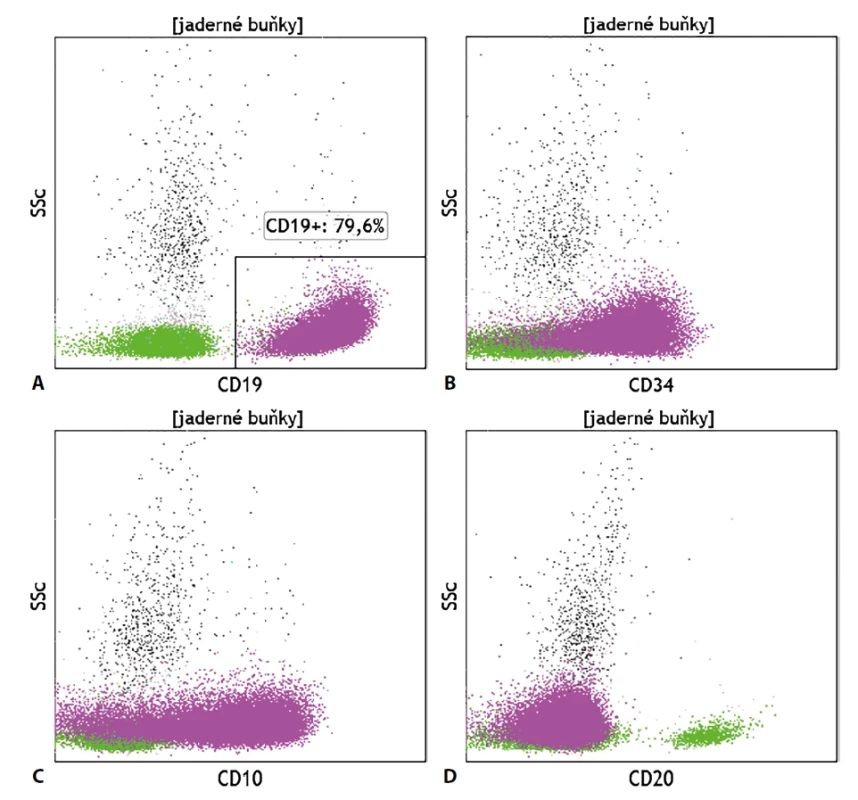
Image 4. Současný nález reziduálních CLL buněk (červeně) a fyziologických B lymfocytů (zeleně); rozdílná exprese znaků (A) CD5 a CD20, (B) negativita znaků CD79b a CD81 na CLL populaci, (C) exprese molekul CD43 a ROR1 na CLL buňkách. 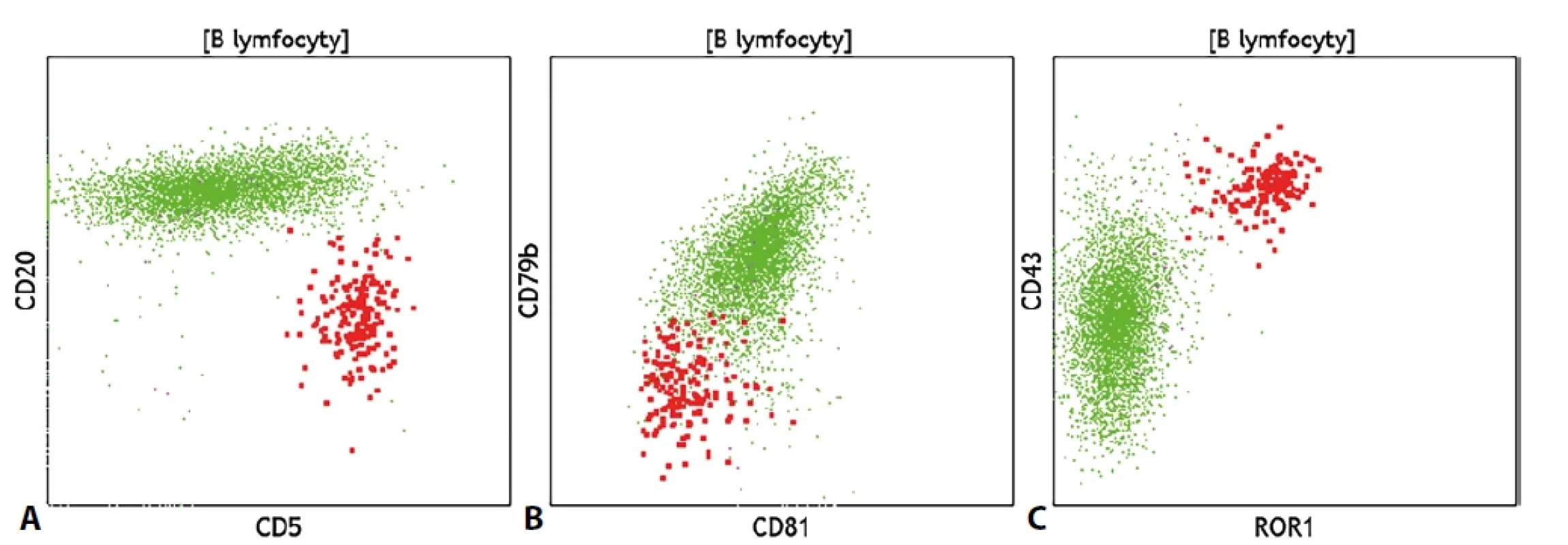
Diagnostika lymfoproliferativních onemocnění z T-linie
V případě posouzení normality T lymfocytů byli cytometristé dlouho odkázáni pouze na stanovení abnormalit v morfologii, v počtu buněk, v poměru CD4+ pomocných a CD8+ cytotoxických T lymfocytů a zejména na abnormality fenotypové, které nejčastěji představuje ztráta či naopak zesílená exprese některé z tzv. panT-lymfocytárních molekul (CD2, CD3, CD5, CD7). K základní fenotypové analýze patří bezesporu i stanovení αβ či γδ typu exprimovaného T-lymfocytárního receptoru (TCR). Fenotypový profil je vhodné doplnit i o detekci izoforem enzymu CD45-RA či RO a případně i o detekci exprese molekul CD27, CD62L či CCR7, pomocí nichž je možné určit naivní či paměťový charakter zralých T lymfocytů. V základní protilátkové výbavě cytometrické laboratoře je dobré mít i znak CD1a pro vyloučení kortikální T-ALL. Podobně jako u jiných patologických populací mohou i klonální T lymfocyty na svém povrchu exprimovat molekuly, které nesouvisí s jejich aktuální vývojovou fází či vývojovou linií a tím na sebe upozornit. Jedná se např. o molekuly CD10, CD13, CD15 nebo CD33.
I kvůli nižší frekvenci výskytu těchto chorob a jejich menší tendenci infiltrovat kostní dřeň a periferní krev je obecně cytometrická zkušenost s diagnostikou T-lymfoproliferativních onemocnění (T-LPD) menší. Stanovení diagnózy by mělo začínat detekcí exprese znaku CD3 (povrchově či cytoplazmaticky v případě absence povrchové exprese) a dále v určení exprese koreceptorů CD4 či CD8, což umožní zpřesnit diagnostickou rozvahu, běžná je však i jejich současná exprese či naopak absence obou typů. V cytometrické laboratoři zaměřené na vyšetření hematoonkologických malignit je běžnější setkat se s diagnózou leukémie z velkých granulárních T lymfocytů (T-LGL), která se projevuje současnou expresí T-lymfocytárních znaků a znaků typických pro NK buňky (CD16, CD56, CD57) na suspektní populaci. Exprese koreceptorů CD4 a CD8 je variabilní, nejčastější je však nález CD4-/CD8+ forem, existují i vzácné formy γδ TCR+ T-LGL či NK-LGL. Pro buňky Sézaryho syndromu je typická ztráta exprese znaku CD26, exprese znaku CD30 může pomoci v diagnostice anaplastického lymfomu (ALCL). Suspekce na angioimunoblastický lymfom může být vyjádřena při současném nálezu abnormální CD4+ T-lymfocytární populace doprovázené eosinofilií a expanzí polyklonálních plazmatických buněk. Znak CD103, který je používán pro detekci intraepiteliálních T lymfocytů, je vhodné mít k dispozici pro diagnostiku lymfomů asociovaných s enteropatií, kde by měla být vždy posouzena zároveň povrchová i cytoplazmatická exprese znaku CD3. Vzhledem k povaze diagnózy je však vhodné takovou diagnostiku provádět především ze střevního bioptátu. Buňky prolymfocytární leukémie mohou vykazovat rovněž různou expresi koreceptorů, z důvodu konkrétní genové mutace však exprimují specifický, cytometricky detekovatelný nádorový marker TCL1.
Novinkou v cytometrické diagnostice T-LPD je monoklonální protilátka proti konstantní oblasti β řetězce 1 většinového αβ TCR. Pro konstantní oblast řetězce existují dva genové segmenty C1 (TRBC1) a C2 (TRBC2) a oba mohou být se stejnou pravděpodobností využity pro tvorbu TCR, přičemž využití jednoho segmentu vylučuje využití druhého a naopak. Ve fyziologické polyklonální populaci T lymfocytů by pak měly být stejnou měrou zastoupeny T lymfocyty TRBC1+ a TRBC1(tedy využívající genový segment C2 pro konstrukci svého TCR). Monoklonální protilátka proti TRBC1 tak umožnila nově posuzovat klonalitu T lymfocytů podobně jako při hodnocení exprese lehkých řetězců κ a λ na B lymfocytech. Obzvláštně přesvědčivý je pak nález klonální populace T lymfocytů, která zároveň vykazuje i fenotypové či morfologické abnormality (obrázek č. 5). Rutinní zavedení tohoto znaku do provozu cytomerických laboratoří nicméně vedlo k častému nálezu početně malých, avšak jednoznačných populací klonálních T lymfocytů, jejichž klinický význam je nejasný. Pro tyto drobné klony byl zaveden termín T-lymfocytární klon nejasného významu (T-CUS).
Imunohistochemické vyšetření se opět s průtokovou cytometrií vzájemně doplňuje a nabízí navrch vyšetření přítomnosti molekul specifických pro cytotoxická granula (TIA-1, perforin, či granzym B), které je pro průtokovou cytometrii komplikované. Detekce kostimulační molekuly CD278 (ICOS) pomáhá při průkazu folikulárních pomocných T lymfocytů, spolu s průtokovou cytometrií je možné stanovení regulační molekuly PD-1. Zcela nezbytné je vyšetření ALK a CD30 pro diagnostiku ALCL. Diagnostika periferního T-lymfocytárního lymfomu může být doplněna o průkaz transkripčních faktorů GATA3 a TBX21, možné je i stanovení chemokinových receptorů (CCR4 či CXCR3), které není z hlediska průtokové cytometrie nemožné, nicméně je obtížné. Doplňující informace představuje analýza vzhledu buněk a dalších okolností, jako způsob infiltrace, míra fibrotizace a vaskularizace dřeně, detekce hemofagocytózy či zvýšená infiltrace eosinofily, makrofágy nebo plazmocyty (9,22–24).
Diagnostika monoklonálních gamapatií
Ačkoliv má průtoková cytometrie značný přínos v diagnostice všech hematoonkologických onemocnění, zejména v oblasti monoklonálních gamapatií může nabídnout ještě mnohem více než prostou detekci a kvantifikaci patologické populace. Podobně jako v případě B-LPD je cytometrie schopna určit zastoupení, fenotyp a klonalitu plazmatických buněk (PC). Klonální původ buněk je stanoven opět pomocí exprese lehkých řetězců imunoglobulinů (obr. 6). V případě PC však musí být jejich exprese stanovena v cytoplazmě buněk a nikoliv povrchově. Základními CD znaky pro detekci PC jsou molekuly CD45, CD38 a CD138, znaky CD19, CD27 a CD56 jsou využívány pro základní fenotypovou analýzu buněk, přičemž fenotyp CD19+, CD27+, CD38++, CD56-, CD138+ se považuje za fyziologický. Zejména pro monoklonální gamapatie nejasného významu je typický výskyt více fenotypově odlišných populací PC, přičemž klonální charakter obvykle vykazují jen některé. Aby nedošlo k přehlédnutí klonální populace na polyklonálním pozadí je proto vždy nutné posuzovat klonalitu pro každou fenotypově odlišnou populaci odděleně. Analýze klonality tak musí předcházet analýza fenotypu. Řada dalších molekul, jako je CD20, CD28, CD44, CD81, CD117 či CD200, pak slouží k podrobnější fenotypové analýze a posouzení stupně zralosti PC. Exprese či absence některých z uvedených molekul mají rovněž vztah k prognóze choroby. U PC se také běžně můžeme setkat s expresí již zmíněného znaku CD117, který přirozeně exprimují nezralé elementy myeloidního původu, či s expresí znaku CD33 typického pro myeloidní buňky všech fází zralosti. Při nejasném či neznámém klinickém zadání tak může být patologický nález buněk CD117+/CD33+ zjištěný při vyšetření panelu myeloidních molekul mylně považován za nález myeloidních blastů. Znak CD38, jeden z klíčových znaků pro detekci PC, se stal cílem monoklonálních terapeutických protilátek, které se etablovaly jako účinný nástroj v léčbě mnohočetného myelomu (MM). Zavedení této terapie nicméně zkomplikovalo detekci PC průtokovou cytometrií, která se o stanovení exprese CD38 opírá a potřebuje tuto molekulu volnou pro detekční diagnostickou protilátku. Na tuto situaci však bezprostředně zareagovali výrobci reagencií vývojem diagnostické směsi protilátek, které se váží se na různé epitopy molekuly CD38 a umožňují tak její detekci i přes obsazení monoklonální protilátkou terapeutickou. Použití multiepitopové protilátkové směsi anti-CD38 je tak dnes již zcela nezbytné zejména při hodnocení MRN. Obdobná situace, kdy je molekulární cíl nezbytný po detekci cílové populace obsazen terapeutickou protilátkou, již komplikuje cytometrickou detekci B lymfocytů (anti-CD19, anti-CD20, anti-CD22 terapie) a bude jistě i dále v budoucnu ovlivňovat a měnit postupy cytometrické analýzy v dalších oblastech hematoonkologické diagnostiky.
Image 5. (A) Nález fenotypově atypické klonální populace T lymfocytů se ztrátou exprese znaku CD5 (oranžově), (B) se slabou expresí znaku CD8 a (C) s výlučnou expresí znaku TRBC1 na celé populaci oproti normální distribuci tohoto znaku na fenotypově normálních CD4+ pomocných T lymfocytech (červeně) a CD8+ cytotoxických T lymfocytech (modře). 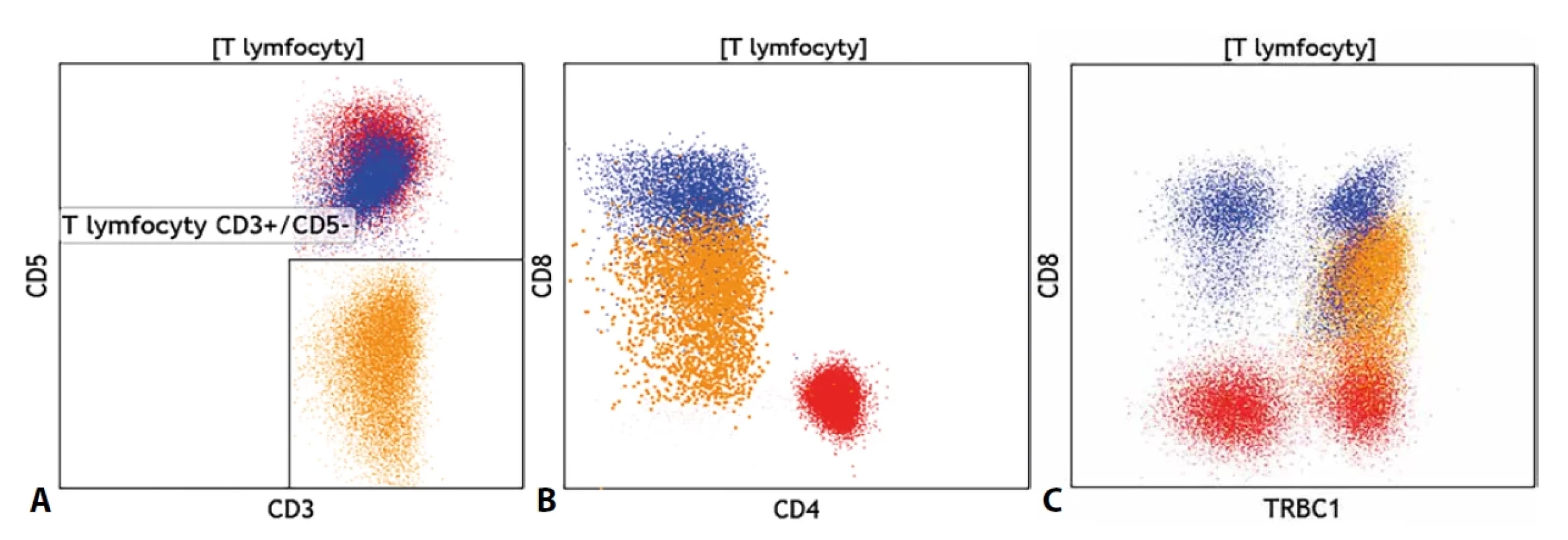
Během léčby MM je průtoková cytometrie rovněž velmi významná pro stanovení MRN a nově i pro detekci cirkulujících nádorových PC v periferní krvi (CTCs). Oba tyto klinické ukazatele dobře informují o úspěšnosti léčby a korelují s dobou přežití do progrese choroby a s celkovým přežitím a budou tak mít velmi pravděpodobně značný vliv na posouzení rizikovosti choroby u konkrétního pacienta a na případnou eskalaci či deeskalaci léčby. Možná je i diagnostika plazmocelulární leukémie, kdy klonální plazmocyty infiltrují periferní krev. Právě v diagnostice této choroby jsou nyní upravována diagnostická kritéria, kdy byla hranice z původních 20 % klonálních PC v periferní krvi snížena v roce 2021 na 5 % a nově je díky aktuálním poznatkům zvažována hranice 2 %, jelikož klinická závažnost je identická i při této hodnotě. Pro sporná diagnostická kritéria i mezery v porozumění etiopatogeneze této choroby Česká myelomová skupina od roku 2023 však nedoporučuje diagnózu plazmocelulární leukémie užívat a hledět na takový nález jako na MM s infiltrací periferní krve klonálními PC. Nově potvrzeným silným prognostickým faktorem je také stanovení tzv. MM-like či MGUS-like fenotypu u MM v závislosti na celkovém počtu PC v kostní dřeni a vzájemném poměru klonálních a polyklonálních PC v rámci těchto PC.
Histopatologické vyšetření nachází v kostní dřeni u pacientů s MM morfologicky abnormální PC, častá je redukovaná hematopoéza, přítomná osteolýza, může být patrná depozice amyloidu. Základními znaky pro detekci PC jsou opět molekuly CD38 a CD138 stejně jako v případě průtokové cytometrie, případně stanovení VS38c. Možné je i stanovení cytoplazmatické exprese lehkých řetězců κ a λ a dalších molekul jako CD20, CD56, CD79a, MUM-1, cyklinu D1 či Ki-67 coby markeru proliferace (25–29).
Diagnostika myelodysplastického syndromu
Posouzení myelodysplastického syndromu (MDS) tkví z pohledu cytometrie zejména v posouzení počtu myeloidních blastů (CD34+/CD117+) a počtu fenotypově zralejších myeloidních elementů (CD34-/CD117+) charakteru vyzrávajících erytroa myeloblastů a promyelocytů. Počet blastů pak může doplnit fenotypová analýza vývoje granulocytů a prekurzorů červené řady. Ač je analýza dysplastických změn primárně záležitostí morfologickou (a cytometrie by neměla mít ambice váhu morfologického vyšetření nahradit), jsou dobře prostudovány fenotypové změny výše uvedených populací, které doprovází fyziologické vyzrávání těchto elementů v kostní dřeni (obr. 7).
Odchylky ve fenotypu odráží nerovnoměrné, dysplastické vyzrávání, které často doplňují i morfologické abnormality. Dysplastický charakter myeloidních blastů i zralých granulocytů však může odrážet i aberantní fenotyp. Ke zhodnocení těchto změn byly zavedeny i různé skórovací systémy, které mají za cíl zvýšit informační hodnotu cytometrického vyšetření kostní dřeně u pacientů s MDS. Komplikovanou kapitolou jsou z pohledu průtokové cytometrie monocyty, posouzení jejich zralosti se opírá především o stanovení exprese znaků CD64 a CD14. Takové rozlišení umožňuje rozdělit monocytární populaci na méně zralé (CD64+/CD14-) a zralé (CD64+/CD14+) elementy, neumožňuje však dostatečně citlivé rozlišení mezi promonocyty a zralými monocyty. Naopak, populaci morfologicky uniformních nezralých elementů – blastů je možné pomocí průtokové cytometrie rozdělit na blasty bez známek monocytární diferenciace a monoblasty. Při analýze monocytů je vhodné doplnit vyšetřovaný panel znaků o molekuly CD4, CD11b, CD11c, CD13, CD15, CD16, CD33, CD36, CD38, CD68
a HLA-DR, neboť zejména u pokročilých MDS či myeloproliferativních onemocnění v progresi často nelze přesně posoudit původ dysplastických elementů vycházejících z myeloidní řady. Fenotypovou analýzu monocytů doplňuje stanovení exprese molekuly CD56, jejíž exprese na monocytech je považována za aberantní a může sloužit i jako znak pro detekci MRN. Exprese nádorového markeru NG2 na monocytech souvisí, stejně jako u dg. B-ALL, s genetickou přestavbou v MLL genu. Průtoková cytometrie může nabídnout i rozlišení mezi reaktivní a patologickou monocytózouu chronické myelomonocytární leukémie (CMML) v krvi na základě exprese znaků CD14 a CD16. Tento postup vyžaduje při tvorbě vyšetřovacího protokolu a následné analýze fenotypové odstranění všech ostatních leukocytárních populací a u zbylých monocytů jejich rozlišení na subpopulace na základě exprese znaků CD14 a CD16, přičemž při CMML výrazně převažuje populace fenotypově„klasických“ monocytů CD14+/CD16-.
Celkově vzato je průtoková cytometrie na základě počtu blastů schopna rozeznat zejména mezi low-grade a high-grade formou MDS, umožňuje detekovat zvýšené zastoupení monocytů či prokázat jejich aberantní fenotyp a sledovat hrubé dysplastické změny. Histologické vyšetření naopak nabízí komplexní pohled na stav kostní dřeně nejen s ohledem na počet blastů, ale i na její buněčnost, fibrotizaci, dysplastické změny ve formě abnormální distribuce nezralých elementů i posouzení abnormalit erytropoézy a megakaryopoézy (30–38).
Diagnostika myeloproliferativních onemocnění
V diagnostice většiny myeloproliferativních onemocnění nehraje cytometrické vyšetření zásadní roli. U pacientů s chronickou myeloidní leukémií vidíme spíše charakteristický soubor abnormalit než jednoznačně rozlišitelnou patologickou populaci. Cytometrický obraz zpravidla zahrnuje velmi snížené zastoupení prekurzorů červené řady a lymfocytů a značně zvýšený podíl granulocytů s typicky sníženou expresí znaku CD15 na jejich povrchu. Obecně má ale cytometrické vyšetření u pacientů s myeloproliferativními chorobami smysl jen pro vyloučení progrese či transformace choroby do akutních stavů a histologické vyšetření opět jistě přináší značně podrobnější informace o stavu kostní dřeně (39).
Image 6. Exprese (A) znaku CD138, (B) aberantní fenotyp (CD19-/CD56+) a (C) monoklonální charakter určený výlučnou cytoplazmatickou expresí Ig κ na plazmatických buňkách u mnohočetného myelomu. 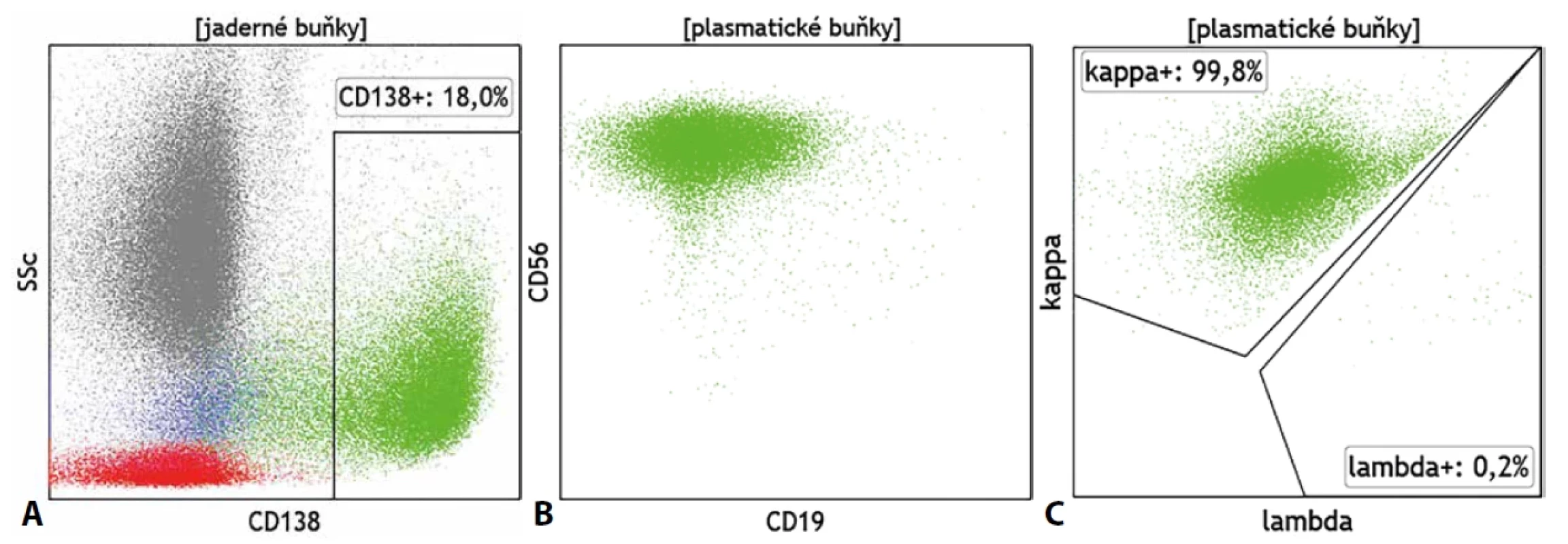
Image 7. (A,B,C) Srovnání exprese znaků CD11b, CD13 a CD16 na vyzrávajících granulocytech u pacienta s myelodysplastickým syndromem a (D,E,F) u pacienta se zdravou krvetvorbou. 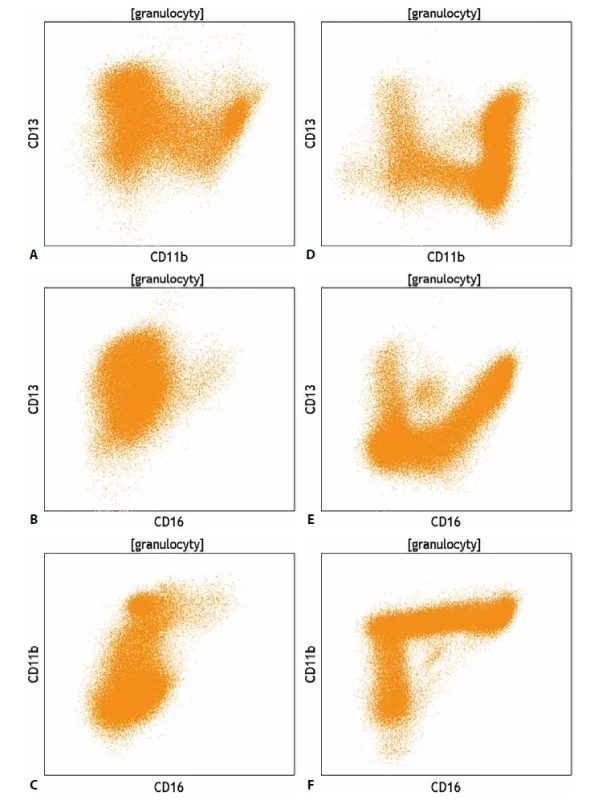
Mastocytóza
Komplikovaná je z pohledu průtokové cytometrie i diagnostika systémové mastocytózy, jelikož je zpravidla z důvodů fibrotizace kostní dřeně v aspirátu zachyceno pouze velmi malé množství buněk. Mastocyty se v při cytometrické analýze jeví jako granulární CD45+ elementy s velmi silnou expresí znaku CD117. Pro diagnostiku mastocytózy je vhodné doplnit vyšetření molekul CD2 a CD25, jejichž exprese je pozitivní na patologických mastocytech (obr. 8). Z dalších molekul svědčících o dané diagnóze je vhodné doplnit molekuly CD35, CD59, CD63 či CD69. Imunohistochemická analýza je tak pro diagnózu mastocytózy zásadní, jelikož nazírá na preparáty kostní dřeně v jejích plné komplexnosti, včetně míry fibrotizace a fokální distribuce mastocytů. Z molekul, které cytometrii v diagnostice mastocytózy doplňují, jsou významná CAE, chymáza, tryptáza, vimentin, α1-antitrypsin a S100 protein. Obecně má pro diagnostiku chorob této skupiny histopatologické vyšetření větší význam než vyšetření cytometrické (40–42).
Image 8. (A) Identifikace mastocytů (žlutě) na základě silné exprese znaku CD117 a jejich aberantní exprese znaků (B) CD2 a (C) CD25 u pacienta se systémovou mastocytózou. 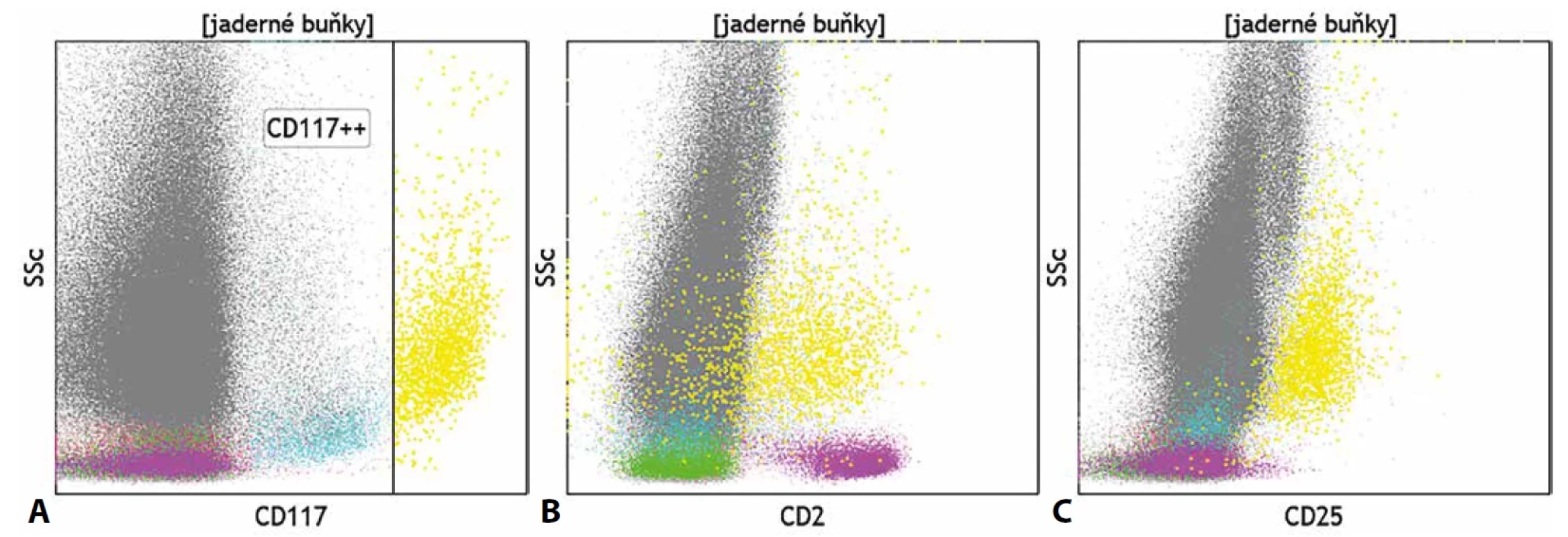
ZÁVĚR
Průtoková cytometrie je zcela nezbytným nástrojem jak v diagnostice hematoonkologických onemocnění, tak i ve sledování léčebné odpovědi, detekci rizikových faktorů a při hodnocení přítomnosti MRN. Jedná se o metodu, která umožňuje rychlé zpracování materiálu a vydání výsledku. Nespornou výhodou je analýza velkého množství buněk umožňující i detekci velmi drobných patologických nálezů. I přes svou robustnost však existuje řada situací, ke kterým se pomocí průtokové cytometrie není možné vyjádřit a na její místo musí nastoupit jiné diagnostické postupy. Řadu slabin průtokové cytometrie nahrazuje právě morfologické a imunohistochemické vyšetření. Nezbytnou schopností lékaře-hematologa pak musí být orientace v těchto slabých a silných stránkách jednotlivých vyšetření a smysl pro posouzení váhy výsledků u dané choroby s ohledem na použitou techniku. Konečnou diagnózu tak tvoří různě velké střípky výsledků jednotlivých metod z mozaiky skutečného stavu pacienta. Zkušený cytometrista by si měl být rovněž vědom svých limitů i předností a dokázat na tyto limity i upozornit a nabídnout radu, kam a na koho se v případě potřeby obrátit. Ideálním stavem v organismu klinického provozu pak samozřejmě je, když se pracovníci z jednotlivých laboratorních i klinických pracovišť vzájemně znají, udržují spolu přátelské vztahy a jsou ochotni si vzájemně pomoci a poradit.Tím jediným, na čem totiž v závěru skutečně záleží, je dobře diagnostikovaný a dobře léčený pacient.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
RNDr. Ondřej Souček, Ph.D.
Laboratoř průtokové cytometrie
Ústav klinické imunologie a alergologie
Fakultní nemocnice Hradec Králové
Sokolská 58, 500 05
tel.: +420495832270
e-mail: ondrej.soucek@fnhk.cz
Sources
- Peters JM, Ansari MQ. Multiparameter Flow Cytometry in the Diagnosis and Management of Acute Leukemia. Arch Pathol Lab Med 2011; 135.
- Wood BL. Flow cytometry in the diagnosis and monitoring of acute leukemia in children. J Hematop 2015; 8(3): 191–199.
- Porwit A, Béné MC. Acute Leukemias of Ambiguous Origin. Am J Clin Pathol 2015; 144(3): 361–376.
- Ossenkoppele GJ, van de Loosdrecht AA, Schuurhuis GJ. Review of the relevance of aberrant antigen expression by flow cytometry in myeloid neoplasms. Br J Haematol. 2011; 153(4): 421–36.
- Wood BL. Principles of minimal residual disease detection for hematopoietic neoplasms by flow cytometry. Cytometry B Clin Cytom 2016; 90(1): 47–53.
- Bene MC, Castoldi G, Knapp W, Ludwig WD, Matutes E, Orfao A, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995; 9(10): 1783–1786.
- Lee ST, Kim HJ, Kim SH. Defining an Optimal Number of Immunophenotypic Markers for Lineage Assignment of Acute Leukemias Based on the EGIL Scoring System. Korean J Lab Med 2006; 26(6): 393–399.
- Genescà E, la Starza R. Early T-Cell Precursor ALL and Beyond: Immature and Ambiguous Lineage T-ALL Subsets. Cancers 2022; 14(8):1873.
- Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111(8): 3941–3967.
- Morice WG, Kurtin PJ, Hodnefield JM, Shanafelt TD, Hoyer JD, Remstein ED, et al. Predictive Value of Blood and Bone Marrow Flow Cytometry in B-Cell Lymphoma Classification: Comparative Analysis of Flow Cytometry and Tissue Biopsy in 252 Patients. Mayo Clin Proc 2008; 83(7): 776–785.
- Seegmiller AC, Hsi ED, Craig FE. The current role of clinical flow cytometry in the evaluation of mature B-cell neoplasms. Cytometry B Clin Cytom 2019; 96(1): 20–29.
- Debord C, Wuilleme S, Eveillard M, Theisen O, Godon C, Le Bris Y, et al. Flow cytometry in the diagnosis of mature B‐cell lymphoproliferative disorders. Int J Lab Hematol 2020; 42 : 113–120.
- Miguet L, Béchade G, Fornecker L, Zink E, Felden C, Gervais C, et al. Proteomic Analysis of Malignant B-Cell Derived Microparticles Reveals CD148 as a Potentially Useful Antigenic Biomarker for Mantle Cell Lymphoma Diagnosis [Internet]. ACS Publications. American Chemical Society; 2009. https://pubs.acs. org/doi/pdf/10.1021/pr801102c
- Rawstron AC, Fazi C, Agathangelidis A, Villamor N, Letestu R, Nomdedeu J, et al. A complementary role of multiparameter flow cytometry and high-throughput sequencing for minimal residual disease detection in chronic lymphocytic leukemia: an European Research Initiative on CLL study. Leukemia 2016; 30(4): 929–936.
- Rawstron AC, Kreuzer KA, Soosapilla A, Spacek M, Stehlikova O, Gambell P, et al. Reproducible diagnosis of chronic lymphocytic leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) Harmonisation project. Cytometry B Clin Cytom 2018; 94(1): 121–128.
- Kroft SH, Dawson DB, McKenna RW. Large cell lymphoma transformation of chronic lymphocytic leukemia/small lymphocytic lymphoma. A flow cytometric analysis of seven cases. Am J Clin Pathol 2001; 115(3): 385–395.
- Higgins RA, Blankenship JE, Kinney MC. Application of immunohistochemistry in the diagnosis of non-Hodgkin and Hodgkin lymphoma. Arch Pathol Lab Med 2008; 132(3): 441–461.
- Maitre E, Troussard X. Monoclonal B-cell lymphocytosis. Best Pract Res Clin Haematol 2019; 32(3): 229–238.
- Marti GE, Rawstron AC, Ghia P, Hillmen P, Houlston RS, Kay N, et al. Diagnostic criteria for monoclonal B-cell lymphocytosis. Br J Haematol 2005; 130(3): 325–332.
- Alaggio R, Amador C, Anagnostopoulos I, Attygalle AD, Araujo IB de O, Berti E, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia 2022; 36(7): 1720–1748.
- Behdad A, Bailey NG. Diagnosis of Splenic B-Cell Lymphomas in the Bone Marrow: A Review of Histopathologic, Immunophenotypic, and Genetic Findings. Arch Pathol Lab Med 2014; 138(10): 1295–1301.
- Shi M, Olteanu H, Jevremovic D, He R, Viswanatha D, Corley H, et al. T-cell clones of uncertain significance are highly prevalent and show close resemblance to T-cell large granular lymphocytic leukemia. Implications for laboratory diagnostics. Mod Pathol 2020; 33(10): 2046–2057.
- Horna P, Shi M, Olteanu H, Johansson U. Emerging Role of T-cell Receptor Constant β Chain-1 (TRBC1) Expression in the Flow Cytometric Diagnosis of T-cell Malignancies. Int J Mol Sci 2021; 22(4): 1817.
- Novikov ND, Griffin GK, Dudley G, Drew M, Rojas-Rudilla V, Lindeman NI, et al. Utility of a Simple and Robust Flow Cytometry Assay for Rapid Clonality Testing in Mature Peripheral T-Cell Lymphomas. Am J Clin Pathol 2019; 151(5): 494–503.
- Jelinek T, Bezdekova R, Zatopkova M, Burgos L, Simicek M, Sevcikova T, et al. Current applications of multiparameter flow cytometry in plasma cell disorders. Blood Cancer J 2017; 7(10): e617–e617.
- Jelinek T, Bezděková R, Zihala D, Sevcikova T, Capkova L, Polackova P, et al. Circulating Plasma Cells Are the Most Powerful Prognostic Marker in Transplant Ineligible Multiple Myeloma with 2% As a New Cut-Off for Primary Plasma Cell Leukemia. Blood 2021; 138 : 546.
- Flores-Montero J, Sanoja-Flores L, Paiva B, Puig N, García-Sánchez O, Böttcher S, et al. Next Generation Flow for highly sensitive and standardized detection of minimal residual disease in multiple myeloma. Leukemia 2017; 31(10): 2094–2103.
- Kumar S, Paiva B, Anderson KC, Durie B, Landgren O, Moreau P, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016; 17(8): e328–346.
- Burgos L, Tamariz-Amador LE, Puig N, Cedena MT, Guerrero C, Jelínek T, et al. Definition and Clinical Significance of the Monoclonal Gammopathy of Undetermined Significance–Like Phenotype in Patients With Monoclonal Gammopathies. J Clin Oncol 2023; JCO.22.01916.
- Bento LC, Correia RP, Pitangueiras Mangueira CL, De Souza Barroso R, Rocha FA, Bacal NS, et al. The Use of Flow Cytometry in Myelodysplastic Syndromes: A Review. Front Oncol 2017; 7 : 270.
- Aanei CM, Picot T, Tavernier E, Guyotat D, Campos Catafal L. Diagnostic Utility of Flow Cytometry in Myelodysplastic Syndromes. Front Oncol 2016; 6 : 161.
- van de Loosdrecht AA, Westers TM, Westra AH, Dräger AM, van der Velden VHJ, Ossenkoppele GJ. Identification of distinct prognostic subgroups in lowand intermediate-1–risk myelodysplastic syndromes by flow cytometry. Blood 2008; 111(3): 1067–1077.
- Duetz C, Westers TM, van de Loosdrecht AA. Clinical Implication of Multi-Parameter Flow Cytometry in Myelodysplastic Syndromes. Pathobiology 2019; 86(1): 14–23.
- Porta MGD, Picone C, Pascutto C, Malcovati L, Tamura H, Handa H, et al. Multicenter validation of a reproducible flow cytometric score for the diagnosis of low-grade myelodysplastic syndromes: results of a European LeukemiaNET study. Haematologica 2012; 97(8): 1209–1217.
- Della Porta MG, Picone C. Diagnostic Utility of Flow Cytometry in Myelodysplastic Syndromes. Mediterr J Hematol Infect Dis 2017; 9(1): e2017017.
- Hudson CA, Burack WR, Bennett JM. Emerging utility of flow cytometry in the diagnosis of chronic myelomonocytic leukemia. Leuk Res 2018; 73 : 12–15.
- Tarfi S, Harrivel V, Dumezy F, Guy J, Roussel M, Mimoun A, et al. Multicenter validation of the flow measurement of classical monocyte fraction for chronic myelomonocytic leukemia diagnosis. Blood Cancer J 2018; 8(11): 114.
- Selimoglu-Buet D, Wagner-Ballon O, Saada V, Bardet V, Itzykson R, Bencheikh L, et al. Characteristic repartition of monocyte subsets as a diagnostic signature of chronic myelomonocytic leukemia. Blood 2015; 125(23):3618–3626.
- Shi M, Nguyen P, Jevremovic D. Flow Cytometric Assessment of Chronic Myeloid Neoplasms. Clin Lab Med 2017; 37(4): 803–819.
- Escribano L, Díaz-Agustín B, Núñez R, Prados A, Rodríguez R, Orfao A. Abnormal Expression of CD Antigens in Mastocytosis. Int Arch Allergy Immunol 2002; 127(2): 127–132.
- Pozdnyakova O, Kondtratiev S, Li B, Charest K, Dorfman DM. High-Sensitivity Flow Cytometric Analysis for the Evaluation of Systemic Mastocytosis Including the Identification of a New Flow Cytometric Criterion for Bone Marrow Involvement. Am J Clin Pathol 2012; 138(3): 416–424.
- Sánchez-Muñoz L, Teodosio C, Morgado JMT, Perbellini O, Mayado A, Alvarez-Twose I, et al. Flow cytometry in mastocytosis: utility as a diagnostic and prognostic tool. Immunol Allergy Clin North Am 2014; 34(2): 297–313.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2023 Issue 4-
All articles in this issue
- Lymfom, či nelymfom, toť otázka
- … od svých vrstevníků jsem se lišil při řezání žížal žiletkou - oni příčně, já podélně …
- MONITOR aneb nemělo by vám uniknout, že
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Kompozitní folikulární lymfom a in situ mantle cell neoplázie lymfatické uzliny: identifikace na základě vyšetření průtokovou cytometrií
- Post mortem vyšetření případů náhlé srdeční smrti. Česká zkušenost a možnost zapojení patologů do multidisciplinárního procesu
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

