-
Medical journals
- Career
Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?
Authors: Ondřej Fabián 1; Ondřej Hradský 2; Jiří Bronský 2; Josef Zámečník 1
Authors‘ workplace: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 1; Pediatrická klinika 2. LF UK a FN Motol, Praha 2
Published in: Čes.-slov. Patol., 55, 2019, No. 3, p. 158-164
Category:
Overview
Prohlubování znalostí na poli zánětlivých střevních onemocnění s sebou nese změnu terapeutických cílů. Zatímco dříve bylo snahou gastroenterologů zmírnění pacientových symptomů, dnes je diskutována zejména otázka slizničního hojení a dosažení endoskopické, případně i mikroskopické remise. Do popředí se tak dostává nutnost objektivního posouzení mikroskopické intenzity a aktivity zánětu, k čemuž mohou sloužit histopatologické skórovací indexy. Jejich reálný přínos je však dosud nejasný.
Cílem tohoto přehledového článku je podat informaci o dostupných histopatologických skórovacích indexech pro ulcerózní kolitidu (UC) a Crohnovu chorobu (CD) a zamyslet se nad jejich přínosem a limitacemi. Systematickou literární rešerší v databázích OVID SP MEDLINE, OVID EMBASE a The Cochrane library bylo nalezeno 19 skórovacích indexů pro UC a 4 pro CD. Naprostá většina z nich však není validována a jejich přínos stran predikce klinického průběhu onemocnění je sporný. Endoskopie tak stále zůstává zlatým standardem hodnocení intenzity a aktivity zánětlivého střevního onemocnění.
Klíčová slova:
Zánětlivé střevní onemocnění – ulcerózní kolitida – histopatologie – skórovací index
Když v roce 1932 Burill Bernard Crohn publikoval článek s názvem „Regional ileitis: A pathologic and clinical entity“ (1), nepřímo tak definoval novou skupinu onemocnění, známou jako zánětlivá střevní onemocnění (IBD). Crohnova choroba (CD) a ulcerózní kolitida (UC) se tak na následujících téměř sto let staly jedním z hlavních témat gastroenterologů a gastrointestinálních patologů. V průběhu doby se však pohled na danou problematiku zásadně změnil, a to s ohledem na definice, klasifikace, diagnostiku i léčbu. IBD již dávno nejsou „pouhými záněty střev“, v dnešní době je chápeme jako chronická systémová zánětlivá onemocnění s predilekcí k trávicímu traktu, jejichž etiologie je neznámá a patogeneze přinejmenším nejasná (2-4). Nové práce na poli IBD jsou publikovány téměř na denním pořádku a prohlubující se znalosti o této skupině chorob s sebou přinášejí i zásadní změny ve strategii léčby včetně vytyčení nových terapeutických cílů. Zatímco dříve bylo hlavní snahou gastroenterologů zmírnění pacientových symptomů, v dnešní době je diskutováno zejména tzv. slizniční hojení (5-11), neboli dosažení endoskopické remise, kterou definuje absence endoskopicky viditelných známek zánětu (2,5). Negativní endoskopický nález však zdaleka nemusí znamenat negativní nález mikroskopický (12-14). Dle dostupných studií až 37 % pacientů s CD v klinické a endoskopické remisi vykazuje mikroskopické zámky přetrvávajícího zánětu (15,16) a u pacientů s UC údaje kolísají od 16 % až po 100 % pacientů (17). Do popředí tak vstupuje otázka objektivizace mikroskopické intenzity a aktivity zánětu pomocí histopatologických skórovacích indexů.
Účelem tohoto přehledového článku je poskytnout informaci o dostupných histopatologických skórovacích indexech pro CD a UC a zamyslet se nad aktuálním stavem mikroskopického hodnocení aktivity zánětu IBD s jeho benefity i limitacemi.
METODIKA
Byl proveden bibliografický průzkum od data prvních uveřejněných publikací až do 10. 10. 2018 v následujících databázích: OVID SP MEDLINE, OVID EMBASE a The Cochrane library. Použitá klíčová slova zahrnovala „inflammatory bowel disease“; „inflammatory bowel diseases“; „ulcerative colitis“; „colitis“; „crohn“; „crohn’s“; „mucosal healing“; „histologic healing“; „histologic remission“; „histopathological remission“; „microscopic remission“; „scoring system“; „scoring index“; „histological scoring“; „histopathological scoring“; „pathological scoring“; „activity assessment“. V případě, že některý z dřívějších dostupných přehledových článků citoval publikaci, která touto metodikou nebyla nalezena, byla tato publikace přidána ručně.
VÝSLEDKY
Celkově bylo nalezeno 2842 publikací. Z průzkumu byly vyloučeny studie v jiném než anglickém a českém jazyce, kazuistická sdělení, abstrakta a studie na zvířatech. Dále byly vyřazeny práce, v nichž autoři ke svému výzkumu využívali skórovací indexy původně etablované jinými autory, nebo indexy určená pro jiná onemocnění. Po uplatnění vyřazovacích kritérií bylo nalezeno 19 skórovacích indexů pro UC a 4 pro CD (tab. 1) (13,16,18-38).
Table 1. Histopatologické skórovací systémy pro IBD. 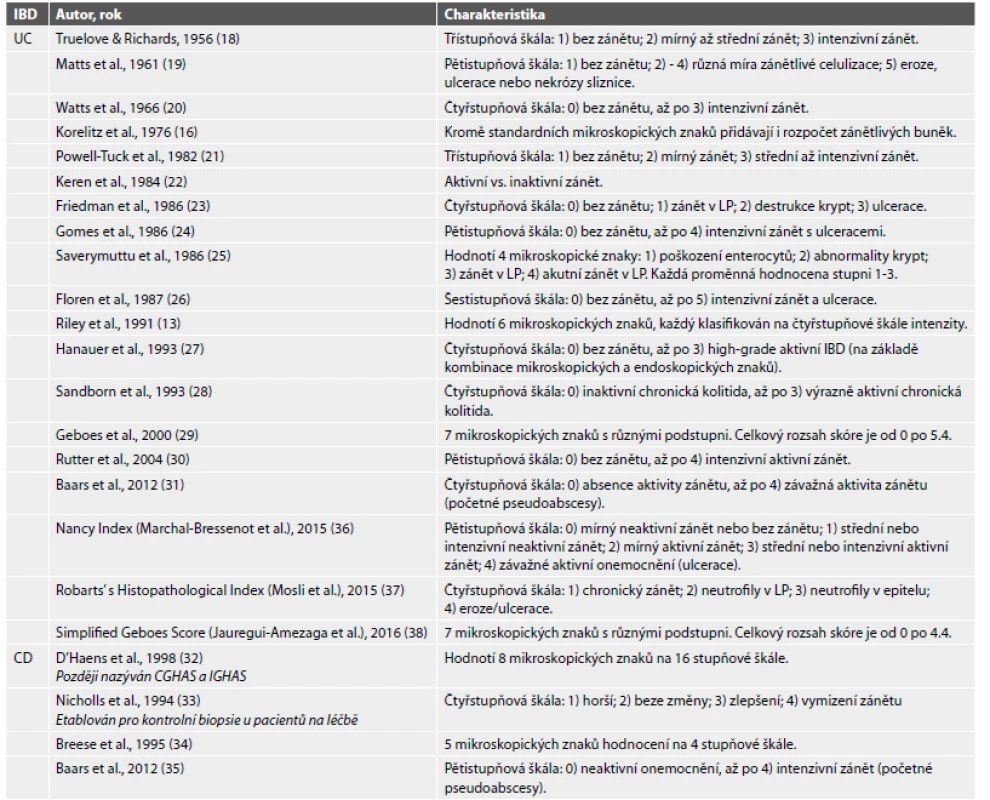
IBD = zánětlivá střevní onemocnění; UC = ulcerózní kolitida; CD = Crohnova choroba; LP = lamina propria; CGHAS = Colonic Global Histologic Activity Score; IGHAS = Ileal Global Histologic Activity Score. Histopatologické skórovací indexy pro ulcerózní kolitidu
Již v 60. letech minulého století Truelove & Richards prezentovali jejich histopatologický skórovací systém pro UC (18), který je zároveň prvním doloženým histopatologickým skórovacím indexem pro IBD obecně. Jedním z nejpoužívanějších indexů se pak stalo Geboesovo skóre z roku 2000 (29). Hodnotí 7 morfologických znaků, mezi které patří 1) porucha architektoniky sliznice, 2) přítomnost neutrofilů v lamina propria, 3) eosinofily v lamina propria, 4) přítomnost neutrofilů v povrchovém epitelu, 5) kryptitida, 6) destrukce krypt a 7) slizniční defekty (eroze a ulcerace). Každá z dílčích proměnných je dále subklasifikována na základě svojí tíže. Ačkoliv se takové skóre na první pohled může zdát příliš komplikované a v rutinní praxi obtížně použitelné (např. dělení rozsahu kryptitidy do 5 %, do 50 % a nad 50 % krypt ve vzorku), vykazuje překvapivě vysokou interpersonální shodu (kappa 0.70) (29). V roce 2017 bylo publikováno modifikované a zjednodušené Geboesovo skóre (38), do kterého byla nově zakomponována přítomnost bazální plazmocytózy.
Jak již bylo zmíněno v úvodu, značná část pacientů s UC v endoskopické remisi nečekaně vykazuje mikroskopické známky přetrvávajícího zánětu. Jelikož je UC charakterizována kontinuálním a rovnoměrně rozloženým zánětem, dala by se předpokládat vysoká míra shody mezi mikroskopickým a endoskopickým nálezem, a tudíž i histopatologickými a endoskopickými skórovacími indexy. Bohužel, studie na toto téma vykazují přinejmenším rozporuplné výsledky (21,24,39-41). Lemmens B et al. (40) se pokusili o korelaci Mayo Endoscopic Score (42) s dvěma pravděpodobně nejčastěji používanými histopatologickými indexy pro UC - Riley Score (13) a již výše komentované Geboesovo skóre (29). Zjištění, že pod Mayo 1, čili mírnou endoskopickou aktivitou, se skrývaly všechny histologické stupně aktivity zánětu, hovoří za vše. Na základě dostupných studií lze shrnout, že nejlepší korelace endoskopie a mikroskopie bývá u intenzivních floridních zánětů a u normálních nálezů, zatímco minimální shoda panuje u mírného neaktivního zánětu (40).
Poněkud optimističtější výsledky u pacientů s UC přináší výzkum na téma histopatologie jako prognostického faktoru. Již od začátku panoval názor, že kombinace endoskopie a mikroskopie bude mít lepší výpovědní hodnotu stran klinického průběhu onemocnění než endoskopie samotná (43), což bylo v průběhu dalších let doloženou řadou dalších studií (13,30,31,43-50). Například ve studii Riley et al. (13) mikroskopická intenzita zánětu predikovala u endoskopicky negativních pacientů klinický relaps v průběhu následujících 12 měsíců a konkrétně Geboesovo skóre se taktéž ukazuje být prediktorem klinického relapsu u pacientů s UC v klinické a endoskopické remisi (44,49).
V nedávné době byly etablovány dva nové histopatologické indexy pro UC - Nancy Index (36) a Robarts‘ Histopathology Index (37). První jmenovaný používá pětistupňovou škálu hodnocení na základě přítomnosti ulcerací a intenzity aktivního a chronického zánětu (obr. 1). Robarts‘ Histopathology Index pak využívá čtyřstupňový grading (1 - chronický zánět, 2 - přítomnost neutrofilů v lamina propria, 3 - neutrofily v epitelu a 4 - přítomnost slizničních defektů). Jde o první skutečně validovaná skóre pro UC, která navíc vykazují shodu s endoskopickým nálezem. Ve studii od Irani NR et al. (51) byla prokázána dobrá korelace obou indexů s Ulcerative Colitis Endoscopic Index of Severity (52) i mezi oběma histopatologickými indexy navzájem. Stran jejich případného prediktivního významu zatím chybí dostatek dostupných informací.
Image 1. Nancy Index pro histopatologické hodnocení intenzity a aktivity zánětu u ulcerózní kolitidy. 
Histopatologické skórovací indexy pro Crohnovu chorobu
Vzhledem k diskontinuálnímu charakteru zánětu je mikroskopické hodnocení intenzity a aktivity zánětu u Crohnovy choroby náročnější a dostupné skórovací indexy jsou limitované počtem i významem. Jediný plošněji používaný index pochází od D‘Haense et al. z roku 1998, který se v praxi ujal pod názvem Global Histologic Activity Score (GHAS) a je často užívaný separátně pro terminální ileum a tlusté střevo (jako tzv. Colonic a Ileal GHAS) (32,53,54). Tento index hodnotí 1) poškození epitelu, 2) poruchu architektoniky sliznice, 3) chronický zánět v lamina propria, 4) neutrofily v lamina propria, 5) neutrofily v epitelu, 6) přítomnost slizničních defektů a 7) přítomnost epiteloidních granulomů, k čemuž následně přičítá počet postižených segmentů střeva (tab. 2). Není však validovaný a je doložená jeho špatná korelace s endoskopickými indexy (24,54).
Table 2. Global Histology Activity Score (GHAS). Používá se separátně pro terminální ileum a tlusté střevo 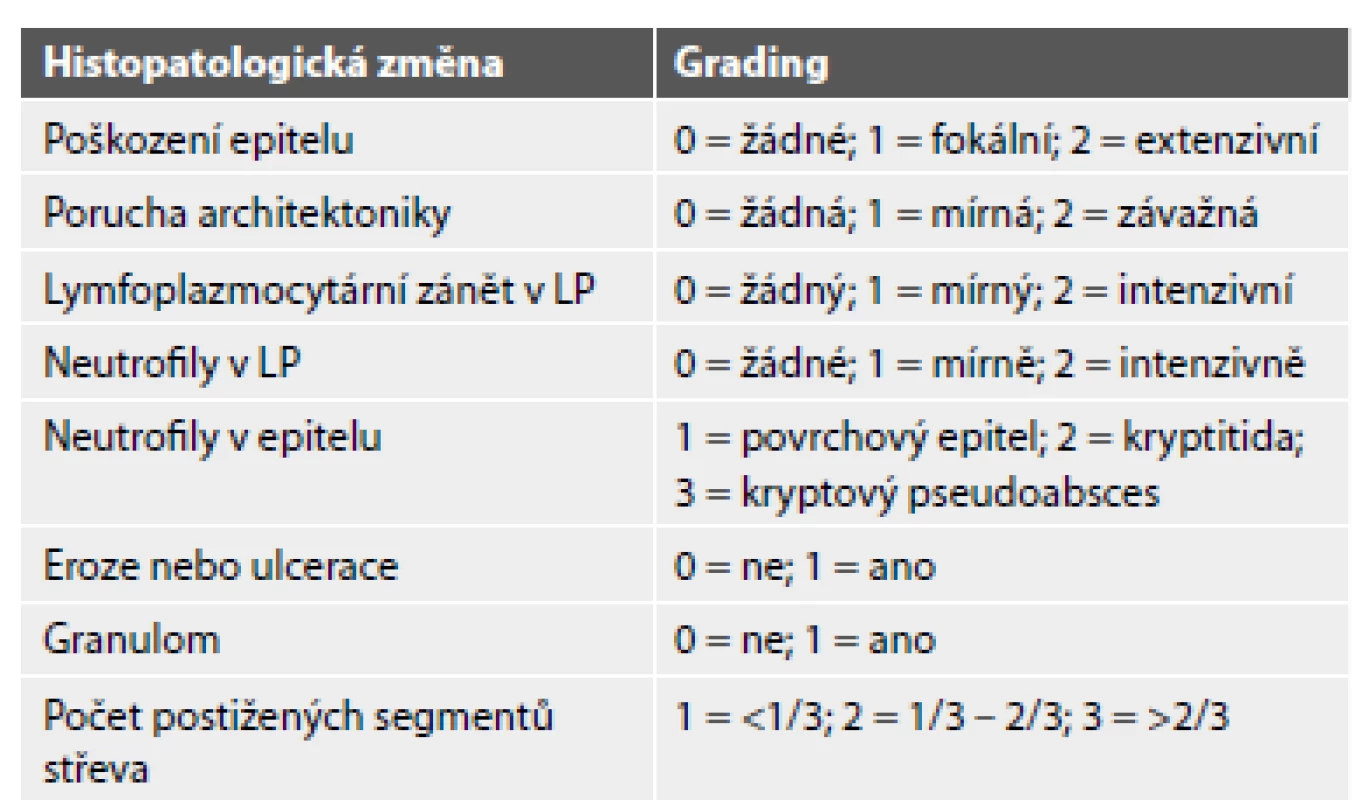
Každá proměnná je hodnocena nezávisle
Výsledné skóre je součet všech individuálních proměnných (max. = 16)
LP = lamina propriaPrognostický význam histopatologie je v případě CD sporný. V jediné nalezené studii na toto téma Baars et al. (31) nebyla prokázána asociace histopatologického nálezu s klinickým relapsem onemocnění, rozvojem striktury či nutností chirurgického zákroku.
Histopatologické skórovací indexy pro pediatrická IBD
Histopatologický skórovací index primárně etablovaný pro dětská IBD nebyl doposud vytvořen (55) a mikroskopické hodnocení intenzity a aktivity zánětu tak u dětí s IBD zůstává čistě subjektivní. Nejasný je i přínos histopatologie stran predikce klinického průběhu onemocnění. Podle recentních studií (56,57) zakomponování mikroskopie do Pařížské klasifikace (58) (která dětská IBD fenotypicky klasifikuje na základě klinických charakteristik a endoskopického nálezu) výrazně zvýšilo hodnocený rozsah zánětlivého postižení u dětí s CD, UC i neklasifikovanou IBD (IBDU). Z daných studií však nevyplývá, nakolik toto odráží klinickou prezentaci choroby a zda mikroskopie přinesla reálnou přidanou hodnotu stran predikce následného klinického průběhu.
Tuto otázku se naše supina pokusila zodpovědět v roce 2017 ve studii s názvem „Low predictive value of histopathological scoring system for complications development in children with Crohn‘s disease.“ (59). Provedli jsme retrospektivní analýzu 63 dětí s nově diagnostikovanou CD. Zpětně byly zhodnoceny vstupní etážové biopsie před zahájením terapie a histopatologická intenzita a aktivita zánětu byla objektivizována za použití výše zmíněného Global Histology Activity Score (32). Následně byla hledána asociace s endoskopickou aktivitou zánětu stanovenou pomocí široce užívaného endoskopického indexu Simple Endoscopic Score for Crohn’s Disease (SES-CD) (60), a dále s Pediatric Crohn‘s Disease Activity Index (PCDAI), který představuje jedno z nejpoužívanějších klinických skóre aktivity pediatrické CD (61). Zároveň jsme zjišťovali, zda lze na základě histopatologie predikovat rozvoj komplikací v průběhu následujícího roku. Bohužel, mikroskopická aktivita zánětu, stanovená za pomocí GHAS, se neukázala být prediktorem komplikovaného průběhu onemocnění (na rozdíl od SES-CD) a nekorelovala s aktivitou zánětu, stanovenou za pomocí SES a PCDAI.
DISKUZE
V současné době je známo několik desítek skórovacích indexů, z nichž jen minimum je validovaných, vykazují slabou korelaci s endoskopickým nálezem a jejich význam stran predikce klinického průběhu onemocnění je limitovaný (17,62,63). V mnoha případech šlo o jednoduchá skóre o několika proměnných, které byly sestaveny skupinami autorů pro potřeby jejich vlastních studií a nebyly určeny primárně pro běžnou rutinní bioptickou praxi. Již samotný fakt, že jsme v pravidelných intervalech konfrontováni se stále novými indexy, nepřímo naznačuje, že doposud stále selháváme ve snaze nalézt jeden ideální, který by výše zmíněné náležitosti splňoval. I z těchto důvodů zatím dosažení histologické remise není považováno za primární terapeutický cíl (5,64,65). Příčiny je možné nalézat v průběhu celého multidisciplinárního diagnostického procesu, od vlastních biologických charakteristik onemocnění přes techniku endoskopického vyšetření, bioptický odběr vzorků, zpracování materiálu až po samotné histopatologické hodnocení a jeho interpretaci:
Kolísání rozsahu zánětu
Vlastní biologická povaha CD se svým kolísavým charakterem zánětu na makroskopické i mikroskopické úrovni značně limituje množství dostupných histologických indexů i jejich využitelnost v praxi. Endoskopické vyšetření, které dokáže přehlédnout celý povrch střevní sliznice, má v takto ložiskově změněném terénu lepší vypovídající hodnotu než bioptické vzorky milimetrových rozměrů. V případě léčené IBD je však situace ještě složitější. Všeobecně známý fakt, že dlouhodobě léčená UC může taktéž vykazovat diskontinuální charakter zánětu (66,67), tak značně limituje přínos mikroskopie i v tomto případě.
Postižení tenkého střeva a horního gastrointestinálního traktu
CD i UC jsou systémová zánětlivá onemocnění se schopností postihnout jakoukoliv oblast trávicí trubice (2-4). Na celkové závažnosti onemocnění se tak může podílet i postižení horního gastrointestinálního traktu, jehož hodnocení zatím není součástí žádného dostupného indexu, endoskopického ani mikroskopického. U dospělých pacientů, na rozdíl od pediatrické IBD, není horní endoskopie ani součástí oficiálních doporučení pro diagnostiku IBD (3,68).
Endoskopické vyšetření dokáže postihnout pouze proximální (duodenum a někdy proximální část jejuna) a distální (terminální ileum) úsek tenkého střeva, avšak právě přítomnost zánětu v tenkém střevě může být pro další klinický průběh choroby určující. Proto byly v posledních letech etablovány indexy aktivity zánětu tenkého střeva pro kapslovou endoskopii. Mezi nejpoužívanější patří Lewis Score (69) a Capsule Endoscopy Crohn‘s Disease Activity Index (70), které doporučují i European Crohn‘s and Colitis Organisation a European Society of Gastrointestinal Endoscopy.
Nemožnost posouzení transmurality zánětu
Crohnova choroba, a v některých případech i ulcerózní kolitida, mohou vykazovat zánětlivé postižení hlubších struktur střevní stěny. Histopatologické i endoskopické vyšetření však podává informaci pouze o luminální aktivitě zánětu. Transmuralita zánětu je jedním z definujících prvků CD a spolupodílí se na celkovém klinickém stavu pacienta a rozvoji případných komplikací. Například záchyt myenterické plexitidy v resekčních okrajích predikuje časný relaps onemocnění po ileocékální resekci (71). Z tohoto důvodu se v posledních letech objevuje snaha o vytvoření validního indexu transmurální aktivity zánětu. Jedním z nich je tzv. Lémann Index (72), který však představuje klinické skóre, nikoliv histopatologické, a hodnotí kumulativní postižení střevní stěny na základě přítomnosti striktur, penetrujícího postižení (přítomnost píštělí a abdominálních abscesů), předchozích chirurgických výkonů a perianálního postižení. V některých případech je dokonce bioptický odběr natolik povrchový, že nezachytí ani bazální partie lamina propria mucosae a znemožní tak posouzení například bazální plazmocytózy, která je součástí některých skórovacích indexů, jako je kupříkladu již zmíněné modifikované Geboesovo skóre (38).
Počet odebraných vzorků
Na základě oficiálních doporučení European Society of Pathology a European Crohn‘s and Colitis Organisation (2-4) by měl bioptický odběr v době diagnózy zahrnovat minimálně dva vzorky z přinejmenším pěti etáží střeva, mezi kterými by nemělo chybět terminální ileum a rektum. Doposud však neexistuje oficiální stanovisko stran minimálního počtu vzorků v rámci kontrolních endoskopií (4). V běžné gastroenterologické praxi mnohdy stále přetrvává tendence nebioptovat endoskopicky negativní úseky střeva, a naopak provádět bohatý sampling v intenzivně zánětlivých změněných úsecích, čímž dochází k falešnému podhodnocení, respektive nadhodnocení mikroskopické intenzity a aktivity zánětu v závislosti na endoskopickém obrazu. Tato diskrepance se může negativně odrazit i na výpovědní hodnotě některých samotných skórovacích indexů jako například GHAS (32), který do hodnocení započítává i počet postižených segmentů střeva.
Histopatologické skóre u vstupních endoskopií
Jedním z hlavních důvodů odběru biopsie v rámci kontrolních endoskopií je zjistit stav mikroskopické intenzity a aktivity zánětu a tím získat informaci o účinnosti dosavadní terapie. Pro klinického lékaře a jeho následný rozhodovací proces je však stěžejní i mikroskopická intenzita zánětu v době diagnózy. Nicméně, patolog představuje pouze jednu z diagnostických modalit, definitivní diagnóza IBD je klinická diagnóza, kterou stanovuje příslušný klinický lékař až po kompletaci výsledků všech provedených vyšetření (2-4,68). Patolog tak ve fázi histopatologického hodnocení vzorků ze vstupní etážové biopsie neví, jaká bude výsledná diagnóza. Zejména pokud nemá k dispozici validní klinické informace, může se jeho diagnóza omezit na „chronickou nespecifickou kolitidu“ (respektive enterokolitidu), přičemž pacient bude z klinického pohledu vykazovat přesvědčivé známky CD s recidivujícími perianálními abscesy, sonografickým ztluštěním kliček tenkého střeva, mezenteriální lymfadenopatií a pozitivitou protilátek proti Saccharomyces cerevisiae. Naopak, nález floridní chronické terminální ileitidy a kolitidy s poruchou architektoniky sliznice a záchytem drobných rozvolněných epiteloidních granulomů může patologa bez validní klinické korelace mylně svést na scestí diagnózy CD, ačkoliv ve skutečnosti půjde o malé dítě se septickými stavy nejasné etiologie a následně geneticky potvrzenou diagnózou chronické granulomatózní choroby. Vzhledem k faktu, že se histopatologické skórovací indexy liší pro CD a UC, je jejich použití v době vstupní etážové biopsie možné až zpětně, po stanovení definitivní klinické diagnózy. Celkový problém podtrhuje i absence jakéhokoliv skórovacího indexu pro IBDU, přičemž tato diagnóza tvoří 10-15 % dospělých IBD a cca 5-7 % dětských IBD a mnohdy se stane diagnózou definitivní (73-76).
Hodnocení slizničních defektů
Pro většinu histopatologických indexů je přítomnost erozí a/nebo ulcerací známkou maximální intenzity zánětu a jsou hodnoceny nejvyššími stupni ve svých škálách. Příkladem je výše zmíněný Nancy Index (36), pro který jakákoliv přítomnost ulcerace automaticky znamená nejvyšší grade bez ohledu na charakter zánětu v okolní sliznici. Z hlediska endoskopie a potažmo i celkového klinického stavu pacienta je však zcela zásadní, jestli mikroskopicky popsaný defekt sliznice pochází z jedné drobné aftózní léze či se jedná o střevo s extenzivně ulcerovaným povrchem ve většině svého rozsahu. Jiné indexy jako např. Geboesovo skóre (29) naopak rozlišují mezi erozemi a ulceracemi. Standardní endoskopický odběr vzorku ze slizničních defektů by však měl zastihnout okraj defektu s přechodem do zachovalé sliznice. Co se tak v mikroskopu jeví jako mělká eroze, může být ve skutečnosti okrajový odběr z hlubšího defektu.
ZÁVĚR
Ačkoliv má histopatologie nezastupitelnou úlohu v diagnostice IBD, její přínos stran hodnocení intenzity a aktivity zánětu je stále omezený. Jak již bylo zmíněno, příčinou je samotná biologická povaha onemocnění, diskrepance s endoskopií i technické aspekty odběru vzorků. Zůstává však otázkou, zda tyto nedostatky odrážejí skutečné limitace mikroskopie a zda nejsou spíše vyvolány uměle. Z analýzy předchozích prací totiž vyplývá, že současná představa ideálního histopatologického skórovacího systému je validovaný index s dobrou interpersonální shodou, který koreluje s endoskopickým nálezem a zároveň slouží jako prediktor klinického průběhu onemocnění. Zjevná snaha o co nejlepší korelaci mikroskopie a endoskopie, což zároveň představuje i jeden z hlavních indikátorů validity, však popírá samotnou smysluplnost takového indexu, protože devalvuje mikroskopii na metodu, která může být maximálně stejně dobrá jako endoskopie. Diskrepance mezi endoskopií a histopatologií je tak naopak žádoucí. Histopatologický index by neměl endoskopický nález potvrzovat, nýbrž zpřesňovat a představovat tak přidanou hodnotu k celkové objektivizaci tíže zánětlivého onemocnění. Jedině tak může být případný skórovací index využíván v rutinní bioptické praxi a nesloužit pouze jako nástroj objektivizace dat pro potřeby studií. Další výzkum by se tak měl zaměřit spíše na přínos histopatologie jakožto prediktoru klinického průběhu onemocnění.
Práce byla podpořena MZ ČR – RVO, FN v Motole 00064203.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
MUDr. Ondřej Fabián
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
V Úvalu 84, 150 06, Praha 5
tel.: +420 224 435 645
e-mail: Ondrej.Fabian2@fnmotol.cz
Sources
1. Crohn BB, Ginzburg L, Oppenheimer GD. Regional Ileitis: A Pathologic and Clinical Entity. JAMA 1932; 99(16): 1323-1329.
2. Magro F, Gionchetti P, Eliakim R, et al. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis 2017; 11(6): 649-670.
3. Gomollón F, Dignass A, Annese V, et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis 2017; 11(1): 3-25.
4. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7(10): 827-851.
5. Travis SP, Higgins PD, Orchard T, et al. Review article: defining remission in ulcerative colitis. Aliment Pharmacol Ther 2011; 34(2): 113-124.
6. Daperno M, Castiglione F, de Ridder L, et al. Results of the 2nd part Scientific Workshop of the ECCO. II: Measures and markers of prediction to achieve, detect, and monitor intestinal healing in inflammatory bowel disease. J Crohns Colitis 2011; 5(5): 484-498.
7. Peyrin-Biroulet L, Ferrante M, Magro F, et al. Results from the 2nd Scientific Workshop of the ECCO. I: Impact of mucosal healing on the course of inflammatory bowel disease. J Crohns Colitis 2011; 5(5): 477-483.
8. Stange EF, Travis SP, Vermeire S, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis. Gut 2006; 55(Suppl 1): i1-i15.
9. Reinisch W, Van Assche G, Befrits R, et al. Recommendations for the treatment of ulcerative colitis with infliximab: a gastroenterology expert group consensus. J Crohns Colitis 2012; 6(2): 248-258.
10. Ardizzone S, Cassinotti A, Duca P, et al. Mucosal healing predicts late outcomes after the first course of corticosteroids for newly diagnosed ulcerative colitis. Clin Gastroenterol Hepatol 2011; 9(6): 483-189.
11. Froslie KF, Jahnsen J, Moum BA, et al. Mucosal healing in inflammatory bowel disease: results from a Norwegian population based cohort. Gastroenterology 2007; 133(2): 412-422.
12. Korelitz BI. Mucosal healing as an index of colitis activity: back to histological healing for future indices. Inflamm Bowel Dis 2010; 16(9): 1628-1630.
13. Riley SA, Mani V, Goodman MJ, et al. Microscopic activity in ulcerative colitis: what does it mean? Gut 1991; 32(2): 174-178.
14. Rosenberg L, Nanda KS, Zenlea T, et al. Histologic markers of inflammation in patients with ulcerative colitis in clinical remission. Clin Gastroenterol Hepatol 2013; 11(8): 991-996.
15. Molander P, Sipponen T, Kemppainen H, et al. Achievement of deep remission during scheduled maintenance therapy with TNFalpha-blocking agents in IBD. J Crohns Colitis 2013; 7(9): 730-735.
16. Korelitz BI, Sommers SC. Response to drug therapy in Crohn’s disease: evaluation by rectal biopsy and mucosal cell counts. J Clin Gastroenterol 1984; 6(2): 123-127.
17. Bryant RV, Winer S, Travis SP, Riddell RH. Systematic review: histological remission in inflammatory bowel disease. Is ‘complete’ remission the new treatment paradigm? An IOIBD initiative. J Crohns Colitis 2014; 8(12): 1582-1597.
18. Truelove SC, Richards WC. Biopsy studies in ulcerative colitis. Br Med J 1956; 1(4979): 1315-1318.
19. Matts SG. The value of rectal biopsy in the diagnosis of ulcerative colitis. Q J Med 1961; 30 : 393-407.
20. Watts JM, Thompson H, Goligher JC. Sigmoidoscopy and cytology in the detection of microscopic disease of the rectal mucosa in ulcerative colitis. Gut 1966; 7(3): 288-294.
21. Powell-Tuck J, Day DW, Buckell NA, et al. Correlations between defined sigmoidoscopic appearances and other measures of disease activity in ulcerative colitis. Dig Dis Sci 1982; 27(6): 533-537.
22. Keren DF, Appelman HD, Dobbins III WO, et al. Correlation of histopathologic evidence of disease activity with the presence of immunoglobulin-containing cells in the colons of patients with inflammatory bowel disease. Hum Pathol 1984; 15(8): 757-763.
23. Friedman LS, Richter JM, Kirkham SE, et al. 5-Aminosalicylic acid enemas in refractory distal ulcerative colitis: a randomized, controlled trial. Am J Gastroenterol 1986; 81(6): 412-418.
24. Gomes P, du Boulay C, Smith CL, et al. Relationship between disease activity indices and colonoscopic findings in patients with colonic inflammatory bowel disease. Gut 1986; 27(1): 92-95.
25. Saverymuttu SH, Camilleri M, Rees H, et al. Indium 111-granulocyte scanning in the assessment of disease extent and disease activity in inflammatory bowel disease. A comparison with colonoscopy, histology, and fecal indium 111-granulocyte excretion. Gastroenterology 1986; 90(5 Pt 1): 1121-1128.
26. Floren CH, Benoni C, Willen R. Histologic and colonoscopic assessment of disease extension in ulcerative colitis. Scand J Gastroenterol 1987; 22(4): 459-462.
27. Hanauer S, Schwartz J, Robinson M, et al. Mesalamine capsules for treatment of active ulcerative colitis: results of a controlled trial. Pentasa Study Group. Am J Gastroenterol 1993; 88(8): 1188-1197.
28. Sandborn WJ, Tremaine WJ, Schroeder KW, et al. Cyclosporine enemas for treatment-resistant, mildly to moderately active, left-sided ulcerative colitis. Am J Gastroenterol 1993; 88(5): 640-645.
29. Geboes K, Riddell R, Ost A, et al. A reproducible grading scale for histological assessment of inflammation in ulcerative colitis. Gut 2000; 47(3): 404-409.
30. Rutter M, Saunders B, Wilkinson K, et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology 2004; 126(2): 451-459.
31. Baars JE, Nuij VJ, Oldenburg B, et al. Majority of patients with inflammatory bowel disease in clinical remission have mucosal inflammation. Inflamm Bowel Dis 2012; 18(9): 1634-1640.
32. D’Haens GR, Geboes K, Peeters M, et al. Early lesions of recurrent Crohn’s disease caused by infusion of intestinal contents in excluded ileum. Gastroenterology 1998; 114(2): 262-267.
33. Nicholls S, Domizio P, Williams CB, et al. Cyclosporin as initial treatment for Crohn’s disease. Arch Dis Child 1994; 71(3): 243-247.
34. Breese EJ, Michie CA, Nicholls SW, et al. The effect of treatment on lymphokine-secreting cells in the intestinal mucosa of children with Crohn’s disease. Aliment Pharmacol Ther 1995; 9(5): 547-552.
35. Baars JE, Nuij VJ, Oldenburg B, et al. Majority of patients with inflammatory bowel disease in clinical remission have mucosal inflammation. Inflamm Bowel Dis 2012; 18(9): 1634-1640.
36. Marchal-Bressenot A, Salleron J, Boulagnon-Rombi C, et al. Development and validation of the Nancy histological index for UC. Gut 2017; 66(1): 43-49.
37. Mosli MH, Feagan BG, Zou G, et al. Development and validation of a histological index for UC. Gut 2017; 66(1): 50-58.
38. Jauregui-Amezaga A, Geerits A, Das Y, et al. A Simplified Geboes Score for Ulcerative Colitis. J Crohns Colitis 2017; 11(3): 305-313.
39. Bessho R, Kanai T, Hosoe N, et al. Correlation between endocytoscopy and conventional histopathology in microstructural features of ulcerative colitis. J Gastroenterol 2011; 46(10): 1197-1202.
40. Lemmens B, Arijs I, Van Assche G, et al. Correlation between the endoscopic and histologic score in assessing the activity of ulcerative colitis. Inflamm Bowel Dis 2013; 19(6): 1194-1201.
41. Fluxa D, Simian D, Flores L, et al. Clinical, endoscopic and histological correlation and measures of association in ulcerative colitis. J Dig Dis 2017; 18(11): 634-641.
42. Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987; 317(26): 1625-1629.
43. Wright R, Truelove SR. Serial rectal biopsy in ulcerative colitis during the course of a controlled therapeutic trial of various diets. Am J Dig Dis 1966; 11(11): 847-857.
44. Azad S, Sood N, Sood A. Biological and histological parameters as predictors of relapse in ulcerative colitis: a prospective study. Saudi J Gastroenterol 2011; 17(3): 194-198.
45. Zenlea T, Yee EU, Rosenberg L, et al. Histology Grade Is Independently Associated With Relapse Risk in Patients With Ulcerative Colitis in Clinical Remission: A Prospective Study. Am J Gastroenterol 2016; 111(5): 685-690.
46. Bitton A, Peppercorn MA, Antonioli DA, et al. Clinical, biological, and histologic parameters as predictors of relapse in ulcerative colitis. Gastroenterology 2001; 120(1): 13-20.
47. Hefti MM, Chessin DB, Harpaz NH, et al. Severity of inflammation as a predictor of colectomy in patients with chronic ulcerative colitis. Dis Colon Rectum 2009; 52(2): 193-197.
48. Burger DC, Thomas SJ, Walsh AJ, et al. Depth of remission may not predict outcome of UC over 2 years. J Crohns Colitis 2011; 5(S3): S4-5.
49. Bessissow T, Lemmens B, Ferrante M, et al. Prognostic value of serologic and histologic markers on clinical relapse in ulcerative colitis patients with mucosal healing. Am J Gastroenterol 2012; 107(11): 1684-1692.
50. Gupta RB, Harpaz N, Itzkowitz S, et al. Histologic inflammation is a risk factor for progression to colorectal neoplasia in ulcerative colitis: a cohort study. Gastroenterology 2007; 133(4): 1099-1105.
51. Irani NR, Wang LM, Collins GS. Correlation between Endoscopic and Histological Activity in Ulcerative Colitis using Validated Indices. J Crohns Colitis 2018; in press.
52. Travis SP, Schnell D, Krzeski P, et al. Reliability and initial validation of the ulcerative colitis endoscopic index of severity. Gastroenterology 2013; 145(5): 987-995.
53. D’Haens G, Van Deventer S, Van Hogezand R, et al. Endoscopic and histological healing with infliximab anti-tumor necrosis factor antibodies in Crohn’s disease: a European multicenter trial. Gastroenterology 1999; 116(5): 1029-1034.
54. Geboes K, Rutgeerts P, Opdenakker G, et al. Endoscopic and histologic evidence of persistent mucosal healing and correlation with clinical improvement following sustained infliximab treatment for Crohn’s disease. Curr Med Res Opin 2005; 21(11): 1741-1754.
55. Noble A, Turner D. Clinical indices for pediatric inflammatory bowel disease research. In: Mamula P, Markowitz JE, Baldassano RN, eds. Pediatric Inflammatory Bowel Disease (1st ed). New York, NY: Springer; 2008 : 507-530.
56. Ashton JJ, Coelho T, Ennis S, Vadgama B, Batra A, Afzal NA, Beattie RM. Endoscopic Versus Histological Disease Extent at Presentation of Paediatric Inflammatory Bowel Disease. J Pediatr Gastroenterol Nutr 2016; 62(2): 246-251.
57. Fernandes MA, Verstraete SG, Garnett EA, Heyman MB. Addition of Histology to the Paris Classification of Pediatric Crohn Disease Alters Classification of Disease Location. J Pediatr Gastroenterol Nutr 2016; 62(2): 242-245.
58. Levine A, Griffiths A, Markowitz J, et al. Pediatric modification of the Montreal classification for inflammatory bowel disease: the Paris classification. Inflamm Bowel Dis 2011; 17(6): 1314-1321.
59. Fabián O, Hradský O, Potužníková K, et al. Low predictive value of histopathological scoring system for complications development in children with Crohn’s disease. Pathol Res Pract 2017; 213(4): 353-358.
60. Daperno M, D’Haens G, Van Assche G, et al. Development and validation of a new, simplified endoscopic activity score for Crohn’s disease: the SES-CD. Gastrointest Endosc 2004; 60(4): 505-512.
61. Hyams JS, Ferry GD, Mandel FS, et al. Development and validation of a pediatric Crohn’s disease activity index. J Pediatr Gastroenterol Nutr 1991; 12(4): 439-447.
62. Mosli MH, Parker CE, Nelson SA, et al. Histologic scoring indices for evaluation of disease activity in ulcerative colitis. Cochrane Database Syst Rev 2017; 5: CD011256.
63. Novak G, Parker CE, Pai RK, et al. Histologic scoring indices for evaluation of disease activity in Crohn’s disease. Cochrane Database Syst Rev 2017; 7: CD012351.
64. D’Haens G, Sandborn WJ, Feagan BG, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132(2): 763-786.
65. D’Haens GR, Fedorak R, Lemann M,et al. Endpoints for clinical trials evaluating disease modification and structural damage in adults with Crohn’s disease. Inflamm Bowel Dis 2009; 15(10): 1599-1604.
66. Peyrin-Biroulet L, Bressenot A, Kampman W. Histologic remission: the ultimate therapeutic goal in ulcerative colitis? Clin Gastroenterol Hepatol 2014; 12(6): 929-934.
67. Villanacci V, Antonelli E, Geboes K, et al. Histological healing in inflammatory bowel disease: a still unfulfilled promise. World J Gastroenterol 2013; 19(7): 968-978.
68. Levine A, Koletzko S, Turner D, et al. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58(6): 795-806.
69. Gralnek IM, Defranchis R, Seidman E, Leighton JA, Legnani P, Lewis BS. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther 2008; 27(2): 146-154.
70. Gal E, Geller A, Fraser G, Levi Z, Niv Y. Assessment and validation of the new capsule endoscopy Crohn’s disease activity index (CECDAI). Dig Dis Sci 2008; 53(7): 1933-1937.
71. Ferrante M, de Hertogh G, Hlavaty T, et al. The value of myenteric plexitis to predict early postoperative Crohn’s disease recurrence. Gastroenterology 2006; 130(6): 1595-1606.
72. Pariente B, Mary JY, Danese S, et al. Development of the Lémann index to assess digestive tract damage in patients with Crohn’s disease. Gastroenterology 2015; 148(1): 52-63.
73. Fabián O, Hradský O, Dršková T, Mikuš F, Zámečník J, Bronský J. Immunohistochemical Assessment of CD30+ Lymphocytes in the Intestinal Mucosa Facilitates Diagnosis of Pediatric Ulcerative Colitis. Dig Dis Sci 2018; 63(7): 1811-1818.
74. Cuffari C. Diagnostic considerations in pediatric inflammatory bowel disease management. Gastroenterol Hepatol 2009; 11 : 775-783.
75. Winter DA, Karolewska-Bochenek K, Lazowska-Przeorek I, et al. Pediatric IBD-unclassified Is Less Common than Previously Reported; Results of an 8-Year Audit of the EUROKIDS Registry. Inflamm Bowel Dis 2015; 21(9): 2145-2153.
76. Martin-de-Carpi J, Rodriguez A, Ramos E, et al. The complete picture of changing pediatric inflammatory bowel disease incidence in Spain in 25 years
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2019 Issue 3-
All articles in this issue
- Monitor aneb nemělo by vám uniknout, že...
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Cytologické vyšetření mozkomíšního moku
- Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?
- Změny angiogeneze a imunitních regulací ve stromálním mikroprostředí kožních melanomů
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Metanefrický adenóm. Kazuistika a prehľad literatúry
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cytologické vyšetření mozkomíšního moku
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

