-
Medical journals
- Career
IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
Authors: Miroslav Hanuš 1; Michaela Matoušková 1; Vlasta Králová 1; Jan Hiblbauer, jr. 2; Jakub Szewczyk 3; Radek Sýkora 3; Riad Sabra 4; Peter Tomaštík 5; Jiří Paseka 6
Authors‘ workplace: Urocentrum, Praha 1; Sanus, Hradec Hrálové 2; Urologické oddělení, FN Ostrava 3; Urolog, Praha 4; Urohelp, Brno 5; Leading Clinical Research 6
Published in: Ces Urol 2015; 19(1): 33-43
Category: Original Articles
Overview
Infekce močových cest (IMC) zaujímají v evropských zemích i u nás dlouhodobě druhé místo ve výskytu infekčních onemocnění v populaci a představují tak významný socioekonomický problém. Spolu s respiračními infekty se rozhodující měrou podílejí na preskripci antimikrobiálních přípravků. Extenzivní antimikrobiální léčba je jednou z nejvýznamnějších příčin nárůstu bakteriální rezistence. Určitou možnost prevence recidiv infekcí dolních močových cest a snížení spotřeby antimikrobiálních preparátů představuje imunostimulace.
Prospektivní multicentrická studie hodnotila klinický účinek, snášenlivost a přínos k léčbě recidivujících zánětů při podávání imunostimulačního přípravku Urivac®.
Počet atak infekcí dolních močových cest se po imunostimulaci významně snížil jak v jejím průběhu, tak po jejím ukončení (p = 2,2x10-16). V průběhu imunostimulace bylo bez příznaků 85 % nemocných a při dalším sledování 70,8 %. Snížil se také počet aplikovaných antimikrobiálních přípravků. Subjektivní zlepšení přetrvávalo ve více než 57 % i po ukončení léčby. Mikrobiologická odpověď dosáhla 77 %, v odstupu od ukončení léčby se snižuje. U exacerbací byla uropatogenní flóra detekována v 61 %. Nežádoucí účinky u dvou nemocných vedly k předčasnému ukončení terapeutického režimu.KLÍČOVÁ SLOVA:
Imunomodulační léčba, bakteriální lyzát, recidivující infekce močových cest (RIMC).ÚVOD
Populace českých žen a mužů je s vysokou prevalencí postižena výskytem recidivujících infekcí dolních močových cest. Při léčbě těchto infekčních atak je významným medicínským problémem nárůst antimikrobiální rezistence. Projevuje se nezanedbatelný socioekonomický dopad na nemocnost, omezení intimního i společenského života nemocných s praktickou eliminací jejich sociálních nebo fyzických aktivit. Racionální diagnostické postupy a uvážlivá empirická i kauzální léčba omezují nárůst rezistence současně se snížením ceny léčby, ale praxe je jiná. Z přehledu použitých antimikrobiálních preparátů (tab. 1) vyplývá povážlivá dominance fluorochinolonů.
Table 1. Přehled antimikrobiální léčby v průběhu 12 měsíců před vstupem do studie Table 1. Overview of antimicrobial therapy within the 12 months prior to study entry 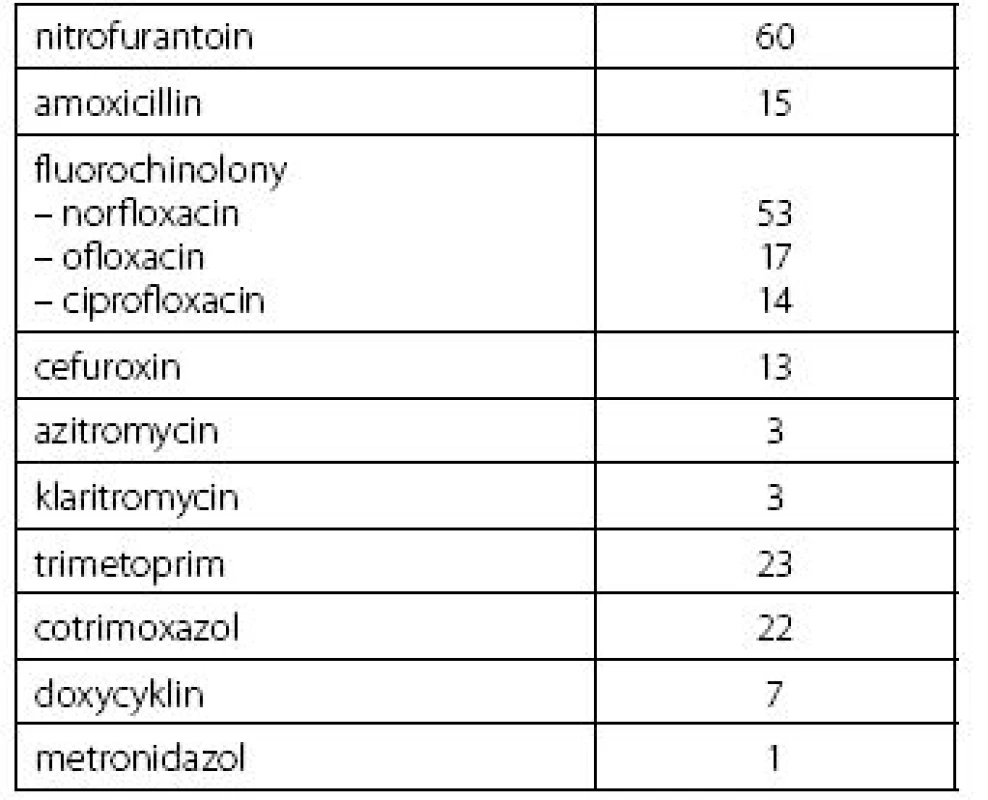
Nejčastějším patogenem komunitních močových infekcí je Escherichia coli, kterou detekujeme až u 75 % postižených. Do spektra enteropatogenů patří dále enterokoky, gram-negativní tyče (nejčastěji Klebsiella sp., Pseudomonas sp., Proteus sp.) a mikrokoky. U žen do 20 let je častým původcem cystitid též Staphylococcus saprophyticus. Význam těchto bakteriálních původců narůstá s nadužíváním antibiotik, protože se rychle stávají nositeli obtížně řešitelných rezistencí. Ze známých patofyziologických důvodů jsou daleko častěji infekcemi dolních močových cest postiženy ženy v reprodukčním věku. RIMC u nich charakterizují více než dvě ataky obtíží během šesti měsíců, nebo více než tři ataky během jednoho roku. Pro diagnózu je stěžejní klinická symptomatologie spolu s nálezem leukocyturie v močovém sedimentu. Mikrobiologický nález umožní hodnocení signifikantní bakteriurie, úpravu empiricky zahájené léčby a je určitým kritériem jejího hodnocení (tab. 2).
Table 2. Kritéria mikrobiologického hodnocení léčby močových infekcí (2) Table 2. The criteria for microbiological evaluation of the treatment of urinary tract infections (2) 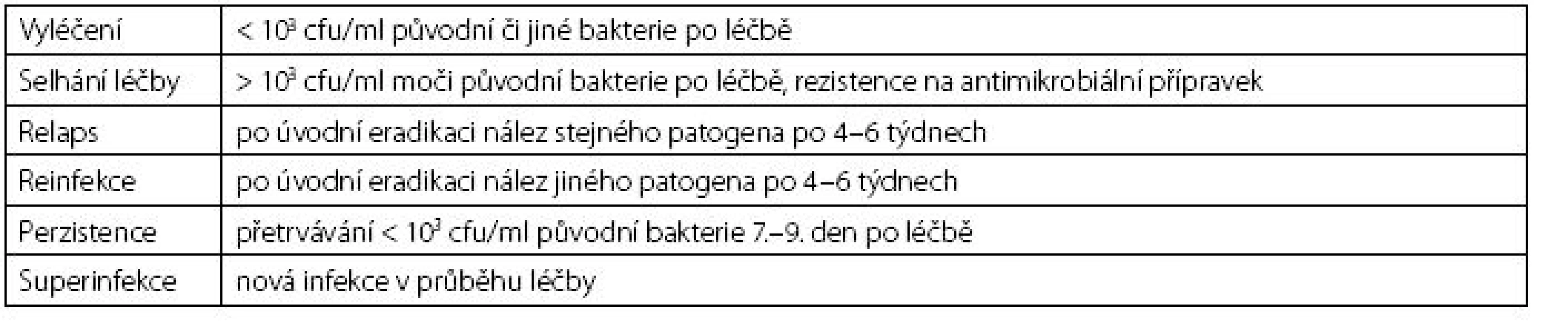
Stanovení diagnózy výlučně podle klinických příznaků není dostatečné a je zdrojem častých relapsů onemocnění a možných komplikací. U žen se IMC velmi často maskují močovým dyskomfortem bakteriální vaginózy. Bez její sanace bývá dlouhodobé ovlivnění mikční symptomatologie prakticky nemožné.
V léčbě RIMC je nezbytná uvážlivá volba antimikrobiální léčby. Velmi důležitá jsou také režimová opatření a podpůrná léčba. Jednou z možností prevence recidivujících atak infekce je imunostimulace, kterou se snažíme podnítit nebo zesílit imunitní odpověď (1).
IMUNITNÍ SYSTÉM A MOŽNOSTI JEHO OVLIVNĚNÍ
Počátky imunoterapie jsou datovány do roku 1893, kdy americký chirurg William B. Coley aplikoval živé či inaktivované kmeny Streptococcus pyogenes a Serratia marcescens pacientům s nádory. V protiinfekční imunitní odpovědi se uplatňují složky přirozené i specifické imunity. Patogenicita a virulence mikroorganizmu a obranyschopnost makroorganizmu se uplatňují v rozvoji infekce. Virulenci charakterizuje schopnost adherence bakterií k urotelu s následnou schopností intraepiteliální invaze. Kolonizaci umožňují adhezíny a invazíny mikroorganizmů. Mechanizmy nespecifické imunity se snaží ochránit tělesný povrch před působením mikrobů a při osídlení pak brání průniku do organizmu. Pokud přesto proniknou mikroorganizmy do vnitřního prostředí, snaží se bránit jejich dalšímu šíření a likvidovat je. Hlavním faktorem humorální imunity sliznic je hlen, substance sestávající se z polysacharidů, bílkovin a sekrečních protilátek sIgA. Chrání sliznice před poškozením, současně zabraňuje přístupu bakterií ke sliznicím a omezuje jejich adherenci na slizniční povrch. Součástí hlenu jsou baktericidní a bakteriostatické látky jako lysozym, laktoperoxidáza a laktoferin. Imunitní systém sliznic je nazýván MALT (musoca associated lymphoid tissue), jeho součástí jsou M buňky, makrofágy, buňky T, buňky B a sekretorické buňky (2). MALT je součástí ochrany sliznic dýchacích, trávicích a močových cest. Obranným faktorem je také oplachování sliznice dolních močových cest tekutinou (proudem moče) a významná je také obměna buněk sliznic s odlučováním urotelií.
Protiinfekční obranná reakce imunitního systému je vždy komplexní, zahrnující zapojení mechanizmů nespecifické i specifické (adaptivní) imunity.
METODIKA
Prospektivní multicentrická studie probíhala na pěti urologických pracovištích v České republice od dubna 2012 do dubna 2014. Nemocným s recidivujícími infekty dolních močových cest byl podáván bakteriální imunomodulátor Urivac®, přípravek vyrobený z usmrcených a různě tepelně opracovaných bakteriálních těl nebo některých jejich částí (bakteriální stěny, organely). Lyzát Urivac® je připravený z kmenů Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterococcus faecalis, Escherichia coli, Proteus mirabilis a Propionobacterium acnes. Je upraven do lékové formy kapslí. Podává se jedna kapsle ráno nalačno 10 dní a po 20denní pauze se režim opakuje. Základní kůra probíhá obvykle 3–6 měsíců, ve studii jsme volili šest měsíců.
Všichni nemocní podepsali souhlas se sledováním, léčebným režimem a vyplňováním karty pacienta. Všichni nemocní byli klinicky a mikrobiologicky vyšetřeni v den zařazení do studie – D0, po měsíci D30, dále pak v den D90, D180 a po roce D360. V případě klinických obtíží proběhlo mimořádné šetření spojené s opakovaným klinickým vyšetřením a vyšetřením moči. Způsob odběru moči byl ponechán na zvyklostech pracoviště, až ve 39 % zvolili lékaři katetrizaci.
Hodnotili jsme počet infekčních atak, počet dní s antimikrobiální léčbou, počet dní se symptomatickou léčbou, nežádoucí účinky léčby, subjektivní potíže a fyzikální nález u nemocných, včetně nálezů mikrobiologických.
Sledované hodnoty jsme posuzovali jak v souboru nemocných s imunostimulací, tak kontrolně v tomtéž souboru nemocných za posledních 12 měsíců před vstupem do studie, kdy byli léčeni jenom antimikrobiálními preparáty a symptomatickou léčbou. Porovnávat výsledky ve zkoumaném souboru nemocných proti nemocným s relapsem IMC bez léčby, nebo při podávání placeba, nebylo možné z etických důvodů. Studii vyhodnotila nezávislá statistická agentura.
SOUBOR NEMOCNÝCH
Do sledování bylo zařazeno 106 pacientů, z toho 87 žen a 19 mužů. Průměrný věk v souboru dosáhl 52,1 roku, byl vyšší u mužů 64,7 <27; 83> roku a nižší u žen 49,5 <19; 83> roku (graf 1). Rozdíl v průměrném věku mužů a žen byl signifikantní (p ≤ 0,002).
Graph 1. Věkové rozdělení souboru Graph 1. Age distribution of the cohort 
V uplynulých 12 měsících před zařazením do studie měli nemocní řadu infekčních atak léčených antimikrobiální léčbou (medián čtyři ataky) bez rozdílu mezi pohlavími (tab. 3, graf 2). Ženy stonaly déle než muži (p = 0,010) a infekční ataky omezily aktivity nemocných v průměru 19 dní u žen a 12,8 dní u mužů. Malý soubor nemocných mužů tvořili vesměs rizikoví nemocní s infravezikální obstrukcí. Ze souboru vybočoval 27letý nemocný s anamnestickou cystoprostatitidou s udávanými patnácti recidivami za rok, kterému byla antibiotická léčba mimo naše pracoviště indikována zřejmě až neúměrně často a který si posléze antibiotika „ordinoval“ sám.
Table 3. Počty nemocných v kohortách podle počtu atak IMC před zařazením do studie Table 3. The numbers of patients in the cohorts according to the number of UTI attacks prior to study enrolment 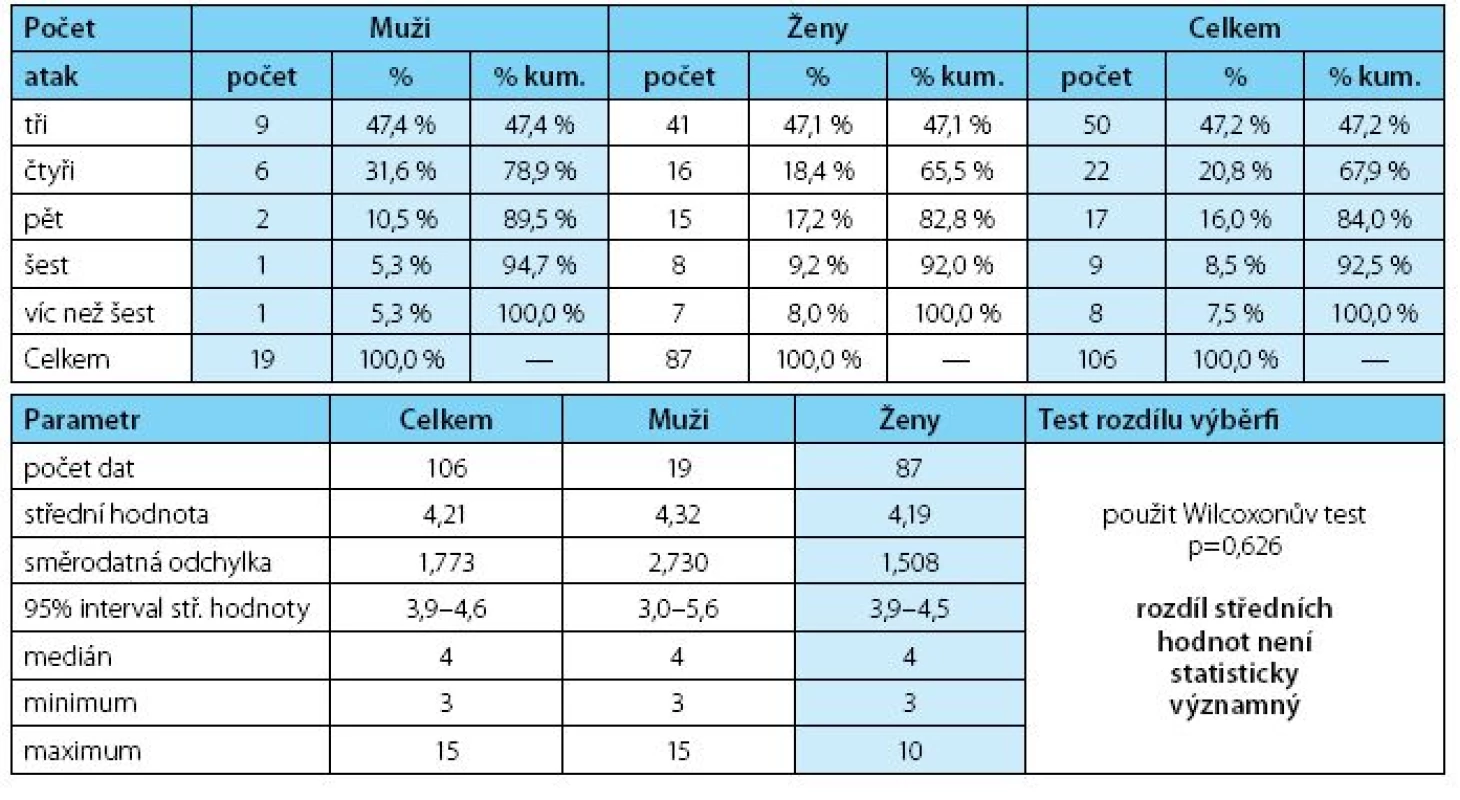
Graph 2. Počty nemocných v kohortách podle počtu atak IMC před zařazením do studie Graph 2. The numbers of patients in the cohorts according to the number of UTI attacks prior to study enrolment 
Ataky IMC byly v té době u všech nemocných léčeny jenom antimikrobiální léčbou (medián 25 dní <10; 260>) a nezjistili jsme statisticky významný rozdíl mezi muži a ženami (p = 0,484). Počet dní se symptomatickou léčbou byl vyšší, průměrná doba dosáhla 57,4 dne, a ani zde nebyl významný rozdíl mezi muži a ženami.
VÝSLEDKY
Pacienti byli sledováni v D0, D30, D90, D180 a D360 a mimořádnými kontrolami. Součástí kontrol bylo klinické vyšetření a vyšetření moči, včetně testování mikrobiologického.
Výskyt nových atak IMC
Hodnotili jsme výskyt nových infekcí v průběhu léčby a sledování nemocných při aplikaci lyzátu Urivac® a porovnali ho s kontrolním 12měsíčním obdobím před zahájením imunomodulace. Pro ověření přetrvávajícího efektu léčby jsme doplnili porovnání počtu infekcí během léčby (D0–D180) a v období následného sledování (D180–D360). Počet atak infekcí močových cest se signifikantně lišil v období léčby a sledování nemocných proti kontrolnímu období před imunostimulací (p = 2,2 x10-16), ale nebyl statisticky významný rozdíl mezi obdobím léčby a následným šestiměsíčním sledováním (tab. 4, graf 3).
Table 4. Hodnocení počtu atak močových infekcí Table 4. Evaluation of the number of urinary tract infection attacks 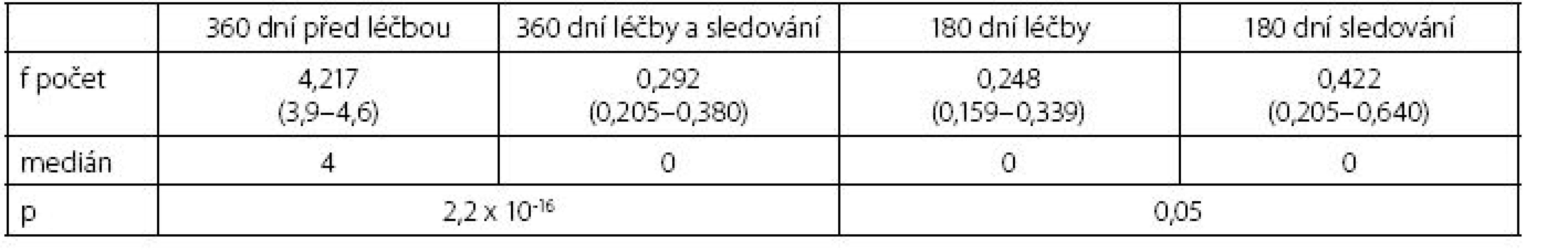
Graph 3. Počet atak močových infekcí – střední hodnoty a jejich 95% konfidenční intervaly Graph 3. The number of urinary tract infection attacks – the mean values and their 95% confidence intervals 
Antimikrobiální léčba IMC
V průběhu imunostimulace jsme zaznamenali významné snížení spotřeby antimikrobiálních preparátů (graf 4). Pouze 9 % nemocných potřebovalo antibiotickou léčbu ve dnech D0–D30, 11,6 % nemocných bylo léčeno ve dnech D30–D90. Ve fázi sledování po ukončení imunostimulace ve dnech D180–D360 nepotřebovalo antimikrobiální léčbu 76,1 % nemocných s anamnézou RIMC.
Graph 4. Antimikrobiální léčba IMC – dny Graph 4. Antimicrobial therapy of UTIs – days 
Symptomatická léčba IMC
V průběhu imunostimulace významně poklesl také počet dnů se symptomatickou léčbou IMC (graf 5). Analýza prokázala, že statisticky významně nejčetněji je s potřebou symptomatické léčby zastoupen počet „žádný“ (p ≤ 0,003). Podíl této nejčetnější kategorie byl ve všech čtyřech sledovaných obdobích obdobný. Pohyboval se mezi 71,4–77,4 % a minimální rozdíly nebyly signifikantní (p ≤ 0,622).
Nežádoucí účinky léčby
U dvou nemocných byl v protokolu od ošetřujícího lékaře zaznamenán nežádoucí účinek. V jednom případě šlo o „dechové potíže“ s předpokládanou alergickou etiologií. U ženy ve věku 67 let ale léčba nebyla přerušena. Ve druhém případě, u muže ve věku 83 let, šlo o úpornou obstipaci ve 2. měsíci léčby a na žádost nemocného byla léčba ukončena.
Graph 5. Symptomatická léčba IMC – dny Graph 5. Symptomatic treatment of UTIs – days 
Přerušení léčby
U jedné nemocné (25 let) byla léčba předčasně ukončena pro graviditu, druhá (25 let) změnila bydliště a léčbu ukončila na vlastní žádost, třetí (72 let) ukončila předčasně léčbu pro zhoršení celkového stavu.
Subjektivní hodnocení léčby nemocnými
Subjektivní hodnocení léčby nemocnými je jedním z klíčových parametrů (graf 6).
Graph 6. Subjektivní hodnocení léčby nemocnými Graph 6. Patients‘ subjective evaluation of treatment 
Statistická analýza souboru prokázala, že při první návštěvě nebyl signifikantní rozdíl mezi zlepšením a zhoršením subjektivního stavu nemocných (p ≤ 0,857). U všech následujících kontrol potom významně převažuje zlepšení (p ≤ 2,2 x 10-16). Subjektivní hodnocení se s narůstajícím časem (v průběhu kontrol) statisticky významně zlepšuje. Lze to doložit závěrem korelační analýzy, která predikuje pro Pearsonův korelační koeficient statisticky významnou závislost (p ≤ 0,020). Pearsonův korelační koeficient vyjadřuje sílu lineární závislosti mezi dvěma veličinami. Pokud spolu totiž dva jevy korelují, pak jsou pravděpodobně provázané (závislé), ale nelze z toho soudit na kauzální souvislost, tj. že by jeden jev byl příčinou a druhý následkem.
DISKUZE
Imunostimulační léčba představuje podání látek, u kterých je doložen stimulační vliv na imunokompetentní buňky, což se v důsledku projeví zvýšenou tvorbou a dozráváním těchto buněk, jejich zvýšenou funkční aktivitou nebo zvýšenou produkcí jejich mediátorů. Je možno k nim řadit již výše zmíněné transfer faktory, očkování živými, ale i oslabenými, usmrcenými a/nebo subjednotkovými vakcínami.
V této skupině látek bude zřejmě budoucnost patřit specifickým stimulačním faktorům, jako jsou interleukíny a faktory stimulující kolonie, z nichž se již nyní používá na specializovaných pracovištích erytropoetin, G-CSF (faktor stimulující tvorbu kolonií granulocytů) a GM-CSF (faktor stimulující tvorbu kolonií granulocytů a monocytů) u těžkých granulocytopenií nebo interleukin IL-2 ke stimulaci LAK buněk (lymphokine activated killer cells) k lokální léčbě (3).
Mezi nejčastěji používané syntetické preparáty patří Isoprinosine (inosinum pranobexum). Účinek tohoto léku je virostatický a imunostimulační se zaměřením na buněčnou imunitní odpověď, tedy aktivaci T a B lymfocytů a přirozených zabíječů – NK buněk (3).
V běžné klinické praxi se k imunostimulaci používají hlavně komerční bakteriální imunomodulátory, individuálně vyráběné autovakcíny a zásobní (stock) vakcíny.
Bakteriální imunomodulační vakcíny jsou běžně připravovány podle standardní metodiky „Návrh na štandardné metódy prípravy bakteriových imunomodulačných stock vakcín“, vydané jako příloha č. 2/1991 k Acta hygienica, epidemiologica et microbiologica (4).
V protinádorové léčbě se dosud používá upravená BCG vakcína, která se uplatňuje při identifikaci a likvidaci zbylých nádorových buněk po odstranění hlavní nádorové masy solidních nádorů (5). Přípravek Immucyst se používá při léčbě karcinomu močového měchýře, kde v dutině po odstraněném nádoru aktivuje místní složky přirozené imunity.
Terapie bakteriálními lyzáty (Ribomunyl, Broncho-Vaxom, Luivac) se osvědčila především v léčení recidivujících infekcí respiračního traktu (6, 7, 8), ale bakteriální lyzáty jsou dostupné také v urologii. Je to nejdéle používaný Uro-Vaxom, NefroVaxin HP a zkoumaný Urivac® s nejširším spektrem lyzátů (8).
Jedna tobolka Uro-Vaxomu obsahuje 60 mg složky OM-89 cryodesiccatum, které odpovídá 6 mg lyzátu Escherichiae coli, která je predominantním vyvolavatelem nekomplikovaných i komplikovaných zánětů močových cest, i když Klebsiella sp., Proteus sp. a Enterococcus faecalis se vyskytují ve zvýšené frekvenci v komplikovaných IMC (8). Terapeutickou indikací je použití v rámci prevence opakujících se infekcí močových cest a výjimečně jako přídatná léčba při léčbě akutních infekcí močových cest. Využití imunostimulace u akutních forem urologických zánětů není běžně užívaná praxe. Naopak u recidivujících cystitid je imunostimulační léčba zásadní a měla by být nemocným nabízená jako standardní (9).
Ve velké evropské randomizované dvojitě zaslepené studii složka OM-89 signifikantně snižovala výskyt recidivující močové infekce během 12 měsíců trvání studie. Výsledky potvrdily, že složka OM-89 je cennou komponentou řešení recidivující močové infekce (10).
NefroVaxin HP obsahuje kombinaci purifikovaných lyzátů ze šesti mikroorganizmů (Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterococcus faecalis, Escherichia coli, Proteus mirabilis, Propionibacterium acnes) a obsahuje také beta glukan. Užívá se ve stejném schématu podávání jako Urivac® po dobu tří měsíců. Po dvouměsíční přestávce se doporučuje terapii zopakovat (8).
V současné době EAU guidelines doporučují antibiotickou profylaxi v prevenci recidivující močové infekce jako primární strategii (11). Obdobný postup předpokládají i Doporučené postupy pro praktické lékaře v ČR (12). Při faktu, že stále více uropatogenů se stává rezistentních k určitým typům antimikrobiálních preparátů, zvažují se také alternativní profylaktické strategie. Jednou z takových možností je perorální podávání imunoaktivních frakcí Escherichia coli, eventuálně bakteriálních lyzátů z kmenů nejčastějších původců IMC (12, 13).
Při podezření na vrozený imunodeficit, kdy novorozenec neprospívá a trpí častými infekcemi již od narození (pneumonie, otitidy, kožní infekce, vážnější infekce GIT, výrazné reakce na očkování), je imunologické vyšetření jednoznačně indikováno a imunomodulační léčba se potom vede podle výsledků vyšetření a pod dohledem alergologa/klinického imunologa. U nemocného, který se v předškolním a školním období vyvíjí standardním způsobem s běžně probíhajícími infekcemi, je možné základní imunomodulaci (trvající 3–4 měsíce) indikovat bez imunologického vyšetření (14).
Imunomodulaci vakcínou považoval za alternativu antibakteriální profylaxe a léčby recidivujících uroinfekcí již Rugendorff v roce 1992 (15). Tento terapeutický postup zvyšuje hladinu interferonů v séru, počet T-lymfocytů, sekreci IgA na sliznici močových cest a výrazně snižuje počet RIMC (16). Ačkoliv experimentálních i klinických údajů o účinnosti takovéhoto postupu přibývá, je třeba v dalších studiích získat naprosto přesvědčivé důkazy o tom, že tato strategie je v prevenci RIMC obdobně efektivní jako profylaxe antibiotická (17). Významnou profylaxí recidivující IMC je racionální antibiotická léčba akutních IMC. Samozřejmou součástí všech imunostimulačních postupů je posléze dodržování režimových opatření nemocnými, nepřecházení nemocí a jejich doléčení (5). V době, kdy většina jedinců nedodržuje pravidelnou životosprávu, při interkurentních infekcích opakovaně onemocnění přemáhá, nedodržuje klid na lůžku při febrilním onemocnění, které se od samého počátku léčí antibiotiky, se nelze divit, že odolnost populace klesá. U nemocných s anamnézou vleklých obtíží a s podezřením na intracelulární přežívání E. coli je vhodné použít dlouhodobější dávkování imunomodulátorů bakteriálního původu v horizontu 9–12 měsíců (18). Zatím spíše experimentální cestou v řešení RIMC je možnost obnovení správné funkce urotelu reparací glykosaminové (GAG) vrstvy ve struktuře urotelu. Jejími zásadními komponentami jsou aminosacharidy kyselina hyaluronová (HA) a chondroitinsulfát (CS). Rejchrt a spol. letos prokázali, že intravezikální terapie kyselinou hyaluronovou a chondroitinsulfátem vede dokonce i u nemocných po míšním poranění na režimu čisté intermitentní autokatetrizace k významnému snížení výskytu recidivujících symptomatických uroinfekcí a menšímu podílu multirezistentních patogenů při chronické kolonizaci dolní močových cest (19).
ZÁVĚRY
Urivac® obsahuje 5 mg bakteriálního lyzátu z kmenů nejčastějších původců urologických zánětů (Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterococcus faecalis, Escherichia coli, Proteus mirabilis, Propionibacterium acnes). Podává se ve tříměsíčním režimu a v průběhu roku je ho možné použít opakovaně (20). Podávání provází signifikantní pokles počtu infekčních atak (p = 2,2 x 10-16), který přetrvává i po ukončení léčby se subjektivním zlepšením v 57 %. V době léčby bylo bez příznaků 85 % nemocných, při dalším sledování 70,8 %. Významně se snížil počet dní vynucené antimikrobiální i symptomatické léčby. Mikrobiologická odpověď dosahuje 77 %, v odstupu od ukončení léčby se snižuje. U exacerbací byla uropatogenní flóra detekována v 61 %. Nežádoucí účinky u dvou nemocných vedly k předčasnému ukončení terapeutického režimu. Polyvalentní lyzáty jsou jednou z alternativ v profylaxi RIMC. Urivac® je takovou významnou možností s předpokladem dobré klinické odpovědi.
Došlo: 2. 3. 2015
Přijato: 21. 3. 2015
Kontaktní adresa:
MUDr. Michaela Matoušková
Urocentrum Praha
Karlovo náměstí 3,
120 00 Praha 2
e-mail: matouskova@urocentrum.cz
Střet zájmů: žádný.
Prohlášení o podpoře:
Zpracování tohoto sdělení nebylo podpořeno žádnou společností.
Sources
1. Bystroň J. Recidivující infekce a možnosti jejich ovlivnění imunomodulací. Med. Praxi 2010; 7(3): 115–121.
2. Bartoníčková K. Uroinfekce. Galén 2000, 79 s.
3. Petanová J. Imunostimulační terapie, rizika, přínosy, současné možnosti. Interní Med. 2011; 13 (9): 343–346.
4. Kotulová D. Návrh na štandardné metódy prípravy baktériových imunomodulačných stock vakcín. Acta Hygienica, Epidemiologica et Microbiologica, příloha č. 2, 1991. Praha: Inst. hygieny a epidemiologie.
5. Conti-Freitas LC, Foss-Freitas MC, et al. Effect of BCG stimulus on proinflammatory cytokine production in laryngeal cancer. Cancer Immunol Immunother. 2009; 58 : 25–29.
6. Fučíková T. Imunomodulace. In: Klinická imunologie v praxi (2. vydání). Praha: Galén; 1997 : 280–318.
7. Bystroň J. Bakteriální imunomodulátory – současné použití v klinické praxi. Remedia 2010; 20 : 298–304.
8. Petanová J. Imunostimulační léčba v urologii. Urol. praxi, 2013; 14(3): 100–103.
9. Bartoníčková K. Komentář k článku Petanové J. „Imunostimulační léčba v urologii“. Urol. praxi, 2013; 14(3): 103.
10. Bauer HW, Alloussi S, Egger G, et al. A Long-Term, Multicenter, Double-Blind Study of an Escherichia Coli Extract (OM-89) in Female Patients with Recurrent Urinary Tract Infections. European Urology, 2005; 47 : 542–548.
11. Grabe M, Bartoletti R, Bjerklund-Johansen TE, et al. Guidelines on Urological Infections. European Association of Urology 2014. http://uroweb.org/guideline/urological-infections/
12. Karen I, Kolek V, Matoušková M, et al. Antibiotická terapie respiračních, močových a kožních infekcí v ordinaci všeobecného praktického lékaře. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře, aktualizace 2014 : 31.
13. Ha US, CHo YH. Immunostimulation with Escherichia coli extrakt: prevention of recurrent urinary tract infections. International J Antimicrob Agent 2008; 31 (Suppl 1): S63–67.
14. Bystroň J. Využití bakteriálních lyzátů v klinické praxi. Interni Med. 2012; 14 (1): 12–17.
15. Rugendorff EW. Immunological therapy of recurrent urinary tract infections with immunoactive E. coli fractions in women. Intern. Urogynecol. J. 1992; 3 : 174–184.
16. Sabra R. Vezikoureterální reflux, refluxová nefropatie a močové infekce. Praha 1995, Maxdorf-Jessenius.
17. Cruz F, Dambros M, Naber KG, et al. Recurrent Urinary Tract Infections: Uro-Vaxom, a New Alternative. European Urology 2009; Supplements, 8 : 762–768.
18. Bartoníčková K. Léčení infekcí močových cest v éře narůstající rezistence na antibiotika. Je imunomodulace smysluplná? Ces Urol, 2009; 1(13): 19–20.
19. Rejchrt M, Havlová K, Kříž J. Prevence recidivujících uroinfekcí intravezikální instilací kyseliny hyaluronové a chondroitinsulfátu u pacientů po míšním poranění. Urol. praxi 2015; 16(1): 43.
20. Proč užívat URIVAC. http://www.bioveta.cz/cs/humanni-divize/urivac.
Labels
Paediatric surgery Paediatric urologist Surgery Nephrology Urology
Article was published inCzech Urology

2015 Issue 1-
All articles in this issue
- VLIV VOLNÝCH RADIKÁLŮ NA FERTILITU MUŽE A MOŽNOSTI LÉČBY
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- VÝZNAM STANOVENÍ MOČOVÉ HLADINY TATI (TUMOUR ASSOCIATED TRYPSIN INHIBITOR) PRO DIAGNOSTIKU A PROGNÓZU TUMORŮ MOČOVÉHO MĚCHÝŘE
- KOMUNIKACE MEZI UROLOGEM A PACIENTEM S RAKOVINOU PROSTATY V PRŮBĚHU LÉKAŘSKÉ KONZULTACE
- KOMPLIKACE PO RADIKÁLNÍ PROSTATEKTOMII OTEVŘENÝM A LAPAROSKOPICKÝM PŘÍSTUPEM, SROVNÁNÍ VÝSLEDKŮ PODLE CLAVIENOVA SYSTÉMU KLASIFIKACE
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
- RYCHLE PROGREDUJÍCÍ UROTELIÁLNÍ TUMOR PÁNVIČKY LEVÉ LEDVINY S TROMBÓZOU VENA CAVA INFERIOR
- JEDNOPORTOVÁ LAPAROSKOPICKÁ (LESS-LAPARO-ENDOSCOPIC SINGLE-SITE SURGERY) NEFREKTOMIE
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

