-
Medical journals
- Career
Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
Authors: S. Kaprálová; B. Ludíková; E. Klásková; A. Palátová
Authors‘ workplace: Dětská klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého, Olomouc
Published in: Čes-slov Pediat 2021; 76 (6): 330-334.
Category: Review
Overview
Péče o pacienty s vrozenými srdečními vadami by měla být komplexní a cílená nejen na vadu samotnou, ale i na rozmanité spektrum přidružených diagnóz, které mohou zásadně ovlivnit morbiditu a mortalitu. Sideropenická anémie je závažnou přidruženou diagnózou, která u pacientů s cyanotickými srdečními vadami prohlubuje hypoxii tkání a u vad s významným levopravým zkratem přispívá k rozvoji srdečního selhání.
Autoři předkládají stručný přehledový článek této problematiky.
Klíčová slova:
sideropenie – sideropenická anémie – vrozené srdeční vady s levopravým zkratem – cyanotické vrozené srdeční vady
ÚVOD
Vrozené srdeční vady (VSV) patří mezi nejčastější kongenitální defekty v lidské populaci [1]. V České republice se jejich prevalence před plošným rozšířením prenatální diagnostiky pohybovala přibližně kolem 6 novorozenců na 1000 živě narozených, v posledních letech výskyt VSV z tohoto důvodu zaznamenává klesající trend [2, 3]. Díky špičkové kardiochirurgické operativě a perioperační péči o tyto pacienty došlo k signifikantnímu poklesu jejich mortality.
Úkolem pediatra je ve spolupráci s dětským kardiologem a kardiochirurgem léčit také přidružená onemocnění, která mohou zhoršovat kvalitu života a prognózu pacienta s vrozenou srdeční vadou. To je klíčové zejména u pacientů s kritickými srdečními vadami (30 % všech VSV), které se manifestují projevy srdečního selhání, centrální cyanózou nebo jejich kombinací a musí být chirurgicky vyřešeny v prvním roce života [3]. Jednou z přidružených diagnóz, která prokazatelně zhoršuje mortalitu i morbiditu těchto pacientů, je sideropenická anémie [3, 4].
Sideropenická anémie vzniká poruchou syntézy hemoglobinu v důsledku vyčerpání zásob železa. Řadí se tak mezi anémie z poruchy erytroidní maturace a je vůbec nejčastějším typem anémie dětského věku v celosvětovém měřítku [5, 6]. Nejčastější příčinou deplece zásobního železa je jeho nedostatečný přívod ve stravě v situaci jeho zvýšené spotřeby v důsledku vyšších nároků na tvorbu hemoglobinu. Prvního vrcholu dosahuje výskyt sideropenické anémie mezi šesti měsíci až třetím rokem života bez rozdílu pohlaví, druhý vrchol připadá na období puberty s vyšším zastoupením u dívek [6]. K typickým projevům sideropenické anémie patří bledost kůže a sliznic, únava, slabost, vertigo, padání vlasů, snížená kvalita nehtů, atrofie papil jazyka a zvýšená náchylnost k rozvoji infekcí [6]. U kojenců vede sideropenická anémie k opoždění psychomotorického vývoje, u starších dětí je popisováno snížení intelektuální výkonosti či poruchy pozornosti [7].
V případě kritických srdečních vad má udržení optimální hladiny hemoglobinu zásadní vliv na hemodynamiku VSV, který se liší podle typu vady. Ve skupině vad s významným levopravým zkratem sideropenická anémie vede k hyperkinetické cirkulaci, která navyšuje metabolické nároky myokardu a potencuje tak rozvoj srdečního selhání, u cyanotických VSV prohlubuje anémie tkáňovou hypoxii [3].
SIDEROPENICKÁ ANÉMIE U VROZENÝCH SRDEČNÍCH VAD S VÝZNAMNÝM LEVOPRAVÝM ZKRATEM
Vznik sideropenické anémie u pacientů s VSV s významným levopravým zkratem je multifaktoriální etiologie. Uplatňují se mechanismy platné v obecné populaci, jako je vyčerpání zásob železa typicky v kojeneckém věku vlivem tělesného růstu, spolu s fyziologickým poklesem hemoglobinu kolem třetího měsíce života (tzv. anémie tříměsíčního období) [3, 8]. Na druhou stranu existují i mechanismy specifické pro pacienty s VSV, jako je malnutrice způsobená vlivem zvýšených metabolických nároků daných vadou samotnou v kombinaci se sníženým perorálním příjmem, jehož limitací je především tachydyspnoe jako jeden z projevů počínajícího selhání levé komory při významném levopravém zkratu [9].
Diagnostika sideropenické anémie ve skupině pacientů s významným levopravým zkratem se neliší od diagnostických kritérií, která jsou platná v běžné populaci. Deficit zásobního i erytrocytárního železa se v krevním obraze manifestuje sníženou hladinou hemoglobinu, hematokritu, počtu erytrocytů, dále mikrocytózou a hypochromii erytrocytů. Jednoznačně potvrdí diagnózu sideropenické anémie alterované parametry metabolismu železa (pokles hladiny sérového železa, zvýšení celkové vazebné kapacity transferinu, nízká hladina feritinu a zvýšená hladina solubilních transferinových receptorů). V recentně publikované studii z roku 2020, která se zabývá vztahem sideropenie a srdečního selhání v dětském věku, bylo zjištěno, že pouze u poloviny pacientů s laboratorně prokázanou sideropenií nakonec došlo k poklesu hladiny hemoglobinu a k mikrocytóze. Na základě tohoto závěru autoři doporučují u pediatrických pacientů se srdečním selháním, což je i případ vad s významným levopravým zkratem (např. hemodynamicky významný defekt komorového septa), cíleně vyšetřovat panel parametrů metabolismu železa za účelem časného záchytu sideropenie před případným rozvojem anémie [10].
Substituci preparáty železa je doporučeno zahájit perorálně v dávce 3–6 mg/kg/den již při laboratorních známkách sideropenie, a to až do operační korekce vady. Preparáty, které lze využít v pediatrické populaci k substituci, jsou uvedeny v tabulce 1.
Table 1. Přehled běžně používaných přípravků obsahující železo v pediatrické praxi.
(Převzato a upraveno dle: Alušíková M, Petráček J, Kotulková M et al. Léčba sideropenické anémie v dětském věku. Farmakoterapeutické informace. Měsíčník pro lékaře a farmaceuty 2015; 12: 1–4.)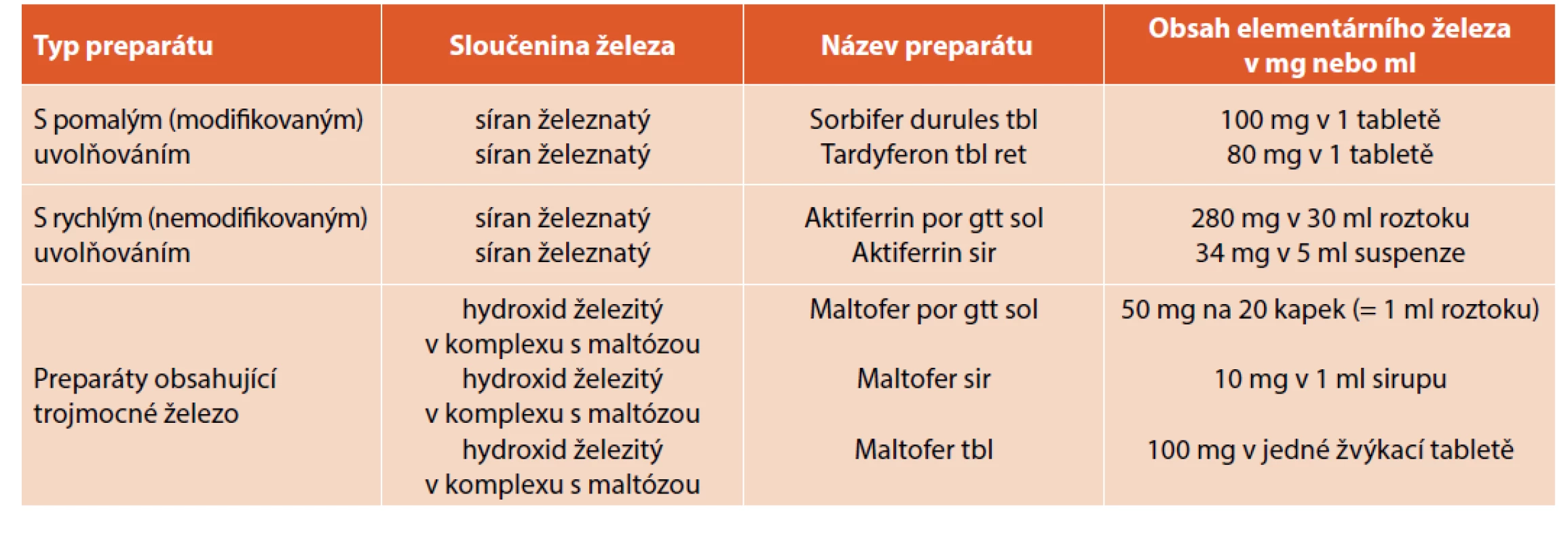
SIDEROPENICKÁ ANÉMIE U VROZENÝCH SRDEČNÍCH VAD CYANOTICKÝCH
V případě cyanotických VSV se na vzniku sideropenické anémie navíc, mimo již zmíněné příčiny, podílí mechanismus sekundární erytropoézy. Vlivem chronické hypoxie stoupá produkce erytropoetinu v ledvinách, jejímž cílem je udržet adekvátní oxygenaci tkání [11]. Vystupňovaná sekundární erytropoéza v kombinaci s deficitem zásob železa vede k rozvoji anémie. S tímto mechanismem vzniku sideropenické anémie se setkáváme v našich podmínkách u pacientů s cyanotickou VSV, jejíž řešení je pouze paliativní (tzn. že nebylo dosaženo plné saturace hemoglobinu v systémovém oběhu, na obrázku 1 je zachycen typický příznak chronické hypoxie u pacienta po paliativním operačním řešení komplexní cyanotické VSV) a u skupiny pacientů s nepoznanou srdeční vadou s původně levopravým zkratem, vedoucí v čase k rozvoji plicní cévní choroby s plicní hypertenzí a změnou zkratu na pravolevý při suprasystémových hodnotách tlaku v plicním řečišti, tzv. Eisenmengerův syndrom [12].
Image 1. Paličkovité prsty s nehty tvaru hodinového sklíčka jako projev chronické hypoxie u pacienta s komplexní cyanotickou vrozenou srdeční vadou po paliativní operační korekci.
Fig. 1. Clubbed fingers as a symptom of chronic hypoxia in patient with complex cyanotic congenital heart defect after palliative cardiac surgery.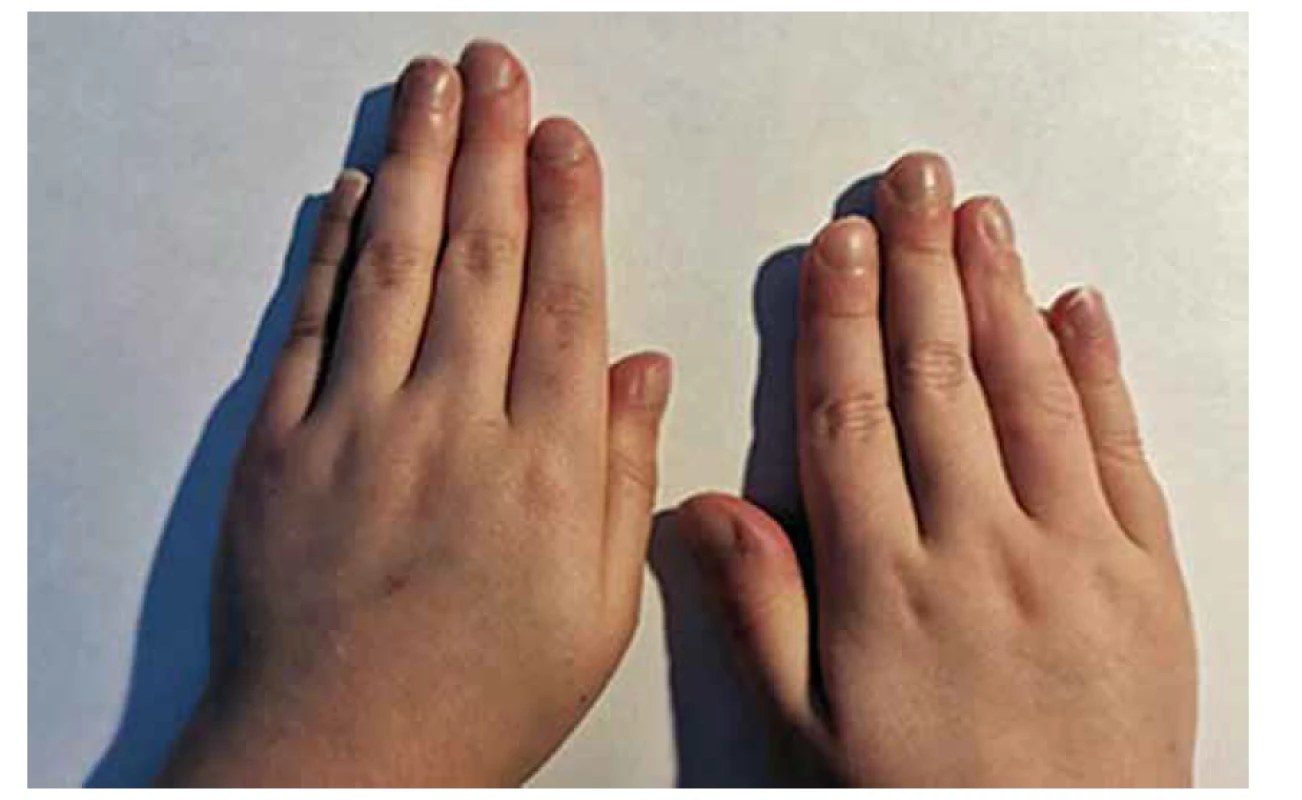
Sekundární erytropoéza u cyanotických VSV ohrožuje pacienta kromě sideropenické anémie také rizikem hyperviskózního syndromu, v jehož důsledku se oxygenace cílových tkání nadále zhoršuje. Navíc mikrocytární populace červených krvinek při sideropenické anémii je méně deformabilní během průchodu mikrocirkulací, čímž dál narušuje již alterované reologické vlastnosti krve a prohlubuje hypoxii tkání, vede k metabolické acidóze, hypoxickým záchvatům nebo tromboembolickým komplikacím, a to zejména ve věkové skupině dětí mladší čtyř let [11, 13].
Literatura zabývající se výskytem sideropenické anémie u pediatrických pacientů s cyanotickými VSV poskytuje rozmanitá data. Stejně jako v obecné populaci závisí její výskyt na úrovni životních podmínek dané země, na věku studované populace a také na stáří publikovaných studií a v neposlední řadě také na definici, v řadě studií je vyjádřena prevalence nikoliv sideropenické anémie, ale pouze sideropenie. Turecká studie z roku 2016 prokázala sideropenii až u poloviny pacientů s cyanotickými VSV (průměrný věk pacientů ve studii byl 10 roků), recentní studie z Nigérie publikovaná v roce 2019 odhalila významně nižší prevalenci pouze kolem 10 % (průměrný věk pacientů ve studii byl 4 roky) [14, 15].
Diagnostická kritéria sideropenické anémie se v případě cyanotických VSV na rozdíl od skupiny VSV s levopravým zkratem liší. Určující není počet erytrocytů, hladina hemoglobinu nebo hematokritu, i v případě již přítomné anémie se pohybují vlivem chronické hypoxie často v rozmezích fyziologických pro danou věkovou skupinu [16]. Navíc žádoucí je zachytit sideropenii ještě před rozvojem anémie. Terlemez et al. ve své práci navrhuje pro detekci sideropenie u pediatrických pacientů s cyanotickými VSV využít kombinaci parametrů MCH (průměrné množství hemoglobinu v buňce), MCV (střední objem erytrocytu) a hladiny feritinu. MCH pod 28 pg, MCV pod 82,8 fl a hladinu feritinu pod 12 μg/l s vysokou senzitivitou a specificitou detekuje dle publikované studie přítomnost sideropenie [14]. Za spolehlivý ukazatel časné fáze sideropenie je uváděna také vysoká hodnota RDW (šíře distribuce erytrocytů odrážející míru anizocytózy), vyšetření RDW je jednoduché a také ekonomicky nenáročné, vhodné jako screeningové vyšetření především pro rozvojové země [17]. V našich podmínkách by mělo být součástí rutinní diagnostiky především kompletní vyšetření parametrů metabolismu železa [18, 19].
Léčebnou strategií je v případě průkazu sideropenické anémie i sideropenie substituce preparáty železa. Diskutovaným rizikem této léčby je u pacientů s cyanotickými VSV možné prohloubení hyperviskózního syndromu při dostatečné nabídce železa organismu. Ve studii autorky Terlemez et al. perorální substituce preparáty železa v dávce 4 mg/kg/den rozdělené do dvou dávek po dobu tří měsíců vedla k vzestupu hladiny hemoglobinu a hematokritu, přičemž nedošlo ke zhoršení projevů hyperviskózního syndromu, naopak byl zaznamenán ústup symptomů (např. rozmazaného vidění, tinnitu nebo bolesti hlavy) [14]. Srovnatelné výsledky přinesla i studie u dospělých pacientů s cyanotickými VSV [20]. Dříve užívaná metoda venepunkce ke zmírnění příznaků hyperviskózního syndromu je ve světle recentních poznatků považována za obsolentní [21].
Otázkou pro další výzkum zůstává, zda by ze substituce železem neprofitovala i skupina pacientů s cyanotickými VSV bez laboratorních známek sideropenie. Dvě turecké studie věnující se této problematice prokázaly depleci zásob železa v čase u pediatrických pacientů s cyanotickými VSV a navrhují i při absenci sideropenie zahájit substituci preparáty železa [14, 16]. Substituce železem průkazně zmírňuje příznaky hyperviskózního syndromu, vede tak ke zlepšení kvality života, k lepší výkonnosti a nárůstu saturací u pacientů s plicní arteriální hypertenzí [14, 20].
Diskutován je také způsob substituce, zatímco ve studiích u pediatrických pacientů je voleno perorální podání, ve studii Blanche et al. u dospělých pacientů z roku 2018 je doporučeno parenterální podání železa [19]. Za důvod neefektivní perorální substituce se považuje neadekvátně zvýšená hladina hepcidinu, který plní roli významného regulátoru v metabolismu železa prostřednictvím snížení absorpce železa z gastrointestinálního traktu a zvýšení jeho ukládání do buněk [22]. Za příčinu neadekvátně zvýšené hladiny hepcidinu u cyanotických VSV je považována chronická hypoxie [19].
ZÁVĚR
Sideropenická anémie u pacientů s VSV s významným levopravým zkratem i s vadami cyanotickými může významně ovlivňovat jejich další prognózu. Mechanismus vzniku sideropenické anémie je u pacientů s VSV komplexní a kromě obecně dobře známých faktorů (progresivní růst v kojeneckém věku, anémie tříměsíčního období) se u pacientů s VSV na jejím vzniku uplatňují i specifické příčiny, jako je malnutrice a v případě cyanotických VSV sekundární erytropoéza vyvolaná vlivem chronické hypoxie [11].
Optimální je u obou skupin VSV detekovat nedostatek železa ještě před rozvojem anémie. U vad s významným levopravým zkratem by tak měl být pravidelně kontrolován nejen krevní obraz, ale i panel parametrů metabolismu železa až do operační korekce vady. Ve skupině cyanotických VSV na základě recentně publikovaných studií lze doporučit k diagnostice využívat rovněž parametrů metabolismu železa (především hladinu feritinu a saturaci transferinu) v kombinaci s MCH (průměrné množství hemoglobinu v buňce), MCV (střední objem erytrocytu) a RDW (šíře distribuce erytrocytů odrážející míru anizocytózy) [14, 17–19].
V případě prokázané sideropenie nebo již rozvinuté sideropenické anémii je doporučeno zahájit substituci preparáty železa u obou skupin VSV, a to bez rizika zhoršení projevů hyperviskózního syndromu v případě vad cyanotických [14]. Preferováno je perorální podání substituce v dávkách odpovídajících všeobecným doporučením 3–6 mg/kg/den.
Tato práce byla podpořena grantem IGA_ LF_2002_045.
Došlo: 20. 1. 2021
Přijato: 24. 2. 2021
Korespondující autorka:
MUDr. Sabina Kaprálová
Dětská klinika FN
a Lékařské fakulty Univerzity Palackého
I. P. Pavlova 6
779 00 Olomouc
e-mail: sabina_s@email.cz
Sources
1. van der Linde D, Konings E, Slager M, et al. Birth prevalence of congenital heart disease worldwide. J Am Coll Cardiol 2011; 58 (21): 2241–2247.
2. Šamánek M, Voříšková M. Congenital heart disease among 815,569 children born between 1980 and 1990 and their 15-year survival: a prospective Bohemia survival study. Pediatr Cardiol 1999 Nov-Dec; 20 (6): 411–417.
3. Chaloupecký V, et al. Dětská kardiologie. 1. vyd. Praha: Galén, 2006 : 1–437.
4. Carson JA, Duff A, Poses RM, et al. Effect of anemia and cardiovascular disease on surgical mortality and morbidity. Lancet 1996; 348 : 1055–1060.
5. Wang M. Iron deficiency and other types of anemia in infants and children. Am Fam Physician 2016; 93 (4): 270–278.
6. Lebl J, et al. Klinická pediatrie. 2. vyd. Praha: Galén, 2014 : 1–698.
7. Pospíšilová D. Sideropenická anémie v dětském věku. Pediatr Praxi 2001; 6 : 269–273.
8. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet 2016; 27 : 907–916.
9. Tsintoni A, Dimitriou G, Karatza AA. Nutrition of neonates with congenital heart disease: existing evidence, conflicts and concerns. J Matern Fetal Neonatal Med 2020; 33 : 2487–2492.
10. Puri K, Price JF, Spinner JA, et al. Iron deficiency is associated with adverse outcomes in pediatric heart failure. J Pediatr 2020; 216 : 58–66.
11. Zabala LM, Guzzetta N. Cyanotic congenital heart disease (CCHD): focus on hypoxemia, secondary erythrocytosis, and coagulation alterations. Paediatr Anaesth 2015; 25 : 981–989.
12. Jansa P. Plicní arteriální hypertenze u vrozených srdečních vad. Interní Med 2006; 6 : 266–269.
13. Olcay L, Ozer S, Gurgey A, et al. Parameters of iron deficiency in children with cyanotic congenital heart disease. Pediatr Cardiol 1996; 17 : 150–154.
14. Terlemez S, Tunaoğlu FS, Göktaş T, et al. The effects of iron treatment on viscosity in children with cyanotic congenital heart disease. Hematology 2017; 22 : 30–35.
15. Itiola AY, Animasahun BA, Njokanma OF. Serum iron status of children with cyanotic congenital heart disease in Lagos, Nigeria. Sultan Qaboos Univ Med J 2019; 19 : 345–351.
16. Onur CB, Sipahi T, Tavil B, et al. Diagnosis iron deficiency in cyanotic heart disease. Indian J Pediatr 2003; 70 : 29–31.
17. Martinez-Quintana E, Rodriguez-Gonzalez F. Iron deficiency anemia detection from hematology parameters in adult congenital heart disease patients. Congenit Heart Dis 2013; 8 : 117–123.
18. Kaemmerer H, Fratz S, Braun SL. Erythrocyte indexes, iron metabolism, and hyperhomocysteinemia in adults with cyanotic congenital cardiac disease. Am J Cardiol 2004; 94 : 825–828.
19. Blanche C, Alonso-Gonzalez R, Uribarri A, et al. Use of intravenous iron in cyanotic patients with congenital heart disease and/or pulmonary hypertension. Int J Cardiol 2018; 15 : 79–83.
20. Tay EL, Peset A, Papaphylactou M, et al. Replacement therapy for iron deficiency improves exercise capacity and quality of life in patients with cyanotic congenital heart disease and/or the Eisenmenger syndrome. Int J Cardiol 2011; 15 : 301–312.
21. Broberg CS. Challenges and management issues in adults with cyanotic congenital heart disease. Heart 2016; 102 : 720–725.
22. Hentze MW, Muckenthaler MU, Galy B, Camaschella C. Two to tango: regulation of Mammalian iron metabolism. Cell 2010; 142 : 24–38.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics
2021 Issue 6-
All articles in this issue
- Vplyv gastroezofágového refluxu na riasinky horných dýchacích ciest u pediatrických pacientov
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- BRDLÍKOVA CENA
- Narkolepsia v detskom veku – naše skúsenosti
- Nie každý hemangióm je hemangióm...
- Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Nie každý hemangióm je hemangióm...
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

