-
Medical journals
- Career
Súvis génových polymorfizmov glutatión S-transferázy T1 a M1 s mikroalbuminúriou a incipientnou nefropatiou u detí s diabetes mellitus 1. typu
Authors: J. Vojtková; M. Čiljaková; P. Ďurdík; Z. Michnová; T. Turčan
Authors‘ workplace: Klinika detí a dorastu, Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta a Univerzitná nemocnica Martin prednosta prof. MUDr. P. Bánovčin, CSc.
Published in: Čes-slov Pediat 2013; 68 (2): 92-100.
Category: Original Papers
Overview
V etiopatogenéze diabetickej nefropatie (DN) sa diskutuje o vplyve oxidačného stresu. Glutatión S-transferáza (GST) predstavuje rodinu multifunkčných enzýmov s antioxidačnou funkciou. Null polymorfizmy GST theta 1 (GST T1) a mu 1 (GST M1) sú asociované s nižšou aktivitou týchto enzýmov. Cieľom práce bolo zistiť, či génové polymorfizmy GST T1 a M1 majú súvis s výskytom mikroalbuminúrie a diabetickej nefropatie u detí s diabetes mellitus typu 1.
U 116 pacientov s diabetes mellitus typu 1 vo veku 6–19 rokov boli zaznamenané základné antropometrické parametre, mali vyšetrenú koncentráciu glykozylovaného hemoglobínu a mikroalbuminúriu. Incipientná nefro-patia bola diagnostikovaná ako opakovaný nález mikroalbuminúrie zo vzorky 12-hodinového nočného moču 20–200 μg/min. Polymerázovou reťazovou reakciou boli stanovené génové polymorfizmy GST T1 a M1.
Diabetici s GST T1 null genotypom (n = 42) mali signifikantne vyššiu mikroalbuminúriu v porovnaní s diabetikmi s GST T1 wild genotypom (n = 74) (p <0,05), pričom v ostatných sledovaných parametroch nebol nájdený signifikantný rozdiel. Podobne nebol potvrdený signifikantný rozdiel v sledovaných parametroch v súvislosti s GST M1 genotypom. Incipientná diabetická nefropatia bola prítomná u 26 jedincov (22,41 %). Pacienti s diabetickou nefropatiou (DN+) mali signifikantne vyšší vek (p <0,01), dlhšie trvanie diabetu (p <0,01), vyšší body mass index (p <0,01) a vyššiu mikroalbuminúriu (p <0,01) v porovnaní s diabetikmi bez nefropatie (DN-). Multivariačnou logistickou regresiou boli uvedené parametre potvrdené ako rizikové faktory pre vznik DN. Rozdiely výskytu génových polymorfizmov medzi podskupinami DN+ a DN - neboli signifikantné.
GST T1 null genotyp môže súvisieť s vyššou mikroalbuminúriou, avšak pre potvrdenie tejto indikácie sú vhodné ďalšie štúdie.Kľúčové slová:
diabetická nefropatia, génové polymorfizmy, glutatión S-transferáza T1 a M1ÚVOD
Diabetes mellitus typu 1 (type 1 diabetes, T1D) je metabolické ochorenie charakterizované hyperglykémiou s absolútnym nedostatkom inzulínu následkom autoimunitného zápalu beta buniek pankreasu. Kvalita života jedincov s T1D je výrazne determinovaná prítomnosťou chronických diabetických komplikácií, ktoré nie sú doménou len dospelého veku, ale vzhľadom na skorý nástup ochorenia sa s nimi stretávame aj u detí a adolescentov. Diabetická nefropatia (DN) postihuje asi 30–35 % diabetikov 1. typu, pričom klinicky manifestná DN sa objaví asi u 30 % diabetikov po 15–20 rokoch trvania diabetu [1]. Klinické rozdelenie DN je uvedené v tab. č. 1.
Table 1. Klinické štádiá diabetickej nefropatie (podľa [2]). ![Klinické štádiá diabetickej nefropatie (podľa [2]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/170b782ab7f8bdb1a861c9391756fe48.png)
V etiopatogenéze diabetickej nefropatie má úlohu genetická predispozícia spolu s pretrvávajúcou hyperglykémiou, ktorá indukuje mnohé metabolické procesy pôsobiace vo vzájomnej interakcii, medzi ktoré patrí neenzýmová glykácia proteínov, polyolová cesta a oxidačný stres. Oxidačný stres, ako výsledok nerovnováhy medzi tvorbou reaktívnych foriem kyslíka (RFK) a činnosťou antioxidačných mechanizmov, indukuje expresiu tkanivového rastového faktora β1 (TGF - β1) a fibronektínu, ktoré podporujú produkciu extracelulárnej matrix, čím prispievajú k zhrubnutiu glomerulárnej bazálnej membrány a k renálnemu poškodeniu. Nadprodukcia RFK alteruje mezangiálne bunky, vyvoláva bunkové procesy vedúce k apoptóze a v mezangiálnych a glomerulárnych bunkách zvyšuje aktivitu proteínkinázy C (PKC) pôsobiacej v bunkovej signalizácii [3]. Izoformy PKC - β1 a 2 zhoršujú krvný prietok cez obličky, zvyšujú kapilárny únik, indukujú produkciu extracelulárnej matrix a aktivujú prozápalové cytokíny, čím prispievajú k mikrovaskulárnemu poškodeniu [4]. PKC tiež stimuluje produkciu RFK. Tieto zmeny spolu s neenzýmovou glykáciou proteínov vedú k renálnej hyperperfúzii, hyperfiltrácii, k hromadeniu extracelulárnej matrix, k vazokonstrikcii renálnych ciev, k rekonštrukcii renálnej štruktúry a dokonca k nefroskleróze.
V súvislosti s oxidačným stresom sú v popredí záujmu génové polymorfizmy niektorých antioxidačných enzýmov, ktoré by mohli mať vplyv na vznik chronických diabetických komplikácií. Glutatión S-transferáza (GST) predstavuje rodinu enzýmov zapojených v metabolizme cudzorodých látok, katalyzujúcich konjugáciu redukovaného glutatiónu s exogénnymi alebo endogénnymi substrátmi (aldehydy, N-nitrozamín, polycyklické aromatické uhľovodíky) s cieľom ich detoxifikácie a jednoduchšej exkrécie. Substrátom pre uvedenú reakciu sú aj sekundárne metabolity reaktívnych foriem kyslíka a organické hydroperoxidy, z čoho vyplýva antioxidačná funkcia GST. Navyše, GST enzýmy majú úlohu v syntéze zápalových mediátorov (leukotriény, prostaglandíny) a tiež v bunkovej signalizácii ako regulátory apoptózy. Podľa substrátovej špecificity, chemickej afinity, štruktúry a kinetiky bolo identifikovaných niekoľko tried cytozolových GST. Najviac študovaným je GST M1 enzým v mu triede kódovaný génom lokalizovaným na chromozóme 1 a GST T1 enzým v theta triede kódovaný génom lokalizovaným na chromozóme 22 [5]. Bolo dokázané, že jedinci s GST null genotypom disponujú signifikantne zníženou aktivitou tohto antioxidačného enzýmu [6] a majú vyššie koncentrácie intermediárnych produktov oxidačného metabolizmu v porovnaní s jedincami s wild genotypom. Táto skutočnosť môže viesť k exacerbácii patologických účinkov reaktívnych foriem kyslíka a môže mať dôležitý vplyv v etiopatogéneze viacerých ochorení.
Podľa posledných prác, GST T1 a M1 génové polymorfizmy majú súvis s vývojom chronických diabetických komplikácií [7, 8], avšak väčšina autorov sa venuje dospelej populácii s diabetom typu 2 (type 2 diabetes, T2D). Cieľom tejto práce je zistiť, či génové polymorfizmy glutatión S-transferázy T1 a M1 majú súvis s mikroalbuminúriou a incipientnou nefropatiou u detí s T1D.
METODIKA
Pacienti a sledované parametre
Projekt bol schválený Etickou komisiou Jesseniovej lekárskej fakulty v Martine. Zúčastnení jedinci a ich zákonní zastupcovia boli informovaní o zámere projektu a mali podpísaný informovaný súhlas. Do štúdie boli zahrnutí pacienti s T1D (kritériá Americkej diabetologickej asociácie) [9], pacienti s ketoacidózou alebo s akútnym infektom boli zo štúdie vylúčení.
Každý jedinec mal zaznamenané trvanie T1D, vek nástupu T1D a základné antropometrické parametre – hmotnosť, výšku, body mass index (BMI). Od každého pacienta boli odobrané dve vzorky venóznej krvi, jedna pre stanovenie glykozylovaného hemoglobínu štandardnými biochemickými postupmi (DCCT norma) a druhá pre vyšetrenie génových polymorfizmov. Zo vzorky 12-hodinového nočného moču bola vyšetrená mikroalbuminúria za štandardných podmienok. V prípade pozitívneho nálezu (>20 µg/min) bola mikroalbuminúria znovu vyšetrená o 2 mesiace za rovnakých podmienok. Ak zvýšená mikro-albuminúria (20–200 µg/min) bola prítomná v obidvoch vzorkách, stav u pacienta bol označený ako incipientná nefropatia. V prípade opakovanej hodnoty mikroalbuminúrie nad 200 µg/min bol stav považovaný za manifestnú nefropatiu. Všetci pacienti mali vyšetrený tlak krvi digitálnym tonometrom. Hodnoty krvného tlaku pod 90. percentilom pre daný vek, pohlavie a výšku boli považované za normálne, hodnoty medzi 90. a 95. percentilom boli považované za prehypertenziu a hodnoty nad 95. percentilom za hypertenziu.
Extrakcia DNA a vyšetrenie polymorfizmov
Na extrakciu genómovej DNA bola použitá štandardná fenol – choloroformová metóda. GST T1 a M1 génové polymorfizmy boli vyšetrené technikou polymerázovej reťazovej reakcie (polymerase chain reaction, PCR). Primery použité pre GST M1 polymorfizmus boli 5´ - GAACTCCCTGAAAAGCTAAAGC-3´ a 5´ - GTTGGGCTCAAATATACGGTGG-3´ a pre GST T1 5´ - TTCGTTACTGGTCCTCACATCTC-3´ a 5´ - TCACGGGATCATGGCCAGCA-3´. Za účelom vylúčenia falošne negatívnych výsledkov bola použitá kontrola beta-globínom. Použité primery pre beta-globín boli 5´ - CAACTTCATCCACGTTCACC – 3´a 5´ - GAAGAGCCAAGGACAGGTAC – 3´. PCR reakcia prebiehala v objeme 25 µl, z čoho 6 µl tvorili primery, 1 µl izolovaná DNA, 8 µl PCR zmes (Taq polymeráza, MgCl2) a 10 µl redestilovaná voda. Dĺžka získaných produktov bola 215 bázových párov (bp), 480 bp a 268 bp pre GST M1, GST T1 a beta-globín v uvedenom poradí.
Štatistická analýza
Výsledky boli spracované štatistickým programom SYSTAT (verzia 11). Parametre boli vyjadrené ako priemer ± štandardná odchýlka. Pre vyjadrenie štatistickej významnosti bol použitý Studentov t test, pričom p menej ako 0,05 bolo považované za štatisticky významné. Pre stanovenie rizika bol multivariačnou logistickou regresiou stanovený parameter OR (odds ratio) s 95. konfidenčným intervalom (95CI).
VÝSLEDKY
Štúdie sa zúčastnilo 116 pacientov s T1D vo veku 6–19 rokov (priemer 12,95 ± 4,13 rokov), 53 ženského a 63 mužského pohlavia. Charakteristika skupiny je uvedená v tabuľke 2.
Table 2. Charakteristika skupiny. 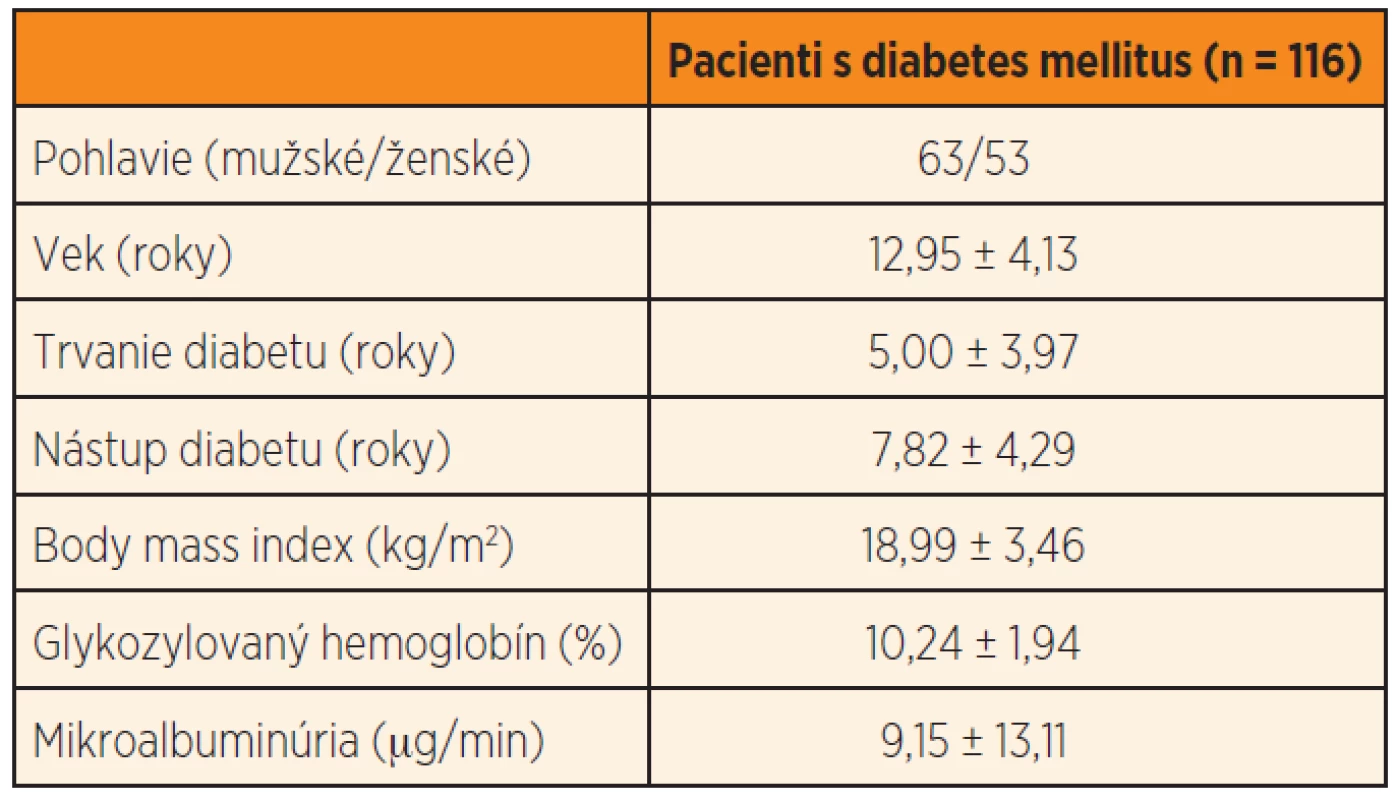
V našom súbore bolo 42 jedincov (36,21 %) nosičmi GST T1 null genotypu a 74 jedincov (63,79 %) GST T1 wild genotypu. GST M1 null genotyp bol prítomný u 46 diabetikov (39,66 %) a GST M1 wild genotyp u 70 pacientov (60,34 %). Diabetici s GST T1 null genotypom mali signifikantne vyššiu mikroalbuminúriu v porovnaní s diabetikmi s GST T1 wild genotypom (12,32 ± 17,08 vs. 7,14 ± 9,40 µg/min, p <0,05) (graf 1), pričom v ostatných sledovaných parametroch nebol nájdený signifikantný rozdiel. Podobne nebol potvrdený štatisticky významný rozdiel v sledovaných parametroch medzi jedincami s GST M1 null a wild genotypom (tab. 3).
Graph 1. Rozdiel v hodnote mikroalbuminúrie medzi diabetikmi s GST T1 <i>wild</i> a <i>null</i> genotypom. 
Table 3. Rozdiely v sledovaných parametroch medzi diabetikmi s GST T1 <i>null</i> vs. <i>wild</i> genotypom a GST M1 <i>null</i> vs. <i>wild</i> genotypom. 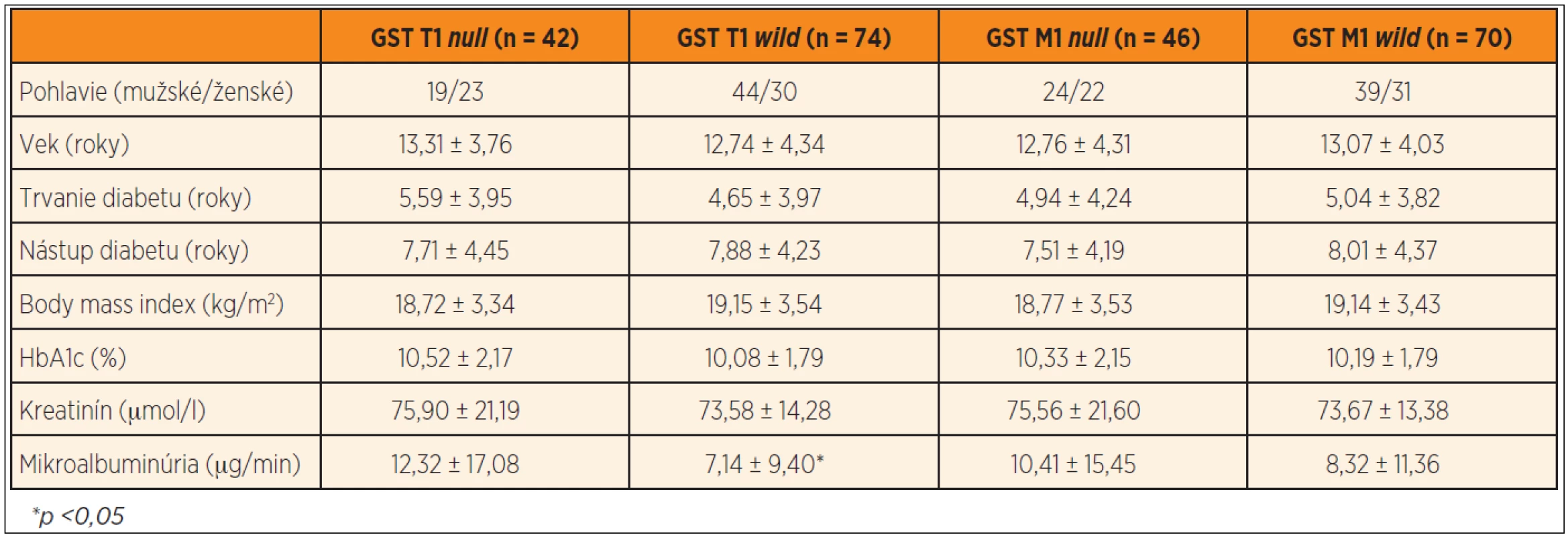
Podľa opakovaného vyšetrenia mikroalbuminúrie bola diabetická nefropatia prítomná u 26 jedincov (22,41 %), pričom u všetkých bola v rozmedzí hodnôt charakteristických pre incipientnú nefropatiu. Dvaja pacienti s diabetickou nefropatiou mali jednorazovým vyšetrením zistené hodnoty krvného tlaku medzi 90. a 95. percentilom pre daný vek, pohlavie a výšku, všetci ostatní diabetici mali hodnoty tlaku krvi pod 90. percentilom. Pacienti s diabetickou incipientnou nefropatiou (DN+) mali signifikantne vyšší vek (15,08 ± 3,11 rokov vs. 12,35 ± 4,19, p <0,01), dlhšie trvanie diabetu (7,13 ± 4,22 rokov vs. 4,44 ± 3,73, p <0,01), vyšší BMI (20,65 ± 3,57 kg/m2 vs. 18,52 ± 3,30, p <0,01) a vyššiu mikroalbuminúriu (16,63 ± 18,87 µg//min vs. 7,68 ± 10,56, p <0,01) v porovnaní s diabetikmi bez nefropatie (DN-). Multivariačnou logistickou regresiou bol ako rizikový faktor pre vznik diabetickej nefropatie potvrdený vek (OR = 1,235, 95CI 1,072–1,424, p <0,01), trvanie diabetu (OR = 1,161, 95CI 1,040–1,296, p <0,01), body mass index (OR = 1,194, 95CI 1,048–1,361, p <0,01) a mikroalbuminúria (OR=1,034, 95CI 1,001 – 1,067, p <0,01). Častejší výskyt GST T1 null genotypu v podskupine DN+ nebol signifikantný (46,15 % vs. 33,33 %, OR = 1,714, 95CI 0,706–4,162, p >0,05), takisto ako riziko predstavené ostatnými génovými polymorfizmami (tab. 4).
Table 4. Výskyt sledovaných génových polymorfizmov u pacientov s diabetickou nefropatiou (DN+) a bez nefropatie (DN-) a stanovenie rizika sledovaných parametrov vo vzťahu k diabetickej nefropatii. 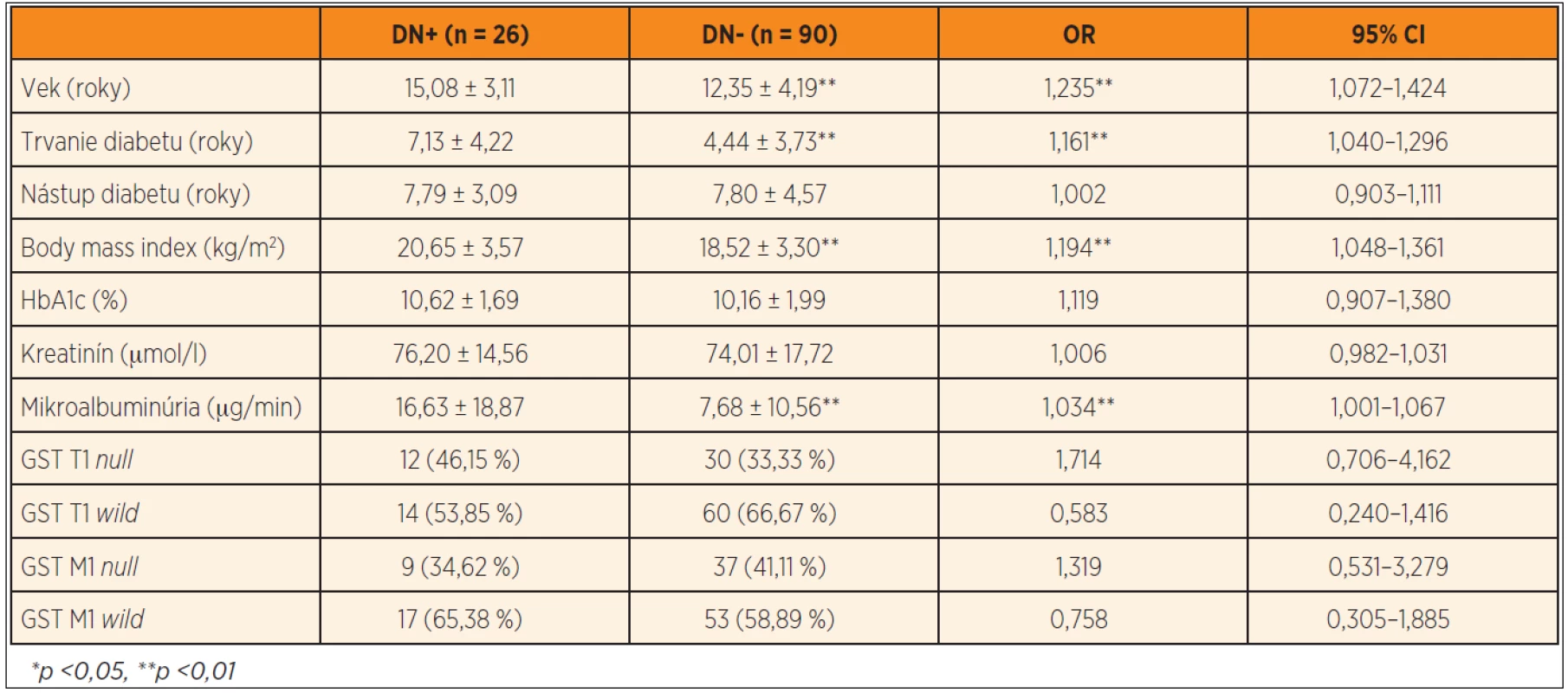
DISKUSIA
Génové polymorfizmy glutatión S-trans-ferázy T1 a M1 sú považované za faktory, ktoré majú prinajmenšom parciálnu úlohu v etio-patogenéze mnohých stavov, ako sú kardio-vaskulárne, gastroenterologické, neurologické, respiračné, alergické, toxické alebo metabolické ochorenia [10, 11, 12, 13, 14, 15, 16, 17]. Podľa posledných prác, GST T1 a M1 génové polymorfizmy ovplyvňujú tiež vývoj diabetes mellitus [18] a chronických diabetických komplikácií [19, 20]. Výsledky štúdií varírujú podľa jednotlivých autorov, regiónov a sledovanej populácie. Prevažná väčšina informácií bola opísaná u dospelých pacientov s T2D, doteraz sa iba jeden kolektív autorov zameriaval na adolescentov alebo mladých dospelých s T1D [21].
Podľa štatistickej analýzy výsledkov našej práce bola zistená signifikantne vyššia mikroalbuminúria u diabetikov s GST T1 null genotypom v porovnaní s pacientami s GST T1 wild genotypom, avšak v prípade GST M1 polymorfizmov nebol zistený signifikantný rozdiel. Častejší výskyt GST T1 null genotypu v podskupine DN+ však nebol signifikantný, čo mohlo byť spôsobené nízkym počtom subjektov v našom súbore. S podobnými informáciami o vplyve GST T1 a M1 genotypu na renálne komplikácie sa môžeme stretnúť aj v literatúre. Podľa posledných prác GST T1 null genotyp je asociovaný s chronickým zlyhaním obličiek u diabetických aj nediabetických jedincov bez ohľadu na GST M1 genotyp [22]. Podobne, GST M1 null genotyp nepredstavoval zvýšené riziko vzniku diabetickej nefropatie japonských pacientov s T2D [23] ani zvýšené riziko zlyhania obličiek [24], zatiaľ čo GST T1 null genotyp zvyšoval riziko zlyhania obličiek diabetických pacientov [24]. Podľa slovinských autorov GST T1 ani M1 genotyp nepredstavuje rizikový faktor pre vznik diabetickej nefropatie pacientov s T1D s priemerným vekom 27 rokov [25]. Tieto rozdielne výsledky môžu byť spôsobené regionálnymi rozdielmi alebo odlišnou dĺžkou trvania diabetu (priemerne 18 rokov v práci slovinských autorov v porovnaní s 5 rokmi v našej práci). Jedným z limitujúcich faktorov asociačných štúdií, ktoré vyhodnocujú vplyv genotypu na progresiu choroby je fakt, že s dlhším trvaním ochorenia sa vyvinie viac chronických komplikácií. Incipientná nefropatia bola v našom súbore prítomná u 22,4 % diabetikov. So zvyšovaním sa dĺžky trvania T1D sa dá predpokladať zvyšovanie prevalencie tejto chronickej komplikácie a teda aj odlišné výsledky asociácie nefropatie s GST génovými polymorfizmami. Vzhľadom na signifikantne nižšiu mikroalbuminúriu v podskupine detí s GST T1 null genotypom však predpokladáme aspoň čiastočný vplyv uvedených polymorfizmov v patogenéze diabetickej nefropatie.
V súvislosti s diabetickou nefropatiou boli študované aj génové polymorfizmy iných antioxidačných enzýmov. Súvis génových polymorfizmov katalázy s DN nebol dokázaný [26, 27], avšak bol potvrdený súvis génových polymorfizmov superoxiddizmutázy s diabetickou nefropatiou [28] a tiež so štádiami albuminúrie [29].
Podľa štatistickej analýzy výsledkov našej práce boli ako rizikové faktory pre vznik DN stanovené vek, trvanie diabetu, BMI a mikroalbuminúria, ktorých význam už bol v literatúre opísaný [30, 31]. Jedným z faktorov urýchľujúcich progresiu nefropatie je hypertenzia [32], ktorá sa vyskytuje často aj u detí s T1D [33]. Súvis GST génových polymorfizmov s vysokým tlakom krvi bola doteraz študovaná u iných než diabetických jedincov. Podľa publikovaných prác kombinácia genotypov GST T1 null/M1 null sa vyskytovala častejšie u pacientov s novodiagnostikovanou esenciálnou hypertenziou v porovnaní s normotenznými jedincami [34]. Podobne, jedinci s GST M1 null genotypom mali signifikantne vyššie riziko vývoja hypertenzie [35]. Okrem dvoch diabetikov mali všetci jedinci v našom súbore normálne hodnoty krvného tlaku, avšak pre presnejšie hodnotenie by bolo v budúcnosti vhodné 24-hodinové ambulantné monitorovanie tlaku krvi a jeho eventuálna korelácia s génovými polymorfizmami.
Prevažnú väčšinu pacientov v našom súbore tvorili pacienti s nedostatočnou kompenzáciou T1D, ktorí boli odosielaní regionálnymi endokrinológmi za účelom zlepšenia kompenzácie základného ochorenia. Táto skutočnosť pravdepodobne ovplyvnila priemernú koncentráciu glykozylovaného hemoglobínu v našom súbore a tiež frekvenciu výskytu incipientnej nefropatie – 22 % po piatich rokoch trvania T1D. Pre porovnanie, podľa prospektívnej štúdie EURODIAB Prospective Complications Study Group bola kumulatívna incidencia mikroalbuminúrie u pacientov s T1D 12,6 % po 7,3 rokoch trvania diabetu [36]. Prevalencia mikroalbuminúrie však môže dosiahnuť aj vyššie hodnoty – 18 % už pred 5 rokmi trvania T1D [37], najmä u pacientov s nedostatočnou kompenzáciou glykémie, s vysokou lipidémiou a hypertenziou. Navyše, nezávislým rizikovým faktorom pre mikroalbuminúriu je aj obdobie puberty [38], čo pravdepodobne prispelo k vyššej prevalencii mikroalbuminúrie aj v našom súbore, keďže priemerný vek sledovaných pacientov bol 13 rokov. U adolescentov s T1D často dochádza k zhoršeniu kompenzácie kvôli endokrinným zmenám v puberte (rastový faktor podobný inzulínu – IGF, sexuálne hormóny) [39], ale aj kvôli nedostatku fyzickej aktivity, nadmernému príjmu potravy, nedodržiavaniu inzulínového režimu, prípadne kvôli rizikovému správaniu (alkohol, fajčenie, drogy, antikoncepcia).
Podľa našich výsledkov u detí s T1D, null polymorfizmus glutatión S-transferázy T1 je asociovaný s vyššou koncentráciou mikroalbuminúrie, častejší výskyt tohto polymorfizmu u jedincov s incipientnou nefropatiou však nebol signifikantný. V budúcnosti sú vhodné ďalšie štúdie s väčším počtom sledovaných jedincov, ktoré by potvrdili alebo vyvrátili spojitosť GST polymorfizmov s chronickými diabetickými komplikáciami.
Poďakovanie
Za odbornú pomoc pri stanovení génových polymorfizmov ďakujeme doc. Mgr. Eve Babušíkovej, PhD., z Ústavu lekárskej biochémie Jesseniovej lekárskej fakulty Univerzity Komenského v Martine, pod vedením prof. MUDr. Dušana Dobrotu, CSc.
Práca bola podporená grantom „OPV – 26110230031/04/D/2010“a projektom “Dobudovanie Centra experimentálnej a klinickej respirológie – CEKR II”, ktorý je spolufinancovaný zo zdrojov EÚ.
Došlo: 19. 6. 2012
Přijato: 21. 10. 2012
MUDr. Jarmila Vojtková, PhD.
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: jarmilavojtkova@gmail.com
Sources
1. Rybka J. Diabetes mellitus – komplikace a přidružená onemocnění. 1. vyd. Praha: Grada, 2007 : 1–320.
2. Bouček P, Kvapil M, Monhart V, Pelikanova T, Rychlik I, a spol. Česká diabetologická společnost ČLS JEP a Česká nefrologická společnost. Doporučené postupy při diabetickém onemocnění ledvin. Aktuality v nefrologii 2012; 18 : 18–26.
3. Ha H, Hwang IA, Park JH, Lee HB. Role of rective oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract 2008; 82: S42–45.
4. Chudý P, Bánovčin P ml. Poruchy hemostázy pri nešpecifických črevných zápaloch. Lekársky obzor 2008; 56 (7–8): 324–329.
5. Oliviera AL, Rodrigues FF, Santos RE, Aoki T, Rocha MN, et al. GSTT1, GSTM1 and GSTP1 polymorphisms and chemotherapy response in locally advanced breast cancer. Genet Mol Res 2010; 9 : 1045–1053.
6. Datta SK, Kumar V, Ahmed RS, Tripathi AK, Kalra OP, Banerjee BD. Effect of GSTM1 and GSTT1 double deletions in the development of oxidative stress in diabetic nephropathy patients. Indian J Biochem Biophys 2010; 47 : 100–103.
7. Bid HK, Konwar R, Saxena M, Chaudhari P, Agrawal CG, Banerjee M. Association of glutathione S-transferase (GSTM1, T1 and P1) gene polymorphisms with type 2 dia-betes mellitus in north Indian population. J Postgrad Med 2010; 56 : 176–181.
8. Ramprasath T, Senthil Murugan P, Prabakaran AD, Gomathi P, Rathinavel A, Selvam GS. Potential risk modifications of GSTT1, GSTM1 and GSTP1 (glutathione-S-transferases) variants and their association to CAD in patients with type-2 diabetes. Biochem Biophys Res Commun 2011; 407 : 49–53.
9. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2008; 31: S55–S60.
10. Havlicekova Z, Jurko A Jr. Heart rate variability changes in children after cardiac transplantation. Bratisl lek Listy 2005; 106 : 168–170.
11. Brndiarová M, Mikler J, Bánovčin P., Michnová T, Fábry J. Extraezofágový reflux – otorinolaryngologické komplikácie gastroezofágového refluxu. Čes-slov Pediat 2011; 66 : 85–91.
12. Babušíková E, Jeseňák M, Kirschnerová R, Bánovčin P, Dobrota D. Association of oxidative stress and GST-T1 gene with childhood bronchial asthma. J Phy-siol Pharmacol 2009; 60: S27–30.
13. Jeseňák M, Havlíčeková Z, Buchanec J, Villa MP, Ronchetti R, Bánovčin P. Diagnostický algoritmus potravinovej alergie v detskom veku. Čes-slov Pediat 2008; 63 : 272–282.
14. Mikler J, Banovcin P, Jesenak M, Hamzikova J, Statelova D. Successful treatment of extreme acute lead intoxication. Toxicol Ind Health 2009; 25 : 137–140.
15. Sivák S, Kurca E, Hladká M, Zelenák K, Turcanová-Koprusáková M, Michalik J. Early and delayed auditory oddball ERPs and brain MRI in patients with MTBI. Brain Inj 2008 Feb; 22 (2):193–197.
16. Straka L, Novomeský F, Krajcovic J, Stuller F, Brzo-bohatá A, Vojtísek T. Forensic interpretation of postmortal ethanol neogenesis in blood samples of cadaverously decomposed bodies. Soud Lek 2010; 55 (2): 18–21.
17. Manfredi S, Calvi D, Fiandra M, Botto N, Biagini A, Andreassi MG. Glutathione S-transferase T1 - and M1 - null genotypes and coronary artery disease risk in patients with Type 2 diabetes mellitus. Pharmacogenomics 2009; 10 : 29–34.
18. Yalin S, Hatungil R, Tamer L, Ates NA, Dogruer N, et al. Glutathine S-transferase gene polymorphisms in Turkish patients with diabetes mellitus. Cell Biochem Funct 2007; 25 : 509–513.
19. Hori M, Oniki K, Ueda K, Goto S, Mihara S, et al. Combined glutathione-S-transpherase T1 and M1 positive genotype afford protection against type 2 diabetes in Japanese. Pharmacogenomics 2007; 8 : 1307–1314.
20. Hossaini AM, Zamrroni IM, Kashem RA, Khan ZF. Polymorphism of glutathione S-transferases as genetic risk factors for the development of complica-tions in type 2 diabetes mellitus. J Crit Care 2008; 23 : 444–448.
21. Bekris LM, Stephard C, Peterson M, Hoehna J, Van Yserloo B, et al. Glutathione-s-transpherase M1 and T1 polymorphisms and association with type 1 diabetes age-at-onset. Autoimmunity 2005; 38 : 567–575.
22. Datta SK, Kumar V, Pathak R, Tripathi AK, Ahmed RS, et al. Association of glutathione S-transferase M1 and T1 gene polymorphism with oxidative stress in diabetic and nondiabetic chronic kidney disease. Ren Fail 2010; 32 : 1189–1195.
23. Fujita H, Narita T, Meguro H, Shimotomai T, Kitazato H, et al. No association of glutathione S-transferase M1 gene polymorphism with diabetic nephropathy in Japanese type 2 diabetic patients. Ren Fail 2000; 22 : 479–486.
24. Yang Y, Kao MT, Chang CC, Chung SY, Chen CM, et al. Glutathione S-transferase T1 deletion is a risk factor for developing end-stage renal disease in diabetic patients. Int J Mol Med 2004; 14 : 855–859.
25. Hovnik T, Dolzan V, Bratina NU, Podkrajsek KT, Battelino T. Genetic polymorphisms in genes encoding antioxidant enzymes are associated with diabetic retinopathy in type 1 diabetes. Diabetes Care 2009; 32 : 2258–2262.
26. Panduru NM, Moţa E, Moţa M, Cimponeriu D, Serafinceanu C, Cheţa DM. Polymorphism of catalase gene promoter in Romanian patients with diabetic kidney disease and type 1 diabetes. Rom J Intern Med 2010; 48 : 81–88.
27. Dos Santos KG, Canani LH, Gross JL, Tschiedel B, Souto KE, Roisenberg I. The catalase -262C/T promoter polymorphism and diabetic complications in Caucasians with type 2 diabetes. Dis Markers 2006; 22 : 355–359.
28. Mohammedi K, Maimaitiming S, Emery N, Bellili-Muñoz N, Roussel R, et al. Allelic variations in superoxide dismutase-1 (SOD1) gene are associated with increased risk of diabetic nephropathy in type 1 diabetic subjects. Mol Genet Metab 2011; 104 : 654–660.
29. Lee SJ, Choi MG, Kim DS, Kim TW. Manganese superoxide dismutase gene polymorphism (V16A) is associated with stages of albuminuria in Korean type 2 diabetic patients. Metabolism 2006; 55 : 1–7.
30. Viswanathan V, Tilak P, Kumpatla S. Risk factors associated with the development of overt nephropathy in type 2 diabetes patients: A 12 years observational study. Indian J Med Res 2012; 136 : 46–53.
31. Zhou Y, Guo LX, Yu DN, Zhou L, Wang Y, et al. Analyses on the relative factors regarding diabetic nephropathy among 1758 cases of type 2 diabetic patients. Zhonghua Liu Xing Bing Xue Za Zhi 2012; 33 : 610–613.
32. Suláková T, Janda J. Ambulatory blood pressure in children with diabetes 1. Pediatr Nephrol 2008; 23 : 2285–2286.
33. Suláková T, Janda J, Cerná J, Janstová V, Suláková A, Slaný J, Feber J. Arterial HTN in children with T1DM-frequent and not easy to diagnose. Pediatric Diabetes 2009; 10 : 441–448.
34. Bessa SS, Ali EM, Hamdy SM. The role of glutathione S - transferase M1 and T1 gene polymorphisms and oxidative stress-related parameters in Egyptian patients with essential hypertension.Eur J Intern Med 2009; 20 : 625–630.
35. Capoluongo E, Onder G, Concolino P, Russo A, Santonocito C, et al. GSTM1-null polymorphism as possible risk marker for hypertension: results from the aging and longevity study in the Sirente Geographic Area (ilSIRENTE study). Clin Chim Acta 2009; 399 : 92–96.
36. Chaturvedi N, Bandinelli S, Mangili R, Penno G, Rottiers RE, Fuller JH. Microalbuminuria in type 1 diabetes: rates, risk factors and glycemic threshold. Kidney Int 2001; 60 : 219–227.
37. Stephenson JM, Fuller JH. Microalbuminuria is not rare before 5 years of IDDM: EURODIAB IDDM Complications Study Group and the WHO Multinational Study of Vascular Disease in Diabetes Study Group. J Diabetes Complications 1994; 8 : 166–173.
38. Donaghue KC, Chiarelli F, Trotta D, Allgrove J, Dahl-Jorgensen K. Microvascular and macrovascular complications associated with diabetes in children and adolescents. ISPAD Clinical Practice Consensus Guidelines 2009 Compendium. Pediatric Diabetes 2009; 10 : 195–203.
39. Court JM, Cameron FJ, Berg-Kelly K, Swift PGF. Diabetes in adolescence. Pediatric Diabetes 2008; 9 : 255–262.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2013 Issue 2-
All articles in this issue
- Přehled pacientů s diagnózou X-vázaného lymfoproliferativního onemocnění (XLP) diagnostikovaných v České republice a na Slovensku
- Emoční reakce vyvolaná textovými zdravotními varováními na obalech tabákových výrobků u dětí staršího školního věku a adolescentů
- Súvis génových polymorfizmov glutatión S-transferázy T1 a M1 s mikroalbuminúriou a incipientnou nefropatiou u detí s diabetes mellitus 1. typu
- Deficit transkripčního faktoru GATA-2: nová imunodeficience se širokým fenotypovým spektrem. První pacienti diagnostikovaní v České republice a přehled literatury
- Dievča s karyotypom 46, XY
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dievča s karyotypom 46, XY
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
- Přehled pacientů s diagnózou X-vázaného lymfoproliferativního onemocnění (XLP) diagnostikovaných v České republice a na Slovensku
- Deficit transkripčního faktoru GATA-2: nová imunodeficience se širokým fenotypovým spektrem. První pacienti diagnostikovaní v České republice a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

