-
Medical journals
- Career
Získaná hemofilie typu A – vzácná komplikace primárního Sjögrenova syndromu
Kazuistiky a literární přehled
: J. Tomasová Studýnková
: Revmatologický ústav, Praha
: Čes. Revmatol., 26, 2018, No. 2, p. 64-70.
:
Uvedené kazuistiky popisují dva případy závažného krvácivého stavu u 65letého muže a 70leté ženy s diagnózou primárního Sjögrenova syndromu (SjS).
Sjögrenův syndrom je systémové autoimunitní onemocnění postihující žlázy s vnější sekrecí, ale může se projevit dalšími, i systémovými, příznaky.
Krvácivý stav u těchto pacientů byl podmíněn sníženou funkcí prokoagulačního faktoru VIII (FVIII) způsobenou přítomností inhibičních autoprotilátek (inhibitoru) FVIII – akutní získanou hemofilií typu A (AHA). Vzhledem k závažnosti projevů AHA je nutné rychlé stanovení diagnózy a včasné zahájení terapie. Léčba spočívá v řešení krvácivého stavu a eradikaci inhibitoru pomocí imunosuprese.
Klíčová slova:
Získaná hemofilie typu A, krvácivý stav, inhibitor faktoru VIII, Sjögrenův syndrom
Úvod
Získaná hemofilie typu A (AHA) je vzácná porucha koagulace, která může vést k závažnému, až život ohrožujícímu krvácení. AHA je podmíněna tvorbou inhibičních autoprotilátek proti hemokoagulačnímu faktoru VIII (inhibitor FVIII), které zamezují jeho prokoagulační funkci. Jedná se o vzácné onemocnění, jehož incidence se pohybuje mezi 0,2–4/milion/rok (1).
Většina případů AHA je idiopatických (51,9 %), ale některé mohou být spojeny s dalším onemocněním – nejčastěji s malignitou (11,8 %) nebo autoimunitním onemocněním (11,6 %) (1).
Klinické projevy AHA zahrnují spontánní krvácení do kůže, svalů či měkkých tkání nebo nadměrné krvácení během operace.
Mortalita onemocnění dříve dosahovala až 33 %, nyní, díky novým terapeutickým možnostem jak v imunosupresi (rituximab), tak podpůrnými prostředky (Novoseven), se mortalitu v přímé souvislosti s krvácením podařilo snížit na 3–9 % (2, 3).
Strategie léčebných postupů u AHA je dvojí. Jednak směřuje ke zvládnutí krvácení a druhou strategií je snaha o eradikaci inhibitoru pomocí imunosuprese (2, 3, 4).
Sjögrenův syndrom je systémové autoimunitní onemocnění žláz s vnější sekrecí. Toto onemocnění je často nediagnostikováno. Jeho prevalence se, dle různých klasifikačních a diagnostických kritérií použitých ve studiích, pohybuje mezi 0,1 a 4,8 % (5, 6). Přestože primárně postihuje žlázy s vnější sekrecí, což se projevuje dominantním příznakem – suchostí sliznic, může se projevit i příznaky systémovými, nejčastěji chronickou únavou, atralgií, myalgií, i orgánovými projevy (5, 6).
Popis případů
Kazuistika I.
Pětašedesátiletý pacient byl počátkem listopadu roku 2015 hospitalizován v Ústavu hematologie a krevní transfúze (ÚHKT) k vyšetření příčiny náhle vzniklých, mnohočetných podkožních a svalových hematomů.
Anamnézu obtíží udával asi 14 dní. První projevy se objevily po pádu na toaletě s následným krátkým bezvědomím. Do ÚHKT byl přeložen ze spádového interního oddělení k dovyšetření tohoto nejasného krvácivého stavu, již ale se suspekcí na získanou hemofílii A.
Jednalo se o polymorbidního pacienta s četnými interními diagnózami – arteriální hypertenzí dlouhodobě ne zcela uspokojivě kompenzovanou terapií, diabetem mellitem II. typu na perorálních antidiabeticích, s hyperurikémií a hyperlipoproteinémií. Pacient byl zároveň silný kuřák, kouřil až 50 cigaret denně, a pravidelný konzument alkoholu (několik piv denně, k tomu občas malé množství destilátů).
V jeho rodinné anamnéze se dosud žádná hematologická onemocnění s poruchou koagulace nevyskytla.
Pacient neudával ani dřívější projevy krvácení (např. ze zažívacího traktu, urologická krvácení, ani při stomatologických výkonech), v minulosti již absolvoval i větší chirurgický výkon – v 18 letech podstoupil apendektomii, se zcela nekomplikovaným per - i pooperačním průběhem.
Subjektivně při přijetí pacient neudával významnější obtíže, stěžoval si pouze na bolesti svalů, a to nejen svalů zasažených krvácením, polyartralgie a zvýšenou únavu.
Při fyzikálním vyšetření pacient nevykazoval výraznější patologie, v objektivním nálezu byl pouze bledší kolorit kůže a mnohočetné hematomy na končetinách, zejména na pravé paži, v levém třísle a méně pak vyjádřené i na stehnech.
V laboratorním vyšetření byl patrný pokles hodnot v červeném krevním obraze (hemoglobin (Hb) 66 g/l), byla zjištěna leukocytóza 19 x 109/l, nicméně hodnoty trombocytů i reaktanty akutní fáze byly opakovaně v normě, dále byla elevace aminotransferáz (ALT 94 µkat/l, AST 26 µkat/l), GMT v mezích normy, a v imunologii pak pozitivita antinukleárních protilátek (ANA) a revmatoidního faktoru (RF). Aktivovaný parciální tromboplastinový čas (aPTT) byl výrazně prodloužen.
Vzhledem k uvedeným skutečnostem byla vyslovena suspekce na získanou hemofilií typu A a následně vyšetřena funkce FVIII, která se pohybovala pod 10 % (norma 50–150 %), naopak hladina inhibitoru FVIII se pohybovala nad 1000 Bethesda Unit (BU), normální hodnoty inhibitoru se pohybují mezi 0 až 0,7 BU.
Zobrazovací metody – CT břicha a UZ stehna prokázaly objemné zakrvácení svalů musculus iliopsoas, musculus psoas vlevo a musculus rectus, hematom pararenálně vlevo a četné hematomy v podkoží.
Z důvodu pozitivity některých imunologických parametrů (pozitivita ANA a RF) a subjektivním obtížím na pohybovém aparátu bylo žádáno konziliární revmatologické vyšetření, při kterém pacient, kromě již dříve uváděných myalgií a polyartralgií, na cílený dotaz zmiňuje i již delší dobu trvající suchost sliznic, a to zejména v ústech. V rámci revmatologického vyšetření v Revmatologickém ústavu (RÚ) bylo doplněno podrobnější imunologické vyšetření, kde kromě pozitivity ANA a RF, byly pozitivní i protilátky anti Ro a La – prokázaných metodami ENA (protilátky proti extrahovatelným jaderným antigenům) a LIA (Line Immuno Assay). Stav byl proto revmatologem uzavírán jako autoprotilátkový syndrom odpovídající Sjögrenovu syndromu, s klinicky nevýraznými sicca příznaky, bez systémových projevů. A stran revmatologie byla doporučena pouze symptomatická léčba, analgetika a dále doplnění ještě vyšetření očního a stomatologického k objektivizaci sicca symptomů.
K řešení krvácení bylo pacientovi podáno několik erymas a rekombinantní koagulační faktor VIIa – NovoSeven 120 ug/kg (12 mg) dvakrát denně, který prokoagulačně působí by-passovým účinkem, s vynecháním faktoru VIII.
Vzhledem k přítomnosti inhibitoru faktoru VIII byla zahájena imunosuprese, nejdříve pomocí glukokortikoidů (KS) v dávce 1 mg/kg, pro malý efekt byla terapie posílena přidáním cyklofosfamidu (CFA) v dávce 100 mg p.o. denně po celou dobu hospitalizace, následně byl podán i Rituximab (v dávce 3x900 mg). Rovněž byl podán 1x puls intrevnózními Ig 40 g 5 dní.
Opakovaně (8x) byla k eliminaci protilátek provedena selektivní imunoadsorpce. Po této terapii došlo sice k poklesu hladiny inhibitoru na 360BU, avšak funkce FVIII zatím zůstala nulová.
I přes intenzivní imunosupresivní terapii a podpůrnou hematologickou léčbu – po přechodném klinickém i laboratorním zlepšení, dochází k progresi krvácení, zhoršení celkového stavu a následně k úmrtí pacienta z důvodu multiorgánového selhání způsobeného dekompenzací jak základní diagnózy AHA, tak dalších přidružených diagnóz.
Kazuistika II.
Druhým případem byla sedmdesátiletá žena s již známou diagnózou Sjögrenova syndromu stanovenou za diagnostické hospitalizace v RÚ v srpnu roku 2015 na základě autoprotilátkového nálezu a klinicky verifikované suchosti sliznic. Terapeuticky byla pacientka od doby diagnózy zavedena na nízké dávce glukokortikoidů a udržovací dávce hydroxychlorochinu 200 mg denně.
Jednalo se, jako v předchozím případě, o pacientkus četnými dalšími chronickými diagnózami – arteriální hypertenzí dobře kompenzovanou terapií antihypertenzivy, hyperlipoproteinémií (v době hospitalizace v RÚ bez specifické terapie), a dále s ne zcela jasným intersticiálním plicním procesem v.s. na podkladě exogenní alergické alveolitis, diagnostikovaným v únoru 2014. V době hospitalizace v RÚ byl plicní nález zlepšený při probíhající kortikoidní léčbě.
V září a říjnu 2015 byla pacientka opakovaně hospitalizována na dermatologii pro splývající erytematózní ložiska anulárního charakteru, s úporným pruritem. Byla provedena biopsie z ložiska s nálezem junkční dermatitidy, který nevylučoval diagnózu subakutního lupus erythematodes, PIF neosvětlené kůže bylo negativní. Při posílené terapii KS došlo k ústupu všech kožních projevů.
V říjnu 2015, po propuštění z dermatologie, byla pacientka rehospitalizována v RÚ k dokončení vyšetření zejména s ohledem na problémy se zažívacím traktem a známkám hepatopatie při předchozí hospitalizaci.
V laboratorním nálezu byla patrna jen mírná anémie a trombocytopenie, mírná lymfopenie, dále známky hepatopatie s elevací pouze GMT a nevýznamná elevace RAF. V imunologickém vyšetření byla pak pozitivita ANA, ENA - SS-A/Ro60, SS-a/Ro52, vysoce pozitivní RF. Vzhledem k opakované negativitě anti dsDNA protilátek, normálním hladinám C3, C4 a absenci dalších projevů pacientka nesplnila kritéria pro systémový lupus erythematodes (SLE) a její stav byl uzavírán jako primární Sjögrenův syndrom.
Při první hospitalizaci v RÚ v srpnu 2015 a i v úvodu říjnové rehospitalizace byly hodnoty aPTT v mezích normy, ale při opakovaném (rutinním) náběru postupně došlo k jeho mírnému prodloužení na 46s ke konci hospitalizace v listopadu 2015.
V lednu 2016 byla pacientka přijata akutně k hospitalizaci na IV. interní kliniku VFN pro náhlý nástup dušnosti, která byla, dle následně provedených vyšetření, způsobena výraznou anemizací. V průběhu této hospitalizace došlo u pacientky k rozvoji masivních podkožních hematomů téměř celého těla.
Laboratorní vyšetření prokázala normocytární anémii (Hb 71 g/l), nyní s již výrazně prodlouženým aPTT na 106 s, který se ještě nadále prodloužil na 170 s. Vzhledem ke klinickým projevům dušnosti, prodlouženému aPTT a známé diagnóze systémové autoimunity byla v rámci diferenciální diagnózy vyloučena možnost antifosfolipidového syndromu – přítomnost nespecifického inhibitoru typu lupusového antikoagulans.
Na základě těchto výsledků byla následně detekována přítomnost inhibitoru faktoru VIII 400BU a snížená (na 10 %) funkce FVIII, která ještě dále poklesla pod 1 %, a byla stanovena diagnóza AHA a pacientka přeložena do ÚHKT.
Anémie u pacientky se prohlubovala. Její stav si vyžádal opakované podání erymasy a zahájení léčby hemostatiky – podání přípravku Novoseven (rekombinantní koagulační faktor VIIa.) Rovněž bylo započato s imunosupresí pomocí KS (zpočátku Solumedrol 250 mg i.v. 2x denně s přechodem na p.o. podávání v dávce 40 mg denně). Vzhledem k jejich nedostatečnému imunosupresivnímu účinku byla terapie posílena nejdříve přidáním CFA v dávce 100 mg p.o., jednoho pulsu intravenózních Ig (30 g 5 dní) a nakonec podáním rituximabu (v dávce 800 mg 4x). A tato intenzivní terapie vedla k celkové úplné remisi krvácivých projevů – zastavení krvácení, obnovení normální funkce FVIII a k nedetekovatelným titrům inhibitoru FVIII. Bohužel i v tomto případě došlo po několika měsících k úmrtí pacientky, ale zcela bez souvislosti se základní diagnózou AHA, která byla nadále v remisi, na základě dekompenzace dalších přidružených diagnóz.
Diskuse a přehled literatury
Získaná hemofilie typu A je autoimunitní onemocnění podmíněné tvorbou protilátek proti hemokoagulačnímu faktoru VIII (inhibitoru faktoru VIII), které se projevuje spontánním, často velmi masivním krvácením u pacientů bez předchozí anamnézy krvácivých stavů.
Tyto protilátky byly poprvé popsány Bidwellem již v roce 1966 (7), ale informace o autoimunitní povaze poruchy koagulačních faktorů jsou v literatuře až v osmdesátých a devadesátých letech minulého století (8).
Jedná se protilátky proti funkčním epitopům koagulačního faktoru VIII. Faktor VIII je glykoprotein tvořený ze dvou nekovalentně spojených řetězců – těžkého (složeného z domén A1-A2-B) a lehkého (domény A3-C1-C2).
Tvorbou protilátek typu IgG1 a IgG4 dochází k obsazení některého z epitopů A2, A3, C2.
1. Koagulační kaskáda. 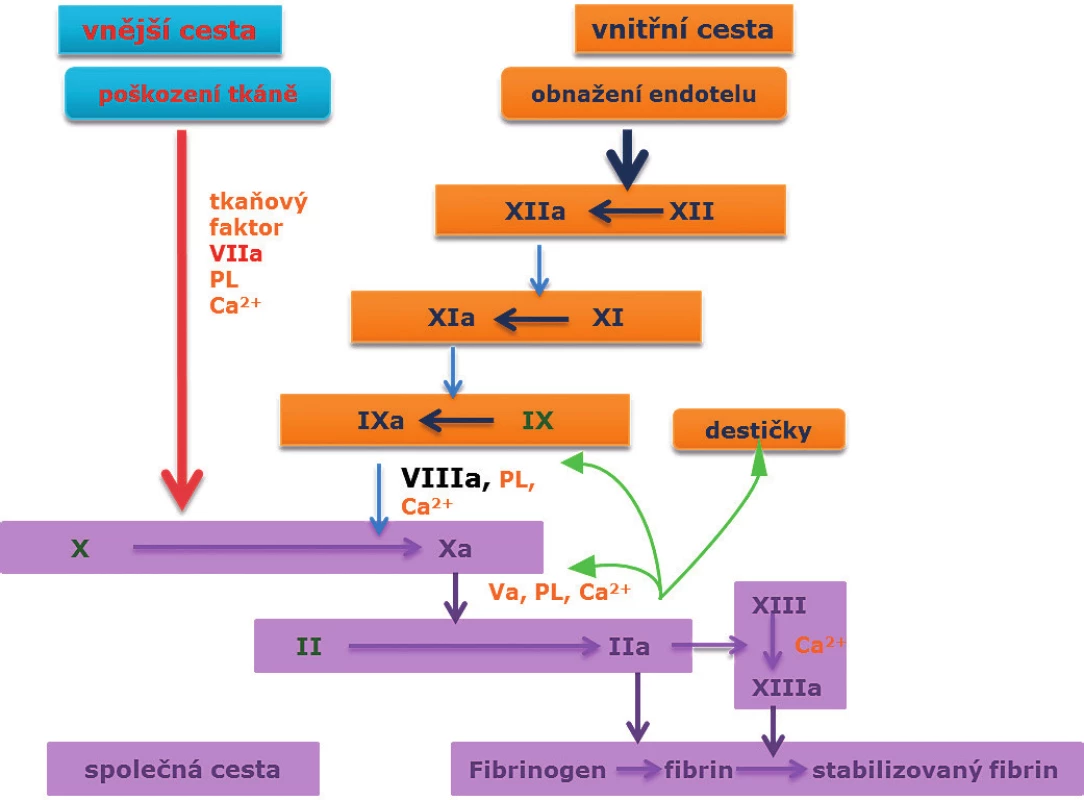
Faktor VIII, spolu s Ca2+ a fosfolipidy, aktivuje faktor X faktor Xa. Faktor Xa společně s faktorem Va, fosfolipidy a Ca2+ vytváří protrombinový komplex, který štěpí protrombin na trombin, a ten působí přeměnu fibrinogenu na fibrin. Hemokoagulační faktory
I – fibrinogen, II – protrombin, III – tkáňový tromboplastin, IV – Ca2+, V – proakcelerin, VII – prokonvertin, VIII – antihemofilický f., IX – Christmasův f., X – Stuart-Prowerové, XI – PTA (plasma thrombin antecedent), XII – Hagemanův f., XIII – fibrin stabilizující f. PL fosfolipidy.Mechanismus jejich inhibice závisí na typu blokovaného epitopu a jeho funkci. Na epitopu A3 dochází k interakci hemokoagulačních faktorů VIII a IXa, na epitopu C2 k vazbě na fosfolipidy a Von Willenbrand faktor, a epitopy A2 a A3 vážou hemokoagulační faktor X (9).
Získaná hemofilie typu A je vzácné onemocnění s incidencí 0,2–4/milion/rok, postihuje spíše starší muže, medián věku prvních projevů 60–67 let, druhou nejvíce zasaženou skupinou jsou pak mladé ženy (20–30 let) po porodu (1).
Klinicky se AHA manifestuje krvácivými projevy a často nečekaným, masivním krvácením u pacienta bez předchozí anamnézy hemorrhagické choroby (často indukované např. traumatem nebo operací). Na rozdíl od hereditárních hemofilií krvácení postihuje nejčastěji kůži a svaly a jen velmi zřídka dochází k typickému příznaku vrozených poruch – k hemartróze (1).
Základním diagnostickou a screeningovou metodou je izolované prodloužení aktivovaného parciálního tromboplastinového času (aPTT). Zde uvedené případy i literární odkazy ukazují, že je třeba věnovat zvýšenou pozornost zejména při prodloužení, byť malém, z dříve normálních hodnot. Při prodluženém aPTT je pak nutné dále vyšetřit aktivitu FVIII pomocí funkčních testů a stanovení hladiny specifického inhibitoru (1, 3).
Terapie AHA spočívá jednak ve zvládnutí krvácivých projevů, tj. podávání erymas, rekombinantního faktoru VIIa, nebo aktivovaného protrombinového komplexu koncentrátu (fII-protrombin, VII, IX a X) aPCC - FEIBA, nebo koncentrátu FVIII k neutralizaci inhibitoru. Vzhledem k vysoké koncentraci inhibitoru je zde nutnost podání vysoké dávky (4).
Druhým terapeutickým postupem je pak snaha o eradikaci inhibitoru pomocí imunosuprese. Základním lékem jsou glukokortikoidy (v dávce 1 mg/kg) buď v monoterapii, nebo v kombinaci s dalším imunosupresivem, nejčastěji to bývá CFA, v druhé linii – rituximab či cyklosporin A (popř. azathioprin, vinkristin, merkaptopurin). Další možností je pak i.v. aplikace imunoglobulínů, plazmaferéza, či specifická imunoadsorpce, bezpečná a účinná metoda, která slouží k eliminaci patologické protilátky – inhibitoru FIII (3, 4).
S těmito novými postupy došlo k výraznému snížení mortality AHA z důvodu krvácení, ale celková úmrtnost způsobená buď přidruženými diagnózami, jako v tomto sdělení v prvním uvedeném případě, nebo i následky intenzivní imunosupresivní léčby, je stále vysoká – 28 % (1).
Terapie těchto pacientů by proto měla probíhat ve specializovaných centrech se zkušenostmi nejen s léčbou přítomnosti inhibitoru faktoru VIII, ale i se zkušeností s imunokompromitovanými pacienty.
Registry AHA
Nejstarší retrospektivní studie zahrnuje 215 pacientů s AHA diagnostikovanou před rokem 1981 (10). Případy AHA z let 1982 až 2002 publikoval v roce 2003 Delgado, jednalo se o 234 pacientů (11). A v roce 2007 Collins publikoval 172 případy z let 2001 až 2003 (12).
V posledních letech došlo k založení několik databázových registrů AHA.
Registr s dosud největším počtem pacientů je The European AHA Registry – EACH2 (1) tab. 1.
1. The European AHA Registry EACH 2.
Prospektivní databáze pacientů ze 117 center ze 13 zemí. Celkem zařazeno 501 pacientů.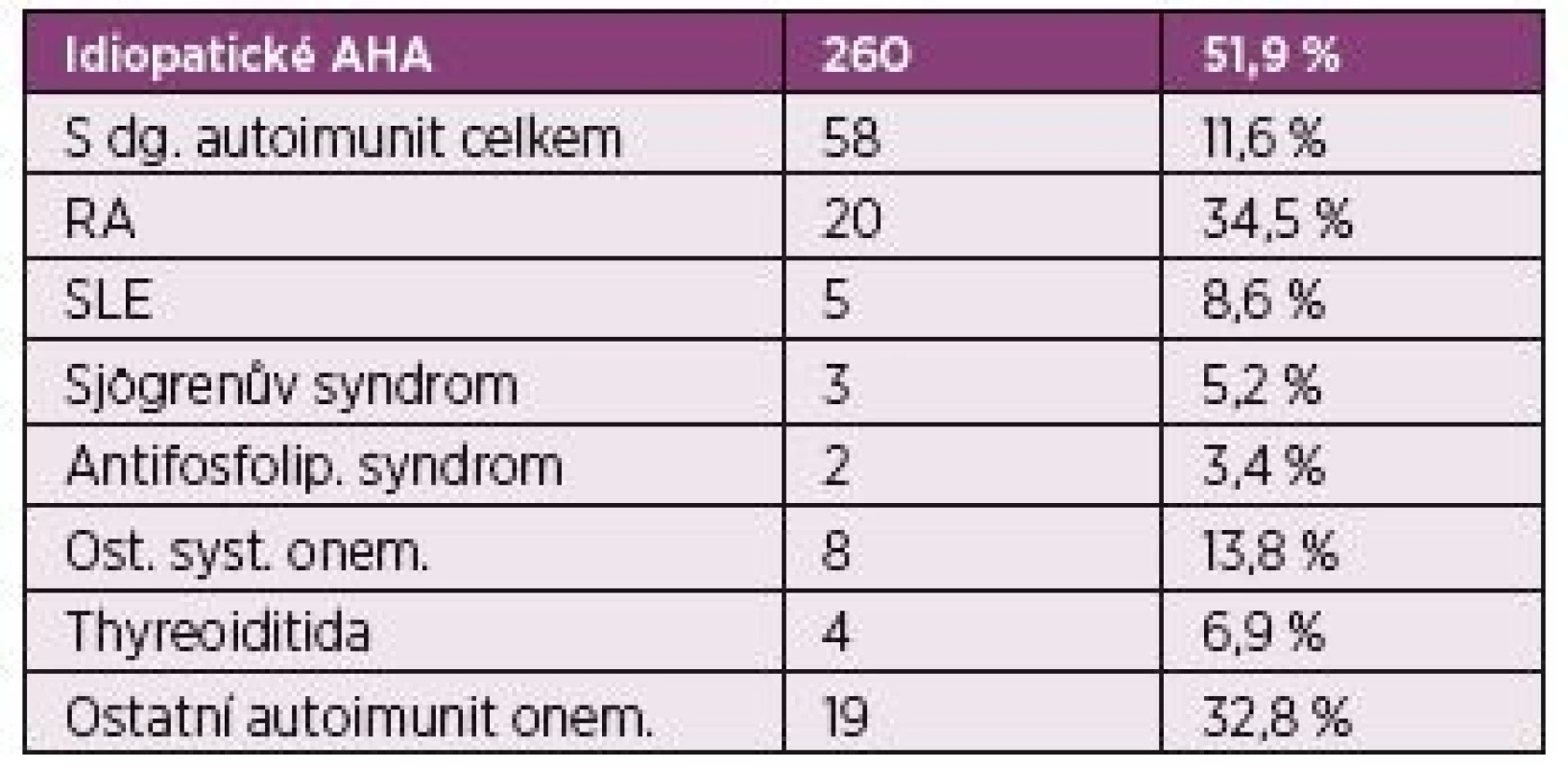
Knoebl P. Et al. J Trombosis and Haemostasis. 2012 Jedná se o prospektivní databázi pacientů ze 117 center, ze 13 zemí. Obsahuje demografické údaje, diagnózy, přidružené diagnózy, charakteristiku krvácivých projevů, léčbu a další data.
Celkem bylo do tohoto registru zařazeno mezi lety 2003 až 2008 pět set jedna pacientů. Zařazeno bylo 266 mužů a 235 žen.
Většina případů AHA v registru EACH2 – 260 (51,9 %) jsou idiopatické, ale jako i ve zde předložené kazuistice je často AHA spojena s dalšími onemocněními, a to nejčastěji malignitami – 59 pacientů (11,8 %), ale také s dalším autoimunitním onemocněním - systémovým, či orgánově specifickým 58 (11,6 %), dále pak v těhotenství 42 (8,4 %), ve spojení s infekcí 19 (3,8 %), léky indukovaná AHA 17 (3,4 %), MGUS 13 (2,6 %), revmatická polymyalgie 11 případů (2,2 %), dermatologické choroby – zejména psoriáza, pemfigus, 7 (1,4 %), krevní transfúze 4 (0,8 %), a další choroby a stavy 41 (8,2 %) (1) tab. 2.
2. O‘Connor 2015 – rešerše Medline z let 1993–2012 z anglické publikace. 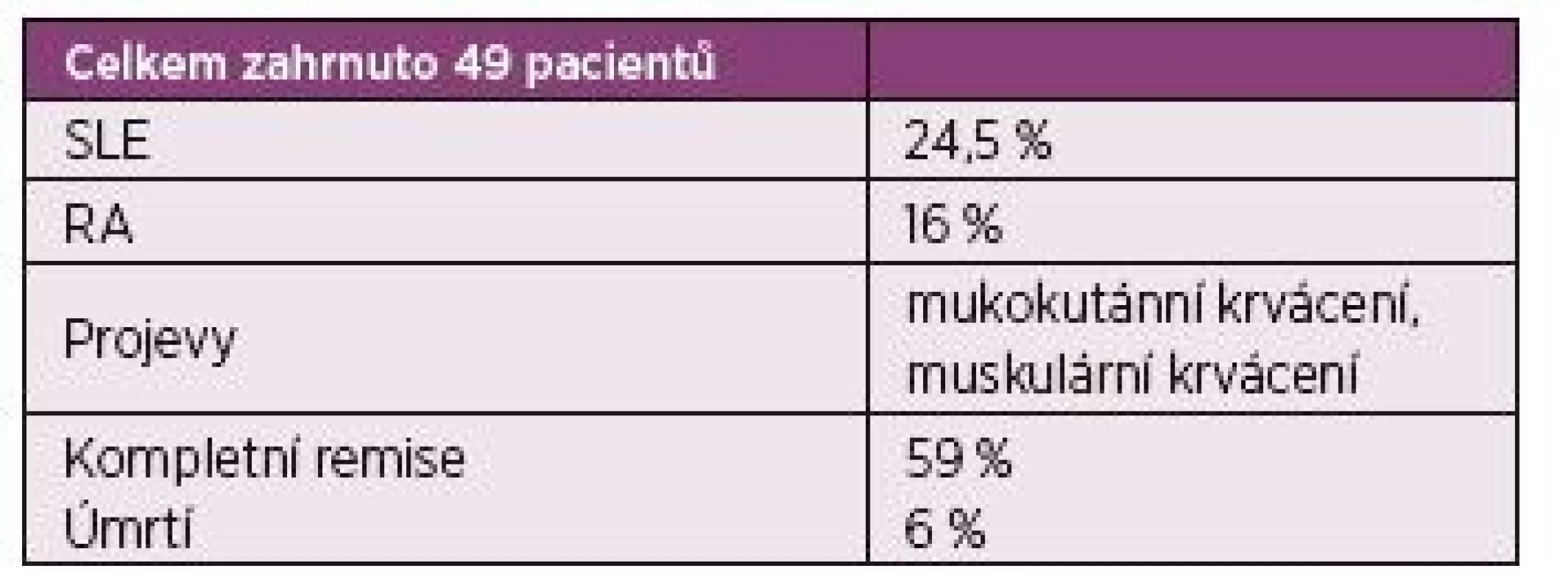
O‘Connor CR. Semin Arthritis Rheum. 2010 Asociace AHA a Sjögrenova syndromu
První literární zmínka o asociaci primárního Sjögrenova syndromu a AHA byla publikována v roce 1994 Dannhäuserem (13). Jednalo se o případ 57letého muže s diagnostikovaným SjS, u něhož se objevily spontánní hematomy paže, levé nohy, a dále hematurie. V laboratorních testech došlo k mírné prolongaci aPTT na 65 s, funkce faktoru VIII byla na 5 % a hladina inhibitoru 26 BU.
Pacient byl zaléčen kombinací prednisonu a azathioprinu a postupně došlo ke kompletní remisi onemocnění (13).
V roce 2015 O‘Connorová publikovala review Medline rešerší anglických publikací týkajících se přítomnosti inhibitoru VIII u pacientů s revmatologickými diagnózami, které byly publikovány mezi 1995 až 2010 (14).
V tomto review je uvedeno dalších pět případů AHA u pacientů se Sjögrenovým syndromem.
Prvním byla Dachmanova kazuistika pacienta se SjS, u kterého došlo k rozvoji kompartment syndromu stehna po pádu z lůžka.
V laboratorním obraze byl prolongovaný aPTT na 61 s, hladina inhibitoru byla 40 BU.
V rámci podpůrné protikrvácivé terapie byl pa-cientovi aplikován FVIII koncentrát a opakované transfúze. Zároveň byla zahájena imunosupresivní léčba KS, intravenózními imunoglobuliny (Ig).
Po tři týdny probíhala tato terapie s efektem, ale poté došlo, stejně jako v našem prvním případě, k úmrtí pacienta bez přímé souvislosti s krvácivým stavem (15).
V roce 1996 byl publikován další případ, kdy se u pa-cienta se Sjögrenovým syndromem vyvinuly náhle klinické i laboratorní projevy AHA (krvácení, prolongace aPTT na 96 s, hladina inhibitoru 512BU).
Pacient byl opět zaléčen kombinovanou imunosupresí Prednison a CFA, a dále intravenózními Ig.
Za této terapie došlo ke zlepšení jeho stavu, nicméně nenastala kompletní remise (16).
Další případem byl pacient s kombinovaným deficitem faktorů VIII a IX, klinicky se projevujícím masivním podkožním a svalovým krvácením, v laboratoři prodloužením aPTT na 100 s a hladinou inhibitoru 25 BU.
Po podpůrné terapii FVIII koncentrátem a opět kombinované imunosupresí – prednison p.o., CFA, intravenózními Ig, azathioprin, došlo i u tohoto pacienta k remisi s nedetekovatelným inhibitorem faktoru VIII (17).
Posledním v této práci uvedeným pacientem byla 58letá žena s diagnózou SjS (klinicky se sicca projevy, v laboratorním nálezu pozitivitou protilátek ANA a anti-Ro, La), u které došlo k masivnímu krvácení na krku a horních končetinách.
Při laboratorním vyšetření byl aPTT prodloužen na 108 s a hladina inhibitoru faktoru VIII byla vysoká – 287 BU.
Imunosupresivní terapie (KS v dávce 2 mg/kg) u této pacientky vedla jen k parciální remisi, proto byl do terapie přidán rituximab v dávce 375 mg/m2/týdně, a po dvou měsících rovněž došlo ke kompletní remisi onemocnění (18).
V loňském roce byla publikována kazuistika 87leté čínské pacientky, přijaté k hospitalizaci po pádu doma s bolestí horních končetin a ramen, v laboratorním nálezu byly známky anémie (s Hb 57 g/l. V průběhu hospitalizace se objevila meléna a známky vaginálního krvácení. Podrobnější laboratorní vyšetření prokázalo prodloužení aPTT více než 150 s a funkce FVII snížena na méně než 1 %, hladina inhibitoru pak 27 BU. Dále byly prokázány autoprotilátky anti Ro a La. Terapeuticky byla zavedena imunosuprese perorálnímu KS a následně došlo k normalizaci faktoru VIII (19).
V poslední době při stále častějším používáním biologické léčby u pacientů se systémovým revmatickým onemocněním se také objevuje otázka, zda projevy AHA a výskyt protilátek proti faktoru VIII nemůže mít souvislost i s touto terapií.
Z literatury jsou známé různými farmaky (antibiotika – penicilin, sulfonamidy, chloramfenikol; antikonvulziva a dalšími) indukované případy AHA (1).
V roce 2012 Arthanari publikoval kazuistiku pacienta s revmatoidní artritidou, který vyvinul inhibitor VIII v průběhu léčby adalimumabem (20).
A práce Banse z roku 2015 zmiňuje 47letou pa-cientku s revmatoidní artritidou léčenou nejdříve infliximabem a následně etanerceptem, která také v průběhu antiTNF léčby vyvinula protilátky proti faktoru VIII (21).
Závěr
Získaná hemofilie typu A je velmi vzácná, a vzhledem ke svým, často i masivním, krvácivým projevům závažná diagnóza, která může pacienty i ohrozit na životě. Je proto nezbytné na tuto chorobu myslet, časně ji diagnostikovat a následně účinně léčit.
Zhruba 50 % případů AHA jsou idiopatické, ale je známa asociace AHA s jinými chorobami, zejména malignitami a různými autoimunitami.
Zde popsané případy i literární data ukazují, že krvácení podmíněné získanou hemofilií typu A může být závažnou komplikací i primárního Sjögrenova syndromu, či jiných autoimunitních systémových onemocnění. A na druhé straně pacienti s AHA mohou trpět dosud nediagnostikovanou systémovou autoimunitou. Dostupné literární údaje naznačují, že ačkoliv je tato komplikace u pacientů se Sjögrenovým syndromem raritní, měla by u pa-cientů se systémovými autoimunitami vykazujícími známky krvácivé choroby – jako jsou spontánní hematomy a anémie, být v diferenciálně diagnostické rozvaze zvážena i AHA. U pacientů s autoimunitním onemocněním by i při absenci krvácivých projevů, před plánovaným chirurgickým zákrokem měla být zejména v případě byť mírného prodloužení aPTT vyšetřena funkce FVIII a jeho inhibitor, aby se zabránilo závažným, leckdy i fatálním, krvácivým komplikacím.
Poděkování. Autorka sdělení děkuje za ochotnou spolupráci a konzultaci při péči o zmíněné pacienty kolektivu spolupracovníků Revmatologického ústavu, Ústavu hematologie a krevní transfúze – MUDr. Jolaně Mertové, MUDr. Peteru Salajovi, a IV. interní kliniky Všeobecné fakultní nemocnice v Praze.
Podporováno výzkumným projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00000023728 Revmatologický ústav.
adresa pro korespondenci:
MUDr. J. Tomasová Studýnková, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
E-mail: tomasova@revma.cz
Sources
1. Knoebl P, Marco P, Baudo F et al. Demographic and clinical data in acquired hemophilia A: results from the European Acquired Haemophilia Registry (EACH2). J Trombosis and Haemostasis. 2012 Apr;10(4):622-31. doi: 10.1111/j.1538-7836.2012.04654.
2. Kessler CM, Asatiani E. In: Textbook of Hemophilia. Lee CA, Berntorp EE, Hoots WK, Aledort LM, editor. 2007. Acquired Inhibitors to Factor VIII; pp. 86–90.
3. Collins PW, Percy CL. Advances in the understanding of acquired haemophilia A: implication for clinical practice. Br J Haematol 2009; 148 : 183–194.
4. Smejkal P, Buliková A, Chlupová G, et al. Získaná hemofilie A. Vnitř Lék 2012; 58(7 a 8): 155–162.
5. Mavragani CP, Moutsopoulos HM. The geoepidemiology of Sjögren's syndrome. Autoimmun Rev. 2010 Mar;9(5):A305-10. doi: 10.1016/j.autrev.2009.11.004.
6. Kryštůfková O. Sjögrenův syndrom. Čes Revmatol 25, 2017, No. 1, p. 26–43.
7. Bidwell E, Denson KWE, Dike GWR, Augustin R, Lloyd GM. Antibody nature of the inhibitor to antihemophilic globulin (Factor VIII). Nature 1966; 210 : 746–747.
8. Ahmed AEE. Autoantibodies to coagulation factors and blee - ding disorders. Clin Rev Allergy Immunol 1998; 16 : 313–319.
9. Oh J, Lim Y, Jang MJ, et al. Characterization of anti-factor VIII antibody in a patient with acquired hemophilia A. Blood Res. 2013 Mar;48(1):58-62. doi: 10.5045/br.2013.48.1.58. Epub 2013 Mar 25.
10. Green D, Lechner K. A survey of 215 non-hemophilic patients with inhibitors to Factor VIII. Thromb Haemost. 1981 Jun 30;45(3):200–3.
11. Delgado J, Jimenez-Yuste V, Hernandez-Navarro F, et al. Acquired haemophilia: review and meta-analysis focused on therapy and prognostic factors.br J Haematol. 2003 Apr; 121(1): 21–35.
12. Collins PW, Hirsch S, Baglin TP, et al. Acquired hemophilia A in the United Kingdom: a 2-year national surveillance study by the United Kingdom Haemophilia Centre Doctors' Organisation. Blood. 2007 Mar 1;109(5): 1870-7. Epub 2006 Oct 17.
13. Dannhäuser D, Casonato A, Pietrogrande F, et al. Acquired factor VIII:C inhibitor in a patient with Sjögren's syndrome: successful treatment with steroid and immunosuppressive therapy. Acta Haematol. 1994; 91(2): 73–6.
14. O'Connor CR. Systematic review of the presentation of coagu-lation factor VIII inhibitors in rheumatic diseases: A potential cause of life-threatening hemorrhage. Semin Arthritis Rheum. 2015 Jun; 44(6): 695-709. doi: 10.1016/j.semarthrit.2014.11.008. Epub 2014 Dec 4.
15. Dachman AF, Margolis H, Aboulafia E. Does Sjögren's syndrome predispose surgical patients to acquired hemophilia? J Am Osteopath Assoc. 1995 Feb; 95(2): 115–8, 121.
16. Vignes S1, Le Moing V, Meekel P, et al. Acquired hemophilia: a rare complication of Sjögren's syndrome. Clin Exp Rheumatol. 1996 Sep-Oct; 14(5): 559–60.
17. Carmassi F, Giannarelli C, De Giorgi A, et al. Combined factor VIII and IX inhibitors in a non-haemophilic patient: successful treatment with immunosuppressive drugs. Haemophilia. 2007 Jan; 13(1): 106–7.
18. Vintimilla M, Joseph A, Ranganathan P, et al. Acquired factor VIII inhibitor in Sjögren's syndrome. Arthritis Care Res (Hoboken). 2010 Jul; 62(7): 1047–50. doi: 10.1002/acr.20147.
19. Mo L, Bao GC. Acquired factor VIII deficiency: two case reports and a review of literature. Exp Hematol Oncol. 2017 Mar 24;6 : 8. doi: 10.1186/s40164-017-0068-3. ECollection 2017.
20. Arthanari S, Ahmad H, Nisar M. Fatal acquired hemophilia A in a patient with rheumatoid arthritis treated with adalimumab. J Clin Rheumatol. 2012 Jan;18(1): 50-1. doi: 10.1097/RHU.0b013e31823ee3cd.
21. Banse C, Benhamou Y, Lequerré T, et al. Acquired hemophilia possibly induced by etanercept in a patient with rheumatoid arthritis. Joint Bone Spine. 2015 May; 82(3): 200-2. doi: 10.1016/j.jbspin.2014.12.003. Epub 2015 Jan 20.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology Surgery Intensive Care Medicine Internal medicine Cardiology Clinical oncology Trauma surgery Laboratory
Article was published inCzech Rheumatology

2018 Issue 2-
All articles in this issue
- Pyoderma gangrenosum and necrotizing arteritis in elderly onset rheumatoid arthritis – a case study
-
Získaná hemofilie typu A – vzácná komplikace primárního Sjögrenova syndromu
Kazuistiky a literární přehled - Fertility and rheumatic diseases
- Polymyalgia rheumatica as a complication of immune checkpoint inhibitors treatment due to malignant melanoma
- Tocilizumab in the treatment of polymyalgia rheumatica – a case report
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Polymyalgia rheumatica as a complication of immune checkpoint inhibitors treatment due to malignant melanoma
- Fertility and rheumatic diseases
- Tocilizumab in the treatment of polymyalgia rheumatica – a case report
- Pyoderma gangrenosum and necrotizing arteritis in elderly onset rheumatoid arthritis – a case study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

